-
石油烃 (PHC) 是目前环境中广泛存在的有机污染物,是多种烃类 (正烷烃、支链烷烃、环烷烃、芳烃) 和少量其他有机物的混合物[1]。PHC进入土壤后,不仅会破坏土壤结构,与无机氮、磷结合并限制硝化作用和脱磷酸作用,减少土壤中有效氮、磷等养分的含量,还会通过挥发或食物链富集等途径对人群健康构成潜在风险[2]。因此,PHC污染土壤的修复治理迫在眉睫[3]。化学氧化剂过硫酸盐 (PS) 因其在环境中存在时间长、适用pH范围广、氧化性强等优势被广泛应用于有机污染土壤修复领域。PS可以在水中分解产生强氧化剂S2O82−,经活化后会产生氧化性更强的SO4−·,能够在广泛的环境条件下转化各种环境污染物[4]。
有机污染物进入土壤后往往以“快”“慢”“极慢”等解吸组分形式存在[5],由于“快”解吸组分易被氧化,氧化后污染物往往以“慢”“极慢”等解吸组分形式存在[6],难以进一步去除,化学氧化末期往往会出现拖尾现象[7-8]。虽然投加过量药剂可以提高PHC降解效率,但也会增加修复成本。因此,化学氧化和其他修复技术的联合应用备受关注[9],如已有研究表明化学氧化与微生物联合处理能够更高效地去除土壤中的PHC[10-12]。由于缺氧条件下微生物对有机污染物的降解效率较低,目前与微生物联合降解有机污染物的研究多在好氧条件下进行[13],然而,通过降解参数优化 (如营养物质、电子受体等) ,微生物的缺氧降解效率会明显提升[14-16]。此外,深层有机污染土壤往往处于缺氧环境[17],因此探究缺氧条件下化学氧化与微生物联合修复PHC污染土壤具有重要意义。
由于PS氧化后土壤中残留的PHC以“慢”“极慢”等解吸组分形式存在,生物有效性更低,限制了其进一步生物降解[11]。加入表面活性剂可以增强土壤中PHC的解吸能力,提高其生物有效性[18-19]。常见的表面活性剂增效修复技术使用单一阴离子或非离子表面活性剂,单一阴离子表面活性剂会发生沉淀作用,非离子表面活性剂则易被土壤吸附,而混合表面活性剂体系既能减少表面活性剂在土壤表面的吸附,提高解吸效率,又能使得洗脱液中污染物浓度和表面活性剂浓度对微生物降解产生正效应,是一种更有效的修复方式[20]。但表面活性剂对PS氧化后土壤中微生物以及PHC缺氧生物降解的影响尚不清楚。因此,本研究将通过加入不同质量浓度和质量比的SDBS和Tween 80,探究其对PS氧化后土壤中PHC解吸、土著微生物群落结构和丰度、PHC缺氧降解的影响,为深层石油污染土壤的微生物修复提供参考。
-
实验所用土壤采自华北地区某加油站地下2~5 m处,在采样现场过2 mm筛,运回实验室用四分法混匀。部分土壤−20 ℃保存用于测定PHC质量分数和微生物指标,其余土壤4 ℃保存用于分析理化性质和后续实验处理。土壤样品理化性质:pH为7.12;含水率为8.13%;TOC为1.52%;总铁为2.17%;SO42−和NO3−质量分数分别为122.29和60.83 mg·kg−1;粒径分布为黏土15.70%,粉土84.13%,砂土0.17%。
实验所用阴离子表面活性剂SDBS为化学纯;非离子表面活性剂Tween 80、过硫酸钠 (Na2S2O8) 均为分析纯;正己烷 (C6H14) 、二氯甲烷 (CH2Cl2) 均为色谱纯;高纯氮气 (N2,99.999%) ;石油烃 (C10~C40) 标准溶液 (1 mg·L−1,美国AccuStandard公司) 。
-
称取15 g新鲜土壤样品置于50 mL血清瓶中,在水土比0.4∶1的条件下[5]加入6 mL PS溶液作为氧化处理组PS1 (使土壤中PS质量分数约为1%) ,将未经处理的土壤样品记为原土US,同时设置加入等量去离子水的空白对照组CK1,每个处理设置3组重复。将处理完成的样品在手套箱中完成缺氧处理后用带橡胶垫的铝盖密封[21],转移至恒温培养箱,在30 ℃下缺氧培养30 d (此时土样中的PS基本消耗殆尽[5]) 。同时设置灭菌对照组 (灭菌后原土组记为SS,氧化处理组记为PS2,空白对照组记为CK2) ,灭菌处理参考文献方法[5],使用高压蒸汽灭菌锅,灭菌温度为121 ℃,时间为30 min,灭菌重复3次。
使用经PS氧化的土样进行解吸实验,将样品转移至50 mL离心管,在水土比为1∶1的条件下分别加入不同质量浓度和质量比的SDBS和Tween 80溶液,同时设置空白对照组CK3,放入25 ℃恒温振荡器内150 r·min−1振荡36 h。根据不同质量浓度及类型的表面活性剂对多环芳烃的解吸效果研究可知[22],当部分表面活性剂的质量浓度达到800 mg·L−1时,便开始有解吸效果;质量浓度为3 000 mg·L−1时,解吸效果开始变得更加明显,但已经对土著微生物丰度产生不利影响。而阴-非离子混合表面活性剂对有机污染物的解吸效果强于单一表面活性剂[20],但混合体系质量比对PHC解吸效果的影响尚不清楚,因此解吸实验选用表面活性剂的质量浓度为800和3 000 mg·L−1,质量比为SDBS∶Tween 80=0∶1、1∶3、1∶2、1∶1、2∶1、3∶1和1∶0。另取一部分PS氧化后的土样,在水土比为1∶1的条件下向血清瓶中加入与上述质量浓度和质量比相同的表面活性剂溶液进行缺氧微生物降解实验,同时设置空白对照CK4,在手套箱中完成缺氧处理后密封血清瓶,转移至30 ℃恒温培养箱继续培养120 d。
-
土壤中PHC的提取采用超声萃取法[16],上清液中PHC的提取采用液液萃取法[23]。PHC检测仪器为气相色谱仪 (7890B,美国Agilent公司) ,色谱柱为HP-5MS (30 m×0.25 mm×0.25 μm) ,测定条件:进样口温度300 ℃,不分流进样,进样量1.0 μL;柱箱初始温度为50 ℃,保持2 min,以40 ℃·min−1升至230 ℃,再以20 ℃·min−1升至320 ℃,保持20 min;气体流量:氮气1.5 mL·min−1,氢气30 mL·min−1,空气300 mL·min−1。
-
土壤DNA采用MOBIO Power Soil DNA Isolation Kit试剂盒提取,细菌丰度的测定采用实时定量PCR扩增技术[24]。以16S rDNA作为靶基因对细菌丰度进行检测。细菌引物为338F (5'-ACTCCTACGGGAGGCAGCAG-3') 和806R (5'-GGACTACHVGGGTWTCTAAT-3') ,片段大小为460。反应条件为:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环。完成上述操作后,将待测样品放在荧光定量PCR仪中进行反应,实时定量PCR扩增效率为97.44%。
微生物群落结构分析测试参照FREY等的方法[25],使用Fastp软件对原始测序序列进行质控,使用Flash软件进行拼接 (最小重叠长度为10 bp,重叠区允许的最大错配比为0.2) 。使用UPARSE软件在97%的相似度对序列进行OTU聚类分析。使用RDP classifier分类器对每条序列进行物种分类注释,比对Silva 16S rRNA数据库进行物种注释分析 (比对阈值为80%) ,统计各样品的细菌群落组成。
-
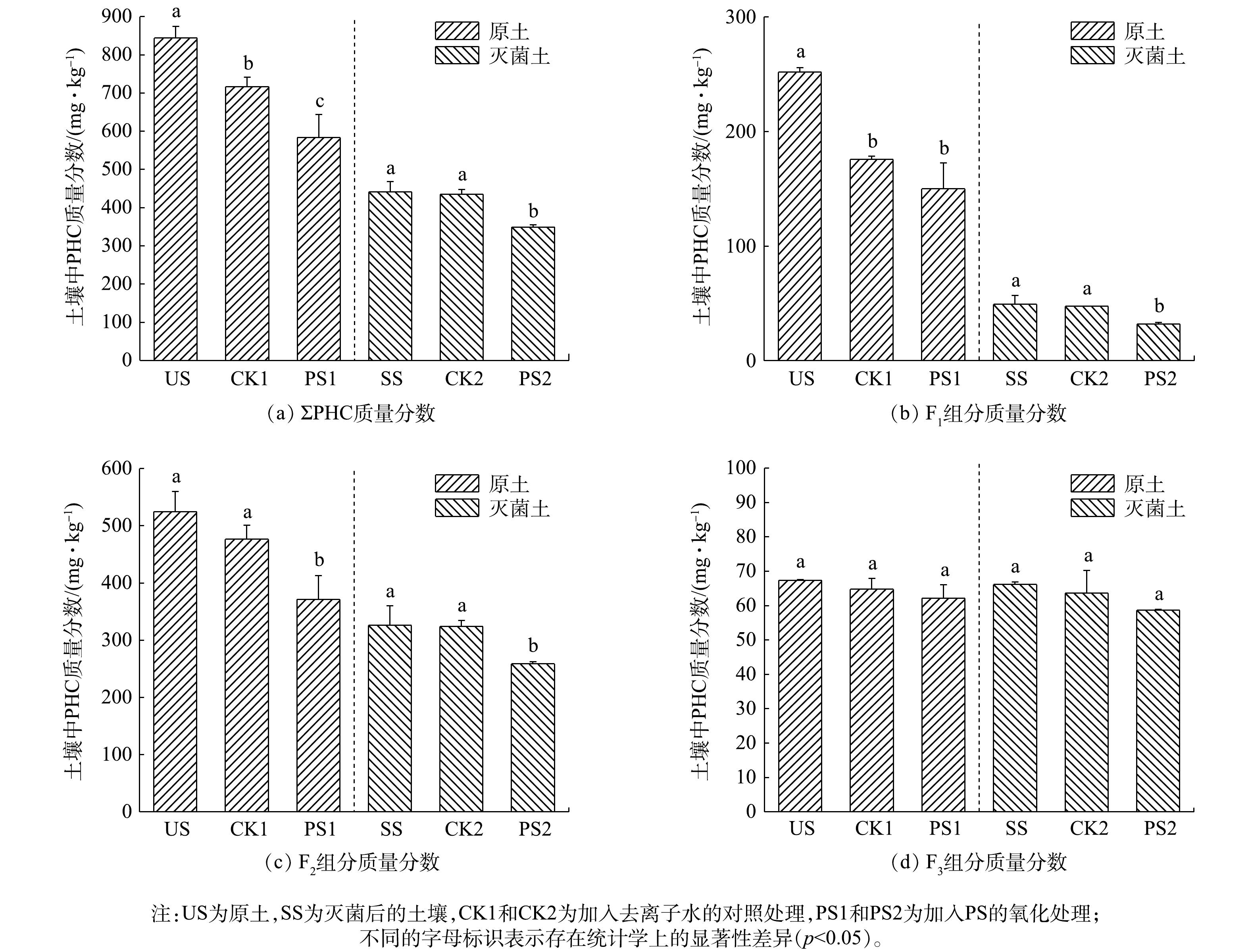
本研究土样中PHC质量分数见表1。由于原土中C31~C40组分质量分数较低 (仅占C10~C40的2.59%) ,对此组分不做进一步讨论。本研究主要探讨碳链长度为C10~C16 (F1) 、C17~C23 (F2) 、C24~C30 (F3) 的组分,其在原土 (C10~C30)中的占比分别为29.83%、62.19%、7.98%,即本研究原土中石油烃污染物以F2组分为主,其次为F1组分。与原土相比,灭菌后的原土中F1组分的损失率最大 (80.47%) ,其次是F2组分 (37.85%) ,F3组分损失率最小 (1.85%) 。
-
由图1 (a) 可以看出,灭菌空白对照组 (CK2) 与灭菌后的原土 (SS) 中ΣPHC无明显差异 (p>0.05) ,但原土空白对照组 (CK1) 中ΣPHC相对于原土 (US) 有明显减少 (p<0.05) ,表明30 d缺氧培养期间原土中PHC发生了缺氧微生物降解,去除了15.06%的ΣPHC。与SS相比,灭菌土壤的氧化处理组 (PS2) 中ΣPHC明显减少 (p<0.05) ,在仅PS氧化降解作用下去除了20.86%的ΣPHC。与US相比,原土的氧化处理组 (PS1) 中ΣPHC明显减少 (p<0.05) ,在此过程中同时发生了PS氧化和缺氧微生物降解,二者联合作用去除了30.84%的ΣPHC。这表明缺氧条件下PS氧化和缺氧微生物降解均能去除土壤中的PHC,但2者联合作用的效果更加显著。ZHANG等[12]利用PS和微生物联合在好氧条件下去除土壤中PHC,其结果也表明联合修复效果优于单一处理效果。此外,从碳链长度角度来看,缺氧微生物降解对F1、F2、F3组分的去除率分别为30.24%、9.21%、3.88%,PS氧化对F1、F2、F3组分的去除率分别为34.83%、20.69%、11.30%,联合作用对F1、F2、F3组分的去除率分别为40.43%、29.21%、7.78% (图1 (b)~图1 (d) ) ,表明土壤中PHC的去除率与其碳链长度成反比,这在其他研究中也得到了相似的结果[10,26]。
-
表面活性剂对PHC解吸的影响实验以原土经PS氧化30 d后PHC质量分数为初始值。如图2 (a) 所示,空白对照组 (CK3) 上清液中ΣPHC质量浓度为5.47 mg·L−1。与CK3相比,800 mg·L−1表面活性剂处理组上清液中ΣPHC增加了25.11%~65.50%,3 000 mg·L−1表面活性剂处理组上清液中ΣPHC增加了45.04%~251.51%,高浓度表面活性剂解吸效果更强,2种处理均在SDBS∶Tween 80=1∶3时解吸效果最好 (分别为65.50%和251.51%) ,但在高浓度处理组中SDBS∶Tween 80=1∶3时解吸效果更显著 (p<0.05) 。表面活性剂对F1、F2、F3组分的解吸效果如图2 (b)~图2 (d) 所示,当表面活性剂质量比相同时,高浓度表面活性剂对各组分的解吸效果更强;而浓度相同时,混合体系对各组分解吸效果强于单一表面活性剂,且随着体系中Tween 80的比例增加而增加。陈巧超等[20]利用SDBS-Tween 80混合表面活性剂对土壤中的芘解吸时发现,Tween 80占比提高时,混合体系解吸能力相应提高,且质量比相同时高浓度混合表面活性剂解吸效果更好。
-
各处理土壤中的细菌丰度如图3所示。US中总细菌基因拷贝数对数值为7.16,PS1中对数值为5.66,细菌数量较US下降了1.50个数量级;空白对照组 (CK4) 中对数值为7.36,较US上升了0.20个数量级。这表明缺氧条件下加入PS对土壤中细菌造成了负面影响,但经过一段时间的培养后细菌数量得以恢复,在其他研究中也观察到了这种现象[27]。在本研究中,氧化后加入表面活性剂继续缺氧培养120 d的土壤与CK4相比,800 mg·L−1处理组土壤中除SDBS∶Tween 80=3∶1和1∶0之外 (较CK4分别增加了0.19和0.49个数量级) ,细菌数量明显增加 (p<0.05) ,增加了0.61~0.81个数量级;3 000 mg·L−1处理组土壤中细菌数量与CK4相比出现显著下降 (p<0.05) ,下降了1.98~2.46个数量级。这表明缺氧条件下低浓度表面活性剂对PS氧化后土壤中细菌生长起到了促进作用,而高浓度则表现出抑制作用。TIAN等[28]在好氧条件下使用表面活性剂对原油处理后发现,表面活性剂对微生物的毒性会随着其剂量的增加而增加,在高浓度下抑制微生物增殖,而在低浓度时有促进增殖的作用。
如图4所示,US中优势菌种主要为放线菌门 (Actinobacteria) 、变形菌门 (Proteobacteria) 和厚壁菌门 (Firmicutes) 。PS1中3种细菌的相对丰度与US相比均有所下降。已有研究表明,PHC降解菌主要属于Proteobacteria和Firmicutes等[29]。GRAY等[30]探究了厌氧条件下PHC的降解机制,调查表明96%的可用细菌序列与15个不同的门有关,且以Firmicutes和所有类别的Proteobacteria为主。US中Firmicutes和Proteobacteria的基因拷贝数对数值为6.87,在CK4中,Firmicutes和Proteobacteria的对数值为7.27,与US相比增加了0.40个数量级。氧化后土壤中加入表面活性剂继续培养120 d,800 mg·L−1处理组土壤中除SDBS∶Tween 80=3∶1和1∶0之外 (较CK4分别增加了0.17和0.49个数量级) ,Firmicutes和Proteobacteria的总数量较CK4增加了0.61~0.81个数量级,土壤中PHC降解菌数量明显增加 (p<0.05) 。而3 000 mg·L−1时土壤中Firmicutes和Proteobacteria的总数量较CK4下降了2.13~2.58个数量级,土壤中PHC降解菌的数量显著减少 (p<0.05) 。
-
表面活性剂对PS氧化后土壤中PHC缺氧微生物降解的影响实验以原土经PS氧化30 d后PHC质量分数为初始值。向氧化后土壤中加入表面活性剂继续缺氧培养120 d后,如图5 (a) 所示,CK4中ΣPHC残留率为69.71%。3 000 mg·L−1表面活性剂处理组土壤中,除SDBS∶Tween 80=0∶1和1∶3外,其余组别ΣPHC的残留率均高于CK4 (增加了1.82%~11.08%) 。虽然高浓度表面活性剂对土壤中PHC解吸能力更强 (图2) ,但显著降低了土壤中细菌的丰度,抑制了PHC降解菌的数量 (较CK4下降了2.13~2.58个数量级,图3) ,因此加入3 000 mg·L−1表面活性剂抑制了PS氧化后土壤中PHC的缺氧微生物降解。
张秀霞等[31]考察了好氧条件下SDBS添加量对微生物修复石油污染土壤效果的影响,结果表明土壤中PHC的降解率会随着表面活性剂质量浓度的增加而降低,修复体系中残留高浓度的SDBS对微生物修复石油污染土壤具有抑制作用,而低浓度的SDBS有促进作用。在本研究中,缺氧条件下800 mg·L−1表面活性剂处理组土壤中ΣPHC的残留率与CK4相比出现明显降低 (p<0.05) ,下降了5.93%~15.80%,在SDBS∶Tween 80=1∶3时残留率最低 (53.91%) 。低浓度表面活性剂促进了PS氧化后土壤中ΣPHC的进一步降解,可能是因为其不仅促进了土壤中ΣPHC的解吸 (如图2,在SDBS∶Tween 80=1∶3时解吸效果最好) ,同时还提高了土壤中的细菌丰度,尤其是对PHC降解起重要作用的Firmicutes和Proteobacteria的数量 (较CK4增加了0.17~0.81个数量级,图3) 。
短链石油烃的分子量小、疏水性弱,容易被生物降解,而长链石油烃因为疏水性强,生物有效性较低[32-33],在土壤中的残留率更高。如图5 (b)~图5 (d) 所示,向PS氧化后的土壤中加入800 mg·L−1表面活性剂继续培养120 d后,F1、F2、F3组分的残留率均低于对照组CK4,对氧化后土壤中残留的中短碳链PHC的强化降解效果更强,这与表面活性剂对土壤中PHC的解吸效果相符。
-
1) 缺氧条件下PS氧化和缺氧微生物降解联合作用对土壤中的PHC有较好的处理效果,去除了30.84%的ΣPHC (C10~C30) 。
2) 表面活性剂SDBS和Tween 80混合体系对土壤中PHC的解吸效果强于单一表面活性剂,解吸效果随着表面活性剂浓度和混合体系中Tween 80比例的增加而增加。
3) 缺氧条件下向PS氧化后土壤中加入低浓度表面活性剂不仅促进了土壤中PHC的解吸,对微生物生长也起到了促进作用,除SDBS∶Tween 80=3∶1和1∶0之外 (较对照组分别增加了0.17和0.49个数量级) ,使土壤中Firmicutes和Proteobacteria的总数量较对照组明显增加了0.61~0.81个数量级,进而降低了土壤中PHC的残留率。降解效果的提升和碳链长度成反比,且随着混合体系中Tween 80的比例增加而增加,在SDBS∶Tween 80=1∶3时残留率最低 (53.91%) 。
4) 尽管高浓度表面活性剂对土壤中PHC的解吸效果更强,但处理后土壤中PHC降解菌总数量较对照组下降了2.13~2.58个数量级,抑制了PHC的缺氧微生物降解。
| PHC组分 | 组名 | 原土PHC质量 分数/mg·kg−1 | 原土灭菌后PHC 质量分数/mg·kg−1 | 原土经PS氧化30 d后PHC 质量分数/mg·kg−1 | 灭菌土经PS氧化30 d后 PHC质量分数/mg·kg−1 |
| C10~C16 | F1 | 251.64±3.94 | 49.14±7.72 | 149.90±22.45 | 32.03±1.17 |
| C17~C23 | F2 | 524.74±34.97 | 326.13±33.77 | 371.47±41.07 | 258.65±3.89 |
| C24~C30 | F3 | 67.37±0.21 | 66.12±0.74 | 62.14±3.95 | 58.65±0.28 |
| C31~C40 | — | 22.41±6.47 | 20.66±5.38 | — | — |
| ΣPHC(C10~C30) | — | 843.75±30.82 | 441.39±26.79 | 583.51±59.89 | 349.33±5.34 |




 DownLoad:
DownLoad: