-
湿地作为陆地生态系统与水生生态系统之间过渡的独特生态系统,在维持生物多样性、降解污染物、调蓄洪水等方面发挥着重要的生态功能[1-2]。近年来,随着围湖垦殖、造塘养鱼、水资源过度耗用、建设用地开发侵占、填海造陆等掠夺性开发,湿地己成为全球受威胁最为严重的自然生态系统之一[2-5],其中最主要的原因就是将湿地垦殖成农业用地或被开发用于其他目的[6-7]。湿地退化会造成湿地生物多样性受损、环境恶化,威胁到区域生态安全与可持续发展[1,8],受损湿地的恢复,是保障区域社会经济发展和保护生物多样性的必由之路。
受损湿地生态系统的修复和恢复,既可以依靠生态系统本身的自控能力进行自然恢复,也可以依靠人工调控工程进行强化修复[9-10]。早期的湿地修复多以人工强化修复为主,近年来多采用人工重建与自然修复相结合的手段[11]。20世纪60年代,欧美国家已开展湿地恢复工作[12]。2000年,美国联邦政府通过了《大沼泽湿地恢复综合规划》[13-14],对南佛罗里达大沼泽湿地进行生物多样性保护、水质改善、沟渠河道修复。我国滨海湿地生态修复工作起步较晚,早期研究多集中在退化湿地修复的基础理论研究[9]。近年来开始关注不同恢复方式对湿地的影响。周远刚等[15]以黑河中游地区张掖国家湿地公园为研究对象,比较了自然恢复方式和人工恢复方式下植物多样性和营养盐的变化特征;杨文军等[16]基于自然恢复湿地、人工恢复湿地、人工重建湿地和自然湖泊湿地等4个对照区,对南滇湿地修复效果进行了评价。退塘还湿近年来已经成为水体滨岸带湿地生态修复的重要举措。云南省高原湖泊异龙湖在2010年即大规模退塘还湖600 hm2[17];“十三五”时期,海南出台《海南省湿地保护条例》,开展湿地保护专项行动,共退塘还湿 2 933 hm2[18]。但总体来说,我国湿地修复技术研究仍然较为薄弱,尚缺乏定量化的工程实施要求[19-20],未形成相对完善的湿地标准或规范,因而对于退塘还湿、退林还湿等具体生态修复工程实施难以进行工程化指导。
天津位于海河流域下游,历史上坑塘洼淀众多,具有丰富的湿地资源,但近几十年来受开发利用影响,湿地面积萎缩、湿地生态退化。为有效遏制湿地退化趋势,天津市2017年制定了《天津市湿地自然保护区规划》等“1+4”规划[21],拟通过污染整治、湿地恢复与修复、生态移民、土地流转、护林保湿等任务,推动全市4大湿地保护与恢复。本研究依托七里海古海岸与湿地国家级自然保护区内的湿地修复工作,选择典型腾退渔塘进行退塘还湿技术研究,通过比对人工强化修复与自然保育2种手段下退塘还湿生态修复的效果,筛选退塘还湿生态修复策略与技术方法,以期为类似生态恢复工程提供参考。
-
本研究选择天津市七里海湿地核心区内的腾退鱼塘作为研究区域,开展修复实验。七里海湿地地处天津市宁河区西南部,中心位置在北纬39°17′,东经117°47′,分布在表口、七里海、淮淀、潘庄、造甲城等5个乡镇,总面积95 km2,其中核心区56.5 km2。七里海土地利用类型[22]主要包括耕地、城镇建设用地、农村居民点、水库水面、养殖水面、河流水面、草地。2019年,在七里海湿地核心区选择40 000 m2腾退渔塘区域作为退塘还湿实验区,参考南滇池国家湿地公园湖滨带鱼塘湿地恢复做法[16],采用去除塘堤、连通外部水体的手段进行恢复,并对塘内部分区域进行塘泥清挖、异位堆存,将原有鱼塘进行地形重构,使其形成高低有致、适宜不同湿地动植物生存的连续地貌环境。在高程−0.5~1.5 m内,将实验区分为深水区、浅水区、湿生区3种区域,并进行人工强化恢复与自然保育修复分区(面积各约50%)。
①高程-0.5~0.5 m 区域:为深水区,水深保持在0.5~1.5 m,以恢复沉水植物为主,兼有浮水植物恢复,如菹草、黑藻、荇菜等。
②高程0.5~1.0 m 区域:为浅水区,水深保持在0~0.5 m,以恢复挺水植物为主,如芦苇、香蒲等。
③高程1.0~1.5 m 区域:为湿生区,以恢复湿生植物为主,主要种植物芦苇及湿生杂草等。
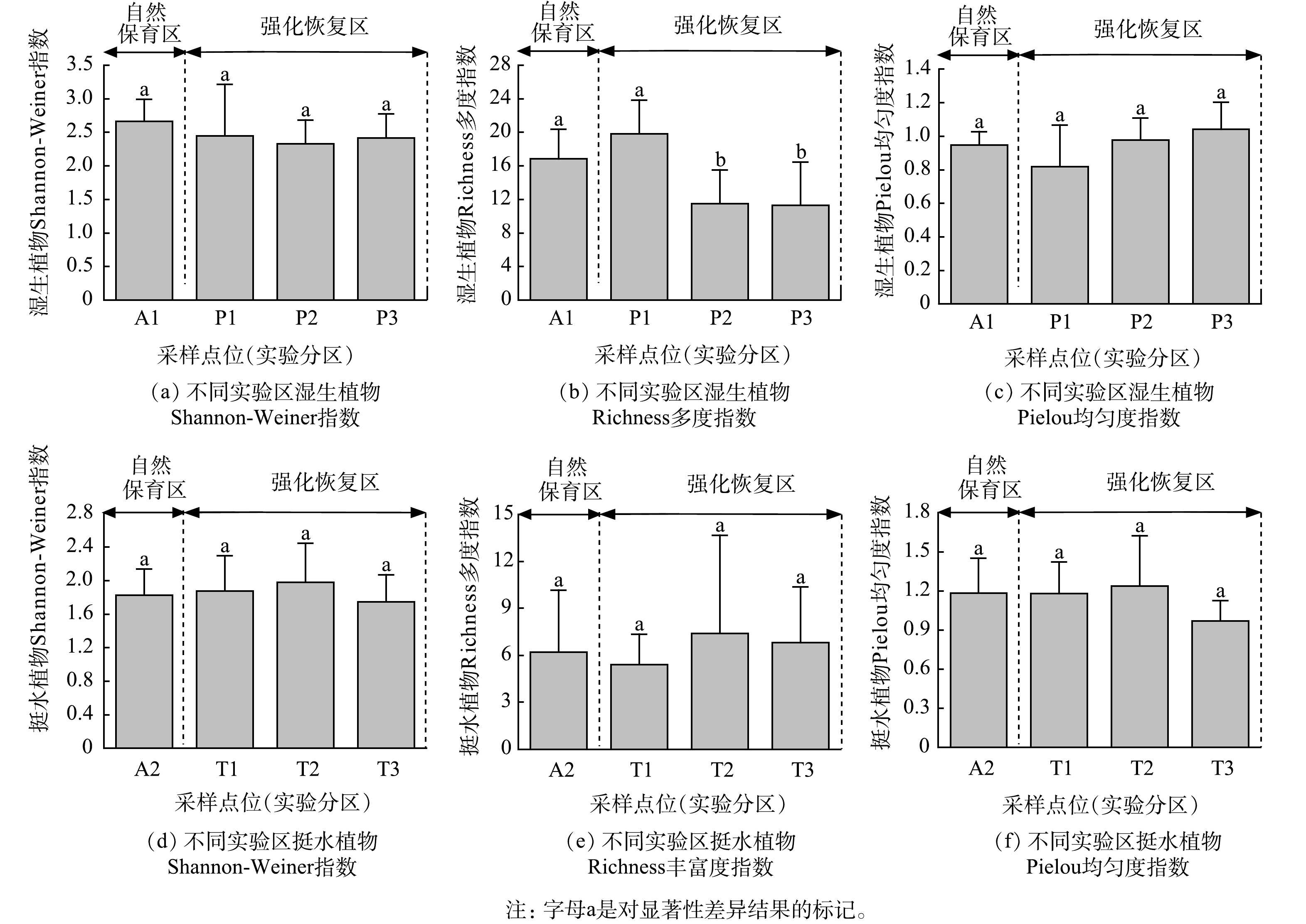
对于湿生植物恢复,人工强化恢复实验分区内设计了平行的3处(分别为P1、P2、P3),自然保育对照分区为A1;对于水生植物恢复,人工强化恢复实验分区内设计了平行的3处(分别为T1、T2、T3),自然保育对照分区为A2。退塘还湿实验区布局见图1,不同分区植物恢复方式见表1。
-
2019年6月—2020年8月,对不同分区生态修复过程进行了跟踪监测,从高等植物、浮游动植物及底栖动物、土壤微生物等3方面分别在人工强化修复与自然保育修复分区进行了监测点位布设。每间隔2个月左右(冬季除外),对湿生植物、浮游动植及底栖动物和土壤微生物(真菌)的种类、密度、生物量及多样性开展周期性监测。
湿地植物恢复区以及浅水区的高等植物调查采用样方法,每个实验分区设置4~5个1 m×1 m调查样方,依据《中国植物志》[23]、《中国高等植物图鉴》[24]等进行鉴定;在湿生植物恢复区,对植物地上部分收割后现场称重,获取高等植物地上生物量。高等植物调查日期为2019年6月、8月、10月,2020年4月、5月、7月。
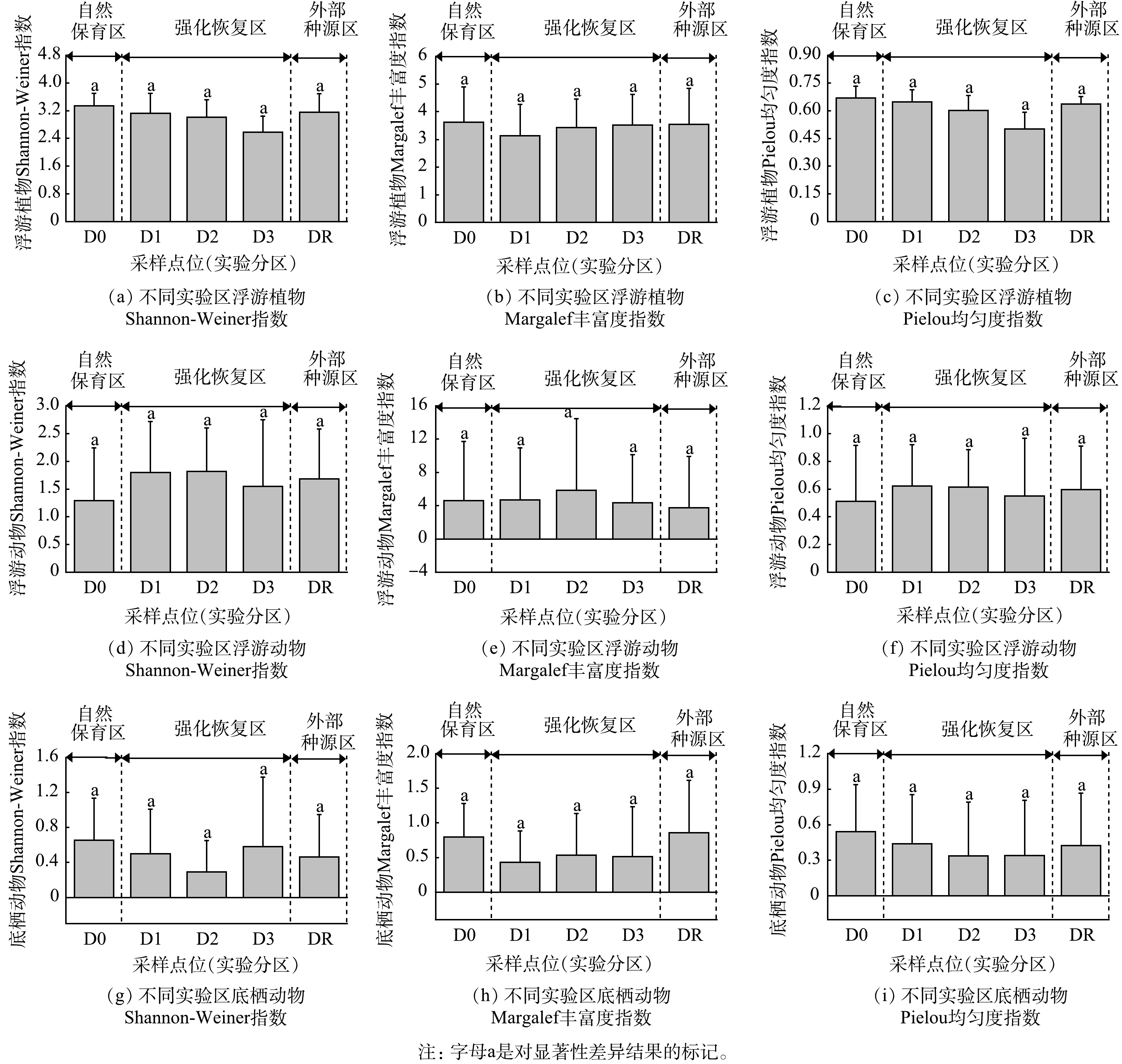
每个水生植物恢复实验分区设置一个浮游动植物和大型底栖动物调查样点(分别为D0、D1、D2、D3),并在实验区外的自然河沟中设置一处对比样点DR,具体位置见图1。浮游动植物和大型底栖动物样品采集、保存、处理和分析参照《淡水浮游生物研究方法》[25]和《湖泊生态调查观测与分析》[26]等提供的方法。底栖动物采用直接称量法,计算其湿生物量。浮游动植物与底栖动物调查日期为2019年5月、8月、10月,2020年5月、8月。
每个湿生植物恢复区采用梅花布点法设置5个土壤样品采集点位,在每个点位进行表层土壤(0~20 cm)样品采集并带回实验室后处理,先后经过冷冻干燥、DNA提取等流程开展分子生物学分析。土壤样品采集日期同浮游动植物与底栖动物调查日期。土壤/沉积物样品采用Power Soil® DNA Isolation Kit(Mobio,USA)试剂盒提取样品的基因组DNA,所用PCR引物如表2所示。PCR反应采用TransGen AP221-02(TransGen,China)的20 μL体系。PCR扩增程序为:95 °C预变性3 min;然后95 °C变性30 s,55 °C退火30 s,72 °C延伸45 s;最后再72 °C延伸10 min。PCR产物使用AxyPrepDNA凝胶回收试剂盒(AXYGEN,USA)纯化后,用2%琼脂糖凝胶电泳进行检测。Illumina高通量测序委托上海美吉生物医药科技有限公司(http://www.Majorbio.com)在Illumina Miseq PE300平台上完成。在高通量测序序列的OTU数据分析中,采用Mothur(version v.1.30.1)计算各个样品的alpha多样性(包括Shannon多样性、Chao1丰富度和Shannon均匀度等)。
-
1)湿生植物、浮游动植物和底栖生物种多样性。采用Shannon Wiener指数(H)、Simpson指数(D)、Margalef(D′)指数和Pielou指数(JSW)进行湿生植物、浮游动植物和底栖生物多样性测度[27]分析,具体计算方法见式(1)~式(4)。
式中:Pi=Ni/N,Ni为样方中第i物种的物种个数;N为样方中全部物种的物种个数;S为物种种类数。
2)数据处理。实验数据运用Excel和SPSS 19.0处理,采用单因素方差分析和多重比较检验各指标在不同时间段以及不同植被类型生境中的差异情况。
-
退塘还湿实验结束时,强化恢复区与自然保育区内的高等植物均恢复效果良好,植被覆盖度很高。实验期间强化恢复区与自然保育区共计调查到高等植物81种,其中自然保育区48种、强化恢复区77种。湿生植物恢复实验区内高等植物植物物种数与地上生物量的历次调查结果见表3。由表3可以看出,自实验开始至结束,强化恢复区物种数量均明显高于自然保育区;但无论自然保育区还是强化恢复区,湿生植物恢复实验区内的物种数量都较为稳定,不同时间调查结果差异主要是因为调查样方内的植物物种差异。强化恢复区内湿生植物地上生物量在2019年3次调查数据分别为7.95~61.5 g∙m−2(平均16.6 g∙m−2)、53.2~513.1 g∙m−2(平均133.2 g∙m−2)、26.5~690.0 g∙m−2(平均134.1 g∙m−2);2020年3次调查数据分别为12.7~168.0 g∙m−2(平均55.5 g∙m−2)、76.8~1 600.0 g∙m−2(平均410.4 g∙m−2)、141.5~1 667.5 g∙m−2(平均585.3 g∙m−2)。自然恢复区湿生植物地上生物量与强化恢复区无显著差异。无论是自然恢复区还是强化恢复区,湿生植物地上生物量高的样方均有红蓼生长,该物种植株高大,导致较高的湿生植物地上生物量。
湿生植物和挺水植物在自然保育区与强化恢复区的生物多样性指数方差分析结果见图2。由图2可以看出,自然保育区A1与强化恢复区P1、P2、P3的湿生植物Richness多度指数差异显著(P<0.05)、Shannon-Weiner指数和Pielou均匀度指数差异不显著(P>0.05)。挺水植物自然保育区A2与强化恢复区T1、T2、T3的Shannon-Weiner指数、Richness多度指数及Pielou均匀度指数差异不显著(P>0.05)。
-
由2019—2020年调查数据可以看出,浮游植物8门、42属、120种,浮游动物4门、18属、27种,底栖动物3门、6属、13种,浮游动植物及底栖动物的最大物种数量均出现在2020年8月。
调查期内自然保育区与强化恢复区的浮游动植物及底栖动物的生物密度及生物量调查结果(多点监测均值)见表4、表5。由表4、表5可以看出,自然保育区与强化恢复区的浮游植物、浮游动物在实验期间均未呈现明显变化,但底栖动物则呈现出显著增长。如自然保育区的底栖动物生物密度,2019年5月1日为550 个·m−2,2020年5月1日则增至2 000 个·m−2。
退塘还湿实验期间,强化恢复区浮游植物、浮游动物及底栖动物的生物多样性指数较为稳定,浮游植物Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数分别为2.58~3.13、3.13~3.53、0.50~0.65;浮游动物Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数分别为1.55~1.82、4.33~5.83、0.55~0.62;底栖动物Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数分别为0.29~0.58、0.43~0.53、0.34~0.44。浮游植物、浮游动物及底栖动物在自然保育区与强化恢复区的生物多样性指数方差分析结果见图3。由图3可以看出,自然保育区与强化恢复区浮游动植物和底栖动物的Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数无显著差异(P>0.05)。
-
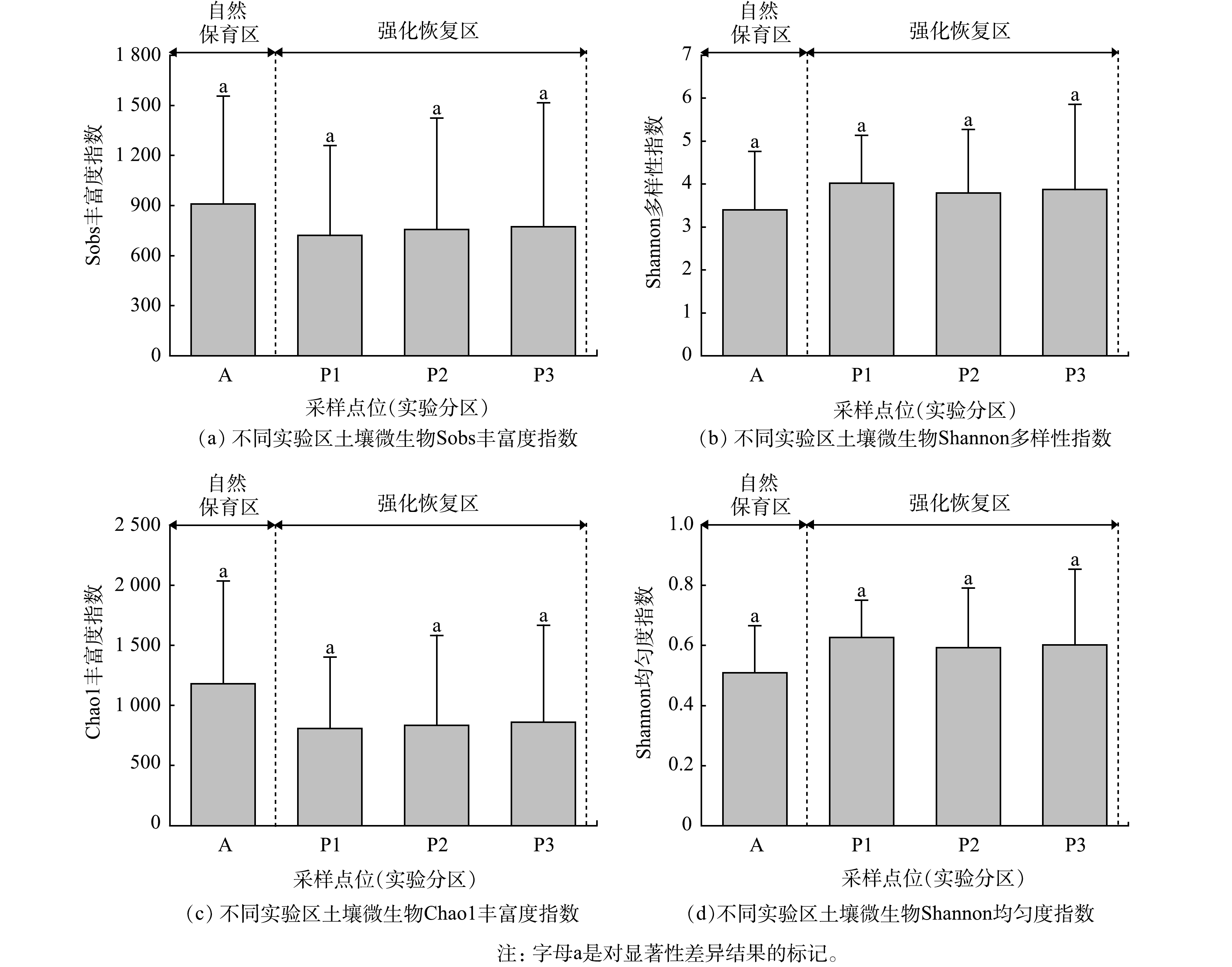
在时间维度上,真菌群落的alpha多样性表现出较大差异。Sobs丰富度指数和Chao1丰富度指数的第1次(2019年5月分别为1 660和1 870)和第3次(2019年10月分别为1 116和1 359)样品的多样性水平显著高于其他3次,表明土壤真菌群落的丰富度随时间的推移表现出明显的下降趋势。第1次样品的Shannon丰富度指数和Shannon均匀度指数(分别为5.4和0.73)高于其他4次样品多样性水平,其他采样时间未呈现明显变化趋势。
虽然在时间维度上,真菌群落的alpha多样性表现出较大差异;但在空间维度上,4个alpha多样性指数均未表现出显著差异(图4)。A区的Sobs指数为910,P1~P3的Sobs指数为720~774;而A区的Shannon多样性指数为3.4,P1~P3的Shannon多样性指数为3.9~4.0;A区的Chao1丰富度指数为1 180,P1~P3的Chao1丰富度指数为806~860;A区的Shannon均匀度指数为0.51,P1~P3的Shannon均匀度指数为0.59~0.63。这表明不同实验区域土壤真菌的alpha多样性水平相对稳定。
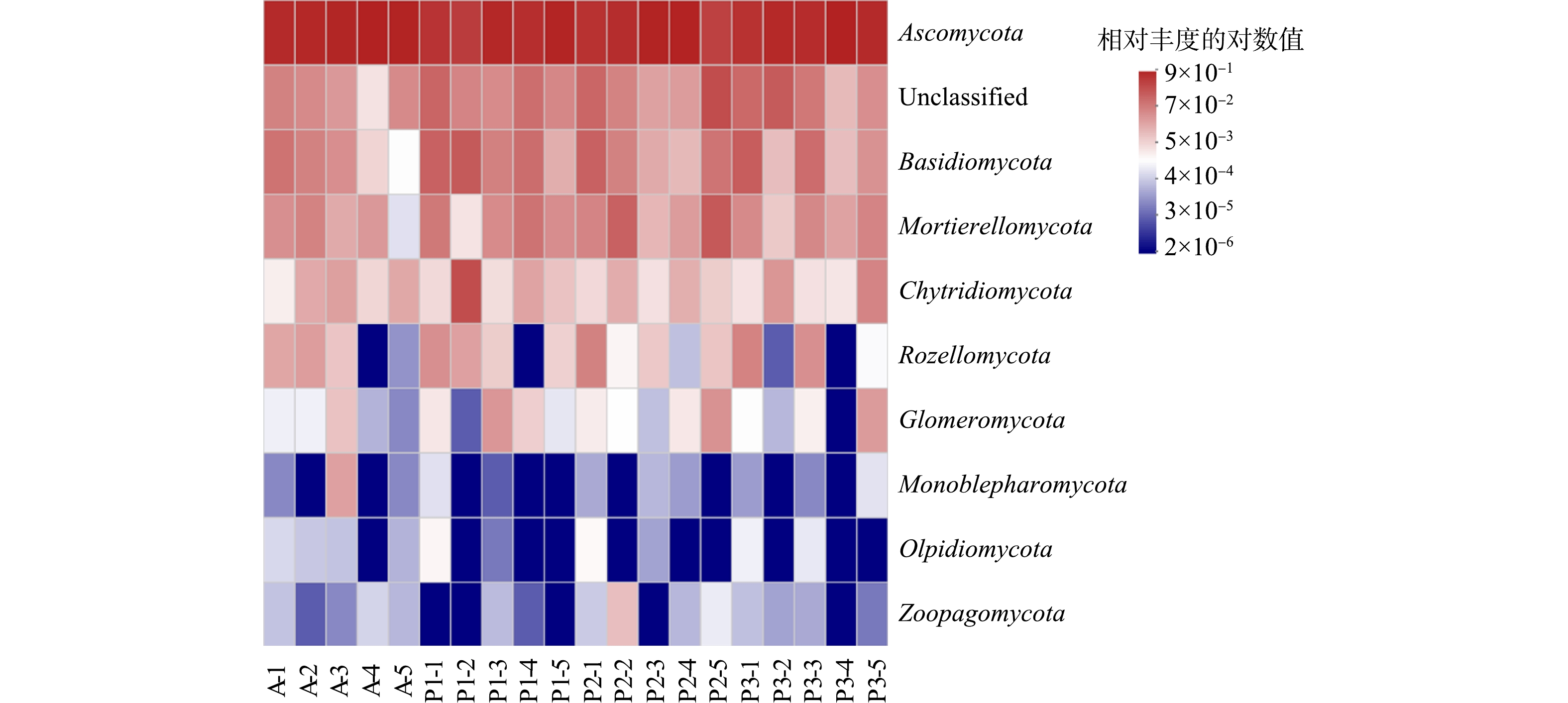
土壤样品中真菌在门水平的组成相对简单,子囊菌门类(Ascomycota)真菌在本研究采集的土壤样品中占据主导地位,其相对丰度达到了39.1%~95.1%。同时有相当部分的真菌属于未分类(unclassified)的真菌门类,其相对丰度达到了0.4%~27.4%。此外,担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)以及壶菌门(Chytridiomycota)真菌门类也在土壤真菌群落中占有一定比例,其相对丰度分别为0.1%~18.8%、0.1%~19.5%以及0.1%~27.5%(图5)。
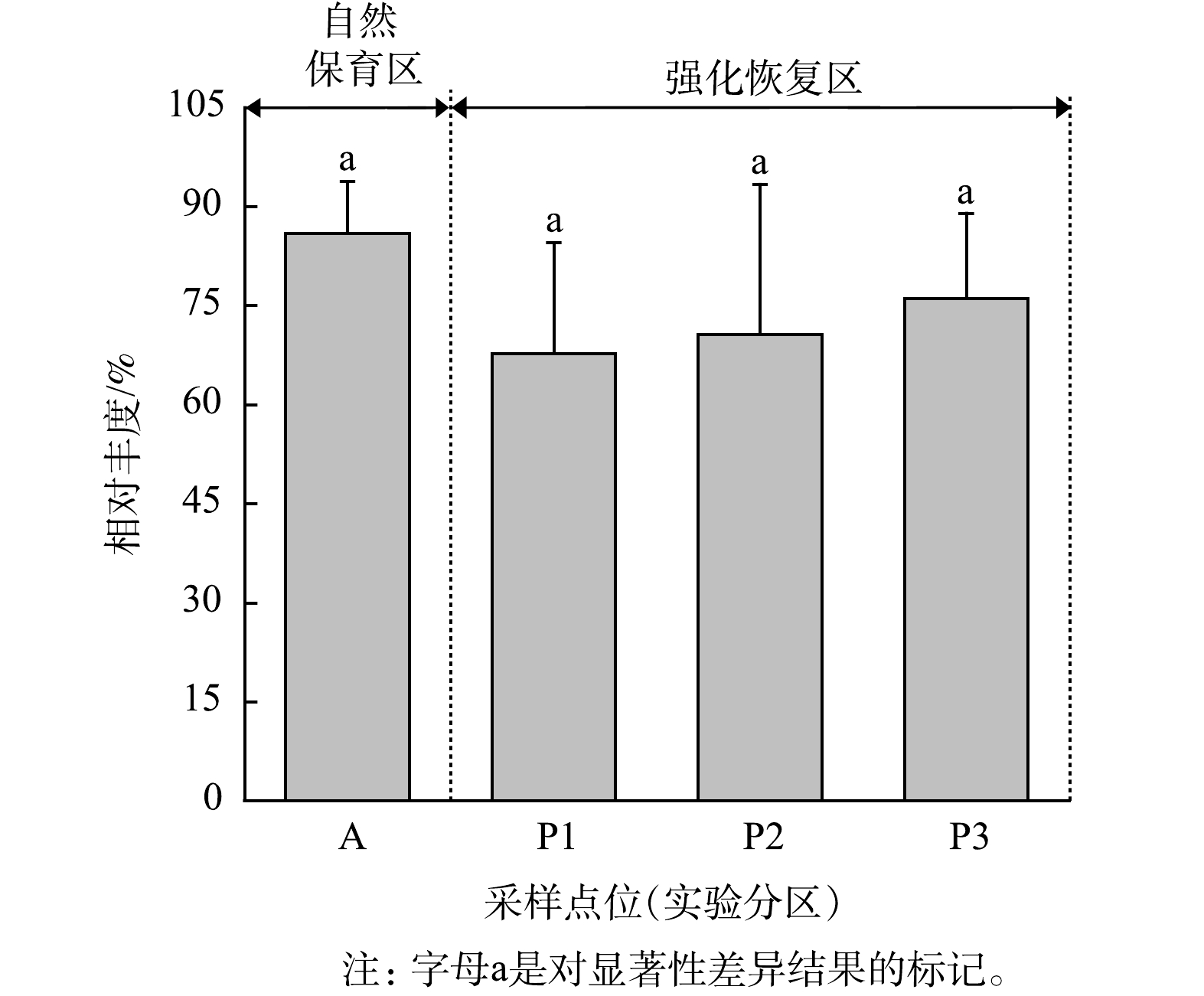
由不同恢复区土壤真菌群落组成的对比结果可以看出,占绝对优势的真菌门Ascomycota在自然保育区(A区)的相对丰度(85.9%±7.9%)要高于强化恢复区(P1~P3区)(分别为67.8%±16.8%、70.7%±22.7%和76.1%±12.9%),但自然保育区与强化恢复区之间没有显著差别(P>0.05,图6)。
-
对于自然生态系统来说,人为干扰通常作为一种负干扰,往往会对生态系统产生负面影响,降低其生物多样性水平。梁炜[28]在物种多样性的研究中发现,不同土地利用类型中人为干扰方式的不同和强度的高低可以造成植物多样性差异。祝林等[29]在南四湖区湿地公园水生植物多样性的研究中发现,人为干扰强度及面积都会对多样性指数产生影响,人为干扰强度小且面积大的区域多样性指数高,人为干扰强度大且面积小的区域多样性指数低。但是对于退化或受损生态系统,人工强化恢复措施则可以是一种正干扰,对生态系统产生正面影响,提高其生物多样性水平。吴迪[30]在上海大莲湖湖滨带湿地修复研究中发现,通过水系沟通、植被配置等方式将养鱼塘恢复成湿地水域,人工修复与自然修复区相比,其植被多样性、景观丰富度、生物多样性乃至水质的恢复效果均较为明显。
但本研究中自然保育区与强化恢复区的湿生植物多样性指数差异均不显著。这可能是因为:该实验区(含强化恢复区与自然保育区)原有鱼塘在进行退塘还湿地形改造前,生长有大量的芦苇及杂草,即使地形重构施工后,土壤中仍保留了大量的芦苇及杂草根茎与种子;同时,该实验区离七里海其他天然湿地距离较近(约200 m),受风媒、虫媒、鸟媒等影响,即使未进行先锋植物种植,自然保育区内依然可以发育多样性较强的植物群落。本实验采取的少数几种先锋植物种植物的恢复方式,不足以令人工强化恢复区在湿地恢复过程中植物多样性与自然保育区产生显著差异。虽然生态系统的修复直至达到平衡是一个缓慢的过程,具有一定的时滞效应[31],短期监测得出的结论还需要进一步跟踪研究[32],但实验前1年半(18个月)的初始阶段未表现出差异,后期显示出差异的可能性就更小。
因此,虽然植物种植通常被作为一种退化湿地的强化恢复手段,如贡湖北岸退渔还湖[33]、滇池湖滨带退塘还湿[16],但从本研究结果来看,对于塘堤原本就有芦苇及杂草生长且距离天然湿地较近的鱼塘退塘还湿,采用自然保育方式生态修复,与进行人工干预的强化恢复相比,在湿生植物、挺水植物、浮游动植物及底栖动物生物多样性等方面差异并不显著,性价比更高。只有当难以实现自然恢复时,再考虑采取人工强化的方式促进生态修复[19]。
-
浮游动植物及底栖生物是生态系统中的重要功能群[34],对湿地生态系统中的环境胁迫具有敏感响应[9,35-36]。王雅雯等[37]在浮游动植物群落结构的研究中发现,种植沉水植物的生态修复区与未修复区相比,浮游动植物多样性差异显著,生态修复区浮游动植物生物量更低、物种数更高。这可能是由于驳岸类型、地形、水深和水生植物覆盖度等因素的不同而造成生境异质性,从而引起浮游生物群落结构的差异性。任葳[9]在退化滨海湿地修复模式研究中发现,底栖动物的物种数及丰富度指数在植被强化恢复区和无植被区差异显著,且均表现为植被恢复区显著高于无植被区。
在本研究中,自然保育区与强化恢复区的浮游动植物及底栖生物的密度及生物量等各项指标,其Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数等均未无显著差异。这主要是因为,本实验区的实验水面北侧均通过狭小沟渠与实验区外河道相连,河道内的鱼类、浮游动植物、底栖动物等均是人工强化恢复与自然保育区同等一致的生物种源;即使在人工强化恢复区进行了浮水、沉水植物种植,但实际上并未产生显著的生境改变。人工强化恢复与自然保育区底栖动物在实验期间均呈现出显著增长,这可能是因为这2个分区都形成了较好的、利于底栖动物生存的栖息地环境。
综上所述,对浅水湿地的修复,可以通过与自然水体联通(构建沟渠)的方式,以自然保育的方式进行修复。
-
土壤真菌是重要的土壤微生物,是土壤中众多生态过程的参与者。本研究中土壤真菌的多样性在不同土壤恢复区间未呈现显著差异。这一结果说明,不同植被类型与恢复方式并不会对土壤真菌产生显著的分异作用[34,38]。而这一结果与以往研究有所不同,例如潘傲等[39]研究了4种植物条件下表面流人工湿地的氮磷平衡以及微生物群落结构,相较于未种植植物的人工湿地,种植植物的表流人工湿地显示出更高的微生物丰富度、多样性。本研究由于是野外实验,野外环境中不同恢复区植物的生长过程不受控制,其对土壤微生物的分异作用进一步被减弱,最终可能导致土壤微生物未呈现出显著差异。这也与真菌群落组成在空间上的变化趋势较为相似,即最占优势的真菌子囊菌门类(Ascomycota)在不同恢复区均未呈现显著差异。而相比之下,恢复过程中土壤真菌的多样性水平更易随恢复时间发生变化。
-
1)强化恢复区与自然保育区内的高等植物均恢复效果良好,共计调查到高等植物81种,但两区湿生植物与挺水植物的生物量及Shannon-Weiner指数差异均不显著。
2)自然保育区与强化恢复区的浮游植物、浮游动物在实验期间均未呈现明显变化,但底栖动物均呈现出显著增长。两区共计调查到浮游植物8门、42属、120种,浮游动物4门、18属、27种,底栖动物3门、6属、13种,但两区之间浮游动植物和底栖动物的Shannon-Weiner指数、Margalef丰富度指数、Pielou均匀度指数无显著差异。
3)对于塘堤原本就有芦苇及杂草生长且距离天然湿地较近的鱼塘退塘还湿,采用自然保育方式生态修复,与进行人工干预的强化恢复相比,在湿生植物、挺水植物、浮游动植物及底栖动物生物多样性等方面差异并不显著,性价比更高。





 下载:
下载: