-
近年来,随着地表水中微量有机物污染的日益严峻和人们对饮用水水质要求的不断提高,内分泌干扰物的环境风险和安全隐患日益受到重视[1]。在已确定的数百种内分泌干扰物中,双酚A在生活和生产中的应用最为广泛且对环境危害较大,已成为目前备受关注的一类有机污染物[2]。环境调查报告显示,双酚A在我国各类地表径流水体、地下水和沉积物中被频繁检出[3-4]。环境中残留的双酚A具有雌激素效应,其含量在ng·L−1水平即可干扰生物体内分泌系统、生殖系统及免疫系统;同时双酚A的持久性使其可以通过食物链在生物体富集,给人类健康和环境安全构成严重的威胁[5]。由于常规的饮用水处理工艺难以实现水中较低浓度双酚A的高效去除,因此,迫切需要寻找一种高效、经济且无二次污染的方法来去除水体中的双酚A。
光催化技术作为一种利用太阳能的绿色、高效水处理技术,在处理水体双酚A污染领域具有广阔的应用前景。王燚凡等[6]制备的超薄硫掺杂石墨相氮化碳纳米片在可见光下对10 mg·L−1双酚A的降解率为66.39%。KUMAR等[7]制备的ZnO-CdO纳米复合催化剂对水中双酚A和环丙沙星均具有优异的光催化性能。在众多的半导体光催化剂中,基于钛片上原位制备的TiO2纳米管阵列(TiO2 nanotube arrays, TNTAs)具有比表面积大、电荷传输性快和光催化活性高等优点,且能够有效解决粉体光催化剂难以回收和再利用的问题[8]。然而TNTAs禁带宽度较大,仅能被紫外光激发,对太阳光利用率低;且光生电子和空穴易于复合,从而阻碍了其在光催化领域的应用[9]。采用窄禁带半导体掺杂TNTAs构建异质结能够有效地解决上述问题[10-11]。
BiOBr作为一种四方晶系的窄禁带半导体,其中[Bi2O2]2+和双卤素层交替排列形成独特的层状结构,能够有效地促进光生载流子分离,显示出较好的可见光催化活性[12-13]。有研究表明,BiOBr能带结构与TiO2较为匹配,将其复合能够有效地拓展光谱响应范围,抑制光生电子空穴的复合[14-15],目前在较高浓度有机物的光催化降解中已有大量研究报道,HAN等[16]制备的BiOBr/TiO2复合催化剂,在可见光下对废水中的染料和抗生素具有良好的降解效果。MA等[17-18]报道了BiOBr掺杂的TNTAs可明显提高TNTAs对废水中罗丹明B和氯代硝基苯的光电催化性能。但采用BiOBr/TNTAs在可见光下对水中微量双酚A的去除还鲜有研究。尤其对自然水体中各种共存的无机离子和天然有机物,对双酚A光催化降解效果的影响研究更少。
本研究采用阳极氧化法-循环浸渍法制备了BiOBr/TNTAs,考察了BiOBr/TNTAs的表面形貌、光学性能及电化学性能,研究了BiOBr/TNTAs光催化降解水中微量双酚A的性能,并考察了不同水质参数对BiOBr/TNTAs光催化降解双酚A的影响规律,通过自由基淬灭实验探究了反应中发挥作用的主要活性物种,揭示了BiOBr/TNTAs光催化降解双酚A的机理。
-
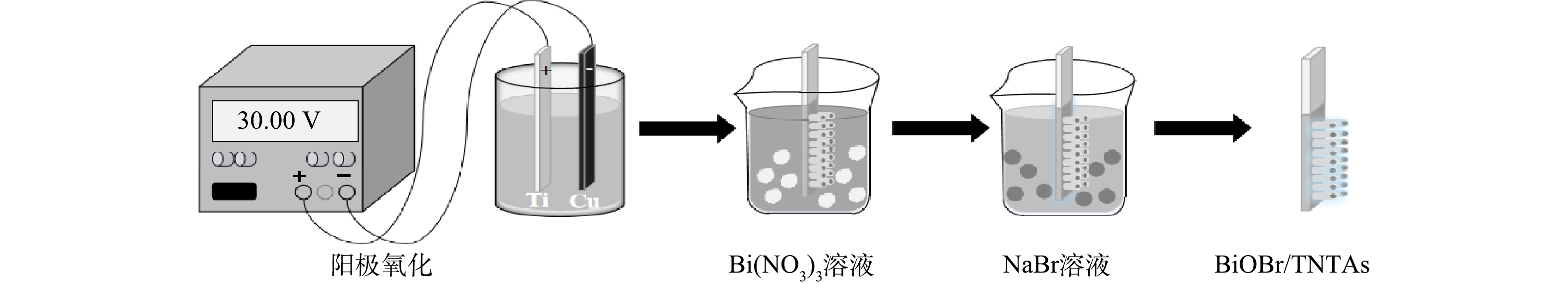
采用阳极氧化法制备TNTAs。用砂纸将钛片打磨光亮,置于乙醇溶液中超声10 min,经去离子水洗涤后烘干备用。分别以铜片和钛片为阴阳两极,在体积比为10%的水和质量分数为0.5%氟化铵的乙二醇电解质溶液中阳极氧化,氧化过程保持稳定供压为30 V,反应体系恒温25 ℃,两极间距为2 cm。氧化后的钛片用去离子水洗涤后烘干,以5 ℃·min−1的升温速率升温至550 ℃煅烧2 h得到TNTAs样品。采用循环浸渍法在TNTAs样品上掺杂BiOBr:将上述TNTAs依次放入50 mmol·L−1 Bi(NO3)3 (以0.1 mol·L−1甘露醇作为助溶剂) 和50 mmol·L−1 NaBr溶液中各浸渍1 min,得到BiOBr/TNTAs,具体制作过程如图1所示。
-
采用Sigma 300型电子显微镜 (德国Zeiss公司) 表征样品形貌,采用其自带的能谱仪分析材料表面元素。采用X-pert 3 X型X射线衍射仪 (荷兰PANalytical公司) 分析其晶型结构。采用UV-3600Plus型紫外可见分光光度计 (岛津中国有限公司) 测定样品的紫外可见漫反射光谱,评价其光吸收性能。采用CHI660E电化学工作站 (上海辰华) 分析样品的电化学性能,以0.5 mol·L−1的Na2SO4溶液为电解质。瞬态光电流测试条件为:初始电压0 V,灵敏度1×10−4 A·V−1。电化学阻抗谱的测试条件为:初始电压0.1 V,频率为10−1~105 Hz,振幅为0.005 V。
-
以初始质量浓度为1 mg·L−1的双酚A模拟其在水中微量存在的情况。双酚A溶液于圆柱形石英反应器中避光搅拌1 h达到吸附-解吸平衡后,用装有紫外滤波片的氙灯作为可见光源(300 W) ,每隔1 h取出少量降解液过0.22 μm滤膜,使用高效液相色谱在230 nm处测定双酚A的残留浓度,使用总有机碳分析仪测定总有机碳含量。由式(1)计算得到双酚A的降解率,由式(2)计算得到矿化率。
其中:η为降解率,%;C0表示初始浓度,mg·L−1;C表示光照一定时间的双酚A浓度,mg·L−1;R为矿化率,%;M0表示初始总有机碳含量,mg·L−1;M表示光照一定时间的总有机碳含量,mg·L−1。
-
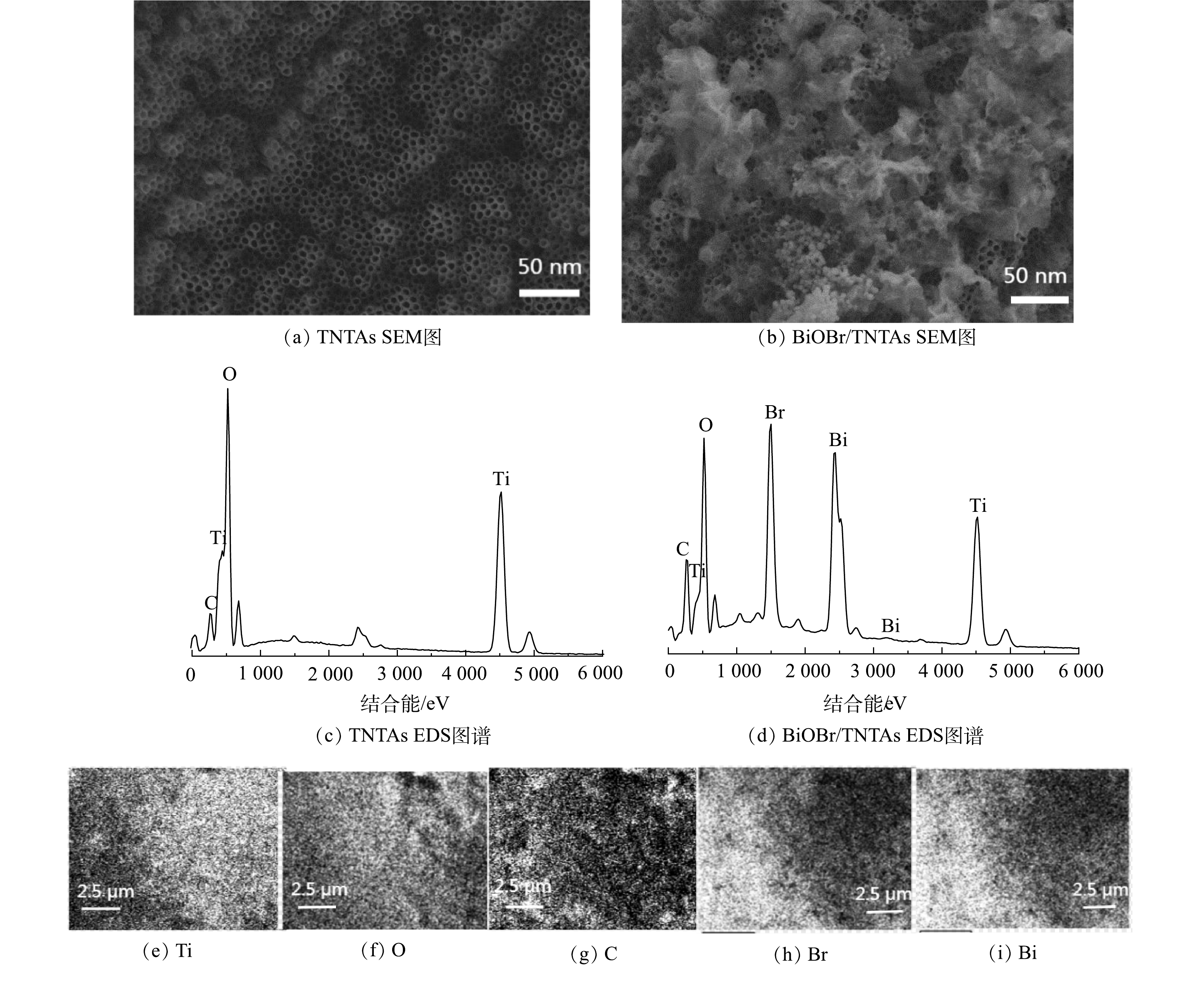
1)表面形貌分析。图2为TNTAs和BiOBr/TNTAs的SEM以及BiOBr/TNTAs的元素分布图。由图2可见:TNTAs纳米管竖直排列且结构完整,内径约50~130 nm,管壁厚约为10~20 nm,管间无杂质附着;与TNTAs相比,BiOBr/TNTAs在纳米管顶表面均匀附着了片层状的BiOBr,纳米管未被BiOBr堵塞仍保持中空结构。EDS能谱分析结果表明,BiOBr/TNTAs在TNTAs原有的Ti、O和C元素之外引入了Br和Bi元素,且Br和Bi的原子比接近1∶1,与BiOBr的掺杂相对应。与TNTAs相比,在BiOBr/TNTAs表面检测出较高的碳含量,主要是由于制备过程中前驱体溶液中的有机碳进入催化剂表面所致。由图2(e)~(i) 可以看出,Ti、O、C、Br和Bi元素分布均匀且紧密接触。以上结果证明通过阳极氧化法和循环浸渍法成功制备了BiOBr/TNTAs。
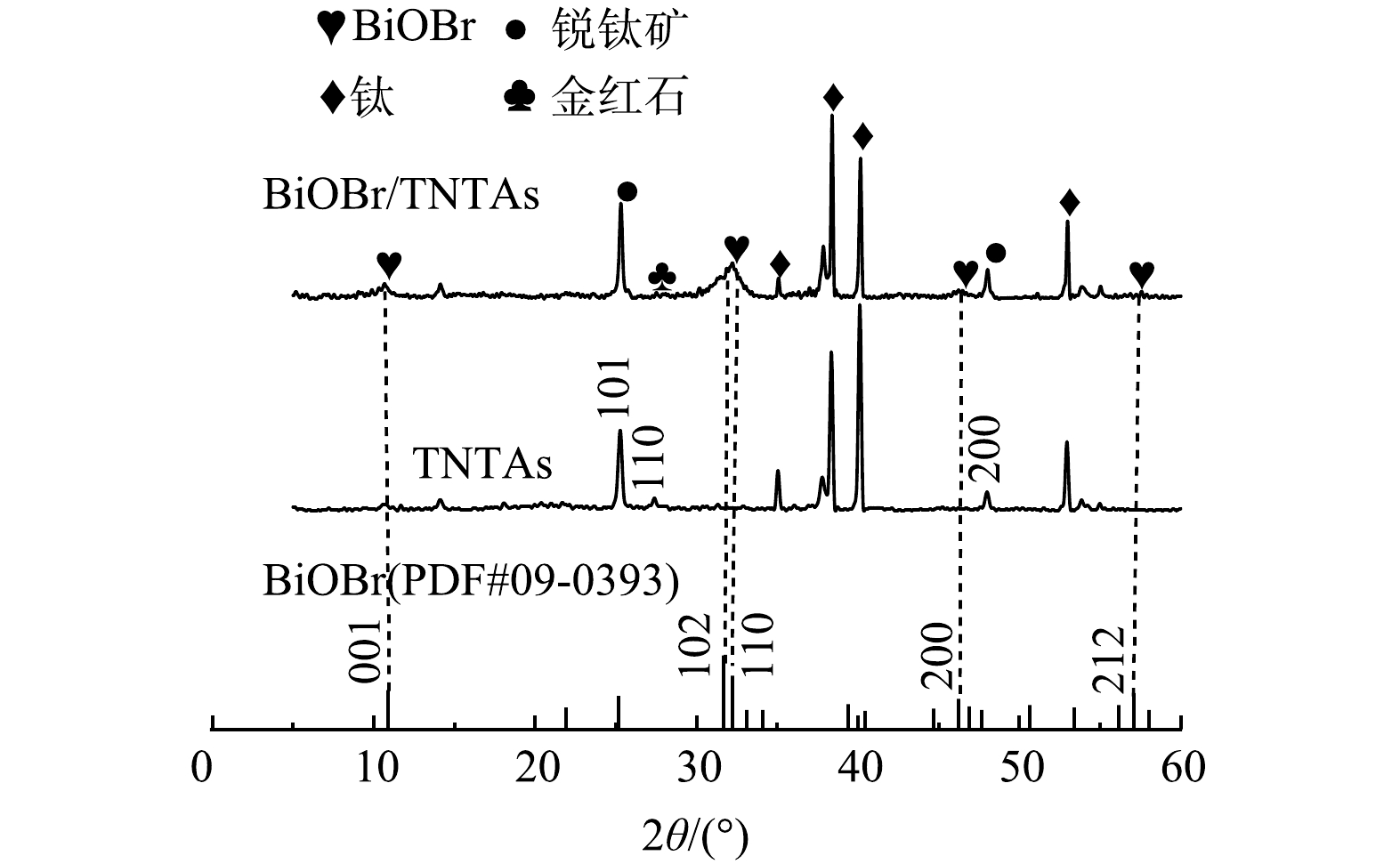
2)晶型结构分析。采用X射线衍射仪对TNTAs和BiOBr/TNTAs的晶型结构进行分析,结果如图3所示。TNTAs在25.31°和48.05°出现的2个衍射峰对应TiO2锐钛矿相的(101)和(200)晶面,在27.41°处的衍射峰对应TiO2金红石相的(110)晶面,其余为钛基体的衍射峰。说明采用阳极氧化法制备的TNTAs是锐钛矿和金红石的混晶结构。BiOBr/TNTAs在10.90°、31.69°、32.22°、46.21°和57.12°处引入5个新衍射峰分别对应四方相BiOBr(JCPDS 09-0393)的(001)、 (102)、(110)、(200)和(212)晶面,说明BiOBr已成功掺杂在TNTAs表面。
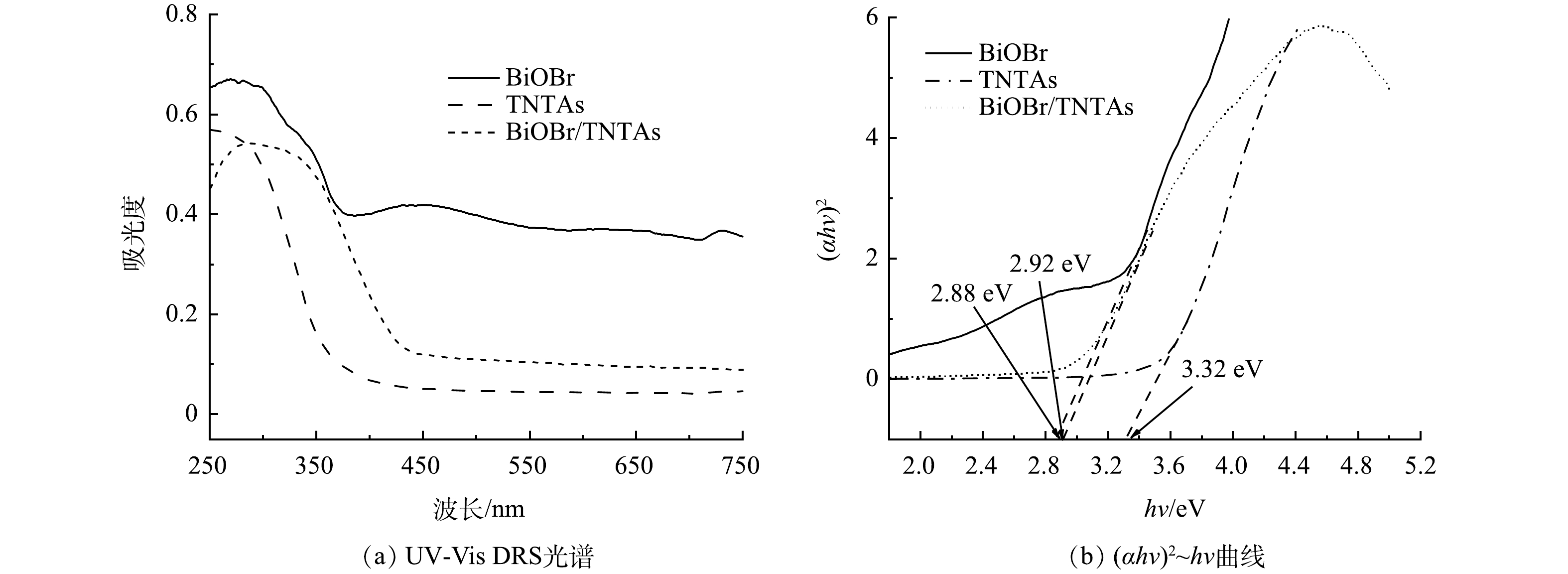
3)光学性能分析。图4为TNTAs和BiOBr/TNTAs的紫外可见漫反射光谱和 (αhv)2~hv曲线。由图4(a)可知,TNTAs不具备可见光响应能力,而BiOBr能够响应部分可见光。与TNTAs相比,BiOBr/TNTAs的最大吸收波长发生了较大红移,且光吸收性能明显增强,说明BiOBr的引入提高了BiOBr/TNTAs的光催化性能。根据式(3)[19]绘制图4(b)计算得到TNTAs、BiOBr和BiOBr/TNTAs的禁带宽度分别为3.32、2.88和2.92 eV。这表明BiOBr的引入有效降低了带隙能,从而提升了光催化性能。
式中:α为吸光系数;h为普朗克常数,eV·s;v为光的频率,Hz;A为比例常数;Eg为半导体材料的禁带宽度,eV。
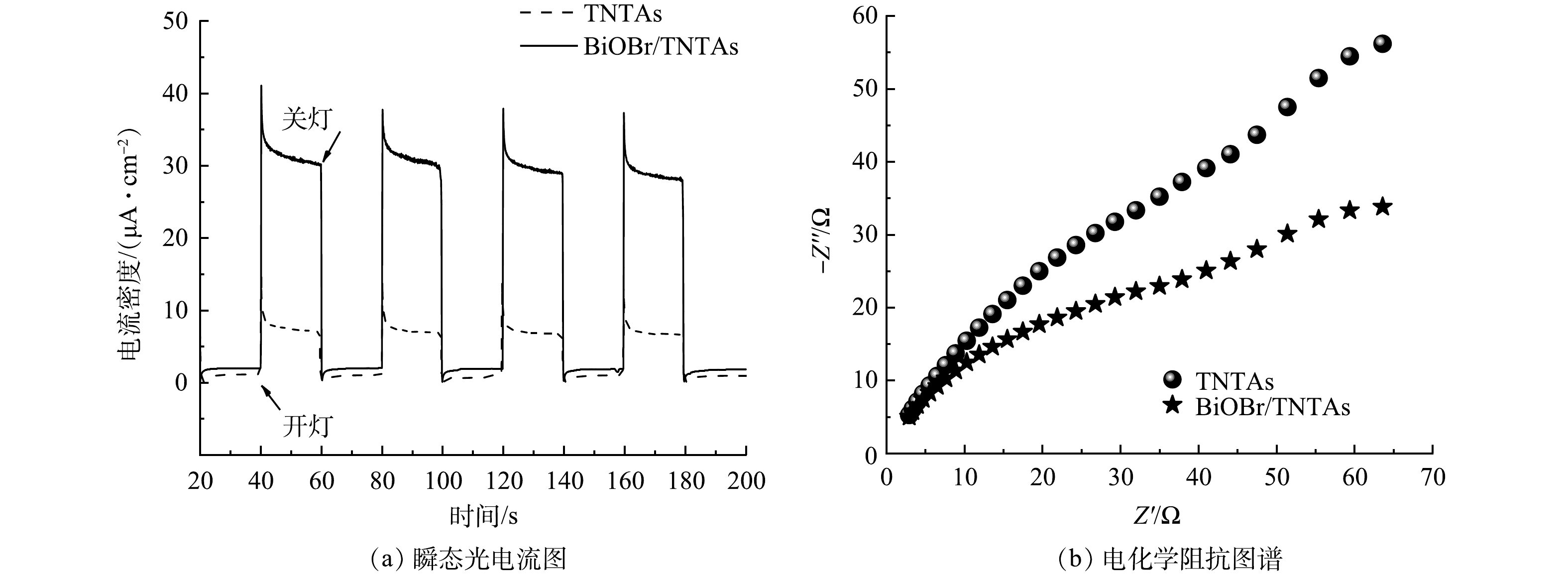
4)电化学性能分析。对BiOBr和BiOBr/TNTAs进行电化学测试以评价其电子-空穴对的分离情况。由图5(a)可以看出,TNTAs和BiOBr/TNTAs都表现出高度可重复的光电流。说明样品稳定性良好。同时,BiOBr/TNTAs的光电流响应强于TNTAs,其光电流密度稳定在31 μA·cm−2,达到了TNTAs的4倍左右。BiOBr/TNTAs的光电流响应增加表明BiOBr的引入降低了电子与空穴的复合速率,BiOBr/TNTAs的电子-空穴对的分离效率和光催化效率明显提高[20]。图5(b)为材料的电化学阻抗图谱。可见,阻抗谱半径越小,其电荷转移电阻越小,电荷迁移能力越强。BiOBr/TNTAs的曲线半径明显小于TNTAs,意味着BiOBr/TNTAs具有更小的电荷转移电阻。上述结果证明BiOBr的高效电子传输能力使TNTAs的电荷迁移速率加快,延缓了光生载流子的复合,从而提升了光催化性能[21-22]。
-
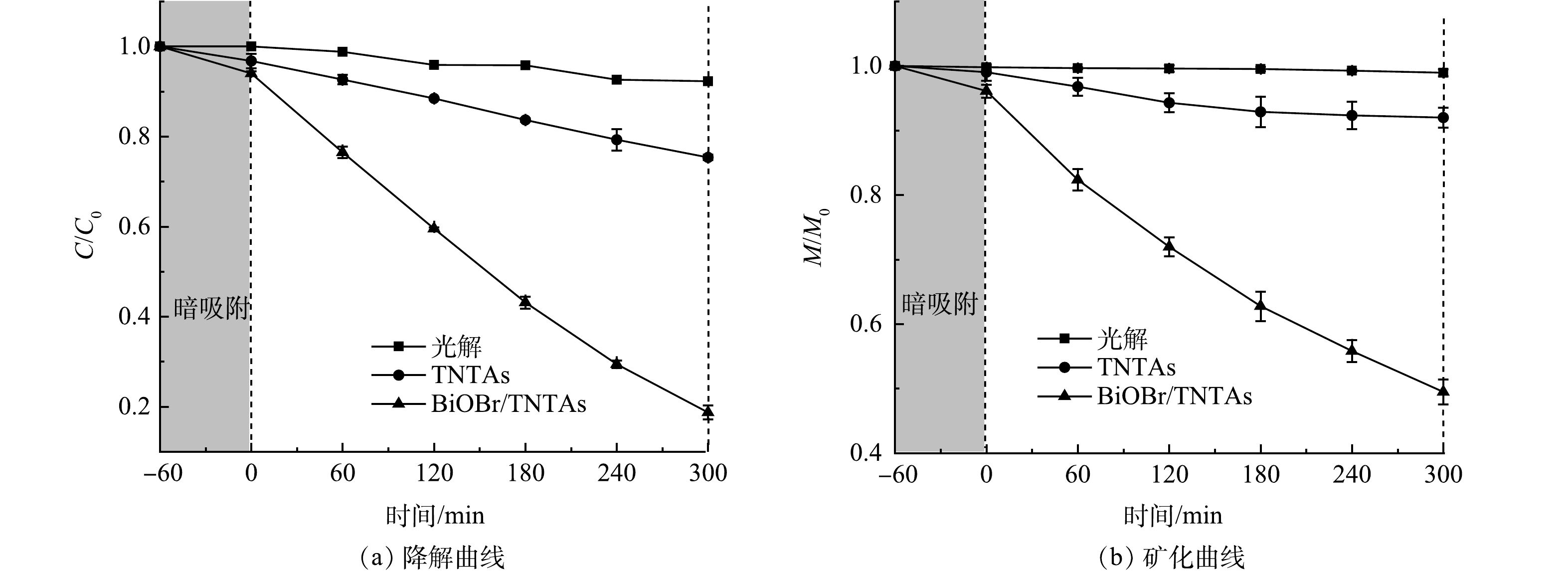
设置双酚A的初始质量浓度为1 mg·L−1来模拟其在水中微量存在的情况。图6反映了BiOBr/TNTAs对水中微量双酚A的光催化降解效果。由图6可见,双酚A基本不能被光解矿化,而采用TNTAs光催化降解双酚A的性能有限。当采用BiOBr/TNTAs进行光催化降解时,双酚A的降解率和矿化率分别由24.65%和8.01%升高至81.28%和50.51%,说明BiOBr/TNTAs对水中微量双酚A的降解性能明显提高。
-
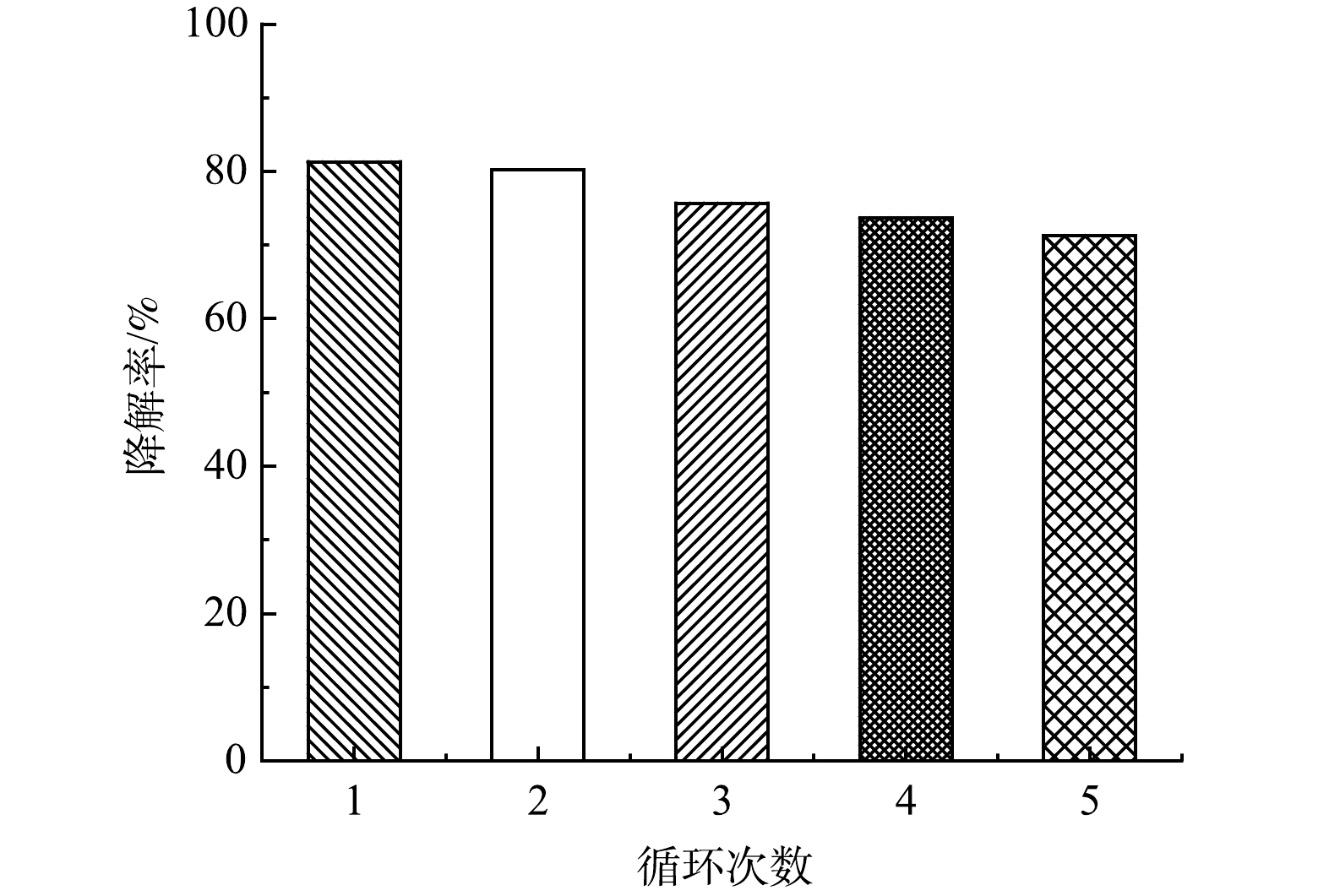
通过循环光催化实验评价BiOBr/TNTAs的稳定性,每次循环时间为360 min(暗吸附60 min、光催化300 min)。如图7所示,经过5次循环降解实验,BiOBr/TNTAs对双酚A的降解率仍保持相对稳定。这表明制备的BiOBr/TNTAs具有良好的光催化稳定性。
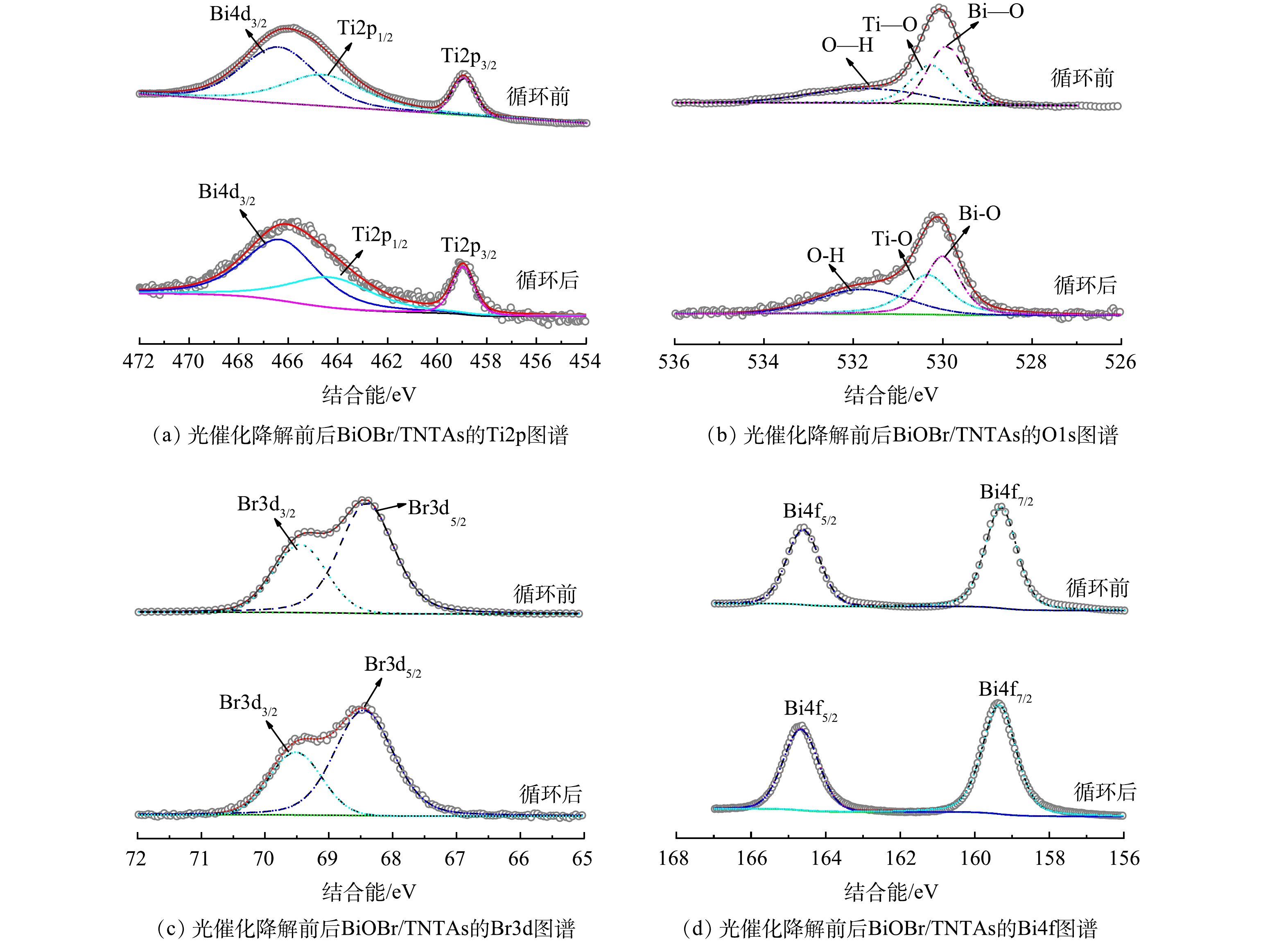
图8为光催化降解前后BiOBr/TNTAs的XPS图谱。如图8(a)所示,在光催化降解前后,458.9 eV附近的特征峰对应Ti2p3/2,466.0 eV附近的特征峰对应Bi4d3/2峰和Ti2p1/2峰的叠加。在BiOBr/TNTAs的O1s高分辨图谱中能够检测到在529.8 eV附近[Bi2O2]2+层结构中的Bi-O键、530.3 eV附近Ti-O-Ti键中的晶格氧和表面羟基氧存在而形成的Ti-OH键(图8(b)) [23-24]。上述结果表明BiOBr和TNTAs之间存在强烈相互作用形成的异质结,且光催化降解前后异质结中的化学键作用未发生改变。如图8(c)和图8(d)所示,处于69.4 eV和68.4 eV附近的特征峰分别与Br−的3d3/2和3d5/2相对应,位于152.3 eV和164.6 eV附近的特征峰分别对应Bi3+的4f7/2和4f5/2[25-26]。光催化降解前后,在TNTAs表面掺杂BiOBr的Br−和Bi3+特征峰的强度和位置并未发生明显变化。上述结果进一步说明制备的BiOBr/TNTAs具有较高的稳定性。
-
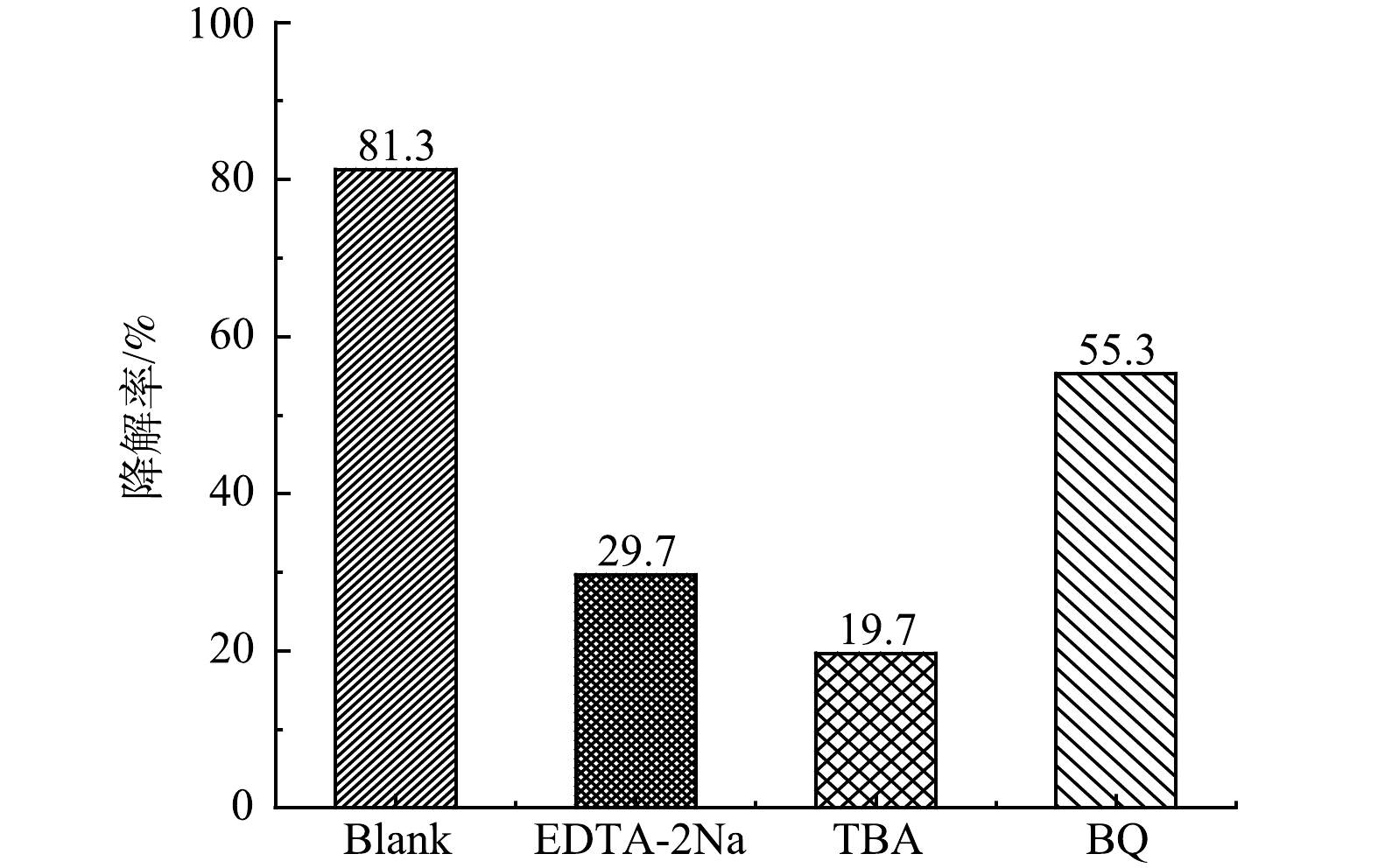
为了进一步探究BiOBr/TNTAs光催化降解双酚A的机理,进行了自由基淬灭实验。分别以乙二胺四乙酸二钠(EDTA-2Na) 、叔丁醇(TBA)和对苯醌(BQ)作为空穴(h+)、羟基自由基 (·OH)和超氧自由基(·O2−)的淬灭剂。由图9可以看出,加入BQ、EDTA-2Na和TBA后,双酚A的降解率分别降为55.3%、29.7%和19.7%。表明·OH和h+是BiOBr/TNTAs光催化降解双酚A的主要活性物种。这与MA等[27]和TAN等[28]的研究结果一致。
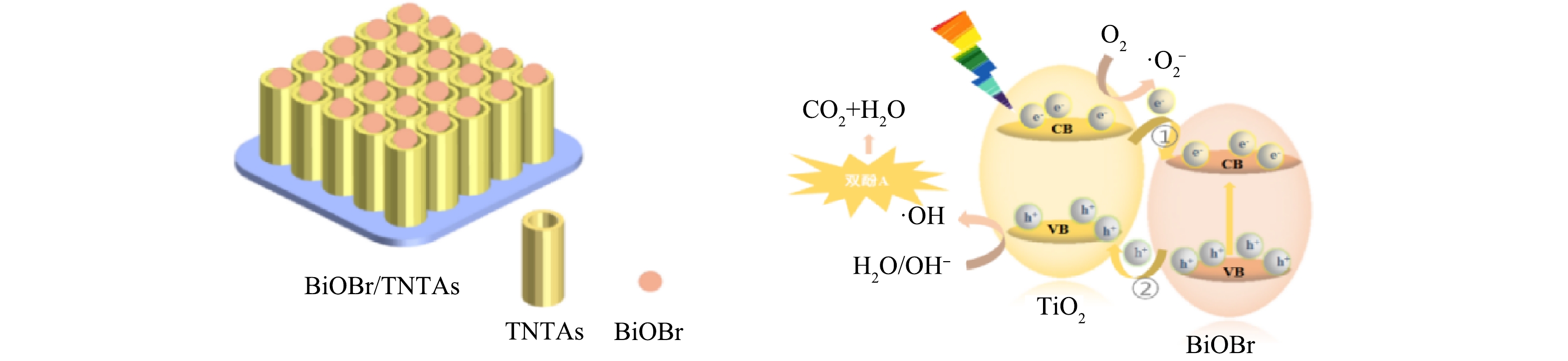
BiOBr/TNTAs光催化降解双酚A的机理如图10所示。n型半导体TiO2和p型半导体BiOBr形成type-Ⅱ型异质结,拓宽了BiOBr/TNTAs的光谱响应范围。在可见光照射下,TiO2导带上的电子迁移至BiOBr的导带,同时BiOBr价带上的空穴迁移至TiO2的价带,从而实现了光生载流子的有效分离[29]。BiOBr与TNTAs之间形成的界面异质结构起到了促进电荷分离的桥梁作用[30]。TiO2价带上的空穴氧化H2O或者OH−形成了·OH,BiOBr导带上的电子还原吸附的氧气形成·O2−[15]。随后,双酚A在空穴、·OH及·O2−的协同作用下得以降解。
-
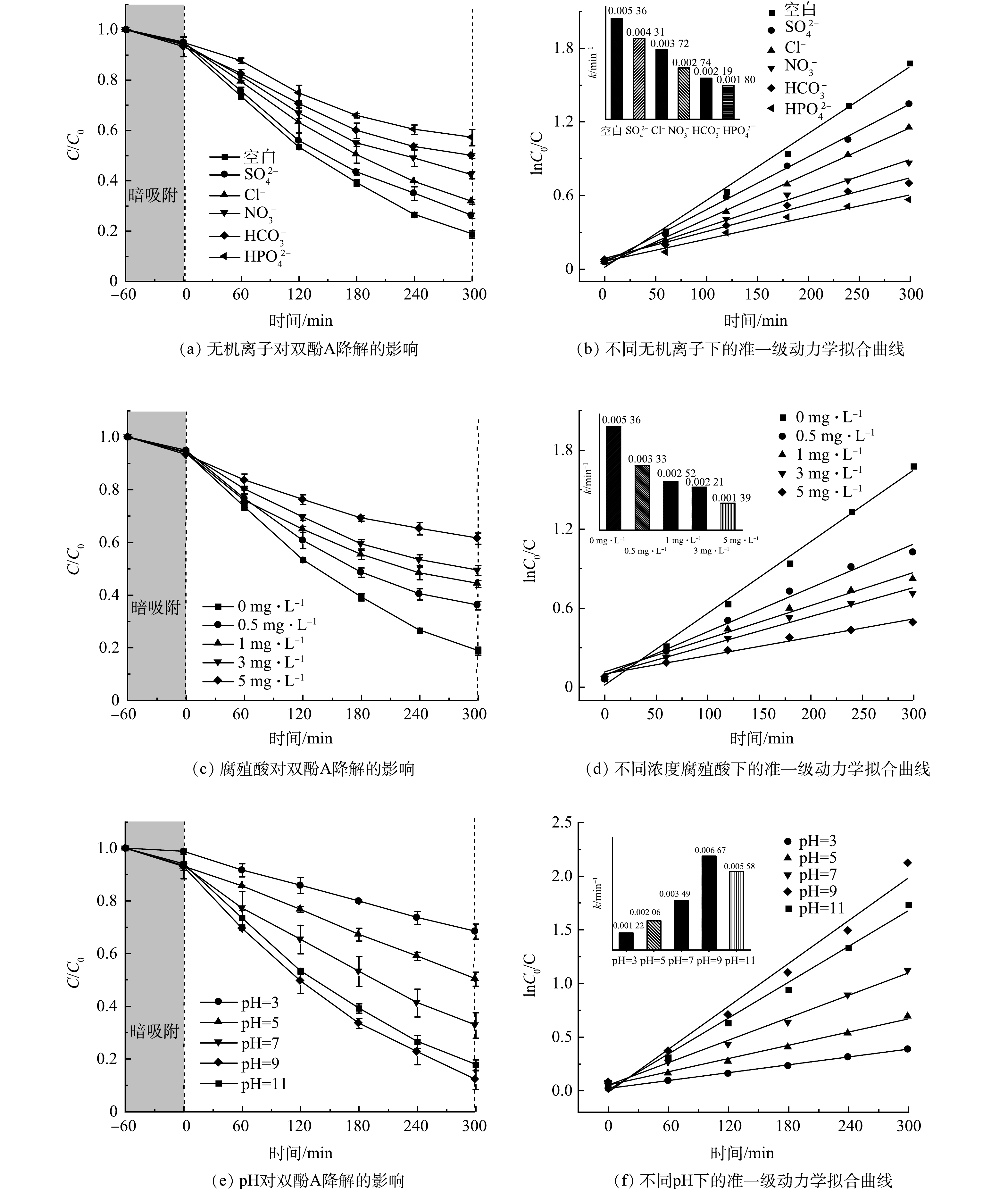
利用光催化技术去除水中微量双酚A时,水体中的双酚A常与各种无机阴离子、天然有机物等共存,他们会通过竞争活性位点或作为自由基清除剂影响双酚A的去除效果[31-32]。因此,研究不同水质参数对BiOBr/TNTAs光催化降解水中双酚A具有重要的现实意义。图11(a)为添加0.2 mol·L−1不同无机阴离子对BiOBr/TNTAs光催化降解双酚A的影响。加入HPO42−、HCO3−和NO3−后,BiOBr/TNTAs对双酚A的降解率由81.2%分别降至42.9%、50.1%和57.8%。这些阴离子常被认为是较强的活性物种清除剂,可以淬灭h+或·OH生成氧化能力较低的PO4•2−、CO3•−和Cl• (式(4)~式(9)) ,从而降低了双酚A的降解率[33-34]。加入Cl−和SO42−后,BiOBr/TNTAs对双酚A的降解效率也有一定程度的降低,Cl−和SO42−会吸附在催化剂表面与双酚A竞争活性位点,或者与h+或·OH发生反应,从而对双酚A的去除产生不利影响 (式(10)~式(13)) [35]。如图11(b)所示,加入Cl−、HCO3−、SO42−、NO3−和HPO42−后,BiOBr/TNTAs对双酚A的降解速率常数分别为0.003 72、0.002 19、0.004 31、0.002 74和0.00 180 min−1,这说明不同阴离子对光催化性能的抑制程度分别为HPO42−>HCO3−>NO3−>Cl−>SO42−。
水体中的双酚A会与各种天然有机物共存,其中腐殖酸约占天然有机物的50%~90%[36]。以腐殖酸为代表,研究了其对BiOBr/TNTAs光催化降解水中微量双酚A的影响。由图11(c) 和图11(d) 中可以看出,随着腐植酸浓度的升高,BiOBr/TNTAs对双酚A降解效果越弱,双酚A的降解率由81.2%降至38.5%,对应的反应速率常数由0.005 36 min−1降为0.001 39 min−1。这可能是由于腐殖酸阻碍了可见光传递至BiOBr/TNTAs的表面,导致材料对可见光的利用率降低;同时腐殖酸能够捕获反应过程中产生的光生空穴,从而降低了BiOBr/TNAs对双酚A的去除率[37-38]。
图11(e)和图11(f)为pH对BiOBr/TNTAs光催化降解微量双酚A的影响结果。双酚A的降解率随着反应体系的pH升高而增加,当pH为9和11时,双酚A的降解率为88.0%和82.3%,对应的反应速率常数为0.006 67 min−1和0.005 58 min−1。碱性条件下有较高的降解率是由于此时双酚A的电离程度增加,能够更好地吸附在BiOBr/TNTAs薄膜的表面,且碱性条件下电子-空穴对易于捕获OH−的电子而产生大量·OH,故光催化效果更好[39-40]。但根据能斯特方程,pH也会影响半导体导带和价带的能级位置,碱性过强则会使二者上移,导致空穴氧化能力下降,影响BiOBr/TNTAs对双酚A的去除[41-42]。
-
1) BiOBr/TNTAs在可见光下对水中微量双酚A的去除率和矿化率分别为81.2%和50.5%,明显高于TNTAs,且表现出优异的光催化稳定性。
2)水体中共存的各种阴离子和腐殖酸等会通过竞争活性位点或作为自由基清除剂影响双酚A的去除效果。
3) ·OH和h+是BiOBr/TNTAs光催化降解双酚A的主要活性物种。
4)光催化活性增强主要归因于BiOBr和TNTAs间p-n异质结的形成,可有效拓展TNTAs的光谱响应范围,从而提高光生电子-空穴的分离效率。
| 土壤编号 | 地点 | 有机质含量/ (g·kg−1) | 全氮/ (g·kg−1) | 总磷/ (mg·kg−1) | 全钾/ (103 mg·kg−1) | 阳离子交换量/ (cmol·kg−1) |
| 1 | 林地 | 6.23 | 0.41 | 138.2 | 1.45 | 3.73 |
| 2 | 农田 | 16.10 | 0.85 | 55.7 | 6.94 | 3.73 |
| 3 | 农田 | 14.91 | 1.07 | 66.2 | 1.16 | 7.27 |
| 4 | 果园 | 15.21 | 2.29 | 277.1 | 4.74 | 7.68 |
| 5 | 农田 | 9.42 | 0.62 | 64.5 | 1.29 | 4.58 |
| 6 | 农田 | 20.81 | 1.69 | 363.1 | 2.77 | 18.98 |
| 7 | 农田 | 9.56 | 1.38 | 332.0 | 2.41 | 16.32 |




 DownLoad:
DownLoad: