-
真菌毒素是由真菌感染产生的一组有毒次生代谢产物,其对人和动物摄入时会产生严重的中毒反应. 因真菌毒素主要污染粮油食品及其制品,而使得其营养价值和商业价值大幅度降低,已成为食品中最为关注的污染物之一. 脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON,又称呕吐毒素)是一种与小麦赤霉病和玉米穗腐病有关的真菌毒素,其化学性质稳定,加工过程难以去除,是谷物相关食品和饲料中的主要检测对象[1]. 同时DON的阳性检出率很高,Yan等[2]发现,在检测的579个小麦样品中均检出DON,而606个玉米样品中99.8%的DON检测结果为阳性.
黄粉虫作为一种富含营养、高效和可持续开发的动物源性蛋白质和能量来源,在饲料和食品加工中受到了广泛的关注. 黄粉虫的饲喂多采用麦麸、玉米屑等易受脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮(zearalenone,ZEN)等真菌毒素污染的谷物,然而,国内外相关研究表明黄粉虫幼虫对DON和ZEN均具有较高的耐受性. 喂食DON浓度为4.9—8.83 mg·kg−1的饲料时,黄粉虫幼虫的增重和存活率等生长性能不受明显影响[3 − 4],黄粉虫幼虫对干饲料中AFB1的耐受性高达0.415 mg·kg−1[5]. 究其原因,其一,黄粉虫体内可能存在一套毒素排泄机制;其二,黄粉虫自身或者其肠道微生物区系具有真菌毒素代谢能力;从而避免或者减轻了真菌毒素对其的毒害作用. 有研究证明玉米赤霉烯酮在黄粉虫体内可以代谢成其α-和β-异构体[6],Van Broekhoven等[4]也发现部分DON(14%—40%)及其降解产物3-乙酰基脱氧雪腐镰刀菌烯醇(3-Ac-DON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-Ac-DON)被排出黄粉虫体外. 同时也有研究表明,黄粉虫幼虫通过中肠中的酶和肠道细菌产生的酶可将DON乙酰化,蜜蜂(Apis mellifera)和玉米耳虫(Helicoverpa zea)通过自身产生的NADPH依赖性还原酶和羟化酶可将黄曲霉毒素羟基化[7]. 此外,细胞色素P450酶、磺基转移酶和糖基转移酶等酶可能也参与了昆虫体内真菌毒素的代谢[6]. 昆虫肠道菌群丰富,主要以易被真菌毒素侵染的食物残渣为食,其肠道内极易存在真菌毒素耐受性微生物,同时大量报道表明黄粉虫的肠道微生物能够降解塑料及其制品[8 − 11]. 综上,黄粉虫可能是真菌毒素降解的良好媒介,在解决真菌毒素污染方面具有极大的潜力,而从黄粉虫体内或者其排泄物中成功分离真菌毒素降解菌株则鲜见报道.
本研究从黄粉虫幼虫的排泄物中筛选得到了一株高效降解DON的Devosia sp. SD9-2,并进一步研究了该菌株的降解最适条件,确定了该菌对DON的降解是由于微生物酶的作用. 本研究为真菌毒素降解菌提供了新的高效的分离来源,丰富了具有生物转化DON能力的微生物资源库,为探索黄粉虫真菌毒素耐受的机理提供了有利的参考,并为开发去除谷物和饲料中DON的微生物制剂奠定基础.
-
黄粉虫幼虫和饲料分别购买自福建省宁德市和山东省德州市. 以麦麸为唯一食物,在温度(25±1) ℃;湿度60%的条件下饲养. 培养容器中麦麸被完全消耗时,用无菌30目孔筛筛除容器底部残留物中的杂质,收集黄粉虫的排泄物.
-
MMFS培养基:Na2HPO4·12H2O 4.03 g,KH2PO4 1 g,NaNO3 0.5 g,(NH4)2SO4 0.5 g,Mg2SO4·7H2O 0.5 g,CaCl2·2H2O 0.025 g. 蒸馏水定容到1 L,pH为7.0,灭菌后加入200 μL微量元素溶液和10%(V/V)无菌粪便上清液.
TSB培养基(g·L−1):胰蛋白胨17.0 g,植物蛋白胨3.0 g,NaCl 5.0 g,K2HPO4 2.5 g,葡萄糖 2.5 g.
培养基灭菌条件为121 ℃高压灭菌15 min. 制备固体培养基的琼脂粉添加比例为1.5%(M/V).
-
DON标准品纯度为98%,购自青岛普瑞邦生物工程有限公司,用水配制成浓度为10 g·L−1的标准溶液. 3-酮基-DON(3-keto-deoxynivalenol,3-keto-DON)标准品纯度为98%,购自加拿大TripleBond公司. 细菌基因组DNA试剂盒、吩嗪硫酸甲酯(phenazine methosulfate, PMS)和用于PCR的2×HIFI Amplification Mix(dye+)购于生工生物工程(上海)股份有限公司;革兰氏染色溶液和纯度为99%的吡咯喹啉醌(pyrroloquinoline quinone disodium salt,PQQ),购自上海源叶生物科技有限公司(中国). 厌氧培养系统(包括厌氧培养袋、厌氧产气包和氧气指示剂)购自青岛海博生物技术有限公司,根据其产品手册使用以进行厌氧培养.
超高效液相色谱仪(美国赛默飞世尔科技公司,UltiMate3000). 检测条件:色谱柱ACQUITY UPLC® BEH C18柱 (2.1 mm×100 mm, 1.7 μm);流动相A为纯水,流动相C为乙腈. 梯度洗脱条件:0—6 min,0.2 mL·min−1,5% C—25% C; 6—12 min,0.2 mL·min−1,25% C;12—13 min,0.2—0.4 mL·min−1,25% C—5% C;13—17 min,0.4 mL·min−1,5% C;17—18 min,0.4—0.2 mL·min−1,5% C. 进样量2 μL;检测波长220 nm;柱温箱40 ℃.
-
降解菌的筛选:将福建和山东的黄粉虫排泄物分别命名为FJ和SD. 分别称取排泄物各3 g于50 mL无菌离心管中,加入45 mL磷酸缓冲液,220 r·min−1振荡,泡涨溶解30 min,静置20 min. 分别吸取500 μL中部上清液接种至添加50 μg·mL−1 DON的4.5 mL MM中,于恒温振荡器220 r·min−1,30 ℃培养3—5 d. 吸取200 μL待测菌液加入等体积甲醇,涡旋振动混匀后,以
14000 r·min−1离心10 min,吸取上清液,用0.22 μm有机滤膜过滤,用超高效液相色谱仪检测. 选择具有DON降解活力的混合培养物,吸取20 μL接种到2 mL添加DON(50 μg·mL−1)和PQQ(10 μmol·L−1)的MMFS中,于恒温振荡器220 r·min−1,30 ℃培养3—5 d. 连续进行4次转接培养,以获得具有稳定降解活性的混合培养物.降解菌的分离纯化:吸取第4次仍保留DON降解活性的菌液100 μL在无菌蒸馏水中梯度稀释(10−1—10−7),每个梯度的稀释液取100 μL均匀涂布在TSA固体培养基,30 ℃培养7 d,挑取整个单个菌落,在含有PQQ(10 μmol·L−1)和DON(50 μg·mL−1)的MMFS(终体积为200 μL)中脱毒3 d,检测其降解DON的能力,在TSA固体培养基上划线3次,获得纯培养物. 从TSA平板刮取菌体,置于25%(V/V)的甘油中,振荡混匀后于−80 ℃保存.
-
形态鉴定:将获得的菌株在TSA培养基上划线,30 ℃培养3—6 d获得单菌落,观察其大小、形状、颜色、边缘和表面的形态等. 对菌株进行革兰氏染色,于显微镜下观察其细胞的形态特征,并判定其革兰氏阴阳性.
分子鉴定:细菌基因组DNA的提取使用细菌基因组DNA试剂盒,按照制造商的说明进行. 用通用引物27F(5‘-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5‘-GTACCTTGTACGACT-3’)在Biometra GmbH PCR仪(Goettingen, 德国)上扩增出16S rDNA序列. 反应体系为:25 μL的2×HIFI Amplification Mix(dye+),上下游引物各1.5 μL,2 μL基因组模板,添加无菌蒸馏水至50 μL. PCR反应条件如下:94 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸45 s,35个循环后于68 ℃继续延伸4 min,扩增产物通过0.8%(W/V)的琼脂糖凝胶电泳进行检测后送至BIOMED(北京,中国)测序. 测序结果在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中进行BLAST搜索,选取序列相似性较高的菌株采用邻接法在MEGA 11.0构建系统发育树.
-
SD9-2虽然在TSA固体培养基上生长良好,但因未知原因和菌株的独特性,它在TSB(与TSA固体培养基成分相同但不添加琼脂粉)、R2A、MMFS等各种液体培养基中振荡、静置和厌氧培养均未见明显生长现象(初始OD600为0.18,培养3 d的OD600为0.17、0.18、0.17),对其DON的降解特性表征的研究方法只能从对液体条件下的菌体生长-毒素降解的动态偶联考察,变为采用收集固态平板上新鲜菌体并考察静息细胞的降解特性,相关方法如下:采用TSA固体培养基对SD9-2进行培养,从平板上刮取菌体,用无菌25 mmol·L−1 Tris-HCl buffer(pH 8.0)将菌体制成菌液,OD600=1.05(相当于3.25×106 cfu·mL−1). 将SD9-2菌液按1%(V:V)添加至含50 μg·mL−1DON的MMFS中,分别用不同培养温度(18 ℃、30 ℃、37 ℃),培养基pH(5.0、6.0、7.0、8.0、9.0),不同浓度的PQQ(0、0.01、0.1、1、10 μmol·L−1)和不同的脱毒方式(好氧、厌氧和静置)对SD9-2静息细胞进行降解特性的研究. 考察不同温度对DON降解活性的影响时,则其它变量因子固定为pH=7.0、10 μmol·L−1 PQQ和220 r·min−1 振荡;考察不同pH对DON降解活性的影响时,则其它变量因子固定为30 ℃,10 μmol·L−1 PQQ和220 r·min−1 振荡; 同理,考察PQQ浓度和脱毒方式时,其它变量因子固定值参考如上. 脱毒3 d后,取样进行残留DON分析.
-
根据1.4.3节的方法制备SD9-2菌液,于4 ℃、
10000 r·min−1离心10 min,弃上清,细胞沉淀用25 mmol·L−1 Tris-HCl buffer(pH 8. 0)洗涤两次,重悬于同样的buffer中得到细胞悬液. 取部分细胞悬液采用超声破碎5 min(150 W,开5 s,关5 s),裂解液在4 ℃、10000 r·min−1条件下离心10 min,得到的上清经过0. 22 μm无菌滤膜过滤即为细胞裂解上清液. 参考Jia等的方法[12],将未处理、热处理30 min和SDS处理6 h的细胞悬液和细胞裂解上清液分别与由50 μg·mL−1 DON、100 μmol·L−1 CaCl2、40 μmol·L−1 PMS和10 μmol·L−1 PQQ组成的降解体系在30 ℃条件下反应2.5 h,同时与不加PMS的降解体系在同样的条件下进行反应,以同样处理的25 mmol·L−1 Tris-HCl buffer(pH 8.0)进行脱毒的组别作为阴性对照. -
所有的样品重复进行3次,每个样品在反应结束时取样处理,用上述液相方法测得样品的毒素峰面积,按以下公式计算DON的降解率(DRDON).
式中,DRDON为DON降解率;Sn为反应结束时DON峰面积(mAU);S0表示初始DON峰面积(mAU).
-
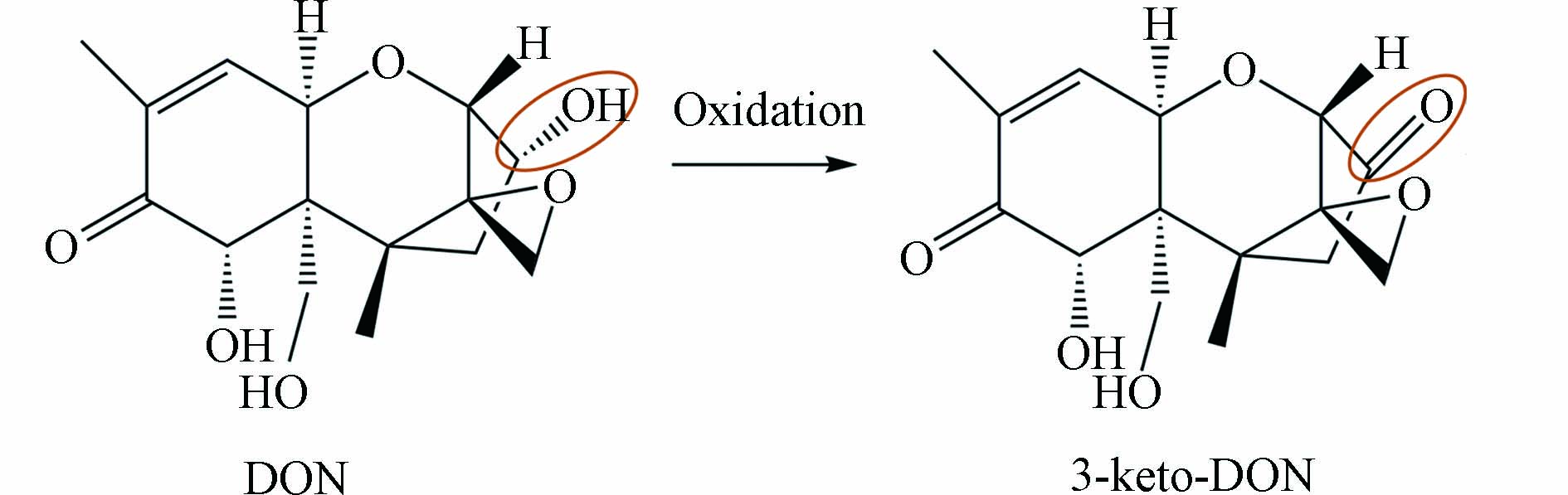
根据现有报道,一些德沃斯氏菌属的DON降解菌在添加外源PQQ时才会表现出DON降解活性[13 − 15]. 为了提高DON降解菌筛选的成功率,在富集培养和纯培养过程中都添加10 μmol·L−1的PQQ. 在PQQ的存在下,从来自山东的黄粉虫排泄物中分离得到1株能够高效降解DON的单菌株SD9-2. 该菌在30 ℃,pH 7.0的条件下,72 h内对50 μg·mL−1的DON降解率高达100%. 将实验组与对照组的色谱峰进行比较,于保留时间10.7 min处得到1个峰,该峰的峰面积与DON的峰面积呈此消彼长的关系,疑似为SD9-2降解DON得到的产物(图1). 通过与3-keto-DON标准品的峰进行比较,判断该产物为3-keto-DON,DON向3-keto-DON转化的示意图如图2所示.
在目的单菌落筛选过程中,发现SD9-2单菌落在MMFS液体中培养初始和培养5 d的OD600相当,认为SD9-2单菌落在MMFS液体中不生长,但仍然表现出良好的DON降解活性,这得益于较高的初始菌体接种浓度(OD600=0.18,相当于5.42×105 cfu·mL−1)和PQQ的加入. 另外,在降解菌筛选过程中,MMFS液体被用作目的菌株的富集培养基,然而分离出的SD9-2单菌落无法在其中生长,SD9-2如何通过富集培养的方式被筛选出来?可能由于黄粉虫粪便的MMFS富集混合培养物中未知种类微生物的存在促进了目的菌株的生长与繁殖,为后续目的纯培养物的筛选提供了足够的菌体数量.
目前,大部分的DON降解菌株分离自土壤、海洋或受镰刀菌感染的植物[16 − 18],主要原因是土壤和海洋的生物多样性比较复杂,受镰刀菌感染的植物易被DON长期诱导,以这些样品作为分离来源大大提高了从中分离DON降解菌株的可能性. 但本研究以黄粉虫的排泄物作为分离来源,用富集培养的方式从来自于山东的黄粉虫排泄物中分离出一株能够高效降解DON的菌株SD9-2,证实了昆虫的排泄物可作为真菌毒素降解菌株的优质分离来源.
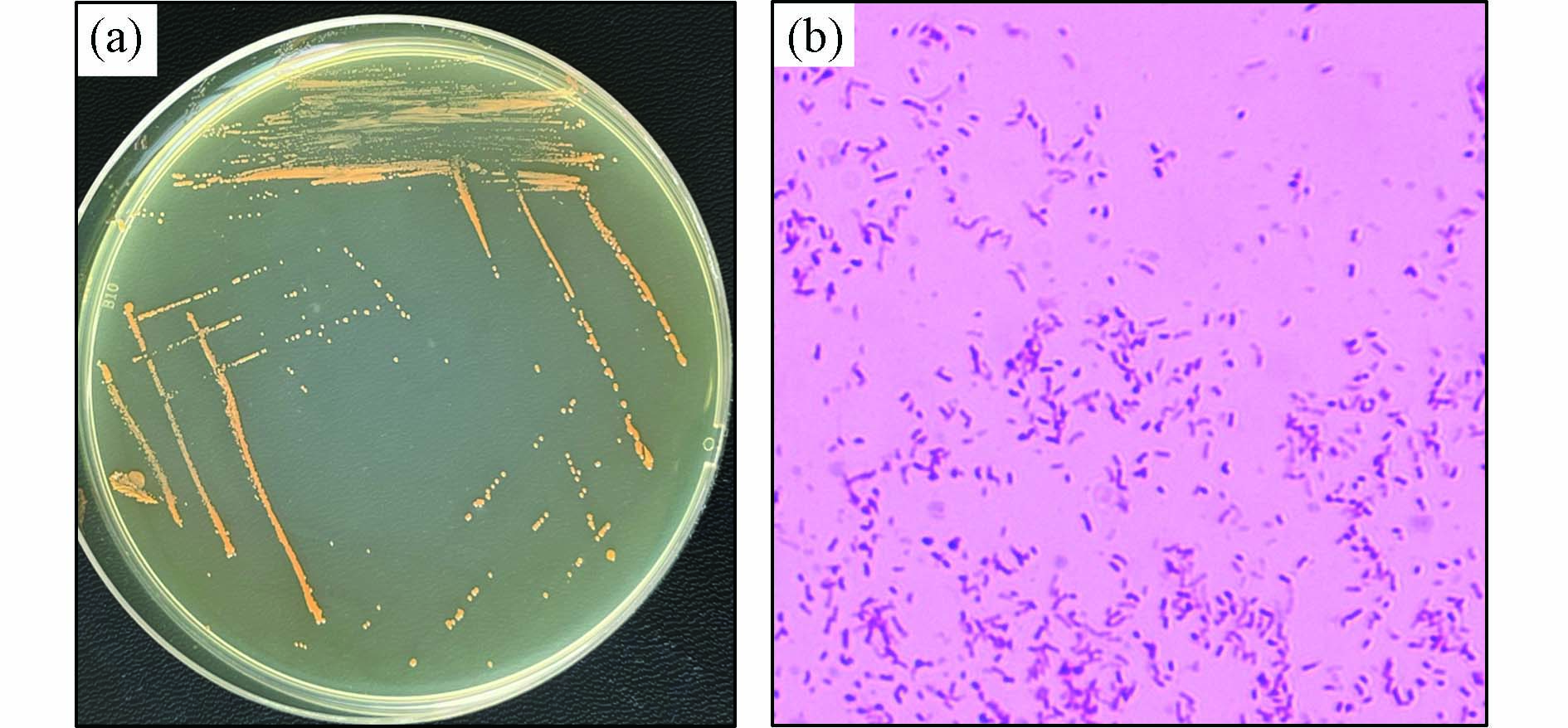
从图3(a)可以看出,SD9-2的单菌落为圆形,直径0.5—2 mm,呈凸起状,橙红色,菌落表面湿润有光泽,无褶皱,边缘整齐. 菌株经过革兰氏染色后用显微镜观察,如图3(b)所示,SD9-2是革兰氏阴性菌,呈椭圆形,短杆状. 德沃斯氏菌属菌株均为革兰氏阴性菌,SD9-2的菌落形态和显微形态符合德沃斯氏菌属菌株的形态特征,颜色与Devosia submarina KMM
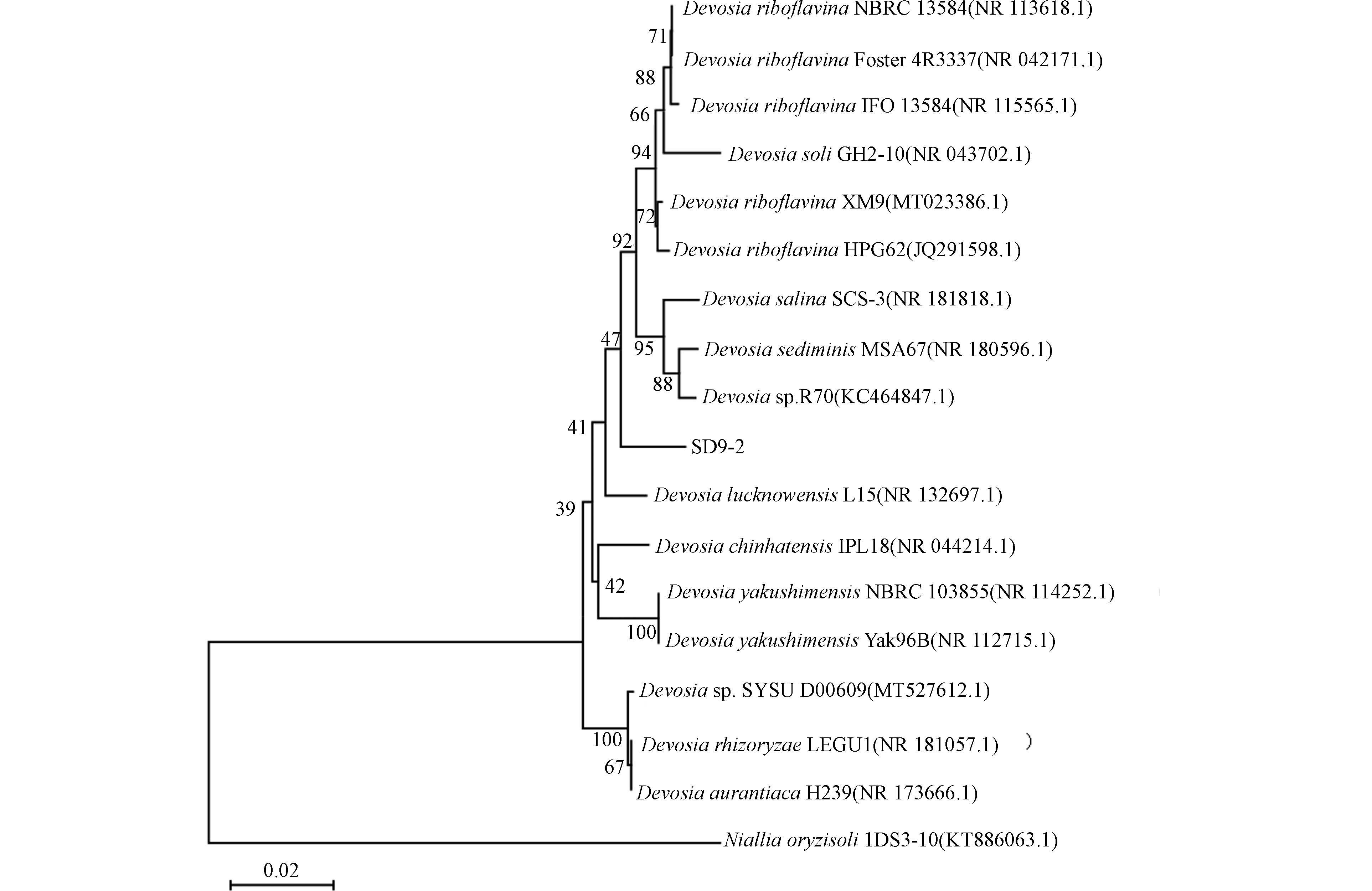
9415 T和Devosia submarina KMM9416 相似[19],菌落的其他特点和微观形态与Devosia elaeis S37T[20],Devosia insulae DS-56T[21]和Devosia limi LMG22951 T[22]等相似. 对SD9-2进行16S rDNA序列鉴定,将测序反馈的基因序列在NCBI标准数据库(https://www.ncbi.nlm.nih.gov/)进行序列比对分析可知,SD9-2菌株与德沃斯氏菌属同属一大分支,其16S rDNA与德沃斯氏菌株LEGU1(NCBI登录号:MN955414.1)有98.14%的序列相似性. 根据构建的系统发育树(图4)确定SD9-2属于Devosia sp.(德沃斯氏菌属).Devosia sp.是DON生物降解的常见重要菌属,目前关于德沃斯氏菌的DON降解机制研究已较为深入和透彻. 德沃斯氏菌对DON的转化主要涉及PQQ依赖性醇脱氢酶(PQQ-dependent alchol dehydrogenase)和NADPH依赖性还原酶(NADPH-dependent reductase),它们分别具有将DON氧化为3-keto-DON和将3-keto-DON立体选择性还原为3-epi-DON的功能[23 − 24]. 从Devosia mutans 17-2-E-8中鉴定表征的DepA酶是第一个能够将DON转化为3-keto-DON的酶[23],该酶在35 ℃,pH 6.0时的降解活性最高[25]. 根据SD9-2的降解产物为3-keto-DON,初步判断该菌的DON降解酶为PQQ依赖性的醇脱氢酶. 据报道,具有DON降解作用的Devosia菌根据其DON降解作用是否为辅助菌依赖型分为两类,其一,Devosia菌自身缺乏完整的或根本不存在PQQ生物合成基因簇,无法合成醇脱氢酶所必须辅因子PQQ,需其它产PQQ的辅助菌株提供PQQ以满足其DON氧化功能,Devosia A6-243和Pseudomonas B6-24即是这样的组合[14];其二,Devosia菌自身具有完整的PQQ生物合成基因簇,执行DON氧化生成3-keto-DON功能的醇脱氢酶所需辅因子为自身合成,如已报道的Devosia mutans 17-2-E-8[26]. 在本研究中,为了增加DON降解微生物成功筛选几率,在富集培养过程中加入微量的PQQ,避免遗漏以PQQ作为辅因子的脱毒菌.
-
在添加50 μg·mL−1 DON的MMFS培养基中,考察了不同温度(18 ℃、30 ℃、37 ℃)、pH (5.0、6.0、7.0、8.0、9.0)和PQQ浓度(0、0.01、0.1、1、10 μmol·L−1)对SD9-2静息细胞降解DON效率的影响. 如图5所示,Devosia sp. SD9-2降解DON的最佳温度为30 ℃,在37 ℃时,SD9-2降解DON的能力大大减弱. pH值对DON降解的影响很大,pH值为5.0或6.0时,SD9-2对DON几乎无降解作用,pH值为7.0—9.0时,DON几乎完全降解. 参考Gao[14]等的文献在降解体系中添加不同浓度的PQQ,图5(c)显示,PQQ的添加对DON的降解率有促进作用,不同浓度PQQ的实验组间的DON降解率没有显著差异. 好氧厌氧环境对于微生物的代谢具有重要影响,SD9-2以好氧、厌氧以及静置等3种不同的方式对DON进行降解. DON的降解情况如图5(d)所示,在好氧和静置条件下,DON完全降解,而在厌氧条件下,DON的降解率只有23%. 综上,Devosia sp. SD9-2的静息细胞在好氧或者静置,30 ℃、pH 7.0—9.0、PQQ浓度为0. 01—10 μmol·L−1的条件下具有良好的DON降解能力.
DON降解菌Devosia sp. A6-243在16—37 ℃几乎完全降解DON[27],在PQQ浓度为2—30 μmol·L−1时,DON降解率均高于60%[14];Bacillus subtilis ASAG216的降解活性物质在35—45 ℃显示出最佳降解率[12];Lactobacillus rhamnosus SHA113在37 ℃、pH 6.0的条件下孵育48 h,DON降解率高达60%[28]. Devosia insulae A16在35 ℃、中性pH、好氧条件下,DON的降解率最高[16]. 由此可见,不同的DON降解菌的最适脱毒条件并不一致,因此对分离得到的DON降解菌进行脱毒性质的表征是十分必要的,为该菌株在工业脱毒方面的应用提供参考.
-
为了初步探究Devosia sp. SD9-2对DON的降解是否为酶的作用,将未处理、热灭活处理以及SDS处理的菌悬液和细胞裂解上清液分别与DON孵育2.5 h,随后检测DON的降解率. 由图6(a)可知,在添加PMS时,未经处理的菌悬液和细胞裂解上清液可以在2.5 h内将DON完全降解. 图6(b)显示在未添加PMS时,细胞裂解上清液失去毒素降解活性. 根据2.1节中的结论,SD9-2的DON降解产物为3-keto-DON. DON向3-keto-DON的转化是一个氧化还原反应,菌悬液中存在完整的细胞,细胞自身携带电子传递链的受体,使反应顺利进行. 而细胞裂解上清液中因没有完整的电子传递链,也无PMS作为外源电子受体添加,导致降解反应缓慢甚至不反应.
经热灭活处理和SDS处理后,DON降解活性完全丧失. 在许多情况下,微生物对DON的降解主要依赖于酶,热处理和SDS处理导致蛋白质变性和聚集,改变蛋白质的空间结构,使酶活性丧失. 与本研究结果类似,DON降解菌Bacillus subtilis ASAG216的降解活性物质经加热和SDS处理后,DON的降解率显著降低[12],Qu等也证明了来自母乳的DON降解菌Lactobacillus rhamnosus SHA113的热灭活细胞对DON的去除率均低于5%[28]. 根据已有研究报道,德沃斯氏菌将DON氧化为3-keto-DON是一个酶促反应的过程,PQQ作为辅酶因子能够促进DON的降解[13,15]. 综上,SD9-2对DON的降解主要是由于酶的作用.
-
1) 从山东黄粉虫的排泄物样本中分离出一株DON高效降解菌株SD9-2,该菌株在72 h内可将浓度为50 μg·mL−1的DON完全降解,通过形态和分子生物学鉴定该菌为德沃斯氏属(Devosia sp.).
2) 对该菌株的降解特性进行了研究,其静息细胞在好氧或者静置,30 ℃、pH 7.0—9.0、PQQ浓度为0. 01—10 μmol·L−1的条件下具有良好的DON降解能力.
3) 用未处理、热灭活处理以及SDS处理的SD9-2的细胞悬液和细胞裂解上清液对DON进行降解,结果表明SD9-2对DON的降解主要是酶的作用.
一株呕吐毒素高效降解菌的筛选鉴定和降解特性表征
Isolation and degradation characteristics of a highly efficient deoxynivalenol-degrading strain
-
摘要: 脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)是一种广泛存在于自然界中的生物毒素污染物. 本文利用富集培养的方法和微生物纯化分离技术,通过添加辅助因子吡咯喹啉醌(pyrroloquinoline quinone disodium salt,PQQ),从黄粉虫(Tenebrio molitor)幼虫的排泄物中分离得到1株可高效降解DON的菌株. 该菌在30 ℃,pH 7.0的条件下,72 h内对浓度为50 μg·mL−1的DON降解率高达100%,降解产物为3-keto-DON. 通过形态学鉴定和基于16S rDNA序列构建的系统发育树分析,该菌的分类地位归属为德沃斯氏菌属(Devosia sp.). 对该菌在不同温度、pH、PQQ浓度和不同脱毒方式下进行降解性质表征,发现该菌静息细胞在好氧或者静置, 30 ℃、pH 7.0—9.0、PQQ浓度为0.01—10 μmol·L−1的条件下具有良好的DON降解能力. 为了确定该菌降解的活性物质,取未处理、加热处理和SDS处理的菌悬液和菌体细胞裂解上清液分别对DON进行降解,结果显示该菌利用自身产生的酶对DON进行降解.Abstract: Deoxynivalenol (DON) is a biotoxic pollutant prevalent throughout nature. In the present study, a DON-degrading bacterial strain SD9-2 was isolated from the excreta of Tenebrio molitor larvae with the addition of the cofactor Pyrroloquinoline Quinone Disodium(PQQ) by enrichment culture method and microbial purification isolation technique. The strain SD9-2 could efficiently remove DON(50 μg·mL−1) at a degradation rate of 100% within 72 h at 30 ℃. The strain was designated a member of the genus Devosia sp. by morphological identification and phylogenetic tree construction based on 16S rDNA sequences analysis. The bio-degradation product of DON was proved to be 3-keto-DON. The DON-degradation abilities of SD9-2 were characterized at different temperatures, pH, PQQ concentrations and detoxification methods. The optimized bio-degration conditions of the strain were at 30 ℃ and pH 7.0—9.0, with 0.01—10 μmol·L−1 PQQ under aerobic and static conditions. In addition, the cell suspension and cell lysate supernatant could completely degrade DON, and the degradation activity disappeared after heat treatment and sodium dodecyl sulfate(SDS) treatment. The results indicated that biocatalysis of the enzyme was responsible for the conversion from DON to 3-keto-DON.
-
Key words:
- Tenebrio molitor /
- deoxynivalenol /
- biodegration /
- Devosia sp.
-
真菌毒素是由真菌感染产生的一组有毒次生代谢产物,其对人和动物摄入时会产生严重的中毒反应. 因真菌毒素主要污染粮油食品及其制品,而使得其营养价值和商业价值大幅度降低,已成为食品中最为关注的污染物之一. 脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON,又称呕吐毒素)是一种与小麦赤霉病和玉米穗腐病有关的真菌毒素,其化学性质稳定,加工过程难以去除,是谷物相关食品和饲料中的主要检测对象[1]. 同时DON的阳性检出率很高,Yan等[2]发现,在检测的579个小麦样品中均检出DON,而606个玉米样品中99.8%的DON检测结果为阳性.
黄粉虫作为一种富含营养、高效和可持续开发的动物源性蛋白质和能量来源,在饲料和食品加工中受到了广泛的关注. 黄粉虫的饲喂多采用麦麸、玉米屑等易受脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮(zearalenone,ZEN)等真菌毒素污染的谷物,然而,国内外相关研究表明黄粉虫幼虫对DON和ZEN均具有较高的耐受性. 喂食DON浓度为4.9—8.83 mg·kg−1的饲料时,黄粉虫幼虫的增重和存活率等生长性能不受明显影响[3 − 4],黄粉虫幼虫对干饲料中AFB1的耐受性高达0.415 mg·kg−1[5]. 究其原因,其一,黄粉虫体内可能存在一套毒素排泄机制;其二,黄粉虫自身或者其肠道微生物区系具有真菌毒素代谢能力;从而避免或者减轻了真菌毒素对其的毒害作用. 有研究证明玉米赤霉烯酮在黄粉虫体内可以代谢成其α-和β-异构体[6],Van Broekhoven等[4]也发现部分DON(14%—40%)及其降解产物3-乙酰基脱氧雪腐镰刀菌烯醇(3-Ac-DON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-Ac-DON)被排出黄粉虫体外. 同时也有研究表明,黄粉虫幼虫通过中肠中的酶和肠道细菌产生的酶可将DON乙酰化,蜜蜂(Apis mellifera)和玉米耳虫(Helicoverpa zea)通过自身产生的NADPH依赖性还原酶和羟化酶可将黄曲霉毒素羟基化[7]. 此外,细胞色素P450酶、磺基转移酶和糖基转移酶等酶可能也参与了昆虫体内真菌毒素的代谢[6]. 昆虫肠道菌群丰富,主要以易被真菌毒素侵染的食物残渣为食,其肠道内极易存在真菌毒素耐受性微生物,同时大量报道表明黄粉虫的肠道微生物能够降解塑料及其制品[8 − 11]. 综上,黄粉虫可能是真菌毒素降解的良好媒介,在解决真菌毒素污染方面具有极大的潜力,而从黄粉虫体内或者其排泄物中成功分离真菌毒素降解菌株则鲜见报道.
本研究从黄粉虫幼虫的排泄物中筛选得到了一株高效降解DON的Devosia sp. SD9-2,并进一步研究了该菌株的降解最适条件,确定了该菌对DON的降解是由于微生物酶的作用. 本研究为真菌毒素降解菌提供了新的高效的分离来源,丰富了具有生物转化DON能力的微生物资源库,为探索黄粉虫真菌毒素耐受的机理提供了有利的参考,并为开发去除谷物和饲料中DON的微生物制剂奠定基础.
1. 材料与方法(Materials and methods)
1.1 材料来源
黄粉虫幼虫和饲料分别购买自福建省宁德市和山东省德州市. 以麦麸为唯一食物,在温度(25±1) ℃;湿度60%的条件下饲养. 培养容器中麦麸被完全消耗时,用无菌30目孔筛筛除容器底部残留物中的杂质,收集黄粉虫的排泄物.
1.2 培养基
MMFS培养基:Na2HPO4·12H2O 4.03 g,KH2PO4 1 g,NaNO3 0.5 g,(NH4)2SO4 0.5 g,Mg2SO4·7H2O 0.5 g,CaCl2·2H2O 0.025 g. 蒸馏水定容到1 L,pH为7.0,灭菌后加入200 μL微量元素溶液和10%(V/V)无菌粪便上清液.
TSB培养基(g·L−1):胰蛋白胨17.0 g,植物蛋白胨3.0 g,NaCl 5.0 g,K2HPO4 2.5 g,葡萄糖 2.5 g.
培养基灭菌条件为121 ℃高压灭菌15 min. 制备固体培养基的琼脂粉添加比例为1.5%(M/V).
1.3 主要试剂和仪器
DON标准品纯度为98%,购自青岛普瑞邦生物工程有限公司,用水配制成浓度为10 g·L−1的标准溶液. 3-酮基-DON(3-keto-deoxynivalenol,3-keto-DON)标准品纯度为98%,购自加拿大TripleBond公司. 细菌基因组DNA试剂盒、吩嗪硫酸甲酯(phenazine methosulfate, PMS)和用于PCR的2×HIFI Amplification Mix(dye+)购于生工生物工程(上海)股份有限公司;革兰氏染色溶液和纯度为99%的吡咯喹啉醌(pyrroloquinoline quinone disodium salt,PQQ),购自上海源叶生物科技有限公司(中国). 厌氧培养系统(包括厌氧培养袋、厌氧产气包和氧气指示剂)购自青岛海博生物技术有限公司,根据其产品手册使用以进行厌氧培养.
超高效液相色谱仪(美国赛默飞世尔科技公司,UltiMate3000). 检测条件:色谱柱ACQUITY UPLC® BEH C18柱 (2.1 mm×100 mm, 1.7 μm);流动相A为纯水,流动相C为乙腈. 梯度洗脱条件:0—6 min,0.2 mL·min−1,5% C—25% C; 6—12 min,0.2 mL·min−1,25% C;12—13 min,0.2—0.4 mL·min−1,25% C—5% C;13—17 min,0.4 mL·min−1,5% C;17—18 min,0.4—0.2 mL·min−1,5% C. 进样量2 μL;检测波长220 nm;柱温箱40 ℃.
1.4 实验方法
1.4.1 DON降解菌的分离纯化
降解菌的筛选:将福建和山东的黄粉虫排泄物分别命名为FJ和SD. 分别称取排泄物各3 g于50 mL无菌离心管中,加入45 mL磷酸缓冲液,220 r·min−1振荡,泡涨溶解30 min,静置20 min. 分别吸取500 μL中部上清液接种至添加50 μg·mL−1 DON的4.5 mL MM中,于恒温振荡器220 r·min−1,30 ℃培养3—5 d. 吸取200 μL待测菌液加入等体积甲醇,涡旋振动混匀后,以
14000 r·min−1离心10 min,吸取上清液,用0.22 μm有机滤膜过滤,用超高效液相色谱仪检测. 选择具有DON降解活力的混合培养物,吸取20 μL接种到2 mL添加DON(50 μg·mL−1)和PQQ(10 μmol·L−1)的MMFS中,于恒温振荡器220 r·min−1,30 ℃培养3—5 d. 连续进行4次转接培养,以获得具有稳定降解活性的混合培养物.降解菌的分离纯化:吸取第4次仍保留DON降解活性的菌液100 μL在无菌蒸馏水中梯度稀释(10−1—10−7),每个梯度的稀释液取100 μL均匀涂布在TSA固体培养基,30 ℃培养7 d,挑取整个单个菌落,在含有PQQ(10 μmol·L−1)和DON(50 μg·mL−1)的MMFS(终体积为200 μL)中脱毒3 d,检测其降解DON的能力,在TSA固体培养基上划线3次,获得纯培养物. 从TSA平板刮取菌体,置于25%(V/V)的甘油中,振荡混匀后于−80 ℃保存.
1.4.2 DON降解菌的鉴定
形态鉴定:将获得的菌株在TSA培养基上划线,30 ℃培养3—6 d获得单菌落,观察其大小、形状、颜色、边缘和表面的形态等. 对菌株进行革兰氏染色,于显微镜下观察其细胞的形态特征,并判定其革兰氏阴阳性.
分子鉴定:细菌基因组DNA的提取使用细菌基因组DNA试剂盒,按照制造商的说明进行. 用通用引物27F(5‘-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5‘-GTACCTTGTACGACT-3’)在Biometra GmbH PCR仪(Goettingen, 德国)上扩增出16S rDNA序列. 反应体系为:25 μL的2×HIFI Amplification Mix(dye+),上下游引物各1.5 μL,2 μL基因组模板,添加无菌蒸馏水至50 μL. PCR反应条件如下:94 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸45 s,35个循环后于68 ℃继续延伸4 min,扩增产物通过0.8%(W/V)的琼脂糖凝胶电泳进行检测后送至BIOMED(北京,中国)测序. 测序结果在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中进行BLAST搜索,选取序列相似性较高的菌株采用邻接法在MEGA 11.0构建系统发育树.
1.4.3 DON降解菌的降解特性表征
SD9-2虽然在TSA固体培养基上生长良好,但因未知原因和菌株的独特性,它在TSB(与TSA固体培养基成分相同但不添加琼脂粉)、R2A、MMFS等各种液体培养基中振荡、静置和厌氧培养均未见明显生长现象(初始OD600为0.18,培养3 d的OD600为0.17、0.18、0.17),对其DON的降解特性表征的研究方法只能从对液体条件下的菌体生长-毒素降解的动态偶联考察,变为采用收集固态平板上新鲜菌体并考察静息细胞的降解特性,相关方法如下:采用TSA固体培养基对SD9-2进行培养,从平板上刮取菌体,用无菌25 mmol·L−1 Tris-HCl buffer(pH 8.0)将菌体制成菌液,OD600=1.05(相当于3.25×106 cfu·mL−1). 将SD9-2菌液按1%(V:V)添加至含50 μg·mL−1DON的MMFS中,分别用不同培养温度(18 ℃、30 ℃、37 ℃),培养基pH(5.0、6.0、7.0、8.0、9.0),不同浓度的PQQ(0、0.01、0.1、1、10 μmol·L−1)和不同的脱毒方式(好氧、厌氧和静置)对SD9-2静息细胞进行降解特性的研究. 考察不同温度对DON降解活性的影响时,则其它变量因子固定为pH=7.0、10 μmol·L−1 PQQ和220 r·min−1 振荡;考察不同pH对DON降解活性的影响时,则其它变量因子固定为30 ℃,10 μmol·L−1 PQQ和220 r·min−1 振荡; 同理,考察PQQ浓度和脱毒方式时,其它变量因子固定值参考如上. 脱毒3 d后,取样进行残留DON分析.
1.4.4 降解活性物质的分析
根据1.4.3节的方法制备SD9-2菌液,于4 ℃、
10000 r·min−1离心10 min,弃上清,细胞沉淀用25 mmol·L−1 Tris-HCl buffer(pH 8. 0)洗涤两次,重悬于同样的buffer中得到细胞悬液. 取部分细胞悬液采用超声破碎5 min(150 W,开5 s,关5 s),裂解液在4 ℃、10000 r·min−1条件下离心10 min,得到的上清经过0. 22 μm无菌滤膜过滤即为细胞裂解上清液. 参考Jia等的方法[12],将未处理、热处理30 min和SDS处理6 h的细胞悬液和细胞裂解上清液分别与由50 μg·mL−1 DON、100 μmol·L−1 CaCl2、40 μmol·L−1 PMS和10 μmol·L−1 PQQ组成的降解体系在30 ℃条件下反应2.5 h,同时与不加PMS的降解体系在同样的条件下进行反应,以同样处理的25 mmol·L−1 Tris-HCl buffer(pH 8.0)进行脱毒的组别作为阴性对照.1.4.5 DON降解率的计算
所有的样品重复进行3次,每个样品在反应结束时取样处理,用上述液相方法测得样品的毒素峰面积,按以下公式计算DON的降解率(DRDON).
stringUtils.convertMath(!{formula.content}) 式中,DRDON为DON降解率;Sn为反应结束时DON峰面积(mAU);S0表示初始DON峰面积(mAU).
2. 结果与讨论 (Results and discussion)
2.1 DON降解菌的筛选及鉴定
根据现有报道,一些德沃斯氏菌属的DON降解菌在添加外源PQQ时才会表现出DON降解活性[13 − 15]. 为了提高DON降解菌筛选的成功率,在富集培养和纯培养过程中都添加10 μmol·L−1的PQQ. 在PQQ的存在下,从来自山东的黄粉虫排泄物中分离得到1株能够高效降解DON的单菌株SD9-2. 该菌在30 ℃,pH 7.0的条件下,72 h内对50 μg·mL−1的DON降解率高达100%. 将实验组与对照组的色谱峰进行比较,于保留时间10.7 min处得到1个峰,该峰的峰面积与DON的峰面积呈此消彼长的关系,疑似为SD9-2降解DON得到的产物(图1). 通过与3-keto-DON标准品的峰进行比较,判断该产物为3-keto-DON,DON向3-keto-DON转化的示意图如图2所示.
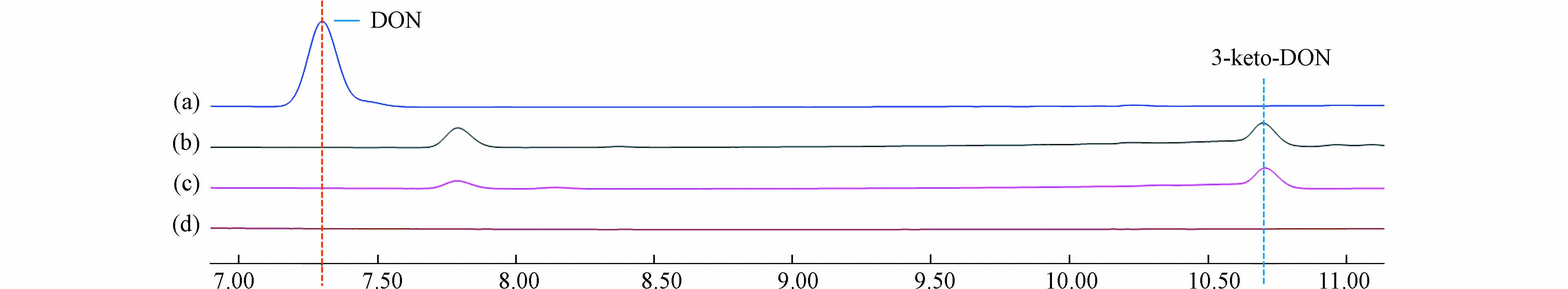 图 1 SD9-2降解DON的液相色谱图Figure 1. Ultra-high performance liquid chromatogram of DON degradation by SD9-2(a) 反应前DON含量,初始浓度为50 μg·mL−1;(b) 反应后DON和降解产物的含量;(c) 3-keto-DON标准品,浓度为50 μg·mL−1;(d)空白(a) DON content before reaction at an initial concentration of 50 μg·mL−1; (b) DON and product content after reaction; (c) 3-keto-DON standard at 50 μg·mL-1; (d) Blank as control
图 1 SD9-2降解DON的液相色谱图Figure 1. Ultra-high performance liquid chromatogram of DON degradation by SD9-2(a) 反应前DON含量,初始浓度为50 μg·mL−1;(b) 反应后DON和降解产物的含量;(c) 3-keto-DON标准品,浓度为50 μg·mL−1;(d)空白(a) DON content before reaction at an initial concentration of 50 μg·mL−1; (b) DON and product content after reaction; (c) 3-keto-DON standard at 50 μg·mL-1; (d) Blank as control在目的单菌落筛选过程中,发现SD9-2单菌落在MMFS液体中培养初始和培养5 d的OD600相当,认为SD9-2单菌落在MMFS液体中不生长,但仍然表现出良好的DON降解活性,这得益于较高的初始菌体接种浓度(OD600=0.18,相当于5.42×105 cfu·mL−1)和PQQ的加入. 另外,在降解菌筛选过程中,MMFS液体被用作目的菌株的富集培养基,然而分离出的SD9-2单菌落无法在其中生长,SD9-2如何通过富集培养的方式被筛选出来?可能由于黄粉虫粪便的MMFS富集混合培养物中未知种类微生物的存在促进了目的菌株的生长与繁殖,为后续目的纯培养物的筛选提供了足够的菌体数量.
目前,大部分的DON降解菌株分离自土壤、海洋或受镰刀菌感染的植物[16 − 18],主要原因是土壤和海洋的生物多样性比较复杂,受镰刀菌感染的植物易被DON长期诱导,以这些样品作为分离来源大大提高了从中分离DON降解菌株的可能性. 但本研究以黄粉虫的排泄物作为分离来源,用富集培养的方式从来自于山东的黄粉虫排泄物中分离出一株能够高效降解DON的菌株SD9-2,证实了昆虫的排泄物可作为真菌毒素降解菌株的优质分离来源.
从图3(a)可以看出,SD9-2的单菌落为圆形,直径0.5—2 mm,呈凸起状,橙红色,菌落表面湿润有光泽,无褶皱,边缘整齐. 菌株经过革兰氏染色后用显微镜观察,如图3(b)所示,SD9-2是革兰氏阴性菌,呈椭圆形,短杆状. 德沃斯氏菌属菌株均为革兰氏阴性菌,SD9-2的菌落形态和显微形态符合德沃斯氏菌属菌株的形态特征,颜色与Devosia submarina KMM
9415 T和Devosia submarina KMM9416 相似[19],菌落的其他特点和微观形态与Devosia elaeis S37T[20],Devosia insulae DS-56T[21]和Devosia limi LMG22951 T[22]等相似. 对SD9-2进行16S rDNA序列鉴定,将测序反馈的基因序列在NCBI标准数据库(https://www.ncbi.nlm.nih.gov/)进行序列比对分析可知,SD9-2菌株与德沃斯氏菌属同属一大分支,其16S rDNA与德沃斯氏菌株LEGU1(NCBI登录号:MN955414.1)有98.14%的序列相似性. 根据构建的系统发育树(图4)确定SD9-2属于Devosia sp.(德沃斯氏菌属).Devosia sp.是DON生物降解的常见重要菌属,目前关于德沃斯氏菌的DON降解机制研究已较为深入和透彻. 德沃斯氏菌对DON的转化主要涉及PQQ依赖性醇脱氢酶(PQQ-dependent alchol dehydrogenase)和NADPH依赖性还原酶(NADPH-dependent reductase),它们分别具有将DON氧化为3-keto-DON和将3-keto-DON立体选择性还原为3-epi-DON的功能[23 − 24]. 从Devosia mutans 17-2-E-8中鉴定表征的DepA酶是第一个能够将DON转化为3-keto-DON的酶[23],该酶在35 ℃,pH 6.0时的降解活性最高[25]. 根据SD9-2的降解产物为3-keto-DON,初步判断该菌的DON降解酶为PQQ依赖性的醇脱氢酶. 据报道,具有DON降解作用的Devosia菌根据其DON降解作用是否为辅助菌依赖型分为两类,其一,Devosia菌自身缺乏完整的或根本不存在PQQ生物合成基因簇,无法合成醇脱氢酶所必须辅因子PQQ,需其它产PQQ的辅助菌株提供PQQ以满足其DON氧化功能,Devosia A6-243和Pseudomonas B6-24即是这样的组合[14];其二,Devosia菌自身具有完整的PQQ生物合成基因簇,执行DON氧化生成3-keto-DON功能的醇脱氢酶所需辅因子为自身合成,如已报道的Devosia mutans 17-2-E-8[26]. 在本研究中,为了增加DON降解微生物成功筛选几率,在富集培养过程中加入微量的PQQ,避免遗漏以PQQ作为辅因子的脱毒菌.
2.2 SD9-2降解特性表征
在添加50 μg·mL−1 DON的MMFS培养基中,考察了不同温度(18 ℃、30 ℃、37 ℃)、pH (5.0、6.0、7.0、8.0、9.0)和PQQ浓度(0、0.01、0.1、1、10 μmol·L−1)对SD9-2静息细胞降解DON效率的影响. 如图5所示,Devosia sp. SD9-2降解DON的最佳温度为30 ℃,在37 ℃时,SD9-2降解DON的能力大大减弱. pH值对DON降解的影响很大,pH值为5.0或6.0时,SD9-2对DON几乎无降解作用,pH值为7.0—9.0时,DON几乎完全降解. 参考Gao[14]等的文献在降解体系中添加不同浓度的PQQ,图5(c)显示,PQQ的添加对DON的降解率有促进作用,不同浓度PQQ的实验组间的DON降解率没有显著差异. 好氧厌氧环境对于微生物的代谢具有重要影响,SD9-2以好氧、厌氧以及静置等3种不同的方式对DON进行降解. DON的降解情况如图5(d)所示,在好氧和静置条件下,DON完全降解,而在厌氧条件下,DON的降解率只有23%. 综上,Devosia sp. SD9-2的静息细胞在好氧或者静置,30 ℃、pH 7.0—9.0、PQQ浓度为0. 01—10 μmol·L−1的条件下具有良好的DON降解能力.
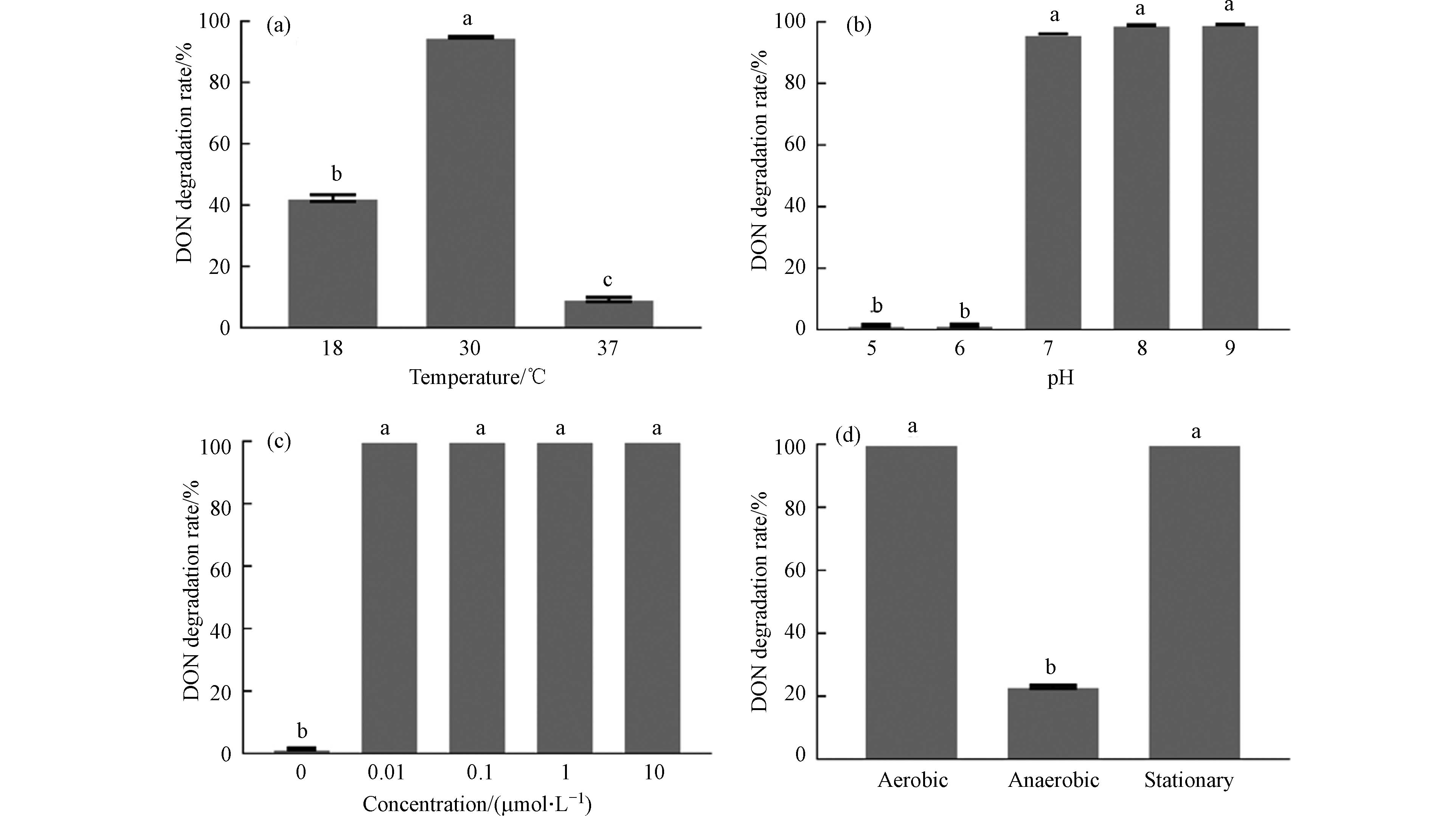 图 5 反应条件对SD9-2降解DON的影响Figure 5. The effects of reaction conditions on the degradation of DON by SD9-2(a) 温度对DON降解率的影响;(b)酸碱度对DON降解率的影响;(c) PQQ浓度对DON降解率的影响;(d) 脱毒方式对DON降解率的影响. 降解率是3次重复的平均值,误差棒表示均值标准误差,字母表示显著性差异(P<0.05).(a) the effect of temperature on the degradation rate of DON; (b) the effect of pH on the degradation rate of DON; (c) the effect of PQQ concentration on the degradation rate of DON; (d) the effect of detoxification methods on the degradation rate of DON. Degradation rate is the mean of three replicates and the error bars indicate the standard error of mean. Different letters indicate significant differences (P < 0.05)
图 5 反应条件对SD9-2降解DON的影响Figure 5. The effects of reaction conditions on the degradation of DON by SD9-2(a) 温度对DON降解率的影响;(b)酸碱度对DON降解率的影响;(c) PQQ浓度对DON降解率的影响;(d) 脱毒方式对DON降解率的影响. 降解率是3次重复的平均值,误差棒表示均值标准误差,字母表示显著性差异(P<0.05).(a) the effect of temperature on the degradation rate of DON; (b) the effect of pH on the degradation rate of DON; (c) the effect of PQQ concentration on the degradation rate of DON; (d) the effect of detoxification methods on the degradation rate of DON. Degradation rate is the mean of three replicates and the error bars indicate the standard error of mean. Different letters indicate significant differences (P < 0.05)DON降解菌Devosia sp. A6-243在16—37 ℃几乎完全降解DON[27],在PQQ浓度为2—30 μmol·L−1时,DON降解率均高于60%[14];Bacillus subtilis ASAG216的降解活性物质在35—45 ℃显示出最佳降解率[12];Lactobacillus rhamnosus SHA113在37 ℃、pH 6.0的条件下孵育48 h,DON降解率高达60%[28]. Devosia insulae A16在35 ℃、中性pH、好氧条件下,DON的降解率最高[16]. 由此可见,不同的DON降解菌的最适脱毒条件并不一致,因此对分离得到的DON降解菌进行脱毒性质的表征是十分必要的,为该菌株在工业脱毒方面的应用提供参考.
2.3 SD9-2降解活性的分析
为了初步探究Devosia sp. SD9-2对DON的降解是否为酶的作用,将未处理、热灭活处理以及SDS处理的菌悬液和细胞裂解上清液分别与DON孵育2.5 h,随后检测DON的降解率. 由图6(a)可知,在添加PMS时,未经处理的菌悬液和细胞裂解上清液可以在2.5 h内将DON完全降解. 图6(b)显示在未添加PMS时,细胞裂解上清液失去毒素降解活性. 根据2.1节中的结论,SD9-2的DON降解产物为3-keto-DON. DON向3-keto-DON的转化是一个氧化还原反应,菌悬液中存在完整的细胞,细胞自身携带电子传递链的受体,使反应顺利进行. 而细胞裂解上清液中因没有完整的电子传递链,也无PMS作为外源电子受体添加,导致降解反应缓慢甚至不反应.
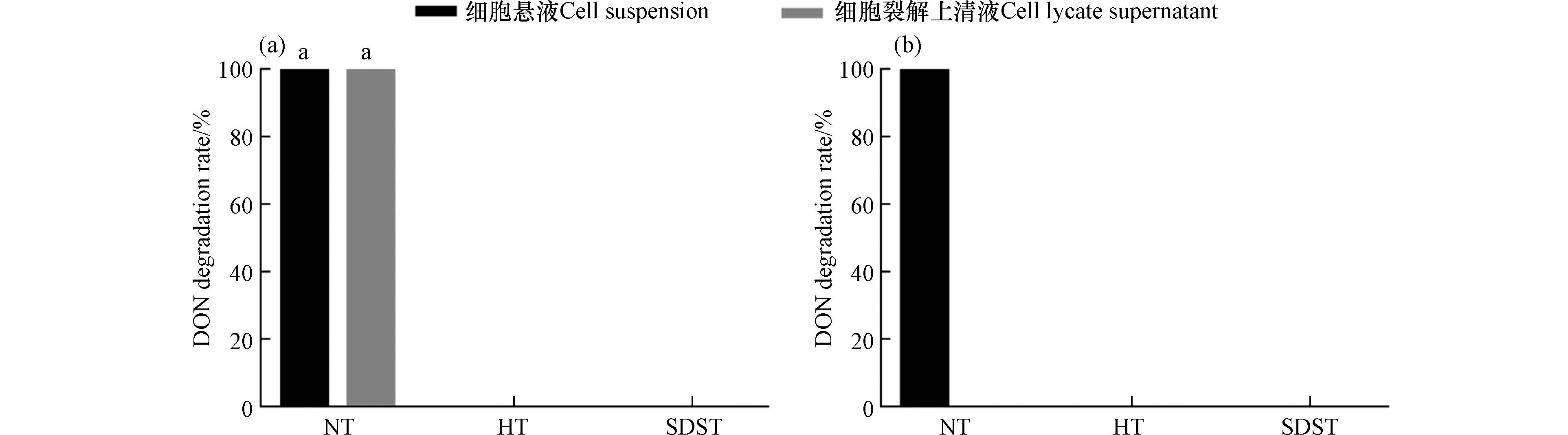 图 6 SD9-2的细胞悬液和细胞裂解上清液在对DON降解效果Figure 6. Effect of cell suspension and cell lysate supernatant of Devosia sp. SD9-2 on DON degradation rate(a) 降解体系添加PMS;(b) 降解体系未加PMS. NT表示未处理组,HT表示热处理组,SDST表示SDS处理组(a) PMS was added to the degradation system; (b) no PMS was added to the degradation system. NT indicates no treatment group, HT indicates heat treatment group and SDST indicates SDS treatment group
图 6 SD9-2的细胞悬液和细胞裂解上清液在对DON降解效果Figure 6. Effect of cell suspension and cell lysate supernatant of Devosia sp. SD9-2 on DON degradation rate(a) 降解体系添加PMS;(b) 降解体系未加PMS. NT表示未处理组,HT表示热处理组,SDST表示SDS处理组(a) PMS was added to the degradation system; (b) no PMS was added to the degradation system. NT indicates no treatment group, HT indicates heat treatment group and SDST indicates SDS treatment group经热灭活处理和SDS处理后,DON降解活性完全丧失. 在许多情况下,微生物对DON的降解主要依赖于酶,热处理和SDS处理导致蛋白质变性和聚集,改变蛋白质的空间结构,使酶活性丧失. 与本研究结果类似,DON降解菌Bacillus subtilis ASAG216的降解活性物质经加热和SDS处理后,DON的降解率显著降低[12],Qu等也证明了来自母乳的DON降解菌Lactobacillus rhamnosus SHA113的热灭活细胞对DON的去除率均低于5%[28]. 根据已有研究报道,德沃斯氏菌将DON氧化为3-keto-DON是一个酶促反应的过程,PQQ作为辅酶因子能够促进DON的降解[13,15]. 综上,SD9-2对DON的降解主要是由于酶的作用.
3. 结论(Conclusion)
1) 从山东黄粉虫的排泄物样本中分离出一株DON高效降解菌株SD9-2,该菌株在72 h内可将浓度为50 μg·mL−1的DON完全降解,通过形态和分子生物学鉴定该菌为德沃斯氏属(Devosia sp.).
2) 对该菌株的降解特性进行了研究,其静息细胞在好氧或者静置,30 ℃、pH 7.0—9.0、PQQ浓度为0. 01—10 μmol·L−1的条件下具有良好的DON降解能力.
3) 用未处理、热灭活处理以及SDS处理的SD9-2的细胞悬液和细胞裂解上清液对DON进行降解,结果表明SD9-2对DON的降解主要是酶的作用.
-
-
[1] MISHRA S, SRIVASTAVA S, DEWANGAN J, et al. Global occurrence of deoxynivalenol in food commodities and exposure risk assessment in humans in the last decade: A survey[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(8): 1346-1374. doi: 10.1080/10408398.2019.1571479 [2] YAN P P, LIU Z Z, LIU S Q, et al. Natural occurrence of deoxynivalenol and its acetylated derivatives in Chinese maize and wheat collected in 2017[J]. Toxins, 2020, 12(3): 200. doi: 10.3390/toxins12030200 [3] 秦菲, 汪洋, 赵祎, 等. 脱氧雪腐镰刀菌烯醇对黄粉虫毒性及其排泄行为[J]. 生态毒理学报, 2022, 17(2): 311-316. QIN F, WANG Y, ZHAO Y, et al. Toxicity and excretion of deoxynivalenol to Tenebrio molitor larvae[J]. Asian Journal of Ecotoxicology, 2022, 17(2): 311-316 (in Chinese).
[4] van BROEKHOVEN S, GUTIERREZ J M, de RIJK T C, et al. Degradation and excretion of the Fusarium toxin deoxynivalenol by an edible insect, the Yellow mealworm (Tenebrio molitor L. )[J]. World Mycotoxin Journal, 2017, 10(2): 163-169. doi: 10.3920/WMJ2016.2102 [5] BOSCH G, FELS-KLERX H J V, RIJK T C, et al. Aflatoxin B1 tolerance and accumulation in black soldier fly larvae (Hermetia illucens) and yellow mealworms (Tenebrio molitor)[J]. Toxins, 2017, 9(6): 185. doi: 10.3390/toxins9060185 [6] NIERMANS K, WOYZICHOVSKI J, KRÖNCKE N, et al. Feeding study for the mycotoxin Zearalenone in yellow mealworm (Tenebrio molitor) larvae—Investigation of biological impact and metabolic conversion[J]. Mycotoxin Research, 2019, 35(3): 231-242. doi: 10.1007/s12550-019-00346-y [7] EVANS N M, SHAO S Q. Mycotoxin metabolism by edible insects[J]. Toxins, 2022, 14(3): 217. doi: 10.3390/toxins14030217 [8] PENG B Y, CHEN Z B, CHEN J B, et al. Biodegradation of polyvinyl chloride (PVC) in Tenebrio Molitor (Coleoptera: Tenebrionidae) larvae[J]. Environment International, 2020, 145: 106106. doi: 10.1016/j.envint.2020.106106 [9] BULAK P, PROC K, PYTLAK A, et al. Biodegradation of different types of plastics by Tenebrio molitor insect[J]. Polymers, 2021, 13(20): 3508. doi: 10.3390/polym13203508 [10] YANG S S, DING M Q, HE L, et al. Biodegradation of polypropylene by yellow mealworms (Tenebrio molitor) and superworms (Zophobas atratus) via gut-microbe-dependent depolymerization[J]. Science of the Total Environment, 2021, 756: 144087. doi: 10.1016/j.scitotenv.2020.144087 [11] YANG S S, DING M Q, ZHANG Z R, et al. Confirmation of biodegradation of low-density polyethylene in dark- versus yellow- mealworms (larvae of Tenebrio obscurus versus Tenebrio molitor) via. gut microbe-independent depolymerization[J]. Science of the Total Environment, 2021, 789: 147915. [12] JIA R, CAO L R, LIU W B, et al. Detoxification of deoxynivalenol by Bacillus subtilis ASAG 216 and characterization the degradation process[J]. European Food Research and Technology, 2021, 247(1): 67-76. doi: 10.1007/s00217-020-03607-8 [13] QIN X J, ZHANG J, LIU Y R, et al. A quinoprotein dehydrogenase from Pelagibacterium halotolerans ANSP101 oxidizes deoxynivalenol to 3-keto-deoxynivalenol[J]. Food Control, 2022, 136: 108834. doi: 10.1016/j.foodcont.2022.108834 [14] GAO H, NIU J F, YANG H, et al. Epimerization of deoxynivalenol by the Devosia strain A6-243 assisted by pyrroloquinoline quinone[J]. Toxins, 2021, 14(1): 16. doi: 10.3390/toxins14010016 [15] HE W J, SHI M M, YANG P, et al. A quinone-dependent dehydrogenase and two NADPH-dependent aldo/keto reductases detoxify deoxynivalenol in wheat via epimerization in a Devosia strain[J]. Food Chemistry, 2020, 321: 126703. doi: 10.1016/j.foodchem.2020.126703 [16] WANG G, WANG Y X, JI F, et al. Biodegradation of deoxynivalenol and its derivatives by Devosia insulae A16[J]. Food Chemistry, 2019, 276: 436-442. doi: 10.1016/j.foodchem.2018.10.011 [17] HE W J, SHI M M, YANG P, et al. Novel soil bacterium strain Desulfitobacterium sp. PGC-3-9 detoxifies trichothecene mycotoxins in wheat via de-epoxidation under aerobic and anaerobic conditions[J]. Toxins, 2020, 12(6): 363. doi: 10.3390/toxins12060363 [18] WANG Y, ZHANG H H, ZHAO C, et al. Isolation and characterization of a novel deoxynivalenol‐transforming strain Paradevosia shaoguanensis DDB001 from wheat field soil[J]. Letters in Applied Microbiology, 2017, 65(5): 414-422. doi: 10.1111/lam.12790 [19] ROMANENKO L A, TANAKA N, SVETASHEV V I. Devosia submarina sp. nov. , isolated from deep-sea surface sediments[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(Pt 8): 3079-3085. [20] MOHD NOR M N, SABARATNAM V, TAN G Y A. Devosia elaeis sp. nov. , isolated from oil palm rhizospheric soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(4): 851-855. [21] YOON J H, KANG S J, PARK S, et al. Devosia insulae sp. nov. , isolated from soil, and emended description of the genus Devosia[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(Pt 6): 1310-1314. [22] VANPARYS B, HEYLEN K, LEBBE L, et al. Devosia limi sp. nov. , isolated from a nitrifying inoculum[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(Pt 5): 1997-2000. [23] CARERE J, HASSAN Y I, LEPP D, et al. The enzymatic detoxification of the mycotoxin deoxynivalenol: Identification of DepA from the DON epimerization pathway[J]. Microbial Biotechnology, 2018, 11(6): 1106-1111. doi: 10.1111/1751-7915.12874 [24] CARERE J, HASSAN Y I, LEPP D, et al. The identification of DepB: An enzyme responsible for the final detoxification step in the deoxynivalenol epimerization pathway in Devosia mutans 17-2-E-8[J]. Frontiers in Microbiology, 2018, 9: 1573. doi: 10.3389/fmicb.2018.01573 [25] YANG H, YAN R X, LI Y, et al. Structure-function analysis of a quinone-dependent dehydrogenase capable of deoxynivalenol detoxification[J]. Journal of Agricultural and Food Chemistry, 2022, 70(22): 6764-6774. doi: 10.1021/acs.jafc.2c01083 [26] HE W J, ZHANG L M, YI S Y, et al. An aldo-keto reductase is responsible for Fusarium toxin-degrading activity in a soil Sphingomonas strain[J]. Scientific Reports, 2017, 7(1): 1-13. doi: 10.1038/s41598-016-0028-x [27] 高慧, 牛家峰, 杨华, 等. 高通量测序分析混合菌群中的呕吐毒素降解菌[J]. 食品科学, 2021, 42(24): 123-130. GAO H, NIU J F, YANG H, et al. High-throughput sequencing analysis of vomitoxin-degrading bacteria in bacterial consortium[J]. Food Science, 2021, 42(24): 123-130 (in Chinese).
[28] QU R, JIANG C M, WU W Q, et al. Conversion of DON to 3-epi-DON in vitro and toxicity reduction of DON in vivo by Lactobacillus rhamnosus[J]. Food & Function, 2019, 10(5): 2785-2796. -




 下载:
下载: