-
硒是人体所必需的一种营养元素,能参与人体谷胱甘肽过氧化酶等多种硒蛋白的合成,辅助调节体内的抗氧化系统 [1 − 2]. 人体中缺少硒会引发诸如克山病、大骨病及阿尔兹海默症等疾病[3 − 6]. 硒的摄入主要是通过食用含硒的农作物,相关农作物将土壤中的无机硒转化为高生物利用度的硒蛋白,使其能被人类或动物吸收. 据报道中国面临缺硒风险的人就有约7000万[7 − 8]. 为降低缺硒给人群带来的风险,人们开始开展富硒农业,现形成了以陕西安康、湖北恩施为典型区域,涵盖陕西、广西等地的富硒农产品开发格局[9]. 在天然富硒区域种植农作物是生产富硒食品的主要方式,近年来在非富硒区域通过人工施用硒肥来提高农产品中硒含量的生产方式迅猛发展,但硒肥的大量施用很可能导致环境中硒含量过高从而对生态环境和人体造成威胁. 土壤中的硒蓄积于农作物中,通过摄食进入人体. 每天摄入超过400 μg的硒即可导致脱发、肝坏死、脑水肿和神经毒性[10].
土壤微生物在土壤系统的新陈代谢中发挥重要作用,不仅促进土壤碳循环和能量循环,还能改善土壤结构[11],在土壤系统中占有重要地位. 通过研究硒对微生物的影响,可以掌握硒对土壤生态系统最基础与最直接的作用. 前人的研究表明低浓度的硒能改变微生物群落结构,从而改善土壤环境. 1.0 mg·kg−1硒与甲壳素结合,可以减少土壤磷淋失[12]. 硒浓度为0.40—2.83 mg·kg−1时能增加土壤细菌群落和真菌群落的多样性[13],5.0 mg·kg−1硒能增加土壤中氮代谢和碳水化合物代谢[14]. 而当硒浓度过高,则对微生物群落产生威胁. 当硒浓度达20 mg·kg−1时,土壤细菌和真菌数量降低[15]. 前人关于硒对土壤微生物影响的研究中,控制实验设计的浓度组一般较少,而原位硒对微生物的研究又大多是直接将硒含量划分为高硒和低硒两部分来研究,因此需要探究硒浓度梯度变化对土壤微生物群落的影响.
PLFA方法是一种常用的测定土壤微生物组成并定量的方法[16 − 17],其原理是通过测定磷脂脂肪酸来表征微生物类别. 磷脂是构成生物膜所需磷脂双分子层的主要成分. 微生物死亡后,磷脂会被迅速分解,因此PLFA方法是鉴定土壤中活微生物的重要方法[18 − 19]. 相较于耗时费力的平板微生物分离法、Biolog微平板法和价格高昂且结果不确定性较高的16S rRNA方法,PLFA方法更加经济、快捷、准确.
本研究选取典型富硒农业发展区土壤,探讨了土壤理化性质、原位硒含量、土壤微生物丰度与群落结构的相关性. 同时为排除土壤理化性质的干扰,进行室内控制变量实验. 参考野外原位硒含量设计室内控制实验中硒的浓度梯度,并探讨控制变量下更广跨度硒含量对土壤微生物菌群短期(2 d)和长期(21 d)的影响. 本研究结合野外原位硒和实验室外源硒对微生物的影响,相关实验结果可以为富硒农业可持续绿色发展提供有力参考.
-
研究区域山东省淄博市博山区曾于2013年开展过采样调查,共采61个样点,硒含量变化范围为0.105—1.460 mg·kg−1,硒含量均值为0.305 mg·kg−1,与全国硒均值0.29 mg·kg−1相当[20]. 该区缺硒、少硒、足硒、富硒样点的占比分别为6.56%%、13.11%、54.10%、26.23%. 据此,2019年在这四类区域里分别布设2、5、9、6个样点(图1). 采用五点取样法进行取样,所采壤土主要来自未施加硒肥的农田、林地等地,取0—20 cm的表层土壤混匀,分为两份. 一份自然风干用于硒含量的测定,另一份保存于−80 ℃冰箱,用于磷脂脂肪酸含量的测定.
-
室内控制实验的土壤采自博山区池埠村(2号样点),土壤的pH为6.54,含水率7.83%,总氮0.102%,总有机碳0.940%,硒含量为0.157 mg·kg−1,按该地区有效硒占比10.16%计[21],有效硒含量为0.016 mg·kg−1.
称取120 g土,将土壤相对含水量调节为37.5%用以模拟旱地土壤,预培养7 d,再将预培养后的土样分别添加亚硒酸钠,浓度分别为0、0.2、0.4、1、5、10、30、50、70 mg·kg−1(计算硒浓度为0、0.0913、0.183、0.457、2.28、4.57、13.7、22.8、32.0 mg·kg−1),每个浓度设置3个平行. 该浓度梯度的设计,即考虑了博山区野外原位硒含量的范围,在其中安排类似浓度的硒处理,又考虑到诸如恩施一些富硒地区土壤平均硒浓度可达到27.81 mg·kg−1[22]. 将土壤置于培养箱中进行为期21 d的培养,分别于0、2、21 d进行采样.
-
土壤中硒的含量采用微波消解法和ICP-MS来测定[20]. 设置程序空白、试剂空白,均未检出,表明试验过程没有受到污染. 标准曲线的R2值大于0.999,加标回收率(n=6)为84.9%—111.0%. 理化性质部分检测了土壤的pH、含水率、TOC以及TN[23].
-
微生物含量的测定采用PLFA法. 磷脂脂肪酸的提取和归一化计算参考ISO/TS 29843-2 [24]. 氯仿:甲醇:柠檬酸缓冲 = 1:2:0.8(柠檬酸缓冲为7.4)混合液作为提取剂进行单相提取[25 − 26]. 过固相萃取柱,过滤中性脂质和糖脂,保留磷脂. 采用碱性催化甲酯化方法,使用0.2 mol·L−1 KOH(以甲醇为溶剂)对磷脂脂肪酸进行甲酯化. 采用GC-MS测定. PLFA的命名以及表征参考自姚晓东等[27]的研究.
-
使用Excel和IBM SPSS Statistics 23分析处理数据,采用R 4.2.1和origin9.5作图. 分析土壤硒含量、理化性质和各微生物菌群之间关系时,使用Spearman相关系数表示相关性,显著性水平设定α=0.05,极显著水平设定α=0.01. 探讨硒含量对土壤微生物群落的影响时,采用Tukey多重比较方法.
-
野外土壤样点的设置如图1所示,其中不同颜色代表硒的不同等级,菱形图案表示采样点,博山硒分布图参考陈娟等2013年的研究[20]. 博山区硒含量整体上呈现由西北向东南方向递减,足硒和富硒区占据绝大部分区域. 从图中2019年取样点硒含量与2013年测得的硒含量分布图比较来看,大部分采样点硒含量基本符合预设. 硒含量以及理化性质如表1所示. 硒含量范围为0.101—4.563 mg·kg−1,覆盖全部土壤硒含量特征样点. 根据谭见安对硒含量等级的划分[28],缺硒点(<0.125 mg·kg−1)1个,少硒点(0.125—0.175 mg·kg−1)1个,足硒点(0.175—0.450 mg·kg−1)13个,富硒点(0.450—2.00 mg·kg−1)6个,和高硒点(>2.00 mg·kg−1)1个,足硒和富硒占比居多. 博山土壤的总氮含量范围为0.73—4.28 g·kg−1,总有机碳含量7.1—98.36 g·kg−1,含水率为2.29%—18.30%,pH为4.27—7.55.
-
样点中表征各类微生物的PLFA的含量如表2所示. 总PLFA含量为29.59—150.56 nmol·g−1. 细菌为博山土壤微生物的优势菌群,其占比范围为80.21%—100%. 革兰氏阳性菌和革兰氏阴性菌的PLFA量范围分别为0.00—27.49 nmol·g−1、4.58—65.89 nmol·g−1.
-
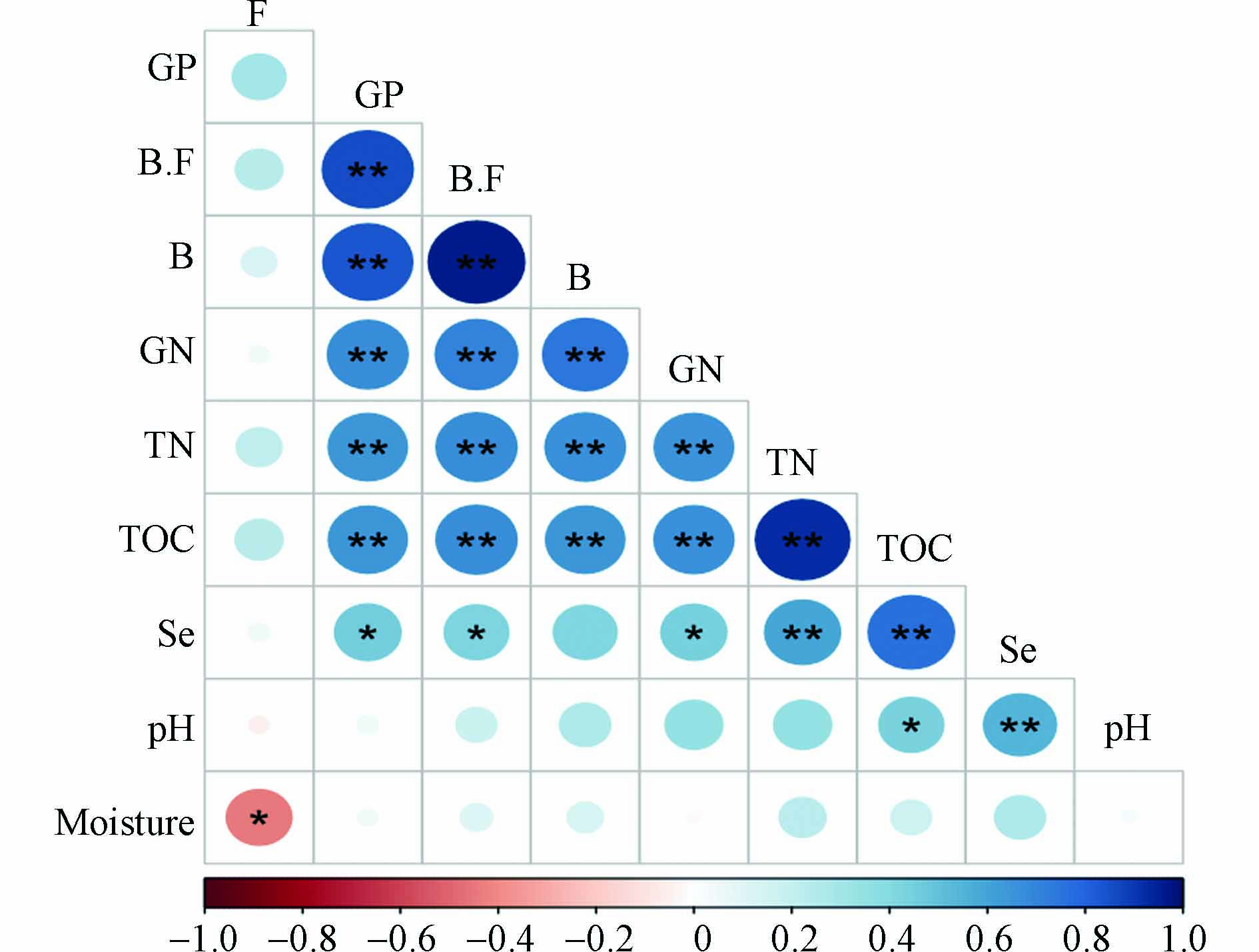
使用Spearman相关系数表征相关性,其可视化结果如图2所示. 硒含量与土壤理化性质中酸碱性、总氮和总有机碳呈极显著正相关. 土壤pH影响土壤中硒的存在形式. 酸性土壤中,硒主要以四价的亚硒酸盐的形式存在,当土壤为碱性的时候,四价的亚硒酸盐会被氧化为六价的硒酸盐[29]. 四价的亚硒酸盐易与铁锰等氧化物形成稳定的复合沉淀,而六价的亚硒酸盐更易迁移淋溶,也更容易被植物吸收,因此有研究表明土壤pH与总硒含量呈负相关[30]. 不过也有研究表明,自然条件下硒含量与土壤pH呈正相关[29,31]. 究其原因可能与土壤有机质含量有关,土壤硒含量除了受pH的影响,同时也受土壤有机质含量的影响. 硒含量与总氮和总有机碳呈极显著正相关,土壤中的有机质与金属形成的复合体能吸附硒,从而促进硒的富集[30]. 综上结果表明,自然条件下,土壤硒含量分布是各类理化性质的共同作用的结果.
不同土壤微生物对土壤含水率的响应不同,真菌与土壤含水率呈显著负相关,细菌与土壤含水率呈正相关(未达到显著). 有研究表明,在干旱条件下,真菌网络稳定性强于细菌网络[32],因此在土壤含水率较低时,真菌更具有优势,从而大量繁殖. 本研究中的土壤微生物总量、细菌、革兰氏阳性菌、革兰氏阴性菌含量与土壤总氮、总有机碳均呈极显著正相关,该结果与肖烨、赵溪等[33 − 35]的研究结果一致. 土壤微生物的活动促进土壤含氮含碳化合物的转化,在碳、氮元素地球化学循环中起着重要作用. 同时土壤有机质为微生物提供生长繁殖所需的养分和能量,决定着土壤中微生物的组成,可以通过施肥增加土壤有机质、土壤有机碳和总氮的含量,提高菌群的丰度[36].
土壤微生物总量、革兰氏阳性菌量、革兰氏阴性菌量与硒含量呈显著正相关,而真菌则与硒含量没有显著相关性. 然而相较于硒含量对土壤微生物的影响,土壤理化性质中的总氮和总有机碳与土壤微生物量的正相关性更强,干扰了硒含量对土壤微生物菌群影响的判断. 因此有必要进行室内控制实验,进一步研究硒含量对土壤微生物群落的影响.
-
不同亚硒酸钠浓度处理下,微生物含量的变化如图3所示.
培养0 d时,不同浓度亚硒酸钠处理下,各类微生物含量差异不显著. 在2 d时,除真菌没有明显变化趋势外,其它种类微生物量均随着硒含量增大而先增后减. 不论是野外原位硒还是室内控制实验,硒对真菌没有展现出显著影响. 在面对铜、锌胁迫时,真菌就展现出更强的耐受性和更低的敏感性[37],对于同样是人体必需微量元素的硒,类似的结果也可能存在. 在再生矿山硒对真菌细菌群落影响的研究中也有所证明,不同硒含量下,真菌门级别上没有表现出显著差异[38]. 总体而言,真菌对硒含量并不敏感,但不排除个别类型的真菌对硒含量具有响应,有待进一步研究. 在亚硒酸钠含量为5 mg·kg−1(硒浓度2.28 mg·kg−1)时,对革兰氏阴性菌的生长促进作用最强;在其为10 mg·kg−1(硒浓度4.57 mg·kg−1)时对细菌和革兰氏阳性菌的促进作用最强. 当亚硒酸钠浓度小于等于10 mg·kg−1(硒浓度4.57 mg·kg−1)时,随着硒含量的增大,对细菌、革兰氏阳性菌和革兰氏阴性菌的生长繁殖起到促进作用,这与野外原位硒(硒浓度0.101—4.563 mg·kg−1 )同土壤微生物相关性的分析结果一致. 当亚硒酸钠处理浓度为70 mg·kg−1(硒浓度32.0 mg·kg−1)时,对革兰氏阳性菌的生长呈现显著抑制. 研究结果表明低剂量硒对土壤微生物生长呈促进作用[13 − 14],而高剂量硒则对微生物的生长表现为抑制作用,该结果也与戴志华等人的研究结果一致[15].
培养到21 d时,真菌没有检出,考虑到0 d和2 d检测出的真菌量也较小,培养到21 d时真菌可能受培养环境影响有所减少至未能检出. 与对照组相比,各浓度组下细菌、革兰氏阳性菌和革兰氏阴性菌含量均减少. 亚硒酸钠浓度在0.2—30 mg·kg−1(硒浓度0.0913—13.7 mg·kg−1)之间时,各处理组之间总体上没有显著差异,当亚硒酸钠浓度为70 mg·kg−1(硒浓度32.0 mg·kg−1)时,细菌、革兰氏阳性菌和革兰氏阴性菌都显著下降. 以上结果表明高浓度硒处理抑制土壤微生物的生长繁殖. 其中低浓度硒处理下微生物量的减少,可能是土壤有机质含量变化造成的. 推测可能在培养2 d后,低硒浓度(亚硒酸钠浓度为0.2—30 mg·kg−1,硒浓度0.0913—13.7 mg·kg−1)处理下,微生物大量繁殖,与对照组相比其微生物量呈现增长趋势,与此同时会消耗更多土壤有机质. 低硒处理组更多的有机质消耗从而导致了21 d时微生物量的下降. 对照组各类微生物(除革兰氏阳性菌外)随时间变化均呈现下降趋势,且真菌与革兰氏阴性菌的微生物量呈现显著下降趋势(用大写字母标注),为土壤有机质的减少提供一定佐证.
在低剂量暴露下亚硒酸钠对微生物呈现促进作用,这与硒是人体必需的微量元素有关. 一定浓度范围的硒不会对微生物产生伤害,而能作为原料参与诸如硒甲硫氨酸等含硒氨基酸的合成,进而合成酶(如含硒的甲酸脱氢酶、烟酸羟化酶等)或者参与核酸合成,促进微生物的生长繁殖[39 − 41]. 樊俊等通过植烟土壤施硒肥盆栽实验研究表明,当硒浓度为5 mg·kg−1和10 mg·kg−1时,都会造成土壤微生物数量的增长[42]. 而当硒含量过高,亚硒酸钠在微生物体内与硫醇反应(如谷胱甘肽),被还原为0价硒,同时产生超氧阴离子,过多的超氧阴离子可能造成微生物的氧化损伤[43 − 44]. 此外,硒还可能过度氧化巯基从而导致蛋白质失活,以此抑制微生物的生长[45].
-
(1)土壤原位硒实验结果表明,土壤微生物总量、细菌量、革兰氏阳性菌量、革兰氏阴性菌量与土壤理化性质中的总氮、总有机碳呈极显著正相关,与硒含量(范围为0.101—4.563 mg·kg−1)呈显著正相关. 低浓度硒可以被微生物利用生成含硒氨基酸,参与细胞内酶、核酸等的合成,从而促进微生物的生长.
(2)实验室外源添加硒控制实验表明,培养2 d时,真菌的含量无显著变化,随着外源添加的亚硒酸钠浓度的升高,土壤细菌、革兰氏阳性菌和革兰氏阴性菌的含量先增加后减小. 当外源添加硒浓度小于等于4.57 mg·kg−1时,随着硒含量的增大,对细菌、革兰氏阳性菌和革兰氏阴性菌的生长繁殖起到明显促进作用,这与野外原位硒同土壤微生物相关性的分析结果一致. 本研究表明低剂量(硒浓度0.0913—22.8 mg·kg−1)硒会增加土壤微生物量,且当硒浓度为2.28 mg·kg−1或4.57 mg·kg−1时促进作用可以达到最大,而高硒浓度则会抑制土壤微生物生长(硒浓度32.0 mg·kg−1).
土壤原位硒及外源硒处理下土壤微生物群落特征分析
Characteristics of soil microbial communities treated with orthotopic and exogenous selenium
-
摘要: 本研究采用野外原位硒研究和实验室外源硒控制实验结合的方法,利用磷脂脂肪酸(phospholipid fatty acid,PLFA)法表征土壤微生物组成并对其定量,探究土壤硒对微生物群落特征的影响的定量关系. 结果表明,土壤微生物总量、革兰氏阳性菌和革兰氏阴性菌的量均与原位硒含量(范围0.101—4.563 mg·kg−1)呈显著正相关,同时其与土壤总氮和总有机碳呈极显著正相关. 室内外源硒控制实验中,在短期培养(培养2 d)时,随着外源硒浓度的增大,除真菌响应不显著,细菌、革兰氏阳性菌和革兰氏阴性菌含量均呈现先升高后降低的趋势. 当硒含量为2.28 mg·kg−1时,对革兰氏阴性菌生长繁殖的促进作用最强,对细菌、革兰氏阳性菌促进作用最强的硒含量为4.57 mg·kg−1. 外源添加硒实验的结果同野外原位硒与土壤微生物相关性的分析结果一致. 当硒含量达22.8 mg·kg−1时,短期(2 d)会促进细菌增长,但长期(21 d)下则表现为显著抑制. 当硒含量为32.0 mg·kg−1时,不论是短期培养(2 d)还是长期培养(21 d),对细菌、革兰氏阳性菌和革兰氏阴性菌生长表现出显著抑制作用. 本研究表明硒含量在一定范围可以促进土壤微生物繁殖,而过量的硒则会抑制微生物的生长,该结果可为富硒农业的可持续绿色发展提供科学依据.Abstract: This study adopted a combination of the field in situ selenium research and laboratory exogenous selenium control experiments to investigate the quantitative relationship between soil selenium and microbial community characteristics. A phospholipid fatty acid (PLFA) method was used to characterize and quantify the composition of soil microorganisms. The results showed that the total amount of soil microorganisms, Gram-positive bacteria, and Gram-negative bacteria was significantly positively correlated with the in situ selenium content (range 0.101—4.563 mg·kg−1) and was also significantly positively correlated with the total nitrogen and total organic carbon in the soil. In the lab exogenous selenium control experiment in the short-term culture (cultured for 2 d), with the increase of exogenous selenium concentration, except that the response of fungi was not significant, the content of bacteria, Gram-positive bacteria and Gram-negative bacteria all showed a trend of first increasing and then decreasing. When the selenium content was 2.28 mg·kg−1, the promotion effect on the growth and reproduction of Gram-negative bacteria was the strongest. The selenium content had the strongest promotion effect on bacteria when Gram-positive bacteria was 4.57 mg·kg−1. The results of the exogenous selenium addition experiment were consistent with the analysis results of the correlation between field in situ selenium and soil microorganisms. When the selenium content reached 22.8 mg·kg−1, short-term culture (2 d) would promote the growth of bacteria, but long-term culture (21 d) showed significant inhibition. When the selenium content was 32.0 mg·kg−1, both short-term culture (2 d) and long-term culture (21 d) showed significant inhibition on the growth of bacteria, Gram-positive bacteria, and Gram-negative bacteria. This study shows that selenium content in a certain range can promote the reproduction of soil microorganisms, while excessive selenium will inhibit the growth of microorganisms, which can provide the scientific basis for the sustainable green development of selenium-rich agriculture.
-
Key words:
- selenium /
- soil /
- microbial community /
- phospholipid fatty acids.
-
已有研究[1-2]表明,生活污水中包含一定量的潜在致病微生物(大肠埃希氏菌、沙门氏菌、志贺氏菌等)。因此,在污水处理系统末端需增加消毒,处理达标之后方可排放。近2年,随着新冠疫情的全球肆虐,不同层面的生物安全问题受到了广泛关注。我国于2021年4月15日起全面实施《生物安全法》,标志着我国生物安全问题进入了依法治理的新阶段[3]。目前,我国现行城市污水生物处理过程中已全部覆盖消毒工艺。但是,对于卫生设施相对薄弱的农村地区,污水中潜在致病微生物的分布、相应污水处理设施的消毒效果等仍存在认识不清、运维不稳等问题,从而对农村地区居民身体健康及区域生态安全造成了极大的潜在风险。
截至2020年,全国共有约5.1亿农村人口,占全国总人口的36%,生活污水排放量很大,而目前针对已有农村污水处理设施的监测重点仍然为COD、NH3-N、TP等基础水质排放控制指标[4-5]。农村生活污水主要来源于厨房污水、生活洗涤污水和冲厕水等,其具有分散性强、水质水量变化大等特点;同时,我国农村区域相对城市而言,经济水平比较低。因此,成本低廉、高度集成、占地面积较小、施工工程量小、运行维护简便的小型化、装备化污水处理设施在农村地区得到广泛应用,净化槽即是其中一种[6-10]。基于其在单户或联用处理中的优势,目前净化槽已经在上海、江苏、云南、山东、黑龙江等地多数农村投入实际使用[11]。调研发现,目前市场上销售的净化槽在工艺单元是配有消毒设施的。但在实际运用中,由于消毒工艺投入成本高,投入的化学消毒试剂如次氯酸钠等在维护不当时可能会造成泄露而引起二次污染,因此,大部分农村地区一体化污水处理设备的消毒设施处于闲置状态,农村污水处理后,未经消毒就直接排放[10]。基于以上研究现状,本研究选取江苏省常熟市虞山街道(N 120°40′48″,E 31°40′48″)处理量为1 m3·d−1的一体化污水处理设施,解析不同工段潜在致病微生物的分布特征,为后续村镇小型污水处理设施运行过程中的健康风险评估研究提供参考。
1. 材料与方法
1.1 设备简介
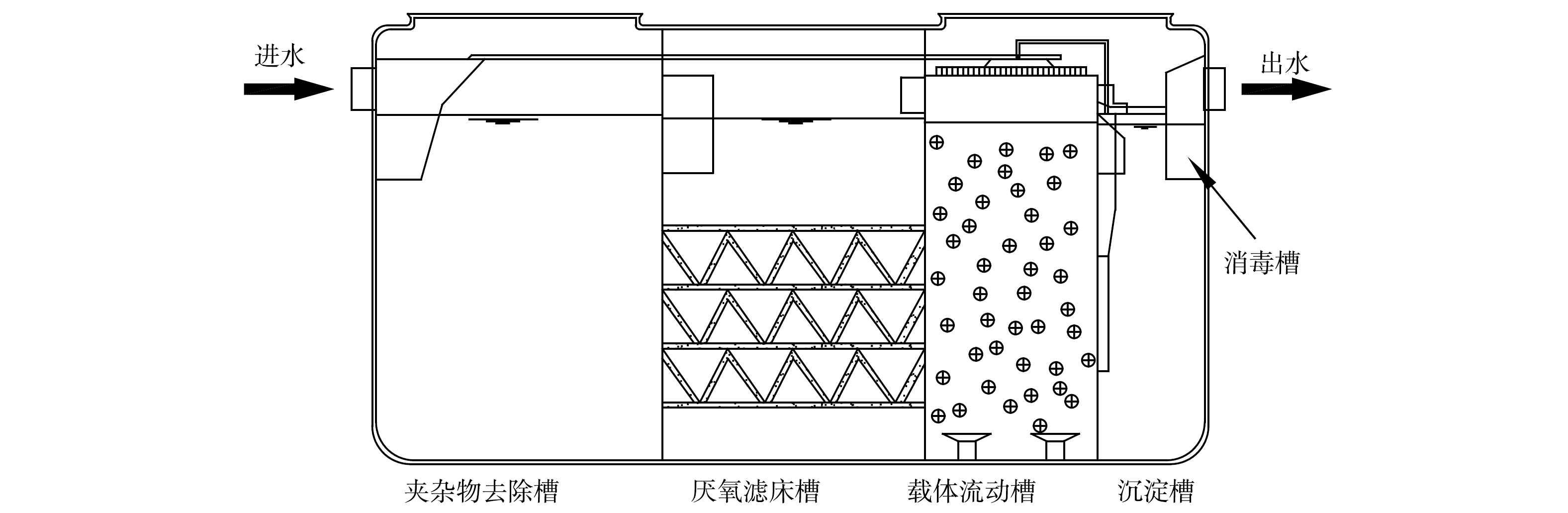
本研究选择江苏省常熟市虞山街道(N 120°4′48″,E 31°40′48″)处理量为1 m3·d−1的一体化污水净化槽(HJA-10,江苏中车环保设备有限公司;长×宽×高=2 190 mm×1 120 mm×1 550 mm)进行研究。净化槽采用A/O处理工艺,主要由夹杂物去除槽-厌氧滤床槽-载体流动槽-沉淀槽-消毒槽处理单元组成(图1)。其中厌氧滤床槽采用PE滤料,载体流动槽即为加有曝气设施和圆球状填料的生物处理单元,消毒槽设定为添加三氯异氰尿酸消毒剂消毒。该村现有农户370多户,共计1 500余人,其中青年人(非假期外出务工、上学等)和老年人(长期在当地居住)的占比分别为60%和40%。净化槽主要收集处理村民家中排放的生活污水(厨房洗涤废水、洗漱用水、马桶废水等),实际运行时,槽中污水依次经过夹杂物去除槽、厌氧滤床槽、载体流动槽和沉淀槽,载体流动槽出水处设有回流管,向夹杂物去除槽回流。
1.2 样品采集
样品按照《水质采样技术指导》( HJ 494-2009 ) 和《水质采样样品的保存和管理技术规定》( HJ 493-2009 ) 要求[12-13],分别从净化槽进水口(A1)、夹杂物去除槽(A2)、厌氧滤床槽(A3)、载体流动槽(A4)、沉淀槽(A5)、出水口处(A6)、出水受纳水体(A7),各采集1 L水样。采样容器材质为聚乙烯,容器采样前均进行灭菌处理,以满足采样需要。水样分别采集于夹杂物去除槽液面下0.8 m,厌氧滤床槽、载体流动槽、沉淀槽液面下0.3 m。各处理单元所采样品分成2份:1份于4 ℃保存,用于理化指标测定;另1份存于−20 ℃,用于微生物多样性分析。
1.3 理化指标测定
采用重铬酸钾法(HJ 828-2017)测定COD值[14];采用纳氏试剂分光光度法(HJ 535-2009)测定NH3-N浓度[15];采用哈希法测定TN浓度;采用重量法(GB 11901-1989)测定SS浓度[16]。
1.4 16S rDNA高通量测序
利用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对 16S rRNA基因V3~V4 可变区进行 PCR 扩增[17-18],产物纯化定量后通过Illumina Miseq平台进行测序。使用UPARSE软件,根据97%的相似度对序列进行聚类并剔除嵌合体,然后利用RDP classifier对每条序列进行物种分类注释,比对数据库,设置比对阈值为70%,最终生成操作分类单元(operational taxonomic unit,OTU) [19-21]。利用mothur进行微生物群落的α多样性分析,计算参数分别为Ace、Chao1、Shannon和Simpson指数。Ace和Chao1指数反映微生物种群丰度,其值越高表明微生物丰度越高;Shannon和Simpson指数反映微生物种群多样性,高Shannon指数和低Simpson指数代表高多样性,其数值受样品群落中丰度和物种均匀度的影响[22]。多样性指数根据式(1)~式(3)计算[23]。
SChao1=Sobs+n1(n1−1)2(n2+1) (1) 式中:SChao1表示估计的OTU数;Sobs表示实际测得OTU数;n1表示只含1条序列的OTU数;n2表示只含2条序列的OTU数。
DSimpson=Sobs∑i=1ni(ni−1)N(N−1) (2) 式中:Sobs表示实际测得OTU数;ni表示第i个OTU所含序列数;N表示所有序列数。
HShannon=−Sobs∑i=1niNlnniN (3) 式中:Sobs表示实际测得OTU数;ni表示第i个OTU所含序列数;N表示所有序列数。
2. 结果与讨论
2.1 一体化污水净化槽运行效果
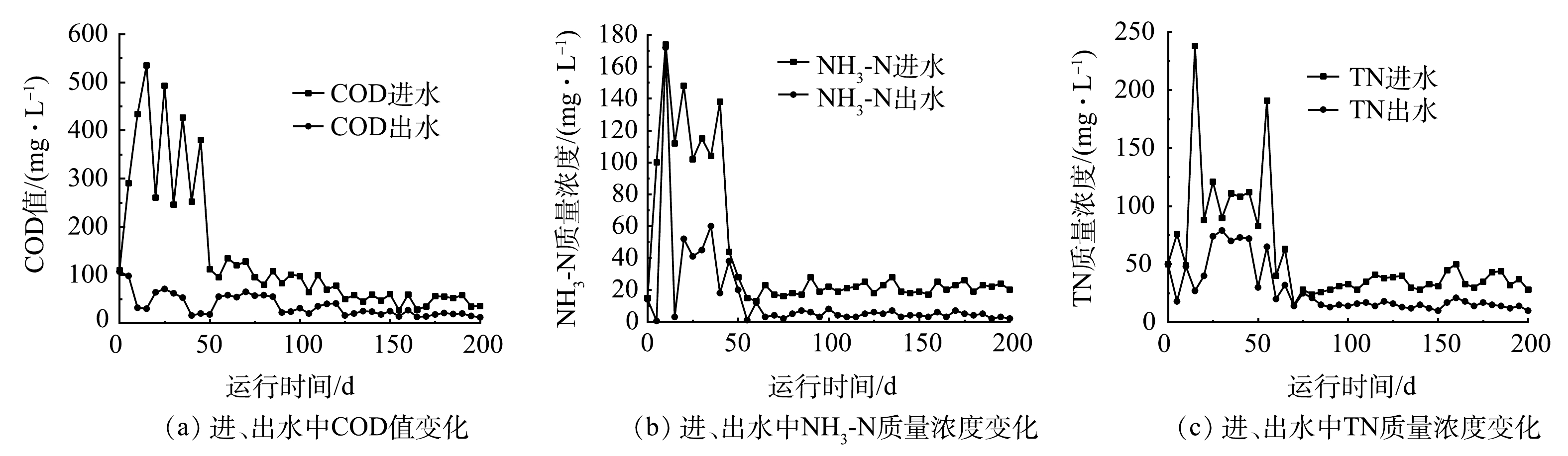
对首次投入使用的一体化污水净化槽进行长期连续进出水水质监测,时间为200 d。结果如图2所示。运行期内,设备进水中COD值为27~537 mg·L−1,NH3-N和TN的质量浓度分别为13~174 mg·L−1和15~238 mg·L−1。50 d内,设备运行处于启动状态,COD去除效果较好, NH3-N和TN去除波动较大。随着设备的运行,在50 d后,其出水COD值稳定在(35.5±22.5) mg·L−1,NH3-N和TN的质量浓度稳定在(5±3) mg·L−1和(22±10) mg·L−1,表明该设备出水水质达到了《农村生活污水处理设施水污染物排放标准》(DB 32/ 3462-2020)[24]。
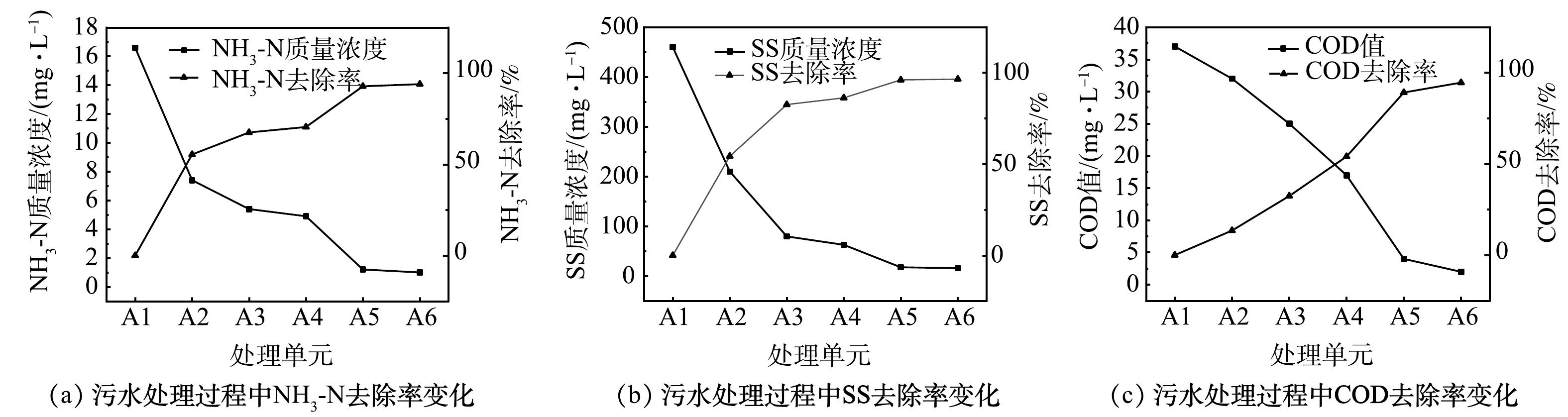
在装置运行约100 d后,考察不同工段污水中NH3-N、SS质量浓度和COD值的沿程变化,结果如图3所示。沿设备运行工段流程,NH3-N、SS质量浓度和COD值均呈逐步下降趋势,NH3-N在A2、A3、A4、A5、A6单元的去除率分别为55.42%、67.47%、70.48%、92.77%、93.98%;SS在A2、A3、A4、A5、A6单元的去除率分别为54.35%、82.61%、86.30%、96.09%、96.52%;COD在A2、A3、A4、A5、A6单元的去除率分别为13.50%、32.43%、54.46%、89.19%、94.59%。以上结果表明,该设备处于长期稳定运行状态,并且不同处理单元对污染物的去除率有所不同。
2.2 一体化污水净化槽各处理单元中微生物群落多样性
采用高通量测序分别对不同处理单元中样本进行了细菌多样性分析,其中Ace和Chao1指数用来表征不同处理单元微生物种群丰度,Shannon和Simpson指数用来表征微生物种群多样性,具体结果如表1所示。由表1可以看出,A3单元Chao1和Ace值最高,分别为2 404.32和2 396.72;Shannon指数最高、Simpson指数最低,分别为5.49和0.01。在该设备中,A3单元中细菌不仅丰度最高,而且多样性也是最高的。这可能与本设备中污水的流程有密切的关系,污水经夹杂物去除槽后,首先进入厌氧滤床槽。因此,该单元有机物更为丰富,异养微生物快速繁殖,从而导致该单元细菌种类及丰度均相对较高。这一结果与前人研究结果存在一定的差异。黄潇等[22]发现,当采用多级A/O工艺处理城市污水时,最高的Shannon和Simpson指数出现在第2好氧区,这可能与工艺流程和污水来源的差异有关。
表 1 不同处理单元微生物群落丰度和多样性Table 1. Microbial community abundance and diversity in different treatment units处理单元 Ace Chao1 覆盖率/% Shannon Simpson A1 1 252.21 1 025.01 99.30 2.25 0.26 A2 1 986.92 1 965.48 98.93 4.13 0.15 A3 2 396.72 2 404.32 98.75 5.49 0.01 A4 2 260.19 2 221.75 98.95 5.01 0.02 A5 1 910.35 1 841.82 99.16 4.92 0.02 A6 2 029.49 1 981.27 98.68 5.06 0.03 2.3 一体化污水净化槽各处理单元中的种群结构
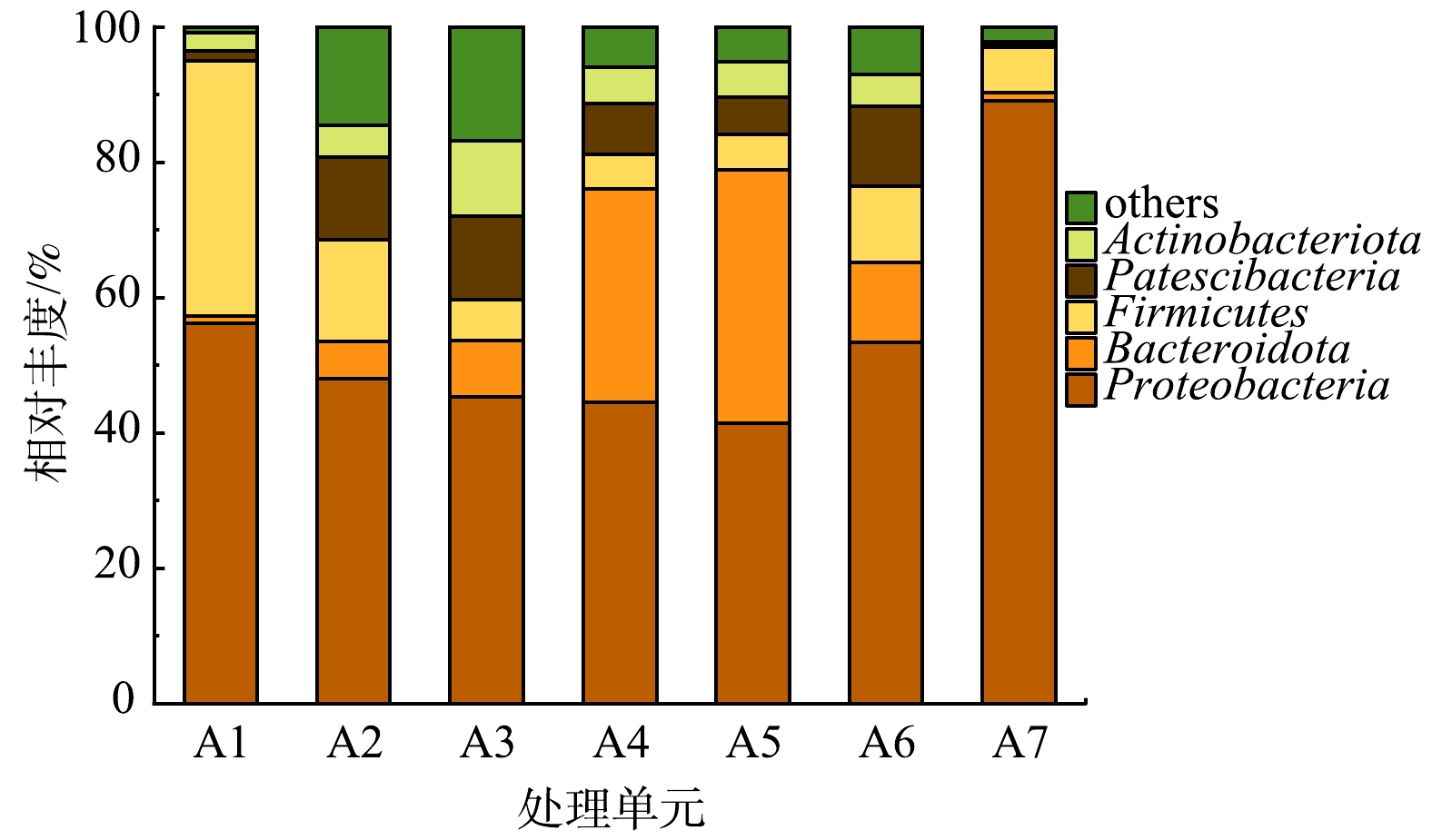
进一步分析受纳水体和设备运行稳定状态下不同单元中细菌种群结构特征,其差异如图4所示。在门水平上,进水中Proteobacteria和Firmicutes是优势菌门,其相对丰度分别为56.21%和37.65%。随着污水流经各处理单元,这2个菌门虽然仍然处于优势地位,但其相对丰度却逐步下降。由图4可见,由A2到A5,Proteobacteria相对丰度分别为48.00%、45.33%、44.58%和41.47%。Proteobacteria在各单元中检测片段数基本不变,在A2~A5单元相对丰度降低是由于各单元其他菌门种类和丰度的增加。由A2到A5,Firmicutes相对丰度分别为15.04%、6.14%、5.21%和5.27%。A2单元Firmicutes相对丰度下降主要是由其门下Chryseomicrobium属相对丰度急降所导致;在A3~A5单元,Firmicutes所测片段数基本不变,其相对丰度变小是由各单元其他菌门种类和丰度的增加所导致。在出水中,检测到的细菌总片段变少,导致Proteobacteria相对丰度增高,此时Firmicutes门下梭菌纲丰度上升是导致Firmicutes相对丰度上升的主要原因,梭菌纲适合在氧气浓度相对较低的出水中繁殖。同时,图4中的结果也表明,进水中Bacteroidota相对丰度较低,为1.08%,但在各单元中Bacteroidota相对丰度呈现逐步升高趋势,尤其是在A4和A5单元,其相对丰度分别可达31.43%和37.42%,这与已有研究结果基本一致 [25-26]。Bacteroidota相对丰度变化主要由其门下Flavobacterium属相对丰度变化引起,Flavobacterium是一种好氧反硝化细菌,适合在含氮物质和氧气含量充足的环境中生存。 本研究中,净化槽消毒单元处于关闭状态,因此,出水中检出的细菌多样性也较高,Proteobacteria仍是优势菌门,其相对丰度为53.41%,Firmicutes、Bacteroidota、Patescibacteria、Actinobacteriota的相对丰度也分别达到了11.31%、11.73%、11.86%、4.68%。与净化槽出水相似,排水口处受纳水体中Proteobacteria也是优势菌门,相对丰度为89.09%,且Patescibacteria、Actinobacteriota相对丰度则显著降低,这可能是由受纳水体中微生物相互作用导致的。
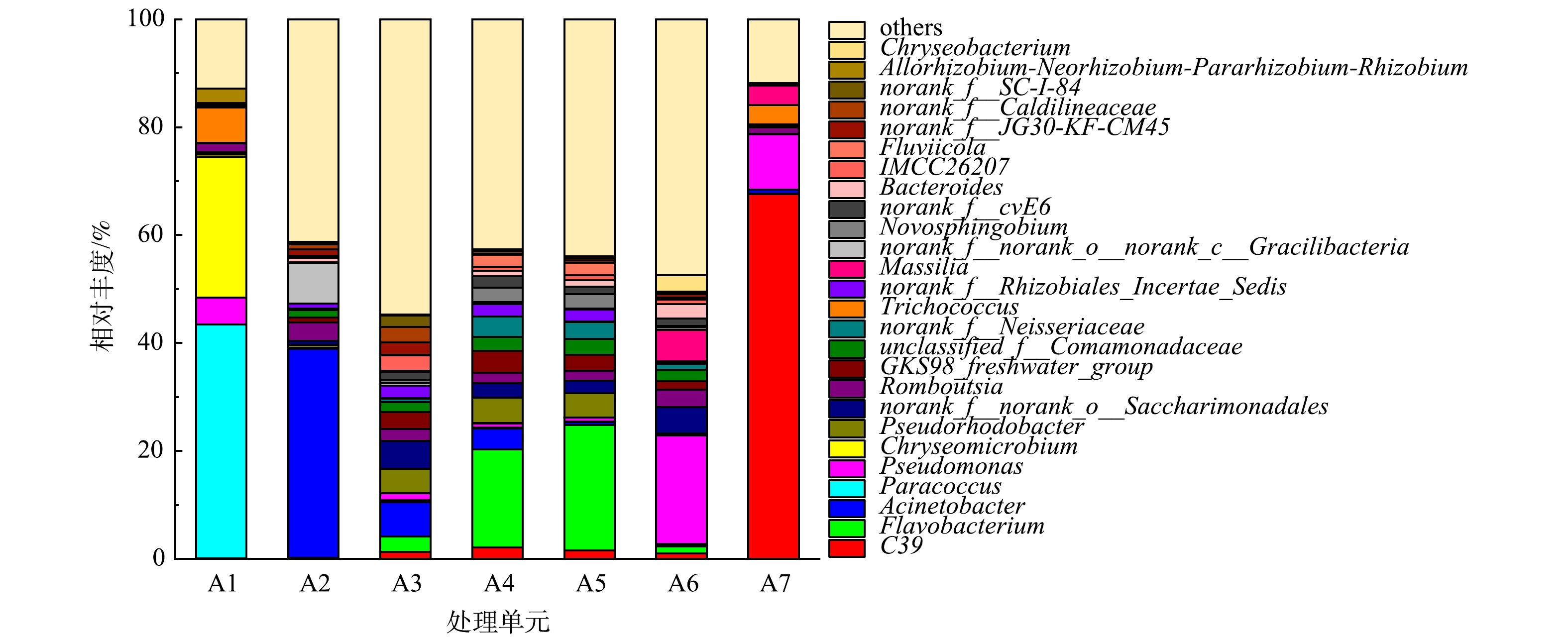
为了更加准确地反映净化槽不同单元和受纳水体中细菌的组成,对所选样本中细菌种群特征进行了属水平上的分析。结果如图5所示,进水中细菌种群相对简单,其中优势菌属为Paracoccus(43.31%)、Chryseomicrobium(26.00%)、Trichococcus(6.60%)和Pseudomonas(5.00%)。同样在有夹杂物的去除槽内,其细菌种群相对也较为简单,不同之处在于其优势菌属发生了明显变化,分别为Acinetobacter(38.70%)、norank_f__norank_o__norank_c__Gracilibacteria(7.54%)和Romboutsia(3.48%)。其原因可能是,在物理去除污水中较大颗粒物的同时,附着在颗粒物上的细菌也一并被去除,从而导致其优势菌属种类发生了变化。与其形成明显对比的是,A3、A4、A5单元中细菌菌属多样性明显增加,并且该3个单元中细菌相似性明显升高。除无法鉴定种类的others之外,A3单元中主要细菌菌属分别为Acinetobacter(6.38%)、norank_f__norank_o__Saccharimonadales(5.11%)、Pseudorhodobacter(4.52%)、Flavobacterium(2.85%)、Pseudomonas(1.29%)等。在A4、A5单元里,这些细菌菌属种类并未发生明显变化,但其相对丰度呈现一定差异。在A3、A4、A5单元中,Flavobacterium相对丰度呈现逐步上升趋势,分别为2.85%、18.12%、23.19%。Flavobacterium是活性污泥工艺的常见的好氧反硝化菌[27],适合在含氮物质和氧气含量充足的A4、A5单元中生存,A3单元的厌氧环境并不适合其生存。在A3、A4、A5单元中,Acinetobacter相对丰度呈现逐步下降趋势,分别为6.38%、3.95%、0.57%。Acinetobacter是水处理过程中常见的异养硝化-好氧反硝化细菌[28],所以在有机物质量浓度相对较低的A4、A5单元中并不利于其生长,导致其相对丰度下降。在A3、A4、A5单元中,Pseudomonas相对丰度呈现逐步下降趋势,分别为1.29%、0.83%、0.72%。有研究[29]表明,在人工湿地等脱氮除磷工艺中发现了参与有机物去除的Pseudomonas,因此,对于有机物质量浓度相对较低的A4、A5单元,Pseudomonas相对丰度可能会有所下降。与出水相比,受纳水体细菌组成出现显著变化,其中C39和Pseudomonas为主要的优势菌属,相对丰度分别为67.61%、10.21%,二者总相对丰度超过75%。
2.4 一体化污水净化槽各处理单元中潜在致病细菌种群特征
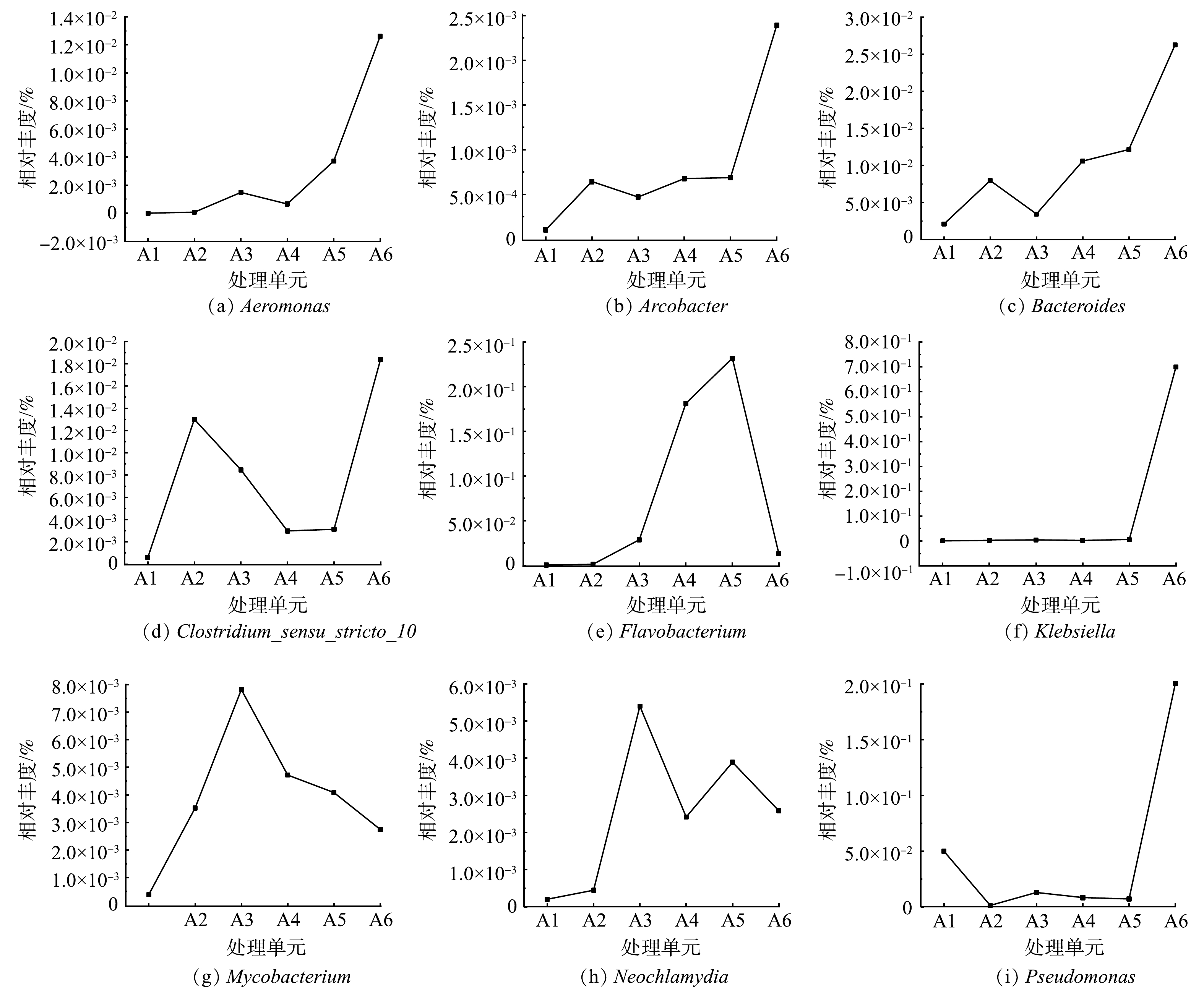
进一步深入分析本研究中一体化污水净化槽各处理单元的细菌特征,结果发现,其检出的潜在人致病性细菌种类丰富,并且各个单元的种类及含量也存在一定差异。进水中共检测到16种潜在致病细菌属, 而出水中则检出了20种潜在致病细菌属。有研究[30-39]表明,出水中检出的相对丰度较高的Klebsiella、Aeromonas、Arcobacter、Neochlamydia、Clostridium_sensu_stricto_10、Mycobacterium、Pseudomonas、Bacteroides、Acinetobacter和Flavobacterium均对人体存在潜在危害。Aeromonas hydrophila普遍存在于淡水、污水、淤泥、土壤和人类粪便中,可引起多种水产动物的败血症和人类腹泻[30];Klebsiella pneumoniae是人类呼吸道和肠道的常居菌,可引起下呼吸道、血液、泌尿道、消化道、手术切口、颅内、皮肤软组织等多个部位感染[31];Arcobacter skirrowii与人类和动物的腹泻、菌血症等疾病密切相关[32];属于易引起疾病衣原体目的Neochlamydia,对人体健康也存在潜在威胁[33];Mycobacterium tuberculosis可引起人体结核病,一种传染性疾病,主要是通过呼吸道传播,以肺结核为最多见[34];Pseudomonas aeruginosa为假单胞菌属中最为常见的一种机会致病菌,常可引起尿路感染、烧伤创面及褥疮感染、败血症和肺部感染等[35];Bacteroides fragilis系革兰阴性厌氧菌,由于其具有黏附性、血细胞凝集素、多糖胶囊、菌毛等多种毒力因素,在拟杆菌属中致病性最强,其可引起腹腔感染、术后伤口感染、糖尿病足感染、菌血症等[36];Acinetobacter bamnannii是我国医院感染最主要的致病菌之一,该菌最常引起的感染为下呼吸道感染,尤其为呼吸机相关性肺炎,其次为血流感染[37];Clostridium perfringens广泛存在于自然界及人和动物的肠道中,是近年来我国家畜“猝死症”的主要病因,可引起气性坏疽和食物中毒的主要病原菌坏死性肠炎[38];Flavobacterium可引起肺炎,也可招致脑膜炎、败血症等感染,该菌会在机体免疫力下降时引起感染[39]。以上结果表明,当污水生物处理设施末端出水不经消毒处理时,其出水中潜在致病微生物的危害可能存在升高趋势。本研究选取了9种对人体危害性较大的致病细菌,对其在不同单元中的相对丰度变化进行了分析,结果如图6所示。不同致病细菌的变化趋势各有差异,总体可分为以下3类。
第1种为进水中相对丰度较低,但在设备不同单元随着污水流向相对丰度逐步呈升高趋势。Aeromonas和 Klebsiella在进水中几乎未检出,但在A2、A3、A4、A5、A6的相对丰度则分别升高至0.007 4%和0.002 5%、0.15%和0.004 5%、0.066%和0.001 9%、0.37%和0.005 9%、1.26%和0.70%。Arcobacter (0.01%)和Bacteroides(0.21%)在进水中有少量检出,但在不同单元中也均呈现上升趋势,A2、A3、A4、A5、A6的相对丰度分别为0.064%和0.80%、0.047%和0.34%、0.068%和1.06%、0.069%和1.22%、0.24%和2.63%。这可能是因为Aeromonas、Klebsiella、Arcobacter、Bacteroides、Pseudomonas等菌属细菌是活性污泥中大量存在且具有降解有机污染物功能的菌属[24,29,40]。因此,相对进水而言,后续各处理单元中这些细菌的相对丰度呈现出上升趋势。
第2种为进水中相对丰度较低,但在整个水处理过程中其相对丰度呈现先上升后下降趋势。Mycobacterium(0.04%)和Neochlamydia(0.02%)在A2、A3、A4、A5、A6的相对丰度分别为0.35%和0.045%、0.78%和0.54%、0.47%和0.24%、0.41%和0.39%、0.27%和0.26%。这2种致病细菌丰度的最大值均在A3单元,可能是由于这2种细菌均属于厌氧菌,当溶解氧浓度较高时会抑制其活性,甚至会影响其生存。同样,Flavobacterium (0.04%)在A2、A3、A4、A5、A6的相对丰度也呈现出先上升后下降趋势,分别为0.10%、2.85%、18.12%、23.18%、1.32%,但下降点在A5单元,这可能因为Flavobacterium同时是一种好氧反硝化细菌[24],在氮物质、有机物含量相对较低环境中会影响其繁殖,导致其相对丰度下降。
第3种为进水中相对丰度较低,但在整个水处理过程中呈现先上升后下降再上升趋势。Clostridium_sensu_stricto_10在进水中的相对丰度为0.06%,而在设备其他处理单元的相对丰度分别为A2(1.30%)、A3(0.85%)、A4(0.30%)、A5(0.31%)、A6(1.84%),其相对丰度的峰值分别在A2和A6中。高通量测序结果显示,各单元检测总片段分别为38 979、40 364、44 672、51 735、50 945、36 408。分析高通量测序结果表明,A1、A2、A3、A4、A5和A6单元中Clostridium_sensu_stricto_10的核酸检出片段量分别为23、525、378、154、159、669。造成这种现象的原因可能是:在功能单元中功能菌种类和相对含量增大,而Clostridium_sensu_stricto_10较功能菌对营养物质的竞争力较小,导致相对丰度下降,但具体原因需要进一步开展研究。以上分析结果表明,无论那种类型变化趋势,其设备出水中均包含一定量的潜在致病性细菌。
3. 结论
1)所研究的一体化污水净化槽设施处理农村生活污水时,不同处理单元细菌中群结构呈现一定差异,尤其是进水、夹杂物去除槽和后续生化处理单元之间。出水中也包含多样性丰富的细菌。
2)本研究在一体化污水净化槽中共检出21种潜在致病细菌,以Flavobacterium、Pseudomonas等为主。值得注意的是,在其出水中存在20种潜在致病细菌,并且有9种优势潜在致病细菌的相对丰度较进水存在明显升高现象。
-
表 1 野外土壤硒含量及理化性质
Table 1. Selenium content and physical and chemical properties of wild soil
样点Sampling site 硒量/(mg·kg−1)Se content 总氮/( g·kg−1)Total nitrogen 总有机碳/( g·kg−1)Total organic carbon 含水率/%Moisture content pH 1 0.101 0.77 9.05 6.71 4.27 2 0.157 1.02 9.40 7.83 6.54 3 0.206 0.99 10.63 4.90 5.79 4 0.207 1.84 16.59 7.01 5.48 5 0.214 0.73 7.10 9.09 7.36 6 0.227 0.87 10.08 4.45 4.91 7 0.298 0.97 10.49 4.43 6.60 8 0.299 1.51 16.76 13.05 6.92 9 0.300 1.52 17.40 2.29 7.47 10 0.319 0.89 9.26 8.03 7.08 11 0.330 1.96 19.46 13.75 6.84 12 0.336 2.05 26.02 14.71 6.86 13 0.360 1.09 12.10 13.37 6.84 14 0.360 1.15 12.01 10.34 7.05 15 0.430 1.40 16.54 9.38 6.04 16 0.468 1.21 13.09 13.83 6.94 17 0.531 1.44 18.19 6.81 7.30 18 0.544 1.60 17.99 18.30 6.50 19 0.657 1.63 27.04 15.23 7.43 20 1.064 1.38 25.71 7.08 6.86 21 1.153 4.28 98.36 4.60 7.55 22 4.563 2.00 53.99 4.70 7.32 表 2 野外土壤微生物各菌群磷脂脂肪酸含量
Table 2. The content of microbial phospholipid fatty acid under the wild soil
样点Sampling point 总PLFA/ (nmol·g−1)Total 细菌PLFA/( nmol·g−1)Bacte ria 真菌PLFA/( nmol·g−1)Fungi 革兰氏阳性菌PLFA/( nmol·g−1)Gram-positive bacterium 革兰氏阴性菌PLFA/( nmol·g−1)Gram-negative bacterium 1 29.59 27.61 1.99 0.00 7.79 2 39.32 37.97 1.35 2.69 15.54 3 78.13 78.13 0.00 15.69 39.45 4 72.55 69.14 3.41 24.70 15.54 5 42.20 42.20 0.00 0.00 13.58 6 41.22 33.06 8.16 3.15 4.58 7 37.60 36.76 0.00 3.59 16.41 8 42.32 41.33 0.99 0.85 15.78 9 40.13 38.91 1.22 3.30 15.81 10 38.59 38.59 0.00 0.00 14.88 11 76.56 72.48 4.09 22.41 22.66 12 46.82 46.82 0.00 3.92 19.94 13 40.97 39.07 1.27 5.63 11.61 14 38.09 35.95 1.05 3.31 16.78 15 58.32 58.32 0.00 10.70 19.12 16 43.52 42.20 0.00 7.50 10.55 17 104.11 91.80 12.31 27.49 30.57 18 44.43 44.43 0.00 3.76 16.63 19 59.47 59.47 0.00 7.63 23.11 20 42.27 40.04 1.39 3.70 14.97 21 150.56 140.90 9.67 22.35 65.89 22 62.25 60.56 1.69 14.02 25.14 -
[1] REEVES M A, HOFFMANN P R. The human selenoproteome: Recent insights into functions and regulation[J]. Cellular and Molecular Life Sciences, 2009, 66(15): 2457-2478. doi: 10.1007/s00018-009-0032-4 [2] KONKOL D, KORZENIOWSKA M, RÓŻAŃSKI H, et al. The use of selenium yeast and phytobiotic in improving the quality of broiler chicken meat[J]. Foods, 2021, 10(11): 2558. doi: 10.3390/foods10112558 [3] RAYMAN M P. Selenium and human health[J]. The Lancet, 2012, 379(9822): 1256-1268. doi: 10.1016/S0140-6736(11)61452-9 [4] YUE S Z, ZHANG H Q, ZHEN H Y, et al. Selenium accumulation, speciation and bioaccessibility in selenium-enriched earthworm (Eisenia fetida)[J]. Microchemical Journal, 2019, 145: 1-8. doi: 10.1016/j.microc.2018.10.015 [5] TAN J A, ZHU W Y, WANG W Y, et al. Selenium in soil and endemic diseases in China[J]. Science of the Total Environment, 2002, 284(1/2/3): 227-235. [6] COBO-ANGEL C, WICHTEL J, CEBALLOS-MÁRQUEZ A. Selenium in milk and human health[J]. Animal Frontiers, 2014, 4(2): 38-43. doi: 10.2527/af.2012-0013 [7] LI N, GAO Z D, LUO D G, et al. Selenium level in the environment and the population of Zhoukoudian area, Beijing, China[J]. Science of the Total Environment, 2007, 381(1/2/3): 105-111. [8] GAO J, LIU Y, HUANG Y, et al. Daily selenium intake in a moderate selenium deficiency area of Suzhou, China[J]. Food Chemistry, 2011, 126(3): 1088-1093. doi: 10.1016/j.foodchem.2010.11.137 [9] 汤超华, 赵青余, 张凯, 等. 富硒农产品研究开发助力我国营养型农业发展[J]. 中国农业科学, 2019, 52(18): 3122-3133. doi: 10.3864/j.issn.0578-1752.2019.18.005 TANG C H, ZHAO Q Y, ZHANG K, et al. Promoting the development of nutritionally-guided agriculture in research and development of selenium-enriched agri-products in China[J]. Scientia Agricultura Sinica, 2019, 52(18): 3122-3133 (in Chinese). doi: 10.3864/j.issn.0578-1752.2019.18.005
[10] LOOMBA R, FILIPPINI T, CHAWLA R, et al. Exposure to a high selenium environment in Punjab, India: Effects on blood chemistry[J]. The Science of the Total Environment, 2020, 716: 135347. doi: 10.1016/j.scitotenv.2019.135347 [11] 陈欣瑶. 重金属—抗生素单一及复合污染胁迫下土壤生态功能稳定性及其微生物调控机制研究[D]. 苏州: 苏州科技大学, 2019. CHEN X Y. Study on stability of soil ecological function and microbial regulation mechanisms under the single and combined pollution of heavy metal and antibiotic[D]. Suzhou: Suzhou University of Science and Technology, 2019 (in Chinese).
[12] TANG Y N, ZHAN T, FAN G C, et al. Selenium combined with chitin reduced phosphorus leaching in soil with pomelo by driving soil phosphorus cycle via microbial community[J]. Journal of Environmental Chemical Engineering, 2022, 10(1): 107060. doi: 10.1016/j.jece.2021.107060 [13] LIU K, CAI M M, HU C X, et al. Selenium (Se) reduces Sclerotinia stem rot disease incidence of oilseed rape by increasing plant Se concentration and shifting soil microbial community and functional profiles[J]. Environmental Pollution, 2019, 254: 113051. doi: 10.1016/j.envpol.2019.113051 [14] CAI M M, HU C X, WANG X, et al. Selenium induces changes of rhizosphere bacterial characteristics and enzyme activities affecting chromium/selenium uptake by pak choi (Brassica campestris L. ssp. Chinensis Makino) in chromium contaminated soil[J]. Environmental Pollution, 2019, 249: 716-727. doi: 10.1016/j.envpol.2019.03.079 [15] 戴志华, 涂书新. 外源硒对水稻土壤微生物多样性及土壤硒形态转化的影响[C]//中国土壤学会土壤环境专业委员会第二十次会议暨农田土壤污染与修复研讨会摘要集. 合肥, 2018: 32. DAI Z H, TU S X. Effects of Exogenous Selenium on soil microbial diversity and soil Selenium Morphological transformation in rice [C]//The 20th Meeting of Soil Environment Committee of Soil Society of China and Symposium on Farmland Soil Pollution and Remediation. Hefei: 2018: 32.
[16] 马进鹏, 庞丹波, 陈林, 等. 贺兰山东坡不同海拔典型植被带土壤微生物磷酸脂肪酸分析[J]. 生态学报, 2022, 42(12): 5045-5058. MA J P, PANG D B, CHEN L, et al. Phospholipid fatty acid analysis of soil microbes in typical vegetation types at different elevation on the east slope of Helan Mountain[J]. Acta Ecologica Sinica, 2022, 42(12): 5045-5058 (in Chinese).
[17] WU L W, ZHANG Y, GUO X, et al. Reduction of microbial diversity in grassland soil is driven by long-term climate warming[J]. Nature Microbiology, 2022, 7(7): 1054-1062. doi: 10.1038/s41564-022-01147-3 [18] 吴愉萍. 基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[D]. 杭州: 浙江大学, 2009. WU Y P. Studies on soil microbial community structure based on phospholipid fatty acid (PLFA) analysis[D]. Hangzhou: Zhejiang University, 2009 (in Chinese).
[19] BALKWILL D L, LEACH F R, WILSON J T, et al. Equivalence of microbial biomass measures based on membrane lipid and cell wall components, adenosine triphosphate, and direct counts in subsurface aquifer sediments[J]. Microbial Ecology, 1988, 16(1): 73-84. doi: 10.1007/BF02097406 [20] 陈娟, 宋帅, 史雅娟, 等. 富硒农业生产基地土壤硒资源空间分布特征及评价[J]. 环境化学, 2015, 34(12): 2185-2190. doi: 10.7524/j.issn.0254-6108.2015.12.2015040302 CHEN J, SONG S, SHI Y J, et al. Spatial distribution and assessment of selenium in soils of a Se-enrich agricultural production base[J]. Environmental Chemistry, 2015, 34(12): 2185-2190 (in Chinese). doi: 10.7524/j.issn.0254-6108.2015.12.2015040302
[21] 梁若玉, 和娇, 史雅娟, 等. 典型富硒农业基地土壤硒的生物有效性与剖面分布分析[J]. 环境化学, 2017, 36(7): 1588-1595. doi: 10.7524/j.issn.0254-6108.2017.07.2016111501 LIANG R Y, HE J, SHI Y J, et al. Bioavailability and profile distribution of selenium in soils of typical Se-enriched agricultural base[J]. Environmental Chemistry, 2017, 36(7): 1588-1595 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017.07.2016111501
[22] YUAN L X, YIN X B, ZHU Y Y, et al. Selenium in Plants and Soils, and Selenosis in Enshi, China: Implications for Selenium Biofortification//Phytoremediation and Biofortification[M]. Dordrecht: Springer, 2012: 7-31. [23] 王婷. 硒对土壤微生物的影响及硒环境基准值研究[D]. 太原: 山西大学, 2020. WANG T. Effects of selenium on soil microorganisms and its environmental criteria. Taiyuan: Shanxi University, 2020 (in Chinese).
[24] Soil quality - Determination of soil microbial diversity - Part 2: Method by phospholipid fatty acid analysis (PLFA) using the simple PLFA extraction method: ISO TS 29843-2[S]. ISO, 2011. [25] BLIGH E G, DYER W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. doi: 10.1139/o59-099 [26] FROSTEGÅRD Å, TUNLID A, BÅÅTH E. Microbial biomass measured as total lipid phosphate in soils of different organic content[J]. Journal of Microbiological Methods, 1991, 14(3): 151-163. doi: 10.1016/0167-7012(91)90018-L [27] 姚晓东, 王娓, 曾辉. 磷脂脂肪酸法在土壤微生物群落分析中的应用[J]. 微生物学通报, 2016, 43(9): 2086-2095. YAO X D, WANG W, ZENG H. Application of phospholipid fatty acid method in analyzing soil microbial community composition[J]. Microbiology China, 2016, 43(9): 2086-2095 (in Chinese).
[28] 谭见安. 环境硒与健康[M]. 北京: 人民卫生出版社, 1989. TAN J A. Environmental selenium and health[M]. Beijing: People's Medical Publishing House, 1989(in Chinese).
[29] 牛忠磊, 王建, 李本玉. 山东省淄博市淄川区土壤硒水平影响因素分析[J]. 黑龙江农业科学, 2020(9): 53-56. NIU Z L, WANG J, LI B Y. Analysis of influencing factors of soil selenium level in Zichuan district of Zibo city, Shandong Province[J]. Heilongjiang Agricultural Sciences, 2020(9): 53-56 (in Chinese).
[30] 赵婉彤, 童建川, 杨剑虹. 重庆市江津区紫色土壤基本性质对土壤硒含量的影响[J]. 安徽农业科学, 2017, 45(5): 92-95. ZHAO W T, TONG J C, YANG J H. Effects of basic properties of purple soil on soil selenium content in Jiangjin district of Chongqing City[J]. Journal of Anhui Agricultural Sciences, 2017, 45(5): 92-95 (in Chinese).
[31] 张含, 龚敏, 石汝杰. 重庆市蔬菜地土壤硒含量及其影响因素分析[J]. 中国农学通报, 2022, 38(19): 114-119. ZHANG H, GONG M, SHI R J. Selenium content of vegetable soil in Chongqing and its influencing factors[J]. Chinese Agricultural Science Bulletin, 2022, 38(19): 114-119 (in Chinese).
[32] DE VRIES F T, GRIFFITHS R I, BAILEY M, et al. Soil bacterial networks are less stable under drought than fungal networks[J]. Nature Communications, 2018, 9(1): 1-12. doi: 10.1038/s41467-017-02088-w [33] 肖烨. 三江平原典型湿地类型土壤微生物学特性对土壤有机碳的影响[D]. 北京: 中国科学院大学, 2015. XIAO Y. Effects of soil microbial characteristics on soil organic carbon in typical wetland types in Sanjiang Plain[D]. Beijing: University of Chinese Academy of Sciences, 2015 (in Chinese).
[34] 赵溪, 李君剑, 李洪建. 关帝山不同植被恢复类型对土壤碳、氮含量及微生物数量的影响[J]. 生态学杂志, 2010, 29(11): 2102-2110. ZHAO X, LI J J, LI H J. Effects of vegetation restoration type on soil carbon, nitrogen, and microbial quantity in Guandi Mountain[J]. Chinese Journal of Ecology, 2010, 29(11): 2102-2110 (in Chinese).
[35] WANG X J, REN Y X, YU Z Q, et al. Effects of environmental factors on the distribution of microbial communities across soils and lake sediments in the Hoh Xil Nature Reserve of the Qinghai-Tibetan Plateau[J]. Science of the Total Environment, 2022, 838: 156148. doi: 10.1016/j.scitotenv.2022.156148 [36] YOU X X, WANG S, DU L N, et al. Effects of organic fertilization on functional microbial communities associated with greenhouse gas emissions in paddy soils[J]. Environmental Research, 2022, 213: 113706. doi: 10.1016/j.envres.2022.113706 [37] RAJAPAKSHA R M C P, TOBOR-KAPŁON M A, BÅÅTH E. Metal toxicity affects fungal and bacterial activities in soil differently[J]. Applied and Environmental Microbiology, 2004, 70(5): 2966-2973. doi: 10.1128/AEM.70.5.2966-2973.2004 [38] ROSENFELD C E, JAMES B R, SANTELLI C M. Persistent bacterial and fungal community shifts exhibited in selenium-contaminated reclaimed mine soils[J]. Applied and Environmental Microbiology, 2018, 84(16): e01394-e01318. [39] 杨善岩, 李海龙, 狄志鸿. 硒元素生理功能及微生物富硒发酵研究现状[J]. 食品工业, 2013, 34(6): 167-170. YANG S Y, LI H L, DI Z H. Research status of the physiological functions of selenium and concentrating selenium of microbe[J]. Food Industry, 2013, 34(6): 167-170 (in Chinese).
[40] 郑世学, 粟静, 王瑞, 等. 硒是双刃剑?谈微生物中的硒代谢[J]. 华中农业大学学报, 2013, 32(5): 1-8. ZHENG S X, SU J, WANG R, et al. Metabolism of selenium in microorganisms[J]. Journal of Huazhong Agricultural University, 2013, 32(5): 1-8 (in Chinese).
[41] 刘建华, 田成, 吴永尧. 微量元素硒的微生物转化研究进展[J]. 湖北民族学院学报(自然科学版), 2006, 24(3): 288-291. LIU J H, TIAN C, WU Y Y. Study progress of trace element selenium on microbial transformation[J]. Journal of Hubei Institute for Nationalities (Natural Science Edition), 2006, 24(3): 288-291 (in Chinese).
[42] 樊俊, 王瑞, 胡红青, 等. 不同价态外源硒对土壤硒形态及酶活性、微生物数量的影响[J]. 水土保持学报, 2015, 29(5): 137-141, 171. doi: 10.13870/j.cnki.stbcxb.2015.05.025 FAN J, WANG R, HU H Q, et al. Effects of exogenous selenium with different valences on Se forms, enzyme activities and microbial quantity of soil[J]. Journal of Soil and Water Conservation, 2015, 29(5): 137-141, 171 (in Chinese). doi: 10.13870/j.cnki.stbcxb.2015.05.025
[43] TURNER R J, WEINER J H, TAYLOR D E. Selenium metabolism in Escherichia coli[J]. Biometals, 1998, 11(3): 223-227. doi: 10.1023/A:1009290213301 [44] KESSI J, HANSELMANN K W. Similarities between the abiotic reduction of selenite with glutathione and the dissimilatory reaction mediated by Rhodospirillum rubrum and Escherichia coli[J]. Journal of Biological Chemistry, 2004, 279(49): 50662-50669. doi: 10.1074/jbc.M405887200 [45] 刘义, 颜承农, 宋昭华, 等. 硒的热化学研究: Ⅳ. 微量热法研究Na2SeO3对微生物生长代谢的抑制[J]. 应用化学, 1998, 15(1): 29-32. LIU Y, YAN C N, SONG Z H, et al. Thermochemical studies of Selenium: Ⅳ. Microcalorimetric study of the inhibiting action of Na2SeO3 on growth metabolism of microbes[J]. Chinese Journal of Applied Chemistry, 1998, 15(1): 29-32 (in Chinese).
-






 下载:
下载: