-
塑料被广泛应用于工业、建筑、医疗和农业生产等领域,根据组分的不同,塑料可分为聚氯乙烯(polyvinyl chloride,PVC)、聚丙烯(polypropylene,PP)、聚苯乙烯(polystyrene,PS)、聚酯纤维(polyester,PET)、聚酰胺(polyamide,PA)或聚乙烯(polyethylene,PE)等. 2020年,塑料在全世界总产量约为3.6亿吨(1950年仅为150万吨),并以每年3%的速度增长[1]. 全球每年有超过8万吨的塑料垃圾漂浮至海洋[2]. 这些塑料在环境中被物理、化学和生物作用降解成更小的塑料微粒或纤维,称为微塑料. 微塑料已经成为一类普遍的水环境污染物,分布广泛,不仅能存在淡水湖和海洋等人类活动频繁的地区,甚至是被科研人员称为地球上“最干净”的地方——南极洲[3]、以及青藏高原也有所检出[4 − 5].
目前,国内广泛关注的新污染物有4大类,MPs便是其中之一. MPs通常被界定为平均粒径小于5 mm的塑料微粒,也有不同研究表明,MPs被归类为1 μm至1000 μm[6]. MPs具有体积小、疏水性强、生物难降解等特征,易被生物体摄取并累积,危害生物体的健康甚至生态安全. MPs还可吸附其他污染物,造成更严重的毒理效应和生态危害[7 − 9]. 水环境中的微塑料可通过食物链进入到水生动物中,且具有生物富集和生物放大的作用. 研究表明,MPs可能会引起水生生物的氧化应激、免疫反应、代谢变化及细胞坏死等生物毒性效应,并可能会通过食物链富集放大,到更高营养级的生物,如海龟、水生哺乳动物和海鸟等动物[10].
斑马鱼是环境污染物毒性测试的普遍生物模型,不同发育阶段的斑马鱼经常被用于研究MPs的健康风险. 斑马鱼幼体全身透明,可通过荧光标记的MPs进行实时成像定位研究[11 − 12] ,便于观察各个组织中的MPs摄取情况. 鉴于利用斑马鱼研究MPs生物毒性效应的趋势日益显著,本文综述了现有文献的研究成果,阐述了微塑料在斑马鱼体内的累积效应,总结了MPs对斑马鱼的生态毒理学效应及毒性机制,包括生长发育毒性、运动神经与生殖系统代谢紊乱和肝脏变化等,并从三个方面对未来的研究方向提出建议.
-
呼吸和摄食是斑马鱼对MPs的主要摄入途径,不同发育阶段的斑马鱼可以通过不同的方式摄取MPs. 斑马鱼对MPs的摄取能力主要受斑马鱼的发育程度和MPs粒径的影响. 粒径较大的塑料颗粒通常只能滞留于胃肠道,粒径较小的塑料颗粒更容易累积,且容易从胃肠道转运到周边其他组织[13]. 胚胎可通过表皮接触MPs,成鱼或幼鱼可通过真皮、眼黏膜和口腔接触MPs[14]. 而Zitouni等指出,无论吸收途径如何,MPs的累积主要取决于粒径大小,较小的MPs更容易累积[15]. Kim等的研究也表明,MPs的尺寸是决定其在鱼体内累积和毒性效应最大的决定性因素,而不是MPs的类型或吸收途径[16]. 斑马鱼的绒毛膜有用于氧气和营养物质运输的孔隙,较小的MPs可以在胚胎期进入这些孔隙,大于孔隙尺寸的MPs附着在绒毛膜上,随水流进入或被幼鱼误食[17]. Duan等发现,直径100 nm的MPs可以有效地被胚胎绒毛阻断,通过口摄取、皮肤摄取与血液迁移等方式进入斑马鱼幼鱼,并在胚胎孵化时分布在肝脏和脑[18].
MPs可在斑马鱼胚胎的绒毛膜[19 − 21],卵黄囊[22]、 肌肉纤维、 眼睛和脊髓[19,23]中累积,甚至在仔鱼和成鱼的嘴[21]、 肠道[24 − 30]、 脑[20]、 血液[31]、 肝脏[27,29]、 心脏[31]、 鳃[11,27,29]和肌肉[25]等部位累积. MPs通常累积在斑马鱼的胃肠道中,部分会转移到循环系统和淋巴系统,甚至分布到肝脏和其他组织器官[32 − 33]. MPs的大小决定了它们在循环系统中的运输效率,造成不同组织的累积差异. Lu等发现MPs在组织中的生物蓄积量与MPs的大小有关,直径为5 μm在组织中的MPs的生物蓄积量是直径为20 μm的2倍,且直径5 μm的MPs能在肝组织中累积,而20 μm则不能[27]. 这与Qiao等的研究结果相似,0.1 μm MPs可累积在斑马鱼肠道、肝脏、鳃,而20 μm的MPs仅累积在斑马鱼的肠道 [29]. Chen等的研究也表明,随着塑料颗粒尺寸的减小,塑料颗粒会转运到更多组织中[25,34]. MPs在组织中的累积会对斑马鱼生长发育[35]、免疫系统[36]、氧化应激[37]、血糖水平[38]、能量代谢[37] 和其他生物反应标记物[27]产生不良影响.
MPs的粒径大小也决定能否通过斑马鱼的血脑屏障累积在脑组织,对中枢神经系统起到直接毒性作用. 斑马鱼的血脑屏障大约建立在受精后72 h[39],MPs可以进入红细胞[40 − 41],穿透血脑屏障[42],随血流进入脑组织. MPs暴露后首先在斑马鱼的卵黄囊和头部累积,随后在心包、胆囊、胰腺、肝脏和胃肠道等其他组织中累积[20]. 目前,关于MPs对不同阶段斑马鱼的毒性研究很多,但还未有系统的总结,本文梳理了微塑料对斑马鱼的累积部位及毒性效应(表1).
-
微塑料对斑马鱼的毒性效应表现在多个方面,主要包括生长发育毒性、神经毒性、生殖毒性、肠道毒性以及心脏毒性等.
-
微塑料会影响斑马鱼的生长发育及繁殖,降低胚胎的孵化率或延迟孵化,从而影响斑马鱼的存活率. Malafaia等的研究证实斑马鱼胚胎暴露于MPs后胚胎孵化率降低,幼鱼存活率也降低[35]. 斑马鱼胚胎绒毛膜可以有效屏障直径为100 nm的MPs,因此大于100 nm的MPs可吸附在绒毛膜外表面,改变绒毛膜的力学性质,导致胚胎处于低氧微环境中[18]. Ong等认为胚胎延迟孵化是MPs包裹在胚胎绒毛膜上引起,进而导致孵化酶被抑制、环境低氧和胚胎自主运动减弱等[55].
MPs对斑马鱼幼鱼具有致畸性,可引起幼鱼形态的改变. 斑马鱼幼鱼暴露于MPs可出现卵黄囊面积增加、头部高度增加,心包/卵黄囊水肿,体轴弯曲,尾部畸形,视泡面积增大[35,43]等形态改变. 斑马鱼摄取MPs后会产生饱腹感,减少营养物质的摄入,成年斑马鱼暴露于MPs(5 μm) 21 d后,发现生长缓慢[38]. 在环境中,MPs与其他污染物共同作用时,其毒性效应可能发生改变. Trevisan等的研究表明MPs和多环芳烃(phenanthrene,PAHs)共同暴露会减少斑马鱼幼体对PAHs的吸收,并减少其引起的发育畸形[12].
-
斑马鱼被广泛用于发育神经毒理学研究,斑马鱼与人类在脑模式以及多个神经和生理系统的结构和功能方面具有广泛的同源性[56], 许多发育中的人类大脑分区在斑马鱼可以识别出对应部分[57]. 中枢神经系统的功能表现为复杂的行为和认知功能改变,斑马鱼神经运动行为的研究主要包括斑马鱼的光暗刺激实验、敲击实验、旷场实验、新型水槽实验等. 斑马鱼具有空间记忆和学习能力,对应激性刺激具有高度的敏感性,表现为焦虑行为、择偶行为、侵略行为、社会行为等[58]. Sarasamma等的研究表明斑马鱼暴露于MPs后昼夜节律活动紊乱,其运动活动、攻击性、浅滩行为和捕食者回避行为均发生明显改变[37]. MPs可导致斑马鱼脑组织产生氧化应激,神经元受损,造成行为障碍. 研究表明直径20 nm的MPs可进入斑马鱼的大脑并在生物累积的脑区产生过量的活性氧(reactive oxygen species,ROS),导致行为障碍和脑损伤[43]. 斑马鱼暴露于MPs可出现癫痫发作行为[33],运动活动量减少[20,43]以及运动能力下降[21]. MPs能够穿透斑马鱼绒毛膜并被胚胎摄取,在组织中累积,显著降低幼鱼的活动能力,产生神经毒性[20]. LeMoine等对斑马鱼的神经毒性研究表明,暴露于MPs后鱼体内与神经元功能相关的基因以及神经元分化和轴突形成基因表达下调[49].
MPs可通过破坏斑马鱼体内的脂质过氧化和干扰神经相关酶而导致神经毒性. 斑马鱼暴露于MPs,可干扰鱼体内多种神经递质的传递,如乙酰胆碱、多巴胺、褪黑素、氨基丁酸、后叶加压素、催产素、5-羟色胺和Kispeptin等[59]. 在各种神经递质的传递作用中,乙酰胆碱酯酶(acetylcholinesterase,AChE)特别被用作神经毒性的主要指标,指示体内胆碱能神经的受损状况. 乙酰胆碱酯酶(AChE)对维持神经肌肉系统的正常功能很重要,它能导致乙酰胆碱(acetylcholine,ACh)的失活,而ACh对神经肌肉接头和脑突触的胆碱能神经信号传递至关重要. 有研究表明,MPs可抑制斑马鱼的AChE活性,对胆碱能神经传递产生不利影响,并导致潜在的神经和神经肌肉功能障碍[25,37]. 抑制AChE能显著增加大脑中的ACh水平,扰乱神经系统的功能. ACh在突触裂隙中的蓄积会对受体产生过度刺激,阻碍神经信号的传递,导致斑马鱼运动功能丧失和死亡[25].
-
性腺的遗传完整性是生殖成功的重要条件[60]. MPs可影响鱼类精子和卵子发生过程[61],导致生殖细胞早期死亡和DNA损伤,并将受损的基因作为缺陷基因遗传给下一代[62],产生毒性. Ma等发现MPs可以通过血睾屏障在性腺组织中累积,诱导性腺组织中的生殖细胞凋亡影响生殖活动[63]. Sarasamma等将斑马鱼暴露于MPs,发现MPs可损害卵泡的生长和功能[37]. 塑料制造行业为了增加材料的可塑性和耐用性经常使用增塑剂,一些增塑剂如邻苯二甲酸酯和双酚A,具有内分泌干扰作用,影响雌激素活性[64]. MPs在迁移转化过程中会释放出有机单体和有毒添加剂,海洋生物摄入MPs后,增塑剂在肠道中被释放[65],产生雌激素内分泌干扰作用[66].
卵黄蛋白原(vitellogenin,Vtg)在肝脏中合成分泌入血,进入发育中的卵母细胞参与卵黄囊形成,在斑马鱼的繁殖中起着重要作用[70]. Vtg可以促进MPs转移到卵母细胞,最终转移到胚胎卵黄囊[22]. MPs可干扰细胞色素P4501A1(CYP 1A1)和卵黄蛋白原相关基因(vtg 1)表达水平,影响卵子产生. CYP1A1表达下调会引起卵泡发育障碍和雌二醇(E2)合成抑制[67 − 69]. Vtg 1对水环境中外源性雌激素或抗雌激素物质暴露具有响应性,常用作鱼类雌激素效应的生物标志物. 当雄性斑马鱼暴露在雌激素样物质中时也可以合成和分泌Vtg[71 − 72]. Mak等对雄性斑马鱼暴露于MPs的急性毒性效应研究表明,MPs使斑马鱼肝脏中Vtg1表达显著上调,即雄性斑马鱼发生了雌化[33].
-
肠腔表面的黏液层能分泌黏蛋白,保护肠黏膜抵御肠道菌群侵袭[73]. MPs在鱼类肠道中累积可导致黏膜上皮损伤、通透性增加、充血性炎症等组织学改变,并引起肠道微生物菌群失调和代谢紊乱[28,53]. Lei等发现,MPs暴露会导致斑马鱼的绒毛损伤和肠细胞分裂,改变肠细胞中钙离子等离子水平,导致肠道功能障碍[51]. 通过肠道被摄入的MPs进入鱼类血液,引起局部组织炎症或过敏反应[74]. MPs可以破坏肠道黏膜细胞,影响肠道黏液的生成[50]. Jin等在关于MPs诱导斑马鱼成鱼肠道菌群失调和炎症反应的研究中,发现斑马鱼暴露于MPs后,肠道黏液体积显著增加[52]. 也有一些研究结果与之相反[75]. MPs还能减少斑马鱼杯状细胞的数量,致使黏蛋白的生成降低,导致条件致病菌生长繁殖[76]. 因此,MPs对斑马鱼肠道黏液的影响有待进一步探究. 幼鱼暴露于MPs后,体内脂肪储量的减少表明其营养不足[14]. 纤维状的微塑料暴露可引起肠道形态变化,包括肠黏膜和肌层厚度减少和异常空泡化,这些通常与营养缺乏和饮食改变有关[77 − 78].
MPs通过摄入累积在肠道,并通过粪便排出[75],其肠道累积和充血程度与MPs的暴露浓度呈正相关. 肠道的损伤程度主要受MPs大小的影响,而不是化学成分[51]. 微塑料纤维对斑马鱼幼鱼和成鱼的肠道损伤具有浓度和长度依赖性,可产生氧化应激、炎症和脂质耗竭等反应. 与短的微塑料纤维相比,长的微塑料纤维可以显著减少斑马鱼的摄食量. 纤维越长,浓度越高,造成的肠壁细胞液泡化和物理损伤越严重[14]. MPs的形状也影响斑马鱼肠道的组织学损伤程度,微塑料纤维导致的肠道毒性比微塑料碎片和微珠更严重[28].
-
MPs可在斑马鱼心包内高度累积,导致心率改变,引起心脏毒性. MPs通过扩散或黏附作用进入细胞内,直接接触细胞内的蛋白质、细胞器和DNA[41],可通过与心脏肌节相互作用或氧化应激机制影响心率[20]. Duan等发现斑马鱼胚胎暴露于MPs 24 hpf后,心率显著加快,可能由于聚苯乙烯微塑料颗粒附着在胚胎绒毛膜上导致胚胎内部的缺氧微环境[18]. Pitt等发现暴露于MPs的斑马鱼幼鱼心率显著降低,浓度为0.1、1、10 mg·L−1的MPs暴露组心率分别下降5%、8%和10%,呈剂量依赖关系[20]. 研究表明心动过缓可能由于聚苯乙烯微塑料颗粒进入心肌细胞与肌节相互作用导致心功能改变[41].
-
微塑料可诱导斑马鱼肠道炎症、肠道菌群失调、氧化应激以及代谢紊乱[53]. 微塑料和其他有机污染物的共同暴露会导致斑马鱼对有机污染物的积累增多,导致更严重的氧化损伤,从而刺激免疫功能,改变肠道微生物组成,对斑马鱼的健康造成危害. 研究表明微塑料和部分有机污染物之间具有协同毒性作用[79].
-
MPs暴露后在鱼类的组织中累积,通过物理和化学作用引起氧化应激,例如肠梗阻和内分泌紊乱[80]. MPs对鱼类细胞的毒性主要是由氧化应激引起的,包括氧化还原平衡紊乱、细胞器的受损和过多ROS的产生[81]. 当抗氧化防御系统紊乱时,过量的ROS参与多种细胞信号通路的激活,引起其他病理生理反应,如细胞自噬、DNA氧化损伤、细胞凋亡[82 − 83]和炎症反应[84 − 85]等. ROS可导致线粒体DNA突变,抑制线粒体氧化磷酸化,致使与能量代谢相关的ATP水平显著下降. Trevisan等通过研究MPs暴露后斑马鱼线粒体的能量产生过程,发现斑马鱼胚胎或仔鱼ATP/ADP比值减小,即NADH产生增加(可能由于微塑料引起线粒体功能障碍减缓了电子传递链对NADH的消耗并随时间累积或机体的代偿机制),ATP合成减少即机体能量产生减少,进而影响生长发育[12].
MPs通过影响斑马鱼体内的抗氧化应激酶的活性,破坏ROS产生和抗氧化损伤之间的抗氧化平衡,导致氧化损伤. 轻微的氧化应激会诱导抗氧化酶的活性[86]. 然而当氧化应激达到一定程度时,抗氧化酶的活性将受到抑制[87]. 抗氧化应激酶通常指超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽-S-转移酶(GST)、还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GPX)和谷胱甘肽还原酶(GR),这些酶是衡量生物体内氧化应激的重要生物标志物[88]. SOD是鱼类对氧化应激的主要防御机制, CAT是将过氧化氢转化为水和氧气的酶[89]. GST参与多种细胞毒性物质的解毒、细胞免受氧化损伤的防御以及脂质、血红素和类固醇等物质的运输[90]. GPX和CAT一样都是通过分解活性物质保护细胞免受过氧化的酶,GSH是小分子抗氧化剂,可作为GPX的底物,阻止自由基和ROS的过量产生成,并抑制它们与DNA、蛋白质和脂类的反应[91]. Umamaheswari等的研究表明MPs暴露会导致斑马鱼中GPX活性降低,阻止过氧化氢转化为无毒的羟基底物,导致组织中ROS的蓄积[92]. 将斑马鱼96 hpf幼鱼暴露于100 μg·L−1和1000 μg·L−1的MPs后,CAT的mRNA的表达显著上调, GPX活性升高、GR活性降低[21]. 而Parenti等将72 hpf的斑马鱼胚胎暴露于浓度为1 mg·L−1的MPs时,结果表明SOD、CAT和GPX活性无任何显著变化[46]. Lu等研究发现直径5 μm的MPs导致斑马鱼肝脏中SOD和CAT的活性显著提高,并呈剂量依赖关系[27],Wan等则表明 MPs(5—50 μm)对斑马鱼幼鱼的CAT活性有明显的抑制作用,GSH的含量显著下降[48].
肠道损伤与肠壁细胞发生的氧化应激有关,慢性氧化应激可引起各种肠道损伤,如炎症反应和肠壁通透性改变等. 鱼类组织中ROS水平的增加会引起氧化应激,导致炎症反应和细胞死亡[93]. 研究表明MPs会增加肠道中ROS的产生, 同时SOD和IL-1α的水平会提高,诱导了明显的氧化应激和炎症反应[14]. Lu等的研究发现微塑料和镉(Cd)的共同暴露会增加斑马鱼的氧化应激和炎症反应[94].
-
斑马鱼暴露于MPs后,会引起血糖、胆固醇和总蛋白水平的变化,导致斑马鱼的血糖、脂肪代谢和氨基酸代谢功能紊乱[49,53]. MPs可以与质膜、溶酶体、细胞骨架(肌动蛋白)和代谢相关蛋白(细胞色素P450酶)相互作用并破坏它们[95]. 长期暴露于MPs可导致斑马鱼肝脏葡萄糖代谢受损,血糖显著升高,其糖代谢、脂肪代谢和氨基酸代谢途径相关基因的表达水平均下降[38]. Wan等发现MPs暴露会引起斑马鱼幼体糖酵解和脂肪代谢相关基因的变化[48]. Veneman等将MPs显微注射到斑马鱼卵黄囊后,发现参与脂质代谢的多个核受体表达上调[31]. Duan等发现胚胎暴露于聚苯乙烯微塑料颗粒时,不饱和脂肪酸、亚油酸和丙氨酸的生物合成途径以及天冬氨酸和谷氨酸的代谢途径发生广泛变化[18]. 有研究表明,因炎症反应和刺激,谷草转氨酶(AST)和碱性磷酸酶(ALP)由肝细胞入血,MPs导致斑马鱼AST和ALP的水平显著升高[96].
有研究表明微塑料会造成斑马鱼多种组织学改变,如肝细胞坏死和脂肪浸润,并引起肝脏炎症反应和脂质堆积[27]. 脂质很容易被氧化,长期的氧化应激和炎症可损害脂质代谢[97]. 脂质过氧化物(LPO)升高表明发生了氧化应激和脂质损伤,暴露于MPs的斑马鱼体内ROS和LPO显著增加[92]. 这表明肠道损伤可能由MPs暴露导致的脂质过氧化引起,这与斑马鱼暴露于MPs后,氧化应激诱导LPO的产生是组织中的显著特征的结论相一致[98]. 丙二醛(MDA)被用作LPO的生物标记物,因为它是脂质氧化损害后的最终产物[99] .
斑马鱼暴露于不同浓度的MPs会产生肠道损伤[27 − 28,36,51],肠道损伤通常与肠道炎症和细胞因子表达水平的变化有关. 肠道炎症与肠道微生物区系失衡密切相关[53],引发肠道通透性的变化. 斑马鱼暴露于MPs后,与新陈代谢、疾病和炎症密切相关的细菌发生改变, 拟杆菌门[48,52]和变形菌门[48,52 − 53]显著减少, 梭杆菌门[52 − 53]和厚壁菌门[48,52]显著增加. 许多研究评估了不同类型、大小和形状的微塑料的风险,强调肠道微生物区系失调与肠道毒性之间的联系[36,50,100]. 暴露于MPs可增加斑马鱼肠道菌群的多样性,且不同浓度的MPs引起肠道菌群在门和属水平上的反应不同[75]. 斑马鱼幼体暴露于MPs (5 μm和50 μm,1000 μg·L−1,持续7 d)导致肠道微生物丰度下降,并产生属水平丰度的显著变化[48]. 另一项研究分析了低剂量MPs微球(5 μm、50 μg·L−1和500 μg·L−1,持续21 d) 对斑马鱼肠道菌群的影响;结果显示菌群多样性减少,梭菌丰度增加,变形杆菌丰度降低[53]. 也有研究评估了MPs纤维对斑马鱼肠道菌群的影响,暴露在10 μg·L−1的微塑料纤维(20—100 μm)中21 d,导致斑马鱼细菌多样性减少和某些菌群的变化(变形杆菌增多,放线杆菌减少)[28]. 肠道菌群的失调会破坏肠黏膜屏障功能和免疫稳态之间的平衡,引发炎症反应[53,101].
-
MPs能跨越生物屏障进入循环系统,导致机械破坏和能量储备减少,从而影响免疫系统[59]. 被鱼类摄入的MPs可能与肠道组织相互作用并转移到循环系统,导致免疫反应的调节受损[102]. 研究表明,MPs可以影响斑马鱼的先天免疫系统和获得性免疫系统功能. PEI 等证实了MPs可以改变斑马鱼肠道微生物区系的丰富度和多样性,引起强烈的氧化应激,破环先天性免疫系统[100]. 补体系统是先天性免疫系统的一部分,可攻击病原体的细胞膜以清除病原体,MPs通过激活补体系统引起免疫反应. 经MPs暴露的斑马鱼幼体,与免疫反应相关的信号通路被激活,补体替代途径基因(如CFHL3、CFHL4、CFb和C9)表达上调[31]. 在MPs暴露后斑马鱼产生的免疫反应多种多样,如溶菌酶、中性粒细胞、过氧化物酶、吞噬作用和免疫球蛋白等. Gu等发现斑马鱼暴露于MPs后,吞噬、趋化和整合素介导的信号通路的功能改变,细胞色素B-245β链(Cybb)、组织蛋白酶S(Ctss)、整合素亚单位β2(ITGB2)表达下调,主要组织相容性复合体(MHC)表达上调[50].
鱼类中的免疫球蛋白IGZ/IGT的功能类似于哺乳动物中的IgA,可以快速有效地消除特定的病原体,在黏膜免疫中发挥着重要作用[103]. 黏膜免疫球蛋白(哺乳动物的IgA;硬骨鱼的IGZ或IGT)的产生是由食物抗原和肠道微生物区系引起的,有助于建立和维持与微生物区系的有益互动[104 − 105]. 由于水环境的原因,大量的微生物不断刺激鱼类的黏膜屏障. 免疫球蛋白在硬骨鱼(IGT)和哺乳动物(主要是IgA)之间进化保守性高,维持共生微生物群落以抵御病原体[106]. 斑马鱼暴露在浓度为500 μg·L−1的MPs后,影响肠道免疫网络产生IgZ,这可能产生促炎细胞因子,吞噬微生物区系,并启动免疫反应[50]. 溶菌酶是一种由白细胞释放的具有抗生素特性的酶,是先天免疫系统的重要防御分子,可介导阻止微生物的入侵,并且经常被用作非特异性免疫功能的指标[107]. Limonta将斑马鱼暴露于MPs(PS和PE)后,观察到斑马鱼的免疫反应显著增强,溶菌酶和中性粒细胞含量增加[36].
斑马鱼的免疫系统有许多细胞因子,维持其体内的稳定环境,是免疫系统的重要组成部分. 微塑料可以特异性改变巨噬细胞溶酶体和细胞表面受体信号转导过程[50],影响相关细胞因子的基因表达. MPs是潜在的免疫刺激剂,以粒径大小依赖和浓度依赖的方式诱导细胞因子和趋化因子的产生. 研究表明,暴露于1000 μg·L−1直径0.5 μm聚苯乙烯的斑马鱼,肠道中与先天性免疫系统相关的细胞因子(IL-1A、IL-1B和IFN)的mRNA水平和蛋白质含量显著增加,产生炎症反应[52]. 在正常情况下,肠道微生物区系和宿主免疫系统之间保持着良好的平衡关系. 当肠道微生物区系失衡时,内毒素可诱导IL-10、IL-15、CXCL12或CXCR4等炎性因子表达增加,这些炎性因子可抑制革兰氏阴性杆菌的生长和扩散[108 − 110]. 暴露于MPs后,斑马鱼体内编码IL-1B的基因表达上调,不同组织(肝脏和肠道)的炎症反应增加[21,27 − 28,51,53]. 暴露于高密度PE和PS颗粒会降低免疫基因白三烯B4受体(ltb4r)和干扰素诱导的跨膜蛋白(ifitm1)的肝脏转录水平[36]. 环氧合酶(COX) 参与前列腺素的合成,与炎症反应密切相关. 将斑马鱼胚胎暴露于MPs后,COX活性显著降低[46].
-
微塑料通过影响斑马鱼体内ROS代谢,引起细胞凋亡,进而导致胚胎或幼鱼畸形的增加[111 − 112]. MPs累积在斑马鱼幼体大脑区域,存在ROS诱导的DNA氧化损伤和细胞凋亡[43]. MPs诱导斑马鱼产生剂量和时间依赖的ROS介导的细胞凋亡反应,P53、Gadd45ba和casp3b基因表达上调[100]. P53基因通过Casp3b和Gadd45ba的激活[113 − 114]以及ptgs2a的表达(斑马鱼中的一种炎性生物标志物)传递信号来刺激细胞凋亡. P53基因激活与细胞凋亡相关的分子(如Bcl2/Bax或细胞色素c)触发caspase信号通路[115],诱导细胞凋亡. Gadd45ba基因与对任何化学或环境应激源的应激反应有关,可引起DNA损伤、细胞凋亡、甚至生长停滞[116].
-
塑料污染问题日益突出,近几年关于微塑料的研究爆炸性地增加,主要集中在环境迁移转化及生态毒理效应. 在生态毒理方面的研究较多集中在工业微塑料标准品对生物的毒性影响,仅有少数研究探究了环境微塑料对鱼类的毒性效应. 环境微塑料相比工业微塑料制品对生物体的毒性影响更为复杂,微塑料的粒径大小、浓度、表面老化程度及添加剂的浸出都是影响生物毒性的重要因素. 此外,水生态系统中存在多种环境污染物,微塑料可以吸附持久性有机污染物、重金属以及微生物,引起生物富集和生物放大,对生物体本身及生态环境存在较大的危害性风险. 目前,微塑料吸附污染物的研究大多数集中在重金属上,且关于微塑料与POPs的吸附解析与复合毒性效应研究较为单一,主要在抗生素及阻燃剂等方面有所涉及,有待进一步探索;塑料添加剂的浸出及生态毒性研究也较为匮乏,因此今后应在以下三个方面有所侧重:(1)环境微塑料及添加剂浸出的生态毒理效应及作用机制;(2)模拟环境老化过程,探讨环境老化及老化过程中添加剂的浸出及其相关毒性机制;(3)微塑料与POPs的复合毒性及作用机制.
微塑料对斑马鱼的毒性效应及机制研究进展
Research status of microplastics for zebrafish on the toxicity and mechanism
-
摘要: 塑料污染已成为全球性重大环境问题,受到国际的广泛关注. 2022年,我国将微塑料(microplastics,MPs)列为四大新污染物之一. MPs是指直径小于5 mm的塑料颗粒,具有生物毒性、环境持久性、生物累积性等特征,其生产和使用与人类生活息息相关,对生态环境和人体健康存在较大风险. 在水环境中,MPs易被水生动物摄取产生毒性效应,并沿食物链富集和放大. 斑马鱼是被广泛使用的毒理学模型,具有成本低、产卵率高、易饲养等特点,与人类的基因序列有很高的同源性. 本文综述了国内外文章,阐述微塑料在斑马鱼体内的富集情况,归纳了微塑料对斑马鱼的生物毒性效应,总结了微塑料对斑马鱼的毒性作用机制,并从三个方面展望了未来的研究方向,为进一步开展微塑料的生物毒性效应、机制研究以及生态风险提供理论支撑和参考.Abstract: Plastic pollution has grown into an important worldwide environmental issue, attracting broad international attention. In 2022, Microplastics (MPs) were classified as new pollutants in China. MPs are plastic particles with a diameter of less than 5 mm that are biotoxic, ecologically persistent, and bioaccumulative, and their manufacturing and usage are inextricably linked to human existence, providing a larger risk to the natural environment and human health. MPs are hazardous to aquatic creatures and are enhanced and amplified along the food chain in the aquatic environment. The zebrafish is a popular toxicological model due to its cheap expense, high spawning rates, ease of raising, and high degree of similarity with human DNA sequences. This paper reviews domestic and international articles, describes the enrichment of microplastics in zebrafish, summarizes the biotoxic effects of microplastics on zebrafish, concludes the mechanism of toxic effects of microplastics on zebrafish, and outlines future research directions from three perspectives, providing theoretical support and reference for further research on the biotoxic effects, mechanism, and ecological risks of microplastics.
-
Key words:
- microplastics /
- zebrafish /
- toxicity /
- mechanism.
-
近百年来,工业水平高速发展,水源污染形势日益严峻,人类社会对饮用水质量的要求日趋严格。在饮用水净化处理过程中,以增加铝盐混凝剂投加量为主要手段的强化混凝技术已成为高效去除水体污染物的主要方式,但与之带来的出厂水中铝残余量显著增加的现象难以避免。此外,近年来大量开展的黑臭水体治理等水环境修复工作,也涉及铝盐混凝剂净化天然水体、处理剩余污泥等方面的应用,增加了水环境中铝残留的环境健康风险[1-2]。
残余铝作为此过程中不可避免的次生污染物,具有强烈的化学活泼性和生物有效性[3]。在人体中积累可导致语言表达能力丧失、记忆能力退化、骨质疏松软化、肝肾功能失调,诱发血液疾病、心血管疾病、阿尔茨海默病、肾衰竭及尿毒症等[4]。研究表明,铝的生物毒性不仅取决于铝的残留浓度,更与其赋存形态密切相关[5]。相关研究大多从剂量-效应角度评价残留铝的毒性特征,鲜有研究探讨不同形态羟基铝团簇的毒性效应。近二十年来,随着低浓度羟基铝团簇形态识别技术的日益成熟[6],铝离子向纳米聚合形态转化的过程逐渐清晰[7]。然而,受低浓度铝形态鉴定、解析技术瓶颈限制,以及受纳米铝团簇赋存形态和转化机制复杂性的影响,纳米羟基铝团簇的致毒过程和机理是否类似于传统单体铝(如Alm)、低聚体铝絮凝剂,纳米残余铝团簇毒性效应特征与其团簇形态的响应关系等依然不清[8]。
本文以残余铝团簇为主要对象,在归纳铝残留途径的基础上,对目前关于铝无机单体态(Alm)和纳米多核形态(Al13)的毒性效应研究进行综述,分析不同残余形态铝的毒性效应特征和影响因素,以期为优化控制混凝工艺中铝的投加和残留控制,确保水生态环境安全提供参考。
1. 残余铝来源及特征(Sources and characteristics of residual aluminum)
1.1 铝的残余控制标准
正常人体含铝量是50—100 mg。每天摄入铝量平均为35 mg,大部分随粪便排出体外,但仍有1%—2%的铝经肠道吸收进入人体并难再从体内排出,被吸收蓄积于肺、骨骼、肝、脑、睾丸等内脏中[9-11]。许多国家、地区和卫生组织都对饮用水中残留铝的含量制定了限制标准[12-14](表1)。2006年我国颁布实施了新的《生活饮用水卫生标准》(GB 5749-2006),要求饮用水中的残留铝含量不大于0.20 mg·L−1[15],然而大量调查表明,我国部分地区生活饮用水铝含量依然超标严重[16-19]。
表 1 国内外生活饮用水铝残留标准 (单位: mg·L−1)Table 1. Standard for residual aluminum concentration in drinking water (Unit: mg·L−1)世界卫生组织World Health Organization 欧共体European Community 日本Japan 美国America 前苏联Former Soviet Union 中国China 残留铝浓度标准Standard of residual aluminum concentration 0.20 0.20 0.20 0.05 0.50 0.20 1.2 残余铝的来源与残留途径
人体内的铝主要来源于饮用水和食物。早在1989年,世界卫生组织便已将铝确定为“食品污染源之一”而加以控制。探明残余铝的来源是控制残余铝、明确其毒性的重要前提。长期以来,人体中过量的铝来源归因于炊具、食物及药品,而对于饮用水这一重要的铝来源缺乏关注。
水源水中铝的来源主要集中在以下3个方面:
(1)酸性降水溶出。在天然水体条件下,水中溶解态铝浓度通常少于0.1 mg·L−1。受全球气候变化影响,部分地区酸性降水增多,土壤、矿物、岩石中的铝不断释放[20]。
(2)人类活动排放。受人类活动影响,采矿、冶炼、化工、制药等行业含铝废水大量排放,致使水环境中的铝残余量明显增加。
(3)天然水环境修复及应急事件中的铝残留。我国80%以上的城市河道受污染,其中大部分已演变为黑臭河道,成为我国当下亟待解决的水环境问题[21]。采用强化混凝方法处理水环境突发事件及城市河道黑臭水体问题,所投加混凝剂的剂量大、浓度高(500−800 mg·L−1),致使大量铝盐残留在水体中[22].
在水处理环节,残余铝主要来源于铝盐絮凝剂的投加尤其是粗放投加。全球范围内约80%的水处理工艺使用聚合氯化铝(PACl)和硫酸铝 [Al2(SO4)3] 等铝盐混凝剂[4,23],其中聚合氯化铝因其优良的絮凝性能作为主流药剂被国内外广泛使用[24-25]。受水源水质不稳定、环境因素季节性波动等影响,混凝剂的非精准投加或过量投加直接导致出厂水中铝浓度超标。研究表明,水源水中的铝和投加混凝剂引入的铝在经混凝、沉淀、过滤、消毒等工艺后仍有约11%残留于出厂水中[16]。已有研究表明,全国40座城市中有5%的城市自来水中铝浓度超标,东北地区超标城市高达76.9%[17]。此外,大量富含铝的水处理污泥直接排入地表水体,也将加大地表水铝残余浓度。地表水的年均铝浓度及羟基铝、单体铝的浓度显著高于地下水[26]。
在输配水环节,给水管网中铝的转化溶出也是残余铝的重要来源[27]。给水和排水管道的主要材料(水泥、混凝土和陶土)中含有一定量的铝,在低pH、低碱度、低钙含量时溶出严重[28-29]。此外,管网中长期沉积铝在水动力、离子强度、水源切换引发pH变化等影响下,也会发生铝形态转化释放。
2. 单体及多聚态残余铝毒性效应(Toxic effects of monomeric and polymeric aluminum)
2.1 残余铝毒性表现形式
2014年,英国水文与生态中心评估了金属对水生生物的潜在危害程度,提出铝位居第二,仅次于铜[30],且鱼类比水生无脊椎动物对铝的毒性更为敏感[31]。当铝浓度达到3.7 μmol·L−1(100 μg·L−1)以上时,水生生态系统的生物多样性出现下降,并导致生物的活体神经组织发生病变[23]。然而,以往研究主要侧重于土壤中铝对植物的毒害作用。目前认为,铝离子的有害作用主要来自其对植物根生长细胞分裂的抑制作用。铝胁迫下的植物根毛、次生根减少,影响根系对水分和营养物质的吸收,同时降低光合作用。除此之外,植物细胞内离子态的铝可以鳌合有机酸、脱氧核糖核酸、三磷酸腺普等重要生物分子,干扰植物正常代谢活动[32]。
(1)铝的神经毒性
对于许多参与糖酵解和基础代谢的酶,铝通过抑制其活性进而引发神经系统疾病[33]。在活体组织中,铝通过对磷酸肌醇和胞内钙离子的干涉而影响细胞的基础功能,对次级信使系统发生抑制作用进而干扰神经系统,可使因年龄增长而导致的新陈代谢变化提前发生[34]。脑组织中铝含量虽相对较低,但可影响大脑中基础三羧酸循环代谢中相关酶的活性,引起透析性脑病或透析性痴呆,现称阿尔茨海默征[35]。临床实验证明,铝可明显降低脑组织中神经原纤维缠结附近乙酰胆碱脂酶的活性[36-37]。挪威、瑞典、英国、加拿大、瑞士和法国的13个关于阿尔茨海默症研究结果发现,饮水中铝含量与阿尔茨海默症的发病存在显著相关性[38]。患者大脑内有30%新皮层区的铝浓度大于4 μg·g−1(干重),脑部神经元细胞核内的铝比正常人高4−30倍[39]。X射线光谱分析发现,阿尔茨海默病患者脑内海马神经纤维的变性病灶中有铝的沉淀。长期口服氢氧化铝凝胶等铝制剂的病人,可引起血铝浓度增高,进而引起智力障碍。大鼠中枢神经病理形态学研究发现,铝可引起大脑顶叶、小脑及与学习记忆密切相关的海马神经元细胞数目减少[39]。除此之外,铝也可以直接或与运铁蛋白及其受体结合使血脑屏障通透性增加[40]。
(2)铝性骨病。
铝与骨骼疾病尤其是骨质疏松间的关系不可低估。生物体内富集的铝会竞争性地抑制钙的吸收并导致相关功能酶失活[41]。与部分重金属一样,过量摄入铝会造成铝在骨骼类骨质中大量沉积并置换出钙,引发铝骨病,临床表现为广泛的骨及关节疼痛、骨质疏松软化、骨骼系统发育不良。研究证明,小肠可吸收病人含铝磷盐结合剂药物中的铝,服用该药的患者滑膜腔内铝含量较不服用的患者高2−10倍,并可引发肋骨、股骨颈、脊椎和股骨干附近的近端肌无力和复发性骨折,还可诱发骨骼变形[32, 42]。进入骨中的铝可降低甲状旁腺激素浓度,并结合胶原蛋白沉积于骨基质中,抑制成骨细胞和破骨细胞的增殖和功能,形成骨内结晶[37, 43]。
(3)血液和心血管疾病
铝含量增加将影响生成红细胞,并干扰血红素合成相关的酶,导致可逆性巨幼红细胞性贫血。研究表明,铝可抑制大鼠的骨髓造血功能,致大鼠贫血,使红细胞膜的流动性下降并影响红细胞膜蛋白百分含量和分子量[44]。临床实验证实,透析脑病综合征患者的透析水及血浆中铝含量显著高于无透析性脑病综合征患者,有全身不适、呕吐、体重减轻、肌肉疼痛等迹象[45]。
(4)肝脏疾病、肾功能失调、肾衰竭及尿毒症
具有骨重塑低下、甲状旁腺素低下的病人,包括甲状旁腺切除患者、肾移植排异使用皮质激素治疗患者、糖尿病患者、二羟胆骨化醇治疗患者和双侧肾切除的患者,对铝毒性作用的更加敏感[46]。终末期肾病患者铝的排泄受阻,铝在体内的蓄积作用增强,使其体内铝含量较正常人高20倍[46]。
(5)生殖毒害
铝对生殖系统和胚胎发育也有一定毒害作用[47-48]。当铝含量与体重之比大于1.5 mg·kg−1时,磷化合物的代谢将被破坏,可能导致体内硫酸盐过量流失。连续摄入剂量达17—50 mg·kg−1体重时,铝对性腺有毒害作用[32,49-50]。铝盐溶液对大鼠胚胎生长发育和器官形态存在影响,导致胚胎畸形[11]。
铝的致毒机理大多与置换反应有关,即通过置换作用取代生物体内原有必需金属或酶活性中心如Fe3+、Ca2+、Mg2+、-SH的位置,这与铝金属元素的性质密切相关[8, 51]。如在类骨质中置换出钙而导致骨生成抑制,在卵母细胞中置换镁离子从而使小鼠生殖细胞及骨髓细胞染色体畸变率提高等。
整体而言,铝属于非急毒、非极毒物质,但其危害是潜在的、长期的、不可逆转的,是不可忽视的。
2.2 铝团簇与单体铝毒性差异
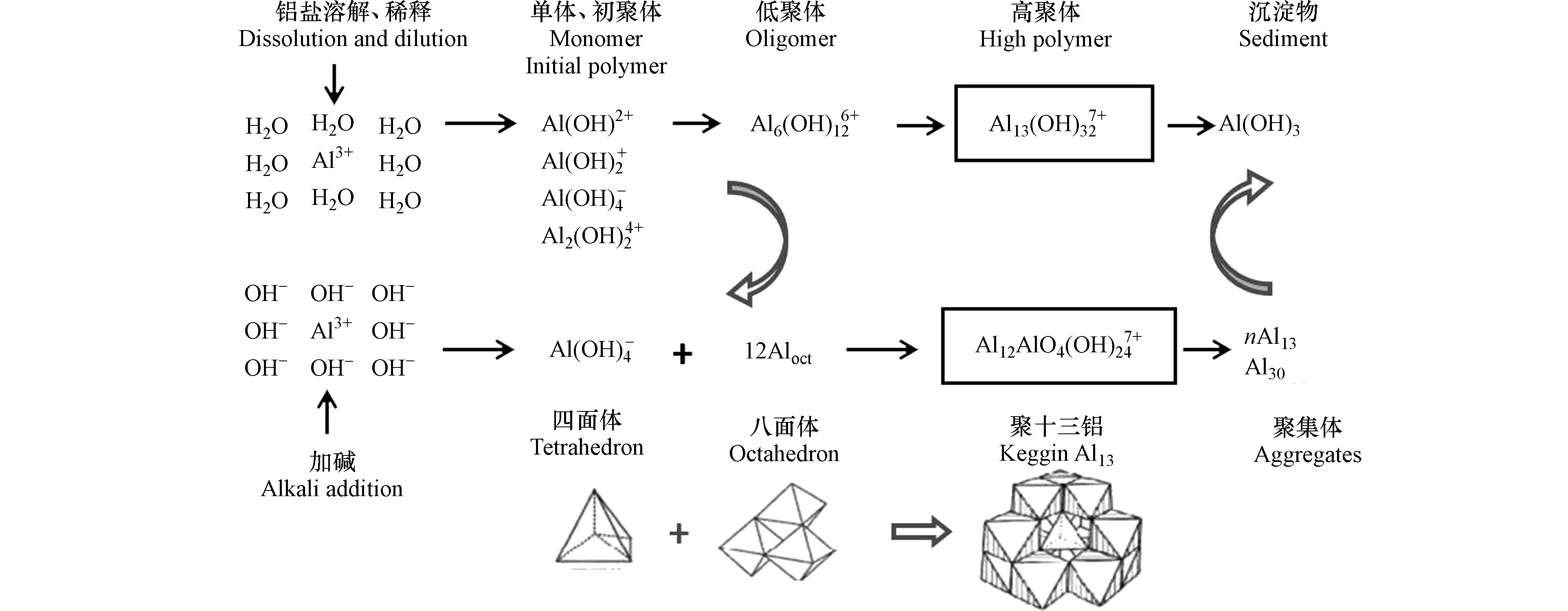
大量研究表明,残余铝毒性特征与其残留形态密不可分。国内外很多学者如汤鸿霄、毕树平、Bertsch、孙忠、Casey、Johansson 等开展了大量研究,提出和验证了铝团簇形态、结构特征及转化模式[52]。整体而言,水中残余铝形态复杂多样,以双水解模式(图1)相互转化,并以单体Alm及多聚体态Al13等主要形态存在。
(1)无机单体铝形态 (Alm)。
铝在水溶液中很活泼,以Al3+、A1(OH)2+、A1(OH)2+等多种离子态存在,水解过程十分复杂。以往研究普遍认为,游离态的铝离子Al3+是人体、动物或植物体中毒性最高的形态[54]。表2给出了无机单体铝离子生物毒性研究现状。单体态残余铝对人脑中脂质过氧化反应的促进作用是铝作为慢性蓄积性神经毒素发挥毒性作用的重要机制[18]。AlCl3染毒大鼠12周后发现随染铝剂量的增加,大鼠学习记忆能力下降,脑组织中丙二醛(MDA)含量显著升高,超氧化物歧化酶(SOD)活力下降,谷胱甘肽(GSH)含量和谷胱甘肽过氧化物酶(GPX)活力先上升后降低[55]。水中离子态铝含量高于0.2—0.5 mg·L−1可使鲑鱼致死。将三氯化铝溶液注入猫的脑海马或脑室内,一周之后,出现明显的脑功能障碍,即记忆力减退、行为障碍,并且海马及脑皮质出现神经原缠结[44, 54]。暴露于亚急性(每日摄入三氯化铝1 g,10 d)和慢性(每日摄入三氯化铝0.03 g,4个月)饮食摄入强度下,老鼠神经突触中铝富集率分别为45%和59%。此外,亲水区域的流动和突触前膜的CH/PL(胆固醇/磷脂)摩尔比的下降伴随着无机铝离子的积累而出现[39]。
表 2 无机单体铝离子生物毒性研究现状Table 2. Research status of biological toxicity effects of inorganic mononuclear Al赋存形态Speciation 浓度Concentration 受试生物Organisms 测试指标Indexs 暴露时间Exposure time 结果Results 文献References AlCl3 2 mg·kg−1 大鼠 记忆能力脂质过氧化反应 84 d 记忆力下降MDA↑ SOD↓ [55] AlCl3 430 mg·L−1 大鼠 血浆Al、转铁蛋白(TF)、可溶性转铁蛋白受体(sTfR)含量及总铁结合力(TIBC) 120 d 体重抑制干扰体内铁代谢 [44] AlCl3 1 g 大鼠 富集率 120 d 45% [39] 0.03 g 大鼠 富集率 120 d 59% AlCl3 6.53 mg·L−1 鳟鱼 鳃组织损伤 96 h 渗透调节紊乱酶活↓ [32] AlCl3(矿山废水) 0.2 mg·L−1 枝角类植物 急性毒性(致死率) 24 h 与离子交换位点结合 [56] AlCl3 3 g·L−1 蛋白核小球藻 生物累积生长抑制 24 h 低pH下毒性↓ [57] (2)多聚体铝团簇形态。
聚合氯化铝(PACl)是在传统硫酸铝盐混凝剂基础上发展起来的新型高效絮凝剂。PACl中最佳凝聚絮凝形态—纳米Keggin Al137+(即Al12AlO4(OH)247+)较单体铝Alm具有更好的除浊、除腐殖酸、脱色效果和更强的电中和能力而被广泛使用。Al13及聚集体投入水中后,可在一定时间内具有稳定性而保持其原有形态[58]。此外,其他各形态残余铝可随水体pH、微界面共存等理化条件变化尤其是在黏土微界面促发下发生形态转变,转化为较为稳定的Al13[7,59-60](图1,双水解模式)。有研究报道,具有适度酸性的河流和湖泊以及某些酸性物质流过的地下水域可形成All3[61],且已被证明在人的脑突触中存在[62]。
迄今为止,基于Alm和Al13毒性效应之争尚无定论。传统观念中流行的、垄断性观点是单体铝毒性高于多聚体态铝,铝的有机配合物低毒或基本无毒[63],也有研究认为有机配体会促进铝在血液中的吸收[39]。近年来,越来越多研究表明多聚体态Al13对生物和人体毒性风险远高于Alm。非单体铝的生物毒性研究现状如表3所示。与Alm单体相比,Al13对海藻类植物的毒性更大[57]。Al13对大豆根尖的毒性比Alm高10倍[64]。有研究者探讨了nano−Al13及Alm对于苹果酸脱氢酶活性、谷氨酸脱氢酶活性、谷胱甘肽还原酶活性、还原型谷胱甘肽和血红蛋白的影响。结果表明,纳米Al13较低电荷单体铝表现出更强的毒性效应,并提出这可能与团簇铝比表面积较大有关[51,65-67]。
表 3 非单体铝的生物毒性研究现状Table 3. Biological toxicity effects of no-nmonomeric Al species赋存形态Speciation 浓度Concentration 受试生物Organisms 测试指标Indexs 暴露时间Exposure time 结果Results 文献References Al13、Al3+ 0.01 m mol·L−1 体外 苹果酸脱氢酶MDAH 50 s 毒性作用Al13>Al3+ [65] 0.1 mol·L−1 体外 还原型谷胱甘肽GSH 50 s [66] 0.25 mol·L−1 烟酰胺腺嘌呤二核苷酸构象 谷氨酸脱氢酶谷胱甘肽还原酶GR 50 s [51,67] Al13、Al3+ 0—100 μmol·L−1 大豆 根尖红细胞 12 h 毒性作用Al13>Al3+ [64] Al2O3 50—200 μm3000 mg·kg−1 蚯蚓 繁殖和行为 28 d 回避行为繁殖未减少 [68] 11 nm3000 mg·kg−1 蚯蚓 繁殖和行为 28 d 回避行为繁殖减少 [68] Al(OH)3 50 mg·L−1 鲑鱼 慢性毒性 28 d 慢性中毒 [69] 此外,多聚体铝团簇同时具备纳米颗粒效应。目前,针对纳米级铝化合物的研究主要关注纳米氧化铝(Al2O3)。纳米氧化铝对各生物主要脏器均有损害作用,肝、肾、脾为主要损伤器官,炎性细胞的浸润可能是其损伤机制之一[68]。作为高效混凝形态,溶解态纳米铝团簇尤其是Keggin结构的Al13成为关注焦点和研究热点。Al13粒度被鉴定为约2 nm,相互之间会结合成线性及枝状的Al13聚集体,其大小为几十或几百纳米[70]。Al13具有纳米尺度、高电荷(+7)、表面多羟基多活性位点、结构稳定等特征,在工业、生物医药制品方面均有应用,也可用作分子筛、电子元件、离子交换剂等。nano−Al13在水中具有较强的吸附、絮凝、络合、沉淀等物理化学性能,其结构和功能区更为规范和集中,微界面特性也更加突出,其生物可利用性及生物毒性机制极大可能不同于常规纳米颗粒物和单体铝离子,从总量角度衡量nano−Al13的毒性效应可能会掩盖其实际的毒性风险。
单体铝和纳米铝团簇毒性的相关争议依然存在,难于达成统一认识。尽管铝的化学行为和生物毒性直接取决于其存在形态已经被广泛认可,但受其形态转化机制复杂且缺少团簇形态分析技术瓶颈的限制,铝团簇生物毒性效应机制研究一直处于严重滞后阶段。从铝团簇形态学角度对其生物毒性效应的研究依然较少,具体毒性机制仍不清晰[1,71]。此外,有研究发现在纳米颗粒物共存且无“微区强碱”前提下也可生成nano−Al13[7]。因此,不仅单体铝而且其微界面促发新生成的nano-Al13以及其它聚合铝都可能是传统单体铝毒性效应的主要贡献组分。
3. 残余铝毒性影响因素(Influencing factors of residual aluminum toxicity)
羟基铝团簇可以和多种无机离子(OH−、F−、SO42-、PO33-、HCO3−等)或有机配体结合,其存在形态复杂多样,主要取决于溶液pH值、复合配体浓度、温度等典型环境理化因素。羟基铝团簇还易与大分子化合物,如蛋白质、DNA、磷脂等形成较为复杂的化合物[64]。共存的有机、无机离子与羟基铝团簇形态结合,势必也将影响铝团簇毒性效应。鉴于目前铝团簇毒性的影响因素研究相对较少,本文仅基于现有研究进展,从水源水质组分、pH值和有机酸角度,结合铝团簇形态的转化阐述不同因素对残余铝毒性的影响。
(1)水源水质对残余铝毒性的影响
水源水的温度、浊度、色度、硬度、有机质含量、无机离子差异和河流水文状况将直接影响铝的含量与形态分布,进而对其毒性大小产生影响[72]。水中铝浓度的增加,会导致水体中有机物的凝聚作用增加,使有机物减少,致水生动物因营养匮乏而死亡;同时,还将导致水体中的可溶性磷沉淀,降低磷的再矿化率,对水生动物的生命带来极大的威胁[73]。原水浊度和TOC、DOC浓度增加可提高残留铝中胶体态铝和溶解态羟基铝含量[74-75]。水体悬浮颗粒物含量与颗粒结合态铝含量存在明显的相关关系。水体氟化物含量对弱酸性水源水的残余铝有显著影响,其对羟基铝团簇的形态分布影响占据主导地位。酸性、弱酸性条件下铝氟化物成为主导形态,但该条件对溶解态铝向颗粒态铝的转化并无显著抑制作用[76]。
(2)pH对残余铝毒性的影响
羟基铝团簇毒性效应除与浓度有关外,还和团簇形态密切相关,而形态赋存和转化受水体pH值影响较大。pH对于水中残余铝含量的影响主要体现在絮凝形态和絮凝机制两方面[15, 77],不同pH下铝团簇形态分布不同[78-79]。在[Al3+] <10−4 mol·L−1水相溶液中,铝的水解优势形态为单体羟基络合离子[80]。当pH值从3−6向7−8以及大于8演变时,铝水解优势形态也从Al3+、Al(OH)2+、Al(OH)2+向Al(OH)3凝胶态、铝酸阴离子Al(OH)4−转化[81-82]。在单体铝的浓度较高([Al3+]>10−3 mol·L−1)或在向含铝溶液中加碱时,溶液中水解生成的单体羟基态铝络合离子会发生聚合反应,生成二聚体、低聚体及高聚体等羟基聚合形态。其中,纳米Al13形态更加稳定,电荷稳定性更好,受pH影响较小。
不同pH条件下水溶液中主导的铝团聚形态不同,其毒性效应亦不同。当pH值约为5.0时,铝以氢氧化铝Al(OH)3的形态沉积在鱼鳃内,阻止氧气进入血液中,并使鱼体内的含盐浓度失调,导致鱼类死亡[73]。在pH=8−9的弱碱性条件下,水中的铝酸根离子浓度高于0.5 mg·L−1时也可使鲑鱼致死;沉淀的氢氧化铝Al(OH)3不会使鲑鱼急性中毒而死,但能引起鲑鱼的慢性中毒,且在未污染的水体中其解毒的过程比较缓慢[11,69]。该观点主要从单体铝形态转化过程角度,从Al(OH)3生成及对鳃的毒性影响角度论述铝的毒性,长期以来一直主导铝毒性效应的认知,同时也并未考虑铝团簇形态尤其是纳米铝团簇毒性机制的差异性。已有研究表明,不同pH及不同浓度的Al3+及nano-Al13对脱氢酶活性的影响存在较大差异[67]。在磷酸盐存在的情况下,pH值在7−10范围内时,无定形态氢氧化铝颗粒可通过共沉淀的方式将磷原子包裹在自身结构之中或吸附磷酸盐基团在表面[83-84];随pH下降,铝和磷酸盐作用生成晶体态铝磷酸盐,并在输水过程中造成残余铝的二次释放,进而引发残余铝毒性。
(3)有机酸对残余铝毒性的影响
有机酸(如柠檬酸、草酸、甲酸等)能与金属形成稳定的复合体,将离子态的金属转变成低毒或无毒的螯合态形式,从而减轻过量金属的毒害效应[85]。有机酸与铝离子形成稳定的化合物,降低铝离子生理活性,从而降低细胞内铝离子的毒害效应。如铝可与柠檬酸形成1∶1的复合体, 与草酸形成1∶3的复合体[86]。几种常见低分子有机酸离子削弱铝毒的能力大小顺序为:草酸>乙酸>柠檬酸/硅酸>酒石酸>水杨酸>邻苯二甲酸[85]。有机酸的化学结构也会影响其对铝的络合能力。水杨酸(邻羟基苯甲酸)能与铝形成稳定的六元环鳌合物,而邻苯二甲酸与铝形成不稳定的七元鳌合物,水杨酸对铝的络合能力比邻苯二甲酸大。柠檬酸与铝也能形成稳定的五元环和六元环鳌合物,因此柠檬酸与铝有很强的络合能力[86]。一些多齿或多配位点的有机配体如EDTA、柠檬酸、聚合酚类与铝形成稳定的鳌合物,能抵抗Al3+水解作用的影响[87]。铝和磷酸盐共同作用可生成铝磷酸盐沉淀,直接影响饮用水的剩余浊度和残余铝含量。
然而,上述研究大多基于传统重金属观念,探讨单体铝与有机酸的络合过程。对于纳米铝团簇而言,其比表面积大、表面能高,位于表面的原子占相当大比例,能有效吸附和配位溶液中重要的生物有机分子。有机酸离子可以与高活性的羟基铝络合成为低活性的有机络合态铝,进而降低铝毒性。同时,有机酸离子在与羟基铝络合过程中还可以释放出OH−,使得pH值升高,进一步降低离子态铝的活性,削弱铝毒。研究发现Alm和nano−Al13对谷胱甘肽还原酶(GR)活性有较强抑制作用,加入柠檬酸、草酸以后,抑制作用均显著减轻,其与铝和配体的配位、酶构象的改变有关[51]。有机酸作为残余铝解毒剂应用具有较高的潜在价值。
4. 展望(Prospect)
现有研究主要从残余铝总量角度探讨单体铝或纳米铝团簇的毒性机制,而从高荷电、纳米粒度、铝团簇结构等角度解析单体铝和纳米多聚体铝团簇形态毒性机制差异性的研究尚少。在溶解性铝团簇生物毒性效应过程与机制研究上有待深入系统揭示内在机理和突破方向,主要可以归纳为以下4点:
(1)高正电荷(+7)、高活性位点、纳米Al13团簇在生物体内组织、内脏等负电性器官中迁移途径与机理是否类似于常规负电性纳米污染物以及溶解性单体铝。
(2)单体铝水解形态在黏土等微界面促发下可转化生成nano-Al13这一新认知,是否能解释以往研究中单体铝与多聚体铝毒性效应认知的矛盾。传统观念中单体铝的毒性效应是否也取决于nano-Al13。
(3)铝团簇不同于其他纳米颗粒物,除具有纳米粒度特征外,还具有极强的凝聚絮凝效能,成为水体有机有毒污染物的重要载体和聚集体,其复合毒性研究依然较少。在毒性机制上,铝团簇纳米聚合体是否存在协同效应还是拮抗效应依然需要深入探讨。
(4)对于已进入水环境中的铝,如何实现高毒性铝团簇形态向毒害作用更低的形态转化,实现解毒效果,也是今后铝毒性效应研究方向之一。
-
表 1 微塑料对斑马鱼的累积及毒性效应研究情况
Table 1. Study on the cumulative and toxic effects of microplastics on zebrafish
阶段Stage 类型Type of MPs 粒径/μmShape and size 暴露浓度/( mg·L−1)Exposure concentration 累积部位Site of accumulation 暴露时间/dDuration of exposure 毒性效应Effects 参考文献References 胚胎 PS 20×10−3 脑 5 死亡率上升DNA损伤 [43] 胚胎 PS 25×10−3 , 50×10−3 , 250×10−3 , 700×10−3 5, 25, 50 肠道, 表皮, 眼睛 2 PS在肠道、表皮、眼睛等器官中的累积 [23] 胚胎 PE 3 核苷酸切除修复(NER)和转化生长因子β(TGF-β)信号通路改变 [44] 胚胎 PS 50×10−3 —100×10−3 1×10−3, 1 4 存在天然酸性有机物的情况下,MPs的活性氧(ROS)水平协同增加 [45] 胚胎 PS 50×10−3 , 200×10−3 , 500×10−3 10×10−3 绒毛膜 1 PS在富含脂质的区域生物累积MPs和Au协同加剧发育异常、存活率、孵化率以及ROS增加 [19] 胚胎 PS 0.5 1 肠道 2 环氧化酶(COX)活性和超氧化物歧化酶(SOD)的诱导显著降低 [46] 胚胎,幼鱼 PS 51×10−3 0.1, 1, 10 胚胎-绒毛膜幼鱼-卵黄,脑,心包,胃肠道 5 心率降低、游泳行为改变 [20] 胚胎,幼鱼 PS 0.7 5 5 补体途径基因(cfhl3、cfhl4、cfb和c9)的上调 [31] 胚胎,幼鱼 PS 1 0.1, 1 胚胎-绒毛膜幼鱼-口腔,胃,肠道 5 游泳能力下降il1b、cat的表达上调 [21] 胚胎,幼鱼 PE 38. 26±15. 64 6.2, 12.5, 25, 50, 100 6 胚胎早期孵化幼鱼存活率低形态学参数发生显著变化 [35] 幼鱼 PS 25×10−3 0.2, 2, 20 肠,胰腺,胆囊 2 葡萄糖水平降低,皮质醇分泌增加运动活动异常 [47] 幼鱼 PS 5—50 0.1, 1 肠道 7 微生物组的改变CAT和GSH含量显著降低糖脂和能量代谢紊乱 [48] 幼鱼 PE 10—45 5, 20 肠道 14 对幼鱼发育和生长没有影响幼鱼基因表达发生短暂而广泛的变化 [49] 成鱼 PS 50×10−3 1 头部,内脏,鳃,肌肉 3 增加头部和内脏对BPA的摄取抑制乙酰胆碱酯酶(AChE)活性髓鞘、微管蛋白/基因表达、多巴胺含量、manf mRNA表达上调 [25] 成鱼 PS 70×10−3 0.5,1.5 性腺,肠道,肝脏,大脑 7 脂质和能量代谢紊乱ROS增加和ATP水平降低抑制乙酰胆碱酯酶、多巴胺、褪黑素、褪黑素、氨基丁酸、5-羟色胺、加压素、kisspeptin和催产素 [37] 成鱼 PS 70×10−3, 5, 20 20 5μm–鳃,肝,肠道20μm–鳃,肠道 7 肝脏炎症和脂质堆积超氧化物歧化酶和过氧化氢酶活性增加肝脏代谢改变 [27] 成鱼 PS 0.1, 5, 200 0.5 肠道 21 肠道免疫细胞功能障碍吞噬细胞产生的ROS相关基因表达改变,增加分泌细胞的黏液分泌特异性改变巨噬细胞溶酶体和细胞表面受体信号转导过程 [50] 成鱼 PA, PE, PP, PVC, PS 0.1, 1, 5 (PS), 70 (PA, PE, PP, PVC) 0.001, 0.01, 0.1, 1.0 , 10.0 10 类型依赖性致死效应小肠损伤伴绒毛破裂和肠细胞分裂在鳃、肝和肾中未观察到组织学损伤 [51] 成鱼 PS 0.1, 20 0.2 肠道>肝脏>鳃 3 MPs和天然有机物(NOM)加剧肝脏和内脏中铜的累积丙二醛(MDA)、金属硫蛋白(MT)水平升高,SOD水平降低 [29] 成鱼 PS 0.5, 50 0.1, 1 14 类杆菌和变形杆菌减少,厚壁菌增加肠道IL1α、IL1β和IFN的蛋白水平显著升高 [52] 成鱼 PS 5 20×10−3 , 100×10−3 21 葡萄糖、丙酮酸、α-酮戊二酸和异柠檬酸脱氢酶下降 [38] 成鱼 PS 5 50×10−3 , 500×10−3 肠道>肝脏>鳃 21 肠壁变薄和充血性炎症、绒毛损伤和上皮损伤. 肠道微生物群落的变化CAT、SOD活性和D-乳酸水平升高 [53] 成鱼 PE 10—22, 45—53, 90—106, 212—250, 500—600 2 肠,鳃 4 癫痫发作和形态学变化(尾巴向下弯曲)cyp1a和vtg1上调 [33] 成鱼 PS 微珠(15),碎片,纤维(25) 10×10−3 肠道 21 形状依赖性积聚——纤维、碎片、珠子肠黏膜损伤(D-Lac降低)和炎症(IL-1α升高)氧化应激(SOD活性升高)肠道通透性增加和肠道菌群失调 [28] 成鱼 PS 90% < 90; 50% < 50; 10% < 25 0.1, 1 20 免疫反应或细胞增殖的一般激活基因上调 [36] 成鱼 PE 125—250 21 prdx1、gstp1、chrna、ngn1、cyp1a1的过度表达 [54] 成鱼、幼鱼、胚胎 PS 42×10−3 4.5、9、12 大脑、肌肉和睾丸的GR活性降低 [22] 成鱼、幼鱼、胚胎 PS 1—5, 10—20 成鱼-鳃幼鱼-肠道,胚胎,绒毛膜 4 通过附着到上皮细胞转移POPscyp1a诱导 [11] 注:PE为聚乙烯, PVC为聚氯乙烯,PA为聚酰胺,PP为聚丙烯. Note: PE (Polyethylene), PVC (Polyvinyl chloride), PA (Polyamide), and PP (Polypropylene). -
[1] PLASTICSEUROPE. Plastics – the Facts 2020. [EB/OL]. [2022-12-19]. [2] ZHANG C N, WANG J, ZHOU A G, et al. Species-specific effect of microplastics on fish embryos and observation of toxicity kinetics in larvae[J]. Journal of Hazardous Materials, 2021, 403: 123948. doi: 10.1016/j.jhazmat.2020.123948 [3] CUNNINGHAM E M, EHLERS S M, DICK J T A, et al. High abundances of microplastic pollution in deep-sea sediments: Evidence from Antarctica and the southern ocean[J]. Environmental Science & Technology, 2020, 54(21): 13661-13671. [4] FENG S S, LU H W, YAO T C, et al. Spatial characteristics of microplastics in the high-altitude area on the Tibetan Plateau[J]. Journal of Hazardous Materials, 2021, 417: 126034. doi: 10.1016/j.jhazmat.2021.126034 [5] ZHANG Y L, GAO T, KANG S C, et al. Microplastics in glaciers of the Tibetan Plateau: Evidence for the long-range transport of microplastics[J]. Science of the Total Environment, 2021, 758: 143634. doi: 10.1016/j.scitotenv.2020.143634 [6] PARKER B W, BECKINGHAM B A, INGRAM B C, et al. Microplastic and tire wear particle occurrence in fishes from an urban estuary: Influence of feeding characteristics on exposure risk[J]. Marine Pollution Bulletin, 2020, 160: 111539. doi: 10.1016/j.marpolbul.2020.111539 [7] OUYANG X G, DUARTE C M, CHEUNG S G, et al. Fate and effects of macro- and microplastics in coastal wetlands[J]. Environmental Science & Technology, 2022, 56(4): 2386-2397. [8] PESTANA C J, MOURA D S, CAPELO-NETO J, et al. Potentially poisonous plastic particles: Microplastics as a vector for cyanobacterial toxins microcystin-LR and microcystin-LF[J]. Environmental Science & Technology, 2021, 55(23): 15940-15949. [9] WANG Y H, YANG Y N, LIU X, et al. Interaction of microplastics with antibiotics in aquatic environment: Distribution, adsorption, and toxicity[J]. Environmental Science & Technology, 2021, 55(23): 15579-15595. [10] PANNETIER P, MORIN B, Le BIHANIC F, et al. Environmental samples of microplastics induce significant toxic effects in fish larvae[J]. Environment International, 2020, 134: 105047. doi: 10.1016/j.envint.2019.105047 [11] BATEL A, BORCHERT F, REINWALD H, et al. Microplastic accumulation patterns and transfer of benzo[a]pyrene to adult zebrafish (Danio rerio) gills and zebrafish embryos[J]. Environmental Pollution, 2018, 235: 918-930. doi: 10.1016/j.envpol.2018.01.028 [12] TREVISAN R, VOY C, CHEN S X, et al. Nanoplastics decrease the toxicity of a complex PAH mixture but impair mitochondrial energy production in developing zebrafish[J]. Environmental Science & Technology, 2019, 53(14): 8405-8415. [13] 丁平, 张丽娟, 黄道建, 等. 微塑料对海洋生物的毒性效应及机理研究进展[J]. 海洋湖沼通报, 2021, 43(2): 144-153. doi: 10.13984/j.cnki.cn37-1141.2021.02.019 DING P, ZHANG L J, HUANG D J, et al. Toxic effect and mechanism of microplastics on marine organisms[J]. Transactions of Oceanology and Limnology, 2021, 43(2): 144-153 (in Chinese). doi: 10.13984/j.cnki.cn37-1141.2021.02.019
[14] ZHAO Y P, QIAO R X, ZHANG S Y, et al. Metabolomic profiling reveals the intestinal toxicity of different length of microplastic fibers on zebrafish (Danio rerio)[J]. Journal of Hazardous Materials, 2021, 403: 123663. doi: 10.1016/j.jhazmat.2020.123663 [15] ZITOUNI N, BOUSSERRHINE N, MISSAWI O, et al. Uptake, tissue distribution and toxicological effects of environmental microplastics in early juvenile fish Dicentrarchus labrax[J]. Journal of Hazardous Materials, 2021, 403: 124055. doi: 10.1016/j.jhazmat.2020.124055 [16] KIM J H, YU Y B, CHOI J H. Toxic effects on bioaccumulation, hematological parameters, oxidative stress, immune responses and neurotoxicity in fish exposed to microplastics: A review[J]. Journal of Hazardous Materials, 2021, 413: 125423. doi: 10.1016/j.jhazmat.2021.125423 [17] RAWSON D M, ZHANG T, KALICHARAN D, et al. Field emission scanning electron microscopy and transmission electron microscopy studies of the chorion, plasma membrane and syncytial layers of the gastrula-stage embryo of the zebrafish Brachydanio rerio: A consideration of the structural and functional relationships with respect to cryoprotectant penetration[J]. Aquaculture Research, 2000, 31(3): 325-336. doi: 10.1046/j.1365-2109.2000.00401.x [18] DUAN Z H, DUAN X Y, ZHAO S, et al. Barrier function of zebrafish embryonic chorions against microplastics and nanoplastics and its impact on embryo development[J]. Journal of Hazardous Materials, 2020, 395: 122621. doi: 10.1016/j.jhazmat.2020.122621 [19] LEE W S, CHO H J, KIM E, et al. Bioaccumulation of polystyrene nanoplastics and their effect on the toxicity of Au ions in zebrafish embryos[J]. Nanoscale, 2019, 11(7): 3173-3185. doi: 10.1039/C8NR09321K [20] PITT J A, KOZAL J S, JAYASUNDARA N, et al. Uptake, tissue distribution, and toxicity of polystyrene nanoparticles in developing zebrafish (Danio rerio)[J]. Aquatic Toxicology, 2018, 194: 185-194. doi: 10.1016/j.aquatox.2017.11.017 [21] QIANG L Y, CHENG J P. Exposure to microplastics decreases swimming competence in larval zebrafish (Danio rerio)[J]. Ecotoxicology and Environmental Safety, 2019, 176: 226-233. doi: 10.1016/j.ecoenv.2019.03.088 [22] PITT J A, TREVISAN R, MASSARSKY A, et al. Maternal transfer of nanoplastics to offspring in zebrafish (Danio rerio): A case study with nanopolystyrene[J]. Science of the Total Environment, 2018, 643: 324-334. doi: 10.1016/j.scitotenv.2018.06.186 [23] Van POMEREN M, BRUN N R, PEIJNENBURG W J G M, et al. Exploring uptake and biodistribution of polystyrene (nano)particles in zebrafish embryos at different developmental stages[J]. Aquatic Toxicology, 2017, 190: 40-45. doi: 10.1016/j.aquatox.2017.06.017 [24] YU F, YANG C F, ZHU Z L, et al. Adsorption behavior of organic pollutants and metals on micro/nanoplastics in the aquatic environment[J]. Science of the Total Environment, 2019, 694: 133643. doi: 10.1016/j.scitotenv.2019.133643 [25] CHEN Q Q, YIN D Q, JIA Y L, et al. Enhanced uptake of BPA in the presence of nanoplastics can lead to neurotoxic effects in adult zebrafish[J]. Science of the Total Environment, 2017, 609: 1312-1321. doi: 10.1016/j.scitotenv.2017.07.144 [26] KARAMI A, GROMAN D B, WILSON S P, et al. Biomarker responses in zebrafish (Danio rerio) larvae exposed to pristine low-density polyethylene fragments[J]. Environmental Pollution, 2017, 223: 466-475. doi: 10.1016/j.envpol.2017.01.047 [27] LU Y F, ZHANG Y, DENG Y F, et al. Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver[J]. Environmental Science & Technology, 2016, 50(7): 4054-4060. [28] QIAO R X, DENG Y F, ZHANG S H, et al. Accumulation of different shapes of microplastics initiates intestinal injury and gut microbiota dysbiosis in the gut of zebrafish[J]. Chemosphere, 2019, 236: 124334. doi: 10.1016/j.chemosphere.2019.07.065 [29] QIAO R X, LU K, DENG Y F, et al. Combined effects of polystyrene microplastics and natural organic matter on the accumulation and toxicity of copper in zebrafish[J]. Science of the Total Environment, 2019, 682: 128-137. doi: 10.1016/j.scitotenv.2019.05.163 [30] SKJOLDING L M, AŠMONAITĖ G, JØLCK R I, et al. An assessment of the importance of exposure routes to the uptake and internal localisation of fluorescent nanoparticles in zebrafish (Danio rerio), using light sheet microscopy[J]. Nanotoxicology, 2017, 11(3): 351-359. doi: 10.1080/17435390.2017.1306128 [31] VENEMAN W J, SPAINK H P, BRUN N R, et al. Pathway analysis of systemic transcriptome responses to injected polystyrene particles in zebrafish larvae[J]. Aquatic Toxicology, 2017, 190: 112-120. doi: 10.1016/j.aquatox.2017.06.014 [32] CHEN Q Q, LACKMANN C, WANG W Y, et al. Microplastics lead to hyperactive swimming behaviour in adult zebrafish[J]. Aquatic Toxicology, 2020, 224: 105521. doi: 10.1016/j.aquatox.2020.105521 [33] MAK C W, CHING-FONG YEUNG K, CHAN K M. Acute toxic effects of polyethylene microplastic on adult zebrafish[J]. Ecotoxicology and Environmental Safety, 2019, 182: 109442. doi: 10.1016/j.ecoenv.2019.109442 [34] CHEN Q Q, GUNDLACH M, YANG S Y, et al. Quantitative investigation of the mechanisms of microplastics and nanoplastics toward zebrafish larvae locomotor activity[J]. Science of the Total Environment, 2017, 584/585: 1022-1031. doi: 10.1016/j.scitotenv.2017.01.156 [35] MALAFAIA G, de SOUZA A M, PEREIRA A C, et al. Developmental toxicity in zebrafish exposed to polyethylene microplastics under static and semi-static aquatic systems[J]. Science of the Total Environment, 2020, 700: 134867. doi: 10.1016/j.scitotenv.2019.134867 [36] LIMONTA G, MANCIA A, BENKHALQUI A, et al. Microplastics induce transcriptional changes, immune response and behavioral alterations in adult zebrafish[J]. Scientific Reports, 2019, 9(1): 1-11. doi: 10.1038/s41598-018-37186-2 [37] SARASAMMA S, AUDIRA G, SIREGAR P, et al. Nanoplastics cause neurobehavioral impairments, reproductive and oxidative damages, and biomarker responses in zebrafish: Throwing up alarms of wide spread health risk of exposure[J]. International Journal of Molecular Sciences, 2020, 21(4): 1410. doi: 10.3390/ijms21041410 [38] ZHAO Y, BAO Z W, WAN Z Q, et al. Polystyrene microplastic exposure disturbs hepatic glycolipid metabolism at the physiological, biochemical, and transcriptomic levels in adult zebrafish[J]. Science of the Total Environment, 2020, 710: 136279. doi: 10.1016/j.scitotenv.2019.136279 [39] XIE J, FARAGE E, SUGIMOTO M, et al. A novel transgenic zebrafish model for blood-brain and blood-retinal barrier development[J]. BMC Developmental Biology, 2010, 10: 76. doi: 10.1186/1471-213X-10-76 [40] RAFTIS J B, MILLER M R. Nanoparticle translocation and multi-organ toxicity: A particularly small problem[J]. Nano Today, 2019, 26: 8-12. doi: 10.1016/j.nantod.2019.03.010 [41] GEISER M, ROTHEN-RUTISHAUSER B, KAPP N, et al. Ultrafine particles cross cellular membranes by nonphagocytic mechanisms in lungs and in cultured cells[J]. Environmental Health Perspectives, 2005, 113(11): 1555-1560. doi: 10.1289/ehp.8006 [42] MATTSSON K, JOHNSON E V, MALMENDAL A, et al. Brain damage and behavioural disorders in fish induced by plastic nanoparticles delivered through the food chain[J]. Scientific Reports, 2017, 7(1): 1-7. doi: 10.1038/s41598-016-0028-x [43] SÖKMEN T Ö, SULUKAN E, TÜRKOĞLU M, et al. Polystyrene nanoplastics (20 nm) are able to bioaccumulate and cause oxidative DNA damages in the brain tissue of zebrafish embryo (Danio rerio)[J]. NeuroToxicology, 2020, 77: 51-59. doi: 10.1016/j.neuro.2019.12.010 [44] KIM Y, JEONG J, LEE S, et al. Identification of adverse outcome pathway related to high-density polyethylene microplastics exposure: Caenorhabditis elegans transcription factor RNAi screening and zebrafish study[J]. Journal of Hazardous Materials, 2020, 388: 121725. doi: 10.1016/j.jhazmat.2019.121725 [45] LIU Y P, LU M X, ZHANG X W, et al. Shift of the microbial communities from exposed sandstone rocks to forest soils during pedogenesis[J]. International Biodeterioration & Biodegradation, 2019, 140: 21-28. [46] PARENTI C C, GHILARDI A, DELLA TORRE C, et al. Evaluation of the infiltration of polystyrene nanobeads in zebrafish embryo tissues after short-term exposure and the related biochemical and behavioural effects[J]. Environmental Pollution, 2019, 254: 112947. doi: 10.1016/j.envpol.2019.07.115 [47] BRUN N R, van HAGE P, HUNTING E R, et al. Polystyrene nanoplastics disrupt glucose metabolism and cortisol levels with a possible link to behavioural changes in larval zebrafish[J]. Communications Biology, 2019, 2(1): 1-9. doi: 10.1038/s42003-018-0242-0 [48] WAN Z Q, WANG C Y, ZHOU J J, et al. Effects of polystyrene microplastics on the composition of the microbiome and metabolism in larval zebrafish[J]. Chemosphere, 2019, 217: 646-658. doi: 10.1016/j.chemosphere.2018.11.070 [49] LeMOINE C M R, KELLEHER B M, LAGARDE R, et al. Transcriptional effects of polyethylene microplastics ingestion in developing zebrafish (Danio rerio)[J]. Environmental Pollution, 2018, 243: 591-600. doi: 10.1016/j.envpol.2018.08.084 [50] GU W Q, LIU S, CHEN L, et al. Single-cell RNA sequencing reveals size-dependent effects of polystyrene microplastics on immune and secretory cell populations from zebrafish intestines[J]. Environmental Science & Technology, 2020, 54(6): 3417-3427. [51] LEI L L, WU S Y, LU S B, et al. Microplastic particles cause intestinal damage and other adverse effects in zebrafish Danio rerio and nematode Caenorhabditis elegans[J]. Science of the Total Environment, 2018, 619/620: 1-8. doi: 10.1016/j.scitotenv.2017.11.103 [52] JIN Y X, XIA J Z, PAN Z H, et al. Polystyrene microplastics induce microbiota dysbiosis and inflammation in the gut of adult zebrafish[J]. Environmental Pollution, 2018, 235: 322-329. doi: 10.1016/j.envpol.2017.12.088 [53] QIAO R X, SHENG C, LU Y F, et al. Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish[J]. Science of the Total Environment, 2019, 662: 246-253. doi: 10.1016/j.scitotenv.2019.01.245 [54] RAINIERI S, CONLLEDO N, LARSEN B K, et al. Combined effects of microplastics and chemical contaminants on the organ toxicity of zebrafish (Danio rerio)[J]. Environmental Research, 2018, 162: 135-143. doi: 10.1016/j.envres.2017.12.019 [55] ONG K J, ZHAO X X, THISTLE M E, et al. Mechanistic insights into the effect of nanoparticles on zebrafish hatch[J]. Nanotoxicology, 2014, 8(3): 295-304. doi: 10.3109/17435390.2013.778345 [56] RANDLETT O, WEE C L, NAUMANN E A, et al. Whole-brain activity mapping onto a zebrafish brain atlas[J]. Nature Methods, 2015, 12(11): 1039-1046. doi: 10.1038/nmeth.3581 [57] WULLIMANN M F. Secondary neurogenesis and telencephalic organization in zebrafish and mice: A brief review[J]. Integrative Zoology, 2009, 4(1): 123-133. doi: 10.1111/j.1749-4877.2008.00140.x [58] DEMIN K A, TARANOV A S, ILYIN N P, et al. Understanding neurobehavioral effects of acute and chronic stress in zebrafish[J]. Stress, 2021, 24(1): 1-18. doi: 10.1080/10253890.2020.1724948 [59] BHAGAT J, ZANG L Q, NISHIMURA N, et al. Zebrafish: An emerging model to study microplastic and nanoplastic toxicity[J]. The Science of the Total Environment, 2020, 728: 138707. doi: 10.1016/j.scitotenv.2020.138707 [60] DAYAL N, THAKUR M, PATIL P, et al. Histological and genotoxic evaluation of gold nanoparticles in ovarian cells of zebrafish (Danio rerio)[J]. Journal of Nanoparticle Research, 2016, 18(10): 291. doi: 10.1007/s11051-016-3549-0 [61] 武芳竹, 曾江宁, 徐晓群, 等. 海洋微塑料污染现状及其对鱼类的生态毒理效应[J]. 海洋学报, 2019, 41(2): 85-98. WU F Z, ZENG J N, XU X Q, et al. Status of marine microplastic pollution and its ecotoxicological effects on marine fish[J]. Haiyang Xuebao, 2019, 41(2): 85-98 (in Chinese).
[62] WANG R L, SONG B, WU J R, et al. Potential adverse effects of nanoparticles on the reproductive system[J]. International Journal of Nanomedicine, 2018, 13: 8487-8506. doi: 10.2147/IJN.S170723 [63] MA Y B, LU C J, JUNAID M, et al. Potential adverse outcome pathway (AOP) of silver nanoparticles mediated reproductive toxicity in zebrafish[J]. Chemosphere, 2018, 207: 320-328. doi: 10.1016/j.chemosphere.2018.05.019 [64] WANG P P, ZHAO Y. Plasticizer Exposure and Reproductive Health: Phthalates and Bisphenol A[M]//Zhang Y. Emerging Chemicals and Human Health. Singapore: Springer, 2019: 49-67. [65] BAKIR A, ROWLAND S J, THOMPSON R C. Enhanced desorption of persistent organic pollutants from microplastics under simulated physiological conditions[J]. Environmental Pollution, 2014, 185: 16-23. doi: 10.1016/j.envpol.2013.10.007 [66] CHEN X P, XU S S, TAN T F, et al. Toxicity and estrogenic endocrine disrupting activity of phthalates and their mixtures[J]. International Journal of Environmental Research and Public Health, 2014, 11(3): 3156-3168. doi: 10.3390/ijerph110303156 [67] BRITT K L, SAUNDERS P K, McPHERSON S J, et al. Estrogen actions on follicle formation and early follicle development[J]. Biology of Reproduction, 2004, 71(5): 1712-1723. doi: 10.1095/biolreprod.104.028175 [68] GUPTA R K, SINGH J M, LESLIE T C, et al. Di-(2-ethylhexyl) phthalate and mono-(2-ethylhexyl) phthalate inhibit growth and reduce estradiol levels of antral follicles in vitro[J]. Toxicology and Applied Pharmacology, 2010, 242(2): 224-230. doi: 10.1016/j.taap.2009.10.011 [69] ROCHA MONTEIRO P R, REIS-HENRIQUES M A, COIMBRA J. Polycyclic aromatic hydrocarbons inhibit in vitro ovarian steroidogenesis in the flounder (Platichthys flesus L. )[J]. Aquatic Toxicology, 2000, 48(4): 549-559. doi: 10.1016/S0166-445X(99)00055-7 [70] ARUKWE A, GOKSØYR A. Eggshell and egg yolk proteins in fish: Hepatic proteins for the next generation: Oogenetic, population, and evolutionary implications of endocrine disruption[J]. Comparative Hepatology, 2003, 2(1): 4. doi: 10.1186/1476-5926-2-4 [71] MARIN M G, MATOZZO V. Vitellogenin induction as a biomarker of exposure to estrogenic compounds in aquatic environments[J]. Marine Pollution Bulletin, 2004, 48(9/10): 835-839. [72] SUMPTER J P, JOBLING S. Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment[J]. Environmental Health Perspectives, 1995, 103(Suppl 7): 173-178. doi: 10.1289/ehp.95103s7173 [73] LINDEN S K, SUTTON P, KARLSSON N G, et al. Mucins in the mucosal barrier to infection[J]. Mucosal Immunology, 2008, 1(3): 183-197. doi: 10.1038/mi.2008.5 [74] HWANG J, CHOI D, HAN S, et al. Potential toxicity of polystyrene microplastic particles[J]. Scientific Reports, 2020, 10(1): 1-12. doi: 10.1038/s41598-019-56847-4 [75] YUAN Y, SEPÚLVEDA M S, BI B L, et al. Acute polyethylene microplastic (PE-MPs) exposure activates the intestinal mucosal immune network pathway in adult zebrafish (Danio rerio)[J]. Chemosphere, 2023, 311: 137048. doi: 10.1016/j.chemosphere.2022.137048 [76] LEGRAND T P R A, WYNNE J W, WEYRICH L S, et al. A microbial sea of possibilities: Current knowledge and prospects for an improved understanding of the fish microbiome[J]. Reviews in Aquaculture, 2020, 12(2): 1101-1134. doi: 10.1111/raq.12375 [77] MIAO S Y, ZHAO C Z, ZHU J Y, et al. Dietary soybean meal affects intestinal homoeostasis by altering the microbiota, morphology and inflammatory cytokine gene expression in northern snakehead[J]. Scientific Reports, 2018, 8(1): 1-10. [78] RAMOS M A, BATISTA S, PIRES M A, et al. Dietary probiotic supplementation improves growth and the intestinal morphology of Nile tilapia[J]. Animal, 2017, 11(8): 1259-1269. doi: 10.1017/S1751731116002792 [79] XU K H, ZHANG Y D, HUANG Y M, et al. Toxicological effects of microplastics and phenanthrene to zebrafish (Danio rerio)[J]. Science of the Total Environment, 2021, 757: 143730. doi: 10.1016/j.scitotenv.2020.143730 [80] SOLOMANDO A, CAPÓ X, ALOMAR C, et al. Long-term exposure to microplastics induces oxidative stress and a pro-inflammatory response in the gut of Sparus aurata Linnaeus, 1758[J]. Environmental Pollution, 2020, 266: 115295. doi: 10.1016/j.envpol.2020.115295 [81] TRESTRAIL C, NUGEGODA D, SHIMETA J. Invertebrate responses to microplastic ingestion: Reviewing the role of the antioxidant system[J]. Science of the Total Environment, 2020, 734: 138559. doi: 10.1016/j.scitotenv.2020.138559 [82] KAMINSKYY V O, ZHIVOTOVSKY B. Free radicals in cross talk between autophagy and apoptosis[J]. Antioxidants & Redox Signaling, 2014, 21(1): 86-102. [83] REDZA-DUTORDOIR M, AVERILL-BATES D A. Activation of apoptosis signalling pathways by reactive oxygen species[J]. Biochimica et Biophysica Acta, 2016, 1863(12): 2977-2992. doi: 10.1016/j.bbamcr.2016.09.012 [84] BHABRA G, SOOD A, FISHER B, et al. Nanoparticles can cause DNA damage across a cellular barrier[J]. Nature Nanotechnology, 2009, 4(12): 876-883. doi: 10.1038/nnano.2009.313 [85] MAHMOUDI M, AZADMANESH K, SHOKRGOZAR M A, et al. Effect of nanoparticles on the cell life cycle[J]. Chemical Reviews, 2011, 111(5): 3407-3432. doi: 10.1021/cr1003166 [86] ZHANG J F, SHEN H, WANG X R, et al. Effects of chronic exposure of 2, 4-dichlorophenol on the antioxidant system in liver of freshwater fish Carassius auratus[J]. Chemosphere, 2004, 55(2): 167-174. doi: 10.1016/j.chemosphere.2003.10.048 [87] NIU Z G, XU W A, NA J, et al. How long-term exposure of environmentally relevant antibiotics may stimulate the growth of Prorocentrum lima: A probable positive factor for red tides[J]. Environmental Pollution, 2019, 255: 113149. doi: 10.1016/j.envpol.2019.113149 [88] BHAGAT J, INGOLE B S, SINGH N. Glutathione s-transferase, catalase, superoxide dismutase, glutathione peroxidase, and lipid peroxidation as biomarkers of oxidative stress in snails: A review[J]. Invertebrate Survival Journal, 2016, 13: 336-349. [89] KIM J H, KANG Y J, KIM K I, et al. Toxic effects of nitrogenous compounds (ammonia, nitrite, and nitrate) on acute toxicity and antioxidant responses of juvenile olive flounder, Paralichthys olivaceus[J]. Environmental Toxicology and Pharmacology, 2019, 67: 73-78. doi: 10.1016/j.etap.2019.02.001 [90] KIM J H, KANG J C. Oxidative stress, neurotoxicity, and non-specific immune responses in juvenile red sea bream, Pagrus major, exposed to different waterborne selenium concentrations[J]. Chemosphere, 2015, 135: 46-52. doi: 10.1016/j.chemosphere.2015.03.062 [91] CHAUDIÈRE J, FERRARI-ILIOU R. Intracellular antioxidants: From chemical to biochemical mechanisms[J]. Food and Chemical Toxicology, 1999, 37(9/10): 949-962. [92] UMAMAHESWARI S, PRIYADARSHINEE S, BHATTACHARJEE M, et al. Exposure to polystyrene microplastics induced gene modulated biological responses in zebrafish (Danio rerio)[J]. Chemosphere, 2021, 281: 128592. doi: 10.1016/j.chemosphere.2020.128592 [93] CHOI J S, JUNG Y J, HONG N H, et al. Toxicological effects of irregularly shaped and spherical microplastics in a marine teleost, the sheepshead minnow (Cyprinodon variegatus)[J]. Marine Pollution Bulletin, 2018, 129(1): 231-240. doi: 10.1016/j.marpolbul.2018.02.039 [94] LU K, QIAO R X, AN H, et al. Influence of microplastics on the accumulation and chronic toxic effects of cadmium in zebrafish (Danio rerio)[J]. Chemosphere, 2018, 202: 514-520. doi: 10.1016/j.chemosphere.2018.03.145 [95] FRÖHLICH E. Cellular targets and mechanisms in the cytotoxic action of non-biodegradable engineered nanoparticles[J]. Current Drug Metabolism, 2013, 14(9): 976-988. doi: 10.2174/1389200211314090004 [96] UMAMAHESWARI S, PRIYADARSHINEE S, KADIRVELU K, et al. Polystyrene microplastics induce apoptosis via ROS-mediated p53 signaling pathway in zebrafish[J]. Chemico-Biological Interactions, 2021, 345: 109550. doi: 10.1016/j.cbi.2021.109550 [97] ITO F, SONO Y, ITO T. Measurement and clinical significance of lipid peroxidation as a biomarker of oxidative stress: Oxidative Stress in Diabetes, Atherosclerosis, and Chronic Inflammation[J]. Antioxidants (Basel, Switzerland), 2019, 8(3): 72. [98] BARBOZA L G A, LOPES C, OLIVEIRA P, et al. Microplastics in wild fish from North East Atlantic Ocean and its potential for causing neurotoxic effects, lipid oxidative damage, and human health risks associated with ingestion exposure[J]. The Science of the Total Environment, 2020, 717: 134625. doi: 10.1016/j.scitotenv.2019.134625 [99] ALOMAR C, SUREDA A, CAPÓ X, et al. Microplastic ingestion by Mullus surmuletus Linnaeus, 1758 fish and its potential for causing oxidative stress[J]. Environmental Research, 2017, 159: 135-142. doi: 10.1016/j.envres.2017.07.043 [100] PEI X, HENG X, CHU W H. Polystyrene nano/microplastics induce microbiota dysbiosis, oxidative damage, and innate immune disruption in zebrafish[J]. Microbial Pathogenesis, 2022, 163: 105387. doi: 10.1016/j.micpath.2021.105387 [101] LU L, WAN Z Q, LUO T, et al. Polystyrene microplastics induce gut microbiota dysbiosis and hepatic lipid metabolism disorder in mice[J]. Science of the Total Environment, 2018, 631/632: 449-458. doi: 10.1016/j.scitotenv.2018.03.051 [102] HIRT N, BODY-MALAPEL M. Immunotoxicity and intestinal effects of nano- and microplastics: A review of the literature[J]. Particle and Fibre Toxicology, 2020, 17(1): 57. doi: 10.1186/s12989-020-00387-7 [103] ZHANG Y A, SALINAS I, ORIOL SUNYER J. Recent findings on the structure and function of teleost IgT[J]. Fish & Shellfish Immunology, 2011, 31(5): 627-634. [104] PETERSEN C, BELL R, KA K, et al. T cell–mediated regulation of the microbiota protects against obesity[J]. Science, 2019, 365(6451): 9351. doi: 10.1126/science.aat9351 [105] PABST O, SLACK E. IgA and the intestinal microbiota: The importance of being specific[J]. Mucosal Immunology, 2020, 13(1): 12-21. doi: 10.1038/s41385-019-0227-4 [106] XU Z, TAKIZAWA F, CASADEI E, et al. Specialization of mucosal immunoglobulins in pathogen control and microbiota homeostasis occurred early in vertebrate evolution[J]. Science Immunology, 2020, 5(44): 3254. doi: 10.1126/sciimmunol.aay3254 [107] SAURABH S, SAHOO P K. Lysozyme: An important defence molecule of fish innate immune system[J]. Aquaculture Research, 2008, 39(3): 223-239. doi: 10.1111/j.1365-2109.2007.01883.x [108] ZHANG L J, MAMILLAPALLI R, HABATA S, et al. Myometrial-derived CXCL12 promotes lipopolysaccharide induced preterm labour by regulating macrophage migration, polarization and function in mice[J]. Journal of Cellular and Molecular Medicine, 2022, 26(9): 2566-2578. doi: 10.1111/jcmm.17252 [109] LEE A J, KANDIAH N, KARIMI K, et al. Interleukin-15 is required for maximal lipopolysaccharide-induced abortion[J]. Journal of Leukocyte Biology, 2013, 93(6): 905-912. doi: 10.1189/jlb.0912442 [110] BARSIG J, KÜSTERS S, VOGT K, et al. Lipopolysaccharide-induced interleukin-10 in mice: Role of endogenous tumor necrosis factor-alpha[J]. European Journal of Immunology, 1995, 25(10): 2888-2893. doi: 10.1002/eji.1830251027 [111] BARAN A, KÖKTÜRK M, ATAMANALP M, et al. Determination of developmental toxicity of zebrafish exposed to propyl gallate dosed lower than ADI (Acceptable Daily Intake)[J]. Regulatory Toxicology and Pharmacology, 2018, 94: 16-21. doi: 10.1016/j.yrtph.2017.12.027 [112] ÇOMAKLI S, KÖKTÜRK M, TOPAL A, et al. Immunofluorescence/fluorescence assessment of brain-derived neurotrophic factor, c-Fos activation, and apoptosis in the brain of zebrafish (Danio rerio) larvae exposed to glufosinate[J]. NeuroToxicology, 2018, 69: 60-67. doi: 10.1016/j.neuro.2018.09.003 [113] ZHAI X W, WANG L, XU C, et al. Triptolide preserves glomerular barrier function via the inhibition of p53-mediated increase of GADD45B[J]. Archives of Biochemistry and Biophysics, 2019, 671: 210-217. doi: 10.1016/j.abb.2019.07.012 [114] PARK S, LEE J Y, PARK H, et al. Bifenthrin induces developmental immunotoxicity and vascular malformation during zebrafish embryogenesis[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2020, 228: 108671. [115] SARMAH S, MARRS J A. Zebrafish as a vertebrate model system to evaluate effects of environmental toxicants on cardiac development and function[J]. International Journal of Molecular Sciences, 2016, 17(12): 2123. doi: 10.3390/ijms17122123 [116] HUMAYUN A, JR FORNACE A J. GADD45 in stress signaling, cell cycle control, and apoptosis[J]. Advances in Experimental , 2022, 1360: 1-22. 期刊类型引用(2)
1. 丛鑫,李瑶,王宇,郑力. 生物炭基针铁矿复合材料对水中莠去津吸附特性研究. 生态环境学报. 2021(10): 2067-2075 .  百度学术
百度学术
2. 计海洋,汪玉瑛,刘玉学,吕豪豪,何莉莉,杨生茂. 生物炭及改性生物炭的制备与应用研究进展. 核农学报. 2018(11): 2281-2287 .  百度学术
百度学术
其他类型引用(5)
-





 DownLoad:
DownLoad: