-
挥发性硫化合物( volatile sulfur compounds, VSCs)能抑制所有有氧细胞线粒体呼吸链末端的细胞色素氧化酶[1],造成细胞窒息,对人体的危害性极大. 司法实践中,硫化氢(H2S)是最常见的VSCs致死毒物,每年全国会有上百人因H2S中毒致死[2 − 3]. H2S是一种较为常见的神经毒剂,主要依靠呼吸道进入身体,也可以通过皮肤、消化道进行缓慢地吸收. H2S在体内的代谢主要有3条途径:其一,H2S进入人体之后与细胞色素氧化酶等蛋白酶结合,导致蛋白酶失去其原有的作用;其二,硫离子在人体被氧化,形成硫代硫化物、硫酸盐等;其三,H2S甲基化后,生成甲硫醚(dimethyl sulfide, DMS)和甲硫醇(methanethiol, MT),之后甲硫醇会随着时间的推移,逐步转化为甲硫醚[4 − 5]. 第一条途径是导致人体硫化氢中毒的原因,后两条途径为肝脏等器官进行解毒的过程.
因DMS和MT的刺激性气味,很少发生直接摄入而急性中毒的案例,且经过初步检验也易将MT、DMS中毒与H2S中毒区分开。因此,作为H2S在人体内主要的代谢产物,DMS和MT具有一定的标识作用。目前,国内外学者主要通过研究血液中的硫离子、硫代硫酸盐以及硫化血红蛋白等鉴定H2S中毒,如强火生、罗才会、Varlet 、张震等[6 − 9]通过GC-MS或GC-FPD等方法测定血液中的S2-,褚建新、刘春霞等[10 − 11]分别通过分光光度计和荧光探针检测血中的硫化血红蛋白,同时为了提高定量的准确性,Maseda等[12]通过LC-MS方法测定血液和尿液中的硫代硫酸盐. 但是上述方法均存在重复性差、操作复杂等缺点。为了避免此类问题,需对H2S甲基化产生的DMS、MT进行分析. 基于相关文献可知[5,9],在人体内检测出H2S、DMS和MT的存在,可为H2S中毒做出判断. 国内外主要是采用气相色谱-质谱(gas chromatography mass spectrometry, GC-MS)法和气相色谱法检验DMS和MT,王芳琳、吴颖娟[13 − 14]采用GC-MS分别对血中的MT和废水中的DMS进行定性定量,张立江、Ábalos等[15 − 16]采用顶空气相色谱的方法对废水中的DMS、MT进行检验,并对挥发性硫化物性质进行较为全面的研究.
顶空气相色谱法(HS-GC)是一种联合操作技术,采用顶空萃取,可专一性收集样品中的易挥发性成分[17]. HS-GC具有较高的灵敏度和比较迅速的分析速度,可降低共提物引起的干扰,且操作简便[18]. 其简便性、快捷性和准确性满足鉴定机构的检验要求,因此本文拟建立全血中DMS和MT的顶空气相色谱检验方法,以期为公安机关处理硫化氢中毒案件和安全生产等方面提供理论依据和方法支撑.
-
Agilent 7890B气相色谱仪(美国安捷伦公司);Agilent 7697A顶空进样器(美国安捷伦公司);Agilent J&W GS-GasPro(30 m×320 μm×5 μm)毛细管柱(美国安捷伦公司).
-
甲硫醚、甲硫醇:色谱纯级,>99.7 %,上海麦克林生化公司;无氧水:实验当天将高纯N2通入到去离子水中进行脱氧 15 min 以制备无氧水;饱和硼砂(Na2B4O7)溶液:称取足量的Na2B4O7,加入无氧水100mL 溶解,充分超声振荡,自然静置后,取上层清澈溶液[19];0.1 %氢氧化钠溶液配制:用电子天平称取0.1 g NaOH固体加入99.9 mL无氧水中[20].
-
硫化氢中毒致死者的全血样本:经公安部物证鉴定中心同意,样本取自于2021年7月—2022年1月因硫化氢中毒而死亡的5起案件,检材样本为心血,并及时在-20 ℃环境下冷冻保存以延缓腐败. 15份血液样本的基本信息见表1. 空白血液样本:50份健康成年人血液,冷冻保存. 其他血液样本:选取20份其他死因中毒血样,冷冻保存.
-
在10 mL顶空瓶中依次加入0.5 mL待测血液样品、0.2 mL的20 %硫酸溶液、0.15 g 氯化钠、1 mL无氧水稀释,及时密封.
-
(1)色谱条件:进样口温度250 ℃,分流模式,分流比10:1,载气为氮气,采用gas-pro毛细管柱,流量为0.5 mL·min−1;柱温升温程序为起始温度50 ℃,保持2 min后,以20 ℃·min−1升至250 ℃,保持2 min,平衡时间1 min;尾吹气为高纯氮气,恒流60 mL·min−1;FPD检测器,温度为270 ℃;空气流量为恒流60 mL·min−1;氢气燃气流量为恒流60 mL·min−1.
(2)顶空进样器条件:加热箱温度为60 ℃,样品瓶平衡时间为15 min,定量环温度为80 ℃,传输线温度为95 ℃.
-
本次实验考察了ALC-1、gas-pro和plot-q三种色谱柱,而ALC-1对于DMS和MT的保留能力较差,plot-q的峰容易出现拖尾现象,响应值较差. 结合文献[9]和实际操作发现Agilent J&W GS-Gas-Pro(30 m×0.32 mm×5 μm)对于DMS、MT和溶剂峰有着较好地分离,且色谱柱的流失较少,所以本实验选择gas-pro强极性色谱柱.
-
本次实验比较了电子捕获检测器(ECD)、氢火焰离子化检测器(FID)和火焰光度检测器(FPD). 以往的研究表明FPD、ECD具有较高的灵敏度,其中FPD对于含硫、磷的物质具有较强的选择性;而ECD对电负性强的物质有较高灵敏度,但硫化物的电负性并不高,在实际检测中灵敏度不如FPD. 在温度较高时,易受溶剂蒸气的污染,以致于减少仪器使用寿命[5]. 所以本实验选择的检测器为FPD,经优化后将其温度参数设置为270 ℃,空气流量为恒流60 mL·min−1,氢气燃气流量为恒流60 mL·min−1.
-
随着储存时间的增加,硫化氢中毒血样会产生二硫化碳等有机物,这些硫化物会干扰FPD检测器对甲硫醚和甲硫醇的检验效果,因此,本实验决定对DMS、MT所在的酸碱环境进行研究,以期达到最优的提取效果.
分别取6份0.5 mL DMS浓度依次为0.01、0.2、0.8 μg·mL−1血样装入顶空瓶中,分别加入空白去离子水、20%硫酸溶液、10%磷酸溶液、三氯乙酸溶液、饱和硼砂溶液、0.1%氢氧化钠溶液,以满足中性、酸性、碱性的测定环境. 具体结果见表2.
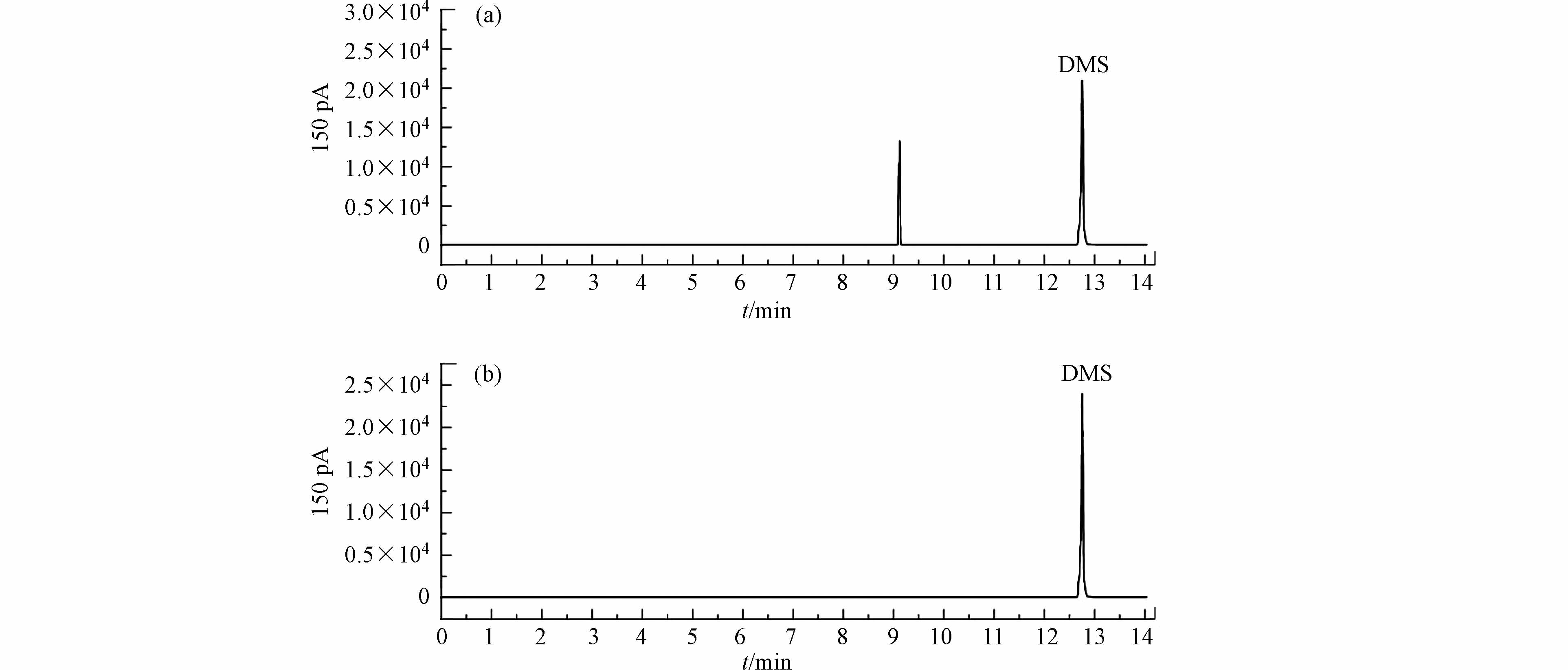
根据表2中数据所示,样品经去离子水稀释后可以显现出DMS,但是其响应值较低,灵敏度不足,实操性较差;饱和硼砂溶液和0.1%氢氧化钠溶液提供的碱性环境不利于醚类和醇类化合物的挥发造成DMS的响应值大幅度降低;磷酸为弱酸,同样不利于待测物的挥发,使得DMS的分析结果较差;三氯乙酸溶液可以很好地提高DMS的GC响应值,但高温环境会使一部分三氯乙酸生成氯仿,对检测器造成污染,具体数据和效果如表2、图1(a)所示;20%硫酸溶液可以有效地提高DMS的响应值,并且杂质峰较少,具体数据和效果如表2、图1(b)所示. 因此,本次实验选择20%硫酸溶液作为酸性介质,检验环境为酸性溶液.
此外,实际操作发现,由于MT的沸点较低(6 ℃),常温下容易挥发. 实验室常温下配制的标准溶液,准确性非常差,虽然可以使用冷藏的溶剂测得其标准曲线,但是重现效果较差,且所得数据不稳定. 结合实际检验工作的条件,含MT的H2S中毒血不可能保存完好. 因此,本实验决定不再研究MT的定量方法,但根据保留时间可以对MT进行定性.
同时,本实验对20 %硫酸溶剂加入量进行考察,发现加入0.2 mL效果最好,因此,本实验选择加入0.2 mL 20 %的硫酸溶液.
-
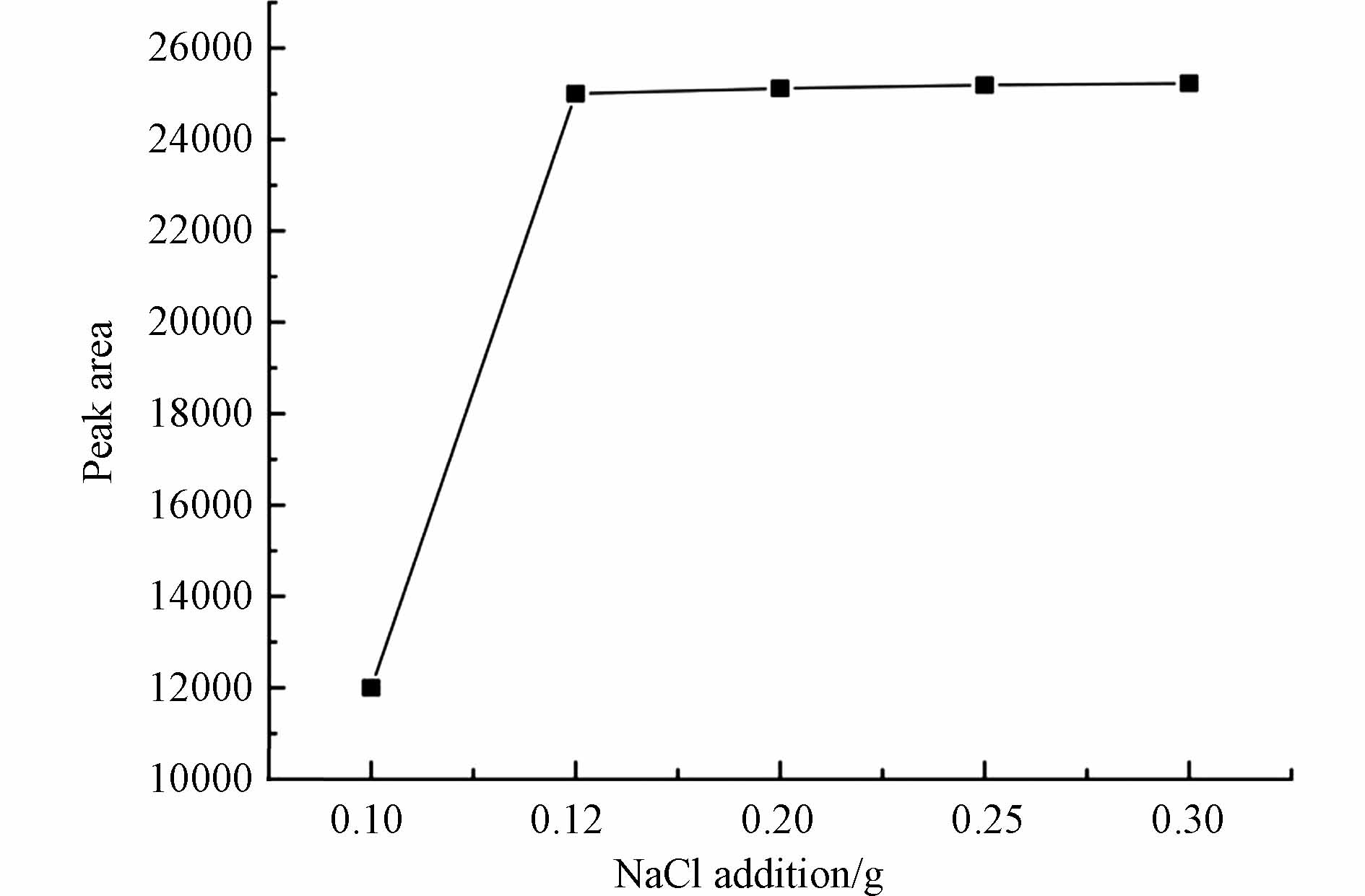
本实验就离子强度对实验结果的影响进行了考察,加入0.1—0.3 g的NaCl使得DMS的响应值得到了较好提升,当加入量在0.15 g以上时,虽然峰面积也有升高,但是提升效果不明显,且加入0.15 g NaCl的效果已达到检验工作的标准,为了减少资源浪费,本实验选择0.15 g NaCl添加量,具体见图2.
-
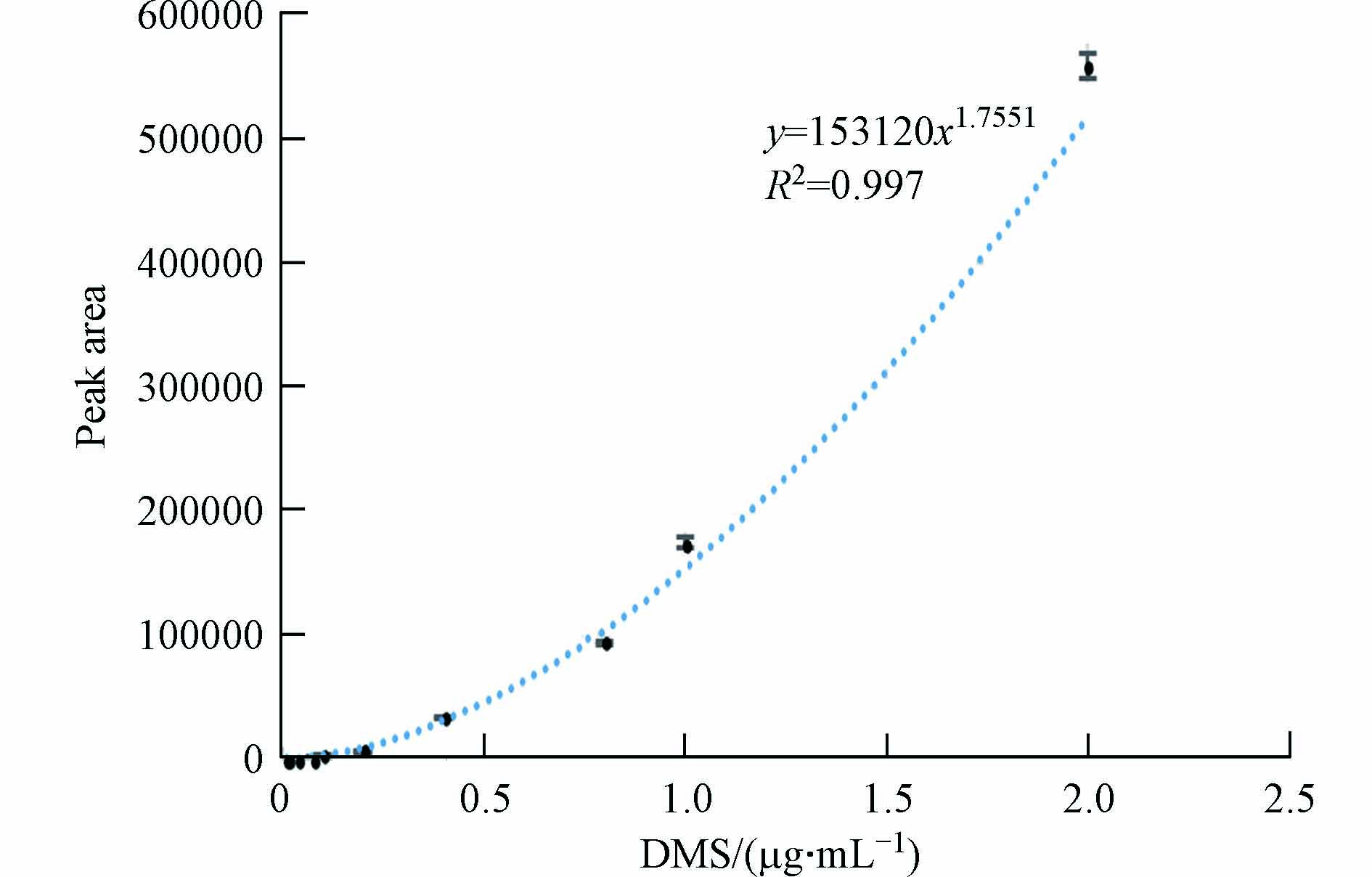
取空白血,添加DMS标准物质配制成含0.01、0.02、0.04、0.08、0.1、0.2、0.4、0.8、1.0、2.0 μg·mL−1 DMS的血液样品,使用“1.4”前处理方法处理,做3组平行实验. 以血样的DMS浓度为横坐标,所得的峰面积为纵坐标,得到DMS血样包含误差棒的标准曲线,通过测定检出限(LOD)和定量限(LOQ)来评价该方法的灵敏度,以信噪比3:1为LOD,以信噪比10:1为LOQ[21 − 22]. 结果见表3和图3. 由图3可知,在0.01—2.00 μg·mL−1 范围内呈幂指数.
-
按照考察所得的全血中DMS检测方法,使用相对标准偏差(RSD)表示精密度. 配制DMS低、中、高 3 种浓度的标准溶液,且连续7 d进行相同操作,得到日内日间精密度,结果见表4. 相对标准偏差落在1.6%—3.6%之间,表示仪器处于较为稳定的状态,满足实际工作需要.
-
使用“1.4”前处理方法处理50份健康成人血样,基于所得实验结果,50份空白血样中仅含有H2S,并未检测出DMS和MT的存在. 结合文献[5]分析其原因,随着储存血样时间的推移,腐败产生的H2S逐渐增多,但由于血样脱离人体,细胞失去活性、代谢停止,使得H2S不能进行甲基化反应得到DMS和MT. 因此,在空白血样中并未检测出DMS和MT的存在.
-
将收集到的20份其他死因中毒血样,按照本实验考察所得的最佳仪器条件、前处理条件进行检验,在其他死因血样中并未检测出DMS和MT的存在,说明其他毒物使人中毒死亡,并不会产生DMS和MT. 因此,本实验判定DMS和MT可能是H2S中毒后特定的代谢产物,研究DMS和MT作为硫化氢中毒的标志物具有重要意义.
但需特别注意的是,在特定案件中,可能存在高浓度DMS和MT的中毒致死案件,此类案件会对于硫化氢中毒起一定的干扰作用,需要结合现场环境及硫化氢中毒后的其他代谢产物,如硫代硫酸盐等进行综合分析判断.
-
采用建立的方法,对硫化氢中毒案件中的血液检材进行检验,结果见表5. 对表5检验结果分析,此五起案件共计15份血样中都存在DMS,浓度范围在0.016—0.430 μg·mL−1之间,位于DMS血样标准曲线的范围,由此证明本实验所建立的方法可以应用到硫化氢中毒案件中DMS的实际案例中.
此外,虽然MT的沸点低,以致于其在室温条件下极易挥发,使得一些H2S中毒血中没能检测出MT,但是本实验发现,其他死因的血样中,都未发现MT的存在,只有H2S中毒血中存在MT. 因此,MT的存在依旧可以作为判断H2S中毒的标志物之一.
-
(1)本实验经过分析空白血样、其他死因血样可知,DMS和MT为人体因硫化氢中毒而死亡的特定代谢物. 但需特别注意的是,在公安实践中,也会发生因吸入高浓度DMS和MT中毒致死的案件,此类血样中也可检测出DMS和MT的存在,对于此类特殊情形,检验人员需要结合相关法医学知识对其进行深入分析,以确定其死因.
(2)关于未来研究硫化氢中毒案件的展望:由于随着时间的推移,尸体、血液会逐渐腐败,因此,在检验硫化氢中毒事故中,尚需建立更加准确的内源性硫化氢、硫代硫酸盐、二硫化碳的阈值,以及研究血液腐败、尸体腐败所产生的硫化氢含量等基础数据.
顶空气相色谱法测定硫化氢中毒血中的甲硫醚和甲硫醇
Determination of dimethyl sulfide and methyl mercaptan in blood by headspace gas chromatography
-
摘要: 甲硫醚和甲硫醇作为硫化氢进入人体之后的主要代谢产物,具有一定的标识作用. 针对血液中甲硫醚和甲硫醇的检验进行研究,建立了顶空气相色谱检验方法. 实验采用对含硫化合物具有高灵敏度的火焰光度检测器(FPD),同时发现向0.5 mL血样中加入0.15 g氯化钠可使检出效率得到提升. 本方法血中甲硫醚的标准曲线范围为0.01—2.00 μg·mL−1,相关系数(R2)为0.997,检出限为0.003 μg·mL−1,定量限为0.01 μg·mL−1. 虽然甲硫醇由于自身沸点太低,不适合对其进行定量分析,但对其进行定性检测,也可为硫化氢中毒提供一定的依据. 本研究建立的方法可直接应用于血液中微量甲硫醚和甲硫醇的检测,从而为硫化氢中毒案件的检验鉴定提供依据.Abstract: Methyl sulfide and methyl mercaptan, as the main metabolites of hydrogen sulfide after entering the human body, have certain marking effects. A headspace gas chromatographic method was developed for the detection of methyl sulfide and methyl mercaptan in blood. A flame photometric detector (FPD) with high sensitivity for sulfur-containing compounds was used, and it was found that the addition of 0.15 g sodium chloride to 0.5 mL of blood sample resulted in improved detection efficiency. The standard curve range of this method was 0.01—2.00 μg·mL−1, the correlation coefficient (R2) was 0.997, the limit of detection was 0.003 μg·mL−1, and the limit of quantification was 0.01 μg·mL−1. Although methyl mercaptan is not suitable for quantitative analysis due to its low boiling point, its qualitative detection can also provide a basis for hydrogen sulfide poisoning. The method developed in this study can be directly applied to the determination of trace amounts of methyl mercaptan and methyl mercaptan in blood, thus providing a basis for the identification of hydrogen sulfide poisoning cases.
-
Key words:
- gas chromatography /
- methyl sulfide /
- methanethiol /
- hydrogen sulfide.
-
抗生素是一种具有抗菌活性的药物[1],可以用于预防和治疗微生物引起的多种疾病[2]。近年来,滥用抗生素带来的生态环境问题已经成为全球性热点关注问题。水环境中残留抗生素的污染分布范围广,具有毒性大、浓度低、难降解、易生物富集等特性[3]。目前降解抗生素的常用方法有物理吸附[4]、化学氧化[5]和生物降解[6]等。其中光催化氧化技术由于有效性、低成本、高稳定性和环境友好性被广泛用于降解抗生素废水[7]。
三氧化钨(WO3)是n型纳米结构半导体,其禁带宽度约为2.6~2.8 eV,制备成本低、绿色环保、具有优异化学稳定性和良好的光催化性能[8-11],因此,被认为是一种有潜力代替TiO2的光催化材料。但由于光生电子和空穴复合率高,其在光催化领域的应用受到了限制,有研究指出构建Z型异质结结构有助于提高WO3的光催化活性[12-15]。
近年来,高分子石墨氮化碳(g-C3N4)被报道为一种新型的无金属光催化剂,其具有2.7 eV的可见光响应窄带隙[16]。g-C3N4制备简单、具有优异的吸附性能和稳定的化学性质,常被用作载体材料。苏跃涵等[17]制备出二维超薄g-C3N4,提高了光催化过程对于恩诺沙星的降解。YU等[18]使用微波加热法制备出金字塔状g-C3N4阵列,其具有较大的比表面积,光生载流子分离效率高,表现出优异的光催化活性,对罗丹明B的脱色率高达99.5%。有研究表明,g-C3N4/WO3异质结材料具有良好的光催化性能[19-20],采用球磨法合成的g-C3N4/WO3具有较高的比表面积,导致光生载流子在可见光下分离和迁移增强,且对罗丹明B的光催化活性明显增强。然而目前将g-C3N4与WO3进行复合并用于降解四环素类抗生素的研究较少,对于g-C3N4/WO3光催化降解抗生素机理的研究较欠缺。
本研究通过原位水热法制备出g-C3N4/WO3复合光催化材料。分析了不同g-C3N4含量的g-C3N4/WO3复合材料的形貌结构和光电性能,并评价了其对土霉素溶液的光催化降解性能和稳定性。最后通过自由基淬灭实验探寻g-C3N4/WO3光催化降解机理。本研究制备的具有高效光生载流子分离、优异氧化还原能力和高吸附能力的Z型异质结光催化剂,对抗生素的去除具有一定的应用价值,可为光催化氧化技术处理抗生素废水提供参考。
1. 材料与方法
1.1 g-C3N4/WO3复合材料的制备
首先采用热缩聚法合成层状g-C3N4。将装有尿素的氧化铝坩埚放入马弗炉中550 ℃下煅烧4 h,自然冷却至室温后收集黄色固体,用蒸馏水和乙醇洗涤3次后在60 ℃下烘干研磨备用。
以二水钨酸钠化合物作为前驱体通过水热反应制备g-C3N4/WO3复合材料。先称取3.30 g Na2WO4·2H2O和一定量的NaCl结构导向剂溶解于40 mL去离子水中,均匀揽拌20 min至原料完全溶解,再加入不同质量(0.3、0.6、1.0、3.0 g)的g-C3N4,搅拌均匀。随后,向溶液中缓慢滴入3 mmol·L−1盐酸溶液同时不断搅拌以调节体系pH至2.0,形成有黄色沉淀的悬浮液。持续揽拌1 h后转移到容量为100 mL的不锈钢高压反应釜中密封并在160 ℃的烘箱中加热24 h。自然冷却至室温后将固体产物进行离心,用蒸馏水和乙醇洗涤3次,最后在60 ℃下烘干(根据g-C3N4不同的添加量,分别将样品命名为WG-0.3、WG-0.6、WG-1.0、WG-3.0,其中W代表WO3,G代表g-C3N4,数字代表复合材料中g-C3N4的添加量分别为0.3、0.6、1.0、3.0 g)。
1.2 WO3/g-C3N4复合材料性能测试
采用PANalytical公司的PW3040/60型X射线衍射仪XRD对复合材料进行晶体结构分析;使用ESCLAB250型X射线光电子能谱仪XPS分析复合材料的表面化学组成,不同元素的XPS谱图以C1s结合能284.8 eV为基准进行校正;采用JEOL公司的JSM-7001F型发射扫描电子显微镜SEM,获取复合材料的微观形貌特征和尺寸。
采用日立公司F-4500型荧光分光光度计测得复合材料的光致发光谱图,观察光催化剂被光激发后电子空穴对的复合状态。复合材料的光电化学性能通过电化学工作站在三电极系统中进行测试,包括瞬态光电流和电化学阻抗谱EIS,用于评估载流子的分离和迁移效率。其中,复合材料作为工作电极,Pt电极作为对电极,饱和甘汞电极作为参比电极,电解质溶液为0.5 mol·L−1硫酸钠溶液。工作电极通过如下方法制备:称取10 mg粉末样品分散在1 mL超纯水溶液中,再加入50 uL Nafion乙醇溶液,超声30 min形成悬浮液,然后在ITO玻璃上滴加150 uL悬浮液,室温下晾干进行光电测试。光电测试所用的光源为北京泊菲莱公司所生产的300 W氙灯(型号PLS-SXE300C)。在EIS测试时,电场变化频率围0.1 Hz~100 kHz,电解质溶液为0.5 mol·L−1硫酸钠溶液。采用安捷伦公司CARY300/PE lambda 750S型光谱仪测得复合材料的紫外-可见漫反射光谱UV-Vi并确定光响应范围及吸收强度。
1.3 WO3/g-C3N4复合材料光催化降解OTC实验
实验采用420 nm滤波片滤除小波长光,300 W氙灯作为光源。每组实验加入50 mg复合材料至含有100 mL 20 mg·L−1 OTC溶液的反应器中。先将混合溶液在黑暗条件下搅拌40 min,使OTC在样品上达到吸附平衡。然后开始光照,每隔20 min取样5 mL,经高速离心除去沉淀,取上清液用于测定HitachiU-3500紫外-可见分光光度计在360 nm处的吸光度值,测定OTC浓度。
实际工程应用中,光催化剂的稳定性至关重要,通过将反应后的复合材料对20 mg·L−1 OTC溶液进行光催化降解的重复实验测试其稳定性。每完成1组循环实验后,将复合材料离心、洗涤、过滤和干燥后用于下1组实验。循环实验次数为3次。
1.4 光催化降解机理实验
在光催化降解OTC的过程添加草酸钠(Na2C2O4,10 mmol·L−1)、异丙醇(IPA,10 mmol·L−1)和超氧化物淬灭剂(TEMPOL,10 mmol·L−1),分别作为空穴(h+)、羟基自由基(·OH)和超氧自由基(·O2−)的淬灭剂。将3种淬灭剂分别加入到含有50 mg WG-0.6的100 mL的OTC溶液中,在黑暗条件下持续搅拌40 min,使OTC在样品上达到吸附平衡。开始光照后,每隔20 min取样5 mL经高速离心除去沉淀,取上清液使用HitachU-3500紫外-可见分光光度计测定在360 nm处的吸光度值。
2. 结果与讨论
2.1 形貌与结构分析
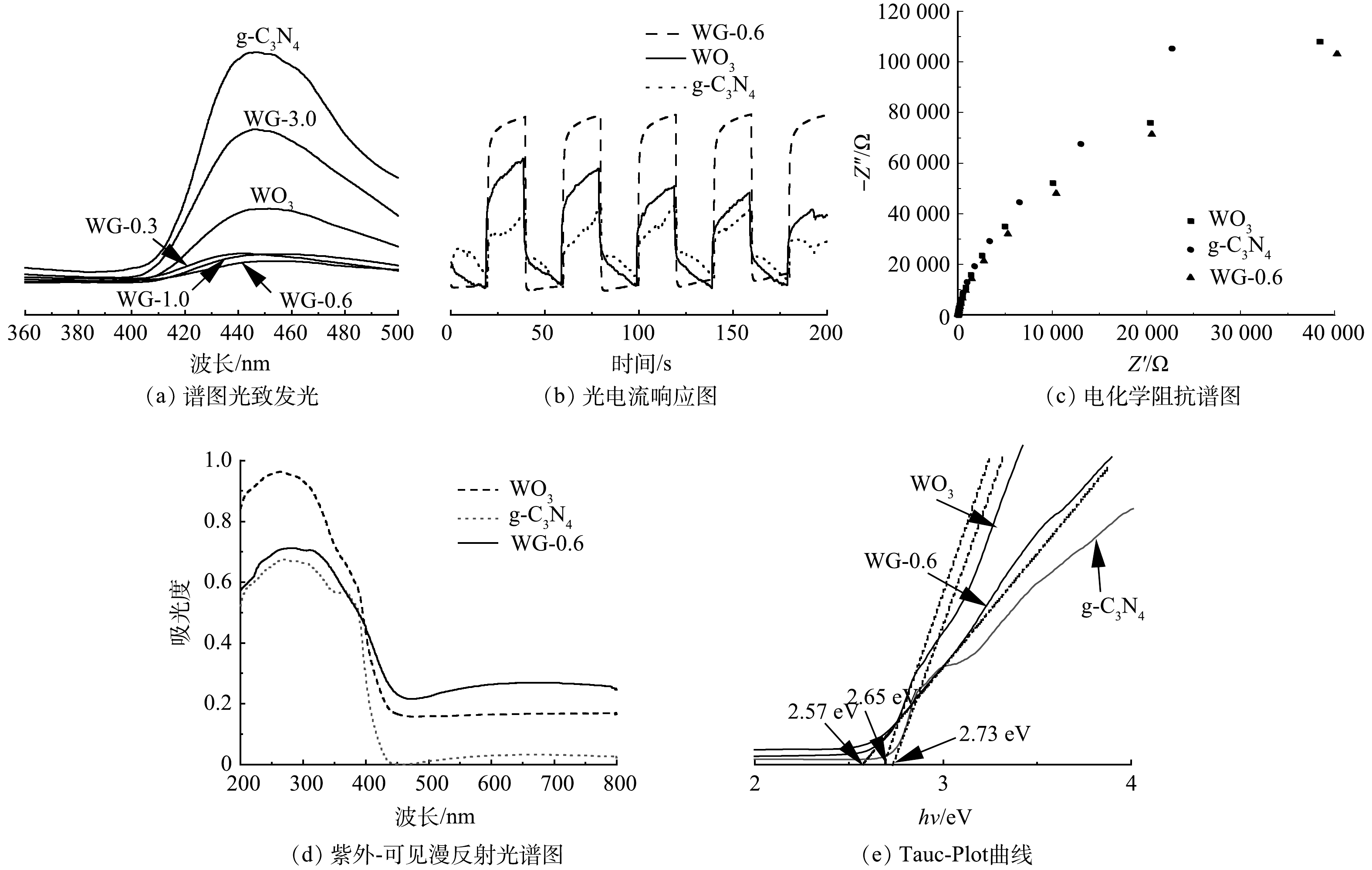
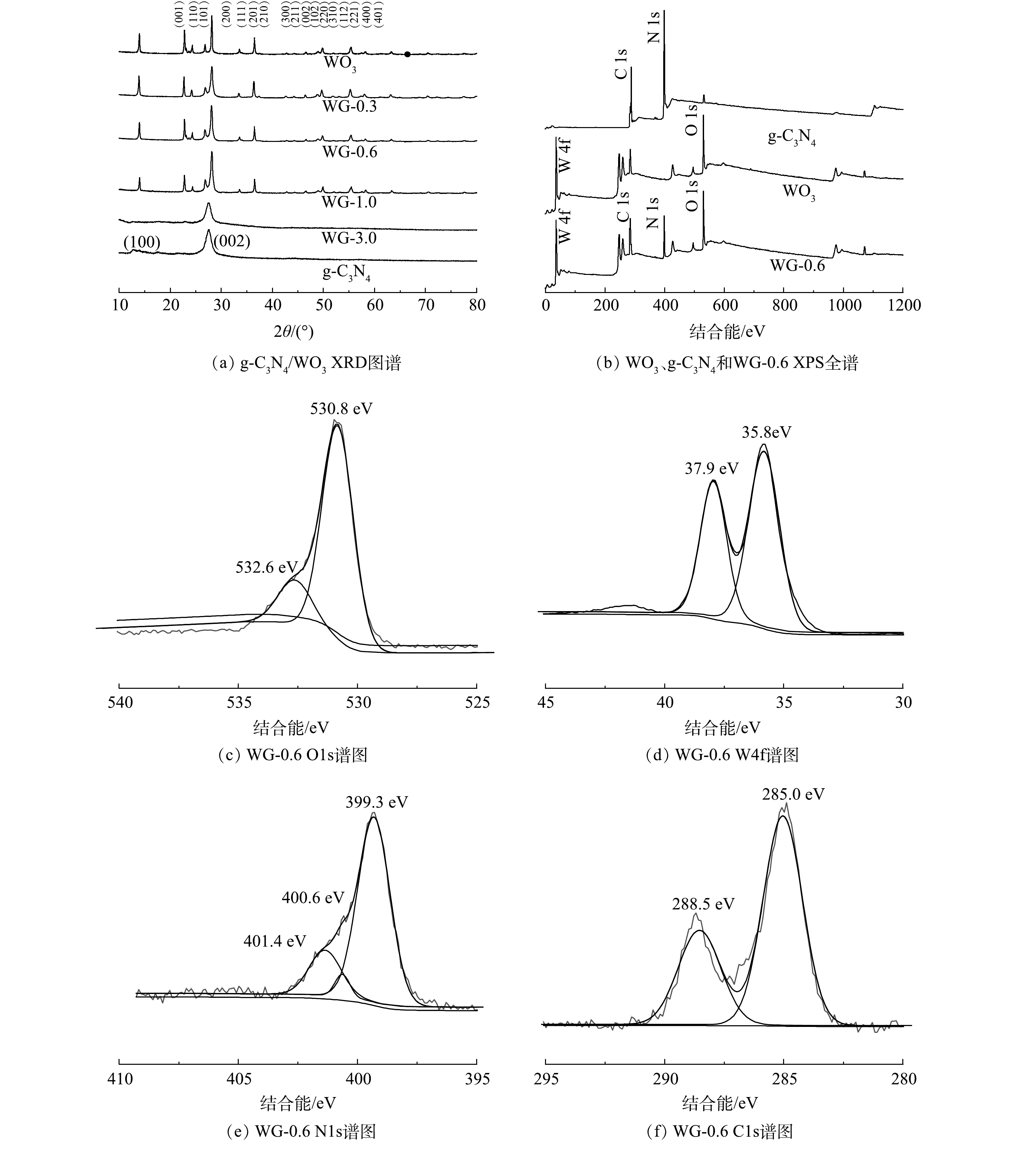
XRD被用于表征复合材料的晶体结构,如图1(a)所示,g-C3N4存在由层面结构堆积而形成的位于27.41的(002)晶面,而块体g-C3N4具有的来自芳香体系的特征晶面间堆积的(100)晶面非常微弱,表明g-C3N4已成功分层剥离。对于具有不同g-C3N4量的g-C3N4/WO3复合材料,观察到所有复合材料的WO3的特征衍射峰,与标准粉末衍射卡(JCPDS)no.35-1001相一致,均为六方相WO3[21]。g-C3N4的(002)衍射峰位置与WO3(101)(200)晶面的衍射峰位置接近,因此,不同g-C3N4含量的g-C3N4/WO3复合材料的主要特征衍射峰与原始WO3的特征衍射峰相近。随着g-C3N4质量含量的增加,WO3的相对衍射峰强度逐渐减弱。此外,当g-C3N4的投加量达到3.0 g时,WO3的衍射图样没有被探测到,表明WO3已经被g-C3N4完全覆盖,同时g-C3N4的(001)晶面的衍射峰也消失。以上结果表明层状g-C3N4与WO3纳米粒子成功地复合。
为深入了解g-C3N4、WO3和WG-0.6复合材料表面元素的化学状态,进行XPS测试。XPS全谱图显示WG-0.6复合材料中存在氧、钨、氮和碳元素。O1s、W4f、N1s和C1s的高分辨率光谱如图1(b)所示。对于图1(c)中的O1s,该峰可分解成530.8 eV和532.6 eV的2个峰,分别对应于W-O-W和W-O-H的氧结合物种。如图1(d)所示,在W4f图谱中结合能分别位于35.8 eV和37.9 eV的W4f7/2和W4f5/2峰,表明WG-0.6中的W为W6+的特征。在N1s光谱中,在401.4、400.6和399.3 eV处可识别出3个峰,分别对应C-N-H,N-(C)3和sp2杂化氮(C=N-C),从而证实sp2键石墨氮化碳的存在,如图1(e)所示。如图1(f)所示,C1s的高分辨率光谱可分为2个峰值,分别为285.0 eV对应sp2C-C键和288.5 eV对应含氮芳环中sp2键的碳(N-C=N)[22]。
使用扫描电镜SEM对光催化剂的结构及形貌分析。由图2(a)可见,WO3为大量纳米棒团聚形成的均匀三维花状微球,其单体为长约500~800 nm,直径约为30 nm的纳米棒。由图2(b)可见,g-C3N4则是通过g-C3N4纳米片的聚集而构建的,结构纹理清晰,表现出典型的带褶皱层状结构。由图2(c)可见,较小的WO3纳米棒修饰在大颗粒层状g-C3N4上,分散性及形貌特征与花状微球形的WO3明显不同。可以观察到,其表面没有表现出明显的g-C3N4层状结构,这意味着g-C3N4纳米片被WO3纳米棒均匀覆盖。纳米棒覆盖在纳米片上的堆积结构增加了材料比表面积,从而可提高其对OTC的吸附能力,促进光催化剂与污染物的接触,有利于提高对OTC的降解率。
2.2 光电化学性能研究
测试WO3、g-C3N4和g-C3N4/WO3复合材料的光致发光谱图,结果如图3(a)所示,以确定光生载流子分离的效率。g-C3N4的光致发光光谱在450 nm附近有一强发射峰,这可能与g-C3N4的光生电子和空穴的复合有关。g-C3N4/WO3复合材料的光致发光强度明显低于g-C3N4,g-C3N4/WO3复合材料中光生电子和空穴的复合受到极大的抑制,而WG-0.6的光致发光强度最低,表明适当的g-C3N4/WO3复合比例可形成更有效的光生载流子分离路径。
为了进一步研究g-C3N4/WO3复合材料的异质结对光生电子和空穴分离效率的影响,测试了g-C3N4、WO3和WG-0.6可见光照射下的瞬态光响应电流,如图3(b)所示。在4个关灯周期过程中的光电流密度与照射时间关系曲线。当灯关闭时,光电流密度接近于零,当灯打开时,光电流密度迅速增加并稳定在一定值。结果显示,WG-0.6表现出较强的光电流密度,表明其具有较高的光生载流子分离率,有利于提高其对可见光的活性。
g-C3N4、WO3和WG-0.6的电化学阻抗谱(EIS)也验证了光电流测试结果。电化学阻抗测试中Nyquist曲线中半圆的直径与电荷迁移电阻有关,Nyquist曲线半圆直径越小说明电子迁移阻力越小[23]。图3(c)为g-C3N4、WO3和WG-0.6的电化学阻抗谱图。相比其他2种材料,WG-0.6的圆弧半径更小,表明电子转移阻力更低,光生载流子的分离更迅速。
紫外-可见漫反射光谱显示,g-C3N4、WO3和g-C3N4/WO3复合材料均在可见光区有典型的半导体吸收。如图3(d)所示,在450 nm附近观察到WO3的吸收边缘,与其他学者研究一致[24]。g-C3N4在约430 nm处显示出吸收边缘。相比于g-C3N4与WO3,WG-0.6在可见光区域表现出较高的吸收强度,且吸收边带有明显的红移。由此可见,通过在WO3上负载g-C3N4改变了原材料的能带结构,从而可增强其对可见光的吸收响应。
根据Tauc-Plot曲线,如图3(e)所示估算光催化剂的带隙,得到g-C3N4、WO3和WG-0.6的带隙分别为2.73、2.65和2.57 eV。综上所述,g-C3N4和WO3构建的Z型异质结结构有利于促进光生载流子的分离。
2.3 光催化降解土霉素效果
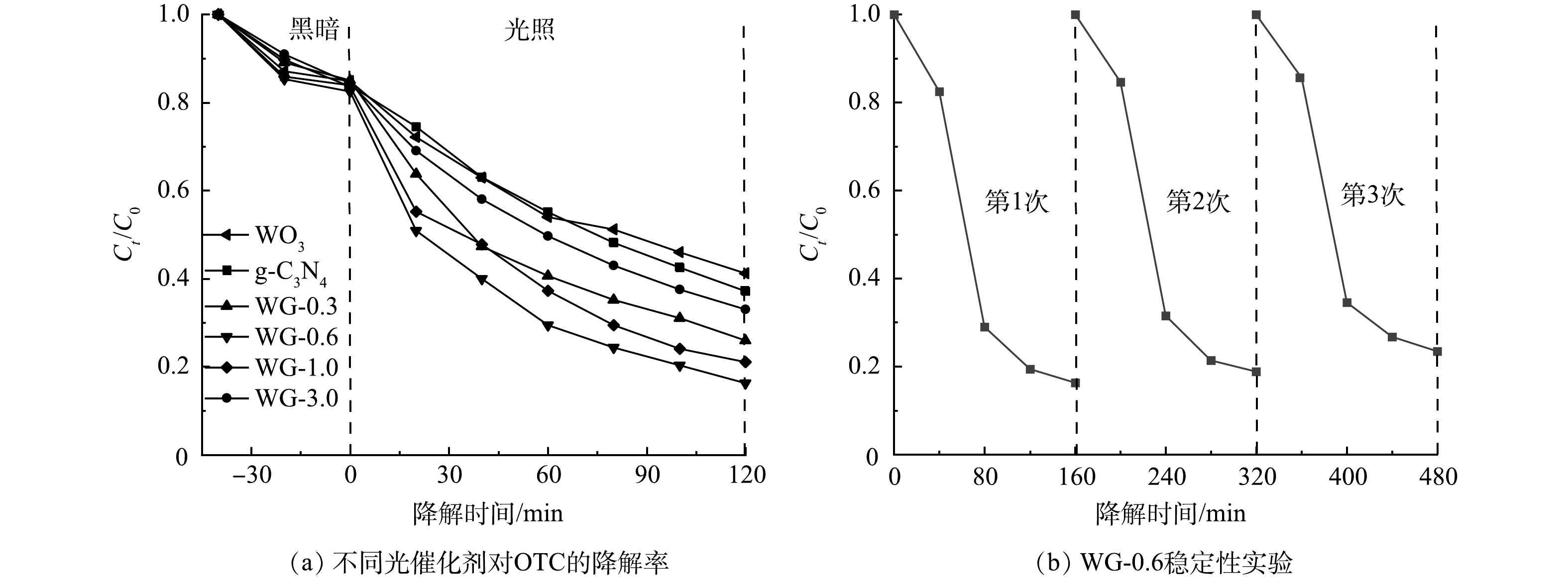
通过光催化降解土霉素实验来研究不同光催化材料的活性。如图4(a)所示,暗反应阶段显示各光催化材料都具有较好的吸附能力。当g-C3N4的添加量为0.6 g时,g-C3N4/WO3复合材料的光催化活性最好。随着g-C3N4添加量从0增加到0.6 g,g-C3N4/WO3的光催化活性增强。当g-C3N4含量超过0.6 g时,g-C3N4/WO3的光催化活性下降。结果表明,g-C3N4的含量对于g-C3N4/WO3复合材料的活性有很大影响,其中g-C3N4的最佳添加量为0.6 g。当g-C3N4的添加量高于0.6 g时,WO3的量不足以在g-C3N4和WO3之间构建有效的异质结来分离和转移光生电子空穴对。当g-C3N4的含量过小时,WO3的含量过高导致复合材料的WO3壳变厚,外层的WO3远离g-C3N4,电荷分离会更低效,光生电子和空穴在移动过程中更容易复合,会降低光催化降解率。
为评价g-C3N4/WO3复合光催化剂的稳定性和重复使用性,在相同条件下用WG-0.6光催化降解OTC 3次,结果如图4(b)所示。OTC经3次光催化降解循环后,WG-0.6的光催化性能略有下降。3次循环实验后,OTC的光催化降解率在120 min内达到77%,表明g-C3N4/WO3复合材料具有良好的光催化稳定性。活性减弱的主要原因是催化剂在循环过程中有所损失。
2.4 光催化降解机理
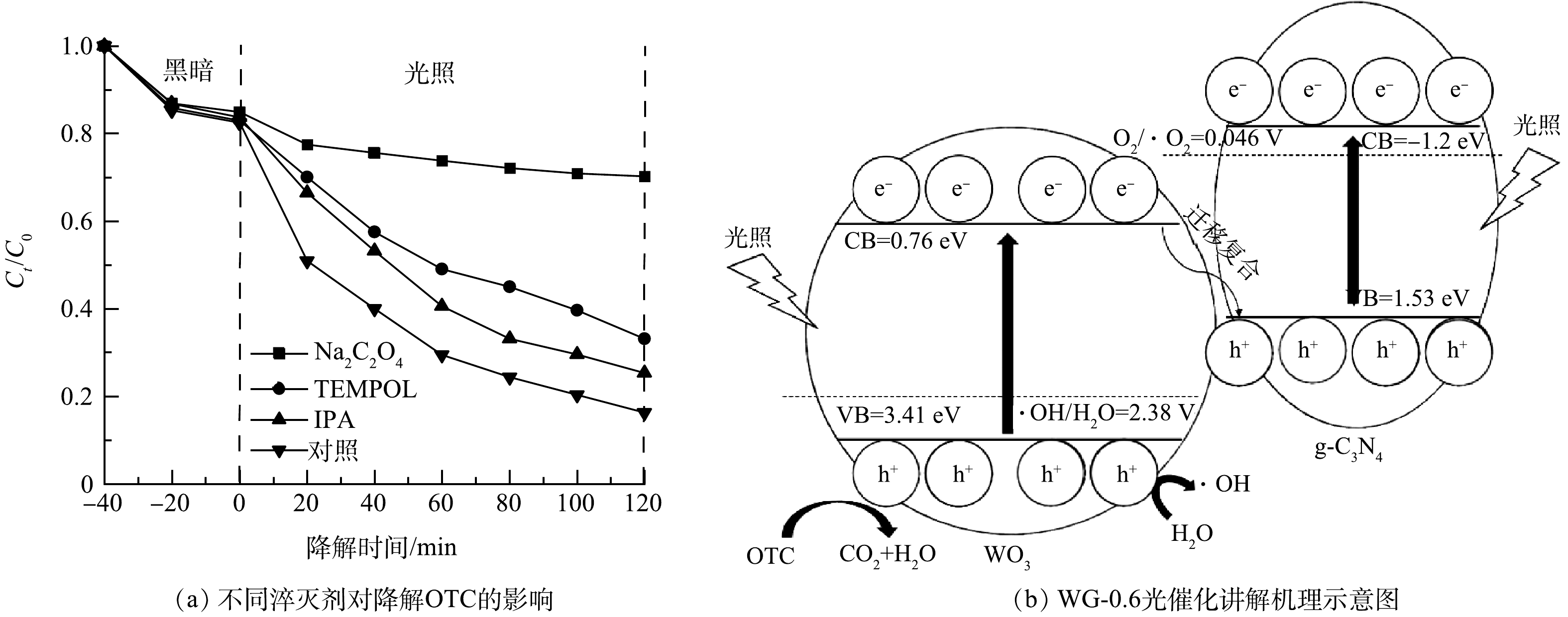
为研究WG-0.6光催化氧化过程中的主要活性物种,进行自由基淬灭实验。如图5(a)所示,光照120 min后,空白对照组和加入Na2C2O4(h+淬灭剂)、TEMPOL(·O2−淬灭剂)、IPA(·OH淬灭剂)后对OTC的光降解率分别为86%、30.2%、66.9%、74.7%,说明h+、·O2−和·OH共同参与g-C3N4/WO3光催化降解OTC反应。其中加入Na2C2O4光催化降解率下降高达55.8%,说明h+在g-C3N4/WO3光催化降解OTC中起主要作用。半导体的导带位置EVB和价带位置ECB可根据经验式(1)~(2)计算[25]。
EVB=X−Ee+0.5Eg (1) ECB=EVB−Eg (2) 式中:X、Ee和Eg分别表示半导体的绝对电负性、自由能和带隙能量。WO3和g-C3N4的X分别为6.59 eV和4.67 eV。Ee大约为4.5 eV,WO3和g-C3N4的Eg分别为2.65 eV和2.73 eV。因此,WO3和g-C3N4的EVB计算分别为3.41 eV和1.53 eV,ECB计算分别为0.76 eV和−1.2 eV。如图5(b)所示,在可见光照射下,g-C3N4和WO3产生光生电子空穴对。因为g-C3N4的ECB比E0(O2/·O2−)=0.046 V更低,g-C3N4导带上的电子可以将溶解的O2还原成·O2−。因为WO3的EVB比E0(·OH/H2O)=2.38 V更高,WO3价带上的空穴可以与水反应生成·OH。WO3导带上的电子开始迁移并与g-C3N4的价带上的空穴复合。最后,OTC在h+、·O2−和·OH的共同作用下被降解。
3. 结论
1)通过原位一步水热法成功合成了g-C3N4/WO3异质结材料。WO3纳米棒均匀地负载在层状的g-C3N4上,形成g-C3N4/WO3异质结结构,光生电子和空穴复合率降低,光吸收范围和吸收强度增强。
2) WG-0.6在可见光照射120 min后OTC降解率高达86%,并且在循环使用3次后仍具有较好催化活性,表现出较高的稳定性。
3) h+、·O2−和·OH共同参与g-C3N4/WO3光催化降解OTC反应,其中h+起主要作用。
-
表 1 15份样本的基本信息
Table 1. Basic information for the 15 samples
案件编号Sequence number 简要案情Brief case 死亡人数Number of deaths 1 2022年1月某地员工矿洞内工作时中毒死亡,之后进入的两位救援人员相继中毒死亡. 3 2 2021年9月某地员工井下作业时中毒死亡. 3 3 2021年7月某地因暴雨导致井位上升,使得居住点临近井位的一家六口全部中毒死亡. 6 4 2021年11月某地梁某在猪饲料厂清理粪池时,中毒死亡. 1 5 2021年10月某地工厂员工下水道作业时中毒死亡. 2 表 2 考察酸碱介质对DMS血样峰面积的影响
Table 2. Examining the effect of acid and base media on the peak area of DMS blood samples
0.01 μg·mL−1 DMS 0.2 μg·mL−1 DMS 0.8 μg·mL−1 DMS 去离子水 0 986 5742 20%硫酸 47 6005 93505 10%磷酸 0 0 0 三氯乙酸 0 2063 19965 饱和硼砂 0 782 5320 0.1%氢氧化钠e 0 0 0 表 3 DMS的相关系数、范围、检出限及定量限
Table 3. Correlation coefficient, range, detection limits and quantification limits of DMS
回归方程Regression equation 范围/(μg·mL−1)Range 相关系数R2 LOD/(μg·mL−1) LOQ/(μg·mL−1) DMS y = 153120x1.755 1 0.01—2.00 0.997 0.003 0.01 表 4 DMS血样的回收率和精密度
Table 4. Recovery rates and precision of DMS blood samples
全血样品浓度/ (μg·mL−1)Concentrations of whole blood samples 回收率/%Average recovery rate RSD/% 日内精密度within-day precision 日间精密度Inter-day 0.8 96 1.6 2.1 0.2 94 2.8 3.5 0.02 97 2.6 3.6 表 5 硫化氢中毒案件中DMS的含量
Table 5. Content of DMS in hydrogen sulfide poisoning cases
序号Sequence number 死亡人数Death toll DMS/(μg·mL−1) 是否检出MTWhether MT is detected ① 3 0.430 √ 0.305 √ 0.280 √ ② 3 0.376 √ 0.296 × 0.215 × ③ 6 0.067 × 0.016 × 0.016 × 0.078 √ 0.093 × 0.027 √ ④ 1 0.247 √ ⑤ 2 0.218 √ 0.079 × -
[1] DILEK N, PAPAPETROPOULOS A, TOLIVER-KINSKY T, et al. Hydrogen sulfide: An endogenous regulator of the immune system[J]. Pharmacological Research, 2020, 161: 105119. doi: 10.1016/j.phrs.2020.105119 [2] 吴凯, 杨相建, 刘春源, 等. 1起硫化氢中毒死亡案例的法医学检验分析[J]. 中国法医学杂志, 2013, 28(1): 85. WU K, YANG X J, LIU C Y, et al. Forensic examination and analysis of a death case of hydrogen sulfide poisoning[J]. Chinese Journal of Forensic Medicine, 2013, 28(1): 85 (in Chinese).
[3] MAEBASHI K, IWADATE K, SAKAI K, et al. Toxicological analysis of 17 autopsy cases of hydrogen sulfide poisoning resulting from the inhalation of intentionally generated hydrogen sulfide gas[J]. Forensic Science International, 2011, 207(1/2/3): 91-95. [4] 吴娜, 王涤新. 硫化氢中毒机制及治疗研究进展[J]. 中国工业医学杂志, 2010, 23(6): 434-436. WU N, WANG D X. Research progress on mechanism and treatment of hydrogen sulfide poisoning[J]. Chinese Journal of Industrial Medicine, 2010, 23(6): 434-436 (in Chinese).
[5] 张震, 张云峰, 吴小军, 等. 硫化氢中毒检验技术研究进展[J]. 分析试验室, 2022, 1(13): 5-12. ZHANG Z, ZHANG Y F, WU X J, et al. Application of molecular signal detection technology for hydrogen sulfide poisoning[J]. Chinese Journal of Analysis Laboratory, 2022, 1(13): 5-12 (in Chinese).
[6] 强火生, 陈航, 沈保华, 等. 硫化氢中毒案件中血液硫离子的测定[J]. 法医学杂志, 2017, 33(2): 148-153. doi: 10.3969/j.issn.1004-5619.2017.02.008 QIANG H S, CHEN H, SHEN B H, et al. Determination of sulfide ion in blood from hydrogen sulfide poisoning cases[J]. Journal of Forensic Medicine, 2017, 33(2): 148-153 (in Chinese). doi: 10.3969/j.issn.1004-5619.2017.02.008
[7] 罗才会, 李剑波, 于天晓, 等. 气相色谱-质谱法测定硫化氢中毒血液中的硫化物[J]. 重庆医科大学学报, 2012, 37(12): 1025-1028. doi: 10.3969/j.issn.0253-3626.2012.12.001 LUO C H, LI J B, YU T X, et al. Determination of sulfide in the hydrogen sulfide poisoned blood using gas chromatograpy-mass spectrometry[J]. Journal of Chongqing Medical University, 2012, 37(12): 1025-1028 (in Chinese). doi: 10.3969/j.issn.0253-3626.2012.12.001
[8] VARLET V, GIULIANI N, PALMIERE C, et al. Hydrogen sulfide measurement by headspace-gas chromatography-mass spectrometry (HS-GC-MS): Application to gaseous samples and gas dissolved in muscle[J]. Journal of Analytical Toxicology, 2015, 39(1): 52-57. doi: 10.1093/jat/bku114 [9] 张震, 吴小军, 魏春明, 等. 三氯乙酸酸化HS-GC-FPD法测定血液中的硫化氢[J]. 中国法医学杂志, 2022, 37(5): 471-474, 484. doi: 10.13618/j.issn.1001-5728.2022.05.012 ZHANG Z, WU X J, WEI C M, et al. Determination of hydrogen sulfide in blood by trichloroacetic acid acidification HS-GC-FPD[J]. Chinese Journal of Forensic Medicine, 2022, 37(5): 471-474, 484 (in Chinese). doi: 10.13618/j.issn.1001-5728.2022.05.012
[10] 褚建新, 满勤, 包朝胜, 等. 分光光度法检测硫化氢中毒血液中的硫化血红蛋白[J]. 法医学杂志, 2003, 19(4): 212-214. CHU J X, MAN Q, BAO C S, et al. Determination of the hemoglobin in poisoned blood by spectrophotometery[J]. Journal of Forensic Medicine, 2003, 19(4): 212-214 (in Chinese).
[11] 刘春霞, 马兴, 魏国华, 等. 一种基于荧光素的高选择性硫化氢荧光探针[J]. 环境化学, 2014, 33(10): 1762-1767. doi: 10.7524/j.issn.0254-6108.2014.10.002 LIU C X, MA X, WEI G H, et al. A fluorescein-based probe for hydrogen sulfide detection with high selectivity[J]. Environmental Chemistry, 2014, 33(10): 1762-1767 (in Chinese). doi: 10.7524/j.issn.0254-6108.2014.10.002
[12] MASEDA C, HAYAKAWA A, OKUDA K, et al. Liquid chromatography-tandem mass spectrometry method for the determination of thiosulfate in human blood and urine as an indicator of hydrogen sulfide poisoning[J]. Legal Medicine, 2017, 24: 67-74. doi: 10.1016/j.legalmed.2016.12.004 [13] 王芳琳, 王炯, 徐建中. 血中甲硫醇的GC-MS检验[J]. 分析测试学报, 2008, 27(增刊1): 42-44. WANG F L, WANG J, XU J Z. GC-MS analysis of methanethiol in blood[J]. Journal of Instrumental Analysis, 2008, 27(Sup 1): 42-44 (in Chinese).
[14] 吴颖娟, 陈飒, 邓怡, 等. HS-SPME/GC/MS法测定水中甲硫醚和二甲基三硫醚[J]. 中国给水排水, 2017, 33(24): 124-127. WU Y J, CHEN S, DENG Y, et al. Determination of dimethyl sulfide and dimethyl trisulfide in water by headspace solid-phase microextraction coupled with gas ChromatographyMass spectrometry[J]. China Water & Wastewater, 2017, 33(24): 124-127 (in Chinese).
[15] 张立江, 冯辉, 景长勇, 等. 顶空气相色谱法测定废水中甲硫醚[J]. 河北工业科技, 2006, 23(1): 31-33. doi: 10.3969/j.issn.1008-1534.2006.01.010 ZHANG L J, FENG H, JING C Y, et al. Determination of dimethyl sulfide in wastewater by headspacegas chromatography[J]. Hebei Journal of Industrial Science and Technology, 2006, 23(1): 31-33 (in Chinese). doi: 10.3969/j.issn.1008-1534.2006.01.010
[16] ÁBALOS M, PRIETO X, BAYONA J M. Determination of volatile alkyl sulfides in wastewater by headspace solid-phase microextraction followed by gas chromatography–mass spectrometry[J]. Journal of Chromatography A, 2002, 963(1/2): 249-257. [17] 王晓姝. 顶空气相色谱法检测尿液及血浆中亚硝酸盐[D]. 苏州: 苏州大学, 2014. WANG X S. Determination of nitrite in urine and plasma by headspace gas chromatography[D]. Suzhou: Soochow University, 2014 (in Chinese).
[18] 刘俊, 张珊, 闫海军. 自动顶空-气相色谱法测定胶囊中9种荷脑的含量[J]. 中国民族民间医药, 2010, 19(19): 27-28. LIU J, ZHANG S, YAN H J. Determination of nine brain brains in capsules by automated headspace-gas chromatography [J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2010, 19(19): 27-28 (in Chinese).
[19] 马英歌, 孙谦, 李莉, 等. 热脱附结合GC-MS测定大气总悬浮颗粒物中的半挥发性有机物[J]. 环境化学, 2017, 36(6): 1424-1427. MA Y G, SUN Q, LI L, et al. Determination of semi-volatile organic pollutants from atmospheric using Thermal Desorption system with Gas chromatography-mass Spectrometer[J]. Environmental Chemistry, 2017, 36(6): 1424-1427 (in Chinese).
[20] 郑烨. 顶空气相色谱直接测定大鼠血样中1-溴丙烷的方法及应用研究[D]. 济南: 山东大学, 2017. ZHENG Y. Method and application research of using headspace gas chromatography to directly measure 1-BP concentrations in rats blood[D]. Jinan: Shandong University, 2017 (in Chinese).
[21] 谢兰桂, 袁淑胜, 韩小旭, 等. 高效液相色谱法测定药用胶塞中的二甲基二硫代氨基甲酸锌[J]. 环境化学, 2021, 40(11): 3631-3634. doi: 10.7524/j.issn.0254-6108.2021.11.hjhx202111038 XIE L G, YUAN S S, HAN X X, et al. Determination of zinc dimethyldithiocarbamate in pharmaceutical rubber closures by high performance liquid chromatography[J]. Environmental Chemistry, 2021, 40(11): 3631-3634 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021.11.hjhx202111038
[22] 侯伟, 张蕾萍, 王继芬, 等. 人体毛发中氯胺酮及其代谢物的超高效液相色谱-串联质谱法检验及含量统计分析[J]. 分析测试学报, 2021, 40(10): 1453-1459, 1466. doi: 10.19969/j.fxcsxb.21031604 HOU W, ZHANG L P, WANG J F, et al. Determination and statistical analysis of ketamine and its metabolites in human hair by ultra-performance liquid chromatography coupled with mass spectrometry[J]. Journal of Instrumental Analysis, 2021, 40(10): 1453-1459, 1466 (in Chinese). doi: 10.19969/j.fxcsxb.21031604
-




 下载:
下载: