-
由于人类活动干扰和自然过程导致大量污染物进入自然水体,所造成的环境污染已严重威胁生态安全、人类健康以及经济发展等. 而自然水体中污染物的迁移、转化以及生物可利用性强烈受到矿物水界面的地球化学过程(如吸附、沉淀、溶解以及多相催化等)影响[1-2]. 因此,通过调控矿物与环境污染物的地球化学过程以此强化矿物对环境污染物的净化能力,被认为是解决自然水体污染的有效途径之一[3-4].
铁的氢氧化物(羟基氧化铁)和氧化物(以下简称铁氧化物)在地表环境中分布广泛、资源丰富、价格低廉并具有大的比表面积、活跃氧化还原性以及电子输运能力,且与环境相容性好,是环境自净化的重要贡献者[5-7]. 在黑暗环境中,铁氧化物可通过化学吸附和静电引力吸附去除环境中的污染物,污染物的吸附量取决于铁氧化物的表面性质,如比表面积、表面羟基密度、表面电荷等,所涉及的吸附机制主要包括静电引力、配体交换、疏水作用、熵效应、氢键结合、离子架桥等[6, 8-10]. 例如,铁氧化物对砷(As)具有良好的亲和力,是自然环境中一种最重要的固定砷的吸附剂[5, 9]. Yu等的研究表明水铁矿依靠自身大的比表面积和高的活性羟基密度对As(V)有很好的吸附能力,吸附容量高达160 mg·g−1[11]. 而在光照条件下,具有半导体性质的铁氧化物(如针铁矿、赤铁矿)被光激发产生光生电子与空穴,其中光生电子转移至分子氧后可以形成O2·−,O2·−可以继续得电子和质子生成H2O2,H2O2又进一步发生反应生成·OH,所产生的活性氧物种可使有机污染物降解甚至矿化. 铁氧化物光催化降解有机污染物己被广泛研究[12-22]. 李芳柏教授团队[23]发现,土壤中的纤铁氧化物、磁赤铁矿、赤铁矿在紫外光与可见光下辐射下均可降解双酚A. 另一方面,光(<580 nm)的引入可以促使Fe(Ⅲ)光解还原成Fe(Ⅱ),而Fe(Ⅱ)在一定程度上可以通过活化分子氧产生活性氧物种[24]. 两种途径所产生的H2O2与Fe(Ⅱ)构成Fenton反应,可产生强氧化性的·OH. 虽然铁氧化物具有一定的光化学活性,但众多研究结果显示其光化学活性却很低[25- 26].
自然环境中天然有机物(如草酸、腐殖酸等)常与铁氧化物共存于自然水体和土壤,能与其结合形成可溶性络合物. 其中,草酸主要来自植物根系、根系周围微生物和真菌的分泌物,或者酚类物质的降解中间产物,自然水体中草酸浓度一般在2.5 × 10−5 mol·L−1 到4.0 × 10−3 mol·L−1之间[27]. 在暗黑环境中,草酸的存在会在一定程度上影响着铁氧化物的化学吸附和静电引力吸附能力[28]. 这是因为草酸与污染物之间存在竞争或者协同吸附,而具体的作用方式与污染物的类型以及草酸浓度有关. Lamy等[29]发现,草酸的存在能促进针铁矿对Cd的吸附,主要是由于草酸在针铁矿与Cd之间担任“架桥”角色. Flynn等[30]运用EXAFS 和ATR-FTIR分析发现草酸与Ni2+可在针铁矿和赤铁矿表面形成三元络合物,而溶解态草酸与Ni2+较容易形成二元络合物,导致针铁矿和赤铁矿吸附Ni2+的效果下降. 由此可见,草酸与铁氧化物之间的相互作用会强烈地影响着环境中的污染物迁移转化,反之亦然. 当引入光照后,光照可为草酸与铁氧化物之间的电子转移过程提供额外的光化学途径,能显著促进草酸-铁氧化物光化学体系中活性氧(O2·−、·OH、H2O2等)的生成,进而提高体系中污染物的降解效率.
目前,铁离子与草酸光化学过程研究介质涉及水体、土壤、空气等,这些研究均表明不同介质中共存的Fe(Ⅲ)与草酸均能在光源照射下活化分子氧产生活性氧物种[23, 31-32]. 铁(Ⅲ)-羧酸盐光化学体系已被证明可诱导多种持久性污染物的光降解,包括含氯除草剂、肥料、双酚、药物等[33-38]. 与此同时,自然光下草酸铁体系的有效光降解能力也已得到证明[39]. 由此,利用天然存在的草酸强化铁氧化物净化环境污染物的能力,被认为可为发展原位环境修复技术提供新契机. 近年来,针对草酸-铁氧化物光化学体系中草酸在铁氧化物表面上的吸附/溶出行为与污染物降解效率、动力学以及途径之间的相关性进行了大量报道. 已涉及的铁氧化物包括针铁矿、纤铁氧化物、赤铁矿、磁赤铁矿和磁铁矿等[26-27, 29-30],而不同结构的铁氧化物光化学活性差异巨大. Huang等[40]通过研究草酸与不同铁氧化物,如赤铁矿、针铁矿、磁铁矿以及磁赤铁矿,与草酸发生光化学反应原位产生活性氧物种降解诺氟沙星. 研究结果发现不同铁氧化物体系诺氟沙星的降解效率不同,其中针铁矿的效果最高,其次为赤铁矿,而磁铁矿与磁赤铁矿光化学效果接近.
对于草酸与铁氧化物的相互作用及光化学过程而言,主要包含以下几个重要过程:(1) 草酸在铁氧化物表面吸附,形成具有高光化学活性的Fe(Ⅲ)-草酸配合物;(2) Fe(Ⅲ)-草酸配合物在光照下,吸收光子,发生光生电荷转移及光分解;(3) 光解产物促进分子氧活化,产生活性氧物种;(4) 活性氧物种降解污染物. 因此,草酸-铁氧化物体系污染物去除效率取决于体系中活性氧的物种形式与含量,而其的产生与转化途径受控于草酸在铁氧化物表面的吸附与转化特性,即草酸与铁氧化物相互作用.
本文综合论述了草酸与铁氧化物相互作用过程含草酸在铁氧化物表面吸附过程和草酸诱导铁氧化物溶出过程、铁氧化物表面和溶于液相中的草酸铁络合物光分解过程以及活化分子氧过程以及各个过程对体系中污染物降解的影响,并对其未来研究方向和应用前景进行了总结与展望.
-
相对于草酸铁均相体系而言,草酸与铁氧化物的异相体系需先进行一个“吸附”过程,再进入光诱导反应阶段,即草酸需先吸附于铁氧化物表面,继而溶解络合形成草酸铁配体[41]. 由于草酸在铁氧化物表面的吸附配位构型制约着体系中表面光生电子的生成和传递效率,同时还影响着溶解于液相中的草酸铁配合物形式. 因此,要深入研究草酸与铁氧化物的相互作用及其环境光化学效应,首先要明确草酸在铁氧化物表面的吸附配位构型.
-
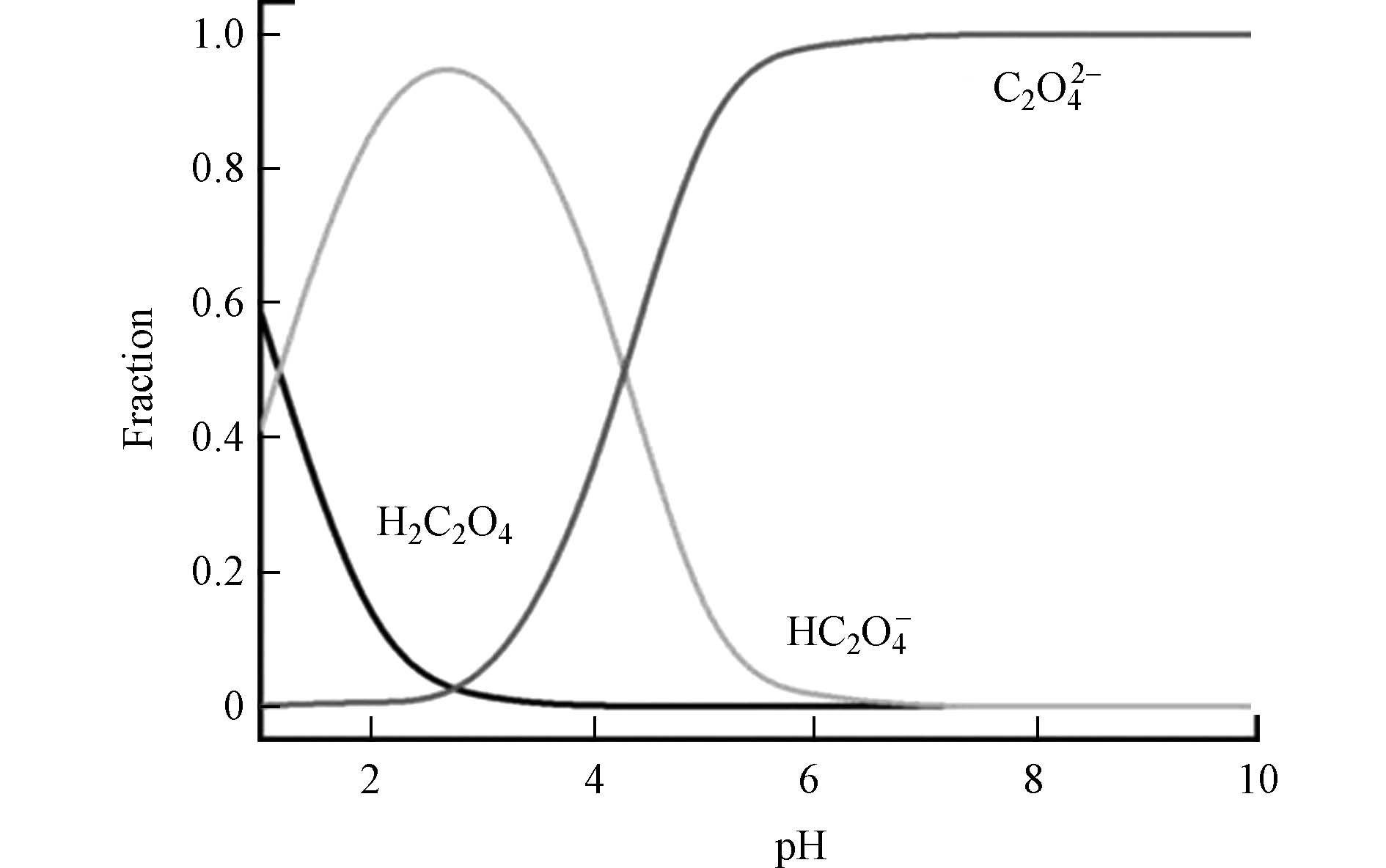
草酸根在溶液中存在电离平衡,平衡常数为 pKa1 = 1.17和 pKa2 = 4.15,分别对应有3个物种,即H2C2O4、HC2O4−和C2O42−. 草酸根物种形式对 pH 值有高度的依赖性,其关系如图1所示.
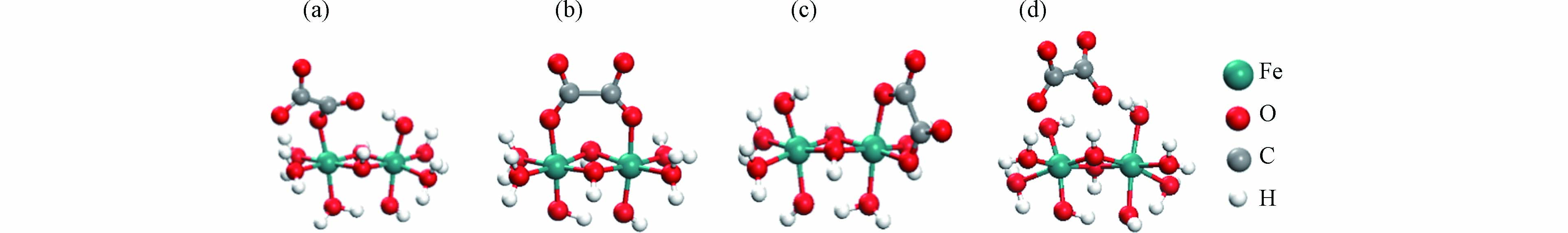
在自然水体中草酸多以阴离子形式存在,而在自然界中铁氧化物的表面大多都带正电荷,因此草酸可以很容易通过静电引力吸附到带正电的铁氧化物表面[43]. 草酸可以在铁氧化物表面上形成多种不同的络合构型 [44-45],包括氢键结合的外核络合物(草酸的H原子键合到与Fe原子相连的OH基)和几种内核络合物,例如单核双齿(草酸的2个O原子与1个Fe原子结合)、单齿单核(草酸的1个O原子与1个Fe原子结合)和双核双齿(草酸的两个O原子分别与1个Fe原子结合)[46],如图2. 利用傅立叶变换衰减全反射红外光谱法(ATR-FTIR)与DFT 计算可确定草酸在铁氧化物表面的吸附配位构型. 前人对草酸在铁氧化物表面吸附与溶出行为的研究主要聚焦于利用傅立叶变换衰减全反射红外光谱法(ATR-FTIR)分析草酸诱导铁氧化物溶解行为,并结合密度泛函理论(DFT)计算的方式探讨草酸在铁氧化物表面的吸附络合构型.
草酸在铁氧化物表面的络合构型与体系溶液的pH有关. Borowski [45]等采用ATR-FTIR结合DFT理论计算的方式研究了不同pH下草酸在纤铁氧化物表面的络合构型. 研究结果显示,草酸在纤铁氧化物表面可形成3种络合构型,分别为外核氢键构型,和单核双齿以及双核双齿的内核构型. 在pH 6时,主要形成的是外层络合物,而随着pH的下降,络合物逐渐以单核双齿的内层络合物为主. Bhandari [44]等采用ATR-FTIR/DFT手段发现草酸以单核双齿的形式吸附在水铁矿表面. Kubicki等[47]同样也发现草酸是以单核双齿的形式吸附在针铁矿表面. 目前的研究结果认为,草酸在铁氧化物如赤铁矿、针铁矿、水铁矿、纤铁氧化物表面均以单核双齿的形式存在. 与此同时,草酸在同种铁氧化物表面的吸附络合构型也受草酸与铁含量的比值影响. 在pH 4.5条件下草酸含量相对较低时(草酸/Fe < 0.1),水铁矿表面吸附态的草酸呈双核双齿构型;而当草酸含量增加时(草酸/Fe ≥ 0.1),水铁矿表面的双核双齿草酸铁络合物被单核双齿构型和氢键外层络合构型络合物替代[48].
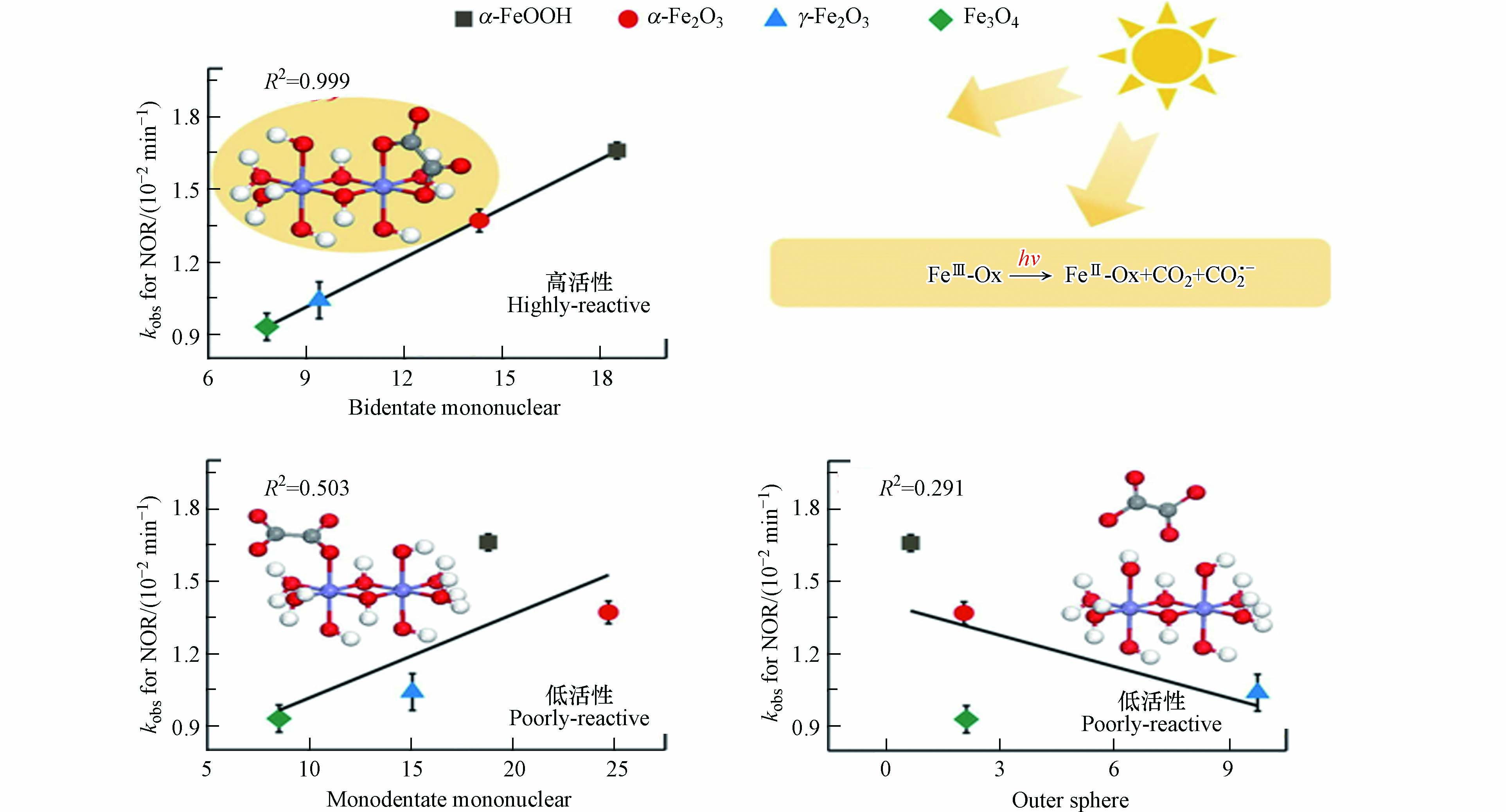
络合构型的不同影响着草酸诱导铁氧化物溶解速率和体系中污染物的降解效率. 如纤铁氧化物的溶解速率与表面形成的单核双齿络合物含量呈正比关系,而不是草酸的总浓度[45]. 在紫外线下(365 nm),单核双齿的光分解速率高于双核双齿和外核氢键络合物,这也意味着单核双齿络合物的草酸-铁氧化物体系污染物的降解效果更好. 图3所示为草酸吸附在针铁矿、赤铁矿、磁铁矿以及磁赤铁矿表面所形成的草酸铁络合物构型与体系中诺氟沙星降解效率之间的关系[40]. 从图3可以看出,诺氟沙星的降解效率于铁氧化物表面的单核双齿构型的内核络合物的含量呈正相关,而与双核双齿构型的内核络合物以及外圈构型的络合物相关性不大. 由此可见,通过调控草酸在铁氧化物表面的吸附络合构型可以提高体系催化降解污染物的能力.
值得关注的是利用现代先进谱学技术考察不同体系中铁氧化物吸附草酸后光照下的光生电荷转移过程,分析光生电荷动力学,揭示光照下草酸在铁氧化物表面不同配位构型对吸光行为以及光生电荷转移的影响;同时结合理论计算揭示草酸修饰前后电子排布与Fe—O键变化,阐明草酸-铁氧化物光化学体系光驱动电荷转移机制. 在此基础上结合草酸在铁氧化物表面的吸附与转化特性,深入揭示草酸-铁氧化物光化学体系界面反应过程具有一定研究意义.
-
铁氧化物的光化学溶解被认为是维持人体生物铁和海洋浮游植物的生长不可替代的重要途径,铁氧化物的溶解与生物地球化学循环与环境污染修复等息息相关[42, 49]. 铁氧化物表面的Fe(Ⅲ)在光激发下,可能会发生轻微的光还原转化为Fe(Ⅱ),并参与活性氧物种的生成. 而有草酸存在时,铁氧化物的铁浸出显著提高[50-51].
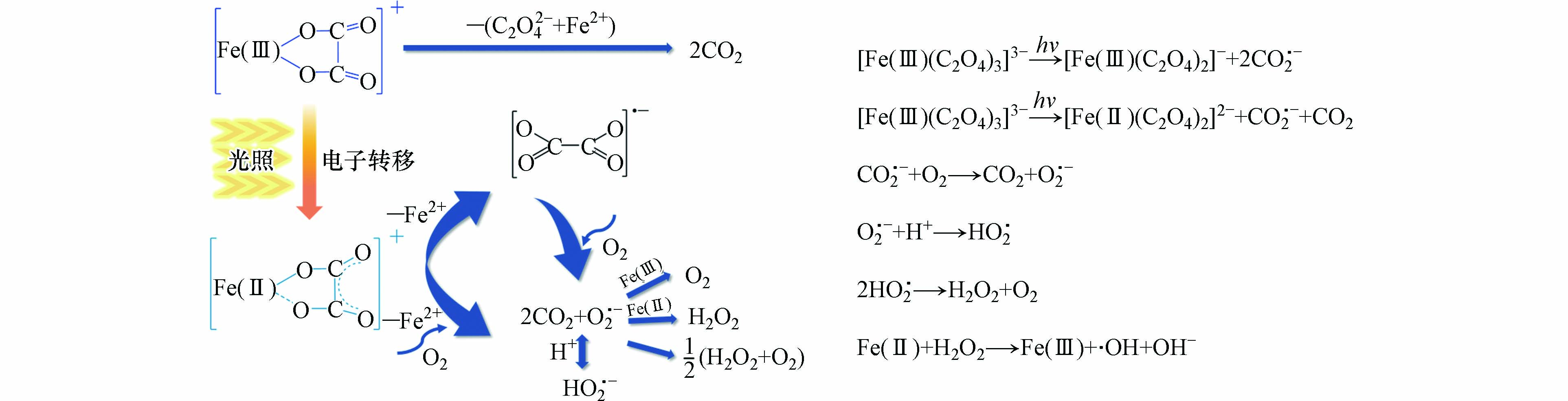
对于草酸-铁氧化物体系而言,草酸的络合作用可以促使草酸铁络合物通过非还原溶解或还原溶解的形式从铁氧化物表面脱落[27, 52]. 其中,非还原溶解是指吸附在铁氧化物表面后所形成的草酸铁络合物进入到液相中,铁的价态未发生变化,过程如公式(1)所示:
这一过程具有较高的反应能,低温下进行缓慢. 在光照的条件下,铁氧化物表面的Fe(Ⅲ)-Ox络合物发生光敏反应弱化了Fe(Ⅲ)—O键,部分以Fe(Ⅲ)-Ox络合物的形式溶解进入液相.
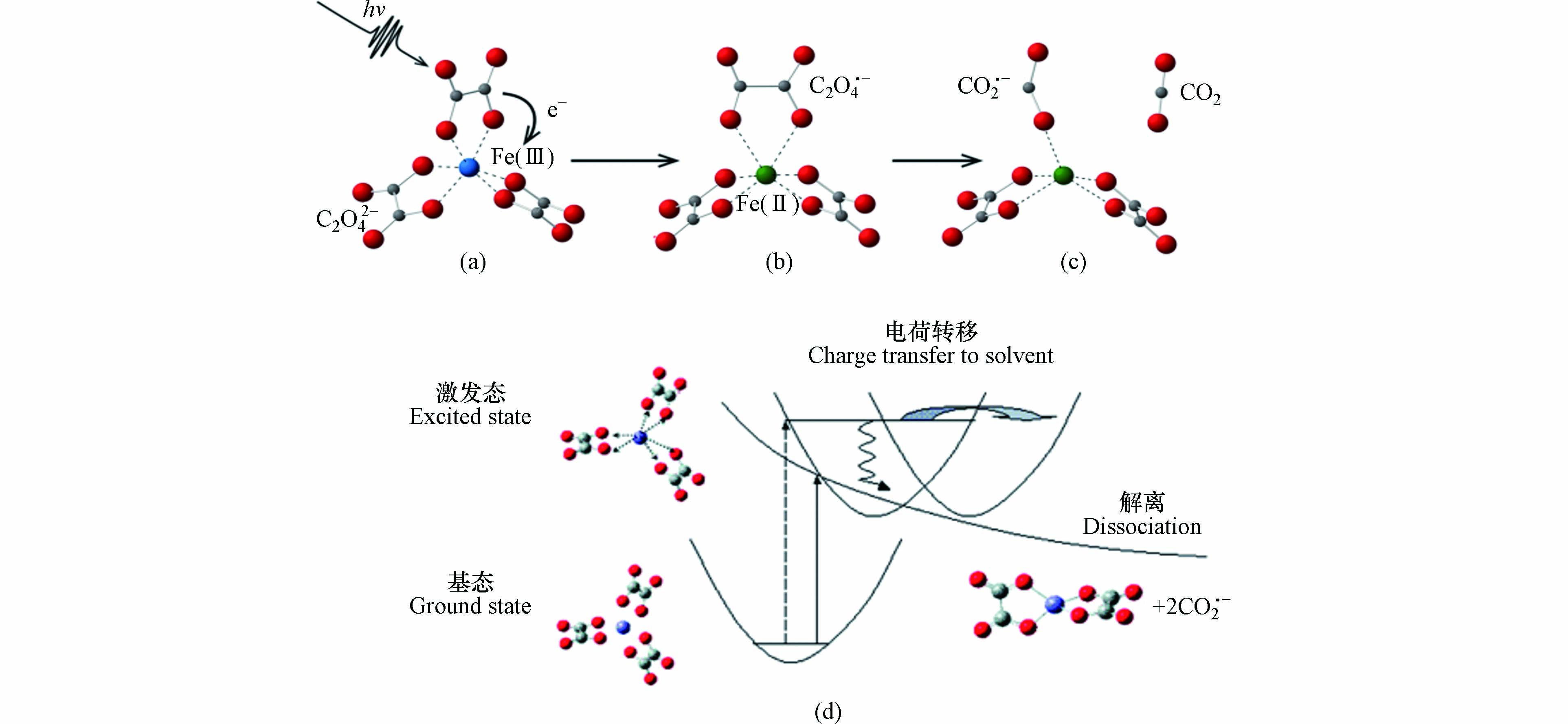
还原溶解过程是吸附在铁氧化物表面的草酸铁络合物在光的激发下发生了配体至金属的电荷转移过程(LMCT),即草酸转移一个电子给Fe(Ⅲ)使其还原为Fe(Ⅱ),草酸则发生氧化过程分解了CO2和CO2·−. 由于Fe(Ⅱ)与O之间的作用力很弱,因此铁氧化物表面的Fe(Ⅱ)会倾向于溶解至液相中.
影响溶解机制最主要的因素有pH、温度和光照[52]. 由于草酸铁高的光化学活性,光照能为电子转移过程提供额外的光化学途径,使其可以大大促进公式(2)的反应过程,从而加快铁氧化物的光还原溶解. 在光照辐射下,草酸诱导铁氧化物溶解过程的主导反应是光化学反应而非热力学反应,光的催化作用克服了电子转移所需的活化能,且光入射波长对赤铁矿的光还原溶解影响很大[52].
草酸-铁氧化物光化学体系中有机污染物的去除效率与铁氧化物吸附草酸能力以及草酸诱导铁溶出量均呈正相关,即草酸吸附量越大、铁离子浸出量越高,则体系中污染物去除效果越好[53-54]. 液相中的铁离子主要来源于铁氧化物表面草酸铁配体的光还原溶解(Fe2+)和非还原溶解(Fe3+). 而草酸诱导铁氧化物表面铁离子溶出方式的不同造成了体系中污染物降解的决速步骤不一致. 部分研究者认为污染物的降解速率由铁氧化物光化学还原溶解至液相的Fe2+含量决定. Mazellier和Sulzberger[55]在研究针铁矿(α-FeOOH)与草酸异相光化学体系降解农药阿特拉津的时候发现,针铁矿光还原生成溶解态Fe(Ⅱ)的速率及草酸作为电子供体决定了阿特拉津在此类异相体系中的动力学. 而也有研究者认为,非还原溶解于液相中的草酸铁络合物的光还原过程才是污染物降解的关键. Huang等[56]发现,适当的延长草酸-磁铁矿体系预吸附时间,溶于液相中的草酸铁络合物含量增加,促使体系中诺氟沙星去除率提高. 当预吸附时间为120 min时,光照1 h后,诺氟沙星去除速率由0.0036 min−1提高至0.0398 min−1. 因此,适当的延长预吸附时间是提高污染物降解效率的一种有效手段.
目前判断草酸诱导铁氧化物溶出的方式主要是根据浸入到溶液中铁离子的价态. 溶液中的 Fe(Ⅱ)或表面结合的Fe(Ⅱ)可以在LMCT过程中直接产生,也可能来源于铁氧化物表面Fe(Ⅱ)的溶解释放或溶液中Fe(Ⅱ)被重新吸附回铁氧化物表面. 因此,单靠鉴别铁离子价态的方式判断草酸诱导铁氧化物溶出方式并不准确,需要结合其他的手段原位深入研究铁溶出过程. 此外,影响草酸诱导铁氧化物溶出方式如铁溶出与吸附络合构型、铁氧化物的晶体结构之间的内在联系,目前尚未解决,还需进一步研究.
-
不同形式的草酸铁配体的光化学活性存在巨大差异[57, 58],如,Fe(C2O4)+、Fe(C2O4)2−、Fe(C2O4)33−在254 nm 波长光辐射下量子产率分别为0、1.18和1.60,在436 nm下量子产率分别降低至0、1.0和0.6[59- 60]. 目前,草酸-铁氧化物光化学体系液相中草酸铁配体的形式主要根据Panias等[61]通过研究纯铁氧化物吸附草酸的热力学过程推导出的公式来确定. Lan等[53]报道磁赤铁矿(γ-Fe2O3)和草酸盐的紫外光照体系降解五氯苯酚(PCP)时根据体系中草酸浓度变化以及Fe2+和Fe3+随时间变化情况,结合Panias推算出来的公式计算出了各草酸铁络合物在反应过程中的比例变化. 结果显示不同初始草酸浓度体系,Fe(C2O4)2−和Fe(C2O4)33−均是主要的草酸铁络合物物种,而在草酸初始浓度为0.8 mmol·L−1时,Fe(C2O4)2−是主导的草酸铁络合物物种.
但是该计算方法忽略了光照对草酸诱导铁氧化物表面铁离子溶出过程的影响,难以真实地反映出草酸-铁氧化物光化学体系液相中草酸铁配体的形式. 近年来,随着谱学分析技术在金属配合物化学性质研究中的应用,可以清晰得到不同配合物结构形式的光学谱图[45],尤其是通过引入计算模拟方法,可以深层次分析液相羧酸铁配合物的结构特性[24],如表面增强拉曼光谱法(SERS)和高效液相色谱-电喷雾质谱(HPLC-ESI-MS)[62]. 研究者采用ATR-FTIR与DFT理论相结合的手段、联合SERS和HPLC-ESI-MS技术研究水铁矿-草酸体系界面反应过程,发现草酸吸附在水铁矿表面后形成了单核双齿络合物,而后该单核双齿络合物以Fe(C2O4)+的形式非还原溶解于液相中,并快速的转化为Fe(C2O4)2−. 而进入液相中Fe(C2O4)2–络合物则通过配体至金属电荷转移过程(LCMT)快速光解,其光分解速率远高于均相体系的络合物Fe(C2O4)33–[46].
草酸铁配体形式与pH、Fe(Ⅲ)与草酸盐含量比例有关[62]. 研究发现在pH小于3时,Fe(C2O4)+是唯一优势物种,对污染物的降解速度有负面影响;而在pH值为3和5时,以Fe(C2O4)2−和Fe(C2O4)33−两种主要形式并存,此时污染物的降解速率显著提升[63]. 因此,有望通过合理调控pH以及铁氧化物与草酸盐含量的比例来控制体系中草酸铁物种的形式强化草酸-铁氧化物体系的光化学性能.
-
目前关于草酸铁均相体系中Fe(Ⅲ)-Ox络合物光化学分解途径有两种[57, 64-65]. 一种为分子内的配体至金属电荷转移过程(LMCT),Fe(Ⅲ)-Ox络合物在100 ps内迅速分解为Fe(Ⅱ)、CO2 和CO2·− (图4a, b, c). 另一种分解途径为光离解过程,该过程中涉及Fe—O键的断裂,但是草酸不转移电子给Fe(Ⅲ),电子全部用于生成CO2·−. 因此该过程中Fe(Ⅲ)-Ox络合物在100 ps内迅速分解的产物为Fe(Ⅲ) + 2CO2·− (图4d). 尽管该两种过程还存在争议,但是基于大部分报道的草酸铁光化学体系中产生了Fe(Ⅱ),目前普遍更接受草酸铁络合物的光分解遵循LMCT机理[40, 54, 57],具体过程如公式(2—5)所示.
这一过程为诱导阶段,溶解速率相对缓慢. 而随着溶液中Fe(Ⅱ)离子的积累,铁氧化物溶解速率加快,进入了自发溶解阶段,过程如公式(6—9)所示.
首先溶液中的Fe(Ⅱ)或Fe(Ⅱ)-Ox络合物重新被吸附回到铁氧化物表面,并在表面架桥形成Fe(Ⅲ)-C2O42−-Fe(Ⅱ)络合物;随后,Fe(Ⅲ)-C2O42−-Fe(Ⅱ)络合物中外层的Fe(Ⅱ)自发转移到电子至Fe(Ⅲ)[52, 56],产生Fe(Ⅱ)-C2O42−-Fe(Ⅲ)络合物;外层的C2O42−-Fe(Ⅲ)络合物不稳定会被重新释放溶解于水体中.
在异相铁氧化物-草酸体系中,铁氧化物表面所吸附的草酸铁配体(吸附态)与溶液中的草酸铁配体(溶解态)均参与了整个光催化过程,对目标污染物的降解均有贡献[56, 66]. 但是较少有研究很好的区分异相和均相光化学反应过程对污染物去除的贡献,最常用的手段之一是通过对比研究相同溶解态铁离子含量的均异体系中光化学去除污染物性能的差异性. Li等[66]发现当异相体系(1 g·L−1铁氧化物+1.2 mmol·L−1草酸)与均相体系(0.75 mmol·L−1 Fe3+ +1.2 mmol·L−1草酸)中的溶解态Fe(Ⅲ)浓度相近时,365 nm紫外光照射40 min后,双酚A在异相铁氧化物体系的降解率(84.0%)明显高于其在均相体系中的降解率(58.8%),这说明,固体表面所发生的草酸铁的LMCT反应显著影响整个体系的动力学. 研究者发现,通过引入预吸附的手段可以区分均相/异相反应对污染物去除的贡献,且非还原溶解液相中草酸铁络合物的LMCT光分解制约着体系中有机污染物的去除速率[56]. 预吸附时间越长,则非还原溶入液相的草酸铁络合物含量越高,体系中有机污染物的去除速率也越快.
近年来,随着原位谱学分析技术在固液界面有机配体化学性质研究中的应用,可以原位清晰观察配体含量在光反应过程中的变化. 比如,原位ATR-FTIR技术在红外光谱仪样品室加装一个含原位池的漫反射装置,能成功规避光照对红外信号的干扰,可以在光照下有效观察固体表面吸附物种变化以及光反应中间产物的生成,结合XPS等手段分析铁氧化物铁元素价态变化,可以直观草酸在铁氧化物表面光分解等界面反应过程. Xu等[62, 67]采用ATR-FTIR的手段原位观察了草酸在水铁矿、赤铁矿表面吸附后在可见光辐射下的FTIR波谱变化,并结合反应前后的Fe 2p3/2 XPS谱变化,发现草酸在水铁矿表面难以分解,而在赤铁矿表面可以通过光解离途径进行分解. 此外,通过吸附一段后时间分离固液的方法发现水铁矿体系的液相草酸铁络合物是通过典型的LMCT过程分解,而赤铁矿体系中液相草酸铁络合物同样是通过光解离途径分解. 总体而言,对于不同结构性质的铁氧化物,与草酸构成的光化学体系中的界面反应过程不同.
总体而言,铁氧化物-草酸光化学体系中的界面反应过程强烈依赖铁氧化物的结构性质,而相关的研究尚不能清晰阐明二者之间的内在联系. 这主要是由于现有的研究手段难以从原子层面深入分析,其次体系太复杂,影响因素太多,比如常规的pH、铁氧化物晶面效应、共存体系常规阴阳离子干扰、金属掺杂铁氧化物等等因素.
-
在活性氧物种(ROS)的形成过程中,分子氧在其中起着重要的作用[68]. 研究者发现,在脱氧条件下体系中无过氧化氢(H2O2)生成,难以产生有效的活性氧物种,360 min后非草隆仅为22%的轻微降解;而自由曝气条件下,非草隆在180 min内能够实现完全降解,且降解产物的毒性明显降低;强制曝气时非草隆在120 min即可完全降解[69]. 通常认为草酸-铁氧化物光化学体系中活性氧物种的生成主要有3个阶段,分别为铁氧化物表面与液相中的草酸铁配体光分解产生CO2·−、活化分子氧生成活性氧物种(O2·−、H2O2),以及光还原产生的Fe(Ⅱ)或Fe(Ⅱ)−草酸络合物与H2O2发生Fenton反应产生·OH,反应历程如图5所示.
通常而言,因·OH具有较高的氧化能力(氧化电位为2.8 eV),污染物的降解效率主要取决于整个过程中产生的·OH 的数量. 前人均认为·OH是通过两步法生成的,即为O2·−→H2O2→·OH [55, 69]. 活化分子氧产生的O2·−进一步与H+/OH−反应产生H2O2,而后H2O2与Fe(Ⅱ)进行Fenton反应产生·OH(两步法过程). 因此在已报道的铁氧化物-草酸光化学体系,研究者不仅探讨了·OH产生过程,同时也定量分析了H2O2浓度. 例如,紫外光辐射下草酸浓度为1 mmol·L−1时,磁铁矿-草酸体系中H2O2浓度最高浓度为45 μmol·L−1 [56]. 而在磁赤铁矿-草酸-UV体系[53]和赤铁矿-草酸-UV体系[69]中,H2O2浓度分别为2 mg·L−1 (58.8 μmol·L−1) 和4 mg·L−1 (117.6 μmol·L−1). 然而,水铁矿-草酸体系H2O2抑制剂CAT对·OH 的产生几乎无影响. 与此同时,在整个光化学过程中,几乎检测不到 H2O2, 表明·OH并不是来自于Fe(Ⅱ)与H2O2组成的Fenton反应过程. 然而Fe(Ⅱ)却显著影响着·OH的生成. 因此,草酸-水铁矿体系O2·−和Fe(Ⅱ)可一步产生·OH,无需通过先产生中间产物H2O2. 与两步法相比,草酸-水铁矿体系中一步法·OH的产生量远高于均相体系的两步法,因此可更快速有效地降解水体中污染物.
此外,草酸铁络合物光分解途径的不一样也会显著影响体系中活性氧物种的产生. 如上文中介绍,理论上一个Fe(Ⅲ)-Ox分子通过光解离和LMCT途径分解可分别产生一个和两个CO2·−自由基[64- 65]. 因此,光解离过程中的O2·−产生量应高于分子内LMCT过程中的产生量. Xu等[67]采用EPR技术分析了赤铁矿-草酸光化学体系和同异相体系光反应和暗反应最高溶解铁离子含量相同的均相铁离子-草酸均相光化学体系中·OH和O2·−产生情况,发现遵循光分解途径的异相体系不管是·OH还是O2·−含量均高于均相体系. 更多的活性氧物种生成量指示着污染物降解效率的提高,这在一定程度上表现出光分解途径的优越性.
草酸-铁氧化物光化学体系中ROS的产生与转化是污染物降解的关键,如何调控ROS的产生过程来提高污染物降解效率是目前的研究重点与热点. 然而,ROS的产生途径与草酸铁类型、浓度以及铁氧化物的结构性质之间的内在联系尚不明晰,还需进一步探索.
-
铁氧化物与草酸之间的协同光化学作用强烈影响着环境中污染物的迁移与转化,使其在环境领域备受关注. 而在草酸-铁氧化物体系优异的污染物降解效果得到证实之后,其光化学体系应用于环境修复的前景发现之余,深刻明晰该体系光化学反应过程及内在机制显得尤为重要. 草酸与铁氧化物表面的铁络合形成高光化学活性草酸铁配体,光辐射下可通过活化分子氧促使生成活性氧物种,进而提高体系中污染物的降解效率. 然而,分子氧活化效率除了受氧含量制约之外,还受控于草酸在铁氧化物表面上的吸附/溶出、电子转移以及氧化还原过程. 本文系统总结了光照下草酸在铁氧化物表面的吸附与转化特性、草酸铁络合物光分解以及光化学活化分子氧途径,这些成果为有机污染物的控制和原位环境修复奠定理论基础和提供技术支持. 然而由于体系的复杂性,光子被吸收后发生的光生电荷转移及铁溶出过程研究不够深入,草酸铁络合物结构性质与界面光化学分解之间的联系仍待进一步探索,有关草酸-铁氧化物体系光驱动电荷过程尚未揭示,草酸与铁氧化物界面反应机制及其环境效应仍需进一步研究讨论. 未来随着相关的环境光化学过程与机理被阐明,研发自然界中广泛存在的铁氧化物和天然小分子酸相结合的绿色、环境友好的污染控制技术,采用少量干预增强环境自净取得环境效益,将成为解决自然水体污染的有效途径之一,也是未来研发污染物控制技术的新方向.
草酸与铁氧化物相互作用及光化学活化分子氧过程的研究进展
Environmental photochemical behaviors of iron minerals and oxalate and reactive oxygen species generation: A review
-
摘要: 草酸与铁氧化物共存于自然环境中,二者之间的相互作用及光化学行为强烈影响着分子氧的活化. 而分子氧活化影响共存体系中污染物的迁移与转化,是发展绿色污染控制氧化技术的关键. 因此,探讨草酸与铁氧化物之间的相互作用与光化学活化分子氧是目前的研究热点之一. 本文系统总结了近年来围绕草酸与铁氧化物相互作用以及草酸诱导铁氧化物活化分子氧的研究成果,论述了草酸在铁氧化表面的吸附与转化特性、草酸铁络合物光化学过程以及活性氧产生与转移途径,同时探讨了上述过程对环境污染物降解的影响,借此加深理解草酸诱导铁氧化物环境光化学行为与活化分子氧原理,并对今后的研究发展方向提出了展望,以期为利用天然铁氧化物和有机质发展原位环境修复技术提供依据.Abstract: Oxalic acid or oxalate (Ox) and iron minerals coexist in the natural environment. The interaction and photochemical behavior between Ox and iron minerals strongly affect the process of molecular oxygen activation. Molecular oxygen activation affects the migration and transformation of pollutants in the coexisting system, which is the key to the development of green pollution control oxidation technology. Therefore, exploring the interaction between Ox and iron minerals and subsequent photochemical activation of molecular oxygen is one of the current research hotspots. This review systematically summarizes the recent research on the interaction between Ox and iron minerals, the adsorption behaviors of Ox on the surface of iron minerals and its conversion features, Fe(Ⅲ)-oxalate complex photolysis, and reactive oxygen species (ROS) generation. Moreover, the influence of the above process on the degradation of pollutants is also discussed. This review can deepen the understanding of the photochemical transformation of organic contaminants with the activation of molecular oxygen by iron minerals, and put forward the prospect of future research development direction. Furthermore, this review may provide a basis for the development of in situ environmental remediation technologies using natural iron minerals and organic matter.
-
Key words:
- oxalate /
- iron mineral /
- photoactivation of molecular oxygen /
- photodegradation /
- Fe-oxalate complex
-
砷在地壳和天然矿物中广泛存在,也是世界各地水生态系统的主要污染物之一[1-2]。砷在地下水中主要以As(Ⅲ)和As(Ⅴ)形态存在,由于As(Ⅲ)更容易被细胞摄取,故其毒性比As(Ⅴ)更强[3]。砷污染地下水广泛分布在6大洲70多个国家,包括孟加拉国、印度、中国、越南、尼泊尔、墨西哥、匈牙利、阿根廷等[4]。部分地区地下水中砷的浓度可以达到数百甚至数千微克每升,远远高于世界卫生组织所推荐的饮用水中10 μg·L−1限值[5]。长期摄入砷可能引发皮肤病、心血管疾病以及其他各种癌症[6]。地下水砷污染是一个严重的环境问题,因此地下水砷污染的治理也一直是研究热点。
吸附法以其高效、灵活、成本低、操作简便等优点被广泛应用于水体中砷的去除[7]。有研究表明,铁氧化物对As(Ⅴ)有较好的吸附作用,但地下水中的砷通常以As(Ⅲ)形态存在,ZHANG等[8]制备了一种铁锰二元氧化物吸附剂,利用锰氧化物氧化和氧化铁吸附作用机制实现了地下水中As(Ⅲ)的高效去除。近年来,纳米零价铁(nano zero-valent iron,nZVI)因其体积小、比表面积大、还原性强、吸附性能好、环境友好等特点,被广泛应用于水体中重金属和有机物污染物的控制[9-10]。此外,有研究[11]表明,nZVI材料在地下水砷污染控制中具有明显优势。
目前,关于nZVI除砷的研究主要是在实验室模拟地下水的严格厌氧环境中,或直接暴露在大气环境下进行的[12-13]。溶解氧的存在明显影响了nZVI在水溶液中的反应行为及对砷的去除作用[14]。但不同氧含量对nZVI除砷效果影响的研究尚未见报道。在自然的地下环境中,随着土壤向沉积物的转变,氧浓度呈现由高向低逐渐变化的趋势[15]。此外,由于地下水过度开采以及季节性变化等也会造成地下水位波动,导致地下水处于厌氧、好氧交替的环境之中[16-18],进而对nZVI除砷效果产生未知的影响。因此,研究不同氧含量条件下nZVI去除As(Ⅲ)和As(Ⅴ)的作用机制,通过人为调控氧含量强化nZVI除砷效果具有重要的环境意义。
本研究通过分析不同氧含量(厌氧、低氧、中氧和高氧)条件下nZVI分别去除As(Ⅲ)和As(Ⅴ)的作用机制,以探索氧含量对nZVI除砷效果的影响。并利用扫描电子显微镜(SEM)、X射线衍射(XRD)和X射线光电子能谱(XPS)等对nZVI-H2O-O2-As(Ⅴ)/As(Ⅲ)反应产物进行了表征,进而明确氧气促进nZVI除As(Ⅴ)/As(Ⅲ)的作用机理。
1. 材料及方法
1.1 实验原料
硫酸亚铁(FeSO4•7H2O)、硼氢化钠(NaBH4)、亚砷酸钠(NaAsO2)和砷酸钠(Na2HAsO4•7H2O)购自上海阿拉丁生化科技股份有限公司。氢氧化钠(NaOH)、氯化钠(NaCl)、盐酸(HCl)、无水乙醇(C2H6O)购于中国国药集团化学试剂有限公司。药品均为分析级或优级纯。NaAsO2和Na2HAsO4•7H2O分别用于制备10 g·L−1 As(Ⅲ)和As(Ⅴ)的储备溶液。实验用水均为超纯水(18.2 MΩ•cm)。
1.2 nZVI的合成方法
根据SUN的方法[19],用硼氢化钠还原亚铁盐制得nZVI。将100 mL NaBH4溶液(0.2 mol·L−1)以每秒1~2滴的速度滴加到100 mL (V水:V乙醇=4:1) FeSO4•7H2O(0.05 mol·L−1)溶液中,滴定过程中持续机械搅拌,滴完后继续反应20 min,整个过程处于氮气保护气氛中。然后将生成的黑色nZVI分别用脱氧水和脱氧乙醇各清洗3次以去除杂质。最后将nZVI保存在乙醇溶液中备用。
1.3 不同氧含量下nZVI除砷实验
实验以0.01 mol·L−1NaCl为背景电解质,反应溶液体系为30 mL,nZVI投加量为200 mg·L−1,初始砷浓度为50 mg·L−1,反应在铝箔包覆的50 mL密封西林瓶中进行,置于转速为150 r·min−1的摇床上振荡。含砷溶液曝氮气(99.99%)以排除氧气,加入nZVI前用NaOH和HCl溶液调节体系pH至7.2。不同的氧气含量通过加入不同体积的氧气(99.99%)来实现。其中,氧含量为顶空与溶液两部分的氧气总和,低氧浓度定义为O2/nZVI的摩尔比为0.05、0.125、0.25和0.5,中氧浓度定义为O2/nZVI的摩尔比为1.0和2.0,高氧浓度定义为O2/nZVI的摩尔比为3.0、4.0和5.0。在温度为25 ℃,大气压为101.3 kPa的条件下,氧气在水中的亨利系数为1.28×10−8 mol·(L·Pa)−1,根据亨利定律和克拉佩龙方程,并对水蒸气的分压进行校正(水的蒸气压为0.031 67×105 Pa),经计算,低氧对应的溶解氧为0.21、0.51、1.03和2.05 mg·L−1,中氧对应的溶解氧为4.10 mg·L−1和8.20 mg·L−1,高氧对应的溶解氧为12.30、16.40和20.50 mg·L−1。所有实验均在室温(25 ℃)下重复进行。
1.4 分析方法及表征技术
反应过程中每隔一定时间进行取样,经0.22 μm的滤膜过滤后采用高效液相色谱(HPLC,LC-20A,岛津,日本)串联原子荧光光谱(AFS,AFS-2202E,海光,中国)测定溶液中砷的浓度。反应结束后,通过离心和真空冷冻干燥得到固体样品。采用扫描电镜(SEM,Gemini 300,蔡司,德国)对产物形貌进行扫描。固体的成分是由X射线衍射(XRD,X/Pert PRO MPD,帕纳科,荷兰)分析。反应固体中砷和铁的氧化价态用X射线光电子能谱(XPS,ESCALAB 250 xi,赛默飞世尔,美国)分析,结合能值均以C1s 284.8 eV作为参照。
2. 结果与讨论
2.1 氧气含量对nZVI除砷效果的影响
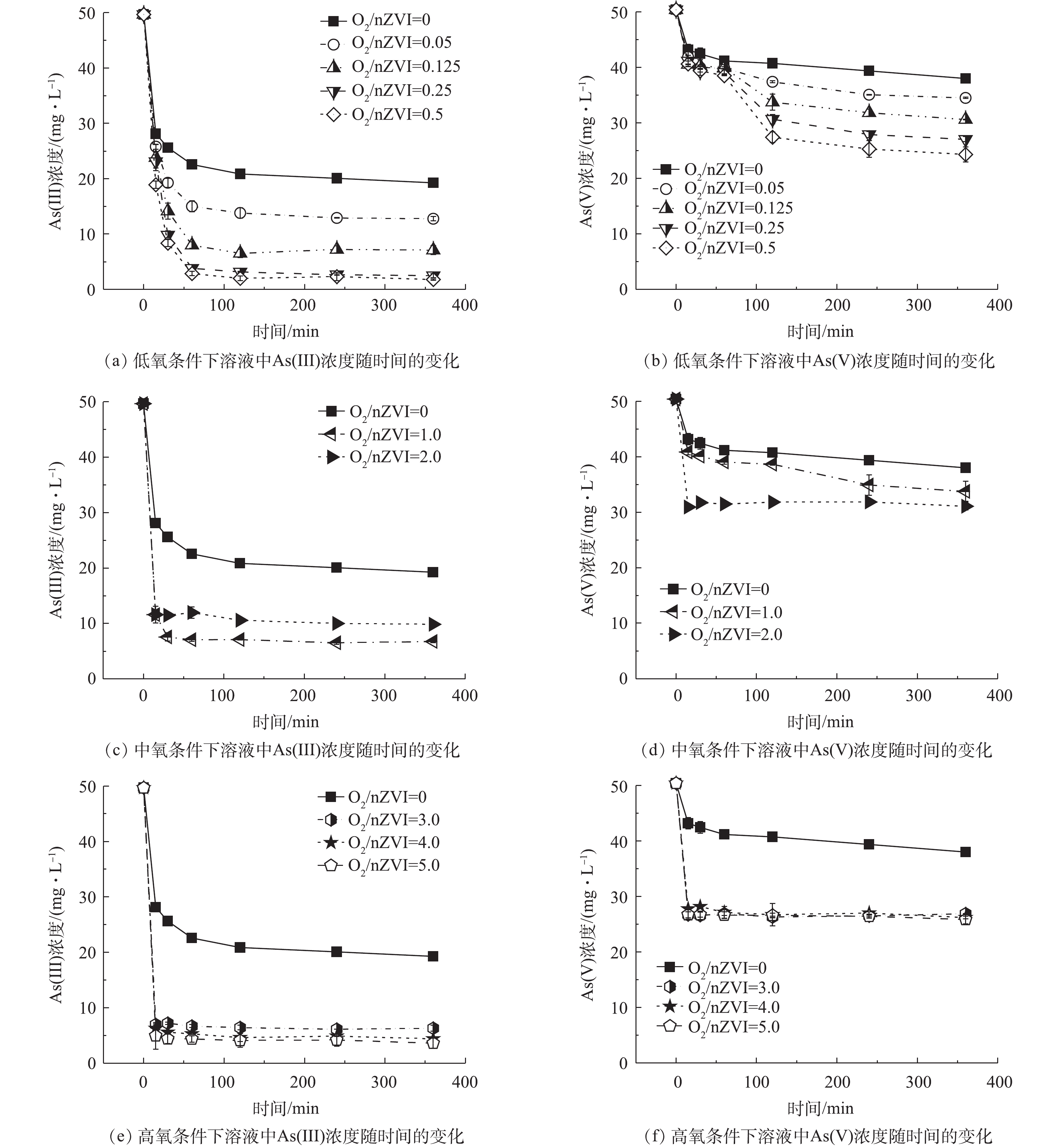
不同氧含量条件下As(Ⅲ)/As(Ⅴ)浓度随时间的变化见图1。
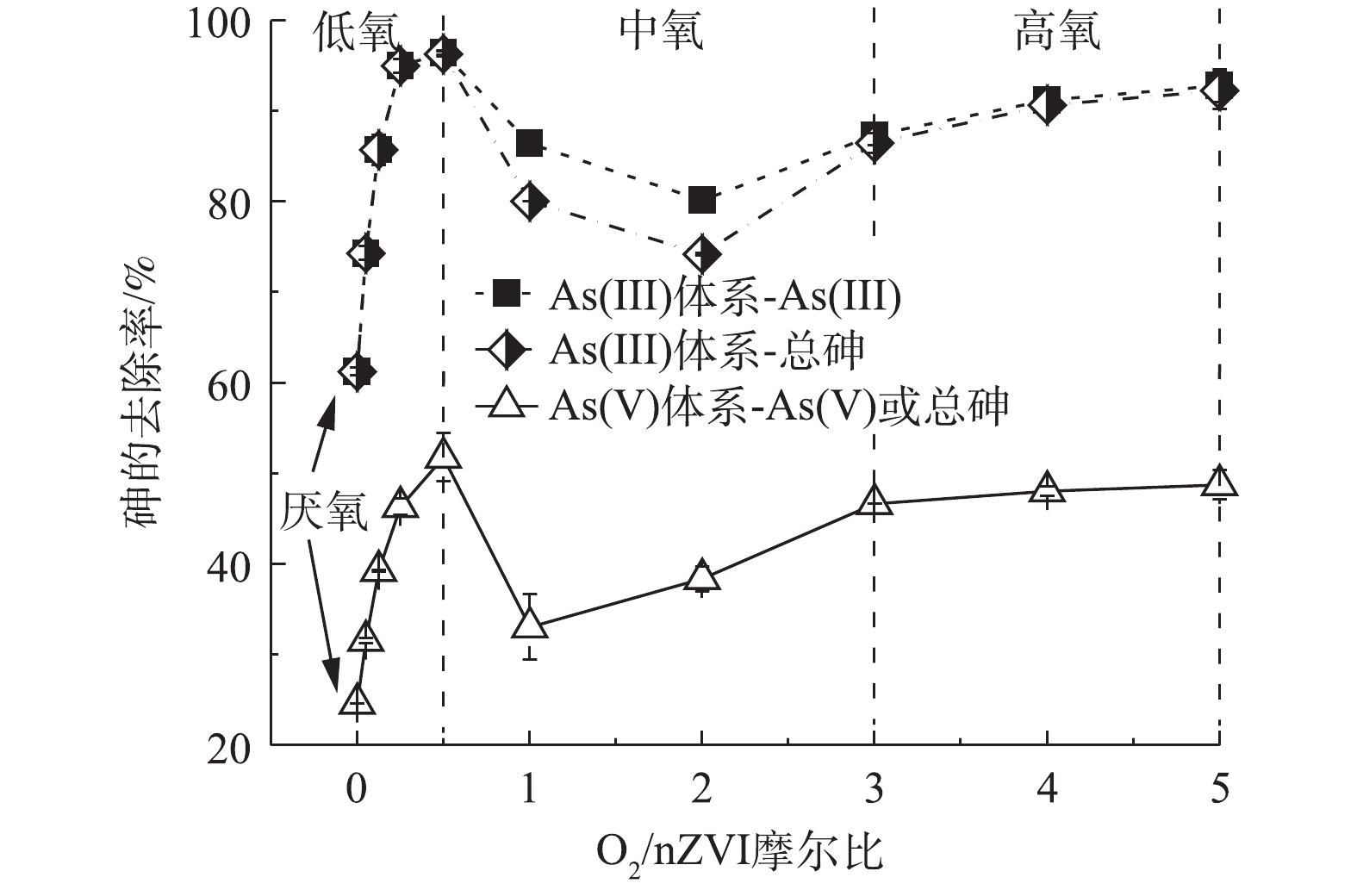
1)氧气含量对nZVI除As(Ⅲ)效果的影响。nZVI去除As(Ⅲ)过程中As(Ⅲ)的浓度随时间变化结果如图1(a)、图1(c)、图1(e)所示,不同氧含量条件下,As(Ⅲ)浓度均随时间延长迅速降低,并逐渐趋于稳定达到反应平衡。厌氧条件下As(Ⅲ)去除率为61.23%;低氧条件下随着氧含量的增加As(Ⅲ)去除率有所升高,在O2/nZVI摩尔比为0.5时,As(Ⅲ)的去除率达到最大,较厌氧条件增加了35.04%。在中氧和高氧(O2/nZVI摩尔比>0.5)条件下,伴随着As(Ⅲ)氧化作用,溶液中可检测到少量As(Ⅴ)(0.26~4.38 mg·L−1)导致As(Ⅲ)去除率与总砷去除率存在差异。中氧条件下反应30 min达到平衡但As(Ⅲ)去除率低,在O2/nZVI摩尔比为2.0时,As(Ⅲ)和总砷的去除率分别为80.13%和74.17%,总砷去除率较厌氧条件只升高了12.94%;高氧条件下总砷的去除率有所升高且稳定在90%左右。
2)氧气含量对nZVI除As(Ⅴ)效果的影响。在nZVI去除As(Ⅴ)的过程中,溶液中未检测到As(Ⅲ),故As(Ⅴ)的去除率即总砷的去除率。不同氧含量条件下溶液中As(Ⅴ)的浓度随时间变化结果如图1(b)、图1(d)、图1(f)所示。厌氧条件下砷的去除率为24.61%;在低氧条件下As(Ⅴ)去除率随着氧含量的增加而升高,在O2/nZVI摩尔比为0.5时As(Ⅴ)去除率达到最大,为51.75%,较厌氧条件增加了27.14%;在中氧条件下砷的去除率下降,在O2/nZVI摩尔比为1.0时去除率为33.03%,较厌氧条件只增加了8.42%;在高氧条件下砷的去除率增大且稳定在48%左右。
对比反应达到平衡后nZVI对As(Ⅲ)和As(Ⅴ)去除(图2)结果表明,不同氧气含量对nZVI除砷的促进程度不同,且整体去除率随着氧含量的增加呈现先升高再下降又升高的趋势;nZVI对As(Ⅲ)的去除率大于As(Ⅴ),说明在As(Ⅲ)为主要污染物的地下水中,采用nZVI除砷具有明显优势;此外,不管是对As(Ⅲ)还是As(Ⅴ),有氧条件下砷的去除效果均好于厌氧条件,说明氧气的存在明显促进了砷的去除。
2.2 反应后溶解态铁和pH随O2/nZVI摩尔比的变化
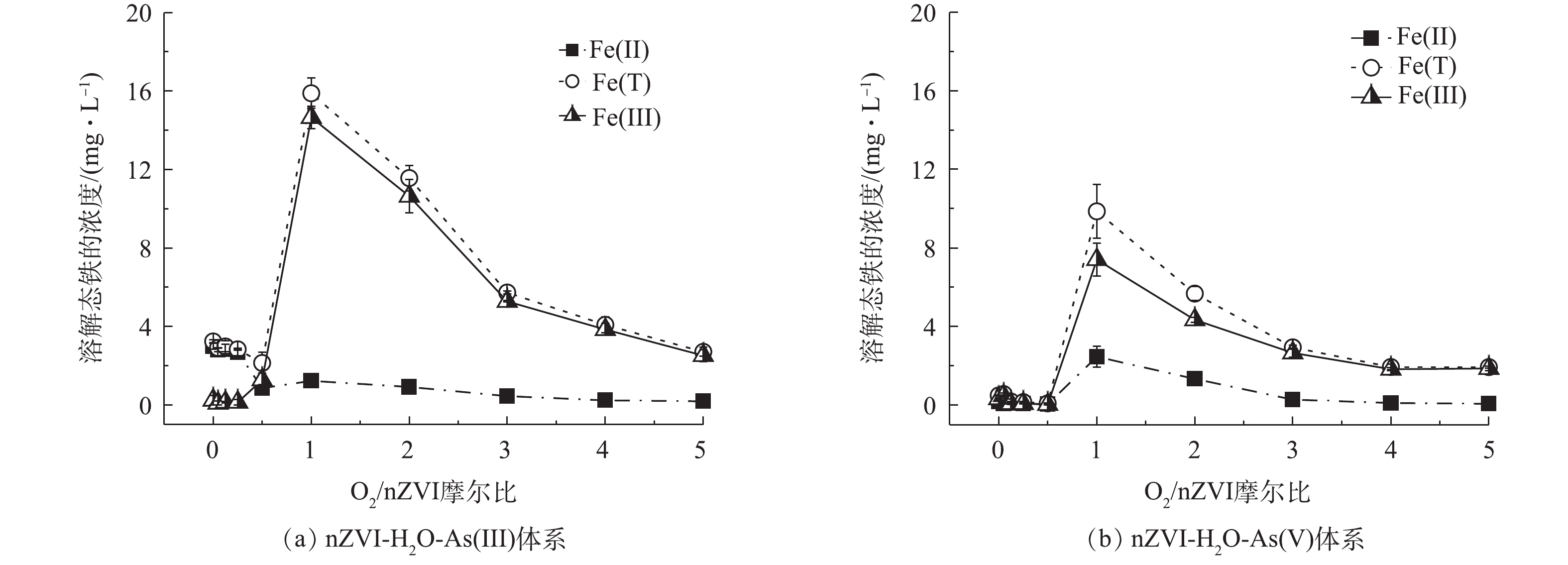
图3是反应达到平衡后不同氧含量条件对溶解态铁释放的影响。如图3(a)所示,As(Ⅲ)体系中,随着O2/nZVI摩尔比增加溶解态铁浓度呈现先上升后降低的趋势,在O2/nZVI摩尔比为0~0.5时主要溶出Fe(Ⅱ),且浓度较低(0.86~2.99 mg·L−1);在O2/nZVI摩尔比为1.0时总铁浓度达到最高(15.89 mg·L−1),且以Fe(Ⅲ)为主。从图3(b)可以看出,As(Ⅴ)体系与As(Ⅲ)体系的溶解态铁整体变化趋势一致,在O2/nZVI摩尔比为1.0时总铁浓度达到最高(9.87 mg·L−1)。化学反应式(1)~式(5)解释了溶解态铁浓度变化的原因[20-22]:在无氧条件下nZVI发生自发腐蚀反应(式(1));低氧条件下发生氧腐蚀溶出少量Fe(Ⅱ)(式(2)),且伴随反应式(3)和式(4)的发生,最终仍产生Fe(Ⅱ);中氧和高氧条件下溶解态铁浓度进一步增加,随着反应(式(4))的进行最终产生Fe(Ⅲ)为主的溶解态铁。其中在中氧条件下过多铁离子溶出,溶解态铁对砷无去除效果从而使除砷效果降低。但在高氧条件下溶出的铁离子浓度远低于中氧条件,推测在过量氧气的作用下铁离子进一步转化为(羟基)氧化铁,增强砷的去除效果[13, 23]。
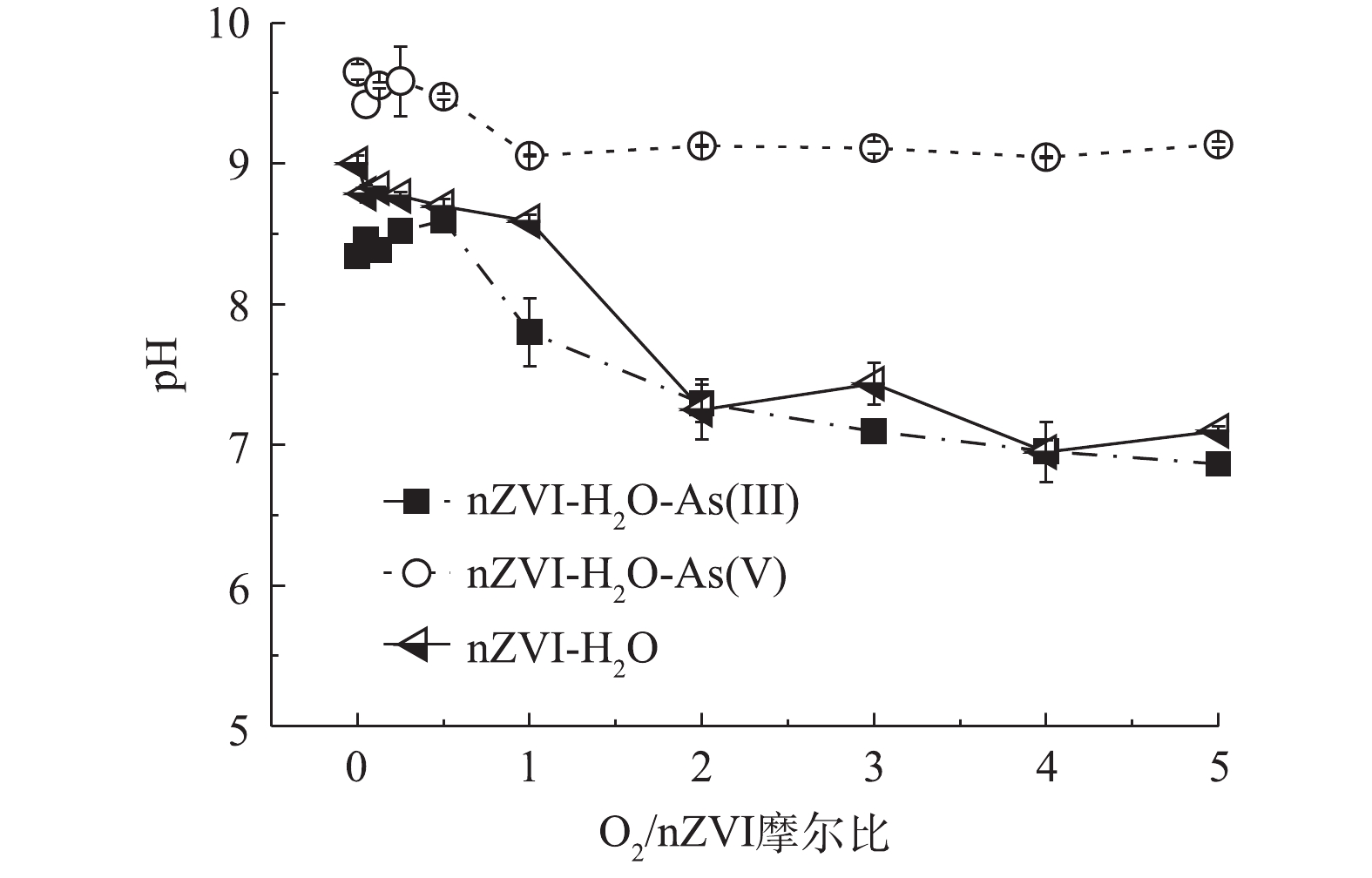
Fe0+2H2O→Fe2++H2+2OH− (1) 2Fe0+2H2O+O2→2Fe2++4OH− (2) 2Fe0+Fe3+→3Fe2+ (3) 4Fe2+(s)+2H2O+O2→4Fe3++4OH− (4) 图4是不同氧含量条件下nZVI除砷时溶液pH的变化趋势。在整个氧含量范围内,As(Ⅲ)体系溶液pH在7.0~8.5,As(Ⅴ)体系溶液pH>9.0。砷的存在形态与pH有关,对于As(Ⅲ),
H2AsO−3 (pKa1=9.22)、HAsO2−3 (pKa2=12.10)、AsO3−3 (pKa3=13.40)为溶液酸性到碱性的优势形态,pH在7.0~8.5时主要以H3AsO03 形态存在;对于As(Ⅴ),H2AsO−4 (pKa1=2.22)、HAsO2−4 (pKa2=6.96)、AsO3−4 (pKa3=11.50)为溶液酸性到碱性的优势形态,pH>9.0主要以HAsO2−4 形态存在[24]。nZVI等电点一般为8.0左右,当pH>9.0时nZVI荷负电[25],HAsO2−4 与nZVI存在较强的静电排斥作用使As(Ⅴ)难以吸附在nZVI氧化壳表面,而H3AsO03 与nZVI不受静电排斥作用的影响,因此,nZVI对As(Ⅲ)的去除效果好于As(Ⅴ)。2.3 产物表征结果
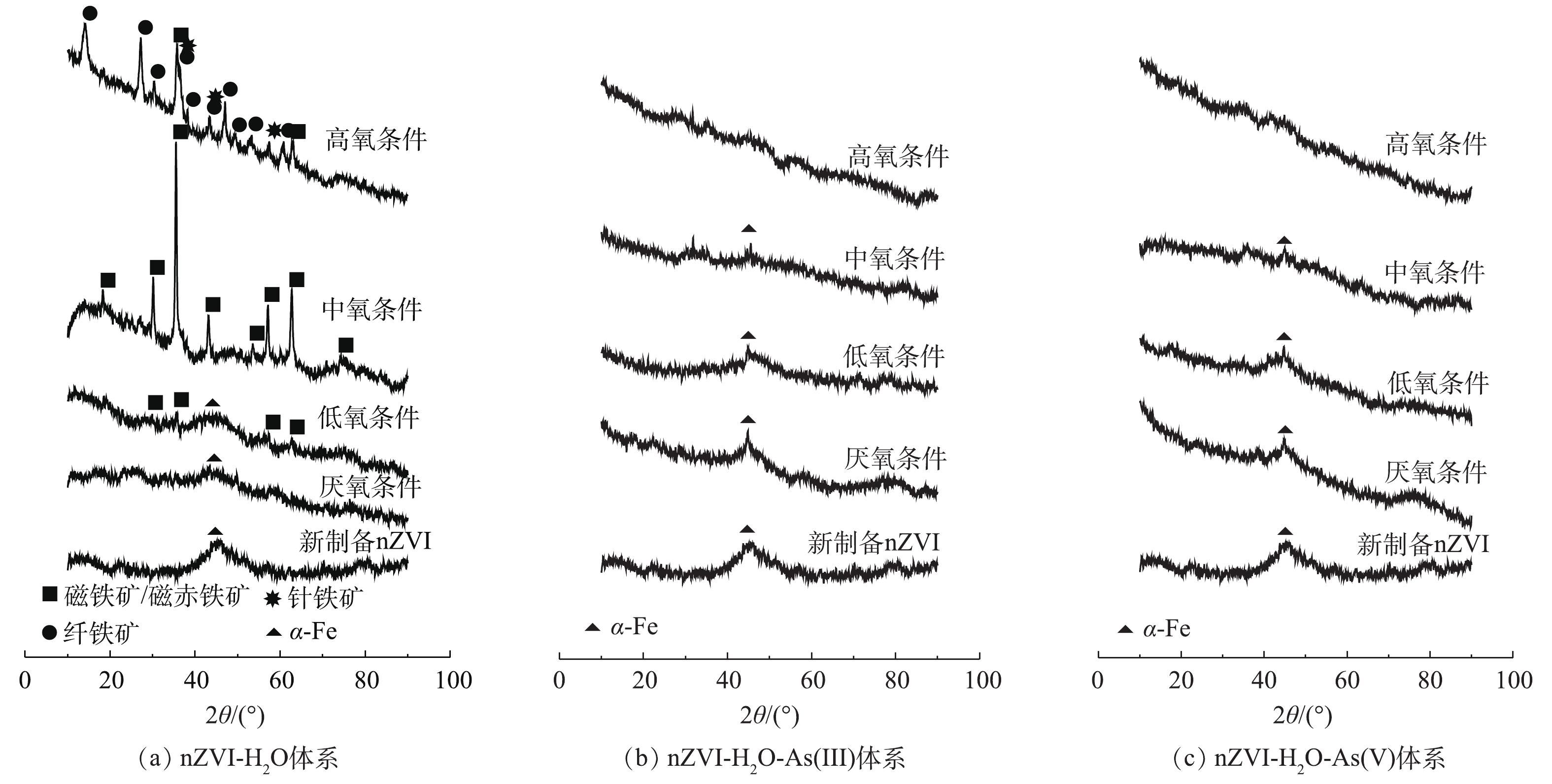
1) SEM与XRD表征结果。图5是新制备nZVI及不同氧含量条件下nZVI-H2O、nZVI-H2O-As(Ⅲ)和nZVI-H2O-As(Ⅴ)体系反应产物的SEM图。为进一步分析不同氧含量下各个体系所生成的产物类型,对其进行了XRD表征分析(图6)。结合SEM与XRD表征可知,新制备的nZVI颗粒呈球形,粒径在50~100 nm,整体呈链条状,存在团聚现象(图5(a)),在衍射角2θ为44.67°处有较宽的衍射峰,对应体心立方结构α-Fe的(110)晶面,这说明制备的是结晶性较差的零价铁(图6(a))。厌氧条件下各体系铁核发生不同程度的溶解,反应后的产物仍然以零价铁为主。对于nZVI-H2O体系随着氧含量的增加产物形貌由扁片状向粗糙粒状、片状及针状结构转化(图5(b))。在低氧和中氧条件下生成的主要产物为磁铁矿/磁赤铁矿[21, 26](式(5)~式(9)),在高氧条件下生成磁铁矿/磁赤铁矿、纤铁矿、针铁矿等多相混合物[27-28],反应见式(10)~式(12),结果见图6(a)。
nZVI-H2O-As(Ⅲ)/As(Ⅴ)体系在有氧条件下的产物形貌和结构与nZVI-H2O体系存在明显差异。其中在低氧条件下均呈片状褶皱结构,在中氧和高氧条件下产物形貌为均为粗糙片状和颗粒絮状(图5(c)和图5(d)),形貌的变化与生成沉淀或新的物相有关,但XRD结果表明无明显晶型(羟基)氧化铁的峰(图6(b)和图6(c))。这是由于As(Ⅲ)/As(Ⅴ)与Fe(O, OH)6之间存在很强的亲和力,在(羟基)氧化铁生成过程中,砷会破坏Fe-O-Fe键从而抑制铁矿物例如针铁矿、纤铁矿和磁铁矿晶体的形成[29-30]。同时As(Ⅴ)/As(Ⅲ)可加速Fe(Ⅲ)水解形成无定型铁矿物如水铁矿,并干扰无定型铁矿物向其他晶态铁矿物转变过程中的晶体成核和生长[31]。有氧条件下氧气可促进nZVI氧化为Fe(Ⅱ)和Fe(Ⅲ)(式(2)和式(4))并进一步在氧化或水解作用下形成无定型(羟基)氧化铁从而促进砷的去除[23]。其中低氧条件下产物仍存在明显α-Fe衍射峰,且除砷效果比厌氧条件好,这说明nZVI经少量氧化生成的无定型铁矿物可促进砷的去除;而在中氧条件下α-Fe衍射峰变弱,且砷去除率降低,结合图3可知,由于溶液中大量铁离子溶出,且溶解态的铁对砷无去除效果所致;在高氧条件下α-Fe衍射峰消失,溶液中铁离子浓度减少,这说明溶出铁离子与氧气反应生成较多无定型铁矿物,再次增强了砷的去除率(图6(b)和图6(c))。
2Fe(OH)3→Fe2O3+3H2O (5) 6Fe2++6H2O+O2→2Fe3O4+12H+ (6) 6Fe(OH)2+O2→2Fe3O4+6H2O (7) 6FeO+O2→2Fe3O4 (8) 4Fe3O4+O2→6Fe2O3 (9) Fe(OH)3→FeOOH+H2O (10) 4Fe0+2H2O+3O2→4γ−FeOOH (11) 4Fe3O4+6H2O+O2→12γ−FeOOH (12) 2) XPS表征结果。采用XPS手段进一步分析氧气对nZVI除砷的影响机制,利用分峰软件avantage5.52对表征结果进行分析(表1)。在nZVI-H2O-As(Ⅲ)/As(Ⅴ)体系中,反应产物仍然分别以As(Ⅲ)和As(Ⅴ)为主。随着氧含量的增大,固体表面As(Ⅲ)比例逐渐减小,As(Ⅴ)比例逐渐增大,As(0)比例逐渐减小,说明nZVI除砷的机理除吸附外,还同时存在砷的氧化和还原作用,且随着氧含量增加抑制了砷的还原,促进了砷的氧化。此外,随着氧含量的增加,固体表面Fe(Ⅱ)比例逐渐减小,Fe(Ⅲ)比例逐渐增大,Fe(0)比例逐渐减小,证实了氧气的存在促进了nZVI的氧化,并形成新的铁矿物,进而影响对砷的吸附行为。
表 1 不同氧含量条件下,nZVI-H2O-As(III)/As(V)体系反应产物中不同价态的砷和铁占比Table 1. Proportion of arsenic and iron with different valence states in reaction products of nZVI-H2O-As(III)/As(V) systemsunder different oxygen content conditions% 体系 氧含量条件 As(V) As(III) As(0) Fe(III) Fe(II) Fe(0) nZVI-H2O-As(III) 厌氧 13.22 80.31 6.47 35.59 54.84 9.57 低氧 16.35 78.80 4.85 39.13 53.31 7.56 中氧 37.55 58.65 4.00 58.03 39.47 2.50 高氧 39.50 57.79 2.71 59.28 38.56 2.16 nZVI-H2O-As(V) 厌氧 65.33 16.59 18.08 17.41 69.16 13.42 低氧 74.22 13.84 11.94 33.85 56.21 9.94 中氧 92.17 7.83 0.00 55.75 42.04 2.21 高氧 92.68 7.32 0.00 57.04 40.96 2.01 2.4 氧气促进nZVI除砷的作用机制
在厌氧和低氧条件下,nZVI-H2O-As(Ⅴ)/As(Ⅲ)体系中产生浓度较低的溶解态Fe(Ⅱ),XRD表征结果表明,反应产物只有α-Fe的衍射峰,说明固体中主要成分仍然以nZVI为主且溶解至游离态程度较低。XPS表征结果表明,固体表面砷的形态以As(Ⅴ)、As(Ⅲ)和As(0)这3种形式存在,这说明nZVI仍然保持着核壳结构所具有的特殊作用。铁核具有还原能力,nZVI氧化还原电位为−0.447 V(Fe(0)/Fe(Ⅱ)),As(Ⅴ)反应至As(0)所需电位为0.449 V,nZVI将As(Ⅴ)还原至As(0)在热力学上是可行的[32-33]。As(Ⅲ)和As(Ⅴ)反应体系产物固体表面分别以As(Ⅲ)和As(Ⅴ)为主,这说明nZVI除砷主要是以吸附作用为主,砷与铁氧化物表面吸附位点上的OH2/OH−进行配体交换,通常在表面形成以双齿双核为主的内球络合物[34-35]。XRD与XPS表征结果表明,在厌氧和低氧条件下的反应产物并无较大的差异,固体表面Fe(0)含量略微下降,Fe(Ⅲ)含量略微增加。但低氧条件下nZVI除砷速度(图1(a)和图1(b))明显比厌氧条件下快,且砷的去除率(图2)也明显比厌氧条件下高,这与nZVI少量氧化有关。综合SEM与XPS结果说明在低氧条件下,nZVI的少量氧化造成其微观形貌的改变,所形成的少量无定型(羟基)氧化铁提升了对砷的吸附作用,使砷的去除率增加。
在中氧和高氧条件下,XPS结果显示固体表面砷和铁各价态含量所占比例大致相当(表1)。nZVI-H2O-As(Ⅲ)体系主要以As(Ⅲ)和As(Ⅴ)为主,nZVI-H2O-As(Ⅴ)体系主要以As(Ⅴ)为主,且无As(0),说明在有氧条件下nZVI除砷主要是以吸附和氧化为主。固体表面Fe(Ⅲ)明显增加,且XRD结果显示α-Fe的衍射峰变弱或消失且没有明显衍射峰,说明nZVI被大量氧化,氧气氧化nZVI为溶解态Fe(Ⅱ)/Fe(Ⅲ),铁离子在氧气的作用下进一步被氧化形成无定型或弱晶型铁矿物,这些铁矿物可起到除砷的作用,此外As(Ⅲ)/As(Ⅴ)也可在新的铁矿物形成的过程中被掺杂固定下来[36]。其中在中氧条件下,氧气促进nZVI氧化为大量溶解态Fe(Ⅱ)/Fe(Ⅲ)(图3),溶解态铁对砷无去除效果,从而降低砷的去除效果;而在高氧条件下溶解态铁Fe(Ⅱ)/Fe(Ⅲ)在足量氧气的作用下进一步被氧化为铁矿物,增强了对砷的去除效果。
高氧条件生成更多铁矿物促进砷的去除,但该条件下nZVI对砷的去除率比低氧条件的最大去除率低,原因可能为低氧条件下nZVI氧化在其表面生成无定型水铁矿,无定型水铁矿均匀分布在nZVI表面,比表面积较大,因此对砷具有较强的吸附能力。而高氧条件下nZVI大量氧化生成了结构更有序的铁矿物,研究表明,随着非晶铁矿物向晶态铁矿物的转变,产物比表面积和吸附位点密度降低,从而降低了其对砷的吸附量[37-38]。
3. 结论
1)氧气的存在会显著促进nZVI对砷的去除效果,但不同氧气含量对nZVI除As(Ⅲ)/As(Ⅴ)的促进程度有所不同。整体趋势表现为,在低氧条件下随着氧气含量的增加As(Ⅲ)/As(Ⅴ)的去除率增大,中氧条件下As(Ⅲ)/As(Ⅴ)的去除率降低,高氧条件下As(Ⅲ)/As(Ⅴ)的去除率再次升高。若将nZVI技术应用于地下水砷的去除时,如果地下水中溶解氧含量极低,为提升砷的去除效果可以向地下水中适量曝气。
2)nZVI除砷的作用机制包括砷的吸附、还原和氧化等,不同氧气含量对nZVI的氧化程度及除砷效果具有较大的影响。在低氧条件下nZVI少量氧化生成的无定型铁矿物促进了砷的去除;中氧条件下nZVI氧化生成较多的溶解态铁,溶解态铁对砷无去除效果,从而造成砷的去除率的下降;高氧条件下溶解态铁被足量氧气进一步氧化为无定型铁矿物,增强了对砷的去除效果。
3)传统铁氧化物对As(Ⅴ)具有良好的去除效果,去除As(Ⅲ)时需先将其氧化为As(Ⅴ)再进行吸附处理。在相同的实验条件下,nZVI对As(Ⅲ)的去除效果好于As(Ⅴ),可实现As(Ⅲ)的直接高效去除,因此,将nZVI作为修复剂应用于主要以As(Ⅲ)污染为主的地下水修复中更具优势。
-
图 1 草酸在不同pH溶液中的物种形式[42]
Figure 1. Species forms of oxalic acid in solutions of different pH
图 2 草酸根在铁簇上的理论络合构型[46]
Figure 2. Optimized Ox surface complex geometries on iron clusters
图 3 草酸在铁氧化物表面形成的络合物构型与诺氟沙星降解速率的相关性[40]
Figure 3. Correlation between Ox surface complex geometries on iron oxides and the degradation rate of norfloxacin
-
[1] ZHAO Z J, YAO L W, LI J, et al. Determination of interactions of ferrihydrite-humic acid-Pb (Ⅱ) system [J]. Environmental Science and Pollution Research, 2022, 29(15): 21561-21575. doi: 10.1007/s11356-021-17258-z [2] ZHAO X P, LI Z P, TANG W J, et al. Competitive kinetics of Ni(Ⅱ)/Co(Ⅱ) and Cr(VI)/P(Ⅴ) adsorption and desorption on goethite: A unified thermodynamically based model [J]. Journal of Hazardous Materials, 2022, 423: 127028. doi: 10.1016/j.jhazmat.2021.127028 [3] 卜庆伟, 曹红梅, 贺小凡, 等. 交互作用对有机-矿质复合体吸附四环素的影响 [J]. 环境化学, 2020, 39(12): 3552-3561. doi: 10.7524/j.issn.0254-6108.2020042904 BU Q W, CAO H M, HE X F, et al. The impact of interaction on organic-mineral complexes adsorb tetracycline [J]. Environmental Chemistry, 2020, 39(12): 3552-3561(in Chinese). doi: 10.7524/j.issn.0254-6108.2020042904
[4] QIU X R, DING L, ZHANG C, et al. Exposed facets mediated interaction of polystyrene nanoplastics (PSNPs) with iron oxides nanocrystal [J]. Journal of Hazardous Materials, 2022, 435: 128994. doi: 10.1016/j.jhazmat.2022.128994 [5] GAO M S, SU Y, GAO J B, et al. Arsenic speciation transformation in soils with high geological background: New insights from the governing role of Fe [J]. Chemosphere, 2022, 302: 134860. doi: 10.1016/j.chemosphere.2022.134860 [6] SHI M Q, MIN X B, KE Y, et al. Recent progress in understanding the mechanism of heavy metals retention by iron (oxyhydr)oxides [J]. Science of the Total Environment, 2021, 752: 141930. doi: 10.1016/j.scitotenv.2020.141930 [7] 朱剑锋, 王艳琼, 王红武. 铁氧化物促进微生物直接种间电子传递的机理及其研究现状 [J]. 环境化学, 2022, 41(6): 1856-1868. doi: 10.7524/j.issn.0254-6108.2021112501 ZHU J F, WANG Y Q, WANG H W. A review on enhancement of direct interspecies electron transfer induced by iron oxides and its mechanism [J]. Environmental Chemistry, 2022, 41(6): 1856-1868(in Chinese). doi: 10.7524/j.issn.0254-6108.2021112501
[8] WANG Y Q, LIU W, WANG T, et al. Arsenate adsorption onto Fe-TNTs prepared by a novel water-ethanol hydrothermal method: Mechanism and synergistic effect [J]. Journal of Colloid and Interface Science, 2015, 440: 253-262. doi: 10.1016/j.jcis.2014.10.036 [9] REN H T, JI Z Y, WU S H, et al. Photoreductive dissolution of schwertmannite induced by oxalate and the mobilization of adsorbed As(V) [J]. Chemosphere, 2018, 208: 294-302. doi: 10.1016/j.chemosphere.2018.05.187 [10] QIN X P, LIU F, ZHAO L, et al. Adsorption of levofloxacin to goethite: Batch and column studies [J]. Environmental Engineering Science, 2016, 33(4): 235-241. doi: 10.1089/ees.2015.0379 [11] YU B, JIA S Y, LIU Y, et al. Mobilization and re-adsorption of arsenate on ferrihydrite and hematite in the presence of oxalate [J]. Journal of Hazardous Materials, 2013, 262: 701-708. doi: 10.1016/j.jhazmat.2013.09.010 [12] ZHANG P, YANG X Y, ZHAO Z B, et al. One-step synthesis of flowerlike C/Fe2O3 nanosheet assembly with superior adsorption capacity and visible light photocatalytic performance for dye removal [J]. Carbon, 2017, 116: 59-67. doi: 10.1016/j.carbon.2017.01.087 [13] WANG Y N, WANG J M, DENG R P, et al. Preparation and photocatalytic property of porous α-Fe2O3 nanoflowers [J]. Materials Research Bulletin, 2018, 107: 94-99. doi: 10.1016/j.materresbull.2018.07.013 [14] WANG Y H, SHI H H, CUI K, et al. Hierarchical hematite/TiO2 nanorod arrays coupled with responsive mesoporous silica nanomaterial for highly sensitive photoelectrochemical sensing [J]. Biosensors and Bioelectronics, 2018, 117: 515-521. doi: 10.1016/j.bios.2018.06.030 [15] SEO J H, CHOI K, NAM J, et al. Synergetic donor-donor codoping strategy for enhanced photoelectrochemical activity of hematite [J]. Applied Catalysis B:Environmental, 2020, 260: 118186. doi: 10.1016/j.apcatb.2019.118186 [16] LI G, WANG C, YAN Y P, et al. Highly enhanced degradation of organic pollutants in hematite/sulfite/photo system [J]. Chemical Engineering Journal, 2020, 386: 124007. doi: 10.1016/j.cej.2019.124007 [17] KEERTHANA S, YUVAKKUMAR R, RAVI G, et al. A strategy to enhance the photocatalytic efficiency of α-Fe2O3 [J]. Chemosphere, 2021, 270: 129498. doi: 10.1016/j.chemosphere.2020.129498 [18] NGUYEN N T T, NGUYEN A Q K, KIM M S, et al. Effect of Fe3+ as an electron-transfer mediator on WO3-induced activation of peroxymonosulfate under visible light [J]. Chemical Engineering Journal, 2021, 411: 128529. doi: 10.1016/j.cej.2021.128529 [19] THARANI K, JEGATHA CHRISTY A, SAGADEVAN S, et al. Photocatalytic and antibacterial performance of iron oxide nanoparticles formed by the combustion method [J]. Chemical Physics Letters, 2021, 771: 138524. doi: 10.1016/j.cplett.2021.138524 [20] LAI C, SHI X X, LI L, et al. Enhancing iron redox cycling for promoting heterogeneous Fenton performance: A review [J]. Science of the Total Environment, 2021, 775: 145850. doi: 10.1016/j.scitotenv.2021.145850 [21] KIFLE G A, HUANG Y, XIANG M H, et al. Heterogeneous activation of peroxygens by iron-based bimetallic nanostructures for the efficient remediation of contaminated water. A review [J]. Chemical Engineering Journal, 2022, 442: 136187. doi: 10.1016/j.cej.2022.136187 [22] YOU Y Y, HUANG S B, CHEN M S, et al. Hematite/selenium disulfide hybrid catalyst for enhanced Fe(III)/Fe(II) redox cycling in advanced oxidation processes [J]. Journal of Hazardous Materials, 2022, 424: 127376. doi: 10.1016/j.jhazmat.2021.127376 [23] LI F B, CHEN J J, LIU C S, et al. Effect of iron oxides and carboxylic acids on photochemical degradation of bisphenol A [J]. Biology and Fertility of Soils, 2006, 42(5): 409-417. doi: 10.1007/s00374-006-0084-7 [24] LUO H W, ZENG Y F, CHENG Y, et al. Activation of peroxymonosulfate by iron oxychloride with hydroxylamine for ciprofloxacin degradation and bacterial disinfection [J]. Science of the Total Environment, 2021, 799: 149506. doi: 10.1016/j.scitotenv.2021.149506 [25] GAJOVIĆ A, SILVA A M T, SEGUNDO R A, et al. Tailoring the phase composition and morphology of Bi-doped goethite-hematite nanostructures and their catalytic activity in the degradation of an actual pesticide using a photo-Fenton-like process [J]. Applied Catalysis B:Environmental, 2011, 103(3/4): 351-361. [26] KHAGHANI S, GHANBARI D. Magnetic and photo-catalyst Fe3O4-Ag nanocomposite: Green preparation of silver and magnetite nanoparticles by garlic extract [J]. Journal of Materials Science:Materials in Electronics, 2017, 28(3): 2877-2886. doi: 10.1007/s10854-016-5872-8 [27] REICHARD P U, KRETZSCHMAR R, KRAEMER S M. Dissolution mechanisms of goethite in the presence of siderophores and organic acids [J]. Geochimica et Cosmochimica Acta, 2007, 71(23): 5635-5650. doi: 10.1016/j.gca.2006.12.022 [28] JIN X H, LI X F, GUO C L, et al. Fate of oxalic-acid-intervened arsenic during Fe(Ⅱ)-induced transformation of As(Ⅴ)-bearing jarosite [J]. Science of the Total Environment, 2020, 719: 137311. doi: 10.1016/j.scitotenv.2020.137311 [29] LAMY I, DJAFER M, TERCE M. Influence of oxalic acid on the adsorption of cadmium at the goethite surface [J]. Water, Air, and Soil Pollution, 1991, 57(1): 457-465. [30] FLYNN E D, CATALANO J G. Competitive and cooperative effects during nickel adsorption to iron oxides in the presence of oxalate [J]. Environmental Science & Technology, 2017, 51(17): 9792-9799. [31] LEE C H, KEENAN C R, SEDLAK D L. Polyoxometalate-enhanced oxidation of organic compounds by nanoparticulate zero-valent iron and ferrous ion in the presence of oxygen [J]. Environmental Science & Technology, 2008, 42(13): 4921-4926. [32] GONZÁLEZ A G, BIANCO A, BOUTORH J, et al. Influence of strong iron-binding ligands on cloud water oxidant capacity [J]. Science of the Total Environment, 2022, 829: 154642. doi: 10.1016/j.scitotenv.2022.154642 [33] BATISTA A P S, COTTRELL B A, NOGUEIRA R F P. Photochemical transformation of antibiotics by excitation of Fe(Ⅲ)-complexes in aqueous medium [J]. Journal of Photochemistry and Photobiology A:Chemistry, 2014, 274: 50-56. doi: 10.1016/j.jphotochem.2013.09.017 [34] POZDNYAKOV I, SHERIN P, BAZHIN N, et al. Fe(Ox)3]3- complex as a photodegradation agent at neutral pH: Advances and limitations [J]. Chemosphere, 2018, 195: 839-846. doi: 10.1016/j.chemosphere.2017.12.096 [35] WAN D, ZUO J L, CHEN Y, et al. Photodegradation of amitriptyline in Fe(Ⅲ)-citrate-oxalate binary system: Synergistic effect and mechanism [J]. Chemosphere, 2018, 210: 224-231. doi: 10.1016/j.chemosphere.2018.07.006 [36] WAN D, ZHANG G F, CHEN Y, et al. Photogeneration of hydroxyl radical in Fe(Ⅲ)-citrate-oxalate system for the degradation of fluconazole: Mechanism and products [J]. Environmental Science and Pollution Research, 2019, 26(9): 8640-8649. doi: 10.1007/s11356-019-04348-2 [37] YAN R, YANG W J, YOU D, et al. Photoinduced evolution of optical properties and compositions of methoxyphenols by Fe(III)-carboxylates complexes in atmospheric aqueous phase [J]. Chemosphere, 2022, 295: 133860. doi: 10.1016/j.chemosphere.2022.133860 [38] EROKHIN S E, SNYTNIKOVA O A, NOVIKOV M V, et al. Probing reactions between imipramine and hydroxyl radical with the photolysis of iron(III) oxalate: Implications for the indirect photooxidation of tricyclic antidepressants in waters [J]. Journal of Photochemistry and Photobiology A:Chemistry, 2022, 422: 113559. doi: 10.1016/j.jphotochem.2021.113559 [39] BI W L, DONG W B. The degradation of oxytetracycline with ferrous oxalate under different light irradiation [J]. Environmental Technology, 2021, 42(7): 1084-1091. doi: 10.1080/09593330.2019.1652698 [40] HUANG M J, XIANG W, ZHOU T, et al. The critical role of the surface iron-oxalate complexing species in determining photochemical degradation of norfloxacin using different iron oxides [J]. Science of the Total Environment, 2019, 697: 134220. doi: 10.1016/j.scitotenv.2019.134220 [41] 兰青, 莫家乐, 曹美苑. 铁-多羧基有机酸光化学体系研究进展 [J]. 生态环境学报, 2018, 27(10): 1972-1980. LAN Q, MO J L, CAO M Y. Research progress on the photochemistry system of the Fe-organic acids with multi-carboxyls: A review [J]. Ecology and Environmental Sciences, 2018, 27(10): 1972-1980(in Chinese).
[42] ZHAN G M, FANG Y M, ZHANG M, et al. Oxalate promoted iron dissolution of hematite via proton coupled electron transfer [J]. Environmental Science:Nano, 2022, 9(5): 1770-1779. doi: 10.1039/D1EN01190A [43] YAO Q, GUO C L, LI X F, et al. Synergy of oxalic acid and sunlight triggered Cr(III)-bearing Schwertmannite transformation: Reaction mechanism, Cr and C spatial distribution and speciation on the nano scale [J]. Geochimica et Cosmochimica Acta, 2022, 329: 70-86. doi: 10.1016/j.gca.2022.05.018 [44] BHANDARI N, HAUSNER D B, KUBICKI J D, et al. Photodissolution of ferrihydrite in the presence of oxalic acid: An In situ ATR-FTIR/DFT study [J]. Langmuir, 2010, 26(21): 16246-16253. doi: 10.1021/la101357y [45] BOROWSKI S C, BISWAKARMA J, KANG K, et al. Structure and reactivity of oxalate surface complexes on lepidocrocite derived from infrared spectroscopy, DFT-calculations, adsorption, dissolution and photochemical experiments [J]. Geochimica et Cosmochimica Acta, 2018, 226: 244-262. doi: 10.1016/j.gca.2018.01.024 [46] XU T Y, ZHU R L, SHANG H, et al. Photochemical behavior of ferrihydrite-oxalate system: Interfacial reaction mechanism and charge transfer process [J]. Water Research, 2019, 159: 10-19. doi: 10.1016/j.watres.2019.04.055 [47] KUBICKI J D, TUNEGA D, KRAEMER S. A density functional theory investigation of oxalate and Fe(II) adsorption onto the (010) goethite surface with implications for ligand- and reduction-promoted dissolution [J]. Chemical Geology, 2017, 464: 14-22. doi: 10.1016/j.chemgeo.2016.08.010 [48] LI F Y, KOOPAL L, TAN W F. Roles of different types of oxalate surface complexes in dissolution process of ferrihydrite aggregates [J]. Scientific Reports, 2018, 8: 2060. doi: 10.1038/s41598-018-20401-5 [49] VOELZ J L, JOHNSON N W, CHUN C L, et al. Quantitative dissolution of environmentally accessible iron residing in iron-rich minerals: A review [J]. ACS Earth and Space Chemistry, 2019, 3(8): 1371-1392. doi: 10.1021/acsearthspacechem.9b00012 [50] WANG Z Z, FU H B, ZHANG L W, et al. Ligand-promoted photoreductive dissolution of goethite by atmospheric low-molecular dicarboxylates [J]. The Journal of Physical Chemistry. A, 2017, 121(8): 1647-1656. doi: 10.1021/acs.jpca.6b09160 [51] 黄荃莅, 黄魁, 卢远桓, 等. 草酸浸出和太阳光催化回收赤泥中的铁和铝 [J]. 环境工程, 2021, 39(12): 199-205. HUANG Q L, HUANG K, LU Y H, et al. Recovery of iron and aluminum from red mud by oxalic acid leaching and solar photocatalysis [J]. Environmental Engineering, 2021, 39(12): 199-205(in Chinese).
[52] SIFFERT C, SULZBERGER B. Light-induced dissolution of hematite in the presence of oxalate. A case study [J]. Langmuir, 1991, 7(8): 1627-1634. doi: 10.1021/la00056a014 [53] LAN Q, LI F B, LIU C S, et al. Heterogeneous photodegradation of pentachlorophenol with maghemite and oxalate under UV illumination [J]. Environmental Science & Technology, 2008, 42(21): 7918-7923. [54] LAN Q, LI F B, SUN C X, et al. Heterogeneous photodegradation of pentachlorophenol and iron cycling with goethite, hematite and oxalate under UVA illumination [J]. Journal of Hazardous Materials, 2010, 174(1/2/3): 64-70. [55] MAZELLIER P, SULZBERGER B. Diuron degradation in irradiated, heterogeneous iron/oxalate systems: The rate-determining step [J]. Environmental Science & Technology, 2001, 35(16): 3314-3320. [56] HUANG M J, ZHOU T, WU X H, et al. Distinguishing homogeneous-heterogeneous degradation of norfloxacin in a photochemical Fenton-like system (Fe3O4/UV/oxalate) and the interfacial reaction mechanism [J]. Water Research, 2017, 119: 47-56. doi: 10.1016/j.watres.2017.03.008 [57] WANG Z H, XIAO D X, LIU J S. Diverse redox chemistry of photo/ferrioxalate system [J]. RSC Advances, 2014, 4(84): 44654-44658. doi: 10.1039/C4RA07153K [58] 兰青, 叶志钧, 陈熠熠, 等. 异相草酸铁光降解五氯酚过程中的铁物种分配 [J]. 环境化学, 2017, 36(2): 336-344. doi: 10.7524/j.issn.0254-6108.2017.02.2016040506 LAN Q, YE Z J, CHEN Y Y, et al. Distribution of Fe species during the photodegradation of pentachlorophenol in heterogeneous Fe-oxalate system [J]. Environmental Chemistry, 2017, 36(2): 336-344(in Chinese). doi: 10.7524/j.issn.0254-6108.2017.02.2016040506
[59] CHEN Y, WU F, LIN Y X, et al. Photodegradation of glyphosate in the ferrioxalate system [J]. Journal of Hazardous Materials, 2007, 148(1/2): 360-365. [60] FAUST B C, ZEPP R G. Photochemistry of aqueous iron(III)-polycarboxylate complexes: Roles in the chemistry of atmospheric and surface waters [J]. Environmental Science & Technology, 1993, 27(12): 2517-2522. [61] PANIAS D, TAXIARCHOU M, DOUNI I, et al. Thermodynamic analysis of the reactions of iron oxides: Dissolution in oxalic acid [J]. Canadian Metallurgical Quarterly, 1996, 35(4): 363-373. doi: 10.1179/cmq.1996.35.4.363 [62] XIAO D X, GUO Y G, LOU X Y, et al. Distinct effects of oxalate versus malonate on the iron redox chemistry: Implications for the photo-Fenton reaction [J]. Chemosphere, 2014, 103: 354-358. doi: 10.1016/j.chemosphere.2013.11.069 [63] SERAGHNI N, DEKKICHE B A, BELATTAR S, et al. Role of Fe(III) and oxalic acid in the photo-Fenton system for 3-methylphenol degradation in aqueous solution under natural and artificial light [J]. Int J Chem React Eng, 2018, 16(9): 20170211. doi: 10.1515/ijcre-2017-0211 [64] CHEN J, ZHANG H, TOMOV I V, et al. Electron transfer mechanism and photochemistry of ferrioxalate induced by excitation in the charge transfer band [J]. Inorganic Chemistry, 2008, 47(6): 2024-2032. doi: 10.1021/ic7016566 [65] MANGIANTE D M, SCHALLER R D, ZARZYCKI P, et al. Mechanism of ferric oxalate photolysis [J]. ACS Earth and Space Chemistry, 2017, 1(5): 270-276. doi: 10.1021/acsearthspacechem.7b00026 [66] LI F B, LI X Z, LIU C S, et al. Effect of oxalate on photodegradation of bisphenol A at the interface of different iron oxides [J]. Industrial & Engineering Chemistry Research, 2007, 46(3): 781-787. [67] XU T Y, FANG Y M, TONG T Y, et al. Environmental photochemistry in hematite-oxalate system: Fe(III)-Oxalate complex photolysis and ROS generation [J]. Applied Catalysis B:Environmental, 2021, 283: 119645. doi: 10.1016/j.apcatb.2020.119645 [68] WU B D, ZHANG G Y, ZHANG L, et al. Key factors in the ligand effects on the photo redox cycling of aqueous iron species [J]. Geochimica et Cosmochimica Acta, 2020, 281: 1-11. doi: 10.1016/j.gca.2020.05.004 [69] KRIBÉCHE M E A, SEHILI T, LESAGE G, et al. Insight into photochemical oxidation of Fenuron in water using iron oxide and oxalate: The roles of the dissolved oxygen [J]. Journal of Photochemistry and Photobiology A:Chemistry, 2016, 329: 120-129. doi: 10.1016/j.jphotochem.2016.06.021 期刊类型引用(1)
1. 张胜男,李玲一,胡立鹃,李俊学,程微. 赤铁矿在污染控制方面的晶面效应研究进展. 中南民族大学学报(自然科学版). 2024(03): 307-318 .  百度学术
百度学术
其他类型引用(1)
-






 下载:
下载: