-
化学工业的发展带来化学品数量的迅猛增加及产量的极大提升. 2002年至今,美国化学文摘数据库中收录的化学物质的数量从2000万迅速增加到了1.95亿[1],目前全球登记的用于生产和使用的化学品数量也超过了35万种[2]. 《全球化学品展望》第二期报告中指出,目前化学品的生产能力为每年23亿吨,预计到2030年将翻一番[3]. 大量化学品在工业及消费品中的使用导致其不断进入环境,形成潜在的环境污染物,威胁环境及人体健康. 一项发表在Lancet上的研究显示全球16%的过早死亡可能与环境污染有关[4],2019年仅由空气污染导致的过早死亡人数就超过了400万[5]. 过去几十年中,以药品及个人护理品(pharmaceuticals and personal care products, PPCPs)[6]、内分泌干扰物[7]、阻燃剂[8]以及全氟/多氟烷基化合物(per- and polyfluoroalkyl substances, PFASs)[9]等为代表的新污染物不断在众多环境介质中被检出,一些报道也指出这些新污染物可能引发多种不良健康效应,引起了广泛的国际关注.
全面认识环境中的污染物是进行环境健康风险评价及制定合理有效的化学品管控措施的前提. 然而,尽管科学家已经进行了长期的环境监测,但实际上人们对环境中潜在污染物却知之甚少. 这主要是由于:(1)对于商业化学品而言,尽管在一些国家和地区其生产使用需要进行登记,甚至需要通过相关监管机构的评估审批,但许多信息包括化学结构、产量、安全性等都是不公开的;加上相当一部分化学品或产品受专利保护,其组成配方、分子结构及合成途径等内容可能都属于保密范畴,主要化学成分及可能的副产物等信息难以获取;(2)区别于实验室合成,大规模的工业生产过程可能会由于生产条件的变化或受到周围环境的影响而产生更多的未知副产物;(3)相关产品及化学品在使用及进入环境后可能发生多种生物及非生物转化,形成未知代谢产物. 因而,对环境中大量潜在的环境污染物进行识别、鉴定以及定量是目前全球科学家和政府面临的巨大挑战.
长久以来,对污染物的监测分析都采用基于色谱-质谱(chromatography-mass spectrometry)联用技术的靶标分析(target analysis)方法. 该方法利用标准品建立分析方法,通过对提取方法及仪器测定参数进行优化,能够实现对特定污染物的高灵敏度(fg·g−1至pg·g−1)检测. 然而,随着大量新化学品不断流入环境并发生迁移转化,环境中实际存在的污染物的种类和数量迅速增加. 此外,大量新污染物的化学结构未知,没有标准品可供使用;对少数已知信息的污染物进行标准品的全获取不仅成本高昂,且往往存在严重的时间滞后. 因此,依靠标准品的常规靶标监测模式只能覆盖实际环境中的一部分污染物,对于全面认识及评估环境及人群的暴露风险来说远远不够.
得益于近年来高分辨质谱(high-resolution mass spectrometry, HRMS)的快速发展,基于色谱-高分辨质谱系统的非靶标分析(nontarget analysis, NTA)方法已逐渐成为环境污染物分析的重要手段. 与传统的靶标分析相比,NTA不再依赖标准品,通过高分辨率、高准确度的全扫描结合多种数据处理技术实现对大量化合物的同时检测分析,以定量已知污染物并识别鉴定未知污染物. 过去十几年,NTA技术在环境分析领域得到了快速发展及应用(表1),帮助科学家在多种环境介质和生物体内鉴定出了许多以前未知的污染物,极大提高了人们对环境中污染物的认识,对于污染物的早期发现及控制有重要意义. 本文回顾了过去十几年来NTA用于复杂基质中环境污染物识别和鉴定的成果,分别从样品前处理、仪器分析以及数据采集和处理三方面对不同研究方法和策略进行了汇总、分析和比较,讨论了各自的优劣及适用范围,以期为NTA技术的整体发展以及开展广泛的新污染物识别提供参考.
-
样品前处理的目的是在提取、富集目标物质的同时,尽可能多地去除样品基质,以获得高分析灵敏度. 在靶标分析中,样品前处理方法通常是通过基质加标的方法来建立的. 而在非靶标分析中,由于目标分子结构未知,提取方法的选择及建立多是依赖结构类似的化合物. 在进行广泛的污染物筛查时,考虑到污染物间可能存在巨大性质的差异,样品提取多采用基于一些基本的化合物性质(如极性、酸碱性、挥发性等)的耗竭式提取方法.
-
液-液萃取(liquid-liquid extraction, LLE)利用有机物在不同溶剂中溶解度的差异进行污染物的富集和提取. 比如,有研究者分别使用二氯甲烷和甲醇对废水中的氟化物[22]和溴化物[23]进行了有效提取. 分散液-液微萃取(dispersive liquid-liquid microextraction, DLLME)是通过在水样中加入与水互不相溶的萃取剂和与水及萃取剂混溶的分散剂,形成乳浊液体系,后经过简单离心实现水和有机物的分离. 该方法操作简单快速,溶剂用量小,在对小体积水样中的有机磷农药[41]、氯酚[42]及双酚A[43]等典型环境污染物进行定量分析时获得了良好的回收率. 在对马尔梅诺泻湖中来自农业、工业、医药等行业的有机污染物进行广泛筛选时,Peñalver等[10]使用1 mL乙醇作为分散剂,125 μL氯仿作为萃取剂对10 mL海水样品进行萃取,成功从中识别出包括邻苯二甲酸酯、多环芳烃、烷基酚、药物等在内的污染物共计18种,回收率均能够达到90%以上.
固相萃取(solid-phase extraction, SPE)以多样化的填料选择和整体更低的基质效应成为水样中污染物提取最常用的方法. 通过使用不同填料的萃取小柱,调节洗脱程序,能够实现对特定极性范围、特定结构类型污染物的高效提取富集以及基质分子的去除净化. 常用的商品化SPE小柱有亲水亲油平衡柱HLB、混合弱阴离子交换柱WAX、混合阴离子交换柱MAX、混合型弱阳离子交换柱WCX和混合阳离子交换柱MCX等. 其中,MAX小柱[20]和MCX小柱[44]分别对酸性和碱性化合物具有高亲和力,WCX小柱[20]和WAX小柱[39]分别对强碱性(如季铵盐)和强酸性(如磺酸盐)化合物具有高选择性. HLB小柱对广谱的化合物都有较好的富集效果,也是水样分析中最常用的小柱类型[45]. 此外,根据分析需求可以进行填料的组合. Psoma等[19]选择HLB、ENV+、Strata-X-AW和Strata-X-CW等4种材料进行了SPE小柱的装填,对二甲双胍等在内的4种药物的生物转化产物进行了评估,共鉴定出22种转化产物. 此外,依据物质在固定相和水相之间的分配平衡原理,研究人员发展了固相微萃取(solid-phase microextraction, SPME)技术,搭配气相色谱(gas chromatography, GC),在NTA研究中也得到了一定应用[12]. 使用SMPE提取和顶空进样技术,Yu等[27]在武汉地区的自来水中筛选出多环芳烃、酯、醛、酚等多种化合物.
样品提取后多需对样品进行浓缩,以提高检测灵敏度. 最常用的浓缩方法是氮吹以及加热,适用于目标分析物为极性物质的分析. 由于低气压下溶液体系沸点降低,可使用真空辅助蒸发浓缩(vacuum-assisted evaporative concentration)进一步降低待分析物在样品制备过程中的损失,有研究者将其用于环境水样的直接浓缩,以富集浓缩其中的农药及转化产物[16]. 在不断地更新换代中,高分辨质谱的灵敏度也在不断提升,因此,在一些未知污染物的识别研究中,直接进样[13, 25]或大体积进样[21]的方式也有所使用,极大简化了样品前处理的流程和时间,提升了分析效率.
-
与水样相比,包括大气颗粒物、土壤、沉积物等在内的固体样品在分析检测中需要面对更加复杂的基质效应. 为提高样品的均匀程度和提取效率,干燥[34, 46]、冷冻干燥[11, 29-30, 32]、研磨或粉碎通常是固体样品前处理的必要步骤. 超声、索氏提取[23]、加速溶剂萃取(pressurized liquid extraction, PLE)[24]等固-液萃取方法常用于进一步的化合物提取. 相比传统的索氏提取,PLE通过施加较高的温度和压力,使溶剂分子的温度高于常压下的沸点,能够在更短的时间内,使用更少的有机溶剂实现对固体样品的自动化提取,基质效应更低. 根据目标化合物的性质可选择极性(如水、乙腈)、半极性(如乙醚、氯仿)或非极性(如环己烷、甲苯)等溶剂对样品进行提取,已在土壤沉积物[29]、颗粒物[36]等样品中新污染物的识别中有所应用. Moschet等[37]使用正己烷和丙酮对室内粉尘进行了提取,得到了含中低极性和极性化合物的提取液,分别用于后续的GC和液相色谱(liquid chromatography, LC)-HRMS分析.
-
生物样品的提取方法类似于一般环境样品,但相比而言,血液、尿液、母乳、肝脏、肌肉、心脏等样品中通常含有高浓度的内源性物质,包括蛋白质、脂质、盐等,可能引起更强烈的基质效应,需要在前处理中进行去除. 比如可以通过静置后离心的方式进行尿液样品中蛋白质和悬浮物质的去除[47]. 对于一些特定结构的污染物,内源性分子如蛋白质等能够与其发生结合,因而在污染物提取时需要先将污染物游离出来. 在一项针对血浆中PFASs的识别研究中,Liu等[40]依次使用乙腈和基于ZrO2的Hybrid SPE柱分别进行蛋白和磷脂的去除,使得与白蛋白结率超过95%的大量PFASs游离,进一步使用聚醚砜磁力棒吸附萃取法进行提取,极大地降低了内源性分子的干扰,实现了对中长链PFASs分子的高灵敏提取和检测. 除了使用有机溶剂,低温冷冻也被用于富含蛋白质的肌肉组织样品的前处理,使蛋白质发生变性沉淀而去除[48]. 对脂质的去除也可使用基于体积排阻和疏水相互作用机制的Captiva EMR-Lipid柱过滤技术[49]. 虽然大多数时候与生理分子的结合对于生物样品中污染物的分析来说都是一种阻碍,但这种结合也为某些特定结构污染物的特异性提取富集提供了一种可能. Yang等[50]将环境水样与人肝脏脂肪酸结合蛋白以及高表达该蛋白的微生物进行共培养,之后通过体积排阻色谱进行相应分子量蛋白质的收集,实现了对其中PFASs的特异性、高效富集,识别出多种新PFASs.
-
样品经过提取、净化后,使用色谱分离可进一步降低基质干扰,提高化合物分析的灵敏度,因而绝大多数的环境污染物分析都采用色谱-质谱联用系统. 在非靶标分析中,实现化合物之间的高分离也有利于未知污染物的结构鉴定. LC主要用于极性、半极性和部分非极性化合物的分析[51]. 常规的反相液相色谱(reversed-phase liquid chromatography, RPLC)主要依靠分子间的非极性相互作用进行分离,对于离子或强极性化合物的保留效果较差. 近年来出现的亲水相互作用液相色谱(hydrophilic interaction liquid chromatography, HILIC),由于采用了极性固定相,对强极性、高亲水性的化合物都有很好的保留,在环境水样中极性污染物的NTA识别中得到了一定的应用[18]. 在另一项研究中,研究者使用复合离子交换柱,通过调整流动相梯度和缓冲液浓度,建立了针对油水分配系数(distribution coefficient, log D)处于-7 – 1(pH = 7.4)的范围间的37种强极性化合物的分析方法[14],但这样的色谱柱存在无法对化学物质的保留进行预测的固有缺陷.
分析非极性、半极性或挥发性化合物时,相比LC,GC可能是更好的选择. Yu等[27]通过GC-HRMS分析,在饮用水中发现了12类挥发性有机化合物. 在对特别复杂的样品进行分析时,多维色谱的使用可进一步降低提取物的复杂性,有利于各化合物的识别鉴定和准确定量. Veenaas等[31]利用GC×GC-HRMS对斯德哥尔摩市从2005年至2015年这10年间的污水和污泥样品进行了分析,使用固定相分别为弱极性和中等极性的两根正交柱,实现了对超过300种化合物的有效分离和鉴定. 另外,在一项关于城市污水的研究中,研究者使用了超临界流体色谱(supercritical fluid chromatography, SFC)技术,鉴定出了常规LC分析无法分离检测的23个臭氧化产物[25].
-
离子源是除质量分析器外HRMS的另一个核心部件. 电子电离(electron ionization, EI)源是GC-HRMS最常用的电离源,主要用于对挥发性或半挥发性物质进行分析. 在非靶标分析中,EI源多用于大气颗粒物中的污染物如多环芳烃类化合物的识别[36],在一些水体[12]、土壤和沉积物[29]中的弱极性、非极性污染物的识别中也有一定应用. 大气压化学电离(atmospheric pressure chemical ionization, APCI)源在非靶标研究中的使用还比较少. Aalizadeh等[52]于近期开发了首个基于GC-APCI-HRMS进行环境样品中的新污染物半定量的工作流程,有望服务于多环芳烃、多溴联苯醚、多氯联苯类物质的检测发现. 在基于LC-HRMS系统的非靶标研究中,ESI源的使用最为广泛,用于检测识别离子型化合物;对于难以自行离子化的化合物,可使用大气压光电离(atmospheric pressure photo-ionization, APPI)或APCI源进行辅助电离,实现在LC条件下的检测. 在一项研究中,一对无法通过色谱实现分离的麝香异构体,在掺杂辅助的APPI(dopant-assisted APPI, DA-APPI)源中显示出不同的离子反应,两个异构体的结构因此得以鉴定[33]. Singh等[53]分别使用ESI和APCI源对超过1000种化合物进行了检测,结果显示,其中181种化合物只能被 ESI源检测到,48种化合物只在APCI源下有响应. 结合ESI、EI及化学电离(chemical ionization, CI)3种电离源,研究人员对大气颗粒物中的水溶性、极性和非极性化合物进行了较为全面的表征[54],表明不同检测模式以及电离源的联合使用有助于实现样品中多种污染物的广泛检测识别.
-
HRMS进行未知物识别鉴定的基础是其极高的质量分辨率(resolving power, RP)及质量精度(mass accuracy, MA). 前者指仪器区分两个质量数接近的质谱峰的能力,后者指的是测得质量数与理论质量数的偏离程度. 更高的RP值产生更窄的质谱峰,意味着更强的区分干扰离子的能力,但相应地,扫描时间也会更长,产生的谱图也更为复杂. 更高的质量精度意味着在分子式推断时产生更少的干扰选项,带来更高效率的化合物的识别鉴定. 质谱仪中搭载的高分辨质量分析器有飞行时间(time-of-flight, TOF)、轨道阱(orbritrap)和傅里叶变换离子回旋共振(Fourier transform ion cyclotron resonance, FT-ICR)3种类型. TOF分辨率及质量精度均较低,但价格相对低廉,联用四极杆(quadrupole time-of-flight, QTOF)使其得到了广泛的应用;FT-ICR尽管具有最高的分辨率,但由于高昂的维护费用,以及更慢的扫描速度导致其与色谱的兼容性较差,在现阶段NTA研究中的应用有限.
-
全扫描(full scan)是HRMS的基本扫描方式,在这种模式下,进入仪器的离子不经过任何筛选,全部进入质量分析器中被测定,能够获得每个离子的质荷比(mass to charge ratio, m/z)及强度信息. 在LC-HRMS和GC-CI-HRMS中,全扫描模式记录到的离子大多为分子离子或准分子离子;而在GC-EI-HRMS中,全扫描记录的则是各化合物的碎片离子信息. 准分子离子难以直接用于化合物结构的推断,需二次进样,经碰撞池,如碰撞诱导解离(collision-induced dissociation, CID)或高能碰撞解离(high-energy collisional dissociation, HCD)池,进行裂解产生丰富的碎片离子以辅助结构判断. 而EI模式下的碎片离子虽然可直接用于结构推断,但很多时候由于化合物结构的高度相似性(如异构体),可能造成母体污染物结构推断困难.
数据依赖采集(data-dependent acquisition, DDA)是目前NTA最常用的扫描方式. 在除GC-EI-HRMS外的其他模式下,该扫描方式可以同时获得所有可检测离子的分子离子信息以及每次扫描中呈现最高响应的一些离子的二级质谱碎片信息. 在进行广泛的污染物筛查中该扫描方法应用较多,尤其适用于高污染样品的分析,进行主要污染物的发现. Gago-Ferrero等[17]使用DDA模式对废水进行分析,并设定将每次扫描中响应值最高的25个信号进行二级裂解,最终识别出18种极性有机污染物,并首次在废水中发现了表面活性剂乙二醇醚硫酸盐. 使用该扫描方式要注意,每轮扫描进行MS2裂解的离子的数量不宜设置太多(通常不超过20),否则会由于总扫描时间太长而造成数据的缺失. 在最新出现的迭代DDA模式中,通过反复分析同一样品,不断排除已经进行过二级碎裂的离子,使样品中浓度、响应更低的离子也能够被裂解,极大拓宽了样品中可识别的污染物的数量和种类,适用于痕量污染物的发现[55]. 为对垃圾渗滤液中的PFASs进行全面表征,Koelmel等[28]使用DDA和迭代DDA分别对样品进行了测试,结果显示迭代DDA的数据覆盖率提高了80%.
与DDA相对应的是数据非依赖的采集模式(data-independent acquisition, DIA),通过裂解设定范围内的全部母离子,获得包含多种离子碎片的混合MS2谱图. 在该扫描模式中,DDA模式固有的母离子-子离子对应关系丢失,给谱图解析和新污染物发现带来一定的困难,但该扫描模式理论上可获得所有分子的MS2信息,适用于大浓度跨度范围的大量污染物的同时检测分析,尤其适用于能够产生特征碎片的特定结构类型污染物的识别. 为降低DIA模式中母体分子的寻找难度,Peng等[35]基于分段质量范围使用DIA对同一样品进行多次分析,经由MS2扫描中的特征碎片Br-在保留时间上的指引对可能的溴化物分子进行筛选. 在一些研究中,为了高效进行污染物识别,研究者们会联合使用DDA和DIA进行样品扫描[38]. 全离子碎裂(all ion fragmentation, AIF)是一种特殊的DIA,此模式对所有进入质谱的离子进行碎裂而无法设置质量范围. 在地中海贻贝的双氯芬酸暴露实验中,研究人员基于暴露组与对照组AIF碎片的差异,鉴定出13种双氯芬酸的代谢产物[56]. 离子源裂解扫描(in-source fragmentation, ISF)与AIF相似,不同之处在于AIF使用裂解池获取离子碎片,而ISF的裂解发生在离子源区域. 一般而言,离子源所能施加的能量整体较低,对于高稳定性的化合物难以获得有效的碎片信息,不适用于该类化合物的发现. Liu等[21]使用快速交替运行的全扫描与ISF扫描,经由ISF中特征碎片的保留时间引导,在污水中识别出5类新PFASs. 在以上扫描模式的设定中,由于未知结构所需的最佳碎裂能量未知,在NTA中经常使用梯度碰撞能量(collision energies, CE,如10、15、30 eV;或normalized collision energies, NCE,如15%、30%、50%)以获取丰富的碎片信息. 在针对特定结构类型污染物的分析中,一些研究者会利用已知的同类型污染物进行裂解能量的测试选择[21],以最大程度提高分析数据的质量.
在对初步筛选的潜在污染物分子进行结构鉴定的时候,可采用目标裂解扫描模式(targeted MS/MS, t-MS2),即使用低质量分辨率的四极杆进行特定质量数的选择(精度0.4 – 1 Da),之后送入裂解池进行碎裂,以获取较为干净的二级图谱.
-
数据分析是指对所采集的色谱-质谱数据进行分析处理以实现复杂样品中污染物分子的识别及结构鉴定,是NTA流程中最复杂、耗时最久的步骤. 常规数据处理流程如图1所示,主要为首先从海量HRMS数据中筛选出可能的污染物分子,之后进行结构判断,再评估结果的可靠性.
-
在NTA中,理论上所有可离子化的化合物都能够被检测并在全扫描中产生信号. 从大量信号中发现少数可能的污染物分子无异于大海捞针,尤其是污染物与样品基质相比,往往处于痕量、超痕量水平,因此需要一些手段首先对可能的污染物分子进行筛选. 最基本的筛选是指对样品中真实存在的离子进行筛选,筛选方法包括扣减空白样品信号(如流程空白、基质空白)、设置一定的信噪比(signal to noise ratio, S/N),以及色谱峰的峰形控制(强度、峰宽、对称性等)等. 当存在成对或者多组差异性样品(如工厂上下游的河水样品,污水处理厂的进出水样品)时,可基于这种差异性,使用统计学方法排除大量的基质分子,实现对未知的新污染物的初步识别. 常用统计方法有主成分分析(principal component analysis, PCA)[57]、偏最小二乘法判别分析(partial least squares-discriminant analysis, PLS-DA)[58]以及层次聚类分析(hierarchical cluster analysis, HCA)[59]. 结合PCA和HCA,研究人员对加迪斯湾的周边情况进行了调查,结果表明537种废水污染物能够从源头蔓延到公海[57].
清单筛查是另一种高效的污染物分子筛查方法,基于公开或研究者自己建立的数据库,通过设置离子质量数及合理的误差范围,对获取的HRMS数据进行提取比对,快速筛选出潜在的污染物分子. 常用的开源环境污染物数据库资源有欧洲NORMAN Exchange系统[60](http://www.norman-network.com/?q=node/236)和美国环保署的CompTox Chemicals Dashboard网站(https://comptox.epa.gov/dashboard/chemical-lists),覆盖污染物种类范围包括农药、PFASs、PPCPs以及一些转化产物等. 研究者也可以从已有的报道、实验室先前的研究结果或前述公开的数据库中收集整理与研究内容相关性更强的污染物或转化产物的相关信息,自行建立污染物清单. Lin等[61]基于ToxCast建立本地数据库,对大气细颗粒物进行筛查,识别出89种化合物. 清单筛查虽然筛选速度快,效率高,但高度依赖已有的研究或报道,对于全新污染物的发现并不适用.
含有特定基团或官能团的同系物,质量数规律可循或在碎裂的过程中可产生共同的特征碎片离子,对于这类污染物可以依据其质量数特征或特征碎片进行识别. 比如存在不同链长同系物的PFASs,可使用Kendrick质量缺陷法则将测得的质量数进行转化后,进行系列同系物分子的发现. 对于分子式相差—CF2—和—CH2CF2的同系物,相应的质量数转化因子分别为49.99681 Da和64.01246 Da. 联合使用该策略以及清单筛查,Wang等[20]在废水中鉴定出37个潜在的PFASs同系物. Peng等[35]通过DIA图谱中Br-碎片的搜寻,在沉积物样品中发现了1593种溴代污染物. 此外,含有一些特殊元素(如Cl、Br等)的化合物由于能够在全扫描中呈现特异性同位素分布而被识别. 通过对t-MS2谱图中的Br-和I-进行搜寻,找到全扫描模式下对应的前体离子,对这些前体离子再一次进行t-MS2扫描,Tao等[26]在自来水中成功鉴定出了64种溴代以及23种碘代消毒副产物(disinfection by products, DBPs). 在近期的一项研究中,研究人员基于特征碎片及同位素分布特征开发了一种针对碘代全氟和多氟烷基酸(iodinated per- and polyfluoroalkyl acids, I-PFAAs)的数据筛查及识别方法. 首先对在DDA分析中获得的MS2谱图进行搜索,筛选含有特征碎片离子I-(m/z = 126.90502)的潜在I-PFAAs分子,之后根据I-保留时间指示在全扫描中筛选可能的对应母离子,再对疑似母离子进行碳、硫同位素分布特征的双重检验,以排除假阳性[22]. 使用此方法,研究者在有机氟化物工业园区的废水中发现了18种I-PFAAs. 近年来,一些自动化软件的出现使得对潜在的特定类型污染物分子的提取更为便捷,如FluoroMatch能够联合质量亏损、特征碎片等信息从复杂质谱数据中对疑似PFASs离子进行筛查及识别[28],Haloseeker能够基于同位素特征对Cl、Br取代的污染物进行快速筛选[62].
-
初步的化合物分子式推断是进行结构鉴定的第一步,即通过设置分子中可能存在的元素种类及数量,列出可能的分子式组成. 对于软件给出的可能分子式,常常需要进一步加以筛选. 根据仪器精度的不同,实验中获得的m/z信息与理论质量数会在一定质量数范围内存在差异,首先需要针对质量偏差进行过滤. 常规TOF、Orbitrap和FT-ICR的质量偏差范围分别在±0.003‰、±0.002‰、±0.001‰. 此外还可以使用Seven Golden Rules(七项黄金法则)[63],从元素数量、元素组成合理性、是否符合Lewis和Senior规则、碳氢元素比例、同位素比例、氮氧硫磷与碳元素比例,以及是否存在三甲基硅烷化合物七方面进行候选分子式的筛选. 例如对于呈现M:[M+2] = 3:1的分子离子,大概率有且仅有1个Cl原子.
对污染物进行分子式的最终确认以及结构判断需要依赖MS2信息. 基于MS2的相似性进行数据库图谱匹配是NTA中化合物结构鉴定的主要方法,可用的二级数据库主要有Mass Bank(http://www.massbank.jp/)、NIST(https://webbook.nist.gov/chemistry/)、METLIN(https://metlin.scripps.edu/landing_page.php?pgcontent=mainPage)、MzCloud(https://www.mzcloud.org/)以及PubChem(https://pubchem.ncbi.nlm.nih.gov/)等,覆盖了环境、代谢组学、蛋白组学、法医学以及食品领域相关的化合物,研究者也可以根据分析需求建立本地二级数据库. 对于多种可能匹配的结果,数据处理软件如Compound Discover、enviMass等均可根据碎片及其相对丰度的匹配程度以及全扫描质谱数据中同位素峰的比例等给出评分,评分的高低可作为可能结构的选择依据之一[24, 64]. 但由于实验图谱中往往存在混杂碎片,或一些评分机制本身不完备,在实际数据库对比中,并不一定是高匹配分数的分子最为可信,因而实际操作中不能盲目依赖软件,需同时配合人工检验. 此外,一些数据库也包含了保留时间、保留指数等信息(如NIST),为提高匹配精度增加了额外的评价因素. 数据库对比适用于已有MS2谱图的污染物的发现. 尽管质谱数据库在持续更新,但相比连年来呈指数增长的新化合物的生产及发现,仍然无法满足当前的分析需求.
针对没有匹配的谱图的化合物,目前主要依靠人工解谱,解析效率及准确度高度依赖研究者的知识与经验,可能产生差异性的解析结果. 在PFASs的鉴定中,高度类似的不饱和全氟烷基磺酸盐类在不同研究中分别被解析为双键和环状[20, 39]. 模拟裂解软件如MetFrag、Mass Frontier的出现极大地改善了这种缺陷,可基于实验获得的MS2质谱图,通过计算机模拟碎裂的方式,对母离子和各级子离子的分子结构进行阐释,辅助人工解谱[65-66]. 另一类模拟软件则可以对给定的结构进行模拟裂解,产生模拟MS2谱图,可帮助研究者从多种可能结构中筛选最可能的母离子结构,提高结构鉴定的准确性. CFM-ID(https://cfmid.wishartlab.com/)可以对一组可能的候选结构进行模拟碎裂,并将得到的结果与实际获得的MS2谱图进行对比后给出各候选结构的可能性排名[67-68]. 在一项瑞士地下水的相关研究中,研究人员使用CFM-ID进行化合物的结构注释,所使用的29个标准品中,有23种得到了确认[15]. 保留时间(retention time, RT)或者保留指数,是化学物质鉴定中另一个重要的评价参数[69]. 基于色谱疏水性指数(column hydrophobicity index, CHI)和log D建立起的两个RT预测模型对于强疏水性化合物有较好的预测结果,可用于进行候选母离子的筛选[70]. Aalizadeh等[71]建立了适用于HILIC和RPLC的RT预测模型,在对曲马多等物质进行臭氧氧化的实验中,RT预测结果与实验结果高度一致,表明该模型能够支持异构体的鉴定工作.
作为一种新的结构解析工具,分子网络(molecular networking, MN)的出现为进行高效的未知结构鉴定提供了强大的支持. MN最早应用于生命科学领域[72],基于实验中产生MS2来创建节点,将所获得的图谱根据相似性进行归类,并与数据库进行匹配. 一般情况下,具有相似结构的化合物产生的碎片光谱也相似,因此这些化合物的节点往往聚集在一起形成类似物簇,只要同属于一簇的任何一个分子与数据库中已有的光谱匹配成功,该簇中大量的分子都能加以注释. Papazian等[54]利用MN对来自马尔代夫的细颗粒物样品进行了分析,结果表明,与来自南印度洋的清洁空气相比,有机氮化物是高污染区域的主要污染物组成. 经过改进后,基于特征的MN(feature-based MN, FBMN)除MS2之外,同时将RT和峰面积考虑在内,在进行结构鉴定的同时兼具了识别同分异构体的能力[73]. Oberleitner等[13]利用FBMN成功在地表水中鉴定出沙坦类物质及其转化产物.
-
对所鉴定的结构进行最终确认需要依靠标准品,或者在对样品分馏纯化后进行核磁共振波谱(nuclear magnetic resonance, NMR)分析. 除了少数化合物,目前新污染物识别研究中鉴定出的化合物都没有经过最终的结构确认. 具体的NTA研究方法不同,所鉴定出的化合物的结构的准确度也存在差异. 为了反映所鉴定结构的可靠性,Schymanski等[74]提出了针对LC-HRMS分析的化合物结构置信等级(confidence level, CL),该评价系统共分为5个置信等级,从CL1到CL5准确度依次降低(图2). 其中,CL5仅包含m/z信息,没有更多的关于分子式或结构的信息. 当有额外的加合离子、同位素或离子片段等信息辅助,能够推算出分子式,但MS2不能提供有效的结构判断信息时,置信等级变更为四级. 置信等级为三级时,部分MS2谱图得到了解释,但仍然不能据此提出明确的完整结构(如不确定某个官能团的具体位置). 二级置信被进一步区分成2a和2b级,分别指的是通过现有的数据库进行谱图匹配,在多个参数(如碰撞能量、RT等)都高度吻合的情况下得到唯一可能结构的情况,以及根据MS2谱图进行人工推断得到唯一可能结构时的情况. 当有标准品提供时,所检测的分子与标准品的色谱质谱行为(如RT,MS、MS2等)表现出高度一致,二级置信中提出的物质结构可被确认,即为一级置信水平.
现在备受关注的PFASs,其特异的同系物特征给出了更多的可供分子识别和结构鉴定的信息,Charbonnet等[75]在Schymanski化合物结构评价体系的基础上提出了针对PFASs的更为细致的置信等级评价方法. 对于经GC-HRMS系统分析及鉴定的化合物,Schymanski体系中的一些评价标准已不再适用,Koelmel等[76]提出了相应的置信评级标准,同样也包括五个等级. 在该体系中,任何可重复检测到的未知碎片都属于CL5,处于这一置信等级的离子仍然具有被注释的可能,但达不到其他任一置信等级的标准. 四级置信度被划分成a、b、c三个等级,根据同位素分布、精确质量数或碎片离子比对后鉴定出的具有唯一化学式的化合物处在4a级;具有重复化学结构,碎裂遵循Kendrick质量缺陷原则或即使在变温条件下仍然具有线性保留指数的系列化合物处在4b级;结构上具有相似性,具有一个或多个精确质量匹配的一组化合物处在4c级. 需要指出的是,从4a到4c并不代表置信等级的降低或者升高. 例如在PFASs分析中,目的是找到多种化合物的系列,此时的评级即为4b级. 此外,对于4b和4c,也可以具有精确的化学式匹配,表示为4ab/4ac级. 除了需要有匹配的保留指数外,三级置信标准与LC-HRMS的二级置信标准基本一致. 二级与三级置信的主要区别在于前者对保留指数匹配度要求更高. 一级置信水平与Schymanski体系类似,但在使用EI源时,可以从一级扫描中获得碎片信息,因此不需要分子离子或二级图谱的信息.
-
NTA的发展使得在对样品中物质信息完全未知的前提下对其中的污染物进行发现成为了可能,有助于更全面地呈现各样品介质中的新环境污染物,以及整体污染物的赋存状况,推进风险评估. 目前一些针对特殊(如全氟工业园区的废水[20])或普通(如湖水、海水[39])环境样品的NTA研究在我国也有开展,但与世界其他国家相比,我国的研究范围有待扩大、研究内容有待深入,开展全方位的新污染物识别工作,有利于促进我国“筛、评、控”[77]的新污染物治理工作进程. 高效且准确的化学结构鉴定是目前NTA研究面临的一大挑战,基于实验数据的包括RT信息在内的MS2数据库的不断扩展是一项长期的任务,基于机器学习的辅助性工具的发展有望以模拟数据库或辅助结构解析的方式服务于未知污染物的结构鉴定. 尽管辅助软件的使用大幅度降低了NTA中数据筛选和比对环节的耗时,但不同软件之间的评分规则存在差异,识别结果很大程度上依赖人工的最终确认,也会产生不一致的结果,因此,发展自动化、智能化的新污染物识别鉴定平台也是加快污染物识别效率的一个重要研究方向. 过去10年,非靶标技术的应用带来了大量新污染物的快速发现,如何从中筛选出具有高环境健康风险的污染物,推进对它们的优先管控,以最终实现削减污染物对人体健康的不利影响的目标,是环境领域科学家面临的重要课题. 在此方面,中国科学院生态环境研究中心于2021年研制成功的高通量多功能成组毒理学分析仪(integrated toxicology analyzer, ITA)已经首先踏出了重要一步[78]. 近年来已经有一些将NTA与毒性评价相结合的探索性研究. 如与效应导向分析(effect-directed analysis, EDA)结合,实现了对样品中针对特定靶点[79-80],或者具有特定毒性[81]的污染物的识别. 对以上几个方面的综合深入探索,有助于推动关键污染物的高效、早期发现,服务于提升人民健康水平的国家需求.
非靶标技术在新污染物识别中的应用
Recent advances in nontarget discovery of emerging pollutants in the environment
-
摘要: 受人类活动的影响,来自工农业生产和生活活动等方面的化学品不断进入环境,加之各类生物和非生物转化时有发生,导致环境中存在多种污染物及复杂的转化产物.全面认识样品中的污染物是进行环境健康风险评价的前提.然而,大量的未知结构、复杂的环境基质以及低环境赋存浓度都为厘清污染物暴露带来了挑战,亟需发展高灵敏度的未知污染物识别技术.非靶标分析(nontarget analysis,NTA)作为一种新的分析手段,可以在化合物信息未知的情况下对复杂基质中的有机物进行识别,有助于最大限度揭示环境样品中存在的污染物,为风险评价奠定基础.本文回顾了非靶标技术在新污染物识别中的应用,从样品前处理、数据采集和数据处理三方面对目前使用的不同方法及策略进行讨论,讨论了各方法的优劣及适用范围,并提出了当前存在的问题及未来发展方向.Abstract: Chemicals from industrial, agricultural, and domestic activities are constantly entering the environment due to anthropogenic influences. In addition, various biotic and abiotic transformations of chemicals further lead to the presence of a wide variety of pollutants and complex transformation products in the environment. A comprehensive understanding of contaminants in samples is a prerequisite for environmental health risk assessment. However, the large number of unknown structures, complex environmental matrices, and low environmental concentrations pose challenges to the clarification of pollutant exposure. A technology with high sensitivity for the identification of unknown contaminants is thus urgently needed. As an emerging analytical strategy, nontarget analysis (NTA) enables the identification of organic compounds in complex matrices where compound information is unknown. NTA will help to reveal pollutants in environmental samples to the greatest extent and provide the critical foundation for risk assessment. In this paper, we review the applications of NTA technology in the identification of emerging pollutants, discuss the advantages, disadvantages, and scope of application of different methods that have been used from three aspects including sample pretreatment, data acquisition, and data processing, and propose challenges and future directions for the development of NTA.
-
水是江南园林的重要组成部分,素有“无水不成景、无水不成园”的说法[1]。水体水质好坏会在很大程度上影响到园林景观,但大多数园林水体的流动性较差、水域面积较小、自净能力偏弱,容易受到降雨径流等外源污染的冲击[2-3]。为提高水体自净效果,一般需要采取人工曝气、旁路过滤和生态浮床等强化措施。但这些方法普遍存在施工量较大、运行维护要求较高和对周边景观影响较大等问题[4–6]。
固定化生物膜技术是一种将微生物固定在一定载体上,通过增加单位水体生物量的方式,提高功能菌对污染物的降解效能的技术。该技术已被广泛应用于河湖水体的水质净化工程。WEN等[7]以玉米芯、麦秆和花生壳等为代表的生物质碳源作为固定化载体,形成的生物膜能释放有机物和氮磷等基质,促进微生物在其表面附着生长,但生物质碳源中有机物的释放速率呈现先快后慢的特点,不利于水体水质的长效治理[8];NI等[9]在纤维生物滤池 (Fiber Biofilter) 中将聚合物填料作为微生物的固定化载体,并将形成的生物膜用于水产养殖中将有机物降解,以及将氨氮转化为硝酸盐;TABASSUM等[10]以粉末状活性炭和水性聚氨酯凝胶包裹的硝化细菌作为固定化载体 (Mass Bio System) ,形成生物膜被用于快速提升水体硝化活性。
近年来,有研究者提出了一种将具有很高的生物亲和性,能以相对恒定的速率向水体释放碳源的新型生物蜡作为微生物固定化载体的技术。该生物蜡可促进生物膜的形成,适合用于治理微污染水体[11]。目前,将生物蜡技术用于封闭园林水体水质改善与长效保持的研究仍鲜有报道,生物膜的主要功能尚不清楚。为此,本研究选取典型的江南园林水体,通过对比投放生物蜡模块前后主要水质指标的统计学变化,从工程应用的角度论证新型固定化生物膜技术对小型半封闭水体的水质净化效能,并采用高通量测序技术,对水体、沉积物和生物膜中的菌群结构功能进行分析,系统阐述利用生物蜡技术实现水质净化的关键反应机制,以期为江南园林水体的原位净化与长效保持提供参考。
1. 材料与方法
1.1 实验地点
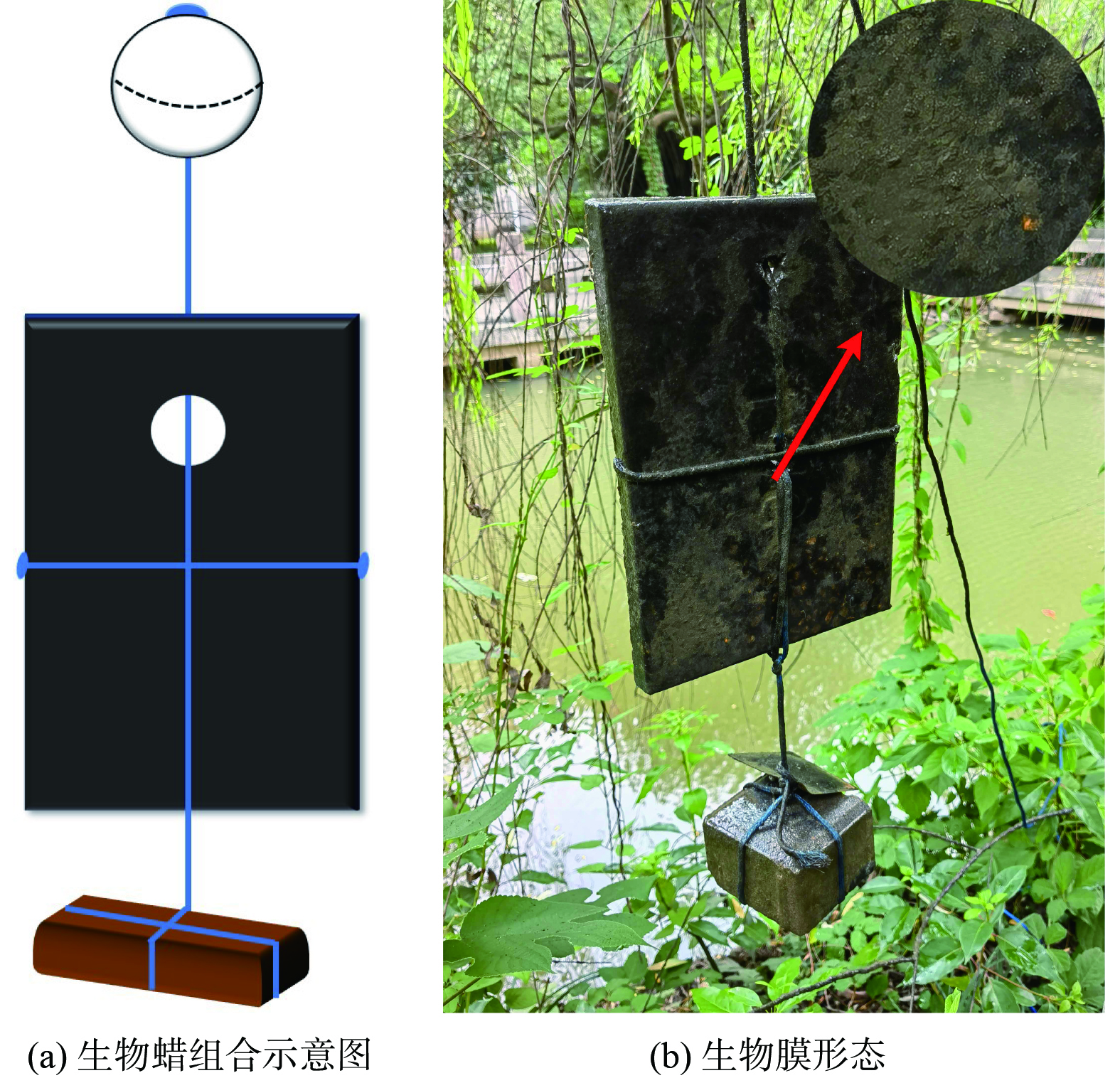
实验地点选取典型的江南园林水体——苏州科技大学石湖校区九曲桥 (31°15′17.88″N,120°34′56.30″E),水域面积约为1 200 m2,平均水深0.6~0.7 m,池底无水生植物,周边有茂密的陆生植被,定期与外部河道进行换水操作,如图1所示。该水体在春夏季受河道进水、降雨径流和内源污染等影响,容易发生局部水华现象。
研究于2021年2月—6月开展,对水体本底值进行监测,并于当年10月份投放生物蜡模块。待生物蜡挂膜成功后,于次年2—6月开展水质常规监测,以评估水体水质变化,监测频次均为每周2次。据调查,2021年苏州市平均气温 18.3 ℃,降水量1 318.6 mm,2022年平均气温 18.1 ℃,降水量1 004.2 mm。2021年和2022年苏州春夏季降雨量、平均气温相差不大,降雨形成的地表径流和树木落叶是潜在的外源污染。水体换水周期为每季度3~4次,每次换水耗时约1~2 d,其余时间水体基本处于静止状态。
1.2 生物蜡投放
生物蜡是一种采用微晶蜡固定脂肪酸 (碳源0.5%,微量元素0.1%,其他为石蜡 (标号56#) ) 的块状基质,整体呈黑色[12-13]。在水体中设置有12个投放点,平均每100 m2水面投放1块0.317 m×0.220 m×0.025 m,重1.25 kg的生物蜡。利用浮漂和配重将生物蜡模块直立悬浮在水中,如图2 (a) 所示。在水流和微生物作用下,生物蜡缓慢释放营养物质,有效促进土著微生物在其表面生成稳定的生物膜结构,期间不投加任何菌种。生物蜡挂膜周期约3个月,成熟的生物膜形态如图2 (b) 所示。
1.3 水质指标分析
使用EXO水质分析仪 (YSI,USA) 现场测定了叶绿素a的浓度,使用赛氏盘现场测定了透明度。使用国标法测定水样的氨氮 ([NH4+-N]) 、总氮 (TN) 、总磷 (TP) ,使用重铬酸盐法测定水样COD。
1.4 微生物高通量测序
2022年7月,分别采集水体中水样 (Water) 、沉积物 (Sediment) 和生物蜡表面生物膜 (Biofilm) 样品。水样经0.22 μm孔径滤膜过滤后,与其他固态样品一同-80 ℃条件下保存。使用试剂盒 (Fast DNA Spin kit for soil,M.P。Company,U.S.) 对各组样品进行DNA提取,每组设置3个平行样。使用引物338F ( 5'-ACTCCTACGGGAGGCAGCA-3') 和806R ( 5'-GGACTACHVGGGTWTCTAAT-3') ,进行16S rRNAV3-V4区基因扩增。PCR扩增完成后,用AxyPrepTM DNA凝胶提取试剂盒 (Axygen Biosciences,Union City,U.S.) 对产物进行纯化。将处理完成后的样品送往Illumina MiSeq 测序平台进行高通量测序。
1.5 细菌群落多样性分析
使用Usearch (version 11) 以97 %的相似性对OTU代表序列进行分类学分析。基于抽平后的OTU数据集,使用Uparse (version 11) 计算了α多样性指数 (Chao1和Shannon指数) ,并进行 (PCoA) 主坐标分析。在门和属水平上,比较了不同介质菌群结构的差异性。采用Kruskal-Wallis 秩和检验方法检验对多组样本进行物种组间差异显著性检验。使用Gephi (version 0.10.1) 分析不同介质细菌在属水平上的共现性网络。使用Faprotax预测不同介质细菌的潜在代谢功能。
2. 结果与讨论
2.1 投放前后理化性质分析
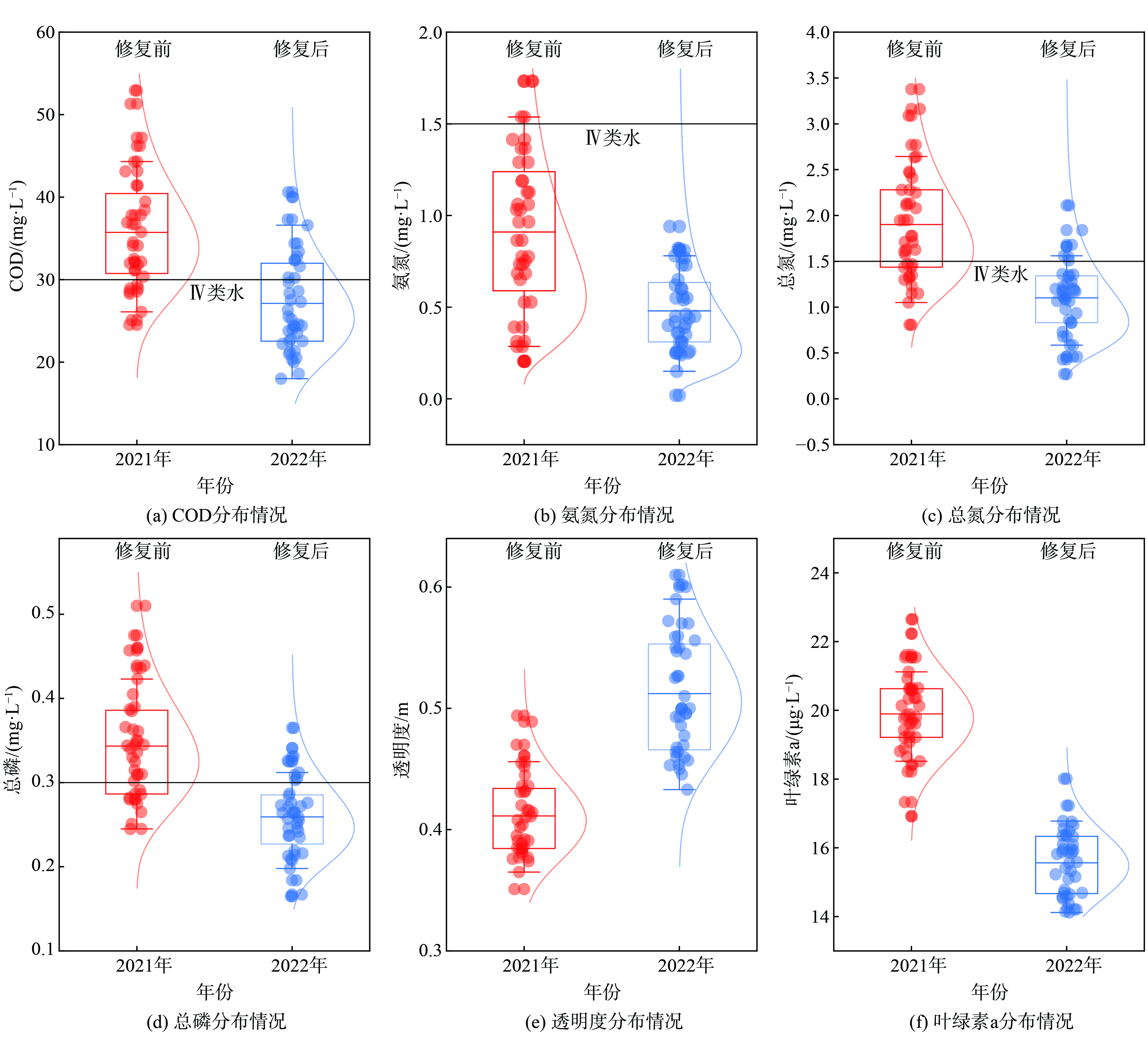
图3所示为投放生物蜡前后水体的各项监测数据,修复前为红色,修复后为蓝色。2021年2—6月:水体的COD、氨氮、总氮和总磷服从正态分布,均值分别为 (35.74±7.01) mg·L−1、 (0.91±0.43) mg·L−1、 (1.90±0.61) mg·L−1、和 (0.34±0.07) mg·L−1,离散系数分别为0.20、0.47、0.32和0.21;池体平均透明度为 (0.41±0.03) m,低于苏州水体均值0.51 m[14];叶绿素a的平均质量浓度为 (19.90±1.20) μg·L−1,高于苏州河道春夏季均值15.36 μg·L−1,这表明该水体属于轻度富营养化程度[15-16]。2022年2—6月:水体的COD、氨氮、总氮和总磷平均值分别为 (27.12±4.88) mg·L−1、 (0.48±0.21) mg·L−1、 (1.10±0.32) mg·L−1和 (0.26±0.05) mg·L−1,较2021年同期分别下降24.12 %、47.25 %、42.11 %和23.53 %,各项指标的离散系数降至0.18、0.44、0.29和0.19;水体透明度平均值升高至 (0.53±0.05) m;叶绿素a平均质量浓度降至 (15.96±0.96) μg·L−1,这表明该水体富营养化程度有所改善。与生物蜡的多种修复功能相比,传统的硅藻土和多孔黏土材料等生物膜载体仅能用于提高水体的生物量,改善部分指标[17-18]。
按照监测次数计算,2021年2—6月,COD、总氮、氨氮和总磷达到《地表水环境质量标准》 (GB3838-2002) Ⅳ 类标准的百分比分别为22.5 %、90.0 %、32.5 %和30.0 %。除受外河水质影响外,九曲桥周边分布有大量落叶乔木和灌木,落叶等凋落物是造成水体氮磷超标的重要源头之一[19]。2022年2—6月,水体COD、总氮、氨氮和总磷的Ⅳ类水达标率分别较2021年同期提高了3.0倍、1.1倍、2.1倍和2.3倍,九曲桥春夏季的水质得到明显改善 (图4) 。
2.2 功能菌群在不同介质中的分布
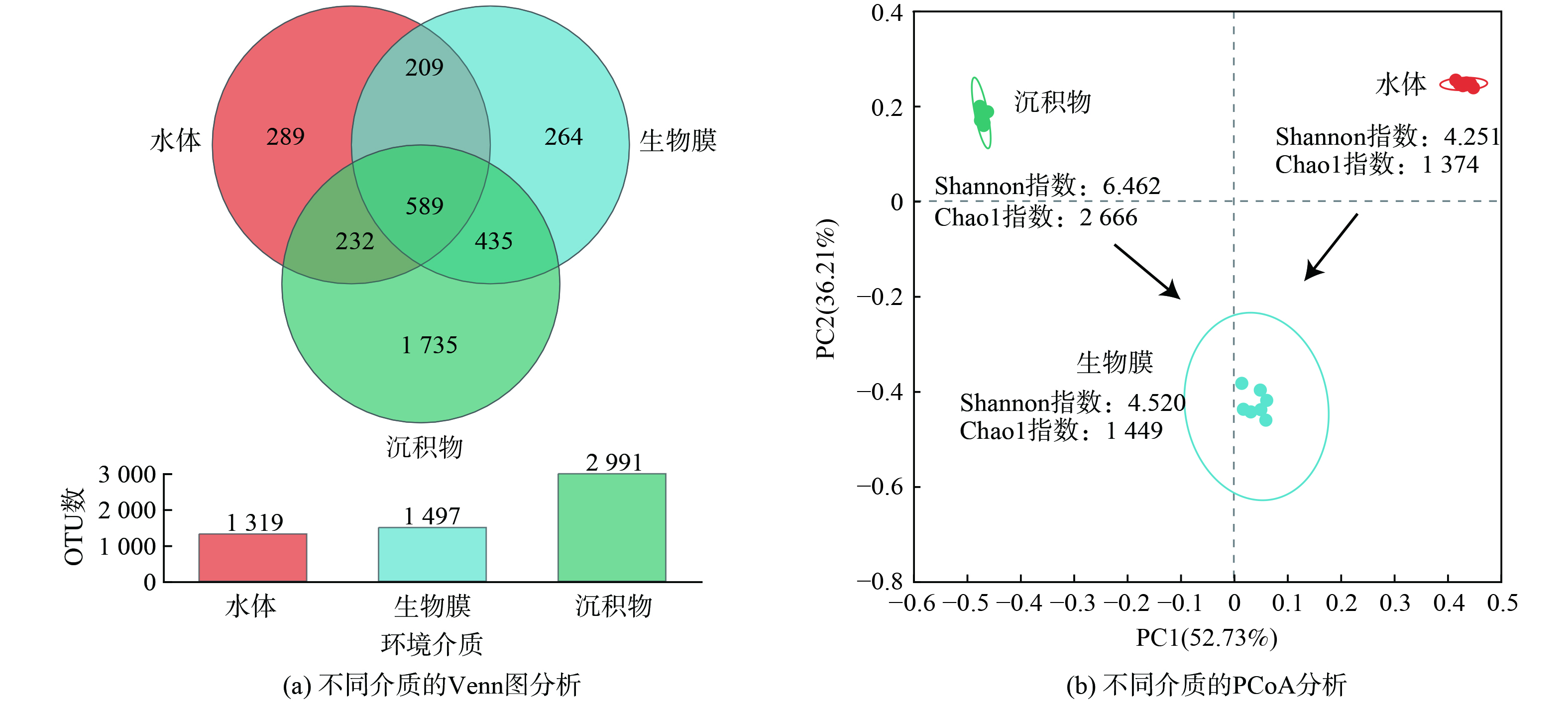
图5 (a) 表明,生物蜡表面生物膜的微生物丰度 (Chao1指数) 和多样性指数 (Shannon指数) 与水体接近,均明显低于沉积物的水平。这可能是由于在水流扰动作用下,沉积物-水体界面更容易形成基质梯度 (如溶解氧) ,进而形成显著的生态位分化,有利于不同功能菌群的协同生长[20-21]。
基于Bray-Curtis距离法的PCoA分析结果表明 (图5 (b) ) ,生物膜在PC1维度 (解释度52.73%) 上介于水体和沉积物之间,在PC2维度 (解释度36.21%) 上与水体和沉积物均存在很大差异。生物膜和水体、生物膜和沉积物共有的OTU数量分别为798个和1 024个,分别占生物膜OTU总数的53.3%和68.4%。相比之下,生物膜中特有的OTU数量为264个,仅占到总数的17.6%。这说明生物膜主要由水体的土著微生物构成,悬浮的生物蜡模块不仅提高了水体中的微生物总量,还改变了微生物的空间分布形态,为降解水中污染物创造了有利条件。
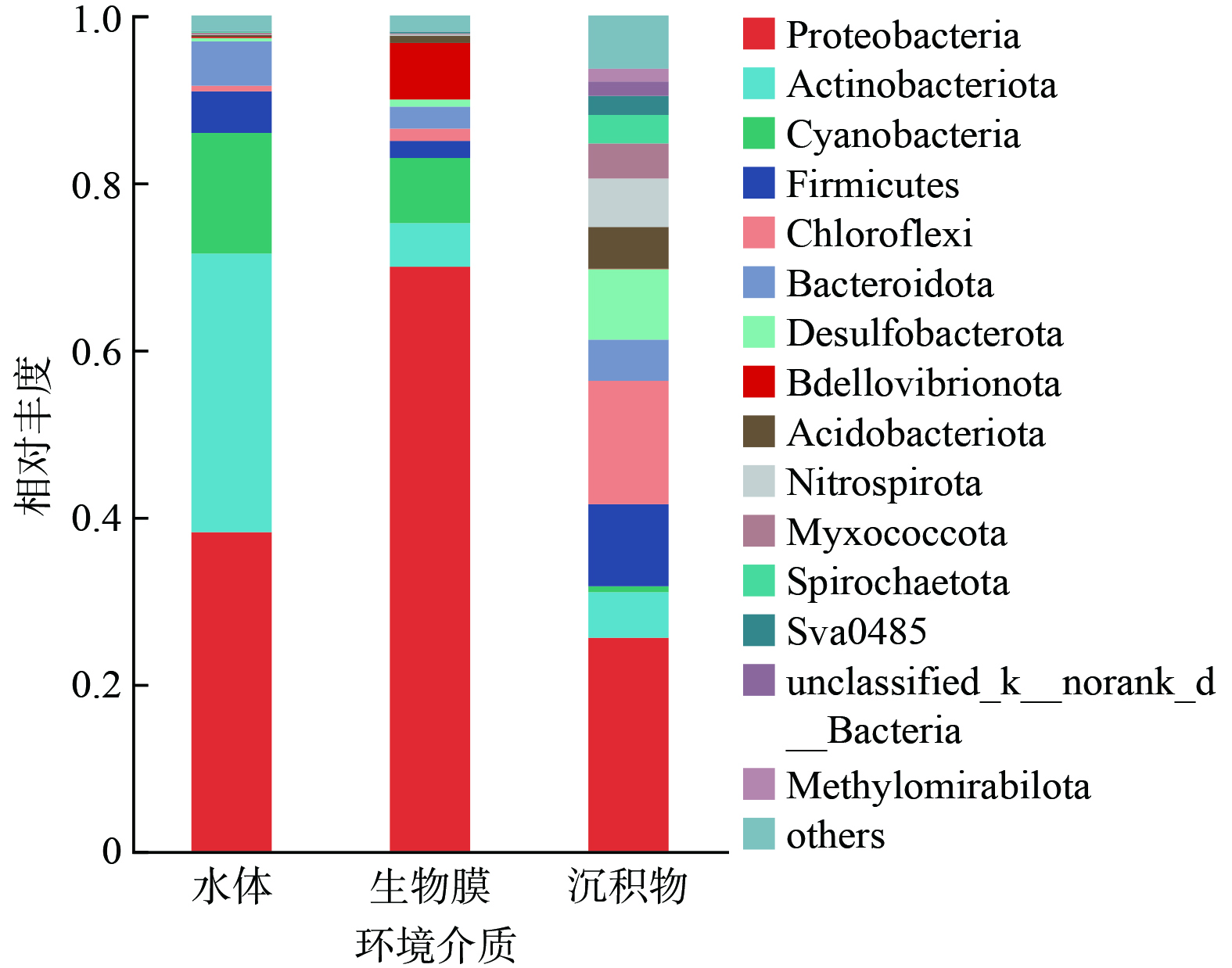
如图6所示,水体样品中的优势菌门分别为变形菌门 (Proteobacteria,相对丰度38.42 %) 、放线菌门 (Actinobacteriota,33.30 %) 、蓝藻门 (Cyanobacteria,14.44%) 、拟杆菌门 (Bacteroidota,5.32 %) 和厚壁菌门 (Firmicutes,4.97 %) 。变形菌门、拟杆菌门、放线菌门和蓝藻门在水体中的富集与其轻度富营养化状况是一致的[22-23]。在沉积物中,丰度前5的菌门包括变形菌门 (Proteobacteria,25.65 %),绿弯菌门 (Chloroflexi,14.78 %)、厚壁菌门 (Firmicutes,9.47 %) 、脱硫菌门 (Desulfobacterota,8.43 %) 和硝化螺旋杆菌门 (Nitrospirota,5.80 %) 。其中,绿弯菌门和厚壁菌门的富集与沉积物中典型的缺氧环境密切相关[24]。相比之下,生物膜中变形菌门的相对丰度最高,达到69.36 %,随后为蓝藻门 (Cyanobacteria,7.79%)、蛭弧菌门 (Bdellovibrionota,6.67%)、放线菌门 (Actinobacteriota,5.22 %) 和拟杆菌门 (Bacteroidota,2.64 %) 。通常认为,变形菌门具有较强的有机物和营养盐代谢潜力,同时,其能够分泌大量胞外聚合物 (EPS) ,为生物膜的形成提供了重要的结构性物质[25-26]。此外,蛭弧菌门在生物膜中的相对丰度分别为水和沉积物中的43.47 倍和159.38 倍。作为典型的掠食性细菌,蛭弧菌门的生长说明生物膜中形成了更长的食物链和更强的淘汰压,有利于形成特定功能化的菌群结构[27]。
如图7所示,通过在属水平上比较不同介质的细菌群落组合,可获得更详细的生态位信息。LEfSe (LDA Effect Size) 分析 (LDA>4) 表明水体中有Acinetobacter (变形菌门,3.63 %) 、 Aurantimicrobium (放线菌门,2.73 %) 、CL500-29_marine_group (放线菌门,3.40 %) 等12个属与其他介质存在显著差异,其中,Acinetobacter、Limnohabitans、CL500-29_marine_group和Polymucleobacter分别在硝化[28]、硝酸盐还原[29]、反硝化[30]和溶解性有机物降解[31]等碳氮循环的过程中发挥作用。具有溶磷能力的Exiguobacterium含量相对较少,这可能是水体磷元素去除率低的原因。沉积物中有norank_f_norank_o__SBR1031 (绿弯菌门,3.00 %) 、Sva0485 (Sva0485门,2.27 %) 、Anaeromyxobacter (黏球菌门,3.18 %) 等5个属与其他介质存在显著差异,其中norank_f_norank_o__SBR1031可利用多种有机物进行发酵生长,在清除微量有机物方面有积极作用[32]。生物膜中有Aquabacterium (变形菌门,16.25 %) 、Hydrogenophaga (变形菌门,7.23 %) 、Caulobacter (变形菌门,3.14 %) 等7个属与其他介质存在显著差异。同时生物蜡表面的生物膜上存在厌氧或厌氧兼性的反硝化细菌[33] (如Hydrogenophaga和Caulobacter) 和异养硝化-好氧反硝化细菌[34] (如Novosphingobium和Sulfuritalea) ,这些细菌为水体氨氮的高去除率和高达标率提供了前提条件。水环境中活性有机物降解菌和反硝化菌的明显增加,可有效减少耗氧污染物,提高水体的承载能力,有利于水质的改善。与玉米芯等生物质碳源作为固定化生物膜载体类似,投加生物蜡选择性地促进了具有固氮和反硝化能力的氮循环微生物的生长[35]。
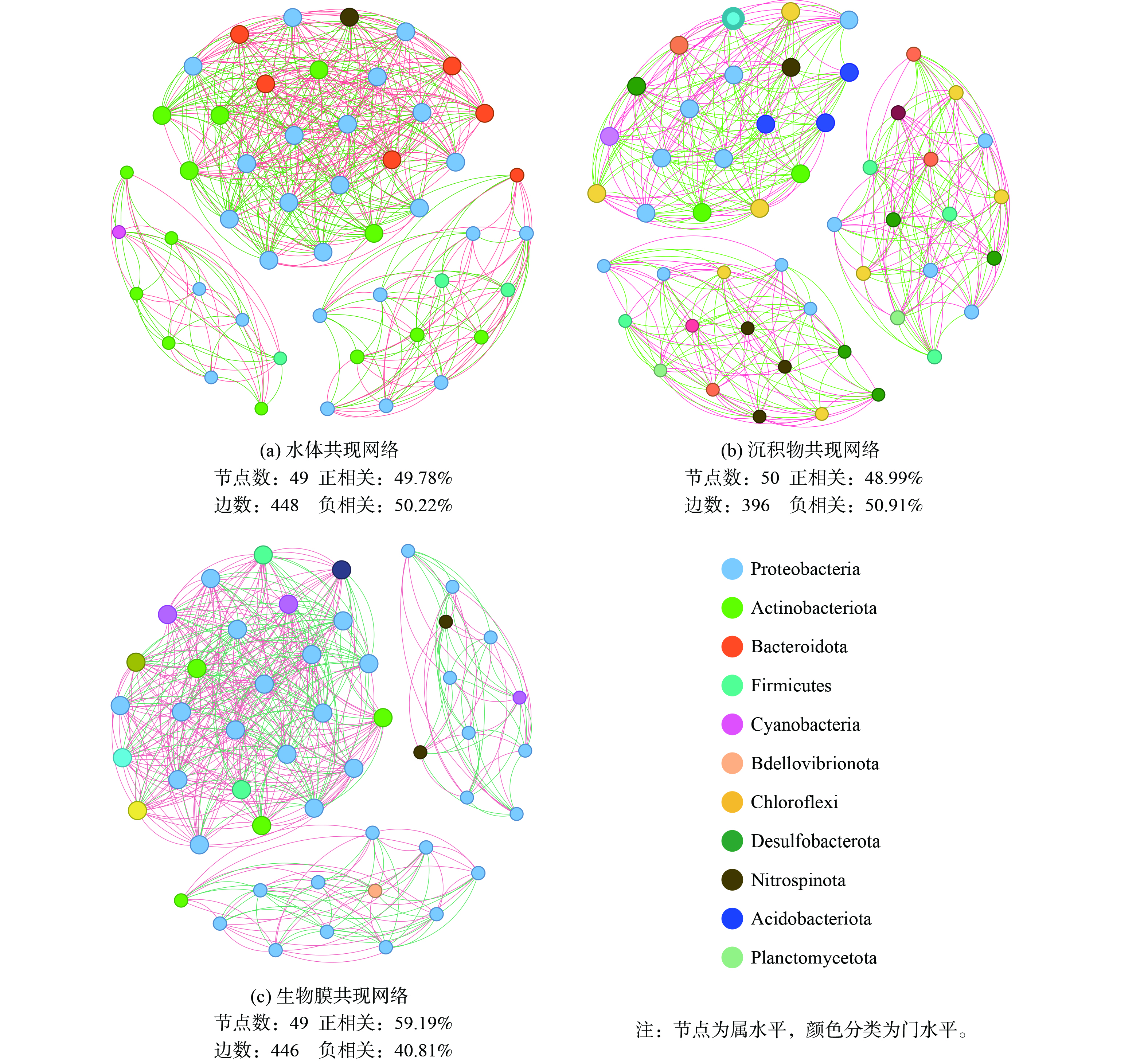
2.3 不同介质中的菌群间功能预测
如图8所示,尽管沉积物中的微生物多样性远高于水和生物膜,但生物膜上形成了更为复杂的微生物关联关系。水体、沉积物和生物膜中丰度前50的菌属之间边数分别为448条边、396条边和446条边。从共现网络发现,水体和生物蜡表面微生物的相互作用主要以变形菌门、放线菌门和拟杆菌门为主,而沉积物中相互作用的微生物具有很高的均质性,以变形菌门、绿弯菌门和脱硫菌门为主。生物膜网络中的正相关性最高,而天然环境中的网络正负相似。这表明在生物膜上微生物之间发生了更紧密的共生关系,互利的共生关系可能涉及代谢物的交换、基因和电子的转移以及信号分子的传输[36], 生物蜡持续释放微生物生长基质有利于在生物膜中形成复杂的关联网络。目前,生物蜡对不同种土著微生物的选择性富集机理尚不清楚,有待后续探究。
共现网络的关键物种对潜在的微生物功能很重要,是细菌群落结构和生态系统稳定性的驱动力,与不同介质的代谢循环密切相关[37]。作为水体的关键物种,拟杆菌门的pseudarcicella利用藻类分解物中的多种物质 (碳水化合物,氨基酸,丙酮酸) 作为其碳源,且更适宜在贫营养低浊度环境下生存[38],hgc I_clade、Flavobacterium等具有溶藻能力的细菌[39],能与pseudarcicella形成“微循环”,增强水体的藻类分解和有机物去除能力。沉积物中脱硫菌门的Syntrophus 可能与硫酸盐还原有关,能在厌氧条件下以硫化物、元素硫、硫代硫酸盐和氢为电子供体,以硝酸盐为电子受体进行硫代谢[40]。生物膜上的关键物种是来自变形菌门的Limnohabitans,其在水体中含量更高,但在生物膜上与其他微生物具有更强的联系, Limnohabitans自身参与氮素营养盐还原[41],可为好氧反硝化细菌如Hydrogenophaga、Aquabacterium和Rhodobacter等提供电子受体[42],进一步稳定生物膜的菌间关系,强化水环境的氮循环能力。
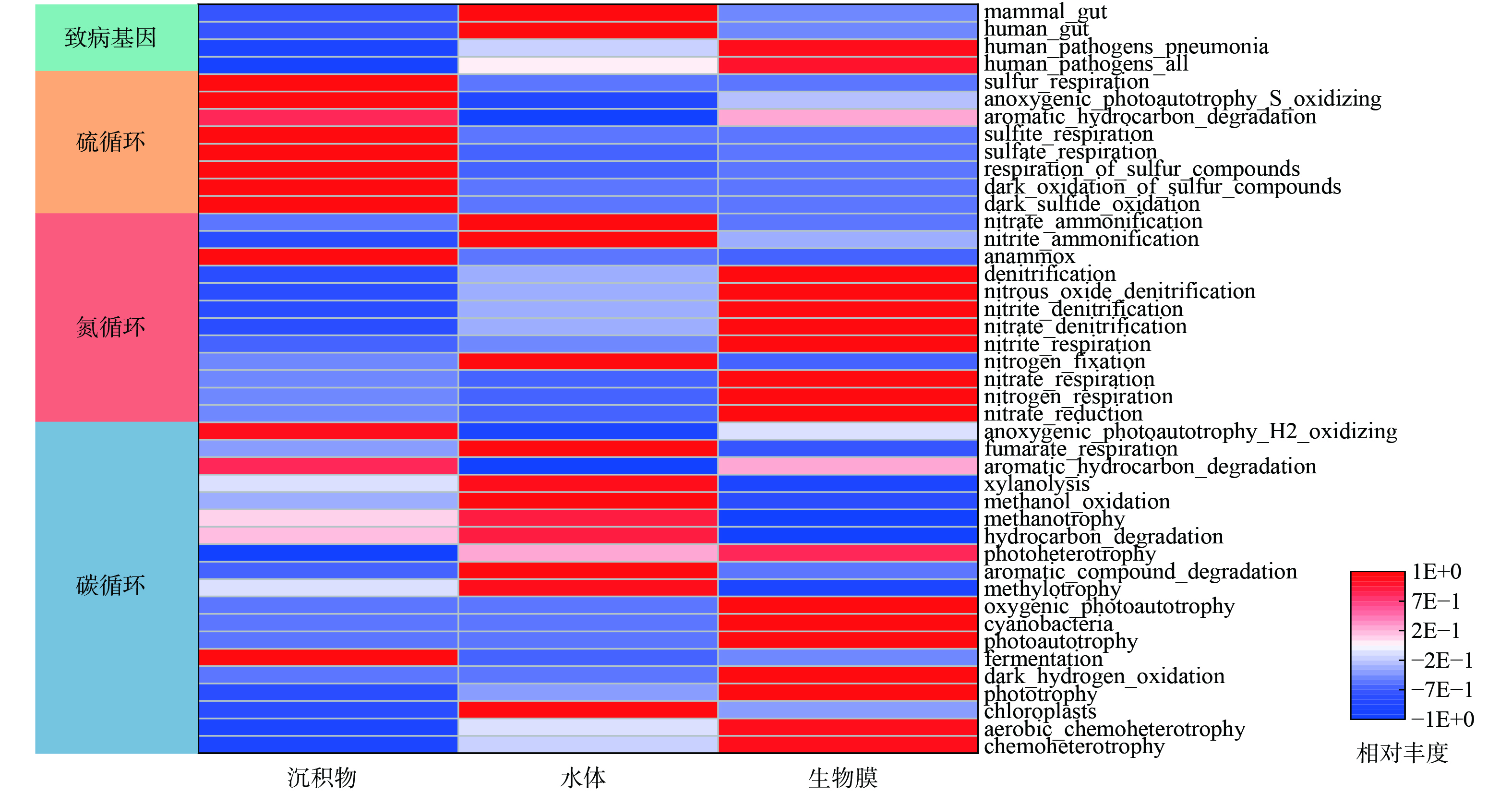
图9所示的Faprotax预测常用于描述菌群的代谢功能和生态位信息。水体中碳氮代谢的功能基因丰度较高,包括methanotrophy、methylotrophy、methanol_oxidation、nitrate_ammonification、nitrite_ammonification和nitrogen_fixation等,同时,也存在一定的致病风险 (如human_gut、manmal_gut) 。在沉积物中,sulfur_respiration、sulfite_respiration等硫循环功能基因占据主导。相比之下,生物膜中chemoheterotrophy、photoautotrophy和phototrophy等碳循环和nitrate_reduction、nitrogen_respiration、nitrate_respiration等氮循环功能基因丰度明显提高。尽管部分致病基因也得到了富集,但生物膜中未检出chloroplasts等藻类代谢基因,具有较高的功能化特征。
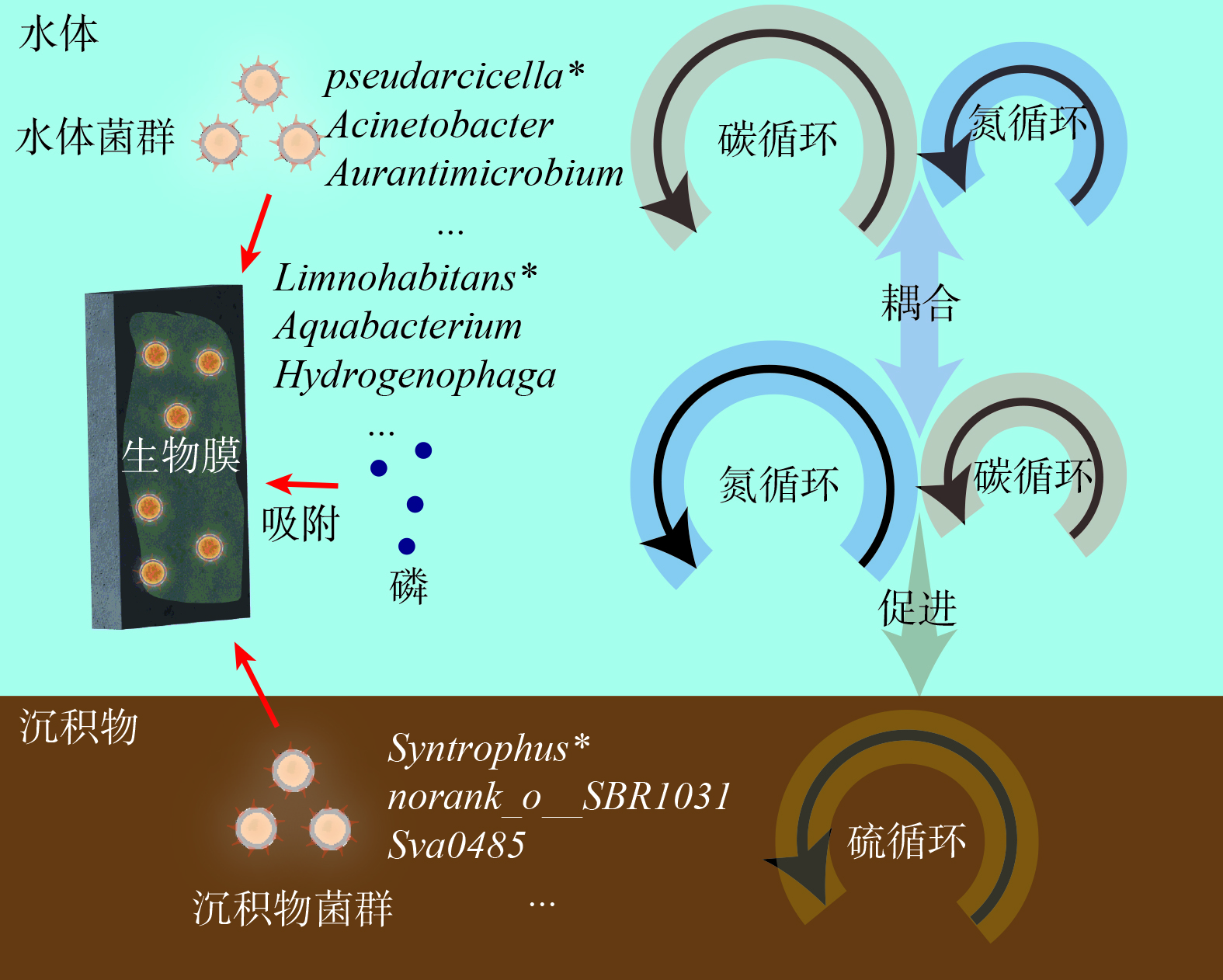
生物蜡技术的微生物反应机制如图10所示。生物蜡能富集水体和沉积物的土著菌种,与上述关键物种功能研究一致,各个介质的关键物种介导了各个介质的核心功能,且水体中主要存在的厌氧消化相关碳循环功能和生物膜上的硝态氮还原相关氮循环功能可进行耦合,进行碳和氮的同时去除[43]。沉积物中硫循环基因的主要代谢过程是将水环境中的硫元素转化为H2S,此过程更容易在厌氧或缺氧环境下进行[44],生物膜的关键物种 Limnohabitans可能会为此过程提供电子受体以促进沉积物硫代谢。功能预测结果表明,生物膜缺少典型的磷循环功能基因,考虑到修复后池体透明度得到改善,推测磷的去除途径主要是生物膜的吸附和含磷颗粒物的沉降,具体磷的去除路径需要在后续研究中进一步阐述。建议种植苦草等水生植物来协同磷元素的去除[45]。研究表明,在园林水体中不同环境介质上微生物功能存在显著的差异性,但水动力、季节更替等自然条件对生物膜功能的影响尚不明确,还需要后续进行研究。
3. 结论
投放生物蜡使水体的COD、氨氮、总氮和总磷分别降低了24.12 %、42.11 %、47.25 %和23.53 %,而且可长期保持在较低水平。同时发现:1) 生物蜡表面生物膜中82.4%的OTU都来源于水体和沉积物,以变形菌门为主,占69.36%,其中以Aquabacterium (变形菌门) 和Hydrogenophaga (变形菌门) 为主要的属。相关性分析筛选出水体的pseudarcicella属 (拟杆菌门) 、生物膜的Limnohabitans属 (变形菌门) 、沉积物的Syntrophus属 (脱硫菌门) 是各个介质的关键物种;2) 生物膜上的光能自养、化能异养和亚硝酸盐去除等核心功能呼吸加强了水环境中有机物的降解和氮化合物间的转化,实现了水体的碳氮耦合,能够增强沉积物的硫代谢能力,提高水环境的污染物降解能力。
生物蜡在促进微生物生长的同时可有效截留生物量,显著提高水体透明度和抑制藻类生长。与颗粒物对磷酸盐的吸附作用类似,生物吸附可能是导致水体总磷浓度降低的重要原因。在后续治理中,建议在池底分区种植能与生物蜡协同的苦草、狐尾藻和轮叶黑藻等水生植物,进一步提高水体除磷效能,同时,采取打捞池中落叶和池底淤泥等管理措施,有效削减内外源强,实现水质长效保持目标。
-
表 1 非靶标分析典型案例
Table 1. Typical cases of nontarget analysis
样品类型Sample type 污染物类别Group of substances 样品前处理Sample preparation 仪器设备Instrumental technique(s) MS2扫描模式MS2 acquisition mode 参考文献Reference 环境液体样品 海水 多环芳烃等 DLLME GC-EI-MS — [10] 河水 有机污染物 SPE LC-QTOF-MS/MS DIA [11] 地表水 有机污染物 SPME GC-TOF-MS — [12] 有机污染物及转化产物 直接进样 LC-ESI-QTOF-MS/MS DDA [13] 极性污染物 SPE LC-ESI-QTOF-MS/MS — [14] 地下水 有机污染物 SPME GC-TOF-MS — [12] 真空辅助蒸发浓缩 LC-Orbitrap-MS/MS DDA [15] 极性污染物 SPE LC-ESI-QTOF-MS/MS — [14] 农药及其转化产物 真空辅助蒸发浓缩 LC-ESI-Q-Exactive Plus-MS/MS DDA [16] 废水 有机污染物 SPME GC-TOF-MS — [12] 极性污染物 SPE LC-ESI-QTOF-MS/MS — [14] DDA [17] 药物 SPE LC-Q-Exactive-MS/MS DDA [18] 药物及转化产物 SPE LC-ESI-QTOF-MS/MS DDA [19] PFASs SPE LC-ESI-QTOF-MS/MS DDA [20] 在线SPE LC-ESI-LTQ-Orbitrap-MS/MS ISF [21] I-PFAAs LLE LC-ESI-Q-Orbitrap-MS/MS DDA [22] 溴代阻燃剂转化产物 LLE LC-ESI-QTOF-MS/MS — [23] 臭氧化产物 SPE LC-ESI-Q-Exactive Plus-MS/MS DDA [24] 过滤后直接进样、LLE LC-QTOF-MSSFC-HRMS — [25] 自来水 DBPs SPE LC-ESI-Q-Orbitrap-MS/MS t-MS2 [26] 饮用水 挥发性有机化合物 SPME GC-EI-MS — [27] 极性污染物 SPE LC-ESI-QTOF-MS/MS — [14] 有机污染物及转化产物 直接进样 LC-ESI-QTOF-MS/MS DDA [13] 垃圾渗滤液 PFASs — LC-Q-Exactive-MS/MS DDA、迭代DDA、AIF [28] 环境固体样品 土壤 卤代化合物等 PLE GC-EI-MS/MSLC-ESI-Q-Exactive-MS/MS — [29] PFASs 固-液萃取 LC-LTQ-Orbitrap-MS/MS DIA [30] 沉积物 有机污染物 超声 LC-QTOF-MS/MS DIA [11] PLE GC×GC-EI-QTOF-MS — [31] LC-ESI-Q-Exactive-MS/MS DIA [32] LC-ESI/APPI-LTQ-Orbitrap-MS/MS — [33] 极性污染物 索氏提取 LC-QTOF-MS/MS — [34] 卤代化合物等 PLE GC-EI-MS/MSLC-ESI-Q-Exactive-MS/MS — [29] 有机溴化物 PLE LC-APCI-Q-Exactive-MS/MS DIA [35] 溴代阻燃剂转化产物 索氏提取 LC-ESI-QTOF-MS/MS — [23] 大气颗粒物 多环芳烃 PLE APPI-FT-ICR-MSGC×GC-TOF-MS — [36] 室内粉尘 有机污染物 超声 GC-EI-QTOF-MSLC-QTOF-MS/MS AIF [37] 氯代磷酸三酯 超声 LC-ESI-Q-Exactive-MS/MS DDA、DIA [38] 生物样品 鱼肝脏 PFASs 固-液萃取 LC-ESI-Orbitrap-MS/MS ISF [39] 北极熊血清 PFASs等 搅拌棒吸附萃取 LC-ESI-Orbitrap-MS/MS ISF [40] -
[1] ESCHER B I, STAPLETON H M, SCHYMANSKI E L. Tracking complex mixtures of chemicals in our changing environment [J]. Science, 2020, 367(6476): 388-392. doi: 10.1126/science.aay6636 [2] WANG Z Y, WALKER G W, MUIR D C G, et al. Toward a global understanding of chemical pollution: A first comprehensive analysis of national and regional chemical inventories [J]. Environmental Science & Technology, 2020, 54(5): 2575-2584. [3] UNEP. Global chemicals outlook II: From legacies to innovative solutions[EB/OL]. [2023-02-10]. https://www.unep.org/explore-topics/chemicals-waste/what-we-do/policy-and-governance/global-chemicals-outlook. [4] LANDRIGAN P, FULLER R, ACOSTA N, et al. The Lancet commission on pollution and health [J]. The Lancet, 2018, 391(10119): 462-512. doi: 10.1016/S0140-6736(17)32345-0 [5] WHO. Ambient (outdoor) air pollution[EB/OL]. [2023-02-10]. https://www.who.int/news-room/fact-sheets/detail/ambient-(outdoor)-air-quality-and-health. [6] HERNÁNDEZ F, IBÁÑEZ M, BADE R, et al. Investigation of pharmaceuticals and illicit drugs in waters by liquid chromatography-high-resolution mass spectrometry [J]. TrAC Trends in Analytical Chemistry, 2014, 63: 140-157. doi: 10.1016/j.trac.2014.08.003 [7] ISMANTO A, HADIBARATA T, KRISTANTI R A, et al. Endocrine disrupting chemicals (EDCs) in environmental matrices: Occurrence, fate, health impact, physio-chemical and bioremediation technology [J]. Environmental Pollution, 2022, 302: 119061. doi: 10.1016/j.envpol.2022.119061 [8] PANTELAKI I, VOUTSA D. Organophosphate flame retardants (OPFRs): A review on analytical methods and occurrence in wastewater and aquatic environment [J]. Science of the Total Environment, 2019, 649: 247-263. doi: 10.1016/j.scitotenv.2018.08.286 [9] NG C, COUSINS I T, DEWITT J C, et al. Addressing urgent questions for PFAS in the 21st century [J]. Environmental Science & Technology, 2021, 55(19): 12755-12765. [10] PEÑALVER R, ORTIZ A, ARROYO-MANZANARES N, et al. Non-targeted analysis by DLLME-GC-MS for the monitoring of pollutants in the Mar Menor lagoon [J]. Chemosphere, 2022, 286: 131588. doi: 10.1016/j.chemosphere.2021.131588 [11] CCANCCAPA-CARTAGENA A, PICO Y, ORTIZ X, et al. Suspect, non-target and target screening of emerging pollutants using data independent acquisition: Assessment of a Mediterranean river basin [J]. The Science of the Total Environment, 2019, 687: 355-368. doi: 10.1016/j.scitotenv.2019.06.057 [12] HERNANDEZ F, PORTOLÉS T, PITARCH E, et al. Target and nontarget screening of organic micropollutants in water by solid-phase microextraction combined with gas chromatography/high-resolution time-of-flight mass spectrometry [J]. Analytical Chemistry, 2007, 79(24): 9494-9504. doi: 10.1021/ac071551b [13] OBERLEITNER D, SCHMID R, SCHULZ W, et al. Feature-based molecular networking for identification of organic micropollutants including metabolites by non-target analysis applied to riverbank filtration [J]. Analytical and Bioanalytical Chemistry, 2021, 413(21): 5291-5300. doi: 10.1007/s00216-021-03500-7 [14] MONTES R, AGUIRRE J, VIDAL X, et al. Screening for polar chemicals in water by trifunctional mixed-mode liquid chromatography-high resolution mass spectrometry [J]. Environmental Science & Technology, 2017, 51(11): 6250-6259. [15] KIEFER K, DU L T, SINGER H, et al. Identification of LC-HRMS nontarget signals in groundwater after source related prioritization [J]. Water Research, 2021, 196: 116994. doi: 10.1016/j.watres.2021.116994 [16] KIEFER K, MÜLLER A, SINGER H, et al. New relevant pesticide transformation products in groundwater detected using target and suspect screening for agricultural and urban micropollutants with LC-HRMS [J]. Water Research, 2019, 165: 114972. doi: 10.1016/j.watres.2019.114972 [17] GAGO-FERRERO P, SCHYMANSKI E L, BLETSOU A A, et al. Extended suspect and non-target strategies to characterize emerging polar organic contaminants in raw wastewater with LC-HRMS/MS [J]. Environmental Science & Technology, 2015, 49(20): 12333-12341. [18] SINGER H P, WÖSSNER A E, MCARDELL C S, et al. Rapid screening for exposure to “non-target” pharmaceuticals from wastewater effluents by combining HRMS-based suspect screening and exposure modeling [J]. Environmental Science & Technology, 2016, 50(13): 6698-6707. [19] PSOMA A K, ROUSIS N I, GEORGANTZI E N, et al. An integrated approach to MS-based identification and risk assessment of pharmaceutical biotransformation in wastewater [J]. Science of the Total Environment, 2021, 770: 144677. doi: 10.1016/j.scitotenv.2020.144677 [20] WANG Y, YU N Y, ZHU X B, et al. Suspect and nontarget screening of per- and polyfluoroalkyl substances in wastewater from a fluorochemical manufacturing park [J]. Environmental Science & Technology, 2018, 52(19): 11007-11016. [21] LIU Y N, PEREIRA A D S, MARTIN J W. Discovery of C5 – C17 poly- and perfluoroalkyl substances in water by in-line SPE-HPLC-Orbitrap with in-source fragmentation flagging [J]. Analytical Chemistry, 2015, 87(8): 4260-4268. doi: 10.1021/acs.analchem.5b00039 [22] TANG C M, ZHU Y Z, LIANG Y T, et al. First discovery of iodinated polyfluoroalkyl acids by nontarget mass-spectrometric analysis and iodine-specific screening algorithm [J]. Environmental Science & Technology, 2023, 57: 1378-1390. [23] MATSUKAMI H, HASHIMOTO S, SUZUKI G. Investigation of novel brominated triazine-based flame retardant (TDBP-TAZTO) and its transformation products emitted from fire-retarded textile manufacturing facility and its downstream sewage treatment plant [J]. Science of the Total Environment, 2021, 791: 148233. doi: 10.1016/j.scitotenv.2021.148233 [24] SCHOLLÉE J E, BOURGIN M, GUNTEN U V, et al. Non-target screening to trace ozonation transformation products in a wastewater treatment train including different post-treatments [J]. Water Research, 2018, 142: 267-278. doi: 10.1016/j.watres.2018.05.045 [25] SEIWERT B, NIHEMAITI M, BAUER C, et al. Ozonation products from trace organic chemicals in municipal wastewater and from metformin: Peering through the keyhole with supercritical fluid chromatography-mass spectrometry [J]. Water Research, 2021, 196: 117024. doi: 10.1016/j.watres.2021.117024 [26] TAO D Y, WANG R, SHI S, et al. The identification of halogenated disinfection by-products in tap water using liquid chromatography-high resolution mass spectrometry [J]. Science of the Total Environment, 2020, 740: 139888. doi: 10.1016/j.scitotenv.2020.139888 [27] YU M Y, YANG X Q, FAN R, et al. Non-target screening analysis of volatile organic compounds in drinking water by headspace-solid phase microextraction gas chromatography-mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2020, 48(9): 1228-1235. doi: 10.1016/S1872-2040(20)60044-5 [28] KOELMEL J P, PAIGE M K, ARISTIZABAL-HENAO J J, et al. Toward comprehensive per- and polyfluoroalkyl substances annotation using FluoroMatch software and intelligent high-resolution tandem mass spectrometry acquisition [J]. Analytical Chemistry, 2020, 92(16): 11186-11194. doi: 10.1021/acs.analchem.0c01591 [29] CHIAIA-HERNÁNDEZ A C, SCHERINGER M, MÜLLER A, et al. Target and suspect screening analysis reveals persistent emerging organic contaminants in soils and sediments [J]. Science of the Total Environment, 2020, 740: 140181. doi: 10.1016/j.scitotenv.2020.140181 [30] SÖRENGÅRD M, AHRENS L, ALYGIZAKIS N, et al. Non-target and suspect screening strategies for electrodialytic soil remediation evaluation: Assessing changes in the molecular fingerprints and per- and polyfluoroalkyl substances (PFASs) [J]. Journal of Environmental Chemical Engineering, 2020, 8(6): 104437. doi: 10.1016/j.jece.2020.104437 [31] VEENAAS C, BIGNERT A, LILJELIND P, et al. Nontarget screening and time-trend analysis of sewage sludge contaminants via two-dimensional gas chromatography-high resolution mass spectrometry [J]. Environmental Science & Technology, 2018, 52(14): 7813-7822. [32] CHIAIA-HERNÁNDEZ A C, GÜNTHARDT B F, FREY M P, et al. Unravelling contaminants in the anthropocene using statistical analysis of liquid chromatography-high-resolution mass spectrometry nontarget screening data recorded in lake sediments [J]. Environmental Science & Technology, 2017, 51(21): 12547-12556. [33] CHIAIA-HERNANDEZ A C, KRAUSS M, HOLLENDER J. Screening of lake sediments for emerging contaminants by liquid chromatography atmospheric pressure photoionization and electrospray ionization coupled to high resolution mass spectrometry [J]. Environmental Science & Technology, 2013, 47(2): 976-986. [34] TERZIC S, AHEL M. Nontarget analysis of polar contaminants in freshwater sediments influenced by pharmaceutical industry using ultra-high-pressure liquid chromatography-quadrupole time-of-flight mass spectrometry [J]. Environmental Pollution, 2011, 159(2): 557-566. doi: 10.1016/j.envpol.2010.10.009 [35] PENG H, CHEN C L, CANTIN J, et al. Untargeted screening and distribution of organo-bromine compounds in sediments of Lake Michigan [J]. Environmental Science & Technology, 2016, 50(1): 321-330. [36] XU C, GAO L R, ZHENG M H, et al. Nontarget screening of polycyclic aromatic compounds in atmospheric particulate matter using ultrahigh resolution mass spectrometry and comprehensive two-dimensional gas chromatography [J]. Environmental Science & Technology, 2021, 55(1): 109-119. [37] MOSCHET C, ANUMOL T, LEW B M, et al. Household dust as a repository of chemical accumulation: New insights from a comprehensive high-resolution mass spectrometric study [J]. Environmental Science & Technology, 2018, 52(5): 2878-2887. [38] WANG L, KANG Q Y, JIA Y T, et al. Identification of three novel chloroalkyl organophosphate triesters in house dust using halogenation-guided nontarget screening combined with suspect screening [J]. Environmental Science & Technology, 2021, 55(4): 2482-2490. [39] LIU Y N, QIAN M L, MA X X, et al. Nontarget mass spectrometry reveals new perfluoroalkyl substances in fish from the Yangtze River and Tangxun Lake, China [J]. Environmental Science & Technology, 2018, 52(10): 5830-5840. [40] LIU Y N, RICHARDSON E S, DEROCHER A E, et al. Hundreds of unrecognized halogenated contaminants discovered in polar bear serum [J]. Angewandte Chemie International Edition, 2018, 57(50): 16401-16406. doi: 10.1002/anie.201809906 [41] BERIJANI S, ASSADI Y, ANBIA M, et al. Dispersive liquid-liquid microextraction combined with gas chromatography-flame photometric detection. Very simple, rapid and sensitive method for the determination of organophosphorus pesticides in water [J]. Journal of Chromatography. A, 2006, 1123(1): 1-9. doi: 10.1016/j.chroma.2006.05.010 [42] FATTAHI N, ASSADI Y, HOSSEINI M R M, et al. Determination of chlorophenols in water samples using simultaneous dispersive liquid-liquid microextraction and derivatization followed by gas chromatography-electron-capture detection [J]. Journal of Chromatography A, 2007, 1157(1/2): 23-29. [43] REZAEE M, YAMINI Y, SHARIATI S, et al. Dispersive liquid-liquid microextraction combined with high-performance liquid chromatography-UV detection as a very simple, rapid and sensitive method for the determination of bisphenol A in water samples [J]. Journal of Chromatography A, 2009, 1216(9): 1511-1514. doi: 10.1016/j.chroma.2008.12.091 [44] JONKERS T J H, MEIJER J, VLAANDEREN J J, et al. High-performance data processing workflow incorporating effect-directed analysis for feature prioritization in suspect and nontarget screening [J]. Environmental Science & Technology, 2022, 56(3): 1639-1651. [45] DANIELS K D, PARK M, HUANG Z Z, et al. A review of extraction methods for the analysis of pharmaceuticals in environmental waters [J]. Critical Reviews in Environmental Science and Technology, 2020, 50(21): 2271-2299. doi: 10.1080/10643389.2019.1705723 [46] ZAJA R, TERZIĆ S, SENTA I, et al. Identification of P-glycoprotein inhibitors in contaminated freshwater sediments [J]. Environmental Science & Technology, 2013, 47(9): 4813-4821. [47] CORTÉJADE A, KISS A, CREN C, et al. Development of an analytical method for the targeted screening and multi-residue quantification of environmental contaminants in urine by liquid chromatography coupled to high resolution mass spectrometry for evaluation of human exposures [J]. Talanta, 2016, 146: 694-706. doi: 10.1016/j.talanta.2015.06.038 [48] DÜRIG W, KINTZI A, GOLOVKO O, et al. New extraction method prior to screening of organic micropollutants in various biota matrices using liquid chromatography coupled to high-resolution time-of-flight mass spectrometry [J]. Talanta, 2020, 219: 121294. doi: 10.1016/j.talanta.2020.121294 [49] MUSATADI M, GONZÁLEZ-GAYA B, IRAZOLA M, et al. Focused ultrasound-based extraction for target analysis and suspect screening of organic xenobiotics in fish muscle [J]. Science of the Total Environment, 2020, 740: 139894. doi: 10.1016/j.scitotenv.2020.139894 [50] YANG D W, HAN J J, HALL D R, et al. Nontarget screening of per- and polyfluoroalkyl substances binding to human liver fatty acid binding protein [J]. Environmental Science & Technology, 2020, 54(9): 5676-5686. [51] ULRICH E M, SOBUS J R, GRULKE C M, et al. EPA’s non-targeted analysis collaborative trial (ENTACT): Genesis, design, and initial findings [J]. Analytical and Bioanalytical Chemistry, 2019, 411(4): 853-866. doi: 10.1007/s00216-018-1435-6 [52] AALIZADEH R, NIKOLOPOULOU V, ALYGIZAKIS N A, et al. First novel workflow for semiquantification of emerging contaminants in environmental samples analyzed by gas chromatography-atmospheric pressure chemical ionization-quadrupole time of flight-mass spectrometry [J]. Analytical Chemistry, 2022, 94(27): 9766-9774. doi: 10.1021/acs.analchem.2c01432 [53] SINGH R R, CHAO A, PHILLIPS K A, et al. Expanded coverage of non-targeted LC-HRMS using atmospheric pressure chemical ionization: A case study with ENTACT mixtures [J]. Analytical and Bioanalytical Chemistry, 2020, 412(20): 4931-4939. doi: 10.1007/s00216-020-02716-3 [54] PAPAZIAN S, D’AGOSTINO L A, SADIKTSIS I, et al. Nontarget mass spectrometry and in silico molecular characterization of air pollution from the Indian subcontinent [J]. Communications Earth & Environment, 2022, 3(1): 1-14. [55] HUANG Y, MOLDEN R, HU M Q, et al. Toward unbiased identification and comparative quantification of host cell protein impurities by automated iterative LC-MS/MS (HCP-AIMS) for therapeutic protein development [J]. Journal of Pharmaceutical and Biomedical Analysis, 2021, 200: 114069. doi: 10.1016/j.jpba.2021.114069 [56] BONNEFILLE B, ARPIN-PONT L, GOMEZ E, et al. Metabolic profiling identification of metabolites formed in Mediterranean mussels (Mytilus galloprovincialis) after diclofenac exposure [J]. Science of the Total Environment, 2017, 583: 257-268. doi: 10.1016/j.scitotenv.2017.01.063 [57] LARA-MARTÍN P A, CHIAIA-HERNÁNDEZ A C, BIEL-MAESO M, et al. Tracing urban wastewater contaminants into the Atlantic Ocean by nontarget screening [J]. Environmental Science & Technology, 2020, 54(7): 3996-4005. [58] HOHRENK L L, VOSOUGH M, SCHMIDT T C. Implementation of chemometric tools to improve data mining and prioritization in LC-HRMS for nontarget screening of organic micropollutants in complex water matrixes [J]. Analytical Chemistry, 2019, 91(14): 9213-9220. doi: 10.1021/acs.analchem.9b01984 [59] CARPENTER C M G, WONG L Y J, JOHNSON C A, et al. Fall creek monitoring station: Highly resolved temporal sampling to prioritize the identification of nontarget micropollutants in a small stream [J]. Environmental Science & Technology, 2019, 53(1): 77-87. [60] TAHA H M, AALIZADEH R, ALYGIZAKIS N, et al. The NORMAN Suspect List Exchange (NORMAN-SLE): Facilitating European and worldwide collaboration on suspect screening in high resolution mass spectrometry [J]. Environmental Sciences Europe, 2022, 34(1): 104. doi: 10.1186/s12302-022-00680-6 [61] LIN Y F, YANG J, FU Q, et al. Exploring the occurrence and temporal variation of ToxCast chemicals in fine particulate matter using suspect screening strategy [J]. Environmental Science & Technology, 2019, 53(10): 5687-5696. [62] LÉON A, CARIOU R, HUTINET S, et al. HaloSeeker 1.0: A user-friendly software to highlight halogenated chemicals in nontargeted high-resolution mass spectrometry data sets [J]. Analytical Chemistry, 2019, 91(5): 3500-3507. doi: 10.1021/acs.analchem.8b05103 [63] KIND T, FIEHN O. Seven Golden Rules for heuristic filtering of molecular formulas obtained by accurate mass spectrometry [J]. BMC Bioinformatics, 2007, 8(1): 1-20. doi: 10.1186/1471-2105-8-1 [64] WANG S R, PERKINS M, MATTHEWS D A, et al. Coupling suspect and nontarget screening with mass balance modeling to characterize organic micropollutants in the Onondaga Lake-Three Rivers system [J]. Environmental Science & Technology, 2021, 55(22): 15215-15226. [65] MENGER F, BOSTRÖM G, JONSSON O, et al. Identification of pesticide transformation products in surface water using suspect screening combined with national monitoring data [J]. Environmental Science & Technology, 2021, 55(15): 10343-10353. [66] FERRANDO-CLIMENT L, GONZALEZ-OLMOS R, ANFRUNS A, et al. Elimination study of the chemotherapy drug tamoxifen by different advanced oxidation processes: Transformation products and toxicity assessment [J]. Chemosphere, 2017, 168: 284-292. doi: 10.1016/j.chemosphere.2016.10.057 [67] WANG F, LIIGAND J, TIAN S Y, et al. CFM-ID 4.0: More accurate ESI-MS/MS spectral prediction and compound identification [J]. Analytical Chemistry, 2021, 93(34): 11692-11700. doi: 10.1021/acs.analchem.1c01465 [68] ALLEN F, PON A, GREINER R, et al. Computational prediction of electron ionization mass spectra to assist in GC/MS compound identification [J]. Analytical Chemistry, 2016, 88(15): 7689-7697. doi: 10.1021/acs.analchem.6b01622 [69] CELMA A, BIJLSMA L, LÓPEZ F J, et al. Development of a retention time interpolation scale (RTi) for liquid chromatography coupled to mass spectrometry in both positive and negative ionization modes [J]. Journal of Chromatography A, 2018, 1568: 101-107. doi: 10.1016/j.chroma.2018.07.030 [70] HU M, MÜLLER E, SCHYMANSKI E L, et al. Performance of combined fragmentation and retention prediction for the identification of organic micropollutants by LC-HRMS [J]. Analytical and Bioanalytical Chemistry, 2018, 410(7): 1931-1941. doi: 10.1007/s00216-018-0857-5 [71] AALIZADEH R, NIKA M C, THOMAIDIS N S. Development and application of retention time prediction models in the suspect and non-target screening of emerging contaminants [J]. Journal of Hazardous Materials, 2019, 363: 277-285. doi: 10.1016/j.jhazmat.2018.09.047 [72] WATROUS J, ROACH P, ALEXANDROV T, et al. Mass spectral molecular networking of living microbial colonies [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(26): E1743-E1752. [73] NOTHIAS L F, PETRAS D, SCHMID R, et al. Feature-based molecular networking in the GNPS analysis environment [J]. Nature Methods, 2020, 17(9): 905-908. doi: 10.1038/s41592-020-0933-6 [74] SCHYMANSKI E L, JEON J, GULDE R, et al. Identifying small molecules via high resolution mass spectrometry: Communicating confidence [J]. Environmental Science & Technology, 2014, 48(4): 2097-2098. [75] CHARBONNET J A, MCDONOUGH C A, XIAO F, et al. Communicating confidence of per- and polyfluoroalkyl substance identification via high-resolution mass spectrometry [J]. Environmental Science & Technology Letters, 2022, 9(6): 473-481. [76] KOELMEL J P, XIE H Y, PRICE E J, et al. An actionable annotation scoring framework for gas chromatography-high-resolution mass spectrometry [J]. Exposome, 2022, 2(1): osac007. doi: 10.1093/exposome/osac007 [77] 国务院办公厅. 新污染物治理行动方案[EB/OL]. [2023-02-10]. http://www.gov.cn/zhengce/content/2022-05/24/content_5692059.htm. [78] 杨晓溪, 李姿慷, 郭云鹤, 等. 成组毒理学分析仪在污染物识别与毒性测试中的应用 [J]. 分析测试学报, 2022, 41(9): 1279-1285. YANG X X, LI Z K, GUO Y H, et al. Application of integrated toxicology analyzer in pollutants identification and toxicity analysis [J]. Journal of Instrumental Analysis, 2022, 41(9): 1279-1285(in Chinese).
[79] MA Q C, LIU Y N, YANG X X, et al. Effect-directed analysis for revealing aryl hydrocarbon receptor agonists in sediment samples from an electronic waste recycling town in China [J]. Environmental Pollution, 2022, 308: 119659. doi: 10.1016/j.envpol.2022.119659 [80] MA Q C, YANG X X, GUO Y H, et al. Effect-directed analysis of estrogenic chemicals in sediments from an electronic-waste recycling area [J]. Environmental Pollution, 2022, 306: 119369. doi: 10.1016/j.envpol.2022.119369 [81] TIAN Z Y, GOLD A, NAKAMURA J, et al. Nontarget analysis reveals a bacterial metabolite of Pyrene implicated in the genotoxicity of contaminated soil after bioremediation [J]. Environmental Science & Technology, 2017, 51(12): 7091-7100. -





 下载:
下载: