-
以太阳能为基础利用光催化技术在温和反应条件下进行清洁能源转化和环境污染物净化对人类社会可持续发展具有重要意义. 绿色高效光催化剂作为光催化反应的核心始终是科研工作者首先需要解决的问题. 石墨相氮化碳(g-C3N4)作为典型非金属聚合物材料,因其结构稳定、合成简单、具有可见光吸收等优点已逐步成为新一代光催化剂的典型代表[1-3].
空心球结构在半导体光催化反应体系格外引人注意,因其结构稳定,可将其他功能性基团集成在球体内外形成复杂的纳米结构,同时也可以“笼”形方式在球体内部进行一系列反应形成特殊的核壳结构[4-7]. 2012年,Wang等以多孔二氧化硅球为模板制备出氮化碳空心球,具有显著增强的光解水制氢性能[8]. 自此,以牺牲模板法制备氮化碳空心球成为主要方法[9]. 然而,受限于高温热聚合过程中聚合物中空纳米结构容易发生塌陷和扭曲,限制了空心球聚合物半导体的有效结构调控. 溶剂热技术可以通过分子工程实现溶液中分子自组装进行产物结构和形貌的有效调控[10]. 本课题组前期研究结果表明,可以在较低的温度下通过直接溶剂热法制备氮化碳空心球,且通过调控合成参数可实现氮化碳空心球的光催化性能优化[11]. 但低温合成产物聚合度较低,限制了光生电荷在长程范围内的有效传输,因此其光催化性能还有待进一步提升.
分子共聚合改性是优化g-C3N4电子结构和光学性质的有效方法. 含芳环小分子化合物与g-C3N4共聚可构造给体-受体结构,增强特征sp2杂化π电子离域. 例如,将巴比妥酸、2-氨基苄腈等共轭分子嵌入g-C3N4骨架有助于提高产物光催化性能[12]. 与等电子体系的六元芳环相比,五元杂环化合物为富电子体系,共聚g-C3N4不仅影响半导体的电子结构和光学性质,还可以调控其氧化还原电位.
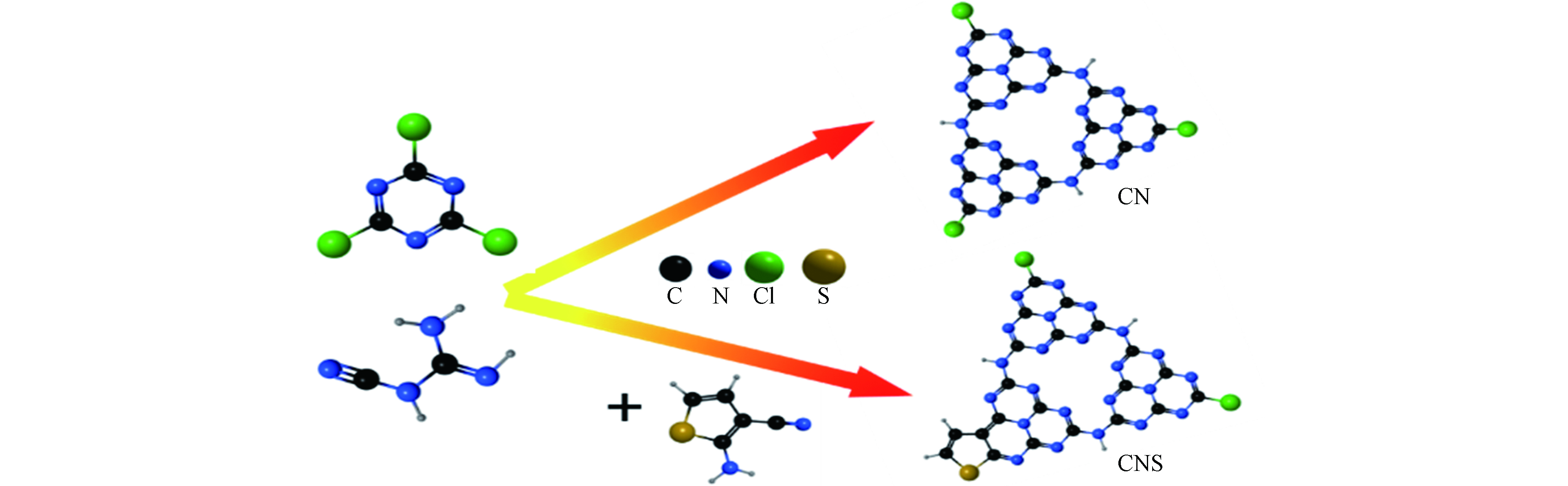
含S噻吩基团为典型的发色基团且具有强大的给电子能力,是优化半导体聚合物光电性能的有效基团,可在半导体内构建分子内电子给体,同时在费米能级上形成半占据杂质能级,降低半导体带隙[13]. 理论研究表明,噻吩基团修饰g-C3N4可引起光诱导电子的有效质量降低,光诱导电子-空穴的迁移率差异增大,从而降低电子-空穴复合率,同时修饰后产物结构畸变,可提高n-π*电子跃迁活性[14]. 截止目前,关于噻吩修饰g-C3N4的工作主要集中于高温热解共聚以及产物在光解水方面的应用,而针对低温合成条件下以含特殊基团分子为共聚体合成特定形貌的g-C3N4及其对光催化性能的影响研究工作还鲜少报道. 鉴于此,本工作以2-氨基噻吩-3甲腈(TPCN)为共聚合单体,一步溶剂热反应成功将噻吩环结构嵌入g-C3N4骨架中,制备出一系列具有宽可见光响应的氮化碳空心球(CNS). 采用多种表征技术对催化剂结构、组成、光电性质等进行分析,通过光催化还原水中Cr6+、光解水制氢以及降解甲基橙考察了催化剂的活性,并推测了相应的光催化反应机理,为低温合成高效g-C3N4基光催化剂提供实验基础.
-
本实验所用实验试剂均为AR级,去离子水为实验室自制. 主要试剂有:三聚氯氰(CC)、二聚氰胺(DCDA)、2-氨基噻吩-3甲腈(TPCN)、乙腈、甲基橙(MO)、重铬酸钾(K2Cr2O7)、三乙醇胺、氯铂酸(H2PtCl6·6H2O)、对苯醌(BQ)、乙二胺四乙酸二钠(EDTA-2Na)、异丙醇(IPA).
-
将CC、DCDA和TPCN按一定物质的量比例分散于60 mL乙腈,常压下混合液中通氮气并连续搅拌30 min.将混合液转移入100 mL水热反应釜中,置于烘箱中180 ℃反应48 h. 自然冷却后将所得固体产物离心分离(转速8000 r·min−1,5 min),用乙腈和去离子水反复洗涤多次,置于烘箱中60 ℃干燥得到最终产物. 反应原料比例及产物命名列于表1,合成示意图见图1.
-
采用X-射线衍射仪(XRD,D/max 2500PC,日本理学株式会社)分析样品聚合结构;采用扫描电子显微镜(SEM,SU-8010,日本日立公司)观察样品形貌;采用固体核磁(NMR,Agilent 600M,瑞士布鲁克公司)测定13C核磁谱图;采用紫外-可见分光光度计(UV-2550,日本岛津公司)表征样品的光吸收性质,BaSO4为标准物质;通过X射线光电子能谱仪(XPS,ESCALAB 250,美国赛默飞世尔科技公司)测定材料表面电子性质;采用荧光光谱仪(PL,QuantaMasterTM40,美国PTI公司)考察催化剂的荧光发光性能;利用电化学工作站(CHI660E,上海辰华仪器有限公司)表征催化剂的光电化学性质. 具体测试方法:乙醇超声催化剂滴涂在FTO导电玻璃上作为工作电极,分别以铂片和饱和甘汞电极作为对电极和参比电极,电解液为 0.2 mol·L−1 Na2SO4溶液.
-
50 mg催化剂分散于100 mL K2Cr2O7溶液(含Cr6+ 10 mg·L−1),避光搅拌40 min,待达到吸附-脱附平衡后,300 W氙灯(CEL HXF300)进行光照(λ>420 nm,光强1.5 mW·cm2),每隔一段时间取反应液4 mL,经离心后取上清液,采用二苯碳酰二肼分光光度法测定吸光度.
-
50 mg催化剂分散于90 mL水,加入10 mL三乙醇胺和100 μL H2PtCl6·6H2O (0.04 g·mL−1). 搅拌30 min并抽真空后,300 W氙灯进行光照(同上). 通过气相色谱仪(GC7920,TCD检测器,N2作为载气)在线检测H2产量.
-
25 mg催化剂加入MO溶液中(20 mg·L−1),避光条件下搅拌30 min,以达到吸附平衡. 300 W氙灯进行光照(同上),每隔一段时间取反应液4 mL,经离心分离后用紫外可见分光光度计测定上清液吸光度.
-
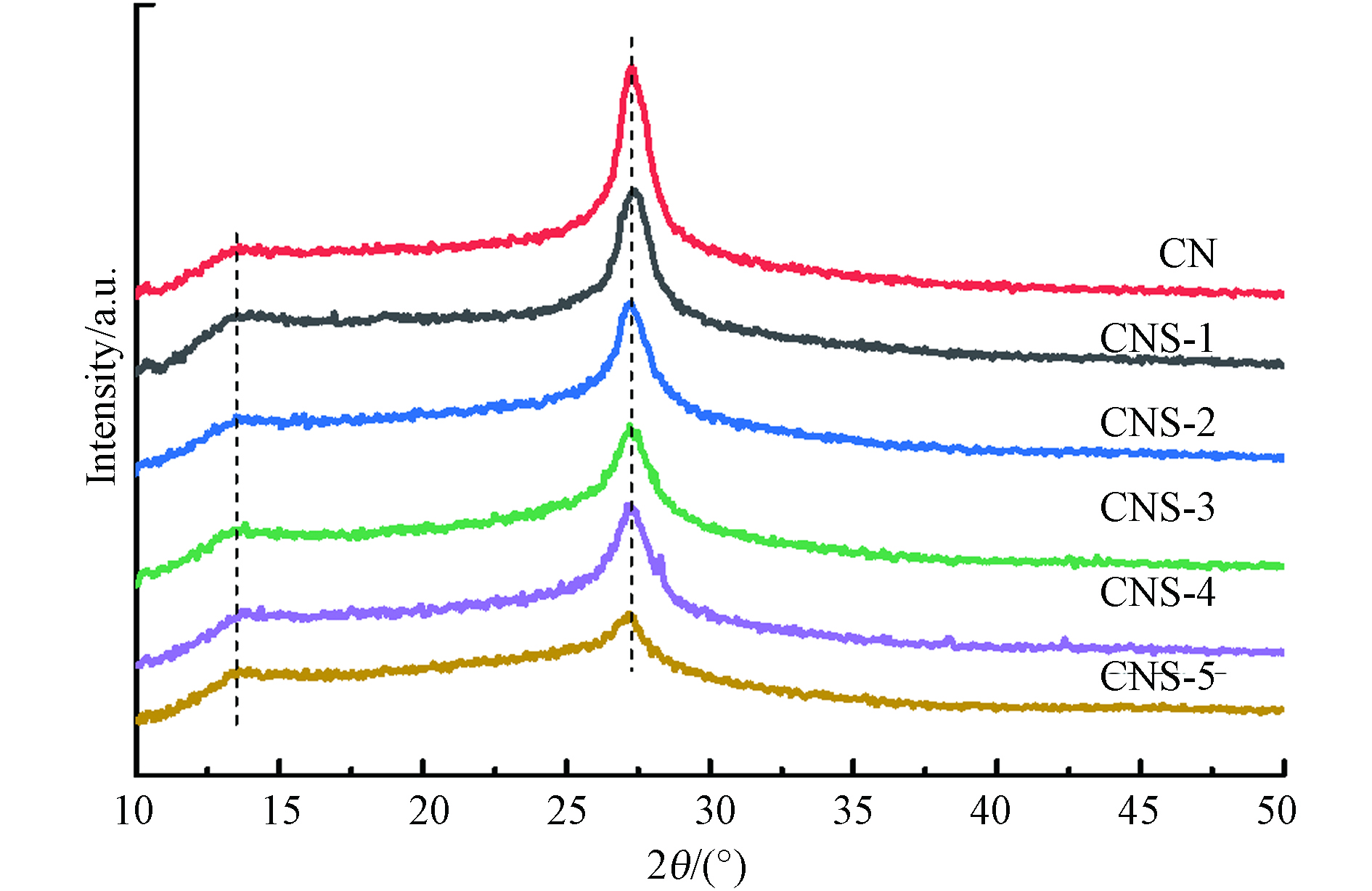
图2为合成催化剂的XRD图谱,CN及CNS样品均具有典型的石墨相结构. 27.3°强峰是石墨相材料典型的层间堆叠(002)峰,13.0°处的宽衍射峰对应氮化碳的(100)晶面,归属于氮化碳面内嗪环结构的重复排列[15]. 与CN相对比,CNS样品的XRD衍射峰位没有发生变化,说明噻吩环的引入没有破坏CN的基本聚合结构. 随着TPCN聚合量的增加,CNS样品的(002)衍射峰强度逐步降低,说明样品聚合结构的长程有序性降低.
通过SEM对CN和CNS样品(以CNS-2为例)的微观形貌进行表征,如图3所示. 图3中a—c和d—f分别为CN和CNS-2样品的SEM图. 低温溶剂热合成有利于CN聚合形成稳定的球状形貌,且呈空心态,平均尺寸约为1 μm. 低温自聚合形成空心球是溶剂热合成的典型合成路径[16]. 以TPCN为共聚合分子得到的CNS-2与CN相比,其形貌依然保持空心球结构,颗粒大小也无明显变化,但球体表面粗糙度增加. 这一结果表明,共聚分子的引入在一定程度上降低了产物聚合度,颗粒表面引入更多结构缺陷,在一定程度上增加了界面反应接触活性位.
催化剂的光吸收谱图如图4a所示. 由图4可以看出,低温溶剂热法所合成产物具有较宽的可见光吸收范围,远大于常规高温煅烧法所制备的氮化碳产物(~ 460 nm). 相对于CN,CNS的光吸收带边均发生不同程度的红移,且随着噻吩环聚合量的增加而逐步扩展至~700 nm,样品颜色由橘红色过渡为暗红色,从光响应角度提升催化剂的光吸收至深可见区是光催化剂性能提升的重要因素. 通过Tauc曲线对样品的禁带宽度进行测算,如图4b所示,CN、CNS-2和CNS-5的带隙宽度分别为 2.0、1.92 eV和1.83 eV. 这一结果说明,噻吩环修饰共聚合有效拓展了CN的π共轭体系,窄化了带隙宽度,拓展了可见光的吸收范围,可显著提升对太阳光的吸收和利用. 图4c为CN和CNS-2的Mott-Schottky曲线. 曲线斜率均为正值说明样品为n型半导体,CN和CNS-2的平带电位分别位于−1.25 V和−1.15 V vs. NHE. 由于n型半导体平带电势接近导带电位,因此可以认为CN与CNS-2的平带电位分别位于−1.25 V和−1.15 V vs. NHE[17]. 与CN相比,尽管CNS-2的导带电位正移,但仍具有较强的还原电势,同时满足在含O2条件下超氧自由基(
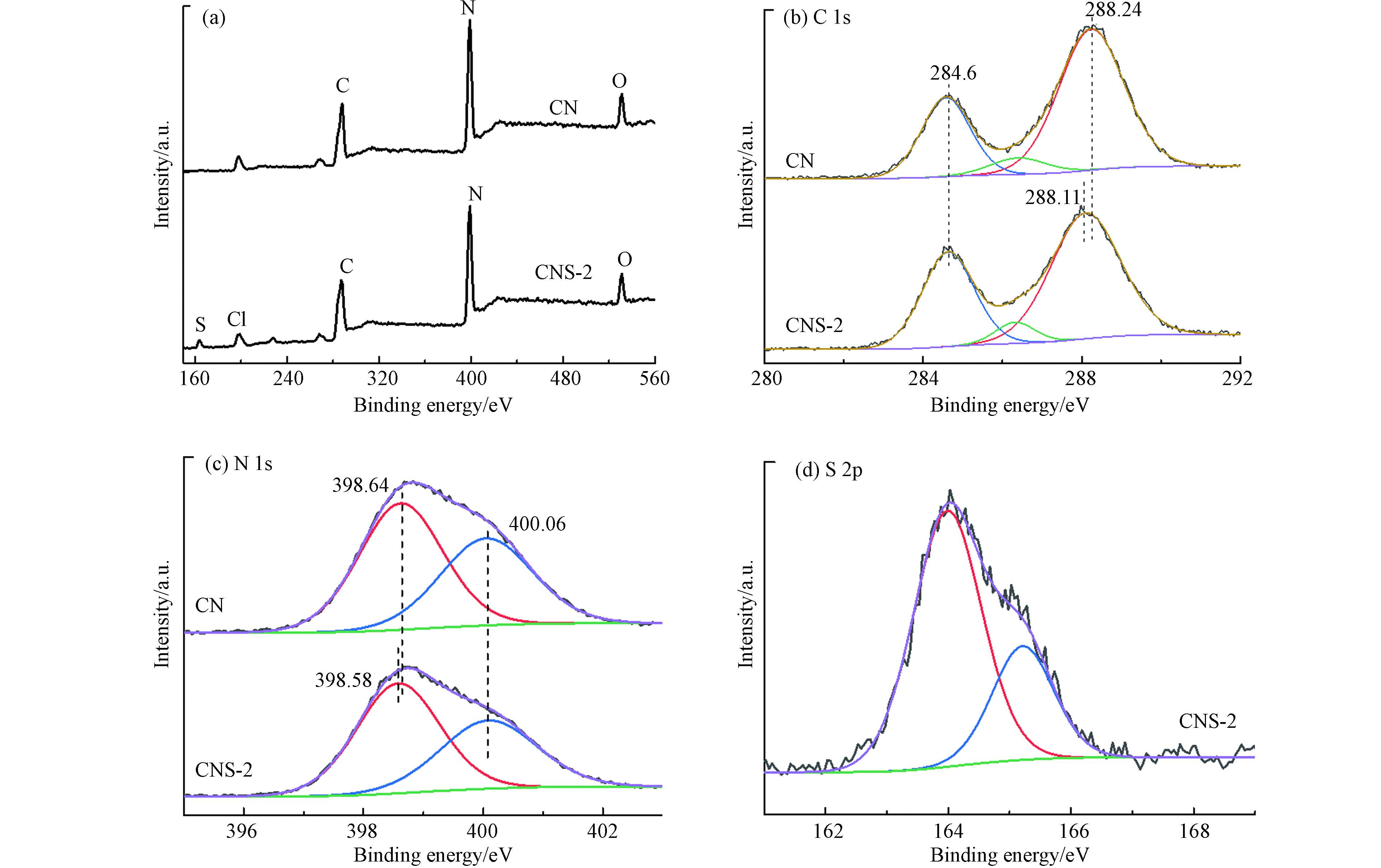
⋅O−2 )的生成(Eθ(O2/⋅O−2 ) = −0.33 V vs. NHE),因此在环境污染物降解方面具有潜在的应用价值[18].图5为CN和CNS-2的XPS谱图. 从总谱图5a中可以看出,CN及CNS样品主要由C、N和O元素组成,另外含有少量Cl元素,来源于三聚氯氰的末端不完全聚合. 与CN相比,CNS-2谱图中出现S元素,初步证明含S噻吩环分子结构共聚合嵌入CN共轭骨架. 图4b中 CN的C 1s谱曲线可以分别在284.60、286.30、288.24 eV处拟合3个峰,对应C—C/C=C键、少量C—O键和sp2杂化碳(N—C=N)[19]. CNS-2具有相似的C1s拟合曲线,但其sp2 C的峰向低位移动0.13 eV. 图4c中CN的N 1s可拟合为2条曲线,中心峰位分别为398.64 eV和400.06 eV,归因于共轭杂环中的sp2 N和桥连N原子N—(C)3[20]. CNS-2同样具有类似的N 1s谱线,但sp2 N峰位同样向低位偏移约0.06 eV. 图5为CNS-2样品的S 2p 高分辨XPS谱图,电子结合能分别位于164.0 eV和165.3 eV的两个峰来源于S 2p3/2和S 2p1/2. 这一结果与文献中报道的S掺杂的氮化碳中S的电子结合能(163.9 eV和168.5 eV)明显不同,而与噻吩化合物中S的电子结合能(163.8 eV和165.0 eV)相吻合,表明所得产物不是简单的S掺杂CN,有力地证实了噻吩环分子通过共聚合的方法成功地并入到了CN的分子结构中[21]. 图5b—d共同说明,CNS-2共轭结构中的sp2杂化C,N具有更高的电荷分布密度. 这是由于噻吩环为典型的供电子基团,共聚合嵌入CN共轭骨架能够拓展共轭杂化结构,拓展光吸收,同时使得产物CNS样品具有更高的不饱和电荷密度,有利于更多光生电荷的产生.
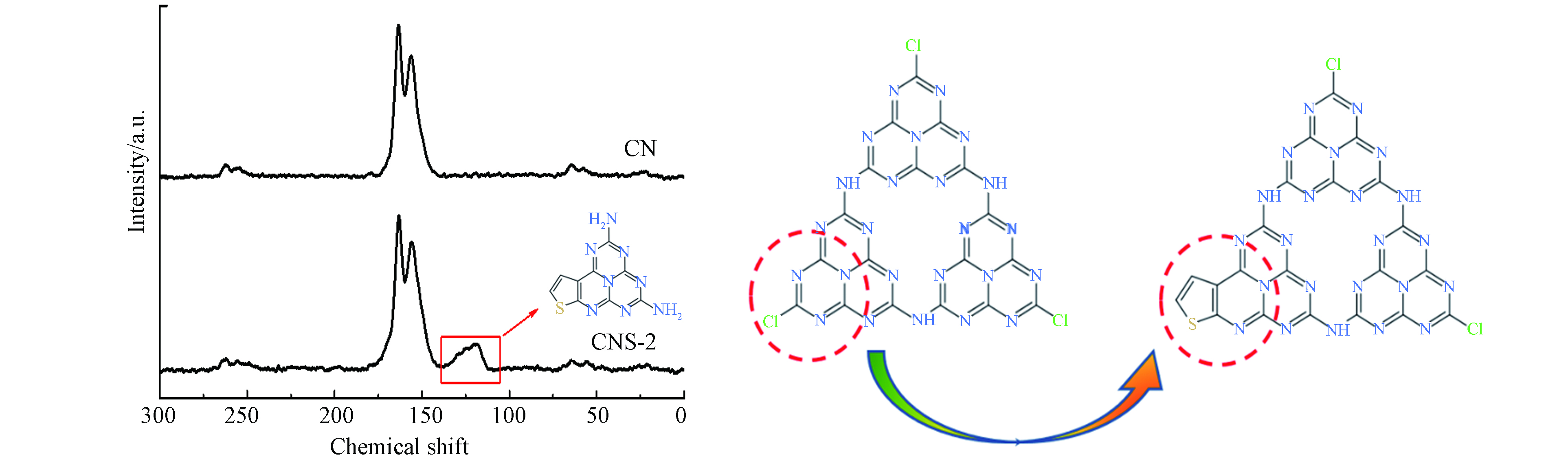
为了进一步证实噻吩环聚合嵌入CN骨架,采用固体13C NMR表征CN和CNS-2的化学结构变化,如图6所示. 可以看出,二者在化学位移155.6和164.3处均出现两个明显的核磁共振峰,归属于氮化碳共轭杂环C. 此外,CNS-2样品在化学位移110附近处出现一个新峰,由噻吩环分子中的C参与CN π共轭而引起,这表明噻吩环结构通过共聚合的方法成功嵌入到CN的组成结构中[22]. 结合XPS分析可推断,在热聚合过程中噻吩基团取代边缘N=C—Cl,从而实现将噻吩结构嵌入到CN分子骨架中.
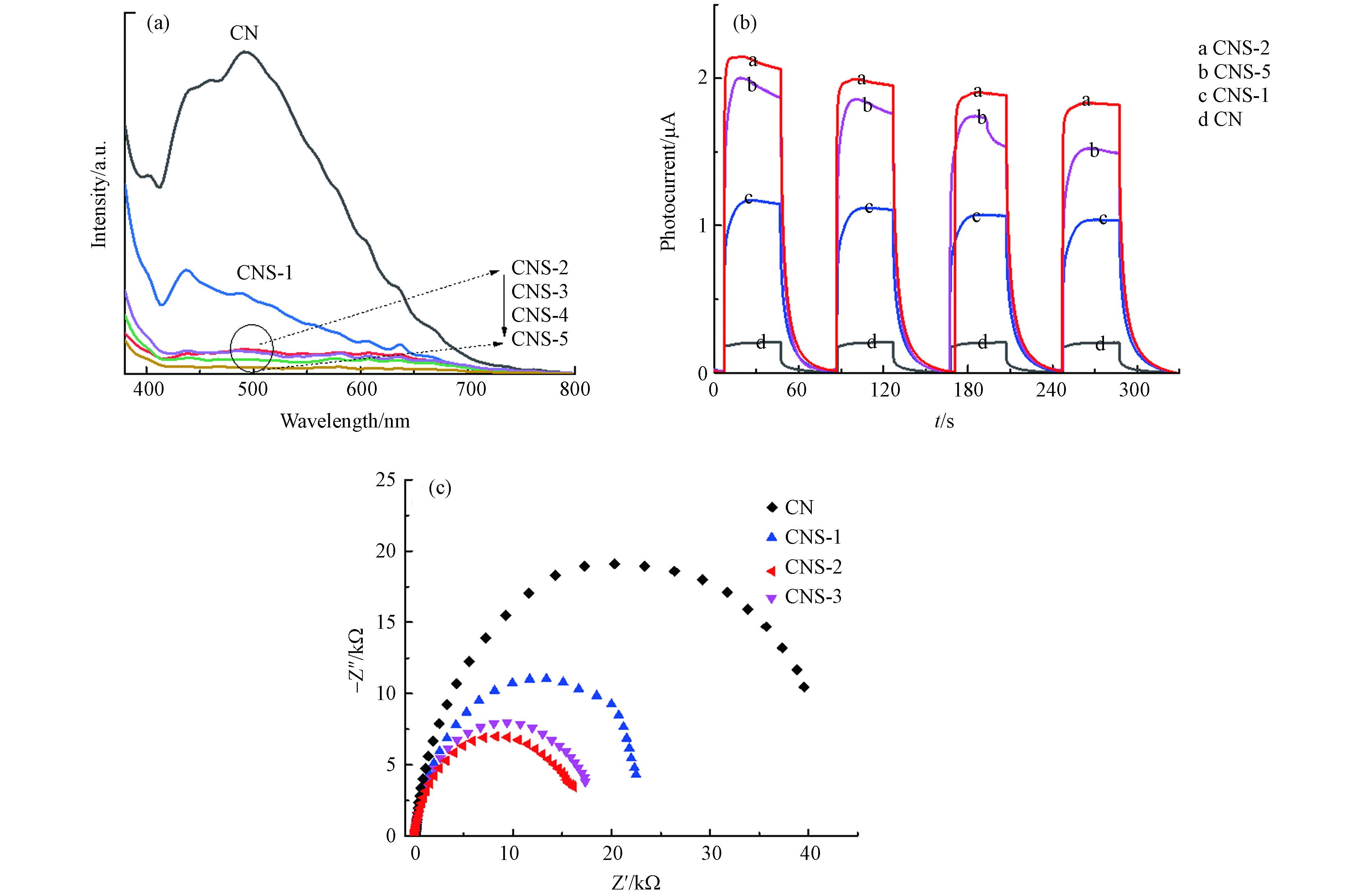
光电响应性能是分析光催化剂的重要技术方法,可以直观的表明在光照条件下催化剂光生载流子的产生和分离. 图7a是催化剂的稳态PL光谱, 在360 nm光激发下,CN在500 nm附近处有较强的PL发射峰,来源于催化剂的π-π*电子激发跃迁[23],表明CN存在较强的光生电子-空穴复合. 当噻吩环嵌入后,CNS系列样品的PL发射峰强度骤然减弱. 除CNS-1仍出现较明显的发射峰外,其他样品PL发射峰几乎可忽略. 显著降低的PL发射峰强度表明CNS样品的光生电子-空穴复合率被明显抑制,具有增强的电子-空穴分离效率. 噻吩环的嵌入有利于优化电子结构,扩大共轭平面电荷离域性,增强电荷流动性. 图7b为采用三电极体系测得催化剂的I-t曲线. 在可见光照下(λ > 420 nm),CN及CNS样品均可以产生瞬时光电流,说明其良好的光电响应性能. 图中CN的光电流强度最弱,CNS样品均表现出显著增强的光电流强度,其中CNS-2的光电流强度最强,表明噻吩环结构聚合量影响CNS样品光电子的产生,其中CNS-2具有最强的光生电荷产生密度,具有最强的光电转换效率. 从暗态电化学阻抗测试(图7c)可以看出,与CN相比,CNS样品的Nyquist圆弧半径明显减小,其中CNS-2具有最小的Nyquist圆弧半径,说明适量的噻吩共聚合改性可以有效降低催化剂内部电荷传输阻力[24]. 从以上分析结果可以看出,噻吩共聚合嵌入CN共轭骨架,一方面拓展了CN的可见光吸收,另一方面增强了光生电荷的产生、传输和分离效率.
-
CN及CNS样品具有较强的还原电位,因此首先通过在室温下可见光还原Cr6+考察其光催化性能,结果如图8所示. 在K2Cr2O7溶液中(pH 6.7)经过40 min暗吸附处理,所有样品对Cr6+基本达到吸附-脱附平衡. 在可见光照下,高温煅烧法制备的纯C3N4对Cr6+几乎无去除效果,而CN及CNS样品均对Cr6+表现出不同程度的去除率. 光照2 h后,CNS-2对Cr6+具有最高的去除率,达55.7%,远高于CN对Cr6+的去除率37.9%. 而随着噻吩环聚合量的增加,CNS样品的催化活性反而下降,说明适量的噻吩环掺杂是优化CN光电性质的重要因素.
根据准一级动力学方程计算了催化剂的反应速率常数,如图8b所示. 可以看出,函数-ln(C/C0)与反应时间t呈较好的线性关系. CN、CNS-2、CNS-5的速率常数分别为0.00153、0.00388、0.00105 min−1. CNS-2的反应速率常数约是CN的2.5倍. 溶液pH是影响Cr6+还原的重要因素,图8c给出了在不同pH环境下CNS-2对Cr6+的还原活性. 可以看出,溶液pH对催化剂吸附性能影响并不明显. 在酸性环境中CNS-2具有显著增强的光还原Cr6+活性,当pH 1.8,光照反应90 min既可以完全去除溶液中Cr6+,而当pH 8.1,光反应2 h后去除率降低至30%. 这是由于溶液中Cr6+还原反应式为:
根据能斯特方程,
CrO2−7 还原为Cr3+在酸性环境中具有更低的电势值. 因此,在酸性及中性环境中,所制备CNS空心球表现出优异的光催化还原Cr6+活性,远高于常规氮化碳材料.光解水制H2是石墨相氮化碳半导体的重要研究方向. 图8d为在可见光下CN及CNS样品的分解水制H2活性速率. 同样的,CNS-2表现出最佳的制H2活性(2.72 μmol·h−1),约是CN活性的3.8倍. 尽管其产氢活性远低于高温热聚合法制备的常规氮化碳材料,但其较低的合成温度,灵活的形貌控制和改性途径仍然值得在清洁能源转化方向进一步深入研究.
尽管氮化碳半导体价带电位较低,通常不具有直接氧化分解有机污染物能力,但其合适的能带结构使得其在光激发下仍然能够生成具有较强氧化活性的氧自由基,同样具有光催化降解有机污染物的活性,在环境净化方面具有重要应用价值[25]. 采用可见光催化降解MO来评价催化剂对有机污染物的催化活性,结果如图9所示.
从图9a可以看出,经过30 min暗吸附,所有样品对MO基本达到吸附-脱附平衡,且吸附量相差不明显. 在光照反应中,相较于CN,适量噻吩共聚合改性后的CNS样品活性明显提升,经过2 h光照反应,CNS-2对MO的去除率达68.4%,远高于CN对MO的去除率50.5%. 对降解过程中MO溶液的pH进行监测,光照2 h后期pH变化仅为0.1,所以溶液pH变化对反应过程几乎无影响. 而随着噻吩环聚合量进一步增加,CNS的光催化活性降低,光照2 hCNS-5对MO的去除率仅为33.5%. 这可能是由于适量的噻吩环掺杂对催化剂电子结构调控提到积极作用,而过量噻吩环的嵌入容易引入更多的结构缺陷,而缺陷态往往是光生电荷复合中心,所以反而不利于光催化性能的进一步提升. 同样采用准一级动力学方程对CN和CNS光催化降解MO数据进行拟合计算催化反应速率常数. 由图9b可知,CNS-2具有最大的反应速率常数0.00934,约是CN(0.00594) 的1.6倍. 此活性测试结果趋势与上述Cr6+还原去除基本保持一致,说明CNS样品具有稳定的光催化应用活性. 同时考察了催化剂投加量对催化性能的影响,如图9c. MO分子较为稳定,在纯光解反应体系几乎不发生任何变化. 随着催化剂使用浓度的提升,光催化MO降解速率逐步提升,进一步证明了光催化剂在反应体系中的重要作用. 活性稳定性是评价催化剂应用性的重要指标. 对催化剂CN及CNS-2光催化降解MO进行反复试验,结果如图9d所示. 经连续5次循环使用后,催化剂依然保持相对稳定的催化活性.
-
为了深入验证CNS光催化降解MO过程中活性物种的产生,以异丙醇(IPA)、对苯醌(BQ)、乙二胺四乙酸二钠(EDTA-2Na)、氮气(N2)分别作为羟基自由基(·OH)、超氧自由基(·O2-)、空穴(h+)捕获剂和溶解氧去除剂进行活性分析[26]. 如图10所示,与空白体系(无捕获剂)相对比, IPA和EDTA-2Na的加入对降解率影响不大,说明在反应过程中·OH和h+不是主要的活性物种. 反应溶液加入BQ后,CNS-2对MO的光降解率明显降低,这说明
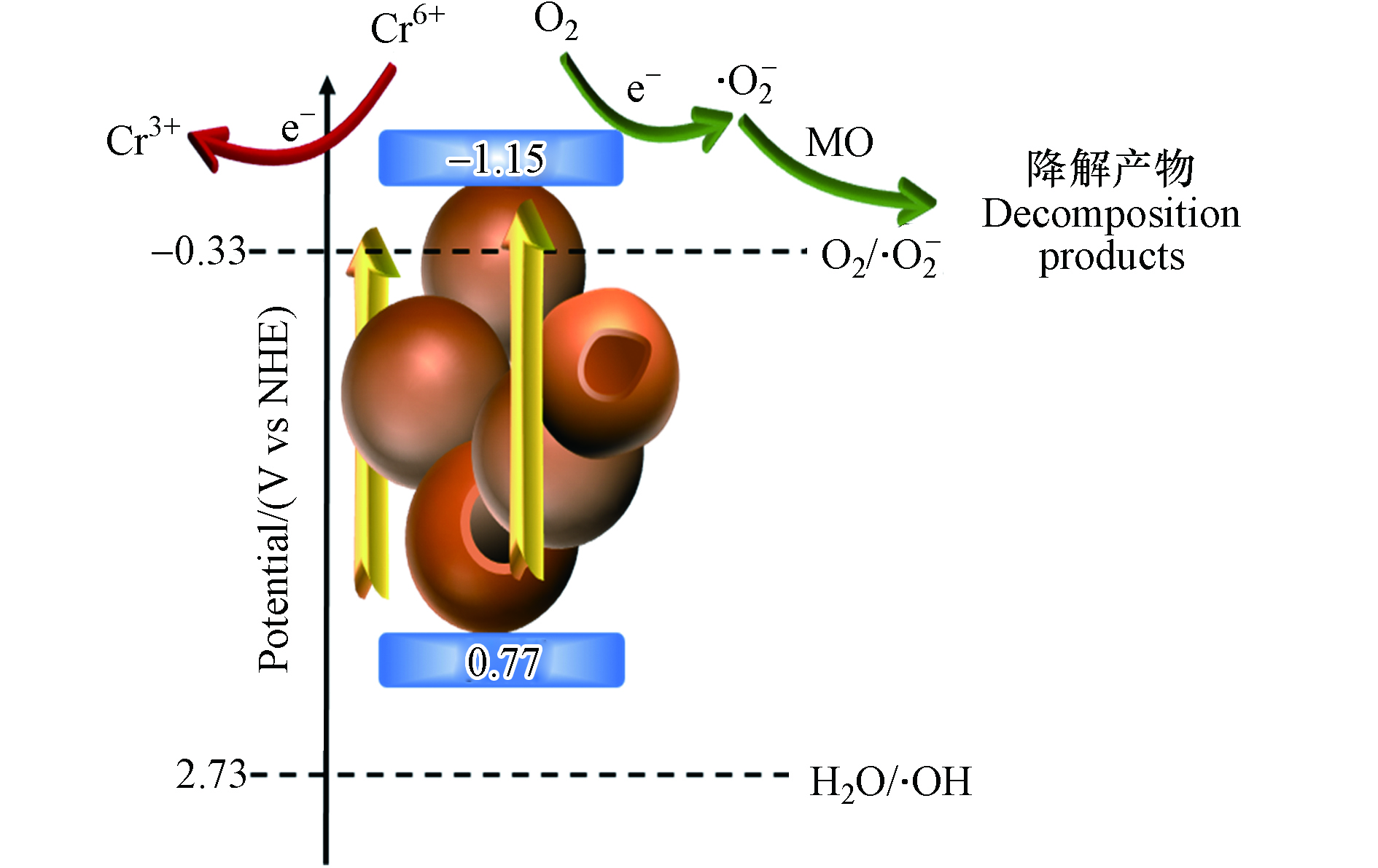
⋅O−2 是主要的活性物种. 向反应溶液中连续通入N2同样导致MO降解率显著下降,说明溶解氧在反应过程中起到重要作用,间接证明⋅O−2 来源于O2.由UV-vis所得带隙数据以及平带电势值可计算推断CNS-2的能带位置,如图11所示,其导带值为−1.15 V,在溶解氧存在环境中可利用光致电子转化生成·O2−. 其价带值为 0.77 V,远低于žOH的生成电势,因此不足以产生·OH. 在可见光照下,较低的带隙使得CNS容易被激发生成光生e−和h+,而光生e−可直接还原Cr6+,同时间接生成·O2−参与MO的催化降解. 为进一步验证此结论,对催化剂进行了难降解抗生素四环素(TC,20 mg·L−1)的光催化降解实验,CNS-2同样表现出最佳的降解活性,但经过2 h光照,对TC的去除率仅为36.5%. 较低的降解活性进一步证实CNS由于较低的氧化电位,不能生成强氧化性自由基.
-
(1) 以2-氨基噻吩-3甲腈为聚合分子,在低温溶剂热条件下可直接将噻吩环结构嵌入氮化碳分子骨架,实现分子聚合改性,所得产物CNS具有空心球形貌.
(2) 噻吩环分子嵌入使得CNS具有宽可见光吸收(~700 nm),且优化的电子结构使得CNS具有明显增强的光生电荷产生密度和电子-空穴分离效率.
(3) 调控噻吩环聚合量可优化催化剂光催化活性,使其具有显著提升的光催化还原Cr6+、光解水制H2以及MO降解活性. 其中,光生e−和间接生成的
⋅O−2 分别是还原反应和氧化降解反应的主要活性物种.
噻吩环修饰氮化碳空心球的制备及其可见光催化性能
Preparation and Photocatalytic performance of thiophene-ring modified carbon nitride hollow spheres
-
摘要: 以噻吩基团分子为聚合单体,低温溶剂热法一步合成噻吩环修饰的氮化碳空心球光催化剂. 采用XRD、SEM、XPS、UV-Vis DRS、PL等测试方法对催化剂的结构、形貌、光电响应等进行了表征. 结果表明,适量的噻吩环嵌入氮化碳骨架不影响产物空心球形貌,尽管降低了长程聚合度,但增加了球体表面缺陷,拓展了可见光吸收范围,缩小了带隙宽度,增强了光生电荷的产生密度并有效抑制了光生电子-空穴的复合,显著增强了光催化反应性能. 通过光催化还原水中Cr6+、光解水制氢和降解甲基橙的测试表明,噻吩环修饰后的CNS-2具有显著增强的光催化活性,其反应速率分别是未修饰氮化碳CN的2.5、3.8、1.6倍. 而光生e−和间接生成的
⋅O−2 分别是发生还原和氧化反应的主要活性物种.Abstract: Thiophene-ring modified carbon nitride hollow sphere photocatalysts (CNS) were synthesized by one-step low-temperature solvothermal method using thiophene group-containing molecules as monomers. The structure, morphology and optoelectronic properties of the catalysts were characterized by XRD, SEM, XPS, UV-Vis DRS, PL and others. The results show that appropriate amount of thiophene-rings embedded in the carbon nitride framework does not affect the hollow spherical morphology of the products, the long-range polymerization degrees of them are reduced, but it increases the surface defects of the spheres, expands the visible light absorption range, narrows the band gap, enhances the generation density of photogenerated charges and effectively inhibits the recombination of photogenerated electron-holes, therefore enhances the photocatalytic performances significantly. The photocatalytic reduction of Cr6+ in aqueous solution, water splitting for hydrogen production, and methyl orange degradation tests show that CNS-2 modified by thiophene-ring performs much enhanced photocatalytic activity, and its reaction rate was 2.5, 3.8 and 1.6 times that of unmodified carbon nitride (CN), respectively. Pphotogenerated e− and indirectly generated⋅O−2 are the main active species for reduction and oxidation reactions, respectively.-
Key words:
- carbon nitride /
- hollow sphere /
- thiophene-ring /
- photocatalysis.
-
重金属在水生生态系统中有着非常广泛的分布. 其主要来源包括地球化学结构、采矿活动、金属冶炼、工业废物、废物焚烧和城市污水排放[1]. 由于重金属不会自然降解,它们通常沉淀在沉积物中,溶解在天然水中,或富集在生物体中[2]. 值得注意的是,重金属在食物链中富集,一旦达到生物利用度的阈值,就会对生物体造成毒性影响[3].
水体环境的物理化学特征对沉积物积累重金属的行为存在显著影响[4]. 由于湖泊沉积物是水体环境中重要的重金属库,沉积物中积累的重金属成了水体环境重金属污染的一个重要来源,因此对于水生生态系统中沉积物中重金属含量的检测,也是了解水环境重金属污染的重要环节[5]. 湖泊沉积物提供了环境变化的信息,显示了流域内不同重金属浓度的时空差异[6-7]. 通过测定不同深度的沉积物岩芯中重金属的浓度可以推测重金属污染史[8-10]. 然而,重金属生物积累和放大的信息不能只通过测定水体和沉积物中重金属来衡量[11].
随着时间的推移,水生生物会吸收其生存环境中的各种污染物,另外,鱼类在水生环境食物网中占据重要地位. 因此,检测鱼类重金属的富集情况可以作为水体环境重金属污染的生物监测手段[10]. 更重要的是,鱼体内富集的重金属可以通过食物链转移到人体. 一般来说,重金属可以分为有毒元素(如Pb、Cd、Cr)和生物必需元素(如Cu、Zn),但即使是生物必需元素在高浓度条件下也会产生毒性效应[12]. 测定鱼体中的重金属含量,对评估人类食用鱼的潜在健康风险具有重要意义[13-14]. 研究鱼类组织中重金属的含量,将有助于评价水环境中重金属的污染状况. 鱼类的肌肉组织是人类消费的主要部分;肝脏是金属最重要的代谢和储存器官[15];鳃可以直接反映水中的金属含量,因为它们是直接暴露在水环境中的呼吸器官,可以调节酸碱和离子转移[16]. 因此,本研究检测鱼类的肌肉、肝脏、鳃部位的重金属含量,来了解鱼类体内重金属污染情况.
滇池作为水资源保护区以及中国最大的高原淡水湖,同时也是昆明市主要的储备水源. 根据《云南省环境保护厅关于印发云南省地表水水环境功能区划(2010—2020年)的通知(云环发〔2014〕34号)》一般鱼类保护区和游泳区,执行地表水环境质量Ⅲ类标准. 在经济快速发展的几十年中,该湖受到了工业、农业和城市日常生活污水和废物的严重污染. 滇池是一个富营养化程度很高的湖泊,具有弱碱性环境和较高的溶解氧浓度[17]. 在弱碱性条件下,即使存在相当大的物理干扰,沉积物中的重金属也很难释放出来进入水体[18]. 在较高溶解氧条件下,金属氧化物和氢氧化物与可溶性重金属离子结合形成共沉淀.[19]悬浮沉积物从水中吸附重金属污染物,从而降低其在水中的浓度[20],使得沉积物中重金属含量高于地表水. 尽管之前有研究表明,在滇池沉积物中存在大量重金属[21],但它们在水体和沉积物中的空间分布和历史变化,以及随环境条件变化在特有野生鱼类组织中的生物蓄积量知之甚少.
本文对滇池水环境、底泥和3种典型野生鱼类(鲤鱼、鲫鱼和银鱼)中Pb、Zn、Cu、Cd、Cr的含量进行了比较研究. 本研究旨在研究水体和沉积物中重金属的含量及其空间变化,阐明其在鱼类器官中的富集水平,为重金属污染防治提供基础资料. 在此基础上,对滇池重金属污染对周边居民可能造成的危害进行了评价. 这些研究有助于更好地了解重金属在自然水环境中的迁移转化以及在生物体内的富集情况,为合理管理和控制重金属污染提供有效信息.
1. 材料和方法 (Materials and methods)
1.1 试剂和仪器
本研究所用溶剂均为分析纯级或色谱纯级. 以Pb、Zn、Cu、Cd、Cr为储备标准溶液(1000 μg·mL−1),经适当稀释后制成标准曲线制备液. 所有塑料容器和玻璃器皿在使用前用稀硝酸(1+9,V/V)浸泡并用蒸馏水冲洗. 微波辅助消解(MAD)由ETHOS 1高级微波消解系统(Milestone,Italy)进行,该系统配有12个样品盘和温度控制系统[22]. 采用火焰/石墨原子吸收光谱仪(AAS,Varian instruments AA240)和电感耦合等离子体质谱仪(ICP-MS,Thermo)进行样品分析.
1.2 水和沉积物样品采集
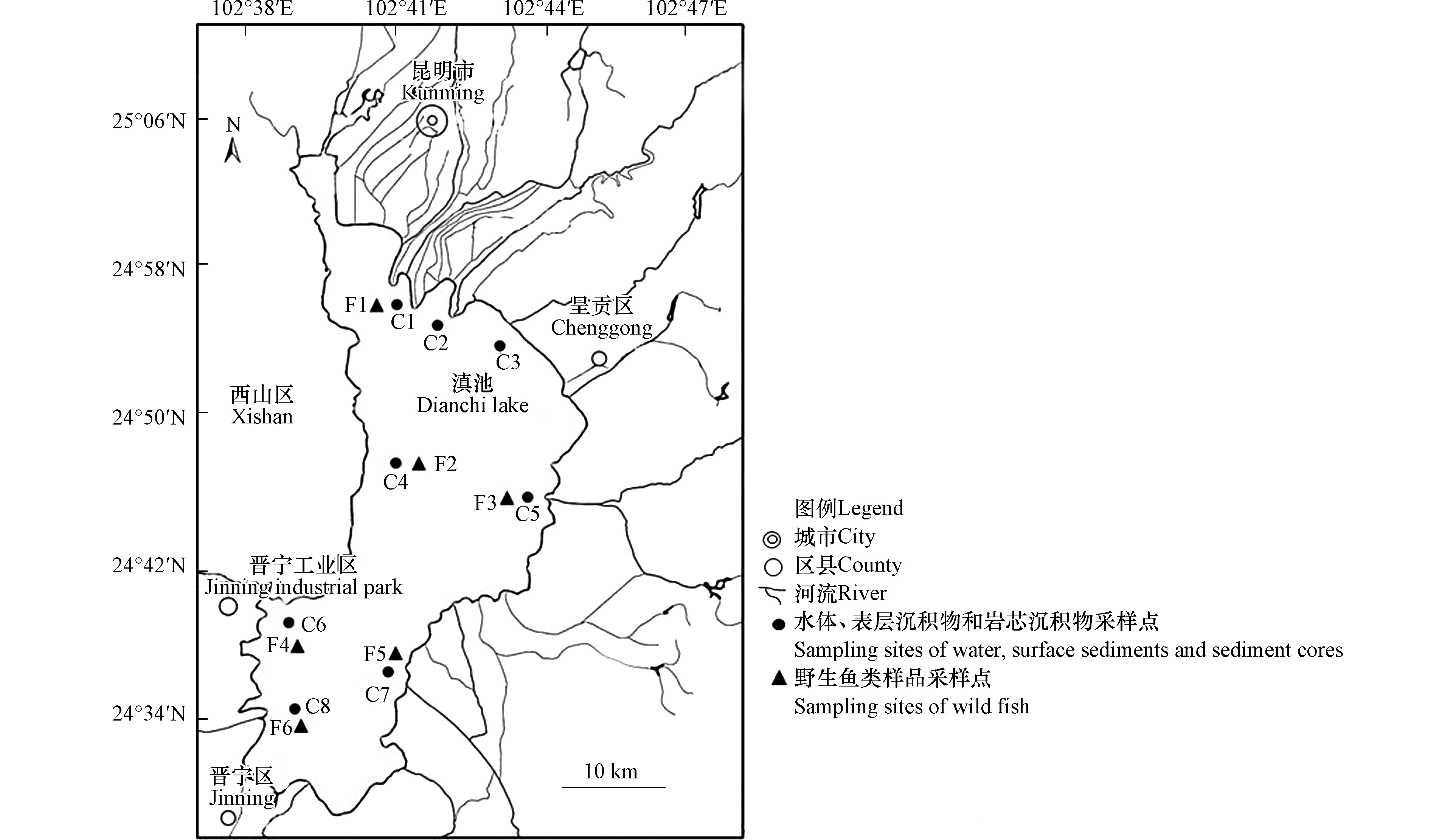
滇池(东经102°10′—103°440′,北纬24°23′—26°22′)是位于我国西南地区的高原湖泊. 该湖海拔1886 m,水面面积330 km2,湖的平均和最大水深分别为4.4 m和10.4 m[23],研究区域和采样点布置图如图1所示.
本研究综合考虑采样点的总体覆盖范围,并结合滇池典型地表水水质监测断面(生态环境部,2012年),选择以下8个采样点(C1:晖湾、C2:宝象、C3:罗家营、C4:观音山西、C5:大鱼乡、C6:海口西、C7:白鱼、C8:滇池南)采集水样和沉积物样品,其中晖湾、罗家营、观音山西、海口西及滇池南5个点位为地表水水质国家重点监控断面. 采样点的坐标采用全球定位系统(GPS,Spectra Precision,America)记录. 用4 L棕色玻璃瓶采集水样,立即向水样中加入1%硝酸,以抑制金属与容器壁的结合. 表层沉积物样品是从湖床顶部以下10 cm处使用不锈钢抓斗取样器采集. 用不锈钢重力取芯器取样容器从110 cm深度采集沉积物岩芯样品. 沉积物岩芯被分成22层,每层5 cm高. 沉积物岩芯的所有部分都放在一个贴有相应标签的塑料袋中. 水样以4 ℃的温度储存,沉积物样品以−35 ℃的温度储存.
1.3 鱼类样品采集
从湖的6个采样点(F1:晖湾、F2:观音山西、F3:大鱼乡、F4:海口西、F5:白鱼、F6:滇池南)采集鱼类样品. 由于鱼存在活动行为,来自某个“地点”的样本实际上代表了一段距离取样地点大约3 km的水域. 表1列出了每个地点每个物种的分析样本信息.
表 1 滇池地区三种特有野生鱼类的特征Table 1. Characteristics of three endemic wild fishes in Dianchi Lake area种类Species 数量Number 体长/cm Body length 体重/g Weight 均值Average 范围Min-Max 均值Average 范围Min-Max 鲤鱼Carp 12 30.9±9.2 14—51 645±485.5 66—1904 鲫鱼Crucian carp 40 16.3±4.7 7—26 113.4±98.1 13—546 银鱼Silvery minnow 38 13.5±3.6 6—20 25.6±16.6 2—66 所分析的鱼类种类有鲤鱼、鲫鱼和银鱼,它们是滇池中常见的鱼类,在食物链中占有相同的位置. 这3种鱼类被当地居民广泛食用,具有较大的研究价值. 本研究从6个地点共采集到90个标本,包括3个物种.
1.4 样品制备和分析
水样用2 mL浓硝酸(65%)和1 mL过氧化氢(30%)在180 ℃条件下消解10 min后用微孔0.45 μm玻璃纤维过滤器(Billerica,MA,USA)过滤去除藻类、浮游动物和悬浮颗粒,然后储存在4 ℃下. 沉积物样品冷冻干燥后用孔径为1 mm清洁塑料筛,筛除大块石头、贝壳等碎片. 筛过的沉积物在玛瑙研钵中研磨,直到所有颗粒通过100目尼龙筛(0.147 mm).在本研究中使用4 mL硝酸(65%)、2 mL过氧化氢(20%)、1 mL氢氟酸(40%)配合微波辅助消解法对沉积物样品进行前处理[3]. 完全消解后,冷却至室温,并用超纯水(Mili-Q 18.2 MΩ·cm电阻率)稀释至所需体积,待测重金属含量.
用致死剂量的麻醉剂(MS-222)杀鱼后,用手术刀解剖,将组织与骨骼分离. 对鱼个体的肌肉解剖、汇集、匀浆和冻干(Eyela FDU-1200,Japan),器官组织均化并分开保存. 银鱼体形较小(<15 cm),只分离肌肉和内脏. 冻干后,将样品磨成粉末,筛至<1 mm,然后在室温下密封储存. 在微波消解系统中,用浓硝酸(65%)和过氧化氢(30%)消化干鱼样品,并用超纯水(Milli-Q 电阻率>18.2 MΩ·cm)稀释样品.
1.5 数据分析和统计分析
生物浓缩因子(BCFs)的计算形式如下:BCF=CF/CW,其中CF为鱼组织中的目标污染物浓度,CW是水中的浓度[24]. 鱼的重量以湿重(ww)计算,单位为L·kg−1. 本研究将BCFdw通过含水率换算成BCFww(用于分析鱼样品的含水量为82.5%—86%,本文按85%进行转换).
目标危险系数(THQ)是暴露量与参考剂量之间的比率,用于表示非致癌作用的风险. 如果该比率小于1,则无明显风险,当剂量大于或等于RfD时,受关注的暴露人群将面临健康风险.
stringUtils.convertMath(!{formula.content}) 式中,EF是暴露频率(365 d·a−1);ED是暴露持续时间(按平均寿命70年算);FIR是食物摄入率(g·d−1);C是鱼类中的重金属浓度(μg·g−1);RfD是重金属口服参考剂量(mg·kg−1·d−1,参考美国环保局标准为Cd、Pb、Cr、Cu、Zn(0.001、0.004、1.5、0.04、0.3));BW是成人的平均体重(按60 kg算);ATn是非致癌物平均暴露时间(365 d·a−1×ED).
由于暴露于两种或多种污染物可能会导致加和或相互作用从而产生潜在健康危害的潜在风险[25]. 本研究用危险指数(HI)来表示各个金属THQ值的算术总和.
stringUtils.convertMath(!{formula.content}) 式中, THQn分别为THQPb、THQZn、THQCu、THQCd、THQCr.
所有统计分析均采用IBMSPSS 20.0版进行. 采用单因素方差分析(ANOVA)对各类样品间的差异进行了检验. 秩相关分析(RHO)探讨了金属浓度与其他水化学变量之间的关系. 用单因素方差分析(ANOVA)比较了物种、组织和地点之间的平均金属浓度差异. 采用方差分析程序,采用Tukey显著性差异检验(HSD)进行多重比较. 如果P<0.05,则差异显著. 所有数据均表示为平均值的±标准误差.
2. 结果和讨论 (Results and discussion)
2.1 水和表层沉积物中重金属的分布
表2显示了滇池各采样点水体中重金属的浓度,不同的采样点的水体的重金属浓度存在着明显的差异(ANOVA,P<0.05). 8个水体取样点重金属的浓度顺序可大体概括为Zn>Cr>Cu>Pb>Cd. 宝象(C2)的水体中Zn、Cd、Cr(六价)浓度最高(P<0.05),罗家营(C3)的Pb浓度最高(P<0.05),采样点C2、C3所在地均十分靠近昆明市. 靠近晋宁工业园区的C8采样点水体中的Cu浓度最高(P<0.05). 水体中重金属的浓度可能与这些地点周围的城市径流、污水排放口和废水排放有关.总的来说,人为因素很大程度上影响了滇中水体重金属的浓度[26]. 根据国家环境保护总局2002年颁布的《地表水环境质量标准》(GB3838—2002),滇池水体中Pb浓度超Ⅱ类水标准,Cr(六价)浓度超Ⅴ类水标准. 除Cu(r=0.147,P=0.05)和Pb(r=−0.039,P=0.928)外,pH值与水中其他重金属浓度呈负相关(r<−0.454,P<0.258). pH值的平均值为9.12,在这种情况下,重金属很容易结合到沉积物中,不会从沉积物中释放出来[17].
表 2 滇池8个采样点的水体和沉积物的重金属含量Table 2. The concentrations of heavy metals in the water and surface sediments at 8 sites in Dianchi lake are listed in below table采样点 C1 C2 C3 C4 C5 C6 C7 C8 EQS1 水体/(μg·L−1) Pb 36.58±2.03ab 20.96±1.84c 46.31±2.07d 42.84±1.82bd 44.85±3.50d 33.62±3.13a 14.33±0.60e 21.22±1.62c ≤10 Zn 466.77±4.86a 491.72±3.50b 355.92±3.43c 316.48±3.41d 384.02±4.07e 345.22±4.08f 214.78±1.51g 386.97±1.56e ≤1000 Cu 93.20±1.88a 105.28±5.20b 84.15±1.75c 125.34±3.06d 107.20±1.83b 100.43±4.94ab 100.58±0.88ab 126.36±2.54d ≤1000 Cd 2.78±0.09ab 3.22±0.12b 1.62±0.09c 2.54±0.34a 1.56±0.23c 1.45±0.05cd 1.02±0.22d 1.36±0.13cd ≤5 Cr 105.73±0.85a 127.83±2.90b 115.89±3.46c 113.48±2.75ac 115.26±3.98ac 118.25±2.18bc 86.72±5.28d 115.19±3.87ac ≤50 C1 C2 C3 C4 C5 C6 C7 C8 SBV2 沉积物/(mg·kg−1) Pb 75.03±4.42A 96.18±3.39B 98.10±4.19B 111.76±7.51BC 112.13±7.05BC 100.90±8.69BC 119.13±6.36CD 135.37±8.01D 26.2 Zn 210.18±6.02A 225.04±3.27A 165.39±5.59B 172.42±6.71B 190.09±9.87C 189.66±5.51C 157.67±8.55B 171.80±5.71B 88.4 Cu 118.26±2.16AD 104.96±5.00ABC 120.73±3.96D 115.46±5.06ABD 193.30±6.12E 102.09±7.10BC 99.97±8.05C 86.59±5.71F 35.1 Cd 2.21±0.09ABC 2.54±0.08BC 2.09±0.14ABD 2.29±0.14ABC 2.33±0.24ABC 2.58±0.08C 1.68±0.31D 1.86±0.09AD 0.28 Cr 134.39±5.16A 148.80±3.68B 132.68±4.06AC 122.62±5.42ACD 127.00±6.08AC 123.78±4.34ACD 110.51±9.45D 119.70±10.65CD 58.6 1中国地表水质量标准二级标准;Chinese surface water quality standard secondary standard;2云南省土壤重金属背景值;Yunnan background values of heavy metals in soil; abcdef代表不同采样点水中重金属浓度的显著差异,P<0.05; The letters abcdef represent the significant difference in the concentration of heavy metals in water between different sampling points (P<0.05); ABCDEF代表不同采样点沉积物中重金属含量的显著差异,P<0.001.The letters ABCDEF represent the significant difference in the concentration of heavy metals in sediments between different sampling points (P<0.001). 表2显示了各采样点表层沉积物中重金属的含量. 各个采样点间虽然存在着明显的差异(ANOVA,P<0.001),但在各采样点重金属中遵循着Zn>Cr>Cu>Pb>Cd的含量顺序. 在滇池北部的晖湾(C1)及宝象(C2)点位具有较高的Zn、Cr和Cd含量,相反在滇池南部的滇池南(C8)点位具有较高的Pb含量,此外大渔乡(C5)Cu元素含量也明显高于其他位点.表2中给出了当地重金属的土壤背景值(1990年),发现各采样点的表层沉积物中重金属的含量均高于土壤背景值,存在严重的重金属污染. 表层沉积物中的重金属来自于水体重金属. 宝象(C2)水体Zn和Cr污染严重的同时表层沉积物中也存在较高的Zn和Cr含量. 由于滇池富营养化的特点,使得沉积物中产生了大量有机质,其中腐殖酸类物质可以与部分重金属形成天然聚电解质的络合金属离子从而结合迁移并沉淀到沉积物中[17]. 同时根据水体及表层沉积物中重金属浓度的相关性分析表3也可以看出,同一采样点表层沉积物Zn、Cr含量与水体Zn、Cr含量呈显著正相关(r=0.873,P<0.001和r=0.716,P<0.05).
表 3 水体(μg·L−1)与表层沉积物(mg·kg−1·dw)样品(n=8)之间重金属浓度的皮尔逊相关系数(r)Table 3. Pearson’s correlation coefficient (r) between heavy metals concentration in water (μg·L−1) and sediment (mg·kg−1·dw) samples collected (n=8).水体 Water Pb Zn Cu Cd Cr 表层沉积物Sediment surface Pb −0.364 −0.526 0.683 −0.619 −0.155 Zn −0.023 0.873** −0.129 0.778* 0.554 Cu 0.627 −0.114 −0.141 −0.026 0.110 Cd 0.403 0.562 −0.072 0.562 0.759* Cr 0.193 0.872** −0.307 0.800* 0.716* * 相关性在0.05水平上显著;Correlation is significant at the 0.05 level;**相关性在0.001水平上显著. Correlation is significant at the 0.01 level. 2.2 沉积物岩芯重金属的分布特征
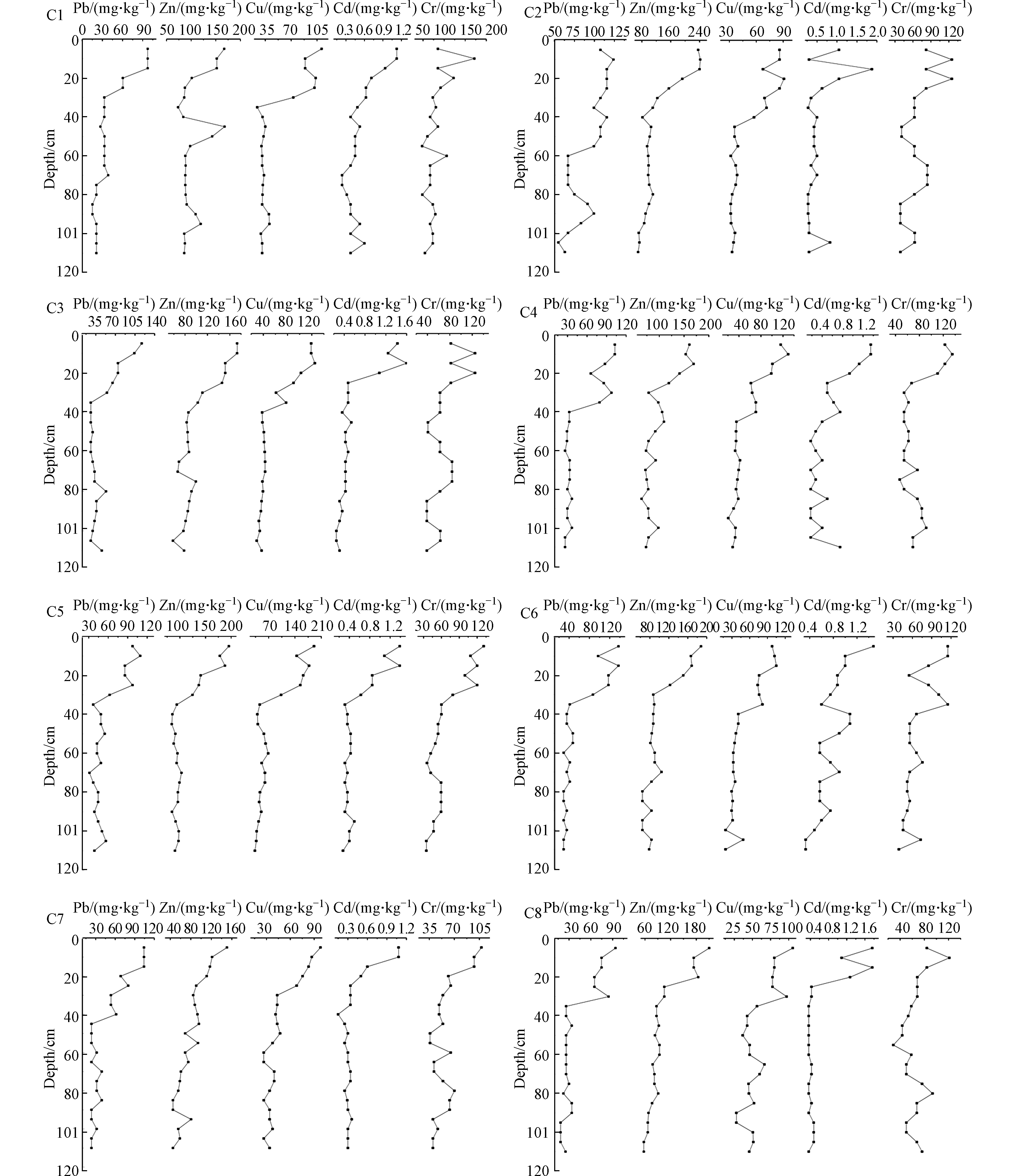
滇池沉积物中Pb、Zn、Cu、Cd、Cr共5种重金属的垂向分布情况如图2所示. 总的来说,30—110 cm的沉积物中重金属的平均浓度近似等于当地土壤的背景水平(国家环保总局,1900年).沉积物岩芯的重金属浓度从30—10 cm明显增加,从10 cm到表层平稳增加. 每个沉积岩芯层段内的重金属含量可以代表某一个时间段内的沉积物重金属污染情况. 通过有关滇池的210Pb和137Cs年代测定[10,27]和滇池沉积物长期的沉积记录来看,0—5 cm的表层沉积物的沉积速率大约为1.40 cm·a−1,5—55 cm的岩芯沉积物的沉积速率约为0.75 cm·a−1,55—110 cm的深层岩芯沉积物的沉积速率为0.26 cm·a−1[27-28].
由此可以判断不同深度的岩芯沉积物的沉积年代,深度在5—10 cm岩芯沉积物大约在21世纪初10年间沉积下来的,而深度在25—30 cm岩心沉积物大约在20世纪70年代沉积下来的,可以推测岩心沉积物的最深层有150多年的历史. 20世纪70年代以来,Pb、Zn、Cu、Cd、Cr的含量上升,对应于10—30 cm的沉积物岩芯. 显然,自20世纪70年代以来,滇池沉积物受到人为源重金属的污染较为严重,这一时期滇池周边地区城市化和工业化的快速发展造成了重金属污染. 此外,研究结果还表明,自2000年以来,这些金属的浓度变化幅度较小,相当于沉积岩芯与表层之间的距离为10 cm.这可能是因为昆明市政府从2003年开始实施环境管理工程,包括调水节水工程、截污工程、河道整治工程、生态修复工程等,农村和农业改良工程、建设工程和生态疏浚工程[29].
2.3 典型野生鱼类重金属污染特征
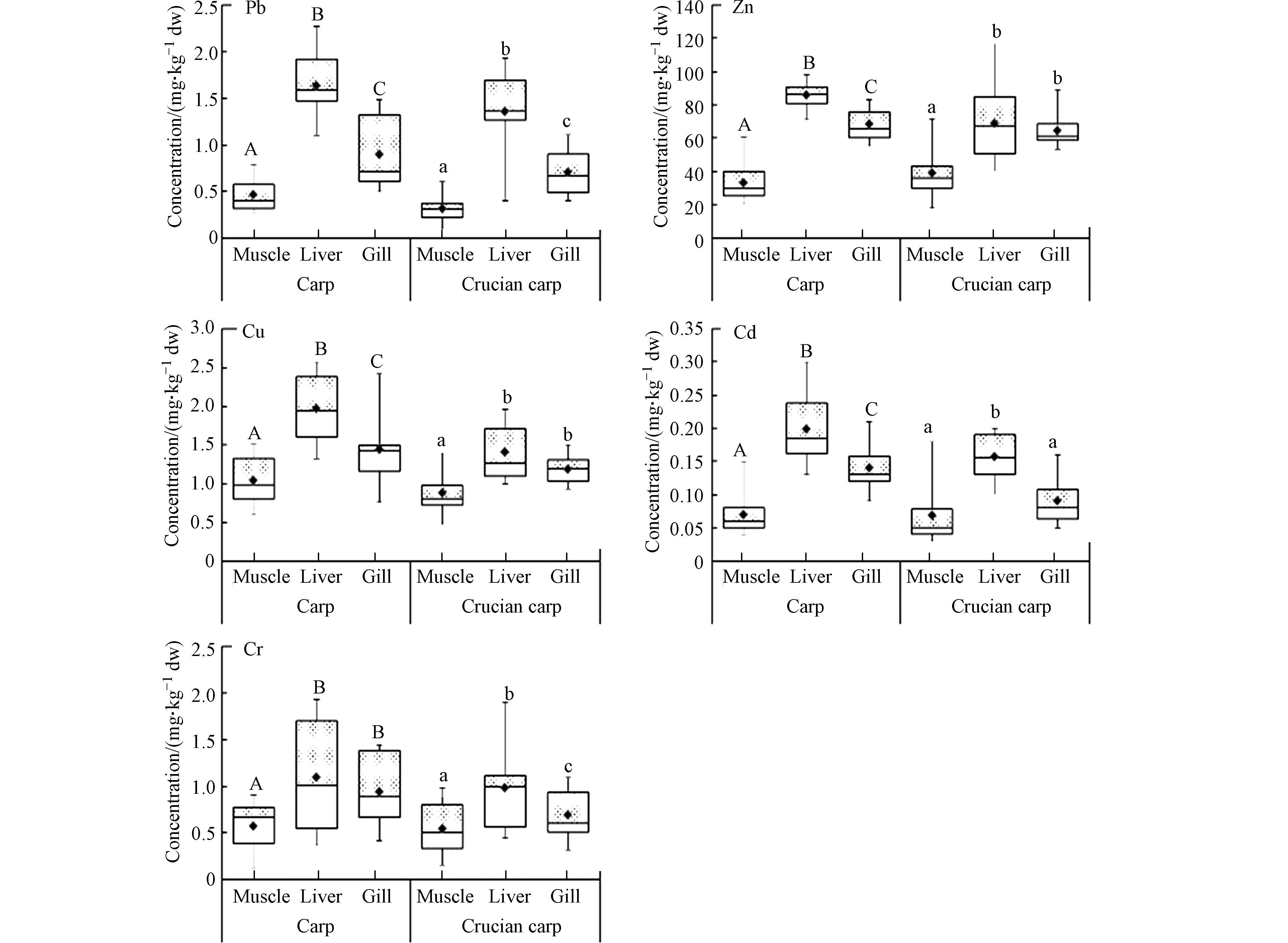
地方野生鱼类中重金属含量分析,点位(F5、12>12.761、P<0.01、ANOVA)和组织(F2、51>7.410、P<0.01、ANOVA)有显著差异,但物种间的差异显著性较低. 鱼类肌肉中重金属的含量如图3所示. 所有金属含量均以干重为基础测定. 靠近济宁工业园区的F4周围3种鱼类肌肉中Pb、Zn、Cu、Cd、Cr含量均显著高于F1、F2、F3、F5和F6.与其他采样点位(F2、F3、F5、F6)相比,采样点F1鱼肌肉中Pb、Zn、Cu的含量显著较高(P<0.05).
根据国家食品安全标准(GB 2762—2012),以样品单位湿重浓度为指标,提出了食品中Zn(GB 13106—91)和Cu(GB 15199—94)的限量标准. 国家食品安全标准规定的Pb、Cd、Cr湿重浓度阈值分别为0.5、0.1、2.0 mg·kg−1,食品中Zn、Cu的限量分别为50、10 mg·kg−1. 分别测定了鱼样品中的水分含量,并测定了鱼肌肉中重金属Pb、Zn、Cu、Cd和Cr的最大湿重浓度,分别为0.12、10.18、0.22、0.02、0.14 mg·kg−1. 所采鱼类Pb、Zn、Cu、Cd、Cr含量均未超过卫生部规定的标准(GB 2762—2012).
具体来说,鱼肌肉中Pb的最低和最高水平分别为:鲫鱼在F2位点的(0.10±0.01) mg·kg−1和鲤鱼在F4位点的(0.78±0.01 )mg·kg−1. 通过对所有鱼类的研究,发现肌肉中Zn(21.79—67.87 mg·kg−1)和Cu(0.48—1.47 mg·kg−1)的含量均高于其他金属,但鱼肌肉中Zn和Cu的含量均低于限值. 所有鱼类品种的肌肉中Cd(0.03—0.16 mg·kg−1)含量均较低. 而距离济宁工业园区最近的F4点,3种特有野生鱼类中Cd含量均比其他点高2—3倍,说明工业废水是造成该区Cd污染的主要原因. 鲤鱼肌肉中Cr含量最低,为(0.13±0.01 )mg·kg−1,银鱼中Cr含量最高,为(0.89±0.15 )mg·kg−1.
在所有采样点,对同一物种(鲤鱼和鲫鱼)的器官(肌肉、肝脏和鳃)进行解剖和收集,以测定Pb、Zn、Cu、Cd和Cr的浓度. 鲤鱼和鲫鱼肝脏、鳃和肌肉中的金属含量分析结果如图4所示. 鲤鱼和鲫鱼组织中重金属含量均无异常值. 其中,相较于其他组织,鱼类(鲤鱼和鲫鱼)肝脏中各种中重金属的平均含量最高,分别为鲤鱼:Pb(1.63±0.32) mg·kg−1、Zn(85.67±7.70 )mg·kg−1、Cu(1.97±0.42) mg·kg−1、Cd(0.20±0.05) mg·kg−1、Cr(1.09±0.54) mg·kg−1,鲫鱼:Pb(1.35±0.45 )mg·kg−1、Zn(68.68±21.23 )mg·kg−1、Cu(1.41±0.35) mg·kg−1、Cd(0.16±0.03 )mg·kg−1和Cr(0.98±0.43) mg·kg−1.从结果上看,鱼类肝脏具有最高重金属含量,可食用部分肌肉中重金属含量最低,而鳃的重金属含量介于肌肉与肝脏中间. 根据研究表明[30],肝脏是重金属最佳的储存器官,且在鲤鱼和鲫鱼各组织中遵循肝脏>鳃>肌肉的平均重金属含量顺序. 鱼鳃作为与水环境直接接触换气的器官,直接接触受污染水体也是导致其含量较高的原因[31]. 此外还发现,鲤鱼中各重金属含量均较高于鲫鱼,可能是由于其不同的生长习性、环境行为以及鱼龄等的差异才导致鲤鱼对于重金属的富集能力强于鲫鱼.
2.4 重金属的生物富集
生物富集是化学物质从周围环境中吸收到生物体中的一个过程. BCF值通常被认为是反映污染物在生物体内富集程度的一个相关指标[32]. 在比较金属吸收顺序时,用BCF值来表示生物富集的结果是具有参考价值的. 表4总结了本研究中鲤鱼、鲫鱼和银鱼肌肉、肝脏和鳃的BCF值. 根据计算结果,这3种鱼类肌肉组织的BCF值最低,其重金属的富集顺序为Zn>Cd>Pb>Cu>Cr.总的来说,滇池鱼类的BCF值均较低,表明滇池鱼类没有受到严重的重金属污染. 但滇池鱼类的金属生物富集受多种因素的影响,需要进一步的研究来解释其生物富集模式的可能机制.
表 4 滇池特有野生鱼类的生物富集因子(BCF, L·kg−1)Table 4. Bioconcentration factors of three wild fishes (BCF, L·kg−1)鱼类Fish species 组织Organ Pb Zn Cu Cd Cr 鲤鱼Carp 肌肉Muscles 2.15 14.10 1.43 5.88 0.79 肝脏Livers 7.59 36.47 2.71 16.66 1.50 鳃Gills 4.159 29.03 1.98 11.76 1.29 鲫鱼Crucian carp 肌肉Muscles 1.46 16.65 1.21 5.79 0.74 肝脏Livers 6.29 29.24 1.94 13.16 1.35 鳃Gills 3.28 27.48 1.63 7.61 0.94 银鱼Silvery minnow 肌肉Muscles 2.00 17.58 1.22 6.55 0.68 2.5 人体健康风险评价
THQ和HI可以为在污染环境中的暴露物提供判断其健康风险水平的信息[33]. 由表5可得知,滇池3种鱼类的HI和THQ均小于1,表明接触者没有明显的健康风险. 综合比较每种鱼类的THQ值看到,Pb和Zn为最高值,且分别占人类健康的31%和39%,Cr为最低值. 这说明,Pb和Zn元素为滇池鱼类对人类健康风险的两种主要贡献者. 3种野生鱼类中Cr元素的THQ值在0.00039—0.00044之间,所以消费这3种野生鱼类的健康风险微乎其微的. 表5显示,鲤鱼、鲫鱼和银鱼的重金属HI值分别为0.376、0.350和0.400.其中,银鱼的HI值略高于鲤鱼和鲫鱼,说明食用银鱼较另两种鱼有更高的非致癌风险. 虽然单个鱼类样品的HI不超过1,但由于重金属的积累和降解抗性. 长期食用这三种鱼类,可能存在一定的非致癌风险. 滇池鱼类重金属积累不可忽视,当其富集程度达到生物毒性水平时,将可能对长期暴露物甚至人群造成一定的健康风险. 本研究所研究的鱼类作为人类饮食的重要组成,为了保证滇池周边居民的健康不受影响,需要加大滇池重金属污染的防治力度.
表 5 3种野生鱼类的目标风险指数(THQ)和风险指数(HI)Table 5. The target risk quotient (THQ) and hazard index (HI) of three wild fish species鱼类Fish species THQPb THQZn THQCu THQCd THQCr HI 鲤鱼Carp 0.135 0.129 0.030 0.082 0.00044 0.376 鲫鱼Crucian carp 0.091 0.152 0.026 0.080 0.00042 0.350 银鱼Silvery minnow 0.125 0.161 0.026 0.088 0.00039 0.400 3. 结论(Conclusion)
在8个滇池水体和表层沉积物采样点中,靠近城市径流和工业园区的点位如C1(晖湾)、C3(罗家营)、C5(大鱼乡)、C8(滇池南)重金属含量均较高,说明人为因素大大影响了重金属含量. C2(宝象)点位的Zn、Cr、Cd均在滇池水体和表层沉积物中体现出最高含量水平,且重金属在水体中的浓度顺序与在表层沉积物中的含量顺序大体一致,均体现为Zn>Cr>Cu>Pb>Cd,这都充分体现了重金属在水体和沉积物之间的相互补充关系. 通过分析滇池8个采样点岩芯沉积物中重金属元素浓度水平及污染特征,得到了重金属元素在滇池污染的历史数据,揭示了滇池重金属污染历史的三个阶段,并发现是由于工业和经济的迅速发展才使得柱状沉积物重金属含量发生变化. 对采集的3种鱼类的肌肉分析中,所检测的5种重金属均没有超过国家规定的限值,并且这3种鱼类重金属的THQ和HI值都小于1,这意味着,人类单一消费其中一种鱼类而摄入的重金属元素对其潜在非致癌性健康风险较低. 鲤鱼和鲫鱼不同组织中重金属的含量也遵循着肝脏>鳃>肌肉的平均重金属含量顺序. 但由于重金属的积累特性可能对人体带来的危害,用有效的措施对滇池进行保护也是刻不容缓的.
-
图 8 不同催化剂在可见光下对Cr6+的光催化还原曲线(a)、动力学拟合曲线(b)、催化剂CNS-2在不同pH条件下对Cr6+的光催化还原曲线(c)和催化剂可见分解水制氢活性(d)
Figure 8. Photocatalytic reduction curves (a), kinetic fitting curves (b) of Cr6+ by different catalysts under visible light, Photocatalytic reduction of Cr6+ by CNS-2 at different pH (c) and H2 evolution activity by visible light water splitting by catalysts (d)
图 9 不同催化剂在可见光下对MO的光催化降解曲线(a)、动力学拟合曲线(b)、催化剂CNS-2对MO的光催化降解活性曲线(c)、CN和CNS-2对MO降解活性稳定性(d)
Figure 9. Photocatalytic degradation curves (a), kinetic fitting curves (b) of MO by different catalysts under visible light, Photocatalytic degradation of MO by CNS-2 (c), degradation activity stability of MO by CN and CNS-2 (d)
表 1 样品合成原料比例
Table 1. Raw materials ratio for samples synthesis
样品Sample CC/mmol DCDA/mmol TPCN/mmol CN 10 7.5 0 CNS-1 10 7 1 CNS-2 10 6.5 2 CNS-3 10 6 3 CNS-4 10 5.5 4 CNS-5 10 5 5 -
[1] WANG X C, MAEDA K, THOMAS A, et al. A metal-free polymeric photocatalyst for hydrogen production from water under visible light [J]. Nature Materials, 2009, 8(1): 76-80. doi: 10.1038/nmat2317 [2] ONG W J, TAN L L, NG Y H, et al. Graphitic carbon nitride (g-C3N4)-based photocatalysts for artificial photosynthesis and environmental remediation: Are we a step closer to achieving sustainability? [J]. Chemical Reviews, 2016, 116(12): 7159-7329. doi: 10.1021/acs.chemrev.6b00075 [3] HE D H, ZHANG C, ZENG G M, et al. A multifunctional platform by controlling of carbon nitride in the core-shell structure: From design to construction, and catalysis applications [J]. Applied Catalysis B:Environmental, 2019, 258: 117957. doi: 10.1016/j.apcatb.2019.117957 [4] COOPER A I. Conjugated microporous polymers [J]. Advanced Materials, 2009, 21(12): 1291-1295. doi: 10.1002/adma.200801971 [5] LI Q, GUO J N, ZHU H, et al. Space-confined synthesis of ZIF-67 nanoparticles in hollow carbon nanospheres for CO2 adsorption [J]. Small (Weinheim an Der Bergstrasse, Germany), 2019, 15(8): e1804874. doi: 10.1002/smll.201804874 [6] HU J, CHEN M, FANG X S, et al. Fabrication and application of inorganic hollow spheres [J]. Chemical Society Reviews, 2011, 40(11): 5472-5491. doi: 10.1039/c1cs15103g [7] LIU Z Y, BAI H W, SUN D. Facile fabrication of hierarchical porous TiO2 hollow microspheres with high photocatalytic activity for water purification [J]. Applied Catalysis B:Environmental, 2011, 104(3/4): 234-238. [8] SUN J H, ZHANG J S, ZHANG M W, et al. Bioinspired hollow semiconductor nanospheres as photosynthetic nanoparticles [J]. Nature Communications, 2012, 3: 1139. doi: 10.1038/ncomms2152 [9] LUO L, MA J N, ZHU H X, et al. Embedded carbon in a carbon nitride hollow sphere for enhanced charge separation and photocatalytic water splitting [J]. Nanoscale, 2020, 12(13): 7339-7346. doi: 10.1039/D0NR00226G [10] NIU H J, CHEN H Y, WEN G L, et al. One-pot solvothermal synthesis of three-dimensional hollow PtCu alloyed dodecahedron nanoframes with excellent electrocatalytic performances for hydrogen evolution and oxygen reduction [J]. Journal of Colloid and Interface Science, 2019, 539: 525-532. doi: 10.1016/j.jcis.2018.12.066 [11] CUI Y J, LI M, WANG H, et al. In-situ synthesis of sulfur doped carbon nitride microsphere for outstanding visible light photocatalytic Cr(Ⅵ) reduction [J]. Separation and Purification Technology, 2018, 199: 251-259. doi: 10.1016/j.seppur.2018.01.037 [12] LI M, ZHANG S B, LIU X, et al. Polydopamine and barbituric acid co-modified carbon nitride nanospheres for highly active and selective photocatalytic CO 2 reduction [J]. European Journal of Inorganic Chemistry, 2019, 2019(15): 2014. doi: 10.1002/ejic.201900366 [13] ZHANG J S, ZHANG M W, LIN S, et al. Molecular doping of carbon nitride photocatalysts with tunable bandgap and enhanced activity [J]. Journal of Catalysis, 2014, 310: 24-30. doi: 10.1016/j.jcat.2013.01.008 [14] ZHANG Y L, REN C J, ZHANG Y F, et al. Improvement of photocatalytic activity of g-C3N4 by five-membered heterocyclic small molecule modifications: A theoretical prediction [J]. Applied Surface Science, 2019, 478: 119-127. doi: 10.1016/j.apsusc.2019.01.128 [15] WANG R R, YANG P J, WANG S B, et al. Regulating morphological and electronic structures of polymeric carbon nitrides by successive copolymerization and stream reforming for photocatalytic CO2 reduction [J]. Catalysis Science & Technology, 2021, 11(7): 2570-2576. [16] CUI Y J, TANG Y B, WANG X C. Template-free synthesis of graphitic carbon nitride hollow spheres for photocatalytic degradation of organic pollutants [J]. Materials Letters, 2015, 161: 197-200. doi: 10.1016/j.matlet.2015.08.106 [17] ZHANG F, ZHANG J H, WANG H F, et al. Single tungsten atom steered band-gap engineering for graphitic carbon nitride ultrathin nanosheets boosts visible-light photocatalytic H2 evolution [J]. Chemical Engineering Journal, 2021, 424: 130004. doi: 10.1016/j.cej.2021.130004 [18] ZHU Y X, CUI Y J, XIAO B B, et al. Z-scheme 2D/2D g-C3N4/Sn3O4 heterojunction for enhanced visible-light photocatalytic H2 evolution and degradation of ciprofloxacin [J]. Materials Science in Semiconductor Processing, 2021, 129: 105767. doi: 10.1016/j.mssp.2021.105767 [19] LIU S H, SONG X Z, LIU G C, et al. Synthesis of hollow donut-like carbon nitride for the visible light-driven highly efficient photocatalytic production of hydrogen and degradation of pollutants [J]. New Journal of Chemistry, 2020, 44(28): 12247-12255. doi: 10.1039/D0NJ02244F [20] ZHU K, OU-YANG J, ZENG Q, et al. Fabrication of hierarchical ZnIn2S4@CNO nanosheets for photocatalytic hydrogen production and CO2 photoreduction [J]. Chinese Journal of Catalysis, 2020, 41(3): 454-463. doi: 10.1016/S1872-2067(19)63494-7 [21] XU X L, ASHER S A. Synthesis and utilization of monodisperse hollow polymeric particles in photonic crystals [J]. Journal of the American Chemical Society, 2004, 126(25): 7940-7945. doi: 10.1021/ja049453k [22] ZHENG D D, PANG C Y, LIU Y X, et al. Shell-engineering of hollow g-C3N4 nanospheres via copolymerization for photocatalytic hydrogen evolution [J]. Chemical Communications, 2015, 51(47): 9706-9709. doi: 10.1039/C5CC03143E [23] DEIFALLAH M, MCMILLAN P F, CORÀ F. Electronic and structural properties of two-dimensional carbon nitride graphenes [J]. The Journal of Physical Chemistry C, 2008, 112(14): 5447-5453. doi: 10.1021/jp711483t [24] PRAKASH K, SELVAM V, BABU S G, et al. Rational design of novel 3D flower-like praseodymium molybdate anchored graphitic carbon Nitride: An efficient and sustainable photocatalyst for mitigation of carcinogenic pollutants [J]. Applied Surface Science, 2021, 569: 151104. doi: 10.1016/j.apsusc.2021.151104 [25] 郭桂全, 胡巧红, 王承林, 等. g-C3N4/RGO的制备、光催化降解性能及其降解机理 [J]. 环境化学, 2021, 40(3): 808-817. doi: 10.7524/j.issn.0254-6108.2019092605 GUO G Q, HU Q H, WANG C L, et al. Preparation, photocatalytic degradation performance and degradation mechanism of g-C3N4/RGO [J]. Environmental Chemistry, 2021, 40(3): 808-817(in Chinese). doi: 10.7524/j.issn.0254-6108.2019092605
[26] KUMAR S, KAUSHIK R D, PUROHIT L P. ZnO-CdO nanocomposites incorporated with graphene oxide nanosheets for efficient photocatalytic degradation of bisphenol A, thymol blue and ciprofloxacin [J]. Journal of Hazardous Materials, 2022, 424: 127332. doi: 10.1016/j.jhazmat.2021.127332 -








 下载:
下载: