-
氟污染是一个全球性问题,特别是在发展中国家[1],其中钢铁冶金、铝电解、铅锌冶炼、铜冶炼、光伏产业、锂离子电池等冶金行业是氟污染的主要来源[2]。过量摄入氟化物将会对人体产生有害影响,阻碍儿童生长发育[3]。我国对地表水体及生活饮用水中的氟化物质量浓度有严格的限值,也不断强化关于氟化物排放的管控。目前,水体中氟化物的去除技术主要有沉淀絮凝法、膜处理法、离子交换法、吸附法[4-7],其中吸附法具有产生无害废物数量少、材料成本低、操作简便等优点,被认为是最有前途的除氟方法。
生物炭具有较大的比表面积,表面含有丰富的含氧官能团,且相对廉价,可作为新型吸附材料用于环境修复领域[8-9]。近年来,已有关于不同生物质来源(改性)生物炭除氟应用的研究报道。汤家喜等[10]利用花生壳、玉米秸秆制备的生物炭,最大吸附容量为1.18 mg·g−1;邱会华等[11]制备的氢氧化钾活化的荷叶基生物炭,最大吸附容量为0.85 mg·g−1;张涛等[12]制备了铁改性猪粪生物炭,最大吸附容量为4.4 mg·g−1;徐凌云等[13]制备了铝负载酒糟生物炭,最大吸附容量为18.05 mg·g−1;FENG等[14]利用城市污水处理厂污泥合成的改性污泥生物炭最大吸附容量高达30.49 mg·g−1。显然,不同原料衍生的生物炭吸附除氟能力不尽相同,其中由于污泥含有更高含量的亲氟矿物,其衍生的污泥生物炭对氟的吸附能力最强。但是,未经改性的污泥生物炭直接除氟效果并不理想,一般需要通过铝、铁等金属的负载以提高其吸附性能。近年来发现镧[15]、铈[16]、钇[17]等稀土金属有更好的亲氟性,可用于氟化物的去除,但是单独使用成本较高,如与铁或铝复合使用,有望发挥协同作用并降低成本。另外,我国污泥产量巨大,据统计2021年我国含水率80%的城市污泥产量已超过6 000×104 t[18]。当前污泥的主流处置方式包括干化焚烧、污泥堆肥和卫生填埋,都可能产生二次污染,对环境造成巨大的风险[19-20]。因此,研发基于污泥生物炭的复合改性除氟材料,拓展污泥资源化利用途径,实现以废治废,具有较好的开发前景。
本研究以南通市政污泥为原料,通过缺氧热解-醋酸钾活化-铝铈改性工艺,制备了铝铈改性污泥生物炭(Al/Ce-CSBC),运用SEM、EDS、BET、XRD及XPS等技术对材料吸附前后的表面形态和结构特征进行了表征和分析,探究了Al/Ce-CSBC对模拟废水中氟离子的吸附行为和吸附机理,以期为污泥生物炭在除氟的资源化利用研究提供参考。
-
干化污泥来自南通市某污水处理厂,在90 ℃鼓风干燥箱中干燥12 h后,粉碎过50目筛备用。所用试剂包括六水合氯化铝(AlCl3·6H2O)、七水合氯化铈(CeCl3·7H2O)、氟化钠(NaF)、醋酸钾(CH3COOK)、氢氧化钠(NaOH)等均为分析纯。准确称取2.21 g干燥的氟化钠粉末溶解在1 000 mL去离子水中,配置成氟离子质量浓度为1 g·L−1的储备液,移取适量储备液用去离子水稀释,配成一定初始氟离子质量浓度的含氟模拟废水。
-
污泥的热解制备生物炭。称取5.00 g经干燥的污泥粉末置于坩埚中,用锡纸包裹,放入马弗炉中以10 ℃·min−1的速度升至650 ℃,并保持温度1 h。将热解后的污泥与醋酸钾按质量比1:2的比例混合,再次放入马弗炉中以10 ℃·min−1的速度升至650 ℃热解1 h,离心洗涤3次,并在80~90 ℃下干燥8 h。第1次热解污泥生物炭产物产量为3.21 g,记为SBC;与醋酸钾混合的第2次热解产物产量为4.29 g,记为CSBC。
生物炭的金属改性。将事先称取的1.00 g CSBC加入体积总量为50 mL的氯化铝(0.10 mol·L−1)、氯化铈(0.05 mol·L−1)或两者的等体积混合溶液中,磁力搅拌2 h,用1.00 mol·L−1氢氧化钠溶液调节溶液pH至7.5,搅拌12 h。离心洗涤3次,最后在80~90 ℃下干燥8 h得到改性污泥生物炭材料。对铝、铈以及铝铈联合改性的污泥生物炭分别命名为Al-CSBC、Ce-CSBC以及Al/Ce-CSBC,其中Al/Ce-CSBC的产量为1.29 g。
-
利用扫描电子显微镜(SEM)(Gemini SEM 300,德国)分析样品的表面形态;利用能谱仪(EDS)分析样品表面的元素;采用比表面积及孔径分析仪(ASAP2460,美国)分析样品的比表面积和孔容孔径;采用X射线粉末衍射仪(XRD)(Ultima IV,日本)分析样品的物相组成及结构;采用X射线光电子能谱仪(XPS)(K-Alpha+,美国)用于确定生物炭表面的成分和价态。
-
准确称取0.04 g吸附剂(Al/Ce-CSBC)置于离心管中,加入40 mL 氟离子质量浓度为10 mg·L−1的模拟废水,立刻移至恒温振荡箱中以140 r·min−1的速度振荡20 h,过0.45 μm滤膜后,用氟离子选择电极(PXSJ-216F)测量滤液中氟离子的质量浓度,每次实验重复3次。pH影响实验只改变pH(3.0~10.0),其余参数不变。吸附等温线实验改变氟离子初始质量浓度(5~100 mg·L−1),采用Langmuir模型和Freundlich模型对实验数据进行拟合。
吸附动力学实验在盛有2 000 mL氟离子初始质量浓度10 mg·L−1溶液的烧杯中进行,调节并保持溶液pH为6.0,将2.00 g吸附剂加入其中后开始磁力搅拌,至规定时间抽取20 mL混合液过滤,测量滤液中氟离子的质量浓度。采用Lagergren伪一阶、伪二阶模型以及Weber-Morris模型对实验数据进行拟合。
-
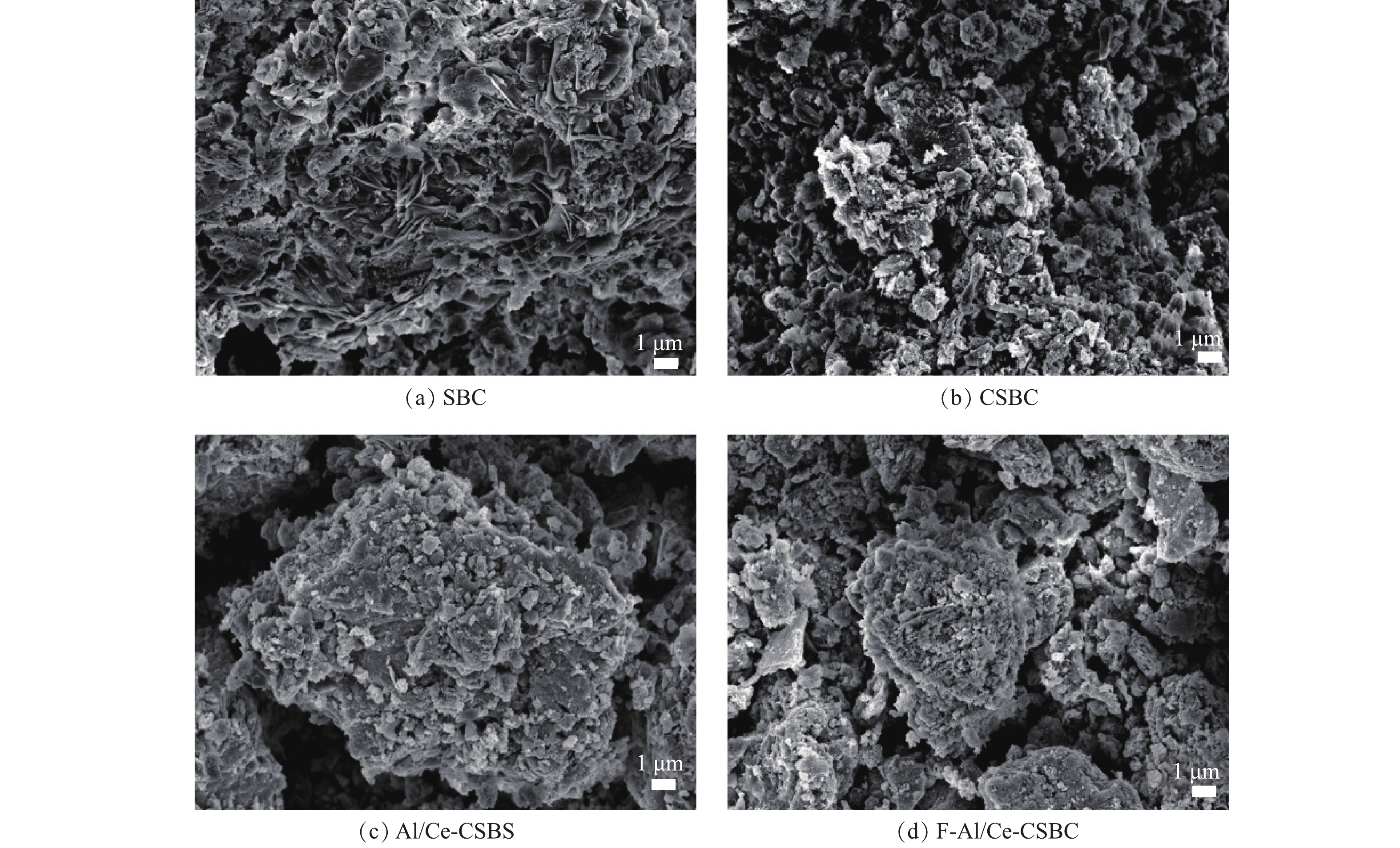
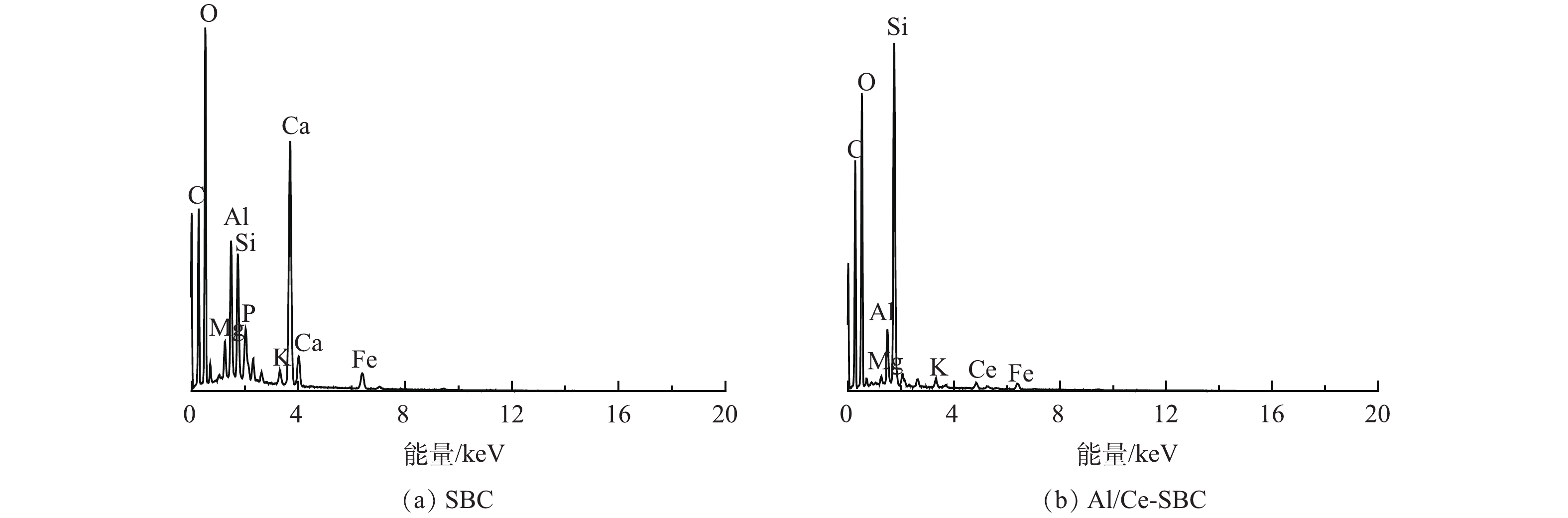
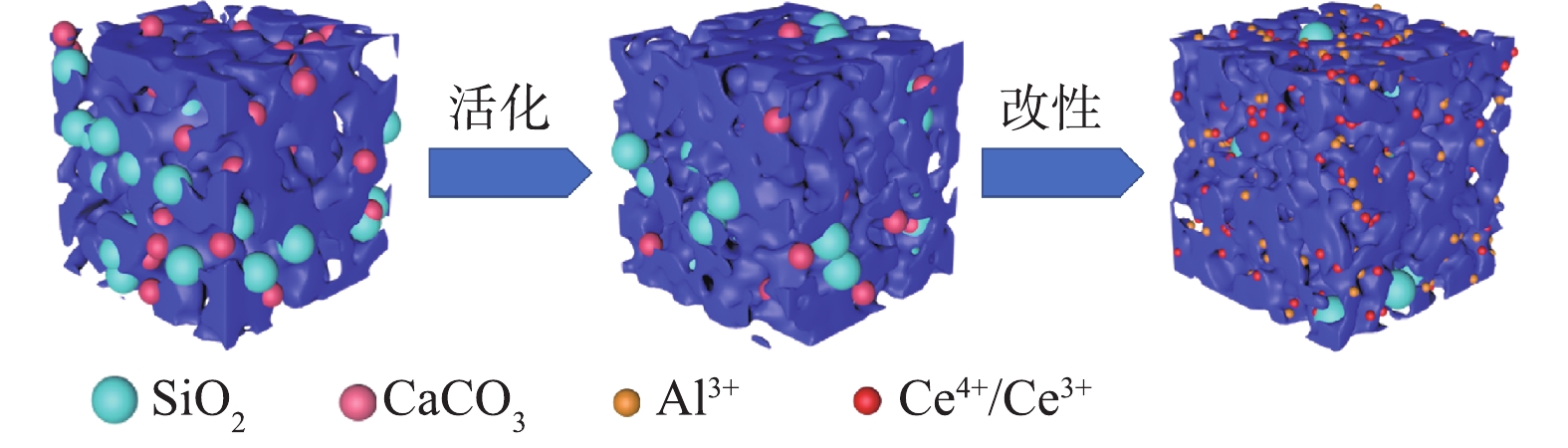
图1为SBC、CSBC、Al/Ce-CSBC及吸附后的复合负载改性材料(F-Al/Ce-CSBC)的SEM图像。SBC表面呈现片状和层状结构,经醋酸钾活化后的CSBC表面呈现堆砌的颗粒状结构,经改性后的Al/Ce-CSBC表面呈块状且附着颗粒状结构,吸附后的F-Al/Ce-CSBC与Al/Ce-CSBC表面形态区别不大。图2为SBC和Al/Ce-CSBC的EDS图谱,SBC的表面元素主要为O、C、Ca及Fe,Al/Ce-CSBC的表面元素主要为C、O、Si和Ce。由表1可见,相对于SBC,Al/Ce-CSBC表面C和Ce的含量有所增加,O和Ca的含量有所降低。前者表明Ce的成功负载以及通过醋酸钾活化引入了大量的碳;后者与金属矿物组分的溶解损失有关,其中Ca的损失最严重,其含量从SBC的16.4%降至改性后的0.2%,几乎完全消失。
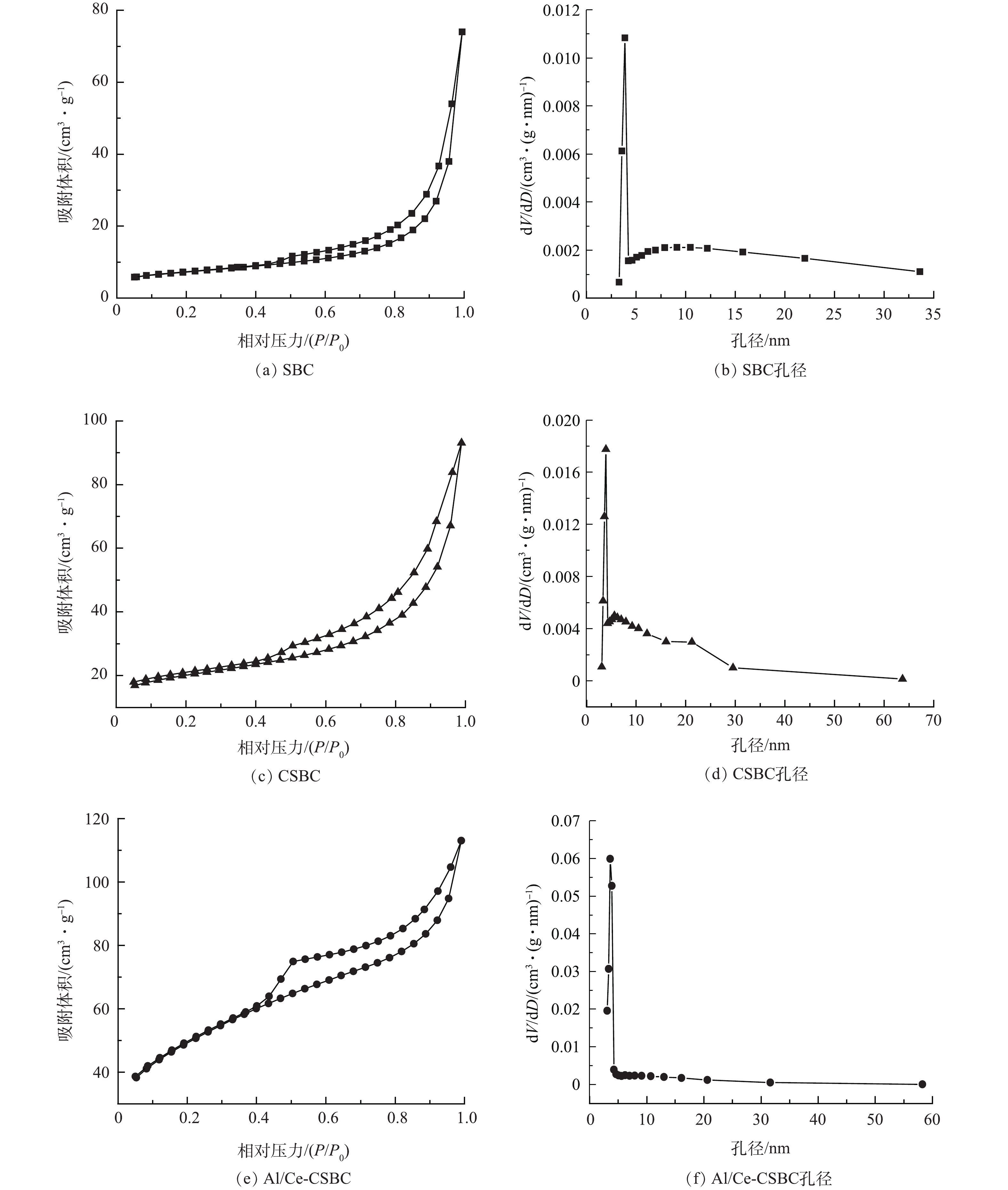
从图3(a)、图3(c)和图3(e)的N2吸附/脱附等温线可以看出,3种样品等温线都属于IV类,且具H3型回滞环特征,表明样品内部存在丰富狭缝形介孔。图3((b)、图3(d)和图3(f))的孔径分布结果表明,经醋酸钾活化和复合负载改性后的CSBC及Al/Ce-CSBC材料孔径分布更呈多样化,但尖锐峰向更小孔径方向移动,其平均孔径应减小,这在表2中得到验证。由表2可见,SBC经活化和改性后,平均孔径变小,但孔容和比表面积有所增大。比表面积由原来的25.59 m2·g−1增至活化后的69.78 m2·g−1及改性后的176.36 m2·g−1,平均孔径则相应由13.4 nm降至11.4 nm和6.6 nm。活化和改性均能显著增加比表面积,可能是由于醋酸钾在活化过程中分解产生大量的CO2,以及改性溶液中酸溶解样品中大量的CaCO3,使得生物炭片层开裂,暴露出更多更小孔径的介孔。
图4(a)为SBC、CSBC、Al/Ce-CSBC和F-Al/Ce-CSBC的XRD图谱。其中SBC中含有明显的SiO2和CaCO3的衍射峰,CSBC中SiO2和CaCO3的峰强明显下降,表明该矿物组分的部分消溶,可能是醋酸钾活化促进了SiO2和CaCO3在高温的消溶/蚀刻反应,进而形成较小的孔隙和较大的比表面积。改性后的Al/Ce-CSBC中CaCO3的衍射峰则完全消失,可能是改性过程引入的金属盐水解产生强酸,使得残留的CaCO3被进一步完全溶解,形成更小的孔隙和更大的比表面积,这与前述关于Ca元素及孔隙的变化相一致。相对于SBC,CSBC和Al/Ce-CSBC中的SiO2的峰强均有不同程度的降低,表明活化和改性对SiO2也有一定的消溶作用。由Al/Ce-CSBC的XRD图谱可知,改性污泥生物炭有SiO2及少量的Al2SiO5晶体,前者是污泥自有残留,后者应为溶出的硅与改性引入的铝反应的产物,此外并没有出现铝和铈的其他晶体结构,表明改性金属主要以无定形负载于污泥生物炭的表面。除了二氧化硅晶体峰强度有略微降低,吸附氟后材料(F-Al/Ce-CSBC)的XRD图谱与吸附前基本一致,表明材料中的晶体结构稳定,推测其不参与对氟的吸附过程,无定形双金属羟基/氧化物应是主要吸附活性组分。由XPS图谱(图4(b))可知,SBC在346.89 eV处有较强的Ca2p信号,在CSBC相对减少,在Al/Ce-CSBC及F-Al/Ce-CSBC则完全消失,趋势与XRD一致,再次验证了碳酸钙的逐步溶解至完全消失的过程。Al/Ce-CSBC的XPS图谱中74.97 eV和885.72 eV处的峰分别对应Al2p和Ce3d,表明铝和铈的成功负载,这与EDS和XRD的结果一致。
图5较直观地显示了上述活化和改性过程的物性变化,即活化过程促进污泥生物炭中二氧化硅和碳酸钙晶体部分消溶,同时醋酸钾发生气化反应,产生造孔作用[21],使得CSBC的比表面积增大(表2);改性过程铝铈被成功负载,碳酸钙完全消失,形成更多的细小孔径,造孔作用更明显,比表面积增加更显著,而少量二氧化硅溶解后与铝(Ⅲ)形成硅酸铝晶体。
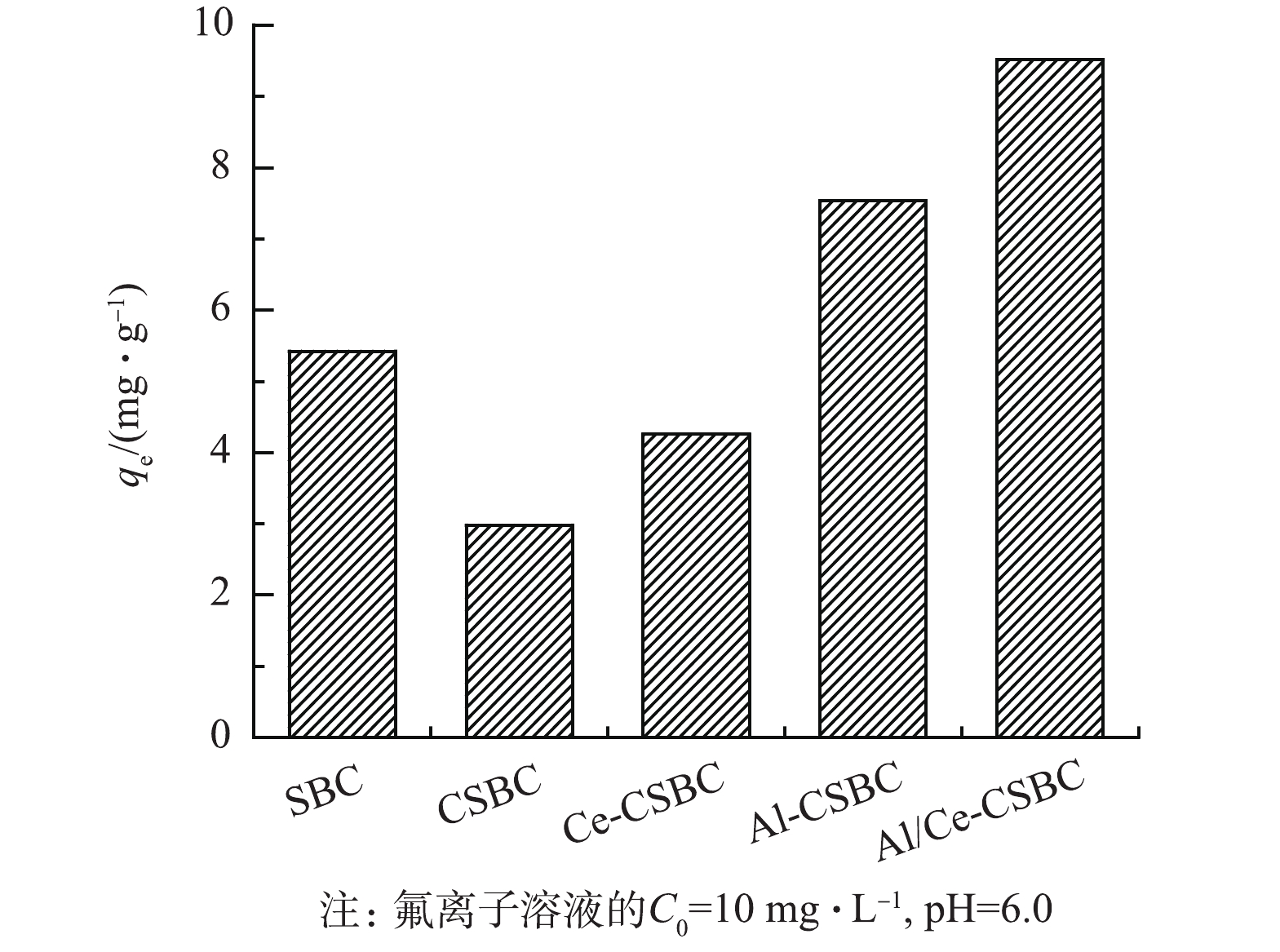
不同合成阶段和金属改性的材料对F−的吸附容量如图6所示,原始污泥生物炭SBC的吸附容量为5.42 mg·g−1,经醋酸钾活化后得CSBC的吸附容量则下降至2.90 mg·g−1,可能是SBC经活化后,部分有利于除氟的矿物(主要是含Ca矿物)溶解流失所致。CSBC再经金属改性后的吸附容量均有提升,但不同金属/金属组合改性提升程度不同,单一的Ce和Al改性使材料吸附容量分别提升了44%和157%,而Al-Ce联合改性则提升了228%,高于2种单一金属改性材料提升量之和,这表明铝铈双金属改性发挥了协同作用。
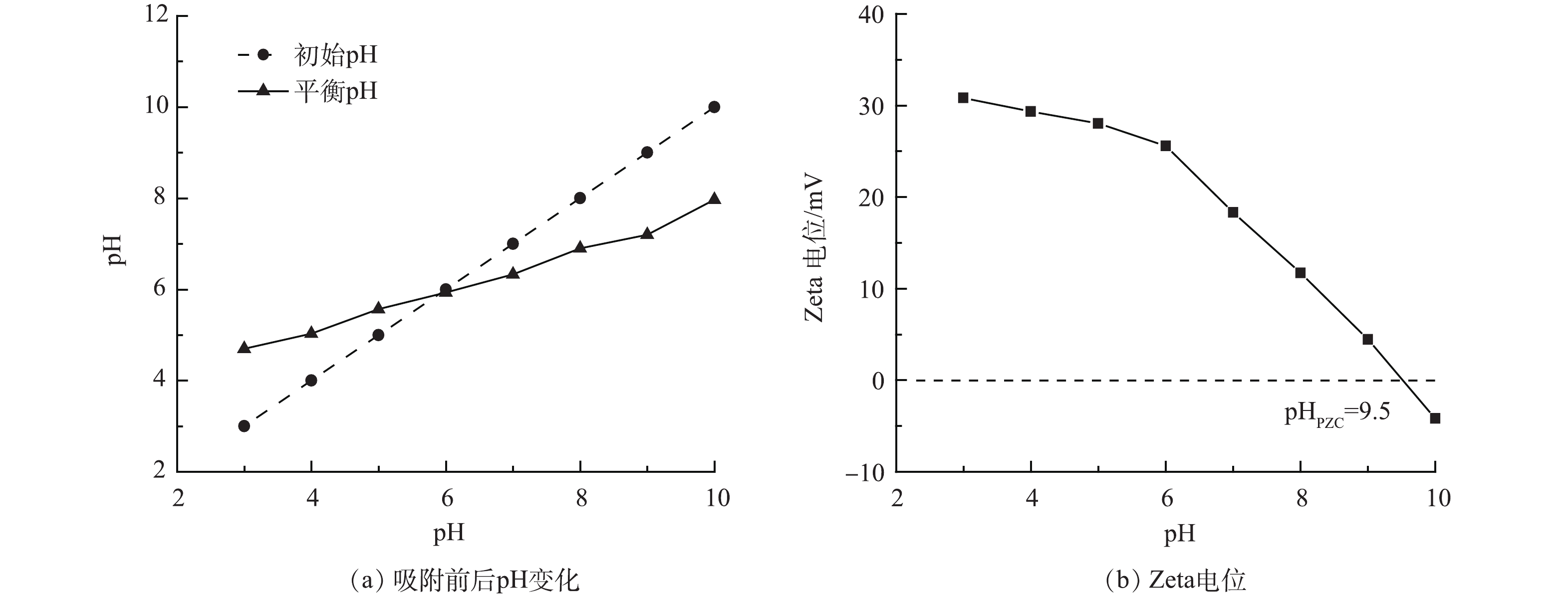
-
pH对Al/Ce-CSBC材料的吸附影响如图7所示,在氟离子初始质量浓度为10 mg·L−1,在酸性范围内,吸附容量随着pH的增加逐渐升高,在pH=6.0时达到最高值9.43 mg·g−1,随后随着pH的增加而逐渐降低,pH升至9.0以上,则急剧下降,其除氟率也有类似规律。Al/Ce-CSBC在溶液pH=4.0~9.0内均有75%以上的除氟率,这是由于生物炭的分散作用,将更多的活性位点充分暴露,使得其有更宽的pH适用范围[22]。同时考察了该体系吸附前后的pH变化,其结果见图8(a)。当pH<6.0时,吸附平衡后的pH有所升高,反之则有所降低,表明Al/Ce-CSBC吸附材料具有一定的pH缓冲作用,FENG等[14]研究其他氧化铝材料也有类似结果,认为该缓冲作用由铝盐的两性性质引起,具体表现为固态金属氧化物表面水解羟基化和质子化作用,详见后文机理分析部分。图8(b)为不同pH下Al/Ce-CSBC的Zeta电位变化。由图可见,该材料的零电位点(pHPZC)高达9.5,表明吸附剂在一定的碱性范围仍带正电荷,可能是因为Al/Ce-CSBC的比表面积较大,具有较好分散性,使得其表面正电荷得到较好维持和保护[22]。在pH<7.0时溶液中含有大量的H+,使得吸附剂表面发生质子化,体系Zeta电位为正值,能够与溶液中的F−发生静电吸附,但过低的pH可能造成吸附剂表面负载的金属氧化物溶解,并有HF的生成,使吸附剂的吸附容量下降。在pH>7.0时,溶液中的OH−会与F−竞争吸附位点,使吸附容量有所下降。在pH=10.0时,吸附容量和除氟率下降更明显,其原因除了前述的竞争吸附,还由于吸附剂表面此时逆转为荷负电,对溶液中的F−产生强烈的静电排斥作用。
-
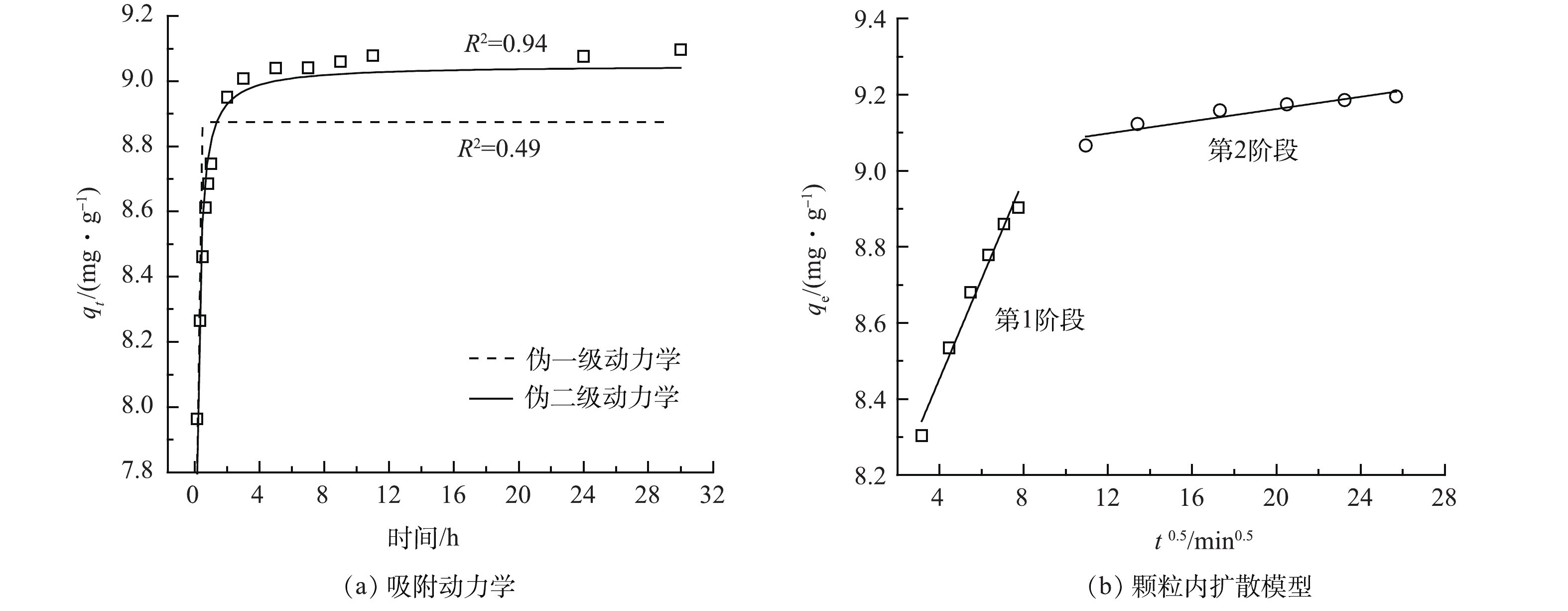
在氟离子初始质量浓度为10 mg·L−1时,Al/Ce-CSBC的吸附容量随吸附时间的变化情况如图9所示。在前期吸附速率较快,10 min内吸附容量达到了8.30 mg·g−1;随后缓慢增加,在5 h时接近平衡状态。
对吸附动力学数据的拟合结果表明,伪二级模型(R2=0.94)比伪一级模型(R2=0.49)更适合描述Al/Ce-CSBC对氟离子的吸附,表明氟化物在Al/Ce-CSBC上的吸附以化学吸附为主。颗粒内扩散模型如图9(b)所示。吸附反应可分为2个阶段,第1阶段,F−通过界面膜扩散从液相水体转移到Al/Ce-CSBC的表面,并与表面大量的吸附位点结合产生快速吸附,这一阶段膜扩散是控制吸附速率的限制步骤;第2阶段,由于大量的F−占据了吸附剂表面的吸附位点,部分F−将渗透到吸附剂内部的孔径中,因此又被称为孔扩散阶段,第2阶段速率有所降低,该图没有通过原点表明颗粒内扩散不是唯一限速步骤[23]。
-
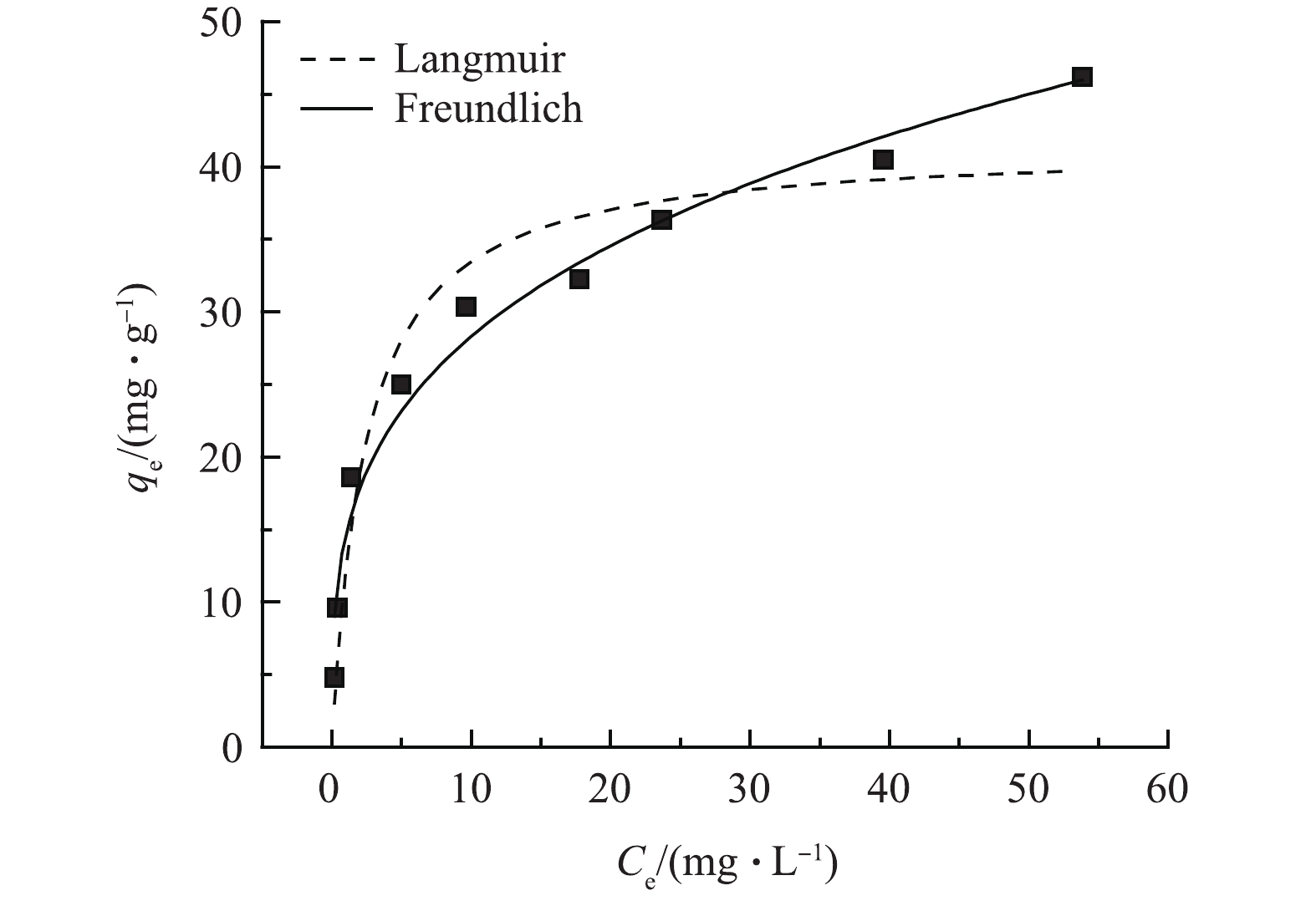
在常温且pH=6.0的条件下,Al/Ce-CSBC的吸附容量随氟离子初始质量浓度变化情况如图10所示。2种模型均能较好描述吸附过程,但Freundlich模型(R2=0.97)较Langmuir模型(R2=0.92)拟合程度更好,表明氟化物在Al/Ce-CSBC上的吸附以多层吸附为主,且Al/Ce-CSBC表面上的活性位点不均匀,1/n =0.29 (0<1/n<1)也表明吸附等温线类型是理想类型[24]。Langmuir模型中最大吸附容量41.47 mg·g−1,其与实际最大吸附容量45.66 mg·g−1相近。
-
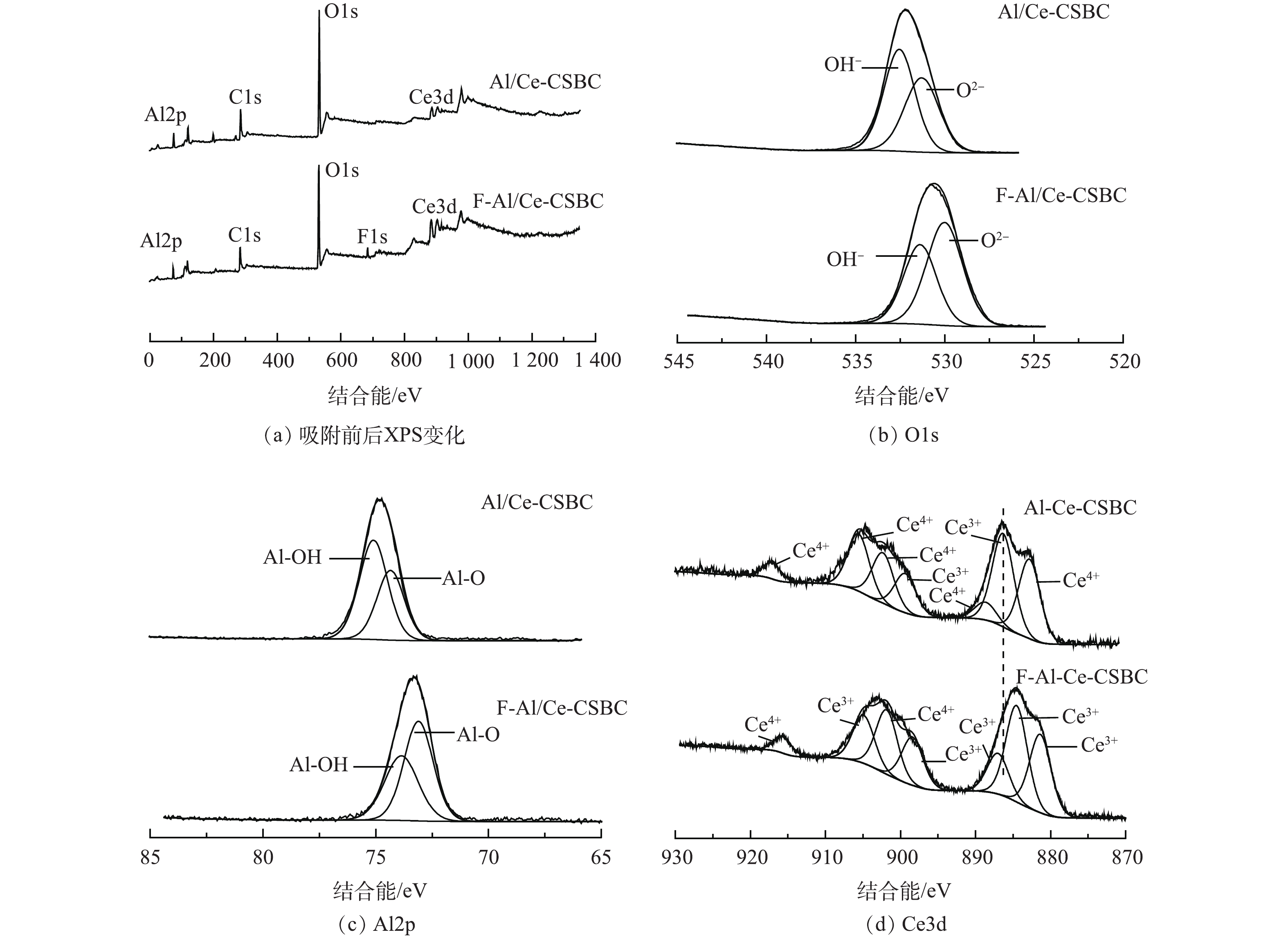
图11(a)为Al/Ce-CSBC材料的XPS全谱图,通过吸附前后的比较发现,吸附后的F-Al/Ce-CSBC在684.15 eV处新增了F1s的峰,表明氟离子被成功吸附在Al/Ce-CSBC吸附剂表面。为了研究其吸附机理,进一步分析了Al/Ce-CSBC吸附氟前后的XPS精细光谱(图11(b)~(d))。由图11(b)的O1s图谱中可见,吸附前531.28 eV和532.54 eV处的特征峰分别对应M―O和―OH,吸附后分别移至530.01 eV和531.39 eV,其中羟基氧占总氧的相对比率由吸附前的55.24%降至41.52%,金属氧化物中M―O的含量由吸附前的44.76%升至58.48%,表明―OH参与了与氟离子的交换。这与其他研究[25-26]结果一致。由图11(c)的Al2p图谱可见,74.46和75.17 eV处峰分别对应Al―O和Al―OH,均归属于负载于材料表面的无定形铝氧化物结构,吸附后峰位置分别移至73.10 eV和73.69 eV。这表明铝羟基/氧化物参与了氟离子的吸附[27-28]。吸附前后Ce元素XPS结果如图11(d)所示。Al/Ce-CSBC的Ce3d5/2的4个代表性峰位于882.78、886.30、888.64及899.35 eV,Ce3d3/2的3个代表性峰位于902.32、905.56及917.10 eV,以上7个峰吸附后分别移至881.34、884.50、886.98、898.37、901.83、904.88及915.65 eV,可清楚地观察到向低能方向位移。经计算Ce4+丰度由吸附前的36.51%下降到22.28%,说明F―Ce络合物的形成及电子转移[16, 29]。
基于上述对氟化物吸附过程pH的变化、等温线模型、动力学模型以及XPS表征分析结果,认为Al/Ce-CSBC对氟化物的吸附为物理吸附和化学吸附,其中化学吸附包括离子交换和表面络合占主导作用。改性过程中形成大量带正电荷的金属羟基/氧化物,且以无定形形式非均匀分散于污泥生物炭的表面,产生大量有效吸附位点并处于相对受保护的高分散体系中,使其表现出较高的零电荷点[22]和酸碱缓冲特性[14]。在碱性条件下产生大量的表面羟基和O2−,并带负电荷(式(1)~式(2));酸性条件下则质子化并带正电荷(式(3))。
在酸性条件下吸附剂表面的Zeta电位较高,对溶液中氟离子产生较强静电吸引,进一步引起式(4)反应,产物以金属氟化络合物形式结合在吸附剂表面,表现很高的吸附量和吸附能力,但是酸性过低时,氟主要以氟化氢形式存在,兼吸附剂表面金属的溶出,使得吸附容量下降;随着溶液pH的增加,吸附剂表面的Zeta电位降低,静电吸引减弱,超过零电点后吸附剂表面荷负电产生静电排斥,此时吸附以离子交换为主(式(5))。
-
通过与其他文献报道的吸附剂除氟性能的比较(表3),本研究使用的Al/Ce-CSBC有明显的相对优势。Al/Ce-CSBC最大吸附容量为41.47 mg·g−1,高于其他材料的吸附量,包括传统活性氧化铝(16.30 mg·g−1)、双金属和三金属复合材料(27~32 mg·g−1)、其他改性生物炭材料(18~28 mg·g−1)以及铝铁改性污泥生物炭材料(30 mg·g−1)。就酸碱适用性而言,Al/Ce-CSBC在较广的范围(pH=4.0~9.0)内均有75%以上的去除率,其他材料(除了三元金属复合材料)则类似传统的活性氧化铝,只能在较窄的酸性范围才有较高的除氟率。因此,铝铈改性污泥生物炭在较广的酸碱范围有较好的强化除氟作用,并可实现污泥的低碳固定和以废治废,在实际废水处理中有潜在应用价值。
-
1)以市政污泥为原料,通过热解-活化-双金属改性成功制备了铝铈负载污泥生物炭Al/Ce-CSBC,活化和改性均可通过造孔和促消溶作用增加材料比表面积和分散性,使负载的无定形金属羟基/氧化物保持吸附活性,材料具较高的等电点和酸碱缓冲性;
2) Al/Ce-CSBC对氟的最大吸附容量达到41.74 mg·g−1,在pH=4.0~9.0内均有较高的除氟率。其吸附动力学符合伪二级模型,吸附等温线符合Freundlich模型,为多层不均质吸附和化学吸附,其吸附机制包括静电吸附、表面络合和离子交换。
3) Al/Ce-CSBC可发挥铝铈双金属协同吸附作用,且在较广的酸碱范围有较好的强化除氟作用。该吸附材料制备简单、廉价,有望实现以废治废和污泥的低碳固定,有潜在的应用价值。
负载铝铈污泥生物炭对模拟废水的强化除氟作用
Enhanced fluoride removal from simulated wastewater by aluminum-cerium loaded sludge biochar
-
摘要: 以市政污泥为原料,通过热解、活化及共沉淀工艺制备了铝铈负载污泥生物炭复合材料(Al/Ce-CSBC),运用多种分析技术表征了材料形貌、比表面积及结构特征,通过模拟废水的批量吸附实验,考察了pH、初始氟离子质量浓度及吸附时间对Al/Ce-CSBC吸附氟性能的影响,最后探究了其除氟机制。结果表明,活化和改性均提高污泥生物炭的比表面积,其中Al/Ce-CSBC具有丰富的狭缝形介孔,比表面积为176.36 m2·g−1,pHPZC为9.5。负载于材料表面的无定形铝/铈氧化物是主要吸附组分,且发挥了双金属协同作用,在pH=4.0~9.0内其可保持较高的吸附容量。吸附动力学符合伪二级模型,吸附等温线符合Freundlich模型。最大吸附容量可达到41.74 mg·g−1,显著优于其他常见生物炭材料。其吸附机理主要包括静电吸附、离子交换和表面络合。本文可为污泥的资源化利用提供重要的参考。Abstract: In this study, sewage sludge was taken as raw material, and a novel Al/Ce loaded sludge biochar composite (Al/Ce-CSBC) was prepared by pyrolysis, activation and co-precipitation. Its morphology, specific surface area and structure were characterized by various advanced instrumental analysis techniques. Batch adsorption experiments were conducted in simulated wastewater, the effects of pH, initial fluoride concentration and adsorption time on fluoride adsorption by Al/Ce-CSBC were investigated, and finally the fluoride removal mechanism was explored. The results showed that both activation and modification could increase the specific surface area of sludge biochar. Al/Ce-CSBC had rich slit mesopores, and its specific surface area and pHPZC were 176.36 m2·g−1 and 9.5, respectively. Amorphous aluminum/cerium oxide loading on the material surface was the main active component for adsorption, and also played a bimetallic synergistic role, which could maintain a high adsorption capacity within pH range of 4.0~9.0. The adsorption kinetics conformed to the pseudo-second order model, the adsorption isotherm conformed to the Freundlich model. The maximum adsorption capacity of Al/Ce-CSBC could reach 41.74 m2·g−1, which was significantly over the conventional biochar adsorption materials. The adsorption mechanism mainly included electrostatic adsorption, ion exchange and surface complexation. This work can provide an important reference for the resource utilization of sludge.
-
Key words:
- sludge /
- biochar /
- aluminum cerium loading /
- defluoridation /
- adsorption
-
作为我国农业的支柱产业之一[1],畜禽养殖业向集约化、规模化方向发展,但规模化养殖产生了大量粪尿等污染物,畜禽养殖污染防治日益得到重视[2]。据相关统计[3]表明,以生猪养殖为代表的畜禽养殖业排放的有机物和总氮已经成为我国农业面源污染之首。
生猪养殖废水具有高氨氮(110~1 650 mg·L−1)、高有机污染物(2 000~30 000 mg·L−1)、高总氮(220~2 055 mg·L−1)等污染特征[4],其主要有还田处理,自然处理和生物处理等方式,其中还田处理和自然处理模式由于占地面积较大、二次污染等原因,而较少被采用。生物处理模式中多采用厌氧-好氧联合处理模式[5],但其存在处理工艺流程较长、出水难以稳定达标、冬季运行效果差等问题[6, 7]。另一方面,由于生猪养殖废水属于低C/N比废水(4~7),缺氧阶段缺乏足够碳源,从而影响微生物生长和反硝化脱氮效果[8]。为增强废水生物处理脱氮效率,需要外加碳源,导致其处理成本和能耗较高[9]。姜超等[10]和SUI等[11]通过建立关联氧化还原电位、pH控制点的SMBR工艺,通过优化好氧曝气时间实现了实时控制短程硝化过程,
NH+4 -N平均出水浓度为11.6 mg·L−1,去除率为98.3%;耗氧有机污染物的平均出水浓度(以COD计)为358 mg·L−1,去除率为95.3%;TN平均出水浓度为81 mg·L−1,去除率为92.7%;亚氮累积率在85%以上,因此,实现了常温下短流程高效处理畜禽养殖废水。本文在实验室规模SMBR工艺研究的基础上,通过研发中试规模SMBR工艺处理生猪养殖废水,考察了在低温环境下该工艺对污染物的去除效果及关键功能菌群的演替特征,其可为高效处理规模化畜禽养殖废水提供技术支撑。
1. 材料与方法
1.1 生猪养殖废水处理中试装置
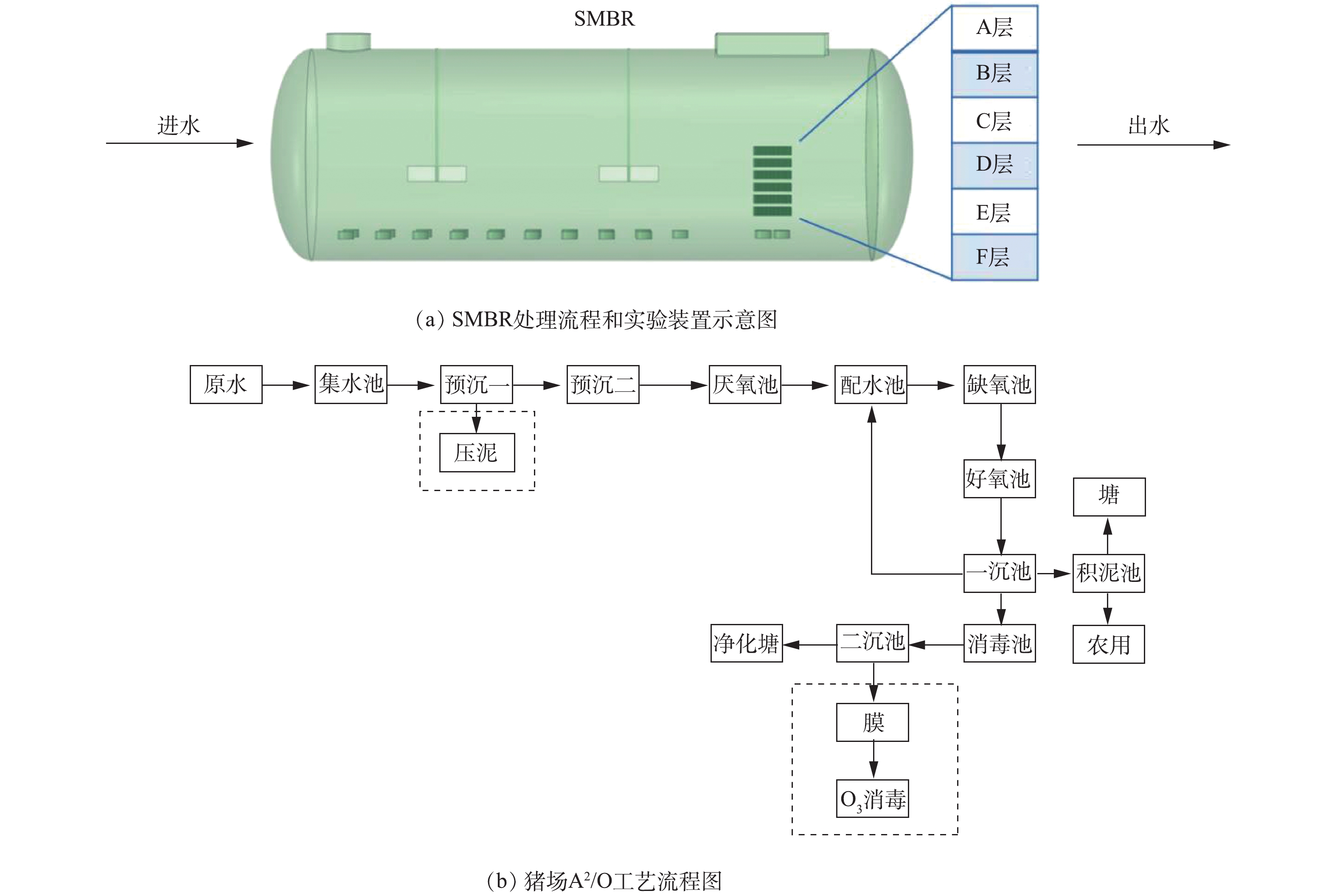
本中试研究在北京某养猪场实施。生猪养殖废水处理中试装置见图1。如图1(a)所示,本研究的中试规模序批式膜生物反应器(sequence membrane bio-reactor,SMBR)由碳钢(壁厚8 mm)制成,呈卧式圆柱体(2.8 m×8 m,总体积为50 m3,有效体积为30~35 m3,北京创迪环保科技有限公司)。如图1(a)所示,内置A~F共计6层陶瓷膜组件(膜孔径1 μm,单片膜单侧有效过滤面积0.5 m×0.11 m(共两侧),江西博鑫精陶环保科技有限公司),每层设置陶瓷膜48片,单片陶瓷膜短边垂直曝气管方向布置,膜片与膜片间隔0.8 cm,单层陶瓷膜设置1个出水管收集出水,6层(共288片陶瓷膜)设置统一出水管与抽吸泵相连,膜组件(共6层)总有效过滤面积为31.6 m2。SMBR设计处理规模10 m3·d−1,实际处理规模5~6 m3·d−1,SRT为15~20 d。反应器采用序批式模式运行:进水0.5 h、缺氧搅拌1.5 h、好氧曝气3 h(溶解氧为0.5~2 mg·L−1)、反应器膜出水0.6~1 h。
该猪场生猪养殖废水处理采用连续流厌氧-缺氧-好氧工艺(anaerobic-anoxic-oxic process, A2/O)(图1(b)),该生物反应器覆盖有阳光棚,冬季具有一定的保温作用,其主要运行参数见表1。
表 1 SMBR和A2/O运行基本参数Table 1. Basic parameters of SMBR and A2/O工艺 阶段或池型 处理量/(m3·d−1) SRT/d HRT/d  -N负荷/(kg·(m3·d)−1)
-N负荷/(kg·(m3·d)−1)有机物负荷/(kg(m3·d)−1) MLSS/(mg·L−1) 水温/℃ SMBR Ⅰ 10 15~20 5.6~6.6 0.11~0.14 1.48~1.75 7 200 20±2 Ⅱ 10 15~20 5.6~6.6 0.11~0.14 1.48~1.75 6 860 15±2 Ⅲ 10 15~20 5.6~6.6 0.11~0.14 1.48~1.75 8 240 10±2 A2/O 厌氧池 150 — 10 0.21 1.12~3.78 1 480 20±3 缺氧池 150 — 10 0.07 1.19~2.20 6 700 20±3 好氧池 150 — 10 0.01~0.02 0.35~0.8 4 340 20±3 1.2 实验用水与接种污泥
猪场A2/O工艺处理实验用水为生猪养殖废水经预沉淀、螺旋挤压分离、沉淀一池、沉淀二池处理。SMBR实验用水为北京市某猪场生猪养殖废水经预沉淀和螺旋挤压固液分离处理,其水质特征如表2所示。SMBR接种污泥取自该猪场废水处理站A2/O工艺中的好氧池污泥,首次接种后反应器内污泥浓度(MLSS)在6 000 mg·L−1左右,MLVSS在4 500 mg·L−1左右。
表 2 生猪养殖废水水质Table 2. Water quality parameters of swine wastewater阶段 水温/℃ COD/(mg·L−1)  -N/(mg·L−1)
-N/(mg·L−1) -N/(mg·L−1)
-N/(mg·L−1)TN/(mg·L−1) 阶段Ⅰ 20±2 9 816±2 190 733.44±78.90 16.96±11.68 880.31±112.24 阶段Ⅱ 15±2 9 520±938 766.50±66.63 36.10±9.47 882.36±69.02 阶段Ⅲ 10±2 8 532±2 668 724.00±72.99 43.31±7.16 904.30±206.32 1.3 水质指标测定方法
实验过程中对常规水质指标进行周期性采样检测,其中
NH+4 -N测试采用纳氏试剂比色法;NO−2 -N测试采用N-(1-萘基)-乙二胺光度法;NO−3 -N测试采用紫外分光光度法;总氮测试采用碱性过硫酸钾紫外分光光度法;有机污染物测定采用快速测定仪测试(哈希中国);SS、VSS测试采用重量法;pH、氧化还原电位和DO测试采用便携式测定仪(德国WTW)测定。1.4 DNA提取
分别在SMBR稳定运行的第28天(阶段Ⅰ)、第46天(阶段Ⅱ)和第63天(阶段Ⅲ),以及在现场A2/O工艺中的厌氧池、缺氧池、好氧池各取污泥混合液50 mL后,实验室提取每个样品1~5 mL,10 000 r·min−1离心10 min,弃上清液,使用试剂盒Fast DNA Spin Kit for Soil(MP, Biomedicals, USA)提取DNA。
1.5 高通量测序与OUT分类
采用Illumina Miseq平台(Illumina, USA)测序分析[11],测序数据经优化后,样品经均一化后均含有40 875条序列,有效序列采用(ribosomal database project, RDP)核糖体数据库进行物种分类。
2. 结果与讨论
2.1 SMBR的生猪养殖废水处理效果
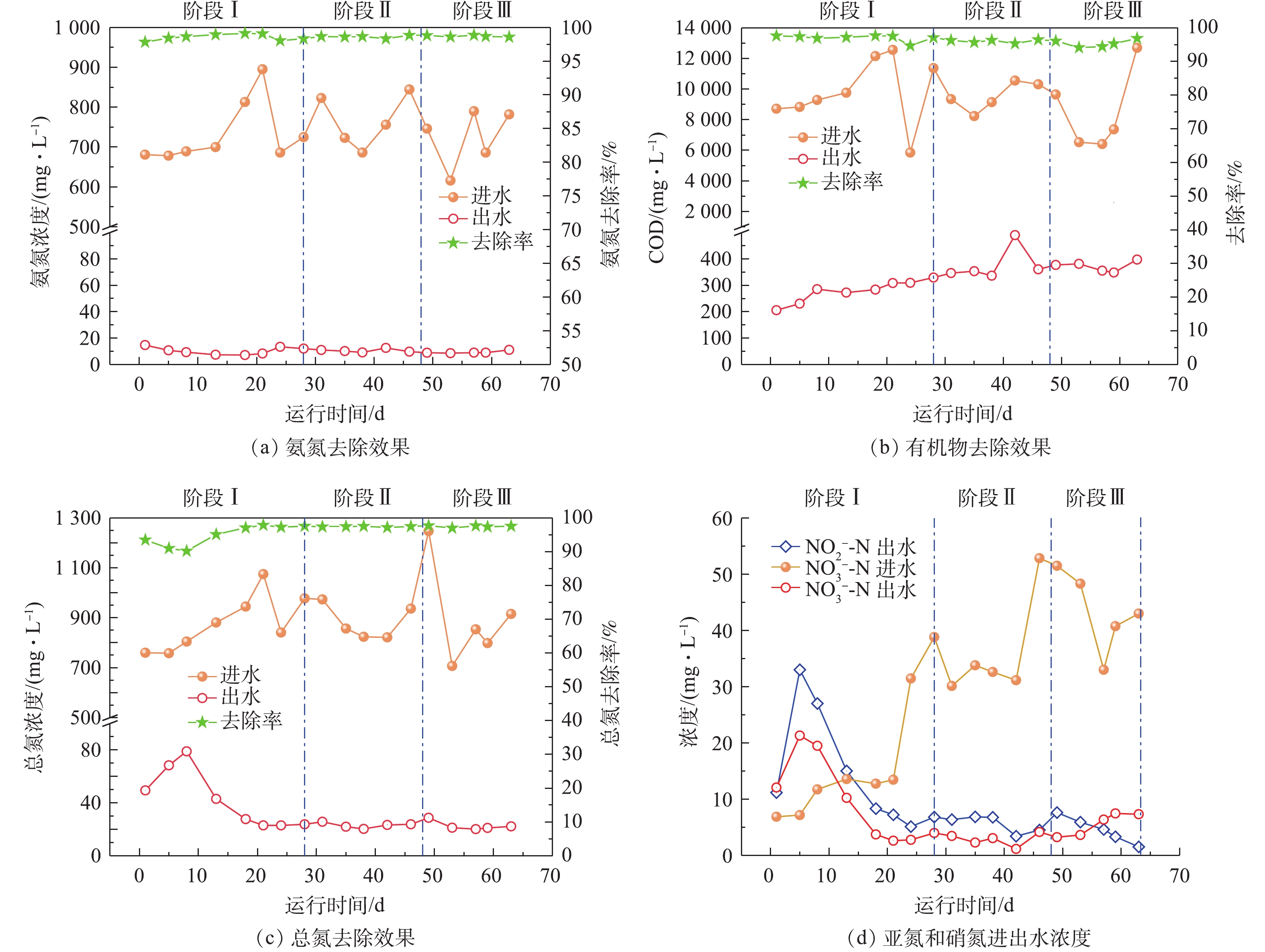
在SMBR的运行过程中,耗氧有机污染物的平均进水浓度(以COD计)为9 377 mg·L−1,平均出水浓度为332 mg·L−1,去除率为96.5%;总氮平均进水浓度为887 mg·L−1,平均出水浓度为31 mg·L−1,去除率为96.5%;氨氮平均进水浓度为740 mg·L−1,平均出水浓度为10 mg·L−1,去除率为98.6%;SS去除率可以达到100%。
SMBR去除污染物效果见图2。如图2(a)所示,在SMBR运行过程中,氨氮平均进水浓度为740 mg·L−1,平均出水浓度为10 mg·L−1,去除率高达98.6%,这表明尽管SMBR的运行温度逐步降低,但依然可以实现较好的氨氮去除效果;由图2(b)可以看出,耗氧有机污染物的出水浓度随着温度的降低有所增加,3个阶段耗氧有机污染物的平均出水浓度(以COD计)分别为279、378和373 mg·L−1,这说明反应器运行温度的降低可能会影响到微生物降解有机污染物的活性,导致出水有机物浓度随着反应器运行温度的降低有所提高;如图2(c)所示,在阶段Ⅰ初期,总氮平均进水浓度为880 mg·L−1,平均出水浓度逐步升高,在第8天达到最高出水浓度为79 mg·L−1,总氮去除率仅为89%,这是由于反应器启动初期,运行不稳定导致脱氮效果较差。此后当反应器稳定运行,出水总氮逐步降低,平均出水浓度降低至29 mg·L−1,总氮去除率提高至97%。
由于接种污泥来自好氧池排泥,含有高浓度的硝酸盐,以及反应器运行初期脱氮效果较差,所以导致硝态氮出水浓度高于硝态氮进水浓度(图2(d))。随着反应器的稳定运行,硝态氮出水浓度逐步降低至6 mg·L−1。在一定温度范围内(5~40 ℃),微生物的转化率与温度之间的关系可以用简化的阿伦尼乌斯方程[12]描述(式(1))。
rT=r293exp[−θ(293−T)] (1) 式中:rT为反应速率,mol·(L·s)−1;r293为标准温度下的反应速率,mol·(L·s)−1;θ为反应温度系数,K−1;T为反应温度,K。
在硝化反应中,反应温度系数θ随着温度的降低而降低[13]。当温度低于20 ℃时,亚硝化细菌最大比增长速率低于硝化细菌[14],亚硝化细菌产生的亚硝酸盐容易被硝化细菌继续氧化成硝酸盐。因此,在SMBR运行中随着水温的降低,亚硝化速率降低,出水亚氮浓度也逐步降低,阶段Ⅰ和阶段Ⅱ的亚氮累积率分别为62%和67%,而当水温降低至10 ℃后,亚氮累积率仅为44%。
总体而言,在SMBR整体运行过程中,虽然运行温度逐步降低,但是SMBR对污染物均具有较好的去除效果,能够获得较高且稳定的污染物去除率,满足《畜禽养殖业污染物排放标准》(GB 18596-2001)所规定的集约化畜禽养殖业污染物最高允许日均排放浓度。
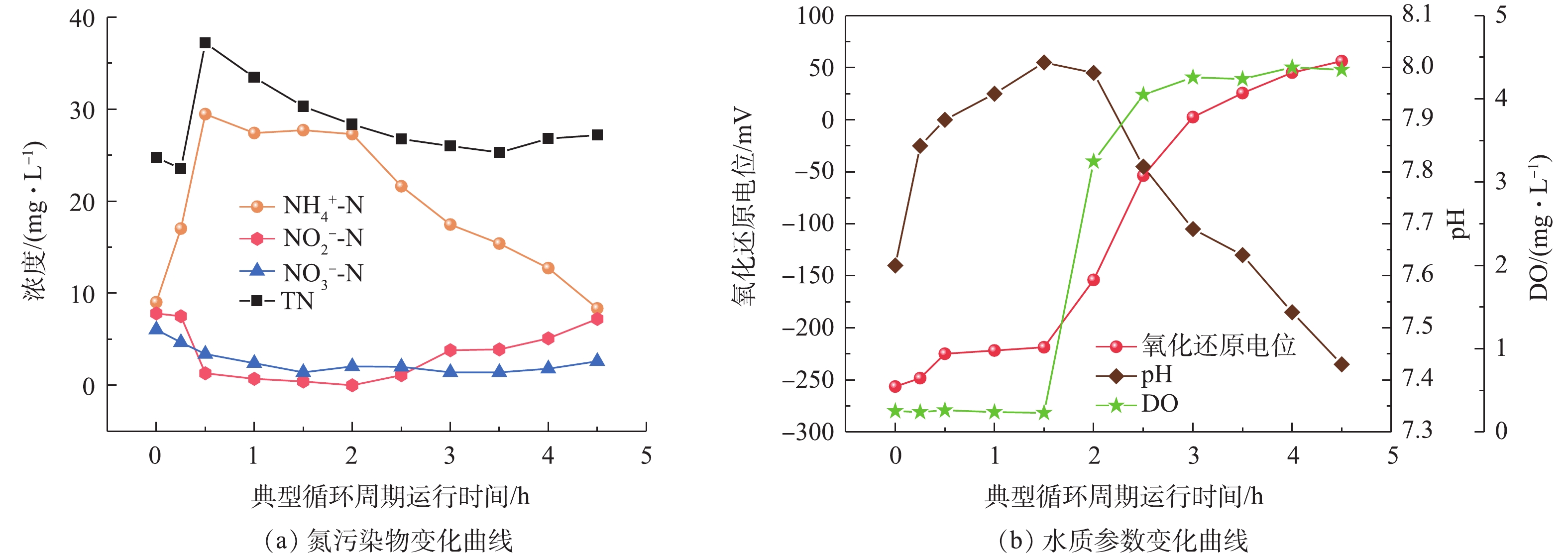
图3为SMBR运行第21天(阶段Ⅰ)的一个典型循环周期内,含氮污染物指标和水质参数的变化曲线。第0~0.5小时为反应器进水阶段,反应器氨氮浓度逐步升高,直至进水完成其浓度达到29.46 mg·L−1,此时反应器总氮浓度也达到37.2 mg·L−1。在缺氧搅拌期间,微生物利用进水中的有机物进行反硝化作用,亚硝酸盐和硝酸盐的浓度降低至0 mg·L−1和1.4 mg·L−1,总氮浓度也因为反硝化脱氮作用逐步降低至30.3 mg·L−1,在此期间产生的碱度使反应器中的pH不断升高。
第1.5~4.5小时为好氧单元,其中在曝气阶段的末端开启膜出水。在开启生物曝气的情况下,由于微生物的硝化作用,反应器内的氨氮浓度逐步降低至4.5 mg·L−1,亚氮浓度则是逐步升高至7.2 mg·L−1。由于反应器搅拌不均匀,存在死区,导致其成为缺氧环境,在好氧单元生成的亚氮或者硝氮在此发生反硝化作用,所以总氮在好氧单元略有降低。在好氧单元由于硝化作用消耗碱度,致使反应器在好氧单元期间实时pH逐步降低。
2.2 A2/O工艺处理生猪养殖废水效果
该猪场A2/O工艺的生猪养殖废水处理效果如表3所示。氨氮平均进水浓度为745 mg·L−1,出水浓度为7 mg·L−1,去除率达到99%;总氮平均进水浓度为844.5 mg·L−1,出水浓度为107 mg·L−1,去除率为87.2%;耗氧有机污染物的平均进水浓度(以COD计)为5 850 mg·L−1,出水浓度为216 mg·L−1,去除率达到96.3%。
表 3 A2/O工艺处理生猪养殖废水效果Table 3. Performance of A2/O process on swine wastewater treatmentmg·L−1 项目 氨氮 亚氮 硝态氮 总氮 COD 进水 745±79 0 37±9 844.5±5 5 850±56 厌氧池 835±1 0 23±3 909±50 2 245±91 缺氧池 65±9 0 20±3 96±31 274±21 好氧池 5±0.2 0 98±18 108±1 215±13 出水 7±2 0 94±25 107±7 216±10 去除率/% 99±0.2 — — 87.2±0.9 96.3±0.3 生猪养殖废水在进入厌氧池之前有曝气沉淀、螺旋挤压固液分离和沉淀池预处理等步骤,降低进水中的SS,其中,由于曝气沉淀预处理的持续曝气原因,导致废水中的部分氨氮通过氧化作用转化为硝氮,使得进入到厌氧池中的废水含有一定浓度的硝态氮。因此,厌氧池中实际为缺氧环境,微生物利用进水中的有机污染物进行反硝化,硝态氮浓度由37 mg·L−1降低至23 mg·L−1,COD值由5 850 mg·L−1降低至2 245 mg·L−1,有机物去除率达到61.6%。厌氧池出水到配水池,在此过程中一沉池污泥回流到配水池。在此过程中,由于污泥回流的稀释作用,导致配水池中的氨氮、总氮和COD大幅降低。在缺氧池中由于废水中缺少足够的可生物降解有机物,所以硝态氮在缺氧池仅去除3 mg·L−1左右。在好氧池中,溶解氧高达6.1~7.2 mg·L−1,微生物在好氧环境中充分发挥硝化作用,氨氮浓度由65 mg·L−1降低至5 mg·L−1,硝态氮由20 mg·L−1升高至98 mg·L−1。在A2/O工艺处理中,畜禽养殖废水的总氮去除率仅为87.2%,有机物去除率为96.3%,说明由于曝气池由于曝气过量,导致进水中的部分有机物在好氧池中进行氧化分解,并未完全利用进行反硝化,导致总氮去除率较低。
2.3 2种工艺的微生物群落结构演替变化
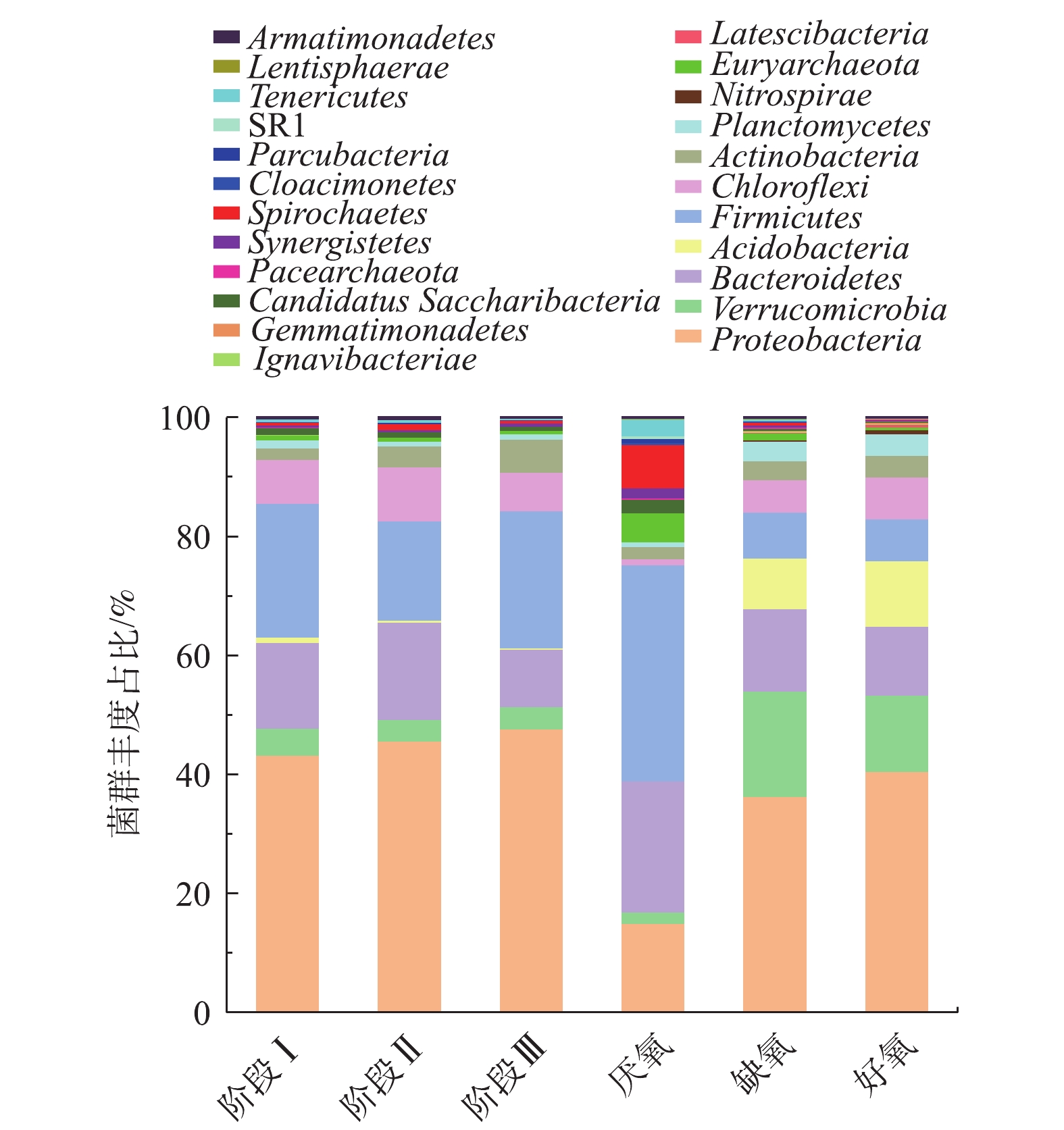
在不同运行温度下SMBR反应器的微生物群落结构表征如图4所示。在3个不同的运行温度下,SMBR反应器内门水平下的群落结构组成基本保持不变,主要由变形菌门(Proteobacteria)(43.29%~47.72%)、拟杆菌门(Bacteroidetes)(9.58%~16.32%)、绿弯菌门(Chloroflexi)(6.53%~9.06%)、厚壁菌门(Firmicutes)(16.67%~23.02%)等组成,其中,变形菌门包含了大多数具有硝化能力的菌属,如Nitrosomonas、Nitrosococcus、Nitrobacter、Nitrococcusi等硝化菌属[15],是污水处理过程的常见微生物[16]。随着运行温度的降低,变形菌门的丰度略有上升,而拟杆菌门和绿弯菌门的丰度则呈现降低的趋势。值得注意的是,放线菌门(Actinobacteria)的丰度随着温度的降低逐步上升。有研究[17]表明,放线菌过度繁殖是导致活性污泥丝状膨胀和起泡现象的主要原因。而在SMBR反应器中由于内置陶瓷膜过滤废水,所以尽管放线菌有增长的趋势,但是并不会导致污泥流失的情况发生。
A2/O工艺中厌氧池、缺氧池和好氧池的门水平群落结构丰度占比如图4所示。厌氧池中的变形菌门、拟杆菌门和厚壁菌门分别占比15%、22%和36%,其余细菌占比均低于10%;由于好氧池污泥回流到缺氧池,所以两者微生物群落组成类似,主要由变形菌门、疣微菌门(Verrucomicrobia)、拟杆菌门、酸杆菌门和厚壁菌门等菌群组成,其中,Verrucomicrobia门是高效活性污泥常见门类,对有机物的降解起重要作用[18]。
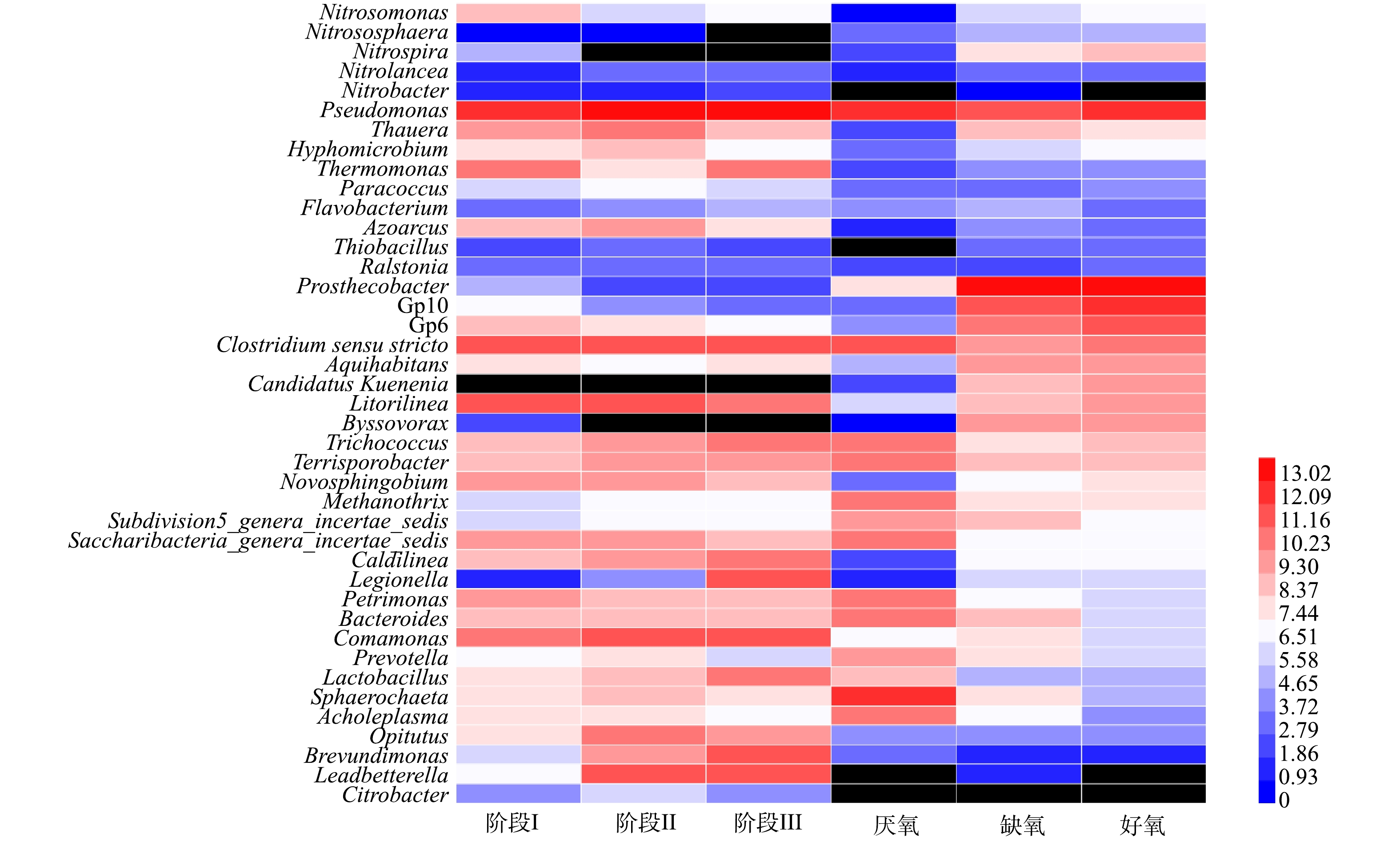
为了深入研究SMBR和A2/O工艺中的微生物群落组成,在属水平上进行了菌属丰度分析,主要结果见图5。Nitrosomonas、Nitrososphaera、Nitrospira、Nitrobacter和Nitrolancea等菌属是SMBR反应器和A2/O工艺的主要硝化菌属,反硝化菌属主要有Pseudomonas、Thauera、Hyphomicrobium、Thermomonas、Paracoccus、Flavobacterium、Azoarcus、Thiobacillus和Ralstonia等,并且SMBR反应器中反硝化菌属的丰度远高于A2/O工艺,这也是SMBR具有较高脱氮效率的原因之一。
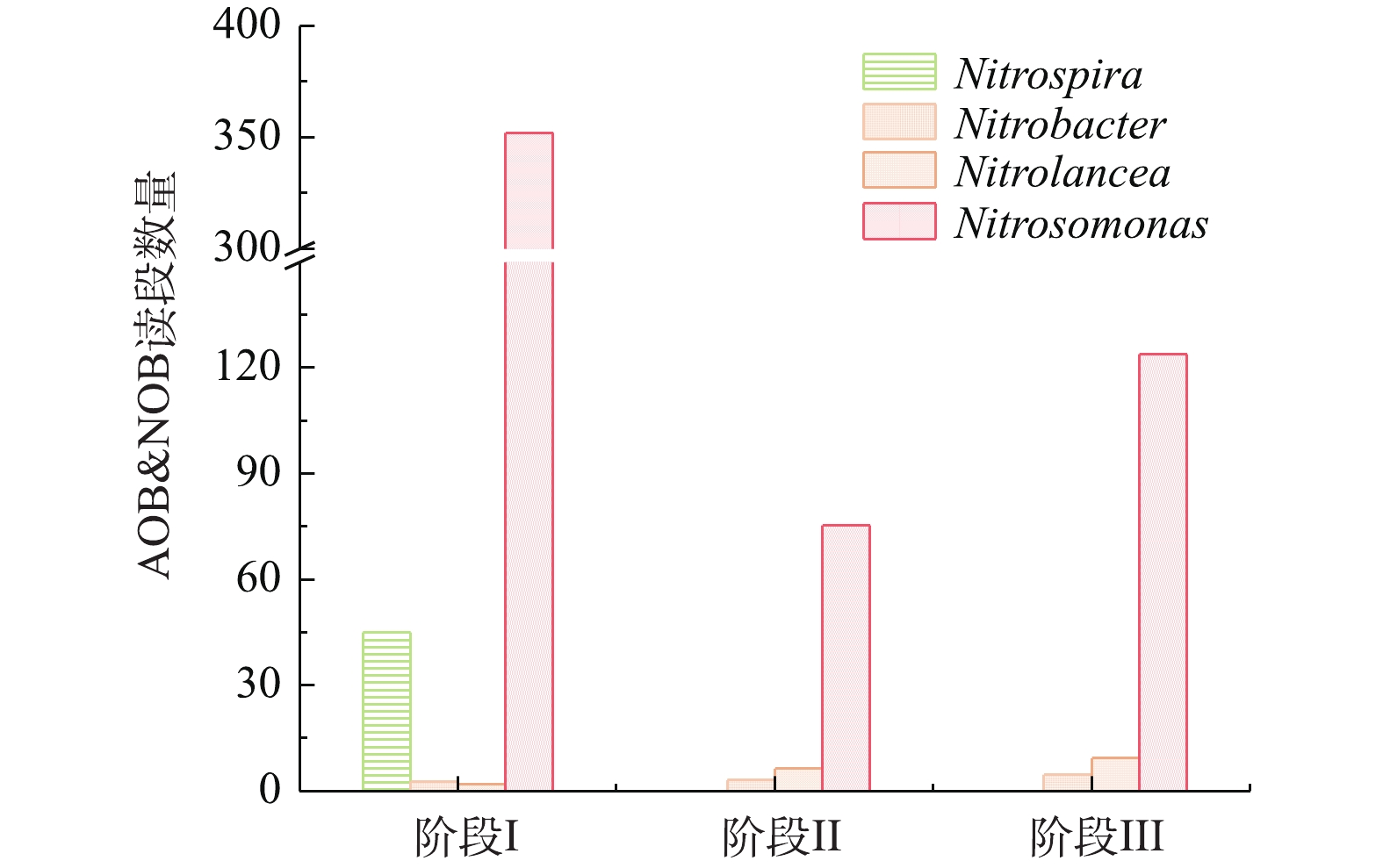
图6反映了SMBR在不同阶段中AOB和NOB读段数量的变化。SMBR中主要的AOB为Nitrosomonas,NOB主要为Nitrospira、Nitrobacter和Nitrolancea。随着温度的降低,AOB和NOB的数量均有所降低,但是AOB仍然是主要的硝化细菌。结果表明,控制曝气时间,防止NOB将亚态氮转化为硝态氮,NOB未能获得足够的能量进行生长繁殖。随着SMBR反应器的稳定运行,NOB逐渐被淘汰,而AOB的优势地位越来越大,因此控制合适的曝气时间有利于AOB的富集和NOB的淘洗。
3. 结论
1) SMBR对畜禽养殖废水具有较好的处理效果,氨氮、总氮和有机物的去除率分别达到98.6%、96.5%和96.5%;猪场现有A2/O工艺对畜禽养殖废水中的氨氮、总氮和有机物的去除率分别为99%、88%和97%,其中总氮去除率低于SMBR的处理效果。
2)高通量测序与OTU分类结果表明,SMBR和A2/O工艺中具有类似的硝化菌属和反硝化菌属,但是SMBR的反硝化菌属的丰度较高,也是SMBR的脱氮效率高于A2/O的可能原因。
3)与现有A2/O工艺相比,SMBR工艺具有短流程、高效脱氮、稳定运行等优势,处理生猪养殖废水的应用前景广阔。
-
表 1 样品元素含量变化
Table 1. Changes in the element content of the samples
% 样品 O C Ca Fe Al Si P Mg K Ce SBC 39.9 28.0 16.4 4.0 3.7 3.4 1.1 1.0 0.8 0 Al/Ce-CSBC 35.1 46.8 0.2 1.8 1.7 10.9 0 0.2 0.6 2.3 表 2 样品的孔隙结构
Table 2. Pore structure of the studied samples
样品 BET比表面积/(m2·g−1) 总孔体积/(cm3·g−1) 平均孔径/nm SBC 25.59 0.114 4 13.454 CSBC 69.78 0.144 0 11.395 Al/Ce-CSBC 176.36 0.174 8 6.610 表 3 不同吸附剂的氟离子吸附性能对比
Table 3. Comparison of fluorine ion adsorption performance of different adsorbents
-
[1] HUANG L, YANG Z H, ZHANG Z X, et al. Enhanced surface hydroxyl groups by using hydrogen peroxide on hollow tubular alumina for removing fluoride[J]. Microporous and Mesoporous Materials, 2020, 297: 110051. doi: 10.1016/j.micromeso.2020.110051 [2] WAN K L, HUANG L, YAN J, et al. Removal of fluoride from industrial wastewater by using different adsorbents: A review[J]. Science of the Total Environment, 2021, 773: 145535. doi: 10.1016/j.scitotenv.2021.145535 [3] XU L Y, CHEN G J, PENG C Y, et al. Adsorptive removal of fluoride from drinking water using porous starch loaded with common metal ions[J]. Carbohyd Polym, 2017, 160: 82-89. doi: 10.1016/j.carbpol.2016.12.052 [4] HE J S, SIAH T S, PUAL CHEN J. Performance of an optimized Zr-based nanoparticle-embedded PSF blend hollow fiber membrane in treatment of fluoride contaminated water[J]. Water Research, 2014, 56: 88-97. doi: 10.1016/j.watres.2014.02.030 [5] RAJKUMAR S, MURUGESH S, SIVASANKAR V, et al. Low-cost fluoride adsorbents prepared from a renewable biowaste: Syntheses, characterization and modeling studies[J]. Arabian Journal of Chemistry, 2019, 12(8): 3004-3017. doi: 10.1016/j.arabjc.2015.06.028 [6] 李程文. 流化床结晶法处理高浓度含氟废水[D]. 长沙: 中南大学, 2011. [7] CUI H, LI Q, QIAN Y, et al. Defluoridation of water via electrically controlled anion exchange by polyaniline modified electrode reactor[J]. Water Research, 2011, 45(17): 5736-5744. doi: 10.1016/j.watres.2011.08.049 [8] NDOUN M C, ELLIOTT H A, PREISENDANZ H E, et al. Adsorption of pharmaceuticals from aqueous solutions using biochar derived from cotton gin waste and guayule bagasse[J]. Biochar, 2021, 3(1): 89-104. doi: 10.1007/s42773-020-00070-2 [9] WANG Y F, KANG J M, JIANG S M, et al. A composite of Ni-Fe-Zn layered double hydroxides/biochar for atrazine removal from aqueous solution[J]. Biochar, 2020, 2(4): 455-464. doi: 10.1007/s42773-020-00066-y [10] 汤家喜, 朱永乐, 李梦雪, 等. 不同生物炭对水中氟离子的吸附特征研究[J]. 生态环境学报, 2020, 29(11): 2270-2278. [11] 邱会华, 林婉琪. 荷叶基生物炭的制备及对水中氟离子的吸附研究[J]. 广东石油化工学院学报, 2018, 28(3): 34-38. doi: 10.3969/j.issn.2095-2562.2018.03.008 [12] 张涛, 吴秋雨, 董岁明, 等. 载铁生物炭的制备及其对高氟水的处理研究[J]. 应用化工, 2018, 47(4): 656-659. doi: 10.3969/j.issn.1671-3206.2018.04.006 [13] 徐凌云, 奚军军, 陈贵杰, 等. 酒糟生物炭负载铝对饮用水中氟的去除[J]. 环境工程学报, 2016, 10(10): 5624-5630. doi: 10.12030/j.cjee.201505003 [14] FENG J, BAI H, XUE Y D, et al. Recycling of iron and aluminum from drinking water treatment sludge for synthesis of a magnetic composite material (ALCS-Fe-Al) to remove fluoride from drinking water[J]. Groundwater for Sustainable Development, 2020, 11: 100456. doi: 10.1016/j.gsd.2020.100456 [15] WANG A H, ZHOU K G, LIU X, et al. Granular tri-metal oxide adsorbent for fluoride uptake: Adsorption kinetic and equilibrium studies[J]. Journal of Colloid and Interface Science, 2017, 505: 947-955. doi: 10.1016/j.jcis.2017.06.074 [16] NEHRA S, RAGHAV S, KUMAR D. Biomaterial functionalized cerium nanocomposite for removal of fluoride using central composite design optimization study[J]. Environmental Pollution, 2020, 258: 113773. doi: 10.1016/j.envpol.2019.113773 [17] JIANG H L, LI X Q, TIAN L, et al. Defluoridation investigation of Yttrium by laminated Y-Zr-Al tri-metal nanocomposite and analysis of the fluoride sorption mechanism[J]. Science of The Total Environment, 2019, 648: 1342-1353. doi: 10.1016/j.scitotenv.2018.08.258 [18] 李赟. 城市污泥焚烧技术研究进展[J]. 东北电力大学学报, 2022, 42(3): 46-56. [19] 郭可心, 田佳一, 孙煜璨, 等. 磁性污泥基生物炭对Pb~(2+)的吸附性能[J]. 环境工程学报, 2022, 16(5): 1416-1428. doi: 10.12030/j.cjee.202201003 [20] 谢昆, 尹静, 陈星. 中国城市污水处理工程污泥处置技术研究进展[J]. 工业水处理, 2020, 40(7): 18-23. [21] ZHANG J, SHAO J, JIN Q, et al. Sludge-based biochar activation to enhance Pb(II) adsorption[J]. Fuel, 2019, 252: 101-108. doi: 10.1016/j.fuel.2019.04.096 [22] LIAO J, XIONG T, DING L, et al. Design of a renewable hydroxyapatite-biocarbon composite for the removal of uranium(VI) with high-efficiency adsorption performance[J]. Biochar, 2022, 4(1): 29. doi: 10.1007/s42773-022-00154-1 [23] PENG G F, JIANG S Q, WANG Y X, et al. Synthesis of Mn/Al double oxygen biochar from dewatered sludge for enhancing phosphate removal[J]. Journal of Cleaner Production, 2020, 251: 119725. doi: 10.1016/j.jclepro.2019.119725 [24] ZHENG D Y, WU M, ZHENG E Y, et al. Parallel adsorption of low concentrated ciprofloxacin by a CoFe-LDH modified sludge biochar[J]. Journal of Environmental Chemical Engineering, 2022, 10(5): 108381. doi: 10.1016/j.jece.2022.108381 [25] HE L Y, LV L X, PILLAI S C, et al. Efficient degradation of diclofenac sodium by periodate activation using Fe/Cu bimetallic modified sewage sludge biochar/UV system[J]. Science of the Total Environment, 2021, 783: 146974. doi: 10.1016/j.scitotenv.2021.146974 [26] MA J, ZHOU B Q, ZHANG H, et al. Fe/S modified sludge-based biochar for tetracycline removal from water[J]. Powder Technology, 2020, 364: 889-900. doi: 10.1016/j.powtec.2019.10.107 [27] EKKA B, DHAKA R S, PATEL R K, et al. Fluoride removal in waters using ionic liquid-functionalized alumina as a novel adsorbent[J]. Journal of Cleaner Production, 2017, 151: 303-318. doi: 10.1016/j.jclepro.2017.03.061 [28] NEHRA S, DHILLON A, KUMAR D. Freeze-dried synthesized bifunctional biopolymer nanocomposite for efficient fluoride removal and antibacterial activity[J]. Journal of Environmental Sciences, 2020, 94: 52-63. doi: 10.1016/j.jes.2020.03.047 [29] ZHU T Y, ZHU T H, GAO J, et al. Enhanced adsorption of fluoride by cerium immobilized cross-linked chitosan composite[J]. Journal of Fluorine Chemistry, 2017, 194: 80-88. doi: 10.1016/j.jfluchem.2017.01.002 [30] KU Y, CHIOU H M. The Adsorption of fluoride ion from aqueous solution by activated alumina[J]. Water, Air, and Soil Pollution, 2002, 133(1): 349-361. [31] MULUGETA E, ZEWGE F, CHANDRAVANSHI B S. Development of a household water defluoridation process using aluminium hydroxide based adsorbent[J]. Water Environment Research, 2015, 87(6): 524-532. doi: 10.2175/106143014X13975035525627 [32] WANG J, WU L Y, LI J, et al. Simultaneous and efficient removal of fluoride and phosphate by Fe-La composite: Adsorption kinetics and mechanism[J]. Journal of Alloys and Compounds, 2018, 753: 422-432. doi: 10.1016/j.jallcom.2018.04.177 [33] CAI H M, CHEN G J, PENG C Y, et al. Removal of fluoride from drinking water using tea waste loaded with Al/Fe oxides: A novel, safe and efficient biosorbent[J]. Applied Surface Science, 2015, 328: 34-44. doi: 10.1016/j.apsusc.2014.11.164 [34] WANG J G, CHEN N, FENG C P, et al. Performance and mechanism of fluoride adsorption from groundwater by lanthanum-modified pomelo peel biochar[J]. Environmental Science and Pollution Research, 2018, 25(16): 15326-15335. doi: 10.1007/s11356-018-1727-6 -




 下载:
下载: