-
纳米材料是一类由纳米结构单元构成且某一维度尺寸小于100 nm的材料,因具有超高的光学、电磁和力学性能,被广泛应用于生物传感、光电催化和环境治理等领域[1-5]. 层状双金属氢氧化物(LDHs)是一种二维黏土型无机金属类纳米材料,化学式为
$\text{[}{\text{M}}_{\text{1}\text{-}\text{x}}^{\text{2+}}{\text{M}}_{\text{x}}^{\text{3+}}\text{(OH}{\text{)}}_{\text{2}}\text{]}{\text{A}}_{\text{x/n}}^{\text{n}\text{-}}\text{·}\text{y}{\text{H}}_{\text{2}}\text{O}$ ,其中M2+和M3+分别为二价和三价金属阳离子,An-为层间阴离子[6-7]. 因其具有层板化学组成可调变、层间阴离子可交换等特性,LDHs在水环境治理领域备受关注[7-9],并且作为环境吸附剂被纳入中国化工行业标准(HG/T 5549-2019)[10]. 近年来,通过模板法合成的三维LDHs(3D-LDHs)因具有更大的表面积和较多的孔容结构引起了广泛的研究[11-13]. 如Zhou等[13]合成了比表面积高达126.31 m2·g−1、孔容为0.30 cm3·g−1的三维MgAl-LDH,发现其对石油废水中磺化褐煤的吸附容量(1014.20 mg·g−1)显著高于二维MgAl-LDHs的吸附容量(86 mg·g−1). 可见,LDHs结构上的调控能显著提高其在污染物治理领域的应用潜力. 然而,三维LDHs为粉末状吸附剂,回收不完全往往会随废水进入自然水体中[14-15],影响环境安全.微藻作为水生生态系统最重要的初级生产者,在维持生态系统结构和功能稳定方面发挥重要作用[16-17]. 同时,微藻因细胞个体小、繁殖速度快以及污染物耐受性低,常被选为生态毒理研究的模式生物[18]. 如MIAO等[19]利用海链藻(Thalassiosira)揭示纳米Ag的毒性主要源于其溶出Ag+;Schwab等[20]借助小球藻(Chlorella vulgaris)和月牙藻(Caulobacter crescentus)揭示了碳纳米管的遮光效应和团聚作用是胁迫微藻生长的主要原因;马菲菲等[21]研究发现,纳米TiO2对新月菱形藻(Nitzschia closterium)的生长抑制随其粒径减小而逐渐增强,并且其纳米片层可诱导藻细胞发生氧化损伤. 由此可见,纳米材料的溶出离子、粒径大小、片层结构等理化性质均可能胁迫微藻并诱导藻细胞生长抑制、光合受阻或者氧化损伤等. 此外,Tengda等[22]发现,二维Cu-Mg-Fe LDHs对四尾栅藻(Scenedesmus quadricauda)生长具有显著的抑制作用(EC50=10 mg·L−1)并且致毒机制主要为Cu-Mg-Fe LDHs黏附在微藻表面造成的遮光效应、与藻相互作用产生的团聚作用以及诱导大量活性氧生成而引发的氧化损伤等. 在材料结构上,三维LDHs比二维LDHs具有更大的比表面积和更多的活性位点,这大大增加了其与水生生物的接触面积.LDHs结构上的调控亦可能影响其存在的潜在生态风险[23]. 然而,目前有关三维LDHs对微藻的毒性影响及机制研究较少.
本研究选取水体环境中常见的小球藻(Chlorella vulgaris)和斜生栅藻(Scenedesmus Oblique)作为受试藻,同时选择应用广泛、原料低廉易得的三维镁铝双金属氢氧化物(3D-MgAl-LDH)为三维层状双金属氢氧化物的代表[24-27]. 考察3D-MgAl-LDH的理化特性(如暴露浓度、暴露时间、溶出物质等)对两种微藻的毒性影响,并通过测定微藻的细胞结构、光合色素含量和抗氧化酶活性等指标探讨微藻的致毒机制,以期为LDHs应用于实际废水治理的潜在风险评估提供理论依据.
-
试剂:六水合硝酸镁(Mg(NO3)2·6H2O,分析纯)、九水合硝酸铝(Al(NO3)3·9H2O,分析纯)、尿素(H2NCONH2,分析纯)、十二烷基硫酸钠(C12H25SO4Na,SDS,分析纯)、甲醇(CH3OH,分析纯);MDA测定试剂盒、SOD测定试剂盒购自南京建成生物工程研究所;BG11培养基采购于青岛高科园海博生物技术有限公司,其成分主要有硝酸钾(1.5 g·L−1)、三水磷酸氢二钾(0.04 g·L−1)、七水硫酸镁(0.00732 g·L−1)、二水氯化钙(0.035 g·L−1)及柠檬酸(0.005 g·L−1)等.
仪器:D8 ADVANCE X型射线衍射仪(XRD,德国Bruker公司),NICOLET傅里叶红外光谱仪(FT-IR,美国Thermo公司),JSM 6701F型扫描电子显微镜(SEM,日本JEOL公司),Mastcrsizer型激光粒度分析仪(英国马尔文仪器公司),SP-756P型紫外可见分光光度计(UV-Vis,上海光谱仪器有限公司),SpectraMax i3x型多功能酶标仪(美谷分子仪器有限公司),LDZX-50FBS型立式电热压力蒸汽灭菌器(上海申安医疗机械厂),Optima8000型ICP原子发射光谱仪(美国PE公司),Multi N/C 3100 型TOC分析仪(德国Ananlitijcna 公司).
受试生物:实验过程采用的小球藻和斜生栅藻均由北京中国环境科学研究院生物驯养实验室提供. 小球藻和斜生栅藻均采用BG11培养基培养,培养条件为:温度(25±0.5)℃,光照强度2500 Lux,光暗比16 h:8 h,每天手工摇3—5次,每次5 min.
-
实验所用3D-MgAl-LDH由水热合成法制备而成[28]. 将Mg(NO3)2·6H2O、Al(NO3)3·9H2O和尿素按照Mg2+/Al3+/尿素物质的量比为2:1:10溶于50 mL去离子水中,配制成混合盐溶液;随后将浓度为0.1 mol·L−1的SDS溶液迅速加入上述溶液中,剧烈搅拌使其混合均匀;接着将所得混合溶液转移至100 mL水热反应釜,于150 ℃条件下反应6 h,待冷却至室温后陈化24 h,将所得产物离心、洗涤、干燥并研磨后获得3D-MgAl-LDH.
3D-MgAl-LDH悬浮液的制备:将1 g 3D-MgAl-LDH加入1 L BG11培养基中,超声分散30 min制备成1 g·L−1的悬浮母液. 根据后续实验所需,稀释配制所需3D-MgAl-LDH悬浮液浓度.
利用X型射线衍射仪(Cu 靶,扫描角度为2°—65°)、傅里叶红外光谱仪(400—4000 cm−1)、扫描电子显微镜(测试条件:15 kV)和激光粒度分析仪(测试范围:0—3500 μm)测定3D-MgAl-LDH的结构性质. 另外利用紫外可见分光光度计(测定波长:750 nm)测定3D-MgAl-LDH悬浮液的吸光度值.
-
采用处于对数生长期的微藻细胞(小球藻和斜生栅藻)开展急性毒性实验. 实验步骤为:将3D-MgAl-LDH悬浮液与藻液按体积比1:1各取50 mL加入到250 mL锥形瓶中反应24 、48 、72、96 h.每组实验均设置3个平行,同时以无添加3D-MgAl-LDH的藻液作为空白对照. 实验参数为:温度(25±0.5) ℃,光照强度2500 Lux,光暗比16 h:8 h,转速150 r·min−1. 实验结束后测定小球藻和斜生栅藻的藻细胞密度、生长抑制率、光合色素含量以及抗氧化酶活性等指标.
3D-MgAl-LDH溶出物的测定与SDS毒性实验:取不同浓度3D-MgAl-LDH悬浮液,经0.22 μm滤膜过滤后,利用ICP原子发射光谱仪测定滤液中Mg2+和Al3+浓度,通过TOC仪测定滤液中SDS浓度.SDS单独暴露对小球藻和斜生栅藻96 h毒性影响的实验步骤同上.
-
(1) 小球藻和斜生栅藻的生长指标测定
建立小球藻、斜生栅藻的藻细胞密度N(105 cells·mL−1)与藻液吸光值(OD680)之间的线性关系,藻密度计算公式见式(1)和式(2):
藻细胞生长动力学方程式及藻的生长抑制率计算公式见式(3)和式(4):
式中,Y为藻细胞密度(cells·mL−1),k为藻细胞生长速率常数(h−1),A为微藻细胞外推密度(cells·mL−1),t为时间(h),IR代表藻细胞生长抑制率(%),Yt为t时刻实验组的藻细胞密度(cells·mL−1),Yc为t时刻空白对照组的藻细胞密度(cells·mL−1).
(2) 光合色素的测定
移取2 mL反应后藻液置于冷冻离心机中,在4 ℃以10000 r·min−1转速离心5 min。弃去上清液,加入2 mL 99.9%甲醇溶液,于45 ℃暗处理24 h,经0.45 μm滤膜过滤,得到提取液. 利用紫外-可见分光光度计在波长665、652、470 nm下测定提取液吸光度值(A). 藻液的叶绿素a、叶绿素b及类胡萝卜素含量按式(5)—(8)计算[29]:
(3) 抗氧化酶活性的测定
取50 mL反应混合液置于冷冻离心机中以7200 r·min−1离心15 min,弃上清液,用超纯水洗涤数次,加入磷酸盐缓冲液混合,体积比为1 : 5,在4 ℃下置于超声清洗仪中重复超声3次,每次超声10 min.待超声完成后,通过离心(温度4 ℃,转速7200 r·min−1)收集上清液中的细胞裂解液,利用MDA试剂盒、SOD试剂盒分别测定藻液的MDA活性、SOD活性.
-
实验均做3组平行,数据用平均值±标准差表示,数据处理和图形绘制采用Origin 2019软件,统计学分析利用SPSS 23软件的单因素方差分析(ANOVA)和LSD多重比较检验,以不同字母表示差异显著(P<0.05).
-
采用X射线衍射图谱、傅里叶红外光谱及扫描电镜对产物组成和形貌进行表征(图1). 由图1(a)可知,产物分别在2θ为3.27°、6.70°、10.17° 和60.82°处出现对应于LDH(003)、(006)、(009)及(110)晶面的衍射峰[28,30-32]. 与常规LDH对比发现,产物(003)晶面峰位置因层间距变化发生低角度偏移,并在2θ=20.5°出现了归因于SDS插层引起的特征峰,这表明SDS作为层间阴离子进入LDH层间[30]. 由图1(b)可知,产物分别在447 cm−1、1210 cm−1和1463 cm−1处出现源于金属键(M—O)和SDS的S=O基团的特征峰[25],这进一步说明样品中含有LDH及SDS组分[33]. 如图1(c)所示,样品由大量纳米片交错聚集而成并且具有三维多孔花状结构. 综上所述,本实验通过水热法成功制备了具有三维花状结构、SDS及LDH组分的3D-MgAl-LDH.此外,利用粒径分布和吸光度值变化表征3D-MgAl-LDH在溶液中的颗粒状态. 由图1(d)可知,3D-MgAl-LDH悬浮液整体呈单峰分布,说明粒径分布良好、溶液分散均匀. 由图1(e)可知,3D-MgAl-LDH悬浮液的吸光值均在24 h内趋于定值,说明溶液稳定性良好.
-
生长抑制率可反映微藻细胞生长受到抑制的程度,是生物毒性研究最常用的指标之一. 图2为不同浓度3D-MgAl-LDH暴露96 h后小球藻和斜生栅藻的生长抑制率. 由图2可知,随3D-MgAl-LDH浓度增加,小球藻和斜生栅藻的抑制率整体呈增加趋势(P<0.05).
值得注意的是,相同3D-MgAl-LDH浓度条件下,小球藻的生长抑制率均大于斜生栅藻,反映出3D-MgAl-LDH对小球藻的毒性影响强于斜生栅藻,这表明小球藻对3D-MgAl-LDH毒性影响表现更为敏感,而斜生栅藻对3D-MgAl-LDH影响表现出更强的耐受性,这可能与两种微藻的hsp70调控区域的结构差异有关[34]. 本文利用微藻细胞密度对其生长趋势进行拟合,相关参数如表1所示. 生长速率常数(K)可描述微藻的生长情况,K值越大,微藻细胞生长越迅速,反之,则微藻生长越缓慢. 当3D-MgAl-LDH浓度为10 mg·L−1时,两种微藻的K值均小于各自空白组,表明小球藻和斜生栅藻受3D-MgAl-LDH毒性影响出现生长缓慢现象. 当3D-MgAl-LDH浓度分别增加至50 mg·L−1和25 mg·L−1时,小球藻和斜生栅藻的K值与空白组基本持平,说明两种微藻开始恢复正常生长. 之后,随3D-MgAl-LDH浓度增加,两种微藻的K值均大于空白组,说明两种藻对3D-MgAl-LDH毒性影响产生抗逆性,即对外界不利环境的适应能力.
-
选取3组3D-MgAl-LDH浓度(10、50、300 mg·L−1),研究不同时间(24 h、48 h、72 h、96 h)条件下,3D-MgAl-LDH对两种微藻的生长情况(藻细胞密度和生长抑制率)影响(图3).
由图3(a)和(c)可知,小球藻和斜生栅藻的藻密度随3D-MgAl-LDH暴露时间延长均持续增加,始终保持一定的生长. 结合藻细胞生长抑制率来看(图3(b)和(d)),各3D-MgAl-LDH浓度处理组的两种微藻在暴露不同时间后的抑制率均高于空白组,表明3D-MgAl-LDH对两种藻的生长均产生抑制作用. 此外,可观测到两种微藻的抑制率均随暴露时间延长逐渐减小,表明藻细胞对3D-MgAl-LDH的胁迫作用逐渐产生抗逆性. 值得注意的是,当3D-MgAl-LDH浓度为300 mg·L−1时,小球藻和斜生栅藻暴露24 h、48 h、72 h、96 h后的抑制率分别为99%、84.22%、54.24%、44.19%和80.44%、29.77%、16.14%、16.77%,相同时间条件下小球藻的抑制率均大于斜生栅藻的抑制率,表明小球藻对3D-MgAl-LDH毒性影响表现更敏感,而斜生栅藻对3D-MgAl-LDH毒性影响更耐受性,这与2.2.1节不同浓度3D-MgAl-LDH对两种微藻的影响结果类似.
-
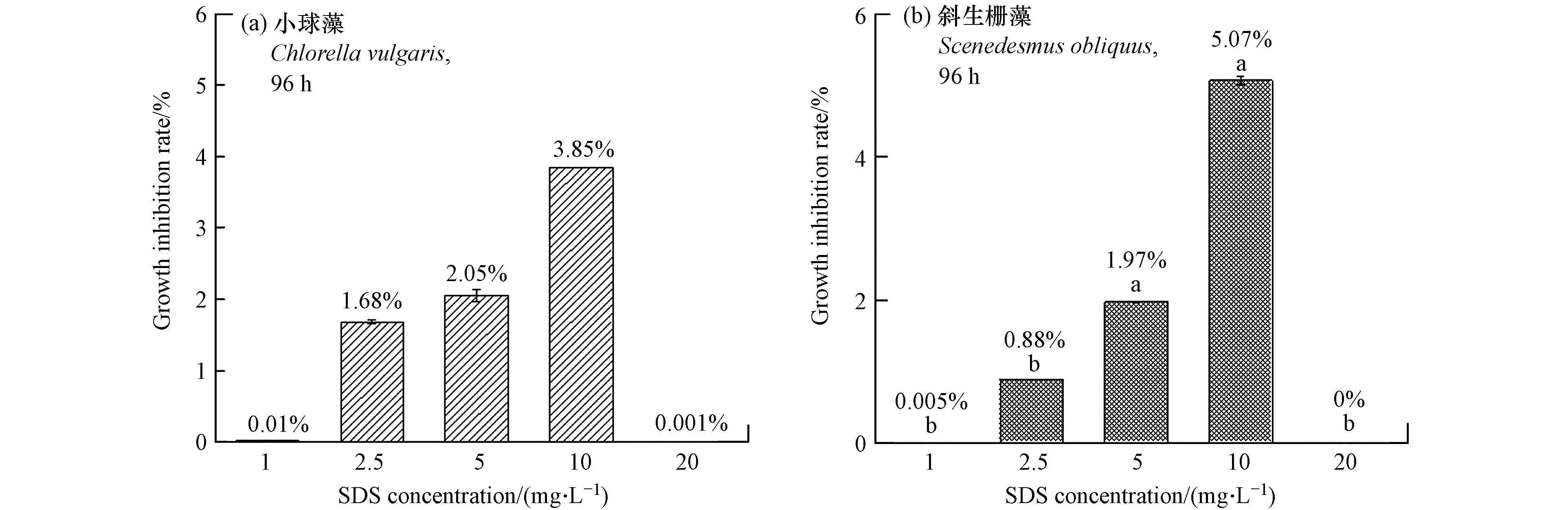
大量研究表明,纳米材料的溶出物质亦可能是其致毒的主要原因[35-37]. 本文考察了不同浓度3D-MgAl-LDH的Mg2+、Al3+及SDS溶出情况(表2). 由表2可知,当3D-MgAl-LDH浓度为300 mg·L−1 时,Mg2+溶出浓度仅为3.58 mg·L−1,其含量远低于BG11培养基中Mg2+浓度(7.32 mg·L−1),即微藻维持正常生长所需Mg2+浓度;Al3+浓度低于仪器检出限,未检出;SDS溶出浓度为20.41 mg·L−1. 因此,3D-MgAl-LDH溶出Mg2+和Al3+的毒性可忽略不计,SDS的毒性有待考究. 根据表2不同浓度3D-MgAl-LDH溶出SDS情况,本文设计1、2.5、5、10、20 mg·L−1的5个SDS浓度,研究单独SDS暴露对小球藻和斜生栅藻的96 h毒性影响,生长抑制率如图4所示.
由图4可知,SDS对两种微藻的生长抑制率均随SDS浓度增加呈现先增大(P<0.05)后下降(P<0.05)趋势. 在SDS浓度为10 mg·L−1时,SDS对小球藻和斜生栅藻的生长抑制率均达到最大值,分别为3.85%和5.07%;而在SDS浓度为20 mg·L−1时,SDS对两种藻的生长抑制率均减小,分别为0.001%和0%. 相应地,在3D-MgAl-LDH浓度为150 mg·L−1时,SDS对小球藻和斜生栅藻的生长抑制率分别为42.69%和18.19%;在3D-MgAl-LDH浓度为300 mg·L−1时,SDS对小球藻和斜生栅藻的生长抑制率分别为48.23%和15.84%(图2). 由此可见,本文中3D-MgAl-LDH溶出物质(Mg2+、Al3+、SDS)对两种微藻产生的毒性影响较小.
-
为进一步探究3D-MgAl-LDH对小球藻和斜生栅藻的致毒机制,本实验测定96 h急性毒性实验后两种微藻的细胞结构、光合色素含量和抗氧化酶活性.
-
细胞结构的完整性是微藻进行一切生命活动的基础,对于其维持正常生理功能具有重要作用. 图5为空白藻细胞(小球藻、斜生栅藻)与3D-MgAl-LDH处理组藻细胞的SEM图. 由图5可知,空白组的小球藻细胞呈现球形或者椭球形,细胞壁表面光滑,细胞直径范围在1—1.40 μm(图5a);空白组斜生栅藻细胞呈现纺锤形,表现为中间扁平而两端尖细,细胞壁表面光滑,细胞直径范围在6.38—9.85 μm(图5c). 由图可观测到,经3D-MgAl-LDH处理后的藻细胞周围被大量纳米片层包裹,小球藻细胞发生明显的挤压变形(图5b),斜生栅藻细胞表面也发生褶皱并且伴随细胞破裂现象(图5d).
-
微藻的光合色素主要包括叶绿素(叶绿素a和叶绿素b)和类胡萝卜素. 其中,叶绿素在微藻光合作用的光吸收中具有核心作用,也是微藻受到外界环境胁迫时常用的光合指标[38-39];类胡萝卜素可以吸收和传递光能、提高光合效率,是光合系统的保护机制[40].3D-MgAl-LDH对小球藻和斜生栅藻的96 h光合色素含量影响如图6所示. 由图6可知,两种藻的叶绿素含量均随3D-MgAl-LDH浓度增加呈现先减少后增加趋势(P<0.05). 具体表现为:当3D-MgAl-LDH浓度在0—25 mg·L−1范围,小球藻和斜生栅藻的叶绿素含量均最少,分别为9.19 mg·L−1和3.87 mg·L−1(P<0.05);当3D-MgAl-LDH浓度在25—300 mg·L−1范围,小球藻和斜生栅藻的叶绿素含量均有所增加(P<0.05),并于3D-MgAl-LDH浓度为300 mg·L−1时(11.74mg·L−1、5.35 mg·L−1)接近细胞正常生长状态的叶绿素含量(12.46 mg·L−1、4.56 mg·L−1)(P<0.05). 相应地,类胡萝卜素含量随3D-MgAl-LDH浓度变化呈现相似的变化趋势.
-
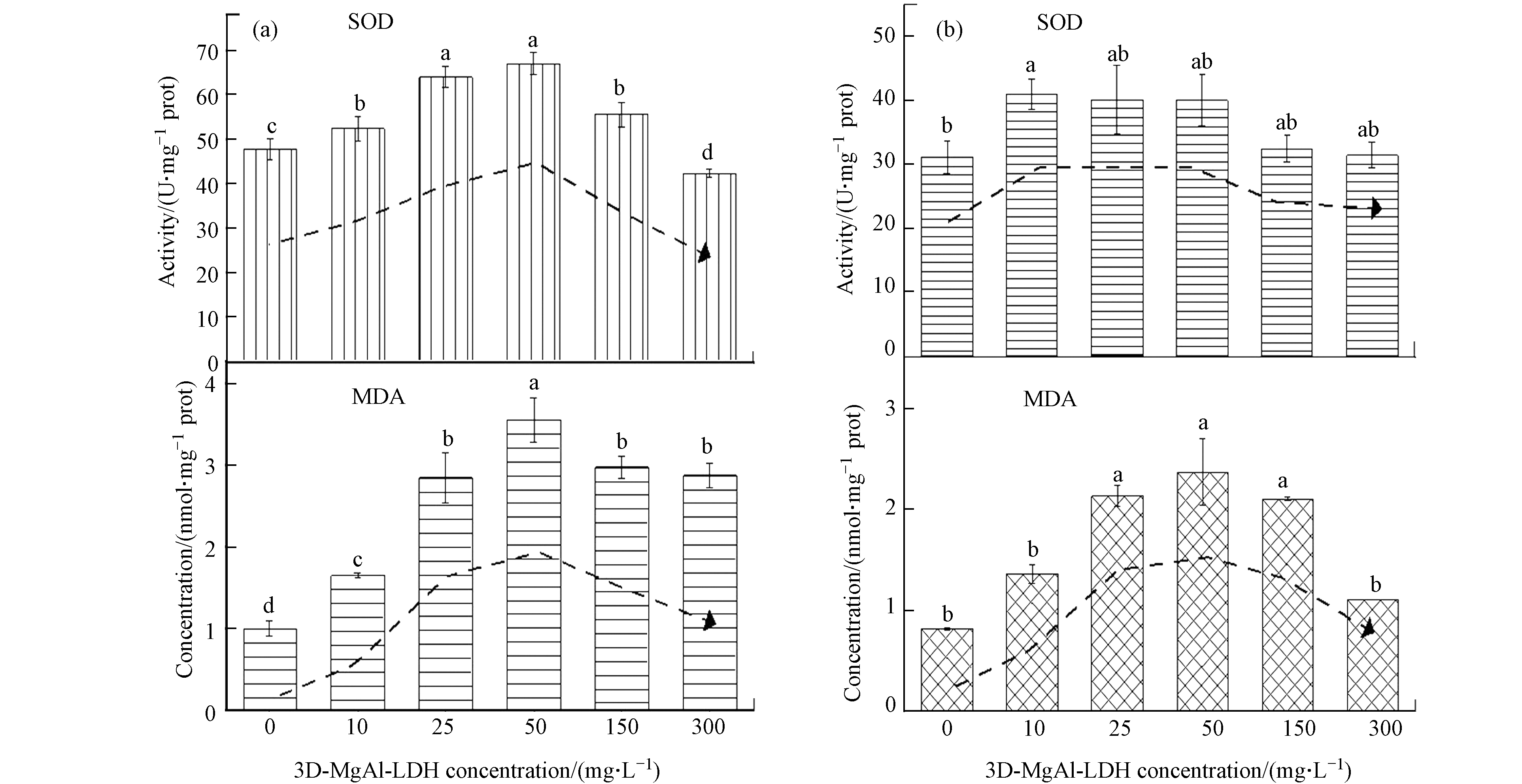
抗氧化酶系统主要包括超氧化物歧化酶(SOD)和丙二醛(MDA)等,是微藻体内有效的活性氧(ROS)清除系统,可将微藻受到外界环境胁迫所产生过量的活性氧(ROS)转化为毒害较低(如H2O2)或无害物质(如H2O和O2),以维持细胞正常代谢和机体平衡. 其中,SOD是生物体内重要的抗氧化酶,作为机体防御机制的产物,在机体氧化与抗氧化平衡中发挥重要作用[41-42];MDA则是机体受外界胁迫发生脂质过氧化反应的产物,间接说明细胞膜系统受损程度及生物抗逆性[43].图7为暴露96 h后3D-MgAl-LDH对小球藻和斜生栅藻的SOD和MDA活性影响. 由图7可知,两种藻的SOD和MDA活性均随3D-MgAl-LDH浓度增加呈现先升高后降低趋势(P<0.05),3D-MgAl-LDH浓度在0—50 mg·L−1时酶活性逐渐增加(P<0.05),在50—300 mg·L−1时酶活性逐渐减弱(P<0.05).
利用SDS改性制备的3D-MgAl-LDH具有良好的疏水特性[44],可通过疏水作用与微藻细胞膜结构上的磷脂双分子层中的半纤维素成分有效结合[45].3D-MgAl-LDH黏附在微藻细胞表面,一方面因纳米片层的不透光性减少微藻光吸收和阻碍光合作用,影响叶绿素的生成;另一方面其纳米片层割伤微藻细胞,破坏藻细胞结构并使叶绿体中叶绿素成分流出,产生大量活性氧并诱导氧化应激反应. 本研究中,低浓度3D-MgAl-LDH(0—25 mg·L−1)条件下,3D-MgAl-LDH的纳米片层包裹在微藻细胞表面,抑制叶绿体内囊体膜中的光系统II活性(PSII),降低微藻的光能捕获能力并阻碍其正常光合作用,致使叶绿体中叶绿素含量减少[46]. 而高浓度3D-MgAl-LDH(25—300 mg·L−1)条件下,微藻由于受到3D-MgAl-LDH的胁迫作用增强,启动自身防御机制,刺激叶绿体中类胡萝卜素含量增加,并促使其进一步生成和转化为叶绿素,以维持微藻的正常光合作用和生长过程,这种现象被定义为“遮光效应”[22]. Metzler等[47]在研究纳米颗粒对藻细胞叶绿素a的影响中也发现类似叶绿素含量增长现象,这是微藻抵制材料“遮光效应”而形成的一种机体保护机制. 同时,高浓度3D-MgAl-LDH(25—300 mg·L−1)的纳米片层也会割伤细胞,破坏细胞叶绿体结构,致使叶绿素成分的流出[46]. 此外,类胡萝卜素又是ROS猝灭剂,可以消除微藻细胞内产生的过量ROS,维持微藻处于氧化与抗氧化平衡的稳定状态. 高浓度3D-MgAl-LDH浓度(25—300 mg·L−1)条件下,两种微藻的类胡萝卜素含量均显著增加(P<0.05),这是由于微藻体内产生了大量的ROS,发生氧化应激反应所致.
SOD是生物体内重要的抗氧化酶,是机体清除ROS的产物,在机体氧化与抗氧化平衡中发挥重要作用[41-42];MDA则是机体受外界胁迫发生脂质过氧化反应的产物,间接说明细胞结构受损程度及生物抗逆性. 本研究中,当3D-MgAl-LDH浓度在0—50 mg·L−1范围时,两种微藻的SOD和MDA活性均逐渐增加(P<0.05),说明藻细胞产生过量ROS,细胞膜脂质过氧化程度增强、细胞受损程度增加,此时微藻生长受到抑制;而当3D-MgAl-LDH浓度在50—300 mg·L−1范围时,两种微藻的SOD和MDA活性均逐渐减弱(P<0.05),说明藻细胞的ROS逐渐被清除、细胞膜脂质过氧化程度有所减弱,此时微藻产生了抗逆性.
-
(1)随3D-MgAl-LDH浓度增加,小球藻和斜生栅藻的抑制率整体呈增加趋势(P<0.05),且在相同3D-MgAl-LDH浓度条件下,小球藻的生长抑制率均大于斜生栅藻,这表明小球藻对3D-MgAl-LDH毒性影响表现更为敏感,而斜生栅藻对3D-MgAl-LDH影响表现出更强的耐受性.
(2)小球藻和斜生栅藻的抑制率均随暴露时间延长逐渐减小,当3D-MgAl-LDH浓度为300 mg·L−1时,小球藻和斜生栅藻暴露24 h、48 h、72 h、96 h后的抑制率分别为99%、84.22%、54.24%、44.19%和80.44%、29.77%、16.14%、16.77%,这表明微藻对3D-MgAl-LDH的胁迫作用逐渐产生抗逆性.
(3)当3D-MgAl-LDH浓度在0—25 mg·L−1范围,小球藻和斜生栅藻的叶绿素含量均在3D-MgAl-LDH浓度为25 mg·L−1时达到最小值,分别为9.19 mg·L−1和3.87 mg·L−1(P<0.05);当3D-MgAl-LDH浓度在25—300 mg·L−1范围,小球藻和斜生栅藻的叶绿素含量均有所增加(P<0.05),并于3D-MgAl-LDH浓度为300 mg·L−1时(11.74 mg·L−1、5.35 mg·L−1)接近细胞正常生长状态的叶绿素含量(12.46 mg·L−1、4.56 mg·L−1).
(4)3D-MgAl-LDH对小球藻和斜生栅藻的致毒机制包括3D-MgAl-LDH纳米片层对两种微藻的细胞割伤、黏附在微藻表面影响光合作用产生的遮光效应以及诱导微藻生成大量活性氧所导致的氧化应激.
三维镁铝层状双金属氢氧化物对微藻的毒性影响及致毒机制
Toxicity effects and mechanism of three-dimensional MgAl layered double hydroxides to microalgae
-
摘要: 为探究三维镁铝层状双金属氢氧化物(3D-MgAl-LDH)对微藻的毒性影响及致毒机制,本研究选取小球藻(Chlorella vulgaris)和斜生栅藻(Scenedesmus obliquus)作为受试藻,借助X射线粉末衍射仪、傅里叶红外光谱仪、扫描电子显微镜和激光粒径分析仪等测试技术表征3D-MgAl-LDH的组成及形貌,通过改变3D-MgAl-LDH暴露浓度、暴露时间以及溶出物质SDS浓度,明晰各因素对两种微藻的毒性影响,并测定3D-MgAl-LDH暴露后微藻的细胞结构、光合色素含量和抗氧化酶(MDA、SOD)活性以揭示其致毒机制. 结果表明:1)3D-MgAl-LDH是由LDH和SDS共组成的三维花状材料. 2)随3D-MgAl-LDH浓度增加,两种微藻的生长抑制率均呈增加趋势(P<0.05),其中小球藻对3D-MgAl-LDH毒性影响更为敏感,而斜生栅藻对3D-MgAl-LDH毒性影响表现出更强的耐受性. 3)随3D-MgAl-LDH暴露时间延长,两种微藻的生长抑制率均逐渐减小,表明微藻对3D-MgAl-LDH的胁迫作用产生抗逆性. 4)3D-MgAl-LDH对小球藻和斜生栅藻的致毒机制主要包括细胞割伤、遮光效应和氧化应激. 本研究结果为LDHs应用于实际废水治理的潜在风险评估提供理论依据.
-
关键词:
- 三维镁铝层状双金属氢氧化物 /
- 小球藻 /
- 斜生栅藻 /
- 毒性影响 /
- 致毒机制.
Abstract: In order to explore the toxicity effect and toxicity mechanism of Three-dimensional MgAl layered double hydroxide(3D-MgAl-LDH) on microalgae, Chlorella vulgaris and Scenedesmus obliquus were selected as the tested algae. The composition and morphology of 3D-MgAl-LDH were characterized by x-ray diffraction (XRD), scanning electron microscope (SEM), fourier infrared spectroscopy (FT-IR) and laser particle size analyzer. To understand the toxicity effects, various experimental factors were systematically investigated, including exposure concentration, exposure time and SDS concentration of dissolved substances of 3D-MgAl-LDH. Moreover, the toxicity mechanisms were explored based on the analysis of cell structure, photosynthetic pigment content and antioxidant enzyme activity (MDA, SOD) of microalgae after 3D-MgAl-LDH exposure. Results showed that 1) 3D-MgAl-LDH composed by LDH and SDS exhibited a well three-dimensional flower-like structure. 2) With the increase of 3D-MgAl-LDH concentration, the inhibition rates of Chlorella vulgaris and Scenedesmus obliquus showed an increasing trend (P<0.05). In comparison, Chlorella vulgaris was more sensitive to 3D-MgAl-LDH toxicity, while Scenedesmus obliquus was more tolerant to 3D-MgAl-LDH toxicity. 3) With the extension of 3D-MgAl-LDH exposure time, the growth inhibition rates of both microalgae presented a gradually decreased trend, indicating that the microalgae possessed stress tolerance under 3D-MgAl-LDH stress. 4) The toxic mechanisms of 3D-MgAl-LDH on Chlorella vulgaris and Scenedesmus obliquus were cell laceration, shading effect and oxidative stress. This study provided a theoretical basis for potential risk assessment of the application of LDHs in practical wastewater treatment. -

-
图 1 常规LDH和3D-MgAl-LDH的X射线衍射图(a),SDS和3D-MgAl-LDH的傅里叶红外光谱(b),3D-MgAl-LDH的扫描电镜图(c),3D-MgAl-LDH的粒径分布图(d)和不同浓度3D-MgAl-LDH吸光度值变化情况(e)
Figure 1. XRD patterns of conventional LDH and 3D-MgAl-LDH (a),FT-IR spectra of SDS and 3D-MgAl-LDH (b),SEM image of 3D-MgAl-LDH (c),particle size distribution of 3D-MgAl-LDH (d) and changes in absorbance values of 3D-MgAl-LDH at different concentrations (e)
图 2 在不同浓度3D-MgAl-LDH中暴露96 h后的小球藻(a)和斜生栅藻(b)的生长抑制率
Figure 2. Growth inhibition rate of Chlorella vulgaris (a) and Scenedesmus Obliquus (b) at various 3D-MgAl-LDH concentration after 96 h exposure (different letters in the figure represent significant differences between treated groups with different concentrations,P<0.05)
图 7 暴露96 h后3D-MgAl-LDH 对小球藻(a)和斜生栅藻(b)MDA及SOD影响(图中小写字母代表不同浓度处理组间存在显著性差异,P<0.05)
Figure 7. The effect of 3D-MgAl-LDH on the MDA and SOD of Chlorella vulgaris(a)and Scenedesmus Obliquus(b)after 96 h (different letters in the figure represent significant differences between treated groups and different concentrations groups,P<0.05)
表 1 3D-MgAl-LDH对小球藻和斜生栅藻的细胞生长动力学参数
Table 1. Cells growth kinetic parameters of Chlorella vulgaris and Scenedesmus Oblique by 3D-LDHs
3D-MgAl-LDH 浓度 /(mg·L−1)
3D-MgAl-LDH concentration小球藻
Chlorella vulgaris斜生栅藻
Scenedesmus ObliquusA(×105)/(cells·mL−1) K/h−1 R2 A(×105)/(cells·mL−1) K/h−1 R2 0 4.20 0.034 0.998 15.00 0.020 0.951 10 3.95 0.032 0.997 14.43 0.019 0.943 25 3.50 0.033 0.997 13.40 0.021 0.951 50 2.74 0.035 0.998 10.88 0.021 0.966 150 1.94 0.037 0.996 9.31 0.023 0.958 300 0.96 0.044 0.996 10.56 0.022 0.927 注:A为微藻细胞外推密度,K为生长速率常数,R2为相关系数. 表 2 不同浓度3D-MgAl-LDH振荡96 h后的Mg2+、Al3 + 和SDS溶出浓度
Table 2. The amount of Mg2+,Al3 + and SDS dissolved by 3D-MgAl-LDH at different concentrations after 96 h
3D-MgAl-LDH 浓度/(mg·L−1)
3D-MgAl-LDH concentrationMg2+溶出浓度/(mg·L−1)
Mg2+ dissolution concentrationAl3+溶出浓度/(mg·L−1)
Al3+ dissolution concentrationSDS溶出浓度/(mg·L−1)
SDS dissolution concentration0 0 未检出 0 10 0.11 1.03 25 0.20 2.12 50 0.34 4.61 150 1.53 11.22 300 3.58 20.41 -
[1] 文若曦, 孙振东, 周群芳, 等. 人工合成纳米材料的生物可给性与毒性 [J]. 环境化学, 2017, 36(1): 1-15. doi: 10.1002/etc.3708 WEN R X, SUN Z D, ZHOU Q F, et al. Bioavailability and toxicity of engineered nanomaterials [J]. Environmental Chemistry, 2017, 36(1): 1-15(in Chinese). doi: 10.1002/etc.3708
[2] 章哲超, 胡佶, 刘淑霞, 等. 纳米二氧化硅与汞(Hg2+)对中肋骨条藻(Skeletonema costatum)的联合毒性效应 [J]. 环境化学, 2018, 37(4): 661-669. doi: 10.7524/j.issn.0254-6108.2017081506 ZHANG Z C, HU J, LIU S X, et al. Effect of nano-SiO2 on the toxicity of Hg2+ to Skeletonema costatum [J]. Environmental Chemistry, 2018, 37(4): 661-669(in Chinese). doi: 10.7524/j.issn.0254-6108.2017081506
[3] 方梦园, 赵天慧, 赵晓丽, 等. 碳纳米管对腐殖酸的吸附及其环境意义 [J]. 环境化学, 2020, 39(10): 2897-2906. doi: 10.7524/j.issn.0254-6108.2019111002 FANG M Y, ZHAO T H, ZHAO X L, et al. Effect of humic acid on adsorption and sedimentation of carboxylic multi-walled carbon nanotubes with different diameters [J]. Environmental Chemistry, 2020, 39(10): 2897-2906(in Chinese). doi: 10.7524/j.issn.0254-6108.2019111002
[4] HASSANPOUR M, HOSSEINI TAFRESHI S A, AMIRI O, et al. Toxic effects of Fe2WO6 nanoparticles towards microalga Dunaliella salina: Sonochemical synthesis nanoparticles and investigate its impact on the growth [J]. Chemosphere, 2020, 258: 127348. doi: 10.1016/j.chemosphere.2020.127348 [5] 王亲媛. 有机三维层状双金属氢氧化物对藻类的致毒机制研究[D]. 南昌∶南昌大学, 2021. WANG Q Y. Toxicity in algal induced by organic three-dimensional layered double hydroxides [D]. Nanchang: Nanchang University, 2021 (in Chinese).
[6] CHATTERJEE A, BHARADIYA P, HANSORA D. Layered double hydroxide based bionanocomposites [J]. Applied Clay Science, 2019, 177: 19-36. doi: 10.1016/j.clay.2019.04.022 [7] ZHAO D L, SHENG G D, HU J, et al. The adsorption of Pb (II) on Mg2Al layered double hydroxide [J]. Chemical Engineering Journal, 2011, 171(1): 167-174. doi: 10.1016/j.cej.2011.03.082 [8] FOGG A M, DUNN J S, SHYU S-G, et al. Selective ion-exchange intercalation of isomeric dicarboxylate anions into the layered double hydroxide [LiAl2(OH)6]Cl·H2O [J]. Chemistry of Materials, 1998, 10(1): 351-355. doi: 10.1021/cm9705202 [9] AI L H, ZHANG C Y, MENG L Y. Adsorption of methyl orange from aqueous solution on hydrothermal synthesized Mg–Al layered double hydroxide [J]. Journal of Chemical & Engineering Data, 2011, 56(11): 4217-4225. [10] ZHANG P, ZHANG L J, KE Z S, et al. Sulfate-loaded layered double oxide: A bifunctional adsorbent for simultaneous purification of metal ion and anionic dye [J]. Applied Clay Science, 2022, 216: 106366. doi: 10.1016/j.clay.2021.106366 [11] LI T, LI G H, LI L H, et al. Large-scale self-assembly of 3D flower-like hierarchical Ni/co-LDHs microspheres for high-performance flexible asymmetric supercapacitors [J]. ACS Applied Materials & Interfaces, 2016, 8(4): 2562-2572. [12] YU X Y, LUO T, JIA Y, et al. Three-dimensional hierarchical flower-like Mg-Al-layered double hydroxides: Highly efficient adsorbents for As (V) and Cr (VI) removal [J]. Nanoscale, 2012, 4(11): 3466-3474. doi: 10.1039/c2nr30457k [13] ZHOU L, SLANÝ M, BAI B B, et al. Enhanced removal of sulfonated lignite from oil wastewater with multidimensional MgAl-LDH nanoparticles [J]. Nanomaterials(Basel, Switzerland), 2021, 11(4): 861. [14] QLAN H B, HUANG S D, BA Z C, et al. HTO/cellulose aerogel for rapid and highly selective Li+ recovery from seawater [J]. Molecules (Basel, Switzerland), 2021, 26(13): 4054. doi: 10.3390/molecules26134054 [15] LU N, WANG Y Q, NING S Q, et al. Design of plasmonic Ag-TiO2/H3PW12O40 composite film with enhanced sunlight photocatalytic activity towards o-chlorophenol degradation [J]. Scientific Reports, 2017, 7: 17298. doi: 10.1038/s41598-017-17221-4 [16] TEELING H, FUCHS B M, BENNKE C M, et al. Recurring patterns in bacterioplankton dynamics during coastal spring algae blooms [J]. eLife, 2016, 5: e11888. doi: 10.7554/eLife.11888 [17] ZHOU X, ZHEG Y, TANG Y Y, et al. Artificial regulation of state transition for augmenting plant photosynthesis using synthetic light-harvesting polymer materials [J]. Science Advances, 2020, 6(35): eabc5237. doi: 10.1126/sciadv.abc5237 [18] 罗潇宇, 任垠安, 高浩杰, 等. 2种类型多壁碳纳米管对蛋白核小球藻的毒理研究 [J]. 生态毒理学报, 2018, 13(6): 333-341. LUO X Y, REN Y N, GAO H J, et al. The toxicology effects of two types of multi-walled carbon nanotubes on the physiology of Chlorella pyrenoidosa [J]. Asian Journal of Ecotoxicology, 2018, 13(6): 333-341(in Chinese).
[19] MIAO A J, SCHWEHR K A, XU C, et al. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances [J]. Environmental Pollution, 2009, 157(11): 3034-3041. doi: 10.1016/j.envpol.2009.05.047 [20] SCHWAB F, BUCHELI T D, LUKHELE L P, et al. Are carbon nanotube effects on green algae caused by shading and agglomeration [J]. Environmental Science & Technology, 2011, 45(14): 6136-6144. [21] 马菲菲, 孙雪梅, 韩倩, 等. 不同粒径 TiO2 颗粒对海洋微藻的毒性效应 [J]. 海洋学报(中文版), 2015, 37(10): 100-105. MA F F, SUN X M, HAN Q, et al. Toxic effects of TiO2 particles with different size on the marine microalga [J]. Acta Oceanologica Sinica, 2015, 37(10): 100-105(in Chinese).
[22] DING T D, LIN K D, CHEN J, et al. Causes and mechanisms on the toxicity of layered double hydroxide (LDH) to green algae Scenedesmus quadricauda [J]. Science of the Total Environment, 2018, 635: 1004-1011. doi: 10.1016/j.scitotenv.2018.04.222 [23] JIANG Y Q, ZHANG H G, WANG Y G, et al. Modulation of apoptotic pathways of macrophages by surface-functionalized multi-walled carbon nanotubes [J]. PLoS One, 2013, 8(6): e65756. doi: 10.1371/journal.pone.0065756 [24] PAN X M, ZHANG M M, LIU H L, et al. Adsorption behavior and mechanism of acid orange 7 and methylene blue on self-assembled three-dimensional MgAl layered double hydroxide: Experimental and DFT investigation [J]. Applied Surface Science, 2020, 522: 146370. doi: 10.1016/j.apsusc.2020.146370 [25] ZHANG J, XIE X L, LI C J, et al. The role of soft colloidal templates in the shape evolution of flower-like MgAl-LDH hierarchical microstructures [J]. RSC Advances, 2015, 5(38): 29757-29765. doi: 10.1039/C5RA01561H [26] YU J Y, FAN G L, YANG Y, et al. Multi-level three-dimensional Mg-Al layered double hydroxide hierarchical microstructures with enhanced basic catalytic property [J]. Journal of Colloid and Interface Science, 2014, 432: 1-9. doi: 10.1016/j.jcis.2014.06.054 [27] SUN Y L, GAO X, YANG N, et al. Morphology-controlled synthesis of three-dimensional hierarchical flowerlike Mg-Al layered double hydroxides with enhanced catalytic activity for transesterification [J]. Industrial & Engineering Chemistry Research, 2019, 58(19): 7937-7947. [28] CREPALDI E L, PAVAN P C, TRONTO J, et al. Chemical, structural, and thermal properties of Zn (II)-Cr (III) layered double hydroxides intercalated with sulfated and sulfonated surfactants [J]. Journal of Colloid and Interface Science, 2002, 248(2): 429-442. doi: 10.1006/jcis.2002.8214 [29] LICHTENTHALER H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes [J]. Methods in Enzymology:Elsevier, 1987, 148: 350-382. [30] LI B, HE J, EVANS D G. Experimental investigation of sheet flexibility of layered double hydroxides: One-pot morphosynthesis of inorganic intercalates [J]. Chemical Engineering Journal, 2008, 144(1): 124-137. doi: 10.1016/j.cej.2008.06.031 [31] ZHANG Q R, TENG J, ZOU G D, et al. Efficient phosphate sequestration for water purification by unique sandwich-like MXene/magnetic iron oxide nanocomposites [J]. Nanoscale, 2016, 8(13): 7085-7093. doi: 10.1039/C5NR09303A [32] ZHANG P, HE T, LI P, et al. New insight into the hierarchical microsphere evolution of organic three-dimensional layer double hydroxide: The key role of the surfactant template [J]. Langmuir:the ACS Journal of Surfaces and Colloids, 2019, 35(42): 13562-13569. doi: 10.1021/acs.langmuir.9b02465 [33] YU J F, LIU J J, CLEARFIELD A, et al. Synthesis of layered double hydroxide single-layer nanosheets in formamide [J]. Inorganic Chemistry, 2016, 55(22): 12036-12041. doi: 10.1021/acs.inorgchem.6b02203 [34] PUIG GIRIBETS M, SANTOS M, GARCIA GUERREIRO M P. Basal hsp70 expression levels do not explain adaptive variation of the warm-and cold-climate O3+4+7 and OST gene arrangements of Drosophila subobscura [J]. BMC Evolutionary Biology, 2020, 20(1): 17. doi: 10.1186/s12862-020-1584-z [35] QIU T A, GUIDOLIN V, HOANG K, et al. Nanoscale battery cathode materials induce DNA damage in bacteria [J]. Chemical Science, 2020, 11(41): 11244-11258. doi: 10.1039/D0SC02987D [36] GUO R Z, LIN Y F, Zheng Y F, et al. The microbial changes in subgingival plaques of orthodontic patients: A systematic review and meta-analysis of clinical trials [J]. BMC Oral Health, 2017, 17(1): 90. doi: 10.1186/s12903-017-0378-1 [37] GRANADOS A, PLEIXATS R, VALLRIBERA A. Recent advances on antimicrobial and anti-inflammatory cotton fabrics containing nanostructures [J]. Molecules (Basel, Switzerland), 2021, 26(10): 3008. doi: 10.3390/molecules26103008 [38] FAN J H, CUI Y B, WAN M X, et al. Lipid accumulation and biosynthesis genes response of the oleaginous Chlorella pyrenoidosa under three nutrition stressors [J]. Biotechnology for Biofuels, 2014, 7(1): 17. doi: 10.1186/1754-6834-7-17 [39] LIU Y H, WANG S, WANG Z, et al. TiO2, SiO2 and ZrO2 nanoparticles synergistically provoke cellular oxidative damage in freshwater microalgae [J]. Nanomaterials, 2018, 8(2): 95. doi: 10.3390/nano8020095 [40] KHANNA K, JAMWAL V L, GANDHI S G, et al. Metal resistant PGPR lowered Cd uptake and expression of metal transporter genes with improved growth and photosynthetic pigments in Lycopersicon esculentum under metal toxicity [J]. Scientific Reports, 2019, 9: 5855. doi: 10.1038/s41598-019-41899-3 [41] HUSAIN H, LATIEF U, AHMAD R. Pomegranate action in curbing the incidence of liver injury triggered by Diethylnitrosamine by declining oxidative stress via Nrf2 and NFκB regulation [J]. Scientific Reports, 2018, 8: 8606. doi: 10.1038/s41598-018-26611-1 [42] TURKEZ H, GEYIKOGLU F, MOKHTAR Y I, et al. Eicosapentaenoic acid protects against 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin-induced hepatic toxicity in cultured rat hepatocytes [J]. Cytotechnology, 2012, 64(1): 15-25. doi: 10.1007/s10616-011-9386-1 [43] LI F, DUAN T Y, LI Y Z. Effects of the fungal endophyte epichloë festucae var. lolii on growth and physiological responses of perennial ryegrass cv. fairway to combined drought and pathogen stresses [J]. Microorganisms, 2020, 8(12): 1917. doi: 10.3390/microorganisms8121917 [44] ZHANG P, QIAN G R, XU Z P, et al. Effective adsorption of sodium dodecylsulfate (SDS) by hydrocalumite (CaAl-LDH-Cl) induced by self-dissolution and re-precipitation mechanism [J]. Journal of Colloid and Interface Science, 2012, 367(1): 264-271. doi: 10.1016/j.jcis.2011.10.036 [45] DIETZ A C, SCHNOOR J L. Advances in phytoremediation [J]. Environmental Health Perspectives, 2001, 109(Suppl 1): 163-168. doi: 10.1289/ehp.01109s1163 [46] 潘雪梅. 有机三维层状双金属氢氧化物和甲基橙复合体系对小球藻的生物效应及机制研究[D]. 南昌∶南昌大学, 2021. PAN X M. Study on biological effect and mechanism of composite system of organic three-dimensional layered double hydroxides and methyl orange on Chlorella vulgaris[D]. Nanchang: Nanchang University, 2021 (in Chinese).
[47] METZLER D M, ERDEM A, TSENG Y H, et al. Responses of algal cells to engineered nanoparticles measured as algal cell population, chlorophyll a, and lipid peroxidation: Effect of particle size and type [J]. Journal of Nanotechnology, 2012, 2012: 237284. -




 下载:
下载: