-
氮是自然界植物和动物生长所必须的营养元素,硝酸盐是农作物的重要养分,并在维持水生生态系统中起着关键作用[1]. 然而,过量的硝酸盐进入水环境会导致水体富营养化,引起藻类和浮游植物大量生长,并导致水华和赤潮[2]. 此外,长期饮用含过量硝酸盐的水会对人类健康造成潜在影响,如糖尿病、自然流产、甲状腺疾病、直肠癌和胃癌等[3]. 世界卫生组织规定,水体中硝酸盐的允许浓度为50 mg∙L−1,饮用水中硝酸盐含量最高含量不超过10 mg∙L−1[4-5]. 人类生活、工农业生产排放导致水体中硝酸盐浓度持续增加,采取一系列技术手段进行氮净化刻不容缓.
水体硝酸盐污染的修复治理方法主要有化学法、物理法及生物法[6-8]. 相对于生物法,物理化学吸附具有效率高、操作和工艺简单的特点,适用于需要硝酸盐快速去除的场景. 为了提高吸附剂吸附性能,通常在吸附剂表面引入官能团或者金属离子等,以调节其物理化学性质[9]. 表面含有大量羟基的壳聚糖,可作为吸附剂用于去除水中硝酸盐,然而其在酸性环境中的稳定性较低,实际水处理应用受到限制;有研究通过在壳聚糖中引入功能性官能团以改善其结构性能,但制备过程较为复杂[10];氧化镁改性后的生物炭可以提高硝酸盐去除效率,然而处理成本高昂,因此不适合大规模应用[11]. 季铵盐作为一种阳离子表面活性剂,常被用于吸附剂表面修饰. 研究表明,季铵盐功能化吸附剂对硝酸盐具有较高亲和力[12-13],季铵盐改性蒙脱土对硝酸盐等阴离子表现出优异的吸附性能[14]. 壳聚糖珠与环氧丙基三甲基氯化铵交联得到的季铵化壳聚糖珠对1000 mg∙L−1硝酸盐溶液吸附能力达到67.5 mg∙g-1[15].
进行阴离子吸附剂的功能化改性时,季铵盐的选择尤为重要,例如十二烷基二甲基溴化铵改性蒙脱石用于去除水中硝酸盐时,尽管最大吸附量达到8.77 mg∙g−1,但烷基季铵盐中Br– 在离子交换过程中会释放到水中,造成二次污染,故在制备吸附剂时需要用FeCl4–进一步处理[16]. 活性炭经十四烷基三甲基溴化铵处理后在25 ℃,pH=6.6,投加量为1 g∙L−1条件下对100 mg∙L−1
NO−3 的吸附量仅有1.94 mg∙g−1,将活性炭与碳纳米管进一步处理后,吸附量方可达到14.59 mg∙g−1[17]. 聚二烯丙基二甲基氯化铵(pDADMAC)为季铵盐的一种,在水体中极易电离带有正电荷,被广泛应用于废水和饮用水处理行业,具有絮凝藻类,细菌及有机物等物质的作用[18-21]. 相比于其他季铵盐类,pDADMAC毒性低且价格便宜. 有研究表明,pDADMAC改性活性炭颗粒可以增加水中磷酸根吸附,且改性方法简便,不会对水环境造成二次污染[22]. 活性炭具有高比表面积、丰富的孔隙率和良好的阳离子交换能力,被作为吸附剂广泛应用于气体净化、水处理、冶金和食品加工等领域. 目前,以活性炭为载体用于吸附硝酸盐的烷基季铵盐功能化吸附剂的研究还鲜见报道.本文用pDADMAC对活性炭进行改性,制备一种硝酸盐氮吸附剂. 通过对照实验,验证改性吸附剂的吸附能力;利用SEM和FT-IR表征改性前后材料的表面特性,以及吸附动力学和吸附等温线拟合分析,探讨其吸附机制;进一步地,根据重复性和干扰性实验,研究材料的重复利用性和抗阴离子干扰性能.
-
所用活性炭从市场购得. 硝酸钠(NaNO3)、磷酸二氢钠(NaH2PO4)、盐酸(HCl)、氢氧化钠(NaOH)、硫酸钠(Na2SO4)、氯化钠(NaCl)均购自国药集团上海化学试剂公司. 聚二烯丙基二甲基氯化铵(pDADMAC)购自山东优索化工科技有限公司.
所用仪器包括:UV-2000紫外分光光度计,尤尼柯(上海)仪器有限公司;RH-Q恒温振荡器,常州奥华仪器有限公司;磁力搅拌器,上海梅颖浦仪仪器制造公司;HACH HQ-40d pH计,美国哈希公司;Brookhaven NanoBrook 90 Plus PALS Zeta电位分析仪; Quanta-250环境扫描电子显微镜;傅立叶红外显微成像光谱仪,Thermo Fisher Scientific USA.
-
选用粒径0.5—1 mm活性炭颗粒(GAC),去离子水清洗后65 ℃烘干. 称取一定质量pDADMAC于塑料烧杯中,加入去离子水,磁力搅拌30 min得到混合均匀的pDADMAC溶液. 将5 g活性炭分别浸渍到64 mL 7.5—1000 g·L−1不同浓度的pDADMAC溶液中,室温搅拌24 h. 为去除非结合和松散结合的pDADMAC,用去离子水清洗数次,每次清洗30 min. 将清洗干净的活性炭于55 ℃烘箱内烘至恒重,即得到改性活性炭pDADMAC-GAC.
-
扫描电子显微镜(SEM)用于观察不同放大倍数(300倍和1000倍)下GAC和pDADMAC-GAC的表面形态和结构. 能量色散X射线光谱仪(DES)用于分析改性前后活性炭各元素含量. 用Brunauer- Emmett-Teller (BET) 法测量样品的比表面积和微孔尺寸分布. 傅立叶红外显微成像光谱仪(FT-IR)用于测定材料官能团. 使用Zeta电位分析仪测定材料表面Zeta电位. 紫外-可见光分光光度计用于测定溶液中硝酸盐的浓度.
-
称取不同质量硝酸钠,用去离子水配置不同质量浓度的
NO−3 溶液(以N计). 取上述溶液0.2 L于锥形瓶中,投加适量吸附剂,摇床130 r∙min−1振荡,水样经0.45 μm滤膜过滤后用紫外分光光度计测定硝酸根浓度,不同条件下吸附剂对溶液中NO−3 的平衡吸附量qe根据式(1)计算:式中,qe为平衡吸附量(mg∙g−1);C0为溶液中初始
NO−3 浓度(mg∙L−1);Ce为吸附平衡时溶液中NO−3 浓度(mg∙L−1);V为溶液体积(L);m为吸附剂质量(g). -
采用准一级动力学模型(2)、准二级动力学模型(3)和颗粒内扩散模型(4)对实验所得数据进行拟合处理,并对拟合参数进行分析以解释吸附机制[23-25]. 3种模型公式如下:
式中,qe和qt分别为吸附平衡时和t时刻
NO−3 吸附量(mg∙g−1);k1为准一级吸附速率常数(min−1);k2为准二级吸附速率常数(g∙(mg∙min)−1);kp为扩散速率常数(mg∙(g∙min−0.5)−1). -
采用Langmuir(5)和Freundlich(6)两种等温线方程对不同温度下所得数据进行拟合[26]:
式中,qe为平衡吸附量(mg∙g−1);C0为溶液中初始
NO−3 浓度(mg∙L−1);Ce为吸附平衡时溶液中NO−3 浓度(mg∙L−1);qmax为理论最大吸附量(mg∙g−1);b为Langmuir常数(L∙mg−1);KF是Freundlich吸附平衡常数;n为浓度指数. -
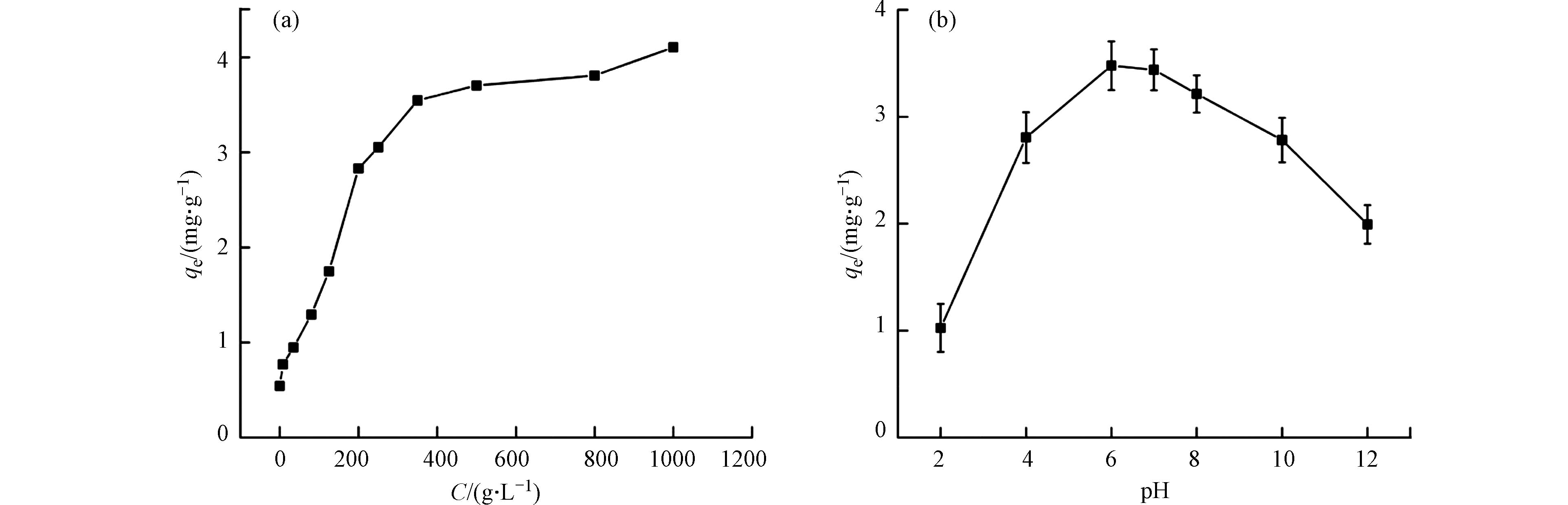
在0—1000 g∙L−1区间内设置11个pDADMAC改性浓度梯度,在pH=6、25 ℃、130 r∙min−1、0.2 g GAC条件下,对初始浓度为15 mg∙L−1的
NO−3 进行吸附,改性活性炭对NO−3 吸附量随pDADMAC浓度变化如图1(a)所示. 随着pDADMAC浓度的增加,改性吸附剂对NO−3 的平衡吸附量增加;当改性浓度达到350 g∙L−1后,平衡吸附量增长缓慢. 这是由于pDADMAC浓度过高,GAC表面结合位点有限,不能充分利用溶液中的pDADMAC. 因此,后续实验选择350 g∙L−1 pDADMAC溶液对GAC进行改性. -
溶液pH值对包括硝酸盐在内的许多吸附质的吸附性能有显著影响. 为探究体系中不同初始pH对pDADMAC-GAC吸附
NO−3 的影响,用0.1 mol∙L−1 HCl和NaOH两种溶液调整硝酸盐溶液的初始pH,分别向不同初始pH的硝酸盐溶液(0.2 L, 15 mg∙L−1)中投加0.2 g pDADMAC-GAC,结果如图1(b)所示. pH从2增加至6,吸附量持续增加,pH=6时增至最大(3.48 mg∙g−1). 这是由于pH较低时,溶液可以将NO−3 离子质子化以HNO3的形式存在,削弱其与吸附剂之间的静电吸引作用[27]; pH逐渐增加,静电吸引力增强,吸附剂的活性位点有利于NO−3 吸附,从而增强了NO−3 吸附能力. 在pH=6—12范围内,随着pH增加,OH –与NO−3 对pDADMAC-GAC表面吸附位点的竞争逐渐增强,不利于NO−3 吸附,从而导致被pDADMAC-GAC吸附的NO−3 逐渐下降[28]. 综上所述,最佳pH值为6,后续实验在此pH值下进行. -
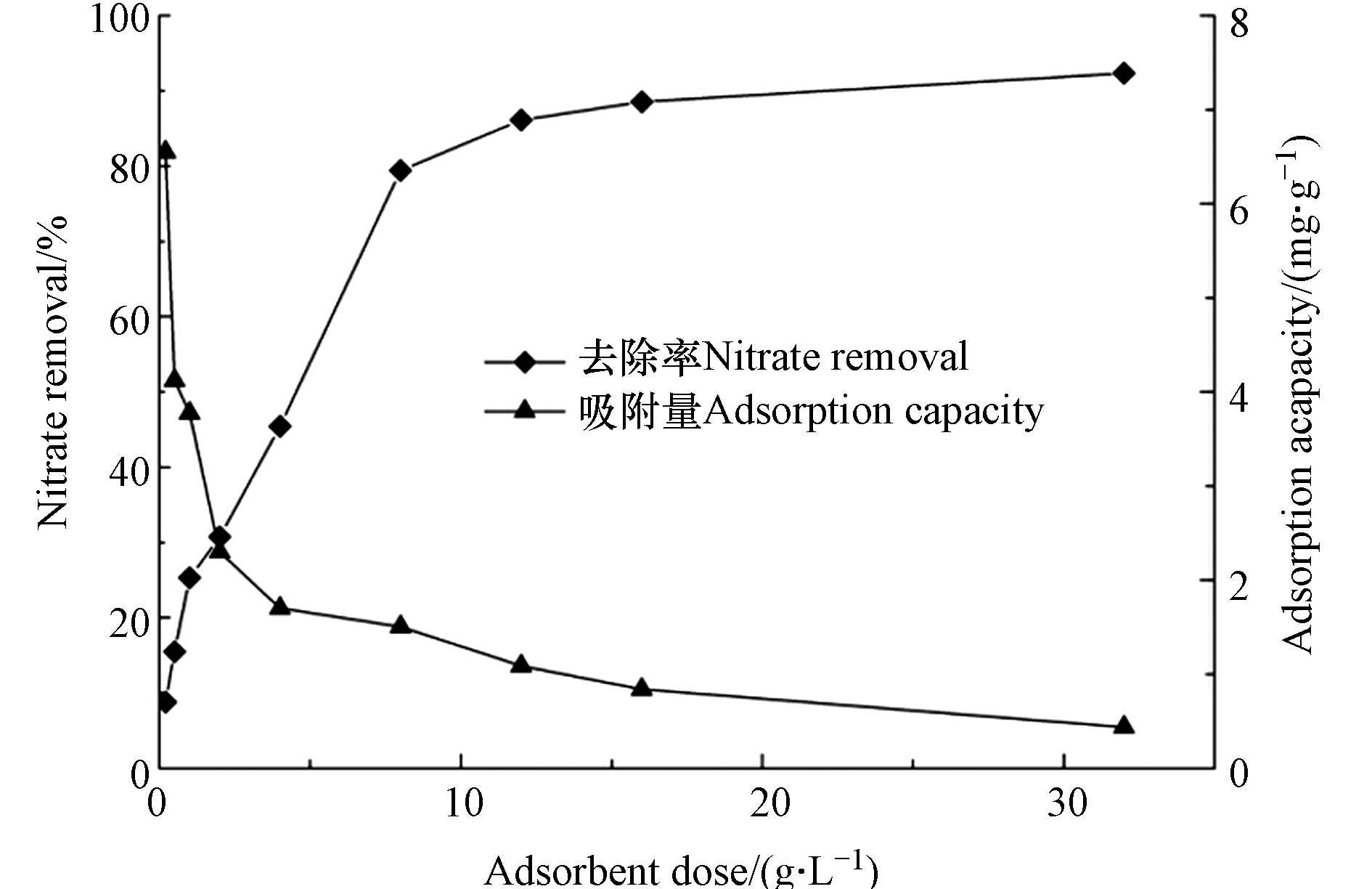
在350 g∙L−1 pDADMAC、pH=6、25 ℃条件下,分别向硝酸盐溶液(0.2 L, 15 mg∙L−1)中投加不同质量的pDADMAC-GAC,吸附效果见图2. 可见,当吸附剂投加量从0.2 g∙L−1增加至32 g∙L−1,
NO−3 去除率从8.78%提高至92.37%. 去除率显著增加主要归因于引入更多的吸附点位来去除NO−3 . pDADMAC-GAC吸附能力从6.55 mg∙g−1急剧下降至0.44 mg∙g−1,主要是由于大量未被占用的吸附位点造成的吸附能力损失. 从去除率以及经济成本两方面考虑,确定pDADMAC-GAC对NO−3 的最佳投加量为1 g∙L−1. -
利用SEM对GAC和pDADMAC-GAC(350 g∙L−1 pDADMAC、pH=6、25 ℃)的表面形态分析如图3. 改性前后活性炭均具有蜂窝状结构,但表面粗糙程度存在差异. 改性后活性炭表面更粗糙,凹凸不平. 该现象与BET结果一致,由表1,改性前后比表面积和孔容从948.12 m2∙g−1和0.41 cm2∙g−1下降至729.97 m2∙g−1和0.36 cm2∙g−1,分别减小23%和12%. 这是由于负载的pDADMAC占据了部分活性炭孔隙. EDS分析表明,改性前的吸附剂表面未检测到N元素,改性后有N元素出现,这是由pDADMAC的负载引入的. 进一步地,由图4 (a)可知,pDADMAC-GAC在1129 cm−1处有强吸收峰,这是胺类的C—N伸缩振动,这也验证了pDADMAC的成功负载.
图4表示改性前后不同pH条件下pDADMAC-GAC表面Zeta电位. 结果表明,GAC在pH=6—12范围内为负电位,与
NO−3 之间存在静电斥力,这限制了其对硝酸盐的吸附. 而pDADMAC-GAC在很宽的pH范围内逆转了GAC的表面电位. pH=6时吸附剂表面Zeta电位达到最大值+40.19 mV;当pH高于6时,Zeta电位逐渐减小,吸附剂表面带有的正电荷减少. 这与溶液初始pH对吸附量影响的结果一致,pH由6增加至8时,Zeta电位从+40.19 mV降至+36.75 mV,减少3.44 mV,NO−3 吸附量也相应减少7.59%. pDADMAC首先通过活性炭表面羧基和羟基的静电力和范德华力负载到活性炭表面,在此过程中只有一小部分胺基基团被活性炭表面负电荷中和,因此,pDADMAC对活性炭进行表面修饰时引入大量带正电荷的胺基基团,带负电荷的NO−3 可以通过与吸附剂表面正电荷点位之间的静电引力和离子交换作用而被吸附[22, 29]. -
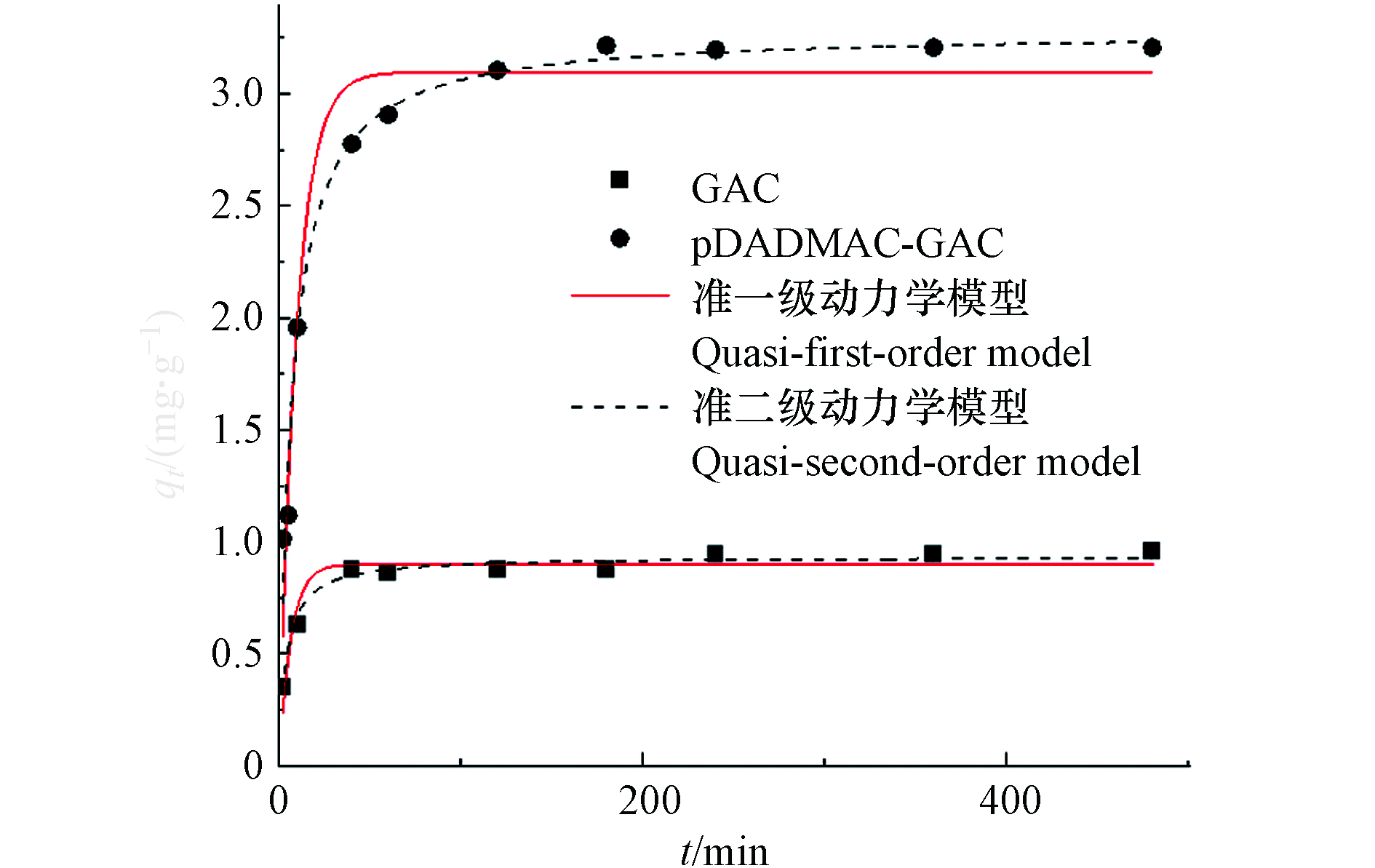
在前述获得的最佳改性浓度和吸附条件下,探究吸附剂对不同初始质量浓度
NO−3 (5、15、25 mg∙L−1)的吸附量随时间变化关系,采用准一级动力学、准二级动力学和颗粒内扩散模型对实验数据进行拟合.由图5可知,整个硝酸盐吸附动力学曲线大致包括3个阶段. 第一阶段(0—40 min)硝酸盐吸附量(qt)急剧增加,约占总吸附量的60.14%—86.35%;下一阶段(40—180 min)瞬时吸附速率逐渐降低,吸附剂对
NO−3 的吸附量逐渐趋于平衡状态,说明吸附剂表面的官能团被充分利用;第三阶段(180 min以后),吸附达到平衡,改性使得吸附量提高了3.36—5.06倍. 这是由于pDADMAC改性引入了叔胺基(—NH2),使活性炭带正电荷,这与Xia[30]等的研究结果相似.动力学拟合参数见表2. 准一级动力学决定系数R2值为0.9407—0.9875,准二级动力学R2值为0.9948—0.9999. pDADMAC-GAC平衡吸附量更接近准二级动力学模型拟合的最大吸附量. 当硝酸盐初始浓度为15 mg∙L−1时,pDADMAC-GAC平衡吸附量为3.22 mg∙g−1,准二级动力学模型拟合的最大吸附量为3.26 mg∙g−1,理论值和实际值相差甚微. 因此,准二级动力学更适合描述
NO−3 在pDADMAC-GAC上的吸附,这说明pDADMAC-GAC对NO−3 的吸附是化学吸附[23].颗粒内扩散模型拟合结果(表2)表明,随着
NO−3 浓度增加,颗粒内扩散速率常数kp增大,这说明NO−3 初始浓度对吸附效果有影响. 由动力学数据可知,NO−3 初始浓度增加,平衡吸附量也会相应增加,达到平衡需要的时间也会缩短,这与kp随NO−3 浓度变化的趋势一致[25]. -
3种温度下两种吸附等温线拟合结果如表3. 可见,其决定系数(R2)均大于0.9,说明两种模型均可用于描述pDADMAC-GAC的等温吸附过程;同一温度下Langmuir模型的R2值大于Freundlich模型,表明改性活性炭表面吸附位点分布均匀,以单分子层吸附为主[26].
浓度指数n是与吸附强度有关的常数. 3种温度下n均大于1,说明即使当水体中硝酸盐浓度较低时,pDADMAC-GAC仍具有较好的吸附量,可用于去除地表水和饮用水中的硝酸盐,且pDADMAC-GAC对硝酸盐的吸附容量受温度影响较小.
-
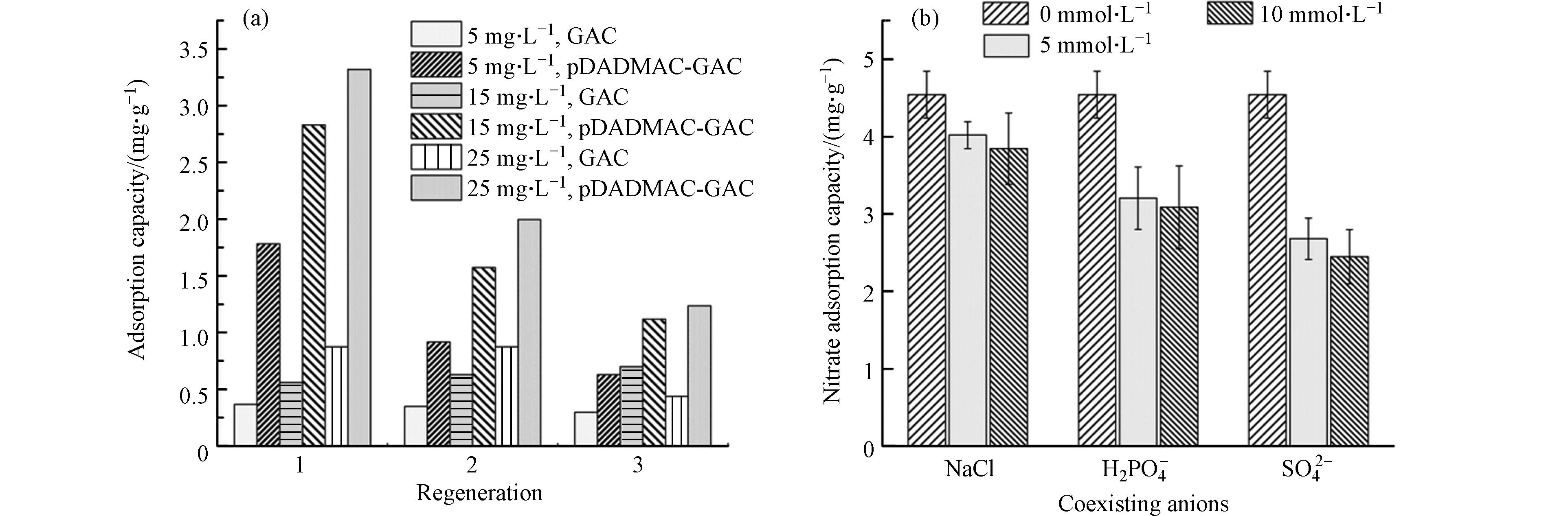
吸附材料的再生和重复利用性可以降低水污染修复的成本. 通过吸附解吸实验测试了pDADMAC-GAC的重复利用性. 在25 ℃,pH=6条件下,分别向初始浓度为5、15、25 mg∙L−1
NO−3 溶液(0.2 L)中投加0.2 g 吸附剂,待吸附平衡后计算NO−3 吸附量;然后以0.1 mmol∙L−1 NaCl溶液为淋洗液对吸附剂进行再生处理后进行再次吸附,结果如图6(a) . 吸附剂的吸附量随材料重用次数逐渐下降,第3次循环时吸附量较第2次损失约32.33%. 这意味着吸附位点不能完全被重新激活,部分NO−3 仍和吸附剂上的吸附位点相结合. 这说明pDADMAC-GAC吸附硝酸盐的机制既包括静电吸附又包括离子交换. 通过静电吸附的NO−3 可以从吸附剂解离,相应吸附位点得到再生;而通过离子键与pDADMAC-GAC结合的NO−3 则难以被解离. 尽管如此,连续3个吸附-解吸循环后pDADMAC-GAC吸附量约为GAC的2.3倍,具有明显高于GAC的吸附能力. 因此,pDADMAC-GAC具有一定的重复利用性. -
天然水中除
NO−3 外还有其它阴离子,与NO−3 之间可能存在竞争吸附. 选择天然水中常见的3种阴离子(Cl–、H2PO–4 及SO2−4 ),探究阴离子对NO−3 吸附的干扰. 在前述吸附条件下,向0.2 L,5 mmol∙L−1NO−3 溶液中分别加入 NaCl、NaH2PO4、Na2SO4,各阴离子与NO−3 摩尔比为1:1或2:1,待吸附平衡后计算吸附量. 需要注意的是,磷酸盐在pH=6条件下主要以H2PO4– 的形态存在,所以在探讨共存阴离子干扰作用时向溶液中投加的是NaH2PO4.由图6 (b)可知,当浓度由0增加至5 mmol∙L−1时,Cl–、
H2PO–4 及SO2−4 均会对NO−3 的吸附产生干扰(P<0.05);当3种阴离子浓度由5 mmol∙L−1提高至10 mmol∙L−1时,平衡吸附量无显著性差异(P>0.05),说明增大溶液中共存阴离子浓度,NO−3 平衡吸附量变化不大. 若硝酸盐仅通过静电力作用被吸附剂吸附,则共存阴离子浓度会明显抑制NO−3 吸附过程;若硝酸盐主要是通过离子交换被吸附剂吸附,则共存离子浓度对NO−3 吸附过程无影响[31]. 因此,进一步说明pDADMAC-GAC吸附硝酸盐的机制包括静电吸引和离子交换作用. 3种阴离子对NO−3 吸附的干扰作用大小为:Cl–<H2PO–4 <SO2−4 . 由于Cl–、H2PO–4 与NO−3 带有相同负电荷,存在对吸附位点的竞争,所以溶液中Cl–、H2PO–4 的存在会对NO−3 吸附产生一定干扰. 电荷密度大的多价阴离子比单价阴离子吸附更迅速,SO2−4 带有的负电荷比NO−3 多[32]. 因此SO2−4 更易被吸附剂通过静电作用吸附,从而对NO−3 的吸附产生较大影响[33-34]. -
(1)pDADMAC-GAC对NO3– 的吸附去除效果明显. 最佳条件为硝酸盐氮初始质量浓度为15 mg∙L−1时,pDADMAC改性浓度为350 g·L−1,吸附剂投加量1 g∙L−1,pH=6,25 ℃,
NO−3 平衡吸附量达到3.21 mg∙g−1.(2)FT-IR和Zeta结果表明pDADMAC负载到了活性炭表面,pDADMAC负载使得GAC表面的Zeta电位在pH=4—12范围内实现了由负到正的逆转. pDADMAC-GAC对硝酸根的吸附主要通过静电吸附和离子交换作用,本质上是一种单分子层化学吸附.
(3)pDADMAC-GAC连续3次吸附平衡-再生循环后吸附量约为GAC的2.3倍,具有可重复利用性;天然水体中的
SO2−4 、H2PO–4 和Cl–会影响吸附剂对NO−3 的吸附,共存阴离子对NO−3 吸附的影响强弱依次为:NO−3 >H2PO–4 > Cl–.(4)pDADMAC-GAC吸附剂制备过程简单,可以作为水处理过滤拦截材料,快速去除水中硝酸盐;还可用作生物反硝化处理区填料,将物理化学吸附与生物脱氮结合,提高硝酸盐去除效率.
pDADMAC改性活性炭对水中硝酸盐的吸附特性
Adsorption characteristics of nitrate in water by pDADMAC modified activated carbon
-
摘要: 相对于生化反硝化,吸附法对
NO−3 的去除速率更快. 自然胶体对NO−3 的吸附能力有限,研发高效、低成本、制备流程简便的NO−3 吸附剂具有重要价值. 用聚二烯丙基二甲基氯化铵(pDADMAC)改性活性炭(GAC),提升其Zeta电位,实现对NO−3 的高效吸附,并通过改性前后材料的形貌表征,探究其对水中NO−3 的吸附机制. 结果表明,pDADMAC负载到了活性炭表面,pDADMAC-GAC表面Zeta电位在pH=4—12范围内都得到了提升,因此在较宽的pH范围内对NO−3 都有良好的吸附效果. pDADMAC改性后的活性炭(pDADMAC-GAC)对NO−3 的吸附量明显提高,约为改性前的3.36—5.06倍. pDADMAC-GAC对NO−3 的吸附动力学过程符合准二级动力学,吸附过程以化学吸附为主;在25 ℃、 pH=6、初始NO−3 浓度为15 mg∙L-1条件下,准二级动力学模型计算得到的pDADMAC-GAC对硝酸盐的最大吸附量为3.26 mg∙g-1. Langmuir吸附等温线拟合效果最好,表明其主要是单分子层吸附. 重复性和干扰性实验表明,pDADMAC-GAC具有可重复利用性,水中共存的SO2−4 、H2PO−4 和Cl− 阴离子对NO−3 吸附有一定干扰. 综上,pDADMAC-GAC具有作为优良的NO−3 阴离子吸附剂的潜力.Abstract: Compared with biochemical denitrification, the adsorption process is more faster to the removal ofNO−3 from water. As natural colloids, their adsorption capacity ofNO−3 was limited, so, it is of great value to develop adsorbents with high efficiency, low cost and simple preparation process. In this study, activated carbon (GAC) was modified with polydiallyl dimethyl ammonium chloride (pDADMAC) to improve its Zeta potential and achieve the efficient adsorption capacity forNO−3 . The adsorption mechanism was investigated by the morphological characterization of the materials before and after modification. The results showed that pDADMAC was loaded on the surface of activated carbon, and the Zeta potential of pDADMAC-GAC surface increased in the range of pH 4—12, so it had a good adsorption performance onNO−3 in a wide range of pH. The adsorption capacity of pDADMAC-GAC toNO−3 was significantly increased, which was about 3.36—5.06 times of that before modification. The adsorption process of pDADMAC-GAC onNO−3 was corresponding with quasi-second-order kinetics model, which indicates the chemical adsorption is main. Under the conditions of 25 ℃, pH= 6 and initialNO−3 concentration of 15 mg∙L−1, the maximum adsorption capacity of pDADMAC-GAC on nitrate calculated by quasi-second-order kinetics model was 3.26 mg∙g−1. Langmuir model are better to correspond the adsorption isotherms, indicating that it is a monolayer adsorption. Repeatability and interference experiments showed that pDADMAC-GAC was reusable, and the coexistence ofSO2−4 ,H2PO−4 and Cl− anions in water interfered withNO−3 adsorption to a certain extent. In conclusion, pDADMAC-GAC has the potential to be an excellentNO−3 anionic adsorbent.-
Key words:
- nitrate adsorption /
- pDADMAC /
- modified activated carbon /
- kinetics /
- coexisting anions.
-
镉(Cd)是水产品中常见的重金属污染物,可以在水环境以及水生动物之间进行迁移转化,并沿着食物链在生物体内蓄积[1 − 2]. 前人研究发现,某些甲壳类水生动物对镉具有明显的蓄积特异性. 其中,三疣梭子蟹(Portunus trituberculatus)的镉蓄积问题尤为突出,引起了人们广泛关注.
三疣梭子蟹是一种生活在水深10—30 m砂质泥或砂质海底的杂食性螃蟹,广泛分布于太平洋的西海岸,北起日本的北海道,南至东南亚的越南、泰国等地[3]. 三疣梭子蟹肉质鲜美,风味独特,是一种深受中国人喜爱的具有较高营养和经济价值的海产品. 《2023中国渔业统计年鉴》[4]指出,2022年,我国海捕梭子蟹的产量就达到45.82万吨,占海捕蟹的70.75%. 然而,膳食摄入是人类暴露镉的主要途径[5],食物中的镉进入人体后会对肝脏、肾脏、骨骼、大脑等部位造成损伤,引起人体慢性中毒,进而产生生殖系统损伤、死亡率升高、预期寿命减少等负面影响[6]. 因此,三疣梭子蟹的食用安全风险问题同样受到广泛关注.
此外,相关的毒理学研究指出,不同形态的镉可能具有不同的生物学毒性[7]. 因此,在进行三疣梭子蟹的食用健康风险评价时,需考虑不同镉形态的毒性影响. 三疣梭子蟹中镉的赋存形态可以分为无机镉形态和有机镉形态[8]. 无机离子态镉可以通过不同的途径对生物体的某一器官和组织产生多方面的危害,如与体内的生物分子,包括酶和核酸等生物大分子相互作用[9]. 有机镉的具体形态目前尚未明确,并且关于有机镉的毒性机理研究也少有报道. 林建云等[10]实验指出有机结合态镉对水产动物的毒理效应和代谢作用与离子态镉(Cd2+)存在着明显的差异. 目前,国内外主要以总镉含量来评价三疣梭子蟹中镉的污染水平及食用健康风险,鲜少有针对镉形态的深入研究. 这使得三疣梭子蟹中镉的安全性评价缺乏不同镉形态的可靠数据与科学依据.
迄今为止,大部分研究主要围绕三疣梭子蟹中的镉蓄积水平、地区差异等问题进行,也有部分科学家开展了三疣梭子蟹中镉的蓄积机制及赋存形态问题的初步研究,但尚未有关于此问题的清晰明确的定论. 基于此,围绕三疣梭子蟹对镉的特异性蓄积问题,本文对三疣梭子蟹中镉的蓄积含量、分布特征及污染现状进行了综述,同时对三疣梭子蟹不同可食用组织中镉的赋存形态和健康风险评估的研究进展进行了总结分析,期望能为后续开展有关三疣梭子蟹中镉蓄积机制及赋存形态的研究提供科学参考与基础指导.
1. 三疣梭子蟹中镉的来源、污染现状及国内外限量标准(Cadmium in Portunus trituberculatus: sources, pollution situation ,domestic and international limit standards)
1.1 三疣梭子蟹中镉来源的研究进展
据报道[11 − 12],水生动物中的重金属来源主要分为两种,一种是表皮细胞或鳃等从周围水环境中直接吸收重金属,然后积累在外皮硬组织中;另一种来源则是含有重金属的颗粒状物质(饵料和沉积物颗粒)被水生动物摄食,通过食物链传递,积累在内脏软组织中. 对于甲壳类水生动物,研究人员认为重金属主要通过4个途径进入其体内. 第一,在甲壳类进行鳃呼吸时,重金属通过呼吸作用进入动物体内. 第二,某些甲壳类饵料中的金属离子通过摄食途径进入动物体内;第三,部分甲壳类动物的体表可通过与水体的渗透交换作用富集重金属;第四,水生动植物中富集的重金属通过食物链进入甲壳类体内[13].
三疣梭子蟹作为典型的甲壳类动物,目前关于其体内的镉来源的研究较少,并且对于三疣梭子蟹各可食组织中蓄积的镉具体来源也未见明确报道. 根据其他蟹类的相关研究[14 − 18],可以推测三疣梭子蟹中镉可能来源于两种途径:①环境途径,三疣梭子蟹的蟹壳和蟹腮与含镉介质(如水体、沉积物)直接接触,通过自由/被动扩散或Ca2+通道截留环境介质中的镉. ②摄食途径,三疣梭子蟹通过食物链从饵料或浮游动植物中富集镉. 作为研究三疣梭子蟹镉蓄积机制的重要组成部分,镉来源的研究还需要结合相关毒理学和生物学方法开展深入实验,以查明镉的不同来源对三疣梭子蟹体内蓄积机制的影响,同时有利于后续开展镉在三疣梭子蟹体内迁移、转运和归趋的相关研究.
1.2 三疣梭子蟹中镉的污染现状
三疣梭子蟹体内可检测出多种金属元素,镉是其中重要的有毒污染物. 尤炬炬等[19]对浙江沿海68个梭子蟹样品进行了铅、镉、总汞和无机砷的检测,发现镉含量远远高于其他重金属. 吴烨飞等[20]检测了梭子蟹中铅、镉、总汞和无机砷,只有镉存在污染问题. 可见,三疣梭子蟹中存在着明显的镉污染状况.
根据《食品安全国家标准 食品中污染物限量(GB2762—2012/GB2762—2017)》,甲壳类水产品中的镉含量不应超过0.5 mg·kg−1. 但在2012—2022年有关水产品重金属检测的报道中,全国各地市售的三疣梭子蟹普遍存在着镉超标问题(表1). 如高志杰等[21]采集了宁波市售的具有代表性的海产品进行重金属检测,发现其中镉含量最高的是梭子蟹6.808 mg·kg−1,超标率达74.5%,存在严重的镉污染现象. 樊伟等[22]研究了2007—2014年绍兴地区7类992份水产品的重金属污染情况,发现梭子蟹的镉污染最为严重,超标率为38.38%. 庞雨樵等[23]对新疆地区市售的6类水产品进行抽检,发现超标样品均为梭子蟹,最大镉浓度为2.1 mg·kg−1. 然而,即使三疣梭子蟹中镉超标问题严重,仍不能仅凭限量判定镉对三疣梭子蟹食用者的毒性大小和风险高低,还需要结合更科学的方法去研究和评价三疣梭子蟹中镉对人类的危害.
表 1 相关文献报道的三疣梭子蟹中镉含量水平及超标率Table 1. The cadmium concentrations and exceedance rates in Portunus trituberculatus reported in relevant literature采样地点Sampling region 采样年份Sampling year 报道年份Year of reporting 平均含量/(mg·kg−1)Average content 超标率/%Exceedance rate 参考文献Reference 宁波Ningbo 2012 2014 6. 808 74.5 [21] 绍兴Shaoxing 2007—2014 2016 0.90±1.35 38.38 [22] 廊坊Langfang — 2016 1.06 73.1 [24] 青岛Qingdao — 2017 2.79 100 [8] 渤海Bohai Sea 2014 2018 1.60 — [25] 温州Wenzhou 2013-2017 2020 1.99 88.4 [26] 山东Shandong — 2020 2.26 — [27] 舟山Zhoushan 2016 2021 1.44 75.6 [28] 莱州Laizhou — 2021 0.36 18.6 [29] 上海Shanghai 2021 2022 2.635 ±1.784 — [30] 注:“—”代表引用文献中未提供该信息. Note:‘—’represents in formation is not provided in the cited references. 1.3 国内外对三疣梭子蟹的限量
三疣梭子蟹对镉具有显著的蓄积特异性[31],其体内的镉含量往往远高于其他甲壳类水产品[32 − 33]. 可能是因为口虾姑[34]和三疣梭子蟹等海水蟹[35]具有不同于其他甲壳类水产品对镉的强蓄积特异性,在我国新实行的国标GB2762—2022《食品安全国家标准 食品中污染物限量》中,就将海蟹和虾蛄中的镉限量指标单独设立,把镉的限量值由原来的0.5 mg·kg−1调整为3 mg·kg−1. 除此之外,对限量值的改动,还可能是因为镉在不同生物体内的不同的赋存形态具有不同的生物利用率和生物学毒性. 依据我国相关检测标准,对水产品进行检测得到的镉总量是以毒性最高的无机离子态镉为限量值的评价标准. 但已有研究指出,三疣梭子蟹和虾蛄中的镉大部分以毒性较低的有机形态存在[8]. 因此,仅以0.5 mg·kg−1作为镉的限量标准,可能会高估三疣梭子蟹等海蟹和虾蛄中镉的毒性. 在港澳台地区,三疣梭子蟹中镉的限量标准有所不同. 澳门规定了去除内脏后的甲壳类镉的最高限量为2 mg·kg−1. 香港则是明确要求去除蟹壳和鳃后的整体(包括性腺、肝及其他消化器官)中镉的限量为2 mg·kg−1. 台湾地区仅规定甲壳类可食用组织限量值不超过0.5 mg·kg−1.
对于三疣梭子蟹中镉的限量值,国际上并没有统一的限量标准. 查阅相关法案文件(表2),可以发现不同国家相关的镉限量值有所不同,最低可至0.5 mg·kg−1,最高可至5.0 mg·kg−1,相差可至10倍. 不同国家的甲壳类水产品中镉含量限定对象的范围也有所不同. 比如,韩国、欧盟等国家会针对甲壳类不同组织进行限量值的规定. 对于各国镉限量差异问题,原因在于各国在划定限量值时没有统一的科学参考依据. 因此,有必要完善甲壳类中镉限量的判断指标. 不仅要根据甲壳类自身特征与生长环境进行评估,还要继续研究不同镉形态的毒理学效应,根据甲壳类中无机镉与总镉的占比情况,更细致地划分限量对象与限量值,更好地保障公众的食品安全.
表 2 部分组织或国家有关三疣梭子蟹中镉的限量值比较Table 2. The comparison of limit values for cadmium in Portunus trituberculatus in some organizations or countries组织或国家Organizations or countries 执行对象Implementation aims 限量值/(mg·kg−1)Limited value 执行标准/法规Implementing standards/regulations 中国China 甲壳类(海蟹、虾蛄除外)Crustaceans(except sea crabs and mantis shrimps) 0.5 GB2762—2022[36] 海蟹、虾蛄Sea crabs and mantis shrimps 3.0 中国澳门Macau, China 甲壳类(去除内脏)Crustaceans(Removal of internal organs) 2.0 第23/2018号行政法规食品中重金属污染物最高限量[37]Administrative Regulation No. 23/2018Maximum limits for heavy metal contaminants in food[37] 中国香港Hong Kong, China 蟹(去除壳和鳃后的整体)Crab (whole after shell and gills removed) 2.0 2018年食物搀杂(金属杂质含量)(修订)规例[38]Food adulteration (Metallic Contamination) (Amendment) Regulation 2018[38] 中国台湾Taiwan, China 甲壳类可食用组织Edible tissues of crustaceans 0.5 食品中污染物质及毒素卫生标准[39]Hygienic Standards for Contaminants and Toxins in Food [39]. 欧盟European Union 蟹类附肢的肌肉Muscles of crab appendages 0.5 European commission (EU) 2023/915 Regulation on the maximum levels of certain contaminants in food[40] 俄罗斯Russia 甲壳类Crustaceans 2.0 Customs Union TR CU 021/2011[41] 韩国South Korea 甲壳类Crustaceans 1.0 Food Code 2021[42] 带内脏的梭子蟹Swimming crab with entrails 5.0 美国American 甲壳类Crustaceans 3.0 Food and Drug Administration[43] 土耳其Turkey 甲壳类(蟹类的棕肉除外)Crustaceans(excluding brown meat of crabs) 0.5 Food Code 2011[44] 孟加拉Bangladesh 甲壳类Crustaceans 0.5 Bangladesh Bulletin 2014[41] 目前,我国对于食品中污染物的限量仍以总的可食用部分计算,并没有针对甲壳类特定组织的浓度限制. 在进行水产品质量安全检测时,若仅将各个可食组织混合检测,并不能全面准确地评价重金属对甲壳类动物的污染程度,也无法准确评估不同可食组织的重金属潜在健康风险. 因此,对甲壳类的不同食用组织进行分类限量,将有助于科学评价水产品质量.
2. 三疣梭子蟹的可食用组织中总镉的分布特征(Distribution characteristics of total cadmium in edible tissues of Portunus trituberculatus)
环境中的镉可以通过各种途径进入三疣梭子蟹体内,并以不同的速率在各种器官中积累[45]. 前人研究发现,镉在三疣梭子蟹体内不同组织的蓄积量存在差异[46]. 本文总结了三疣梭子蟹不同可食组织中总镉含量的研究现状,以了解镉在各可食组织中的分布特征,期待为后续镉蓄积相关研究提供参考.
2.1 肝胰腺
作为三疣梭子蟹体内重要的消化代谢器官,肝胰腺兼具肝脏和胰腺的功能,能够直接参与金属的摄取、存储和排泄[47]. 同时,肝胰腺作为镉的靶标器官,还会从生物体内的其他组织积累镉[48]. 此外,肝胰腺中存在的金属硫蛋白(metallothionein,MT)还被认为与三疣梭子蟹对重金属的解毒机制有关[49]. 有报道指出,三疣梭子蟹肝胰腺对镉的响应较敏感,能够在感应到镉的胁迫后迅速提高MT的表达[50],产生的MT结合游离的镉,形成低毒状态的金属硫蛋白-镉(cadmium-metallothionein,Cd-MT),从而降低血淋巴中的镉浓度,保证其他维持生命的器官和组织功能不受影响[51 − 53]. 因此,有学者认为三疣梭子蟹的肝胰腺可能是镉的主要蓄积组织[54].
由于肝胰腺与性腺位置相连,难以剥离,研究人员常检测的是肝胰腺和性腺的混合组织(棕肉),而不是单独检测肝胰腺组织. 因此,当前单独针对三疣梭子蟹肝胰腺组织进行镉检测的报道较少. 在仅有的报道中,有学者指出三疣梭子蟹的肝胰腺中镉含量显著高于其他可食组织[33]. 如牛红鑫等[55]对上海市售的梭子蟹中镉的残留量进行了调查,发现梭子蟹各部位中镉的含量为肝胰腺(18.44±10.50) mg·kg−1>性腺(0.49±0.37) mg·kg−1>肌肉(0.22±0.15) mg·kg−1. 然而,仅少量文献不足以说明肝胰腺对镉的蓄积特异性,往后还需要更多的研究支撑.
目前,关于肝胰腺中镉的来源、迁移与归趋的机理问题尚未有科学解释,也未有更深入的分子生物学上的研究. 并且,除了金属硫蛋白之外,肝胰腺是否存在其他蓄积镉的途径也未有明确定论. 综上可知,有关三疣梭子蟹肝胰腺的镉蓄积问题还需要不断探索.
2.2 性腺
三疣梭子蟹的性腺是消费者极为喜爱食用的组织,尤其是发育成熟的性腺[27]. 然而,专门检测三疣梭子蟹性腺中镉含量的报道非常少,绝大多数检测的是性腺与肝胰腺混合物(棕肉)中镉的含量水平. 因为三疣梭子蟹的性腺与肝胰腺位置极为相近,以往有观点认为性腺也可能是三疣梭子蟹中重要的镉蓄积组织. 有学者认为肝胰腺与性腺分布相近,两者在重金属富集分布上具有高度的相似性[33]. 此外,对于肝胰腺中某些脂类及蛋白质会在蟹类性成熟时期通过血淋巴转运至生殖腺,有学者推测某些脂溶性的镉形态可能会随之转移至性腺中[56]. 但棕肉中的镉含量并不能说明镉在性腺中蓄积的情况. 因为棕肉中的成分会因性腺发育时期的不同而产生差异. 例如,有的文献[24]检测的棕肉样品中性腺尚未发育,此时棕肉的成分几乎全是肝胰腺. 另有文献[30]对性成熟的梭子蟹样品中的棕肉进行检测,此时棕肉成分中除了肝胰腺以外,性腺也占有不小的比例. 因此,不能仅依靠棕肉的镉含量水平去单独判断肝胰腺或性腺对镉的蓄积能力.
目前,有极少量报道[32]单独检测了性腺中的镉含量,指出肝胰腺中的镉含量要高于性腺. 但是如此少量的报道,并不足以说明镉在三疣梭子蟹性腺中的蓄积情况,仍需要后续对性腺进行单独检测和研究. 性腺是三疣梭子蟹繁殖的重要器官,探究性腺中镉的蓄积情况,对研究镉对三疣梭子蟹可能存在的生殖毒性[57],以及对消费者食用三疣梭子蟹的安全风险评估研究有着重要意义. 值得注意的是,目前对于三疣梭子蟹性腺不同发育时期的镉含量检测未见报道. 性腺不同发育时期中镉含量的变化规律也是研究三疣梭子蟹中镉蓄积机制的重要部分. 因此,对于三疣梭子蟹性腺中镉的蓄积问题后续需要针对性腺不同发育时期进行更为详细和深入的实验与研究.
2.3 肌肉
在绝大多数报道中,三疣梭子蟹的肌肉(包括胸肌、腿肌、钳肌)较其他可食组织的镉含量水平最低. 如Mei等[28]对东海舟山渔场捕捞的三疣梭子蟹进行了检测,发现内脏组织的Cd水平大约是肌肉组织的9.5倍. 有研究指出,蟹类肌肉组织中的重金属含量与多种复杂因素有关,包括环境参数、种间的生理变异、以及重金属的理化性质、生物活性和累积特性等[58]. 蟹类肌肉中的镉主要来源于血淋巴的输送[59]. 研究指出,环境中的镉进入三疣梭子蟹体内后,会先经过肝胰腺的解毒,若是肝胰腺中重金属过度积累,会加快镉向肌肉组织迁移的速度[49]. 研究指出,镉与生物体中内源性物质亲和力的差异导致其在组织器官蓄积的异质性[60]. 因此,可能是肌肉对重金属的低亲和力导致了镉在肌肉中的蓄积量远低于其他组织[61].
图1展示了部分文献报道的三疣梭子蟹各个可食用组织中镉含量的堆积百分比. 可见,在多数报道中,三疣梭子蟹的可食组织被分为棕肉和白肉(肌肉)组织进行检测,且棕肉中镉含量占比显著高于白肉;对于肝胰腺和性腺分开检测的报道较少,仅有的报道显示肝胰腺中镉含量占比远高于性腺和肌肉组织. 综合而言,关于镉在三疣梭子蟹各可食组织中的分布特征,目前较为明确的是肌肉组织的镉含量水平明显低于其他可食组织,尤其是低于棕肉组织和肝胰腺组织;对于肝胰腺组织,较多学者猜测其为三疣梭子蟹的镉主要蓄积组织,但对其单独进行镉含量检测的报道较少,需要后续进行更多的实验和研究;对于性腺组织,有观点认为性腺也可能是三疣梭子蟹中重要的镉蓄积组织,但相关报道太少并不足以支撑此观点,因此后续仍需要学者们对性腺展开相关研究,尤其要针对性腺不同发育时期进行研究.
3. 镉在三疣梭子蟹可食组织中的赋存形态研究进展(The progress of chemical speciation of cadmium in the edible tissues of Portunustri tuberculatus)
重金属在环境中的迁移转化规律及其对生物的毒理学效应,并非取决于重金属的总浓度,而是由其赋存形态的性质决定[60]. 镉在三疣梭子蟹体内的赋存形态可分类为两种,一种是镉与有机物结合形成的有机镉形态,第二种则是镉以游离的无机离子态形式存在[65]. 多数毒理学研究指出,镉的毒性与其存在形态有关,无机游离态镉的毒性较高,有机结合态镉毒性较低[66]. 目前,镉在生物体内具体的赋存形态尚未清晰,针对具有镉蓄积特异性的三疣梭子蟹开展不同镉形态的分析,不仅有助于揭示三疣梭子蟹中镉的蓄积机制,同时也能为不同形态镉在其他生物体内的研究提供探索思路与数据支持.
3.1 不同镉形态的提取方法的研究进展
研究镉的形态,首先需要将不同形态的镉从生物体内提取和分离出来. 因此,选择适当的提取剂是准确测定镉形态的前提条件. 并且提取形态所用的提取剂应能将生物体内不同形态的镉完整而充分地提取且不破坏其原有形态结构. 水生生物中镉形态的研究起步较晚,关于土壤[67 − 69]、陆生植物[70 − 74]、藻类[75 − 76]中的镉形态提取分离模式和方法研究较多,且大多数提取方法是利用连续化学浸提法,即利用不同的提取剂进行分级提取后测定提取剂中的镉. 至于这些提取剂是否会在连续提取的过程中影响和破坏镉的具体化学形态,鲜有报道.
目前,有学者对水生生物中镉形态的提取开展了相关的研究. 先是有学者尝试用碱性酶缓冲液对海豚肝脏进行提取,发现提取到的可溶态镉只占镉总量的45%左右,且这部分镉全部都与蛋白质(非金属硫蛋白)相结合[77]. 除此之外,还有学者尝试用柠檬酸和琥珀酸两种有机酸溶剂提取牡蛎匀浆液中的镉,提取率可达到90.2%—91.8%,但未研究此种提取法是否会对镉形态产生影响[78]. 针对不同的浸提方法,李敏[65]分析了渔用饲料的镉形态,发现有机溶剂环己烷和乙醇无法浸提出饲料中的有机态镉,同时发现较低浓度的盐酸就能使有机态镉发生解离. 也有研究人员对比了不同提取剂的逐级提取效果,田姣姣等[79]对比了Tris-HCl缓冲溶液、HCl(pH值3.5)和碱性蛋白酶3种不同的提取剂对三疣梭子蟹可食用组织中镉形态逐级提取的效果,结果表明Tris-HCl具备较好的提取效果,对肝胰腺、性腺等组织的镉提取率高达90%,但对肌肉组织中的提取率仅为60%,仍有37%的非游离态镉存在,而经碱性蛋白酶处理后可有效溶出.
综上所述,镉形态的提取常用到酸性溶液、有机溶剂以及碱性蛋白酶缓冲液,但这些提取溶液的使用都有可能会引起有机镉形态的破坏,从而影响形态检测的结果. 目前,有研究人员开始使用与生物体生理条件相似的中性Tris-HCI缓冲溶液,以最大程度保证镉的形态在提取过程中不发生变化. 对于镉形态的研究,提取剂的选择固然重要,但目前大部分的镉形态研究仍停留在依赖不同的提取剂将镉形态进行分类后检测其中无机镉含量,未能实现直接检测镉的具体化学形态. 因此,往后对于提取方法的研究应当针对镉的具体化学形态,这对于镉具体化学形态的研究也具有重要意义.
3.2 三疣梭子蟹中无机镉形态的研究现状
国内有关水产品中无机镉的分析研究起步较晚,且所用方法大多为高效液相色谱在线联用电感耦合等离子体质谱法(high performance liquid chromatography-inductively coupled plasma mass spectrometer,HPLC-ICP-MS). 章红等[80]最早建立了水产品中无机镉的测定方法. 他们使用石墨炉原子吸收法(graphite furnace atomic absorption spectrometry, GFAAS),利用盐酸作为浸提液,测定了7种水产品中无机镉的含量. 但此方法并未分析使用盐酸浸提对样品中无机镉离子的提取效果,也没有考虑到是否存在有机镉形态被盐酸破坏转化为无机镉. 随后,赵艳芳等[81]利用Tris-HCl缓冲溶液作为浸提液,借助CG5A阳离子保护柱和CS5A阳离子分析柱对样品中Cd2+分离,建立了HPLC-ICP-MS法测定海水贝中离子态镉的含量. 自此之后,大部分有关于水产品中无机镉离子的检测方法都在此研究基础上做出优化. 如姜芳等[82]同样采用HPLC-ICP-MS法测定了海水贝中无机镉离子含量,通过进一步优化前处理过程及流动相浓度,完善了海水贝中无机镉离子的定性和定量分析方法.
国内有关三疣梭子蟹中无机镉离子的形态研究少之又少. 仅田姣姣[83]和冯瑞雪等[84]对三疣梭子蟹不同组织中的无机镉进行了探究. 在赵艳芳[81]的研究基础上,田姣姣[83]探讨了流动相浓度、pH、流速对HPLC-ICP-MS检测Cd2+的影响规律,建立了三疣梭子蟹各部位离子态镉检测的前处理方法,并且测得的三疣梭子蟹中只有蟹膏部位含有离子态镉,约占蟹膏部位总镉的9.4%. 这说明三疣梭子蟹不同部位镉的赋存形态存在差异. 而在此基础上,冯瑞雪等[84]进一步优化了HPLC-ICP-MS检测离子态镉的方法,探究了经过蒸煮和模拟消化后三疣梭子蟹各部位镉的变化. 发现经过蒸煮加工及模拟消化后,肌肉中Cd2+含量上升,蟹膏、蟹黄中Cd2+含量下降. 他们认为在蒸煮过程中,可能因汁液流失、浓缩效应或在不同部位间存在的迁移转化使样本中Cd2+含量发生变化. 综合来看,针对三疣梭子蟹体内无机镉形态的研究尚处于起步阶段,仍需要后续不断优化和完善提取、检测、定量方法,以便深入地探索三疣梭子蟹体内镉赋存形态的分布特征及蓄积机制,同时也为后续更加科学合理地评估三疣梭子蟹的食用安全风险提供研究数据.
3.3 三疣梭子蟹中有机镉形态的研究现状
研究发现,三疣梭子蟹体内毒性较高的无机镉离子含量占总镉的比例较小,间接地表明了低毒性的有机镉形态在总镉中的占比较大[85]. 目前,分析生物体中有机镉形态最常用的方法是体积排阻色谱(size exclusion chromatography,SEC)与高效液相色谱(HPLC)串联电感耦合等离子体质谱(ICP-MS)联用技术[73, 76, 86 − 87]. 然而,有机镉形态的检测存在着标准物质缺乏的问题,难以对生物体内的有机镉形态进行定性. 为此,有学者尝试将无机镉的标准溶液与其他溶液进行络合,根据镉络合物的保留时间来初步判断镉可能在生物体内存在的形态[73].
在前人的研究基础上,赵艳芳等[8]运用了SEC-HPLC-ICP-MS首次对三疣梭子蟹中的有机镉形态进行分析. 发现三疣梭子蟹肝胰腺组织中的镉主要以金属硫蛋白-镉(metallothionein-Cadmium,MT-Cd)和半胱氨酸-镉(cysteine-Cadmium,Cys-Cd)两种形态存在. 并且,根据总镉量的不同,肝胰腺中有机镉的主要存在形态也有所不同. 而对于肌肉组织,镉主要以Cys-Cd形态存在. 此后,田姣姣等[79]进一步对三疣梭子蟹体内镉赋存形态开展了研究. 他们利用Tris-HCl缓冲液进行提取,结合超滤结合透析的方式,对提取液中不同分子质量镉复合物进行分离测定. 结果显示,分子质量>10 kDa的镉复合物占比最高,可能是MT以外的其它蛋白或多糖、脂类等与镉形成大分子复合物. 这说明三疣梭子蟹在MT所介导的途径之外,可能存在其它的蓄积代谢机制;同时<500 Da的镉组分约占4%—25%,可能是存在离子态镉、氨基酸-镉等小分子镉组分.
目前,三疣梭子蟹体内有机镉形态尚未完全明确,并且有机镉的标准物质缺乏,定性与定量存在困难. 后续需要进一步确定三疣梭子蟹体内有机镉的具体形态,同时确定不同结合态的有机镉的毒性效应和转化机制,对于三疣梭子蟹中无机镉与有机镉的占比问题也值得进行更深入的探索与验证.
无论有机镉还是无机镉,国内外针对三疣梭子蟹中镉的赋存形态分析的研究非常少. 并且,研究镉形态的检测手段、测定方法并不完善,仪器设备的发展水平和镉形态的提取与分离都限制了镉形态分析. 此外,由于缺少镉形态的标准品,无法明确三疣梭子蟹等水产品中镉存在的不同形态及其相关毒理效应[31]. 因此,后续需要对镉形态的定性和定量分析开展进一步的研究,以便更科学地评估不同形态镉的毒性效应,并将研究结论应用于完善相关限量标准.
4. 三疣梭子蟹中镉的人类健康风险评估(Human health risk assessment of cadmium in Portunus trituberculatus)
镉作为一种高危有毒的环境污染物,仅关注其在三疣梭子蟹中的蓄积量不足以评估其对生物体健康的危害风险. 因此,对三疣梭子蟹中的镉进行健康风险评估可以将三疣梭子蟹中镉的膳食摄入量与机体负荷有机联系起来,同时监测镉对人体健康的潜在影响. 人体健康风险评估不单取决于食品中重金属的摄入量,还需要借助各种指标和参数[88]. 目标危害系数(Target hazard quotient, THQ)和靶标癌症风险(Target cancer risk, TCR)是人类健康风险评估最常关注的指标. THQ可以评估通过水产品途径的接触单一重金属的非致癌健康风险[89]. TCR是一种衡量个体在食用水产品期间长期暴露于潜在致癌物而患癌症风险的指标[90]. 除此之外,生物可及性(Bioaccessibility)也常用于评估食品中有毒物质的危害性. 它是指在胃肠消化过程中,营养素或污染物从食物基质中释放溶出并可以被人体吸收的百分比[91]. 考虑到一定比例的重金属不具有生物可及性[92],将生物可及性因素纳入风险计算有助于更全面地进行评估.
目前,有关三疣梭子蟹中镉的人类健康风险评估的研究大多着眼于两个方面. 一方面,研究主要针对不同食用人群进行健康风险评估[93 − 94],年龄、性别和体重是重要的影响因素. 据报道,对于同性别不同年龄段人群,三疣梭子蟹中引起的健康风险趋势表现为年龄越小,健康风险越大;对于同年龄段不同性别人群,三疣梭子蟹中镉引起的健康风险趋势表现为女性大于男性. 有学者认为,因为计算THQ时体重作为分母,低龄人群和女性群体较轻的体重导致了THQ结果较大,因此,低龄儿童和女性群体食用三疣梭子蟹的风险相对较大,并且在食用三疣梭子蟹时需要避免食用过量. 另一方面,针对三疣梭子蟹不同可食组织进行健康风险评估. 对于肌肉组织,有研究指出[49],无论镉暴露浓度的高低(1—50 μg·L−1),肌肉中的THQ值均小于限值1,这说明食用三疣梭子蟹肌肉组织造成的健康风险属于低关注级别. 然而,对于肝胰腺或棕肉组织,常常显示较高的食用风险[27, 30]. 如Yang等[95]分别评估了食用三疣梭子蟹的白肉和棕肉样品的人类健康风险,发现棕肉的非致癌风险(THQ)是白肉的16倍,致癌风险(TCR)是白肉的100倍. 即使经过烹饪后棕肉中镉的含量下降,但THQ仍接近风险限值. Zhao等[27]利用镉的生物可及性浓度计算了三疣梭子蟹组织允许每周消耗量,并由此评估了山东沿海地区三疣梭子蟹的食用安全性,指出在山东的成年人每周食用0.13 kg棕色肉和1.56 kg白肉,对机体不会产生明显的危害,并且不建议食用棕肉,更推荐食用白肉. 此外,有研究指出[95],煮熟后的三疣梭子蟹中的镉浓度有所下降,建议消费者最好只食用熟蟹黄或熟蟹肉,避免食用烹饪螃蟹的汁水或油,以减少镉对人体健康的危害. 综上,对于三疣梭子蟹不同的可食组织,消费者最好少食用或不食用肝胰腺或棕肉,更推荐食用安全性更高的肌肉组织.
关于三疣梭子蟹的人类健康风险评估,后续研究除了可以针对如孕妇、幼童等易受镉污染影响的敏感人群进行研究,还可以针对三疣梭子蟹食用频次和数量较高的沿海居民进行健康风险观察. 另外,野生捕捞和规模养殖的三疣梭子蟹中镉的健康风险尚未见报道. 总而言之,食用三疣梭子蟹作为一种可预见的、可判断的人类膳食摄入镉的途径,研究三疣梭子蟹中镉的人类健康风险有助于相关限量的制定以及对食用量和膳食人群做出推荐.
5. 结论与展望(Conclusion and prospect)
针对三疣梭子蟹中镉的特异性蓄积问题,相关研究大多着眼于三疣梭子蟹不同组织中总镉的含量水平,而有关镉在三疣梭子蟹中的蓄积机制及赋存形态问题的研究仍处于探索阶段. 虽然已经有研究初步检测了三疣梭子蟹不同组织中的镉形态,但受限于镉形态的提取、分离、定性和定量方法的不完善,后续仍需要建立相应的技术方法,以便更好地研究三疣梭子蟹中不同形态镉的具体类型以及各组织中不同形态镉的占比问题,为深入研究三疣梭子蟹中镉的蓄积机制和赋存形态提供技术基础,同时为食用三疣梭子蟹的镉安全性问题提供新的风险评价思路.
基于三疣梭子蟹中镉的蓄积机制及赋存形态尚未明晰的现状,今后可从以下几方面着手进行更深入的研究:①镉在三疣梭子蟹不同组织中的迁移、转化、蓄积以及释放的全过程未有研究,可以开展相关的检测实验,寻找镉在三疣梭子蟹中的变化规律,进而探索镉在三疣梭子蟹体内的蓄积机制,还可为后续标准限量的修订提供科学参考依据. ②为更深入探索镉在三疣梭子蟹中的蓄积机制,也为更加全面评估不同毒性的镉形态对人类健康的影响,三疣梭子蟹各组织中赋存的镉形态研究必不可少. 镉形态标准物缺乏、分离分析方法不完善、仪器设备不够精密等问题,有待后续的学者们持续研究和解决. 建立科学的方法,才能够更清晰地了解三疣梭子蟹中镉的赋存形态及分布规律,最终摸索出三疣梭子蟹对镉的蓄积机制. ③研究三疣梭子蟹中镉的特异性蓄积问题,终是为了能更加准确地评估人们食用三疣梭子蟹的膳食风险. 虽然前人已经进行了相关研究,但考虑到人群和时空的差异,不能仅依靠过往的评估结果进行食用三疣梭子蟹的安全性判断,需要持续对食用三疣梭子蟹进行镉的安全性评估. 在进行评估时,孕妇、幼童等易受镉污染影响的敏感人群以及食用三疣梭子蟹频次和数量较高的沿海居民都是重点研究对象. 此外,还可以进行不同养殖方式、不同食用组织、不同镉赋存形态等方面的健康风险评估,全面分析三疣梭子蟹中镉的膳食风险,保障人们在食用三疣梭子蟹时不受重金属镉的威胁.
-
表 1 改性前后吸附剂的元素含量和BET分析
Table 1. Elemental contents and BET analysis of activated carbon before and after modification
材料 Material 质量百分比/%Weight percentage 原子百分比/%Atomic percentage 比表面积/(m2∙g−1)Surface area 孔容/ (cm2∙g−1)Total pore volume C N O Cl Ca C N O Cl Ca GAC 94.97 — 4.15 — 0.25 96.56 — 3.17 — 0.08 948.12 0.4099 pDADMAC-GAC 92.83 0.47 4.57 2 0.13 95.33 0.41 3.53 0.69 0.04 729.97 0.3606 表 2 吸附动力学模型拟合参数
Table 2. Fitting parameters of adsorption kinetic models
拟合方程Kinetic models 参数Parameters 初始条件Initial conditions 5 mg∙L−1 15 mg∙L−1 25 mg∙L−1 GAC pDADMAC-GAC GAC pDADMAC-GAC GAC pDADMAC-GAC qe实际值/(mg∙g−1) 0.4768 2.4114 0.9582 3.2152 1.0058 3.5443 准一级动力学 k1/min−1 6.69×10−3 1.75×10−2 0.50×10−1 0.35×10−1 0.12×10−1 0.48×10−1 qe理论值/(mg∙g−1) 0.4334 2.0281 0.6124 2.1542 0.7550 3.1402 R2 0.9790 0.9875 0.9079 0.9479 0.9758 0.9407 准二级动力学 k2/(g∙(mg∙min)−1) 0.31×10−1 1.95×10−2 1.36×10−1 4.87×10−2 4.97×10−2 4.24×10−2 qe理论值/(mg∙g−1) 0.5137 2.4443 0.9649 3.2609 1.0180 3.4777 R2 0.9805 0.9948 0.9991 0.9999 0.9948 0.9988 颗粒内扩散 kp/(mg∙(g∙min0.5)−1) 0.0289 0.2453 0.0807 0.3151 0.0711 0.6640 R2 0.9906 0.9836 0.9007 0.9337 0.9782 0.9683 表 3 不同温度下pDADMAC-GAC的吸附等温线拟合参数
Table 3. Fitting parameters of adsorption isotherms at different temperatures
模型 Models 参数 Parameters 温度/K Temperature 288 298 308 Langmuir qmax/(mg∙g−1) 80.4538 81.2759 84.0346 KL 8.58×10−4 6.41×10−4 6.51×10−4 R2 0.9258 0.9761 0.9789 Freundlich 1/n 0.7946 0.7936 0.7787 KF 0.1670 0.1359 0.1567 R2 0.9032 0.9666 0.9761 -
[1] SERIO F, MIGLIETTA P P, LAMASTRA L, et al. Groundwater nitrate contamination and agricultural land use: A grey water footprint perspective in Southern Apulia Region (Italy) [J]. Science of the Total Environment, 2018, 645: 1425-1431. doi: 10.1016/j.scitotenv.2018.07.241 [2] GLIBERT P M. Harmful algae at the complex Nexus of eutrophication and climate change [J]. Harmful Algae, 2020, 91: 101583. doi: 10.1016/j.hal.2019.03.001 [3] ZHANG Q Y, QIAN H, XU P P, et al. Effect of hydrogeological conditions on groundwater nitrate pollution and human health risk assessment of nitrate in Jiaokou Irrigation District [J]. Journal of Cleaner Production, 2021, 298: 126783. doi: 10.1016/j.jclepro.2021.126783 [4] ZHAO F, XIN J, YUAN M J, et al. A critical review of existing mechanisms and strategies to enhance N2 selectivity in groundwater nitrate reduction [J]. Water Research, 2022, 209: 117889. doi: 10.1016/j.watres.2021.117889 [5] WHO. Guidelines for Drinking-water Quality, Fourth ed [R]. World HealOrgan, 2011. [6] SONG N F, XU J, CAO Y P, et al. Chemical removal and selectivity reduction of nitrate from water by (nano) zero-valent iron/activated carbon micro-electrolysis [J]. Chemosphere, 2020, 248: 125986. doi: 10.1016/j.chemosphere.2020.125986 [7] CECCONET D, DEVECSERI M, CALLEGARI A, et al. Effects of process operating conditions on the autotrophic denitrification of nitrate-contaminated groundwater using bioelectrochemical systems [J]. Science of the Total Environment, 2018, 613/614: 663-671. doi: 10.1016/j.scitotenv.2017.09.149 [8] WU J L, YIN Y N, WANG J L. Hydrogen-based membrane biofilm reactors for nitrate removal from water and wastewater [J]. International Journal of Hydrogen Energy, 2018, 43(1): 1-15. doi: 10.1016/j.ijhydene.2017.10.178 [9] TONG D L, ZHUANG J, LEE J, et al. Concurrent transport and removal of nitrate, phosphate and pesticides in low-cost metal- and carbon-based materials [J]. Chemosphere, 2019, 230: 84-91. doi: 10.1016/j.chemosphere.2019.05.056 [10] BANU H A T, KARTHIKEYAN P, VIGNESHWARAN S, et al. Adsorptive performance of lanthanum encapsulated biopolymer chitosan-Kaolin clay hybrid composite for the recovery of nitrate and phosphate from water [J]. International Journal of Biological Macromolecules, 2020, 154: 188-197. doi: 10.1016/j.ijbiomac.2020.03.074 [11] LI R H, WANG J J, ZHOU B Y, et al. Simultaneous capture removal of phosphate, ammonium and organic substances by MgO impregnated biochar and its potential use in swine wastewater treatment [J]. Journal of Cleaner Production, 2017, 147: 96-107. doi: 10.1016/j.jclepro.2017.01.069 [12] 郑雯婧, 林建伟, 詹艳慧, 等. 氯化十六烷基吡啶改性活性炭对水中硝酸盐的吸附作用 [J]. 环境科学, 2013, 34(11): 4325-4332. doi: 10.13227/j.hjkx.2013.11.036 ZHENG W J, LIN J W, ZHAN Y H, et al. Removal of nitrate from aqueous solution using cetylpyridinium chloride (CPC)-modified activated carbon as the adsorbent [J]. Environmental Science, 2013, 34(11): 4325-4332(in Chinese). doi: 10.13227/j.hjkx.2013.11.036
[13] 郑雯婧, 林建伟, 詹艳慧, 等. 锆-十六烷基三甲基氯化铵改性活性炭对水中硝酸盐和磷酸盐的吸附特性 [J]. 环境科学, 2015, 36(6): 2185-2194. doi: 10.13227/j.hjkx.2015.06.036 ZHENG W J, LIN J W, ZHAN Y H, et al. Adsorption characteristics of nitrate and phosphate from aqueous solution on zirconium-hexadecyltrimethylammonium chloride modified activated carbon [J]. Environmental Science, 2015, 36(6): 2185-2194(in Chinese). doi: 10.13227/j.hjkx.2015.06.036
[14] BAGHERIFAM S, KOMARNENI S, LAKZIAN A, et al. Highly selective removal of nitrate and perchlorate by organoclay [J]. Applied Clay Science, 2014, 95: 126-132. doi: 10.1016/j.clay.2014.03.021 [15] SOWMYA A, MEENAKSHI S. An efficient and regenerable quaternary amine modified chitosan beads for the removal of nitrate and phosphate anions [J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 906-915. doi: 10.1016/j.jece.2013.07.031 [16] LUO W H, HUANG Q D, ZENG P, et al. Gemini surfactant-modified montmorillonite with tetrachloroferrate (FeCl4−) as a counterion simultaneously sequesters nitrate and phosphate from aqueous solution [J]. Journal of Hazardous Materials, 2021, 409: 124829. doi: 10.1016/j.jhazmat.2020.124829 [17] MENG X M, YAO L, JIANG W J, et al. In situ growth synthesis of the CNTs@AC hybrid material for efficient nitrate-nitrogen adsorption [J]. ACS Omega, 2021, 6(2): 1612-1622. doi: 10.1021/acsomega.0c05566 [18] PALTRINIERI L, REMMEN K, MÜLLER B, et al. Improved phosphoric acid recovery from sewage sludge ash using layer-by-layer modified membranes [J]. Journal of Membrane Science, 2019, 587: 117162. doi: 10.1016/j.memsci.2019.06.002 [19] RAY J R, SHABTAI I A, TEIXIDÓ M, et al. Polymer-clay composite geomedia for sorptive removal of trace organic compounds and metals in urban stormwater [J]. Water Research, 2019, 157: 454-462. doi: 10.1016/j.watres.2019.03.097 [20] 岳钦艳, 许鹏举, 李倩, 等. 聚二甲基二烯丙基氯化铵改性高炉渣的制备及其应用 [J]. 环境化学, 2006, 25(6): 735-738. doi: 10.3321/j.issn:0254-6108.2006.06.016 YUE Q Y, XU P J, LI Q, et al. Preparation and application of pdmdaac-bf slag [J]. Environmental Chemistry, 2006, 25(6): 735-738(in Chinese). doi: 10.3321/j.issn:0254-6108.2006.06.016
[21] 田秉晖, 潘纲, 栾兆坤. 阳离子聚电解质强化絮凝去除活性染料的研究 [J]. 环境化学, 2007, 26(1): 46-50. doi: 10.3321/j.issn:0254-6108.2007.01.011 TIAN B H, PAN G, LUAN Z K. Study on enhanced flocculation removal of reactive dyes by cationic polyelectrolyte [J]. Environmental Chemistry, 2007, 26(1): 46-50(in Chinese). doi: 10.3321/j.issn:0254-6108.2007.01.011
[22] WANG Z Y, BAKSHI S, LI C Y, et al. Modification of pyrogenic carbons for phosphate sorption through binding of a cationic polymer [J]. Journal of Colloid and Interface Science, 2020, 579: 258-268. doi: 10.1016/j.jcis.2020.06.054 [23] SHEPHERD J G, JOSEPH S, SOHI S P, et al. Biochar and enhanced phosphate capture: Mapping mechanisms to functional properties [J]. Chemosphere, 2017, 179: 57-74. doi: 10.1016/j.chemosphere.2017.02.123 [24] WANG J L, GUO X. Adsorption kinetic models: Physical meanings, applications, and solving methods [J]. Journal of Hazardous Materials, 2020, 390: 122156. doi: 10.1016/j.jhazmat.2020.122156 [25] MAZARJI M, AMINZADEH B, BAGHDADI M, et al. Removal of nitrate from aqueous solution using modified granular activated carbon [J]. Journal of Molecular Liquids, 2017, 233: 139-148. doi: 10.1016/j.molliq.2017.03.004 [26] GUO X, WANG J L. Comparison of linearization methods for modeling the Langmuir adsorption isotherm [J]. Journal of Molecular Liquids, 2019, 296: 111850. doi: 10.1016/j.molliq.2019.111850 [27] YAZDI F, ANBIA M, SALEHI S. Characterization of functionalized chitosan-clinoptilolite nanocomposites for nitrate removal from aqueous media [J]. International Journal of Biological Macromolecules, 2019, 130: 545-555. doi: 10.1016/j.ijbiomac.2019.02.127 [28] ISLAM M, PATEL R. Physicochemical characterization and adsorption behavior of Ca/Al chloride hydrotalcite-like compound towards removal of nitrate [J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 659-668. [29] HSIEH H S, PIGNATELLO J J. Modified carbons for enhanced nucleophilic substitution reactions of adsorbed methyl bromide [J]. Applied Catalysis B:Environmental, 2018, 233: 281-288. doi: 10.1016/j.apcatb.2018.04.007 [30] XIA F, YANG H F, LI L, et al. Enhanced nitrate adsorption by using cetyltrimethylammonium chloride pre-loaded activated carbon [J]. Environmental Technology, 2020, 41(27): 3562-3572. doi: 10.1080/09593330.2019.1615133 [31] ZHANG G S, LIU H J, LIU R P, et al. Removal of phosphate from water by a Fe-Mn binary oxide adsorbent [J]. Journal of Colloid and Interface Science, 2009, 335(2): 168-174. doi: 10.1016/j.jcis.2009.03.019 [32] WAN D J, LIU H J, LIU R P, et al. Adsorption of nitrate and nitrite from aqueous solution onto calcined (Mg-Al) hydrotalcite of different Mg/Al ratio [J]. Chemical Engineering Journal, 2012, 195/196: 241-247. doi: 10.1016/j.cej.2012.04.088 [33] SOWMYA A, MEENAKSHI S. Removal of nitrate and phosphate anions from aqueous solutions using strong base anion exchange resin [J]. Desalination and Water Treatment, 2013, 51(37/38/39): 7145-7156. [34] LONG L, XUE Y W, HU X L, et al. Study on the influence of surface potential on the nitrate adsorption capacity of metal modified biochar [J]. Environmental Science and Pollution Research International, 2019, 26(3): 3065-3074. doi: 10.1007/s11356-018-3815-z 期刊类型引用(0)
其他类型引用(5)
-






























 DownLoad:
DownLoad: