-
饮用水消毒始于20世纪初,其目的是为了杀死水中的病原微生物,切断介水传染病的传播和流行,保障饮用水的安全. 然而,在消毒过程中,消毒剂会不可避免地与水中的天然有机物、外源污染物、无机物等发生反应,生成一类对人体有致畸、致癌、致突变作用的物质——消毒副产物(disinfection by-products, DBPs). 1974年,Rook[1]等发现,氯消毒会产生三卤甲烷(trihalomethanes, THMs),两年后美国癌症协会宣布三氯甲烷对人体具有致癌性,使得DBPs成为了饮用水处理领域关注的热点. 由于氯消毒会产生较多的THMs、卤乙酸(haloacetic acids, HAAs)等受到严格管控的含碳消毒副产物(carbonaceous disinfection by-products, C-DBPs),不少饮用水厂转而采用氯胺、臭氧、二氧化氯等其他消毒方式来代替氯消毒. 氯胺作为消毒剂,它与消毒副产物前体物的反应活性远小于氯,能够有效减少消毒后THMs和HAAs的生成,且氯胺在管网中形成余氯的持续时间长,能够有效抑制管网中残留细菌的再繁殖. 然而,有研究发现,氯胺消毒会导致消毒后水中含氮消毒副产物(nitrogenous disinfection by-products, N-DBPs)生成的增加[2],N-DBPs是一种新兴的DBPs,包括卤代乙腈(haloacetonitrile, HANs)、卤代乙酰胺(haloacetamides, HAcAms)、卤代硝基甲烷(halogenated nitromethanes, HNMs)、亚硝胺类(nitrosamines, NAs)等,相对于C-DBPs,N-DBPs虽然生成浓度较低,但却具有更高的遗传毒性和细胞毒性[3-4].
近年来,有研究发现,当原水中存在溴离子和碘离子时,消毒后的水中不仅会生成氯代DBPs,还会有溴代和碘代DBPs生成[5-6],且溴代和碘代DBPs的细胞毒性和遗传毒性都较氯代DBPs强[4,7]. 例如,Plewa等[8]研究发现,溴乙酸和碘乙酸的细胞毒性分别是氯乙酸的125倍和500倍;Muellner等[9]研究发现,碘乙腈(iodoacetonitrile, IAN)的遗传毒性是目前已知的DBPs中最高的,是二氯乙腈的74倍. 在我国,大部分沿海地区的水源是潮汐河流,靠近入海口,经常会受到咸潮入侵的影响,而海水中溴离子和碘离子的浓度是一般淡水的三千多倍和十几倍[10-12],这将使得这些地区的水源水中有存在较高浓度溴离子和碘离子的风险,进而导致消毒过程中更容易生成溴代和碘代的DBPs. 此外,在我国北方地区的一些城镇生活饮用水中的碘含量可以超过100 μg·L−1[13-14]. 水体中较高的碘含量,不仅会增加人类患甲状腺疾病的风险,而且还会增加消毒过程中I-DBPs的形成. 目前,对于溴代和碘代DBPs的研究多集中在常规的C-DBPs如THMs和HAAs等方面,例如Zha等[15]的研究发现,当溴离子的浓度从0.5 mg·L−1增加至2 mg·L−1时,消毒后生成的三溴甲烷从18.31 μg·L−1增加至127.60 μg·L−1;当碘离子浓度从0增加至2 mg·L−1时,三碘甲烷的生成量从0 μg·L−1增加到317.20 μg·L−1,同等条件下,氯仿的生成量则从241.97 μg·L−1下降至96.23 μg·L−1,表明溴、碘离子的存在会使得氯代THMs向溴代和碘代THMs转变. 而且即使在溴离子浓度较低时,溴代THMs与溴代HAAs的生成量仍然会随之增加. 如Zhang等[16]的研究表明,溴离子浓度为500 μg·L−1的水体经消毒后生成的溴代THMs与溴代HAAs分别是溴离子浓度为65 μg·L−1时的5倍与10倍. 对于溴、碘离子的存在对消毒过程中N-DBPs生成的影响,目前的研究多集中在溴代N-DBPs. 研究发现,HANs、HNMs与HAcAms等N-DBPs的生成总量均会随着溴离子浓度的增加而增加[17-18],并且溴代N-DBPs的占比也会随着溴离子浓度的增加而增加,表明在有溴离子存在的情况下,氯代N-DBPs会向溴代N-DBPs转变. 此外,氯胺消毒过程中溴的反应活性要强于氯消毒[19],并且在碘离子存在的情况下,氯胺消毒不能像氯和臭氧消毒一样进一步将次碘酸氧化为碘酸盐[20],因而在氯胺消毒过程中,可能有更高的溴代和碘代N-DBPs生成的风险.
此外,原水中有机前体物的种类、含量及组成对后续消毒过程中溴代和碘代DBPs的生成也具有重要影响. 目前,我国湖泊、水库等水源水仍存在着富营养化严重,藻类季节性爆发等问题,使原水中含有较多的藻类有机物等生物源有机物,而这些生物源有机物已经成为DBPs,特别是N-DBPs的重要前体物[21-22]. 考虑到实际水体中的有机物来源广泛,种类繁多,成分复杂,难以进行直接研究,采用模拟化合物来模拟实际水体中的有机物是广泛采用的研究方法. Hua等[23]采用牛血清蛋白、鱼油和淀粉来模拟藻类有机物的生化成分中的蛋白质、脂肪以及多糖,结果表明鱼油生成的三氯甲烷分别是牛血清蛋白和淀粉的1.8倍和16倍. Wei等[24]采用腐殖酸、牛血清蛋白、DNA、淀粉与鱼油模拟化合物模拟生物源有机物的主要生化成分腐殖酸、蛋白质、核酸、多糖和脂肪,研究溴、碘离子对C-DBPs的生成影响时发现,鱼油模拟的脂肪类结构经氯化消毒后,形成的I-DBPs比其他模拟化合物都要多,在碘离子浓度为2 mg·L−1时,生成了16.97 μg·L−1的一碘二氯甲烷,而腐殖酸经消毒后仅生成3.87 μg·L−1的一碘二氯甲烷. Yang等[25]的研究发现,含有较多脂肪族结构的亲水性天然有机物(natural organic matter, NOM)较芳香族结构的疏水性NOM更易形成I-DBPs. 而鱼油的重要成分二十二碳六烯酸提取于藻类,其主要成分不饱和脂肪酸均属于脂肪族化合物.
本研究将选择鱼油作为模拟化合物,模拟原水中广泛存在的天然有机物和生物源有机物的脂肪类组成成分,采用氯胺作为消毒剂,分别考察无机前体物(溴、碘离子)浓度、总有机碳(Total Organic Carbon, TOC)、氯胺投加量、消毒时间、初始pH等因素对溴代和碘代N-DBPs生成的影响. 整个研究对于控制溴代和碘代N-DBPs的生成,保障人民群众的饮用水安全具有重要意义.
-
一溴乙腈(bromoacetonitrile, BAN, 97%)购自Macklin,二溴乙腈(dibromoacetonitrile, DBAN, 97%)与无水硫酸钠(分析纯)购自Aladdin, IAN(>98%)购自上海梯希爱,一溴硝基甲烷(bromonitromethane, BNM, 97%)购买自海晟泰,内标物1,2-二溴丙烷(1000 mg·L−1于甲基叔丁基醚)购自上海安谱,鱼油(18%EPA, 20%Ώ3)购买自罗恩试剂,甲基叔丁基醚(色谱纯)购买自TEDIA,氯化钠(优级纯)、次氯酸钠(分析纯)、溴化钠(分析纯)、硫代硫酸钠(分析纯)均购自西陇科学,碘化钾(分析纯)购买自汕头市达濠精细化学品有限公司、氯化铵(分析纯)购自国药集团化学试剂有限公司.
-
取15 mL鱼油,采用超纯水溶解并定容至1000 mL,配置成鱼油储备液,静置过夜后,用定量滤纸过滤,置于棕色瓶中并于4 ℃下保存. 模拟水样的TOC采用总有机碳分析仪(TOC-VCPN,岛津,日本)测定,分析方法为燃烧氧化-非分散红外吸收法. 测定TOC与使用前都要先通过添加硫酸(0.1 mol·L−1)和氢氧化钠(0.1 mol·L−1)将pH调节至中性,再加入浓度为5 mmol·L−1的磷酸盐缓冲液调节水样的pH= 7.2.
-
一氯胺溶液由NaClO与NH4Cl溶液(保持二者质量比为4 mg·L−1 Cl2:1 mg·L−1 NH4+-N)于冰水浴下暗处混合反应30 min制得,需现用现配. 制得的溶液采用N,N-二乙基-1,4-苯二胺分光光度法测定其一氯胺含量(以氯计).
准确量取20 mL1.2节中配制好的模拟水样于带聚四氟乙烯瓶垫的圆底离心管中,加入一定量的溴化钠(C(Br-)= 500 mg·L−1)或碘化钾(C(I-)= 100 mg·L−1)溶液,然后以C(TOC):C(Cl2)= 1:5加入氯胺消毒剂,于恒温培养箱内25 ℃避光反应72 h. 反应完毕后,取出水样,用100 mg·L−1的Na2S2O3溶液终止反应.
-
采用液液萃取[26]. 具体方法为:取消毒完毕后的水样,加入盐酸(1 mol·L−1)将pH调节至2.0,加入50 µL 1 mg·L−1的1,2-二溴丙烷作为内标物,加入5 mL的MTBE作为萃取剂,再加入8 g氯化钠以促进分层,涡旋振荡1.5 min,静置5 min分层,将上层有机相吸出,加入3 g无水硫酸钠(使用前需经马弗炉400 °C灼烧并用MTBE洗涤)过滤至吹脱管中,氮吹至有机相剩余0.5 mL,最后用MTBE定容至1 mL,转移至棕色进样小瓶中等待后续检测.
-
本研究中进行定量分析的溴代和碘代N-DBPs包括HANs与HNMs两大类,其中,HANs类为BAN、DBAN、IAN,HNMs类为BNM. HANs与HNMs的定量分析方法参考EPA551.1和Carter[27]等的方法. 所用仪器为Thermo Trace-1300 ISQ-Mass气相色谱-质谱联用仪,色谱柱型号为HP-5MS UI(30 m × 250 µm × 0. 25 µm). 进样口温度为150 ℃,传输线温度为280 ℃,检测器温度为290 ℃. 升温程序为35 ℃保持5 min后,以10 ℃·min−1的速度升至65 ℃保持3 min,最后以20 ℃·min−1的速度升至260 ℃保持5 min,共26 min;进样方式为不分流进样,进样量为2 µL,载气为高纯氦,氦气流速为1.0 mL·min−1,采用EI电离源,电离电压为70 eV.
-
有研究表明,溴或碘离子的存在,会使消毒过程中的DBPs氯代向溴代和碘代转变. 因此,本研究首先考察鱼油在不同浓度的溴离子和碘离子存在的情况下,经氯胺消毒后,溴代和碘代N-DBPs的生成情况.
-
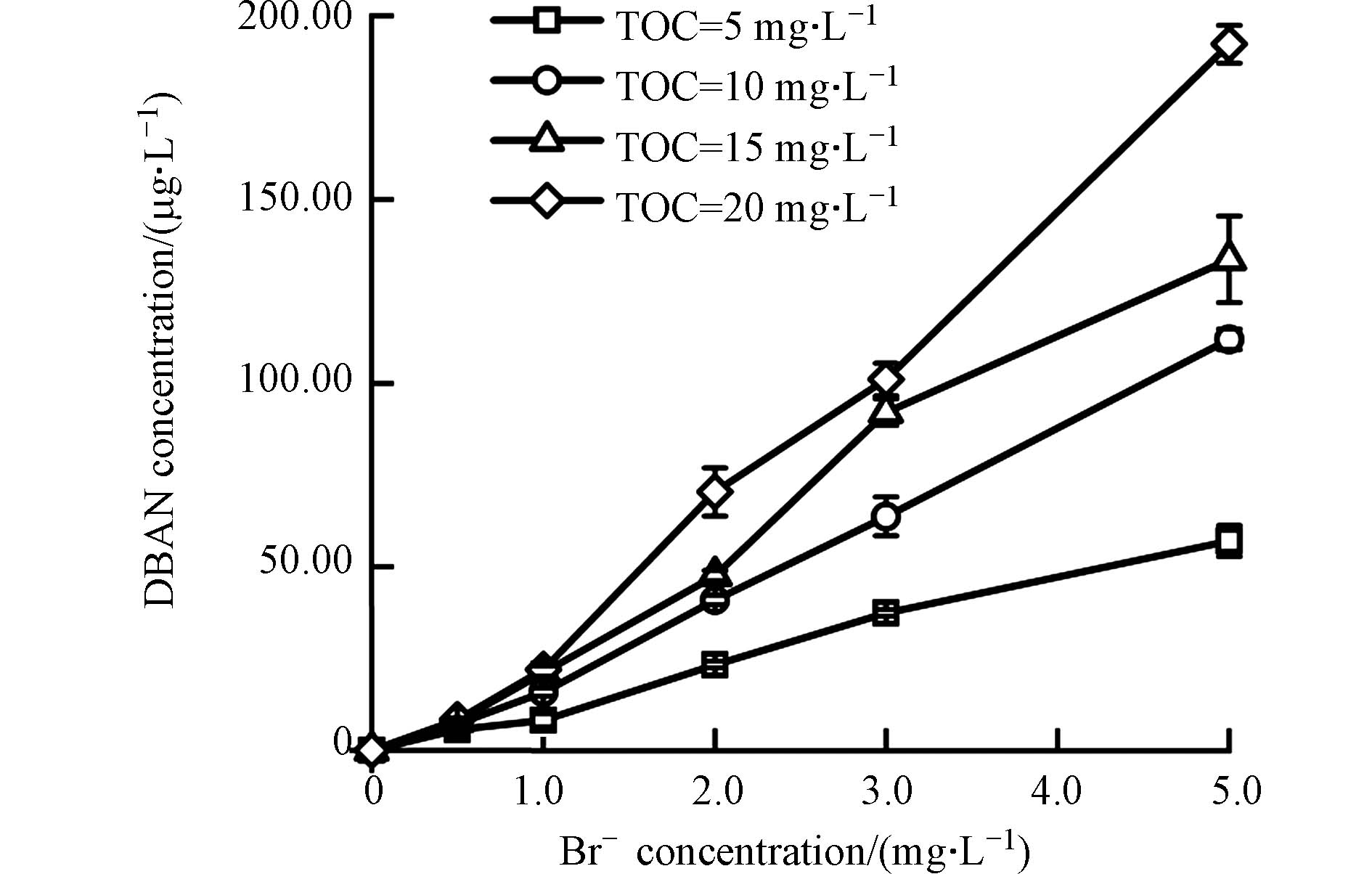
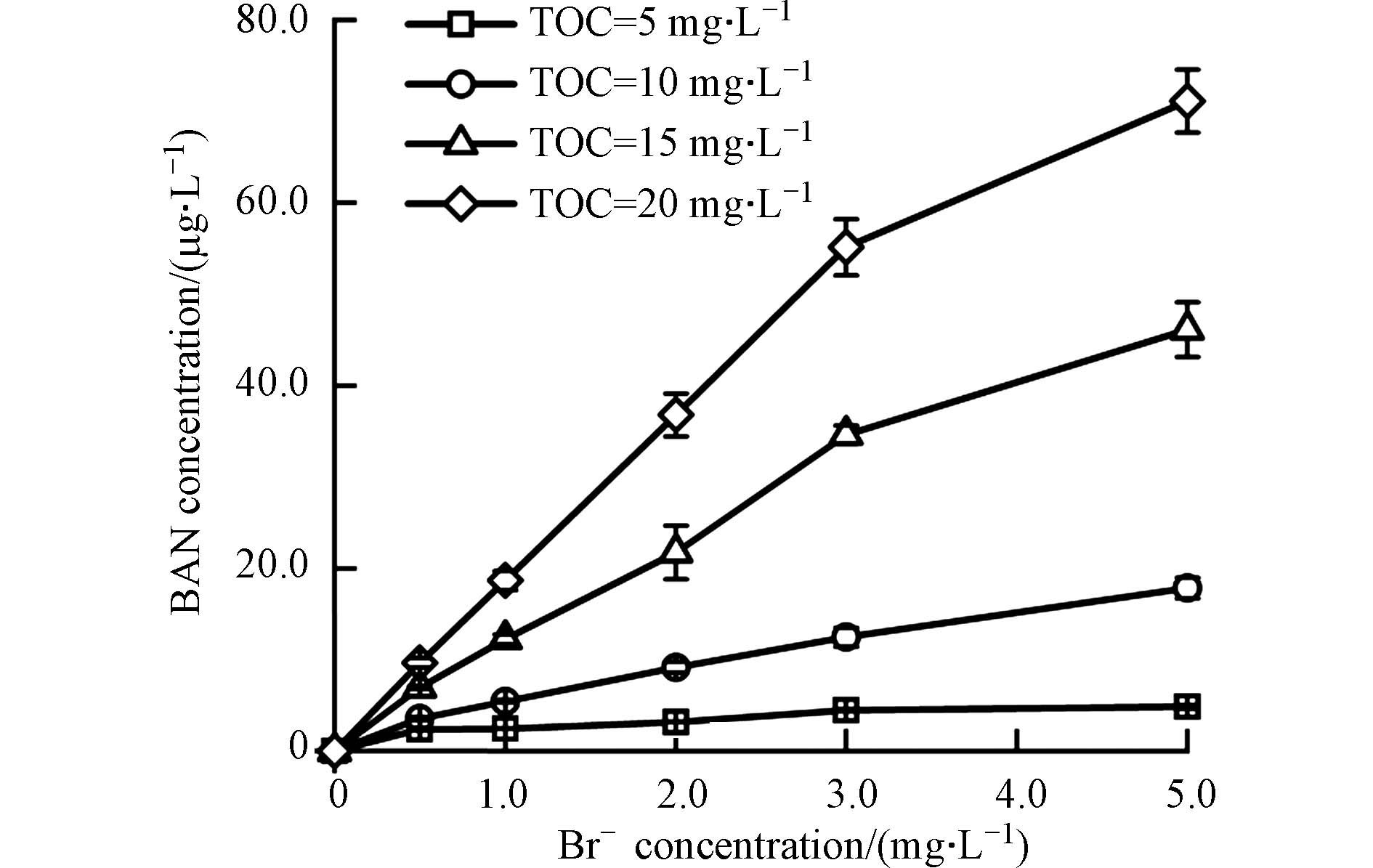
图1是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后BAN的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到BAN的生成,而当溴离子浓度增加到0.5 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了少量的BAN,且BAN的生成量随着水样TOC浓度的增加而增加.
此外,当溴离子的浓度从0 mg·L−1增加至5 mg·L−1时,4种不同TOC浓度下BAN的生成量均逐渐增加,当溴离子浓度为5 mg·L−1时,4种不同TOC浓度下的BAN的生成量均达到最大值,分别为4.83、17.82、46.13、71.15 μg·L−1. 一方面,增加水样的TOC,提供了更多的DBPs的有机前体物,使得BAN的生成量也随之增加,这说明鱼油模拟的脂肪成分为BAN的有效前体物. 另一方面,当水样中有溴离子存在时,氯胺水解释放的次氯酸会先与溴离子反应[28],产生次溴酸,次溴酸与水中的胺或氯胺反应,生成溴胺与溴氯胺,它们的反应活性比氯胺强[29],更容易与有机前体物反应生成BAN. 当水样的TOC一定时,溴胺与溴氯胺的生成量会随着溴离子浓度的增加而不断增加,其不断地与有机前体物反应,最终表现为BAN的生成量的增加.
此外,从图1还可以发现,当模拟水样的TOC浓度保持不变,BAN的生成量虽然会随着溴离子浓度的增加而逐渐升高,但增长速率会逐渐放缓. 这可能是因为当水样的TOC不变的情况下,水样中能够提供的有机前体物是有限的,而随着溴离子浓度的不断增加,氯胺与溴离子反应形成的溴胺会通过可逆的歧化反应形成二溴胺,二溴胺在水中会快速地分解[30],因此继续增加溴离子浓度可能不会使得BAN的生成量大幅增长;另一方面可能是由于溴离子浓度增加使得生成的BAN向DBAN转变,因此BAN的生成量增幅有所下降.
-
图2是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后DBAN的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到DBAN的生成. 当溴离子浓度增加到0.5 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了少量的DBAN,生成浓度分别为5.60、7.13、7.96、8.35 μg·L−1,且DBAN的生成量随着水样TOC浓度的增加而增加. 这是由于水样TOC的增加,使得水中含有更多的DBPs的前体物,因而DBAN的生成量随之增加,说明脂肪类结构是DBAN的有效前体物,这与BAN的生成规律一致. 在溴离子浓度较低时,溴的取代反应进行的不完全,生成的DBAN含量较少,随着溴离子浓度逐渐增加,4种不同TOC浓度下DBAN的生成量均迅速增加,当溴离子浓度为5 mg·L−1时,4种不同TOC下DBAN的生成量分别达到57.03、111.97、133.71、192.36 μg·L−1. 增加溴离子的浓度,一方面使水中产生的溴胺与溴氯胺增加[28],二者不断地与有机前体物发生反应;另一方面,溴离子的浓度增加使水样中生成的BAN向DBAN转变,最终表现为DBAN生成量的增加.
-
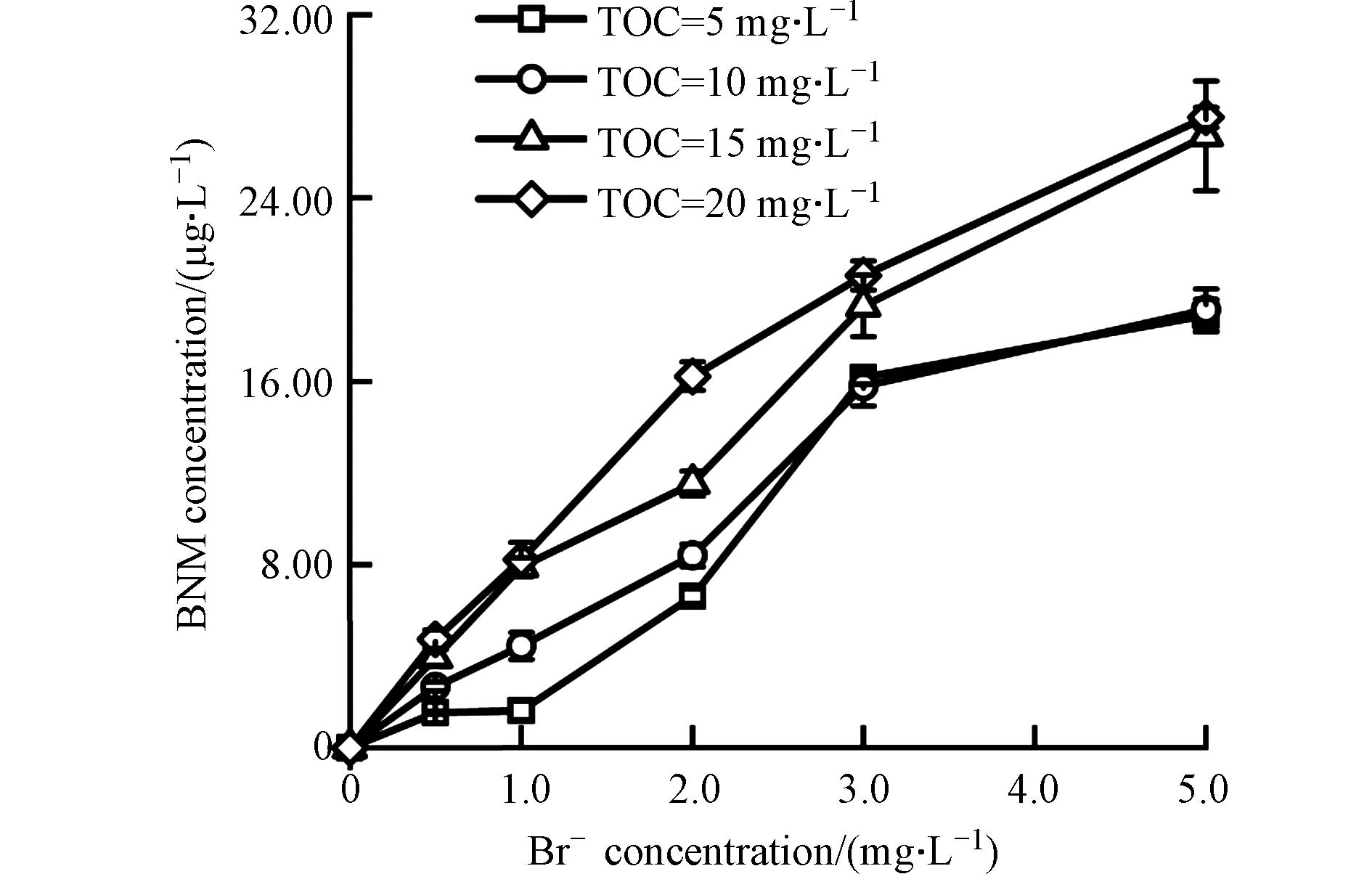
图3是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后BNM的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到BNM的生成. 当溴离子的浓度增加到0.5 mg·L−1时,4种不同浓度TOC下的模拟水样均检测到了BNM的生成. 但是与BAN的生成规律不同,BNM的生成量没有随着TOC浓度的增加而出现大幅的增长. 这可能是因为,HNMs的重要前体物是硝基化合物[31],而本研究选取的模型化合物鱼油作为一种典型的支链脂肪烃类有机物,并不是BNM的重要前体物. 另一方面,模拟水样中并不存在对HNMs的形成有重要影响的亚硝酸盐类物质,且亚硝酸盐经氯化后形成的NO2Cl,与脂肪族化合物相比,更易与含有芳香族和共轭双键的化合物发生亲电取代产生硝基化合物[32].
另外,当水样的TOC浓度一定时,随着溴离子浓度的增加,BNM的生成量也逐渐增加,在溴离子浓度为5 mg·L−1时,4种不同TOC下BNM的生成量分别为18.87、19.12、26.71、27.52 μg·L−1. 说明溴离子浓度的增加,使得水中生成的溴胺与溴氯胺增加,溴胺与溴氯胺与有机物反应进而生成更多的BNM.
-
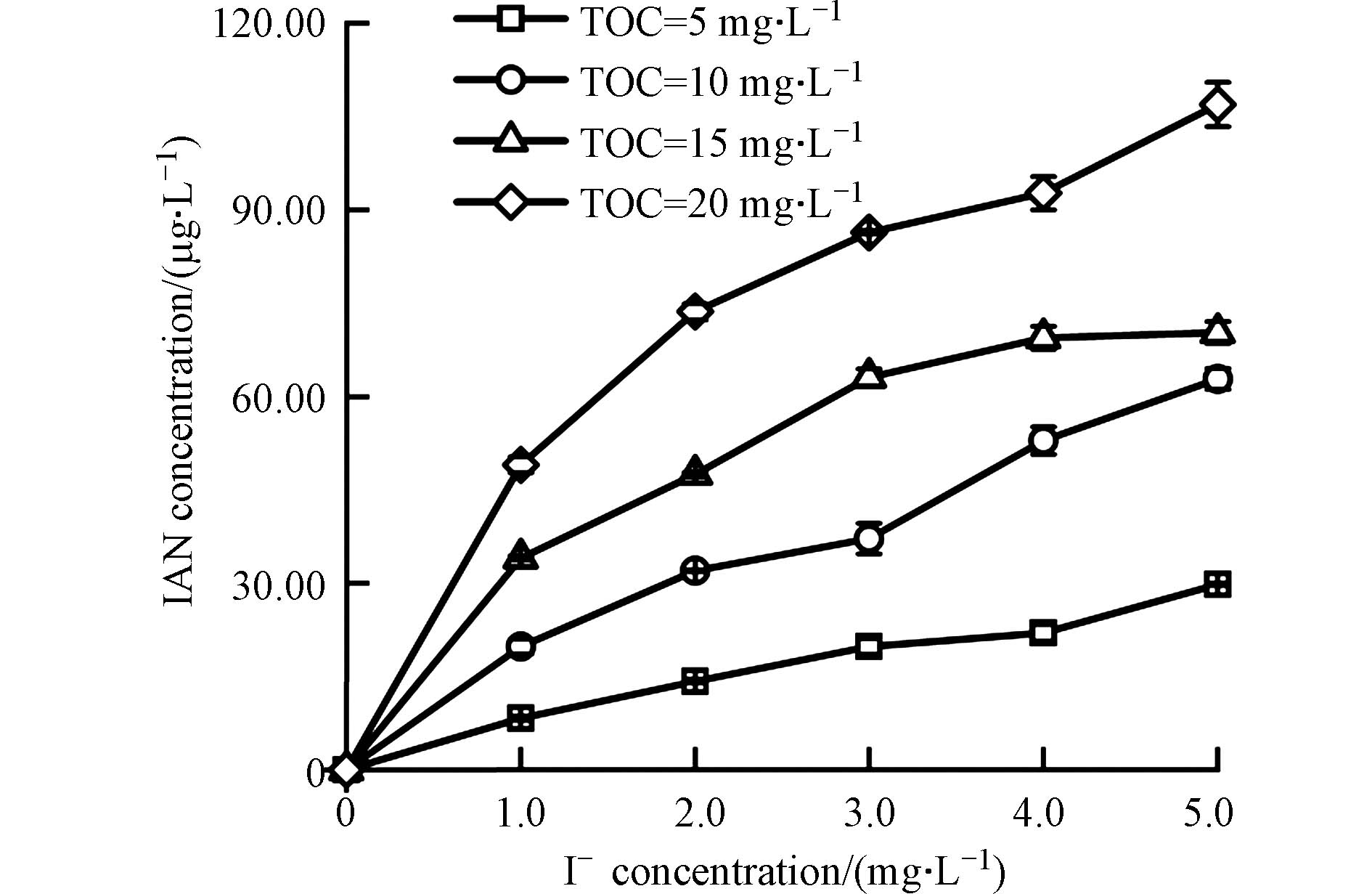
图4是在不同的TOC与碘离子浓度下,鱼油模拟水样经氯胺消毒后IAN的生成情况. 从图4中可以看出,在未投加碘离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到IAN的生成,而当碘离子的浓度增加到0.1 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了IAN的生成,且IAN的生成量会随着水样TOC浓度的增加而出现明显的增长. 在TOC一定时,随着碘离子投加量从0 mg·L−1增加到0.5 mg·L−1,IAN的生成量逐渐增加. 当TOC为20 mg·L−1,碘离子浓度为0.5 mg·L−1时,IAN的生成量达到最大值,为106.95 μg·L−1,远高于在5 mg·L−1溴离子情况下BAN的生成量. 这可能是因为碘相比于溴,具有更强的与有机前体物发生亲核取代的能力,而Liu等[33]也发现,在消毒过程中,卤素的消耗遵循碘>溴>氯的顺序. 此外,对比Wei等[24]研究可以发现,氯胺消毒下,IAN的生成规律与I-THMs的生成规律一致,生成量都是随着碘离子浓度的增加而增加.
-
图5是在不同的氯胺投加量下,鱼油模拟水样经氯胺消毒后BAN、DBAN、BNM与IAN的生成情况. 从图5可以看出,当氯胺的投加量为5 mg·L−1时,BAN、DBAN、BNM、IAN的生成量分别为4.62、33.75、3.75、10.29 μg·L−1;而当氯胺的投加量增加到100 mg·L−1时,4种N-DBPs的生成量均达到最大值,分别为49.69、218.40、22.34、123.44 μg·L−1. BAN、DBAN、BNM、IAN的生成量均随着氯胺投加量的增加而增大. 这可能是因为增加氯胺的投加量,能够加速氧化溴离子产生更多的次溴酸,促进次溴酸与胺或氯胺反应,产生更多的溴胺和溴氯胺,从而促进了溴胺、溴氯胺与有机前体物反应,形成更多的溴代N-DBPs. 另一方面,氯胺浓度增加能够加速氧化碘离子成为次碘酸,次碘酸的亲核取代能力远远超过了次氯酸[33],它与有机前体物反应产生使得碘代N-DBPs的生成量快速增加.
-
图6展示了氯胺消毒时间对BAN、DBAN、BNM和IAN生成的影响. 从图6中可以看出,在反应的前12 h,BAN与BNM的生成量缓慢增加,从12 h时开始,BAN与BNM的生成量出现明显的增加,到反应的72 h,BAN与BNM的生成量均达到最大值,分别为19.09 μg·L−1与16.36 μg·L−1. DBAN在反应的前2 h未检测到,之后随着反应时间的延长而缓慢增加,反应24 h后DBAN的生成量开始快速增加,到反应的72 h达到最大生成量,为107.62 μg·L−1. 在反应的前24 h,IAN生成量基本保持在35 μg·L−1,从24 h时开始,IAN的生成量出现明显的增加,到反应的72 h,IAN的生成量达到最大值,为63.60 μg·L−1. 4种N-DBPs的生成量均随着消毒时间的延长而增加. 这是由于氯胺相对于氯,是更加稳定的化合物,氯胺在水中的分解较为缓慢,使得其与有机前体物反应的活性低于氯,难以在较短的时间氧化有机物进而产生DBPs. 此外,消毒72 h时,水样中溴代和碘代N-DBPs的生产量仍旧有增加的趋势,但是由于饮用水经水厂消毒后,通过供水系统到达用户,经过的时间一般在72 h以内,因此将消毒时间控制在72 h.
-
pH不仅可以影响一氯胺在水中的形态及其水解速率,还会干扰N-DBPs的稳定性. 一般来说,在酸性条件下,氯胺更易水解释放游离氯,在碱性条件下,卤乙腈类物质容易发生水解. 此外,当有机前体物不同时,氯胺消毒后N-DBPs的生成也会随着pH的变化有着不同的规律. Yang[34]与Nihemaiti[35]等发现,酪氨酸作为前体物时,当水样的pH从5增加至9,DCAN生成量一直减少,而天冬酰胺作为前体物时,DCAN随pH增加一直增加,甲基吡咯与间二苯酚做前体物时,DCAN先增加后减少. 因此,本研究考察了鱼油在不同的初始pH情况下,经氯胺消毒后,溴代和碘代N-DBPs的生成情况.
图7是在不同的初始pH下,鱼油模拟水样经氯胺消毒后BAN、DBAN、BNM、IAN的生成情况. 从图7中可以看出,3种卤乙腈类N-DBPs包括BAN、DBAN与IAN的生成量均随着pH的增加先增加再减少,当pH= 8时,BAN、DBAN与IAN的生成量均最大,分别为19.64 μg·L−1、118.21 μg·L−1与68.24 μg·L−1,当pH继续增大至9时,由于在碱性环境中卤乙腈类物质更容易发生水解,因而形成的卤乙腈类物质减少. 而HNMs的生成规律与HANs不同,随着pH的增加,BNM的生成量缓慢减少,当pH= 5时,BNM的生成量最大,为23.98 μg·L−1. 这可能是由于酸性条件下,氯胺更易水解释放游离氯,与溴离子结合形成更多的次溴酸,促进了与有机前体物反应,生成更多的BNM.
-
本研究选择鱼油作为模型化合物来模拟原水中广泛存在的天然有机物和生物源有机物的脂肪类组成成分,采用氯胺作为消毒剂,分别考察无机前体物(溴、碘离子)浓度、氯胺投加量、消毒时间、初始pH等因素对溴代和碘代N-DBPs生成的影响,得出了以下结论:
鱼油经氯胺消毒后,生成的溴代和碘代N-DBPs主要包括BAN、DBAN、BNM和IAN. 其中,BAN、DBAN与BNM的生成量随溴离子和TOC浓度的增加而增加,IAN的生成量则随碘离子浓度和TOC的增加而增加.
增加氯胺的投加量可使N-DBPs的生成量快速增加;当氯胺的投加量从5 mg·L−1增加到100 mg·L−1时,BAN、DBAN、BNM与IAN的生成量分别从4.62 μg·L−1、33.75 μg·L−1、3.75 μg·L−1和10.29 μg·L−1增加到49.69 μg·L−1、218.40 μg·L−1、22.34 μg·L−1和123.44 μg·L−1.
消毒时间与4种NDBPs的生成量高度正相关, 在氯胺消毒72 h后,4种N-DBPs的生成量均达到最大值.
pH能够影响一氯胺的形态、水解速率与N-DBPs的稳定性,进而影响溴代和碘代N-DBPs的生成. 3种卤乙腈类N-DBPs(BAN、DBAN与IAN)的生成量均随初始pH的增加呈现出先增加后减少的趋势,而BNM的生成量则随初始pH的增加而不断减少.
N-DBPs作为一类新兴的消毒副产物,由于具有较高的细胞毒性和遗传毒性,已成为当前消毒副产物领域研究的热点,未来关于N-DBPs的研究将从以下几个方面展开:一、目前关于N-DBPs的研究多集中在HNMs、HANs、HAcAms、NAs这几类物质,而其他的含氮消毒副产物,特别是一些极性较强的溴代和碘代N-DBPs,尚未被识别和检测出;二、氯代、溴代和碘代含氮消毒副产物间的相互转换路径及溴代和碘代含氮消毒副产物的生成机理仍未得到确定;三、溴代和碘代含氮消毒副产物的生成对水体整体生物毒性变化的影响仍有待毒理学研究进行确定.
鱼油氯胺消毒过程中溴代和碘代含氮消毒副产物的生成
The formation of brominated and iodinated nitrogenous disinfection by-products during the chloramination of fish oil
-
摘要: 本研究采用鱼油作为模拟化合物,模拟微污染原水中广泛存在的生物源有机物的脂肪类组成成分,考察氯胺消毒过程中溴代和碘代含氮消毒副产物(nitrogenous disinfection by-products,N-DBPs)的生成情况. 结果表明,鱼油经氯胺消毒后,生成的溴代和碘代N-DBPs主要包括一溴乙腈(bromoacetonitrile,BAN)、二溴乙腈(dibromoacetonitrile,DBAN)、一溴硝基甲烷(bromonitromethane,BNM)、一碘乙腈(iodoacetonitrile,IAN). 其中,在本研究考察范围内,BAN、DBAN与BNM的生成量会随溴离子和总有机碳(Total Organic Carbon,TOC)浓度的增加而增加;当溴离子浓度为5 mg·L−1,TOC为20 mg·L−1时,BAN、DBAN与BNM的最大生成量分别为71.15、192.36、27.52 μg·L−1. IAN的生成量则随碘离子和TOC浓度的增加而增加;当碘离子浓度为0.5 mg·L−1,TOC为20 mg·L−1时,IAN的最大生成量为106.95 μg·L−1. 当氯胺的投加量从5 mg·L−1增加到100 mg·L−1时,BAN、DBAN、BNM与IAN的生成量分别从4.62、33.75、3.75、10.29 μg·L−1增加到49.69、218.40、22.34、123.44 μg·L−1. 4种N-DBPs的生成量均随消毒时间的延长而增加,在消毒72 h后,4种N-DBPs的生成量均达到最大值. 3种卤乙腈类N-DBPs(BAN、DBAN与IAN)的生成量均随初始pH的增加呈现出先增加后减少的趋势,而BNM的生成量则随初始pH的增加而不断减少.Abstract: In this study, fish oil was adopted as the surrogate model compound to simulate the lipid composition of biologically derived organic matter which widely presented in micro-polluted raw water. The formation of brominated and iodinated nitrogenous disinfection by-products (N-DBPs) during the chloramination of fish oil were also investigated. The results showed that four brominated and iodinated N-DBPs including bromoacetonitrile (BAN), dibromoacetonitrile(DBAN), bromonitromethane (BNM) and iodoacetonitrile (IAN) were generated from the chloramination of fish oil. The concentration of BAN, DBAN, and BNM were gradually increased with the increasing bromide ion concentration from 0 to 5 mg·L−1. Specifically, the maximum formation yield of BAN, DBAN and BNM was 71.15 μg·L−1, 192.36 μg·L−1 and 27.52 μg·L−1, respectively, with the bromide ion concentration of 5 mg·L−1 and the total organic carbon (TOC) concentration of 20 mg·L−1. Similarly, the concentration of IAN was gradually increased with the increasing iodide ion concentration from 0 to 0.5 mg·L−1. The maximum yield of IAN was 106.95 μg·L−1 with the iodide ion concentration of 0.5 μg·L−1 and the TOC concentration of 20 mg·L−1. In addition, the concentrations of BAN, DBAN, BNM and IAN were increased from 4.62 , 33.75, 3.75, 10.28 μg·L−1 to 49.69, 218.40, 22.34, 123.44 μg·L−1 when the chloramine dose increased from 5 mg·L−1 to 100 mg·L−1. The yields of four N-DBPs were highly positively correlated with the disinfection time which reached the maximum yield after 72 h disinfection. The formation of BAN, DBAN and IAN were firstly increased and then decreased with the increase of inital pH, while the formation of BNM was decreased constantly with the increase of inital pH.
-
Key words:
- nitrogenous disinfection by-products /
- chloramination /
- iodide ion /
- bromide ion /
- fish oil.
-
饮用水消毒始于20世纪初,其目的是为了杀死水中的病原微生物,切断介水传染病的传播和流行,保障饮用水的安全. 然而,在消毒过程中,消毒剂会不可避免地与水中的天然有机物、外源污染物、无机物等发生反应,生成一类对人体有致畸、致癌、致突变作用的物质——消毒副产物(disinfection by-products, DBPs). 1974年,Rook[1]等发现,氯消毒会产生三卤甲烷(trihalomethanes, THMs),两年后美国癌症协会宣布三氯甲烷对人体具有致癌性,使得DBPs成为了饮用水处理领域关注的热点. 由于氯消毒会产生较多的THMs、卤乙酸(haloacetic acids, HAAs)等受到严格管控的含碳消毒副产物(carbonaceous disinfection by-products, C-DBPs),不少饮用水厂转而采用氯胺、臭氧、二氧化氯等其他消毒方式来代替氯消毒. 氯胺作为消毒剂,它与消毒副产物前体物的反应活性远小于氯,能够有效减少消毒后THMs和HAAs的生成,且氯胺在管网中形成余氯的持续时间长,能够有效抑制管网中残留细菌的再繁殖. 然而,有研究发现,氯胺消毒会导致消毒后水中含氮消毒副产物(nitrogenous disinfection by-products, N-DBPs)生成的增加[2],N-DBPs是一种新兴的DBPs,包括卤代乙腈(haloacetonitrile, HANs)、卤代乙酰胺(haloacetamides, HAcAms)、卤代硝基甲烷(halogenated nitromethanes, HNMs)、亚硝胺类(nitrosamines, NAs)等,相对于C-DBPs,N-DBPs虽然生成浓度较低,但却具有更高的遗传毒性和细胞毒性[3-4].
近年来,有研究发现,当原水中存在溴离子和碘离子时,消毒后的水中不仅会生成氯代DBPs,还会有溴代和碘代DBPs生成[5-6],且溴代和碘代DBPs的细胞毒性和遗传毒性都较氯代DBPs强[4,7]. 例如,Plewa等[8]研究发现,溴乙酸和碘乙酸的细胞毒性分别是氯乙酸的125倍和500倍;Muellner等[9]研究发现,碘乙腈(iodoacetonitrile, IAN)的遗传毒性是目前已知的DBPs中最高的,是二氯乙腈的74倍. 在我国,大部分沿海地区的水源是潮汐河流,靠近入海口,经常会受到咸潮入侵的影响,而海水中溴离子和碘离子的浓度是一般淡水的三千多倍和十几倍[10-12],这将使得这些地区的水源水中有存在较高浓度溴离子和碘离子的风险,进而导致消毒过程中更容易生成溴代和碘代的DBPs. 此外,在我国北方地区的一些城镇生活饮用水中的碘含量可以超过100 μg·L−1[13-14]. 水体中较高的碘含量,不仅会增加人类患甲状腺疾病的风险,而且还会增加消毒过程中I-DBPs的形成. 目前,对于溴代和碘代DBPs的研究多集中在常规的C-DBPs如THMs和HAAs等方面,例如Zha等[15]的研究发现,当溴离子的浓度从0.5 mg·L−1增加至2 mg·L−1时,消毒后生成的三溴甲烷从18.31 μg·L−1增加至127.60 μg·L−1;当碘离子浓度从0增加至2 mg·L−1时,三碘甲烷的生成量从0 μg·L−1增加到317.20 μg·L−1,同等条件下,氯仿的生成量则从241.97 μg·L−1下降至96.23 μg·L−1,表明溴、碘离子的存在会使得氯代THMs向溴代和碘代THMs转变. 而且即使在溴离子浓度较低时,溴代THMs与溴代HAAs的生成量仍然会随之增加. 如Zhang等[16]的研究表明,溴离子浓度为500 μg·L−1的水体经消毒后生成的溴代THMs与溴代HAAs分别是溴离子浓度为65 μg·L−1时的5倍与10倍. 对于溴、碘离子的存在对消毒过程中N-DBPs生成的影响,目前的研究多集中在溴代N-DBPs. 研究发现,HANs、HNMs与HAcAms等N-DBPs的生成总量均会随着溴离子浓度的增加而增加[17-18],并且溴代N-DBPs的占比也会随着溴离子浓度的增加而增加,表明在有溴离子存在的情况下,氯代N-DBPs会向溴代N-DBPs转变. 此外,氯胺消毒过程中溴的反应活性要强于氯消毒[19],并且在碘离子存在的情况下,氯胺消毒不能像氯和臭氧消毒一样进一步将次碘酸氧化为碘酸盐[20],因而在氯胺消毒过程中,可能有更高的溴代和碘代N-DBPs生成的风险.
此外,原水中有机前体物的种类、含量及组成对后续消毒过程中溴代和碘代DBPs的生成也具有重要影响. 目前,我国湖泊、水库等水源水仍存在着富营养化严重,藻类季节性爆发等问题,使原水中含有较多的藻类有机物等生物源有机物,而这些生物源有机物已经成为DBPs,特别是N-DBPs的重要前体物[21-22]. 考虑到实际水体中的有机物来源广泛,种类繁多,成分复杂,难以进行直接研究,采用模拟化合物来模拟实际水体中的有机物是广泛采用的研究方法. Hua等[23]采用牛血清蛋白、鱼油和淀粉来模拟藻类有机物的生化成分中的蛋白质、脂肪以及多糖,结果表明鱼油生成的三氯甲烷分别是牛血清蛋白和淀粉的1.8倍和16倍. Wei等[24]采用腐殖酸、牛血清蛋白、DNA、淀粉与鱼油模拟化合物模拟生物源有机物的主要生化成分腐殖酸、蛋白质、核酸、多糖和脂肪,研究溴、碘离子对C-DBPs的生成影响时发现,鱼油模拟的脂肪类结构经氯化消毒后,形成的I-DBPs比其他模拟化合物都要多,在碘离子浓度为2 mg·L−1时,生成了16.97 μg·L−1的一碘二氯甲烷,而腐殖酸经消毒后仅生成3.87 μg·L−1的一碘二氯甲烷. Yang等[25]的研究发现,含有较多脂肪族结构的亲水性天然有机物(natural organic matter, NOM)较芳香族结构的疏水性NOM更易形成I-DBPs. 而鱼油的重要成分二十二碳六烯酸提取于藻类,其主要成分不饱和脂肪酸均属于脂肪族化合物.
本研究将选择鱼油作为模拟化合物,模拟原水中广泛存在的天然有机物和生物源有机物的脂肪类组成成分,采用氯胺作为消毒剂,分别考察无机前体物(溴、碘离子)浓度、总有机碳(Total Organic Carbon, TOC)、氯胺投加量、消毒时间、初始pH等因素对溴代和碘代N-DBPs生成的影响. 整个研究对于控制溴代和碘代N-DBPs的生成,保障人民群众的饮用水安全具有重要意义.
1. 材料与方法(Materials and methods)
1.1 药品与试剂
一溴乙腈(bromoacetonitrile, BAN, 97%)购自Macklin,二溴乙腈(dibromoacetonitrile, DBAN, 97%)与无水硫酸钠(分析纯)购自Aladdin, IAN(>98%)购自上海梯希爱,一溴硝基甲烷(bromonitromethane, BNM, 97%)购买自海晟泰,内标物1,2-二溴丙烷(1000 mg·L−1于甲基叔丁基醚)购自上海安谱,鱼油(18%EPA, 20%Ώ3)购买自罗恩试剂,甲基叔丁基醚(色谱纯)购买自TEDIA,氯化钠(优级纯)、次氯酸钠(分析纯)、溴化钠(分析纯)、硫代硫酸钠(分析纯)均购自西陇科学,碘化钾(分析纯)购买自汕头市达濠精细化学品有限公司、氯化铵(分析纯)购自国药集团化学试剂有限公司.
1.2 模拟水样的配制
取15 mL鱼油,采用超纯水溶解并定容至1000 mL,配置成鱼油储备液,静置过夜后,用定量滤纸过滤,置于棕色瓶中并于4 ℃下保存. 模拟水样的TOC采用总有机碳分析仪(TOC-VCPN,岛津,日本)测定,分析方法为燃烧氧化-非分散红外吸收法. 测定TOC与使用前都要先通过添加硫酸(0.1 mol·L−1)和氢氧化钠(0.1 mol·L−1)将pH调节至中性,再加入浓度为5 mmol·L−1的磷酸盐缓冲液调节水样的pH= 7.2.
1.3 氯胺消毒实验
一氯胺溶液由NaClO与NH4Cl溶液(保持二者质量比为4 mg·L−1 Cl2:1 mg·L−1 NH4+-N)于冰水浴下暗处混合反应30 min制得,需现用现配. 制得的溶液采用N,N-二乙基-1,4-苯二胺分光光度法测定其一氯胺含量(以氯计).
准确量取20 mL1.2节中配制好的模拟水样于带聚四氟乙烯瓶垫的圆底离心管中,加入一定量的溴化钠(C(Br-)= 500 mg·L−1)或碘化钾(C(I-)= 100 mg·L−1)溶液,然后以C(TOC):C(Cl2)= 1:5加入氯胺消毒剂,于恒温培养箱内25 ℃避光反应72 h. 反应完毕后,取出水样,用100 mg·L−1的Na2S2O3溶液终止反应.
1.4 HANs与HNMs的定量分析方法
1.4.1 水样预处理方法
采用液液萃取[26]. 具体方法为:取消毒完毕后的水样,加入盐酸(1 mol·L−1)将pH调节至2.0,加入50 µL 1 mg·L−1的1,2-二溴丙烷作为内标物,加入5 mL的MTBE作为萃取剂,再加入8 g氯化钠以促进分层,涡旋振荡1.5 min,静置5 min分层,将上层有机相吸出,加入3 g无水硫酸钠(使用前需经马弗炉400 °C灼烧并用MTBE洗涤)过滤至吹脱管中,氮吹至有机相剩余0.5 mL,最后用MTBE定容至1 mL,转移至棕色进样小瓶中等待后续检测.
1.4.2 GC-MS分析测试条件
本研究中进行定量分析的溴代和碘代N-DBPs包括HANs与HNMs两大类,其中,HANs类为BAN、DBAN、IAN,HNMs类为BNM. HANs与HNMs的定量分析方法参考EPA551.1和Carter[27]等的方法. 所用仪器为Thermo Trace-1300 ISQ-Mass气相色谱-质谱联用仪,色谱柱型号为HP-5MS UI(30 m × 250 µm × 0. 25 µm). 进样口温度为150 ℃,传输线温度为280 ℃,检测器温度为290 ℃. 升温程序为35 ℃保持5 min后,以10 ℃·min−1的速度升至65 ℃保持3 min,最后以20 ℃·min−1的速度升至260 ℃保持5 min,共26 min;进样方式为不分流进样,进样量为2 µL,载气为高纯氦,氦气流速为1.0 mL·min−1,采用EI电离源,电离电压为70 eV.
2. 结果与讨论(Results and discussion)
2.1 溴/碘离子投加量对溴代和碘代N-DBPs生成的影响
有研究表明,溴或碘离子的存在,会使消毒过程中的DBPs氯代向溴代和碘代转变. 因此,本研究首先考察鱼油在不同浓度的溴离子和碘离子存在的情况下,经氯胺消毒后,溴代和碘代N-DBPs的生成情况.
2.1.1 溴离子投加量对BAN生成的影响
图1是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后BAN的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到BAN的生成,而当溴离子浓度增加到0.5 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了少量的BAN,且BAN的生成量随着水样TOC浓度的增加而增加.
此外,当溴离子的浓度从0 mg·L−1增加至5 mg·L−1时,4种不同TOC浓度下BAN的生成量均逐渐增加,当溴离子浓度为5 mg·L−1时,4种不同TOC浓度下的BAN的生成量均达到最大值,分别为4.83、17.82、46.13、71.15 μg·L−1. 一方面,增加水样的TOC,提供了更多的DBPs的有机前体物,使得BAN的生成量也随之增加,这说明鱼油模拟的脂肪成分为BAN的有效前体物. 另一方面,当水样中有溴离子存在时,氯胺水解释放的次氯酸会先与溴离子反应[28],产生次溴酸,次溴酸与水中的胺或氯胺反应,生成溴胺与溴氯胺,它们的反应活性比氯胺强[29],更容易与有机前体物反应生成BAN. 当水样的TOC一定时,溴胺与溴氯胺的生成量会随着溴离子浓度的增加而不断增加,其不断地与有机前体物反应,最终表现为BAN的生成量的增加.
此外,从图1还可以发现,当模拟水样的TOC浓度保持不变,BAN的生成量虽然会随着溴离子浓度的增加而逐渐升高,但增长速率会逐渐放缓. 这可能是因为当水样的TOC不变的情况下,水样中能够提供的有机前体物是有限的,而随着溴离子浓度的不断增加,氯胺与溴离子反应形成的溴胺会通过可逆的歧化反应形成二溴胺,二溴胺在水中会快速地分解[30],因此继续增加溴离子浓度可能不会使得BAN的生成量大幅增长;另一方面可能是由于溴离子浓度增加使得生成的BAN向DBAN转变,因此BAN的生成量增幅有所下降.
2.1.2 溴离子投加量对DBAN生成的影响
图2是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后DBAN的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到DBAN的生成. 当溴离子浓度增加到0.5 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了少量的DBAN,生成浓度分别为5.60、7.13、7.96、8.35 μg·L−1,且DBAN的生成量随着水样TOC浓度的增加而增加. 这是由于水样TOC的增加,使得水中含有更多的DBPs的前体物,因而DBAN的生成量随之增加,说明脂肪类结构是DBAN的有效前体物,这与BAN的生成规律一致. 在溴离子浓度较低时,溴的取代反应进行的不完全,生成的DBAN含量较少,随着溴离子浓度逐渐增加,4种不同TOC浓度下DBAN的生成量均迅速增加,当溴离子浓度为5 mg·L−1时,4种不同TOC下DBAN的生成量分别达到57.03、111.97、133.71、192.36 μg·L−1. 增加溴离子的浓度,一方面使水中产生的溴胺与溴氯胺增加[28],二者不断地与有机前体物发生反应;另一方面,溴离子的浓度增加使水样中生成的BAN向DBAN转变,最终表现为DBAN生成量的增加.
2.1.3 溴离子投加量对BNM生成的影响
图3是在不同的TOC与溴离子浓度下,鱼油模拟水样经氯胺消毒后BNM的生成情况. 从图中可以看出,在未投加溴离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到BNM的生成. 当溴离子的浓度增加到0.5 mg·L−1时,4种不同浓度TOC下的模拟水样均检测到了BNM的生成. 但是与BAN的生成规律不同,BNM的生成量没有随着TOC浓度的增加而出现大幅的增长. 这可能是因为,HNMs的重要前体物是硝基化合物[31],而本研究选取的模型化合物鱼油作为一种典型的支链脂肪烃类有机物,并不是BNM的重要前体物. 另一方面,模拟水样中并不存在对HNMs的形成有重要影响的亚硝酸盐类物质,且亚硝酸盐经氯化后形成的NO2Cl,与脂肪族化合物相比,更易与含有芳香族和共轭双键的化合物发生亲电取代产生硝基化合物[32].
另外,当水样的TOC浓度一定时,随着溴离子浓度的增加,BNM的生成量也逐渐增加,在溴离子浓度为5 mg·L−1时,4种不同TOC下BNM的生成量分别为18.87、19.12、26.71、27.52 μg·L−1. 说明溴离子浓度的增加,使得水中生成的溴胺与溴氯胺增加,溴胺与溴氯胺与有机物反应进而生成更多的BNM.
2.1.4 TOC与碘离子对IAN生成的影响
图4是在不同的TOC与碘离子浓度下,鱼油模拟水样经氯胺消毒后IAN的生成情况. 从图4中可以看出,在未投加碘离子的情况下,4种不同TOC浓度下的鱼油模拟水样经氯胺消毒后,均未检测到IAN的生成,而当碘离子的浓度增加到0.1 mg·L−1时,4种不同TOC浓度下的模拟水样均检测到了IAN的生成,且IAN的生成量会随着水样TOC浓度的增加而出现明显的增长. 在TOC一定时,随着碘离子投加量从0 mg·L−1增加到0.5 mg·L−1,IAN的生成量逐渐增加. 当TOC为20 mg·L−1,碘离子浓度为0.5 mg·L−1时,IAN的生成量达到最大值,为106.95 μg·L−1,远高于在5 mg·L−1溴离子情况下BAN的生成量. 这可能是因为碘相比于溴,具有更强的与有机前体物发生亲核取代的能力,而Liu等[33]也发现,在消毒过程中,卤素的消耗遵循碘>溴>氯的顺序. 此外,对比Wei等[24]研究可以发现,氯胺消毒下,IAN的生成规律与I-THMs的生成规律一致,生成量都是随着碘离子浓度的增加而增加.
2.2 氯胺投加量对溴代和碘代N-DBPs生成的影响
图5是在不同的氯胺投加量下,鱼油模拟水样经氯胺消毒后BAN、DBAN、BNM与IAN的生成情况. 从图5可以看出,当氯胺的投加量为5 mg·L−1时,BAN、DBAN、BNM、IAN的生成量分别为4.62、33.75、3.75、10.29 μg·L−1;而当氯胺的投加量增加到100 mg·L−1时,4种N-DBPs的生成量均达到最大值,分别为49.69、218.40、22.34、123.44 μg·L−1. BAN、DBAN、BNM、IAN的生成量均随着氯胺投加量的增加而增大. 这可能是因为增加氯胺的投加量,能够加速氧化溴离子产生更多的次溴酸,促进次溴酸与胺或氯胺反应,产生更多的溴胺和溴氯胺,从而促进了溴胺、溴氯胺与有机前体物反应,形成更多的溴代N-DBPs. 另一方面,氯胺浓度增加能够加速氧化碘离子成为次碘酸,次碘酸的亲核取代能力远远超过了次氯酸[33],它与有机前体物反应产生使得碘代N-DBPs的生成量快速增加.
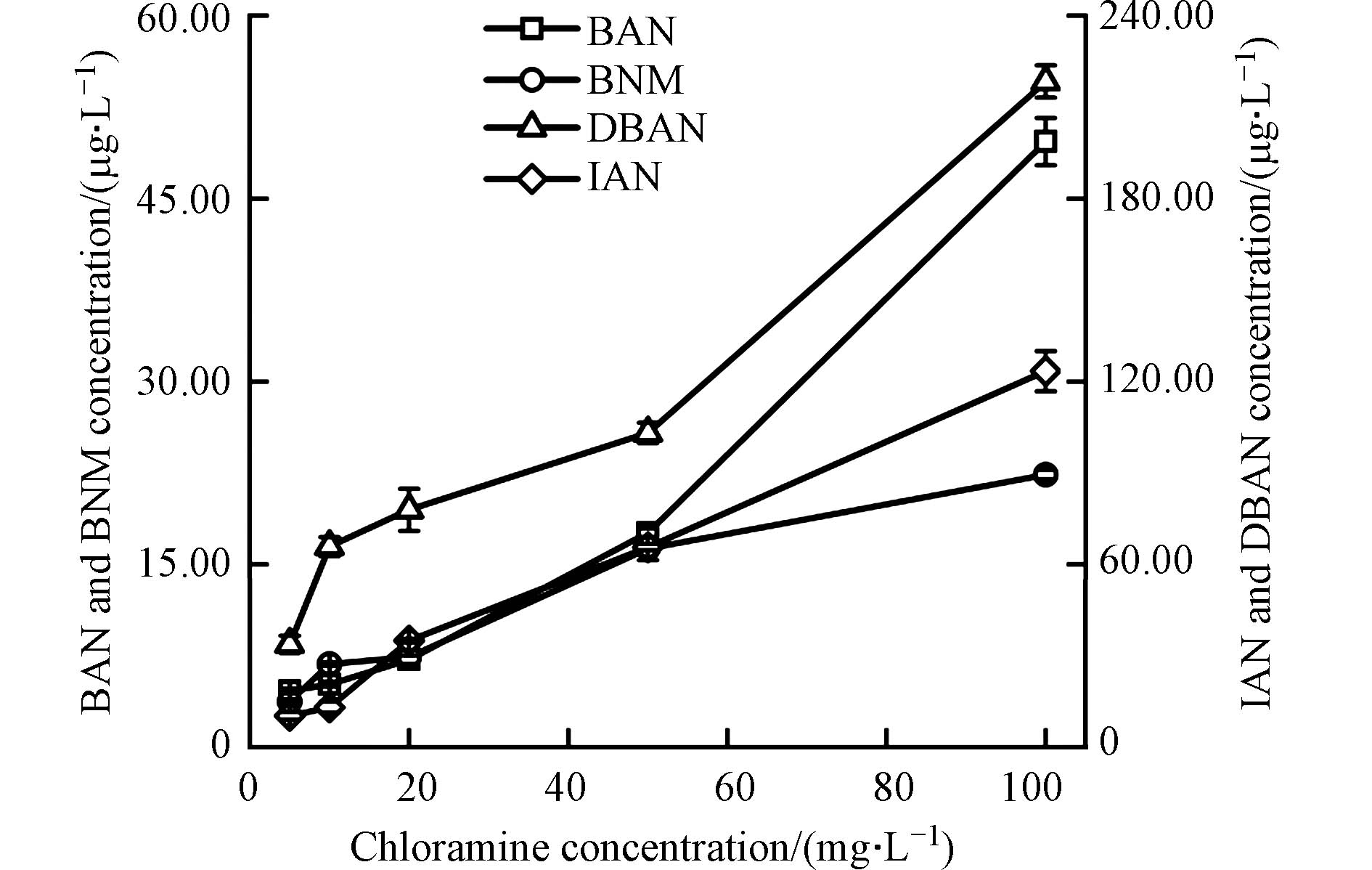 图 5 氯胺投加量对溴代和碘代N-DBPs生成的影响Figure 5. Effect of the dosge of chloramine on the formation of brominated and iodinated N-DBPs(起始反应条件:TOC= 10 mg·L−1,C(Br-)= 5 mg·L−1,C(I-)= 0.5 mg·L−1,pH= 7.2,反应时间72 h)(Initial reaction conditions: TOC= 10 mg·L−1, C(Br-)= 5 mg·L−1, C(I-)= 0.5 mg·L−1, pH= 7.2, disinfection time: 72 h)
图 5 氯胺投加量对溴代和碘代N-DBPs生成的影响Figure 5. Effect of the dosge of chloramine on the formation of brominated and iodinated N-DBPs(起始反应条件:TOC= 10 mg·L−1,C(Br-)= 5 mg·L−1,C(I-)= 0.5 mg·L−1,pH= 7.2,反应时间72 h)(Initial reaction conditions: TOC= 10 mg·L−1, C(Br-)= 5 mg·L−1, C(I-)= 0.5 mg·L−1, pH= 7.2, disinfection time: 72 h)2.3 消毒时间对溴代和碘代N-DBPs生成的影响
图6展示了氯胺消毒时间对BAN、DBAN、BNM和IAN生成的影响. 从图6中可以看出,在反应的前12 h,BAN与BNM的生成量缓慢增加,从12 h时开始,BAN与BNM的生成量出现明显的增加,到反应的72 h,BAN与BNM的生成量均达到最大值,分别为19.09 μg·L−1与16.36 μg·L−1. DBAN在反应的前2 h未检测到,之后随着反应时间的延长而缓慢增加,反应24 h后DBAN的生成量开始快速增加,到反应的72 h达到最大生成量,为107.62 μg·L−1. 在反应的前24 h,IAN生成量基本保持在35 μg·L−1,从24 h时开始,IAN的生成量出现明显的增加,到反应的72 h,IAN的生成量达到最大值,为63.60 μg·L−1. 4种N-DBPs的生成量均随着消毒时间的延长而增加. 这是由于氯胺相对于氯,是更加稳定的化合物,氯胺在水中的分解较为缓慢,使得其与有机前体物反应的活性低于氯,难以在较短的时间氧化有机物进而产生DBPs. 此外,消毒72 h时,水样中溴代和碘代N-DBPs的生产量仍旧有增加的趋势,但是由于饮用水经水厂消毒后,通过供水系统到达用户,经过的时间一般在72 h以内,因此将消毒时间控制在72 h.
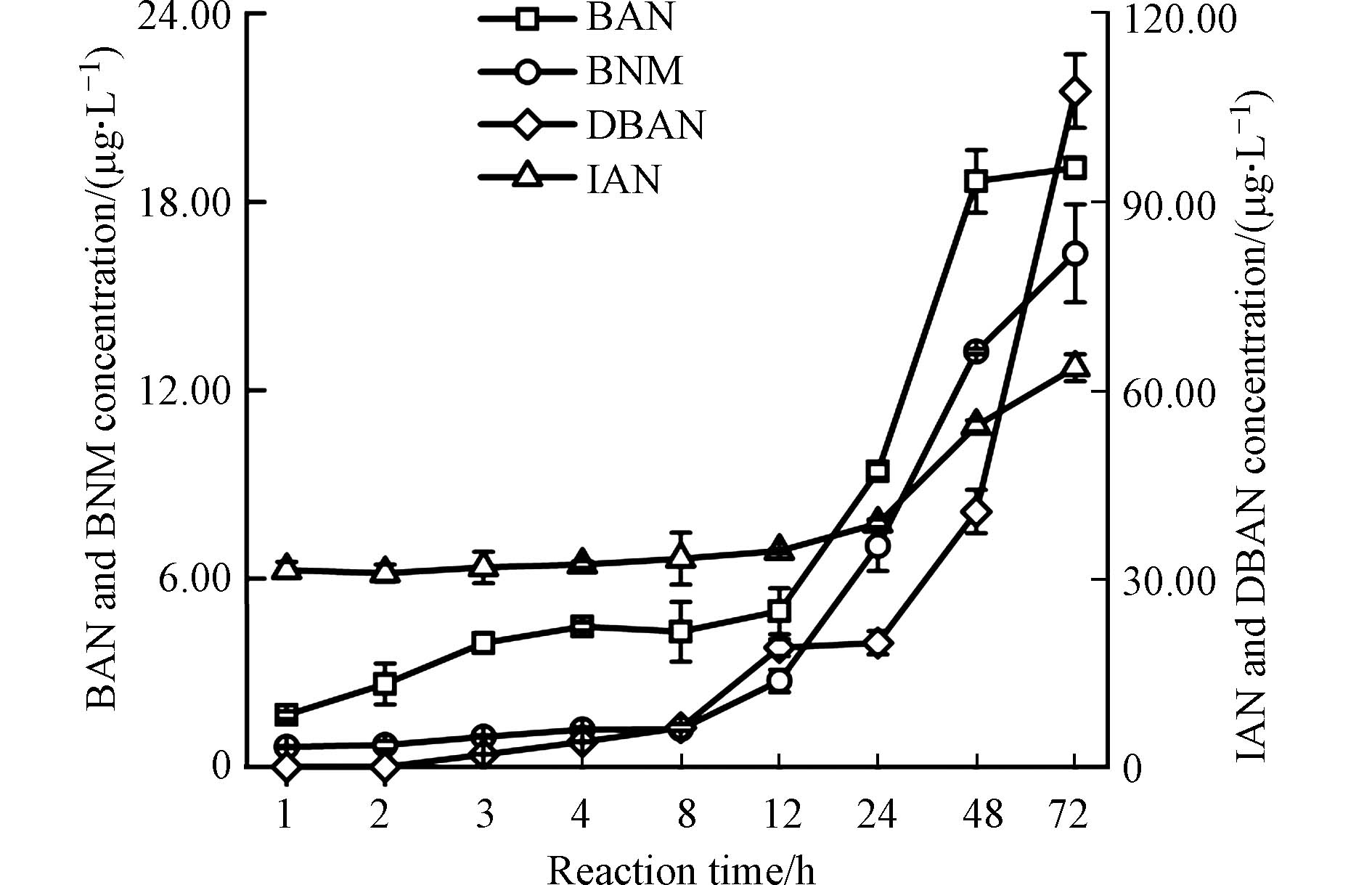 图 6 消毒时间对溴代和碘代N-DBPs生成的影响Figure 6. Effect of disinfection time on the formation of brominated and iodinated N-DBPs(起始反应条件:TOC= 10 mg·L−1,C(NH2Cl)= 50 mg·L−1,C(Br-)= 5 mg·L−1,C(I-)= 0.5 mg·L−1,pH= 7.2)(Initial reaction conditions: TOC= 10 mg·L−1, C(NH2Cl)= 50 mg·L−1, C(Br-)= 5 mg·L−1, C(I-)= 0.5 mg·L−1, pH= 7.2)
图 6 消毒时间对溴代和碘代N-DBPs生成的影响Figure 6. Effect of disinfection time on the formation of brominated and iodinated N-DBPs(起始反应条件:TOC= 10 mg·L−1,C(NH2Cl)= 50 mg·L−1,C(Br-)= 5 mg·L−1,C(I-)= 0.5 mg·L−1,pH= 7.2)(Initial reaction conditions: TOC= 10 mg·L−1, C(NH2Cl)= 50 mg·L−1, C(Br-)= 5 mg·L−1, C(I-)= 0.5 mg·L−1, pH= 7.2)2.4 初始pH对溴代和碘代N-DBPs生成的影响
pH不仅可以影响一氯胺在水中的形态及其水解速率,还会干扰N-DBPs的稳定性. 一般来说,在酸性条件下,氯胺更易水解释放游离氯,在碱性条件下,卤乙腈类物质容易发生水解. 此外,当有机前体物不同时,氯胺消毒后N-DBPs的生成也会随着pH的变化有着不同的规律. Yang[34]与Nihemaiti[35]等发现,酪氨酸作为前体物时,当水样的pH从5增加至9,DCAN生成量一直减少,而天冬酰胺作为前体物时,DCAN随pH增加一直增加,甲基吡咯与间二苯酚做前体物时,DCAN先增加后减少. 因此,本研究考察了鱼油在不同的初始pH情况下,经氯胺消毒后,溴代和碘代N-DBPs的生成情况.
图7是在不同的初始pH下,鱼油模拟水样经氯胺消毒后BAN、DBAN、BNM、IAN的生成情况. 从图7中可以看出,3种卤乙腈类N-DBPs包括BAN、DBAN与IAN的生成量均随着pH的增加先增加再减少,当pH= 8时,BAN、DBAN与IAN的生成量均最大,分别为19.64 μg·L−1、118.21 μg·L−1与68.24 μg·L−1,当pH继续增大至9时,由于在碱性环境中卤乙腈类物质更容易发生水解,因而形成的卤乙腈类物质减少. 而HNMs的生成规律与HANs不同,随着pH的增加,BNM的生成量缓慢减少,当pH= 5时,BNM的生成量最大,为23.98 μg·L−1. 这可能是由于酸性条件下,氯胺更易水解释放游离氯,与溴离子结合形成更多的次溴酸,促进了与有机前体物反应,生成更多的BNM.
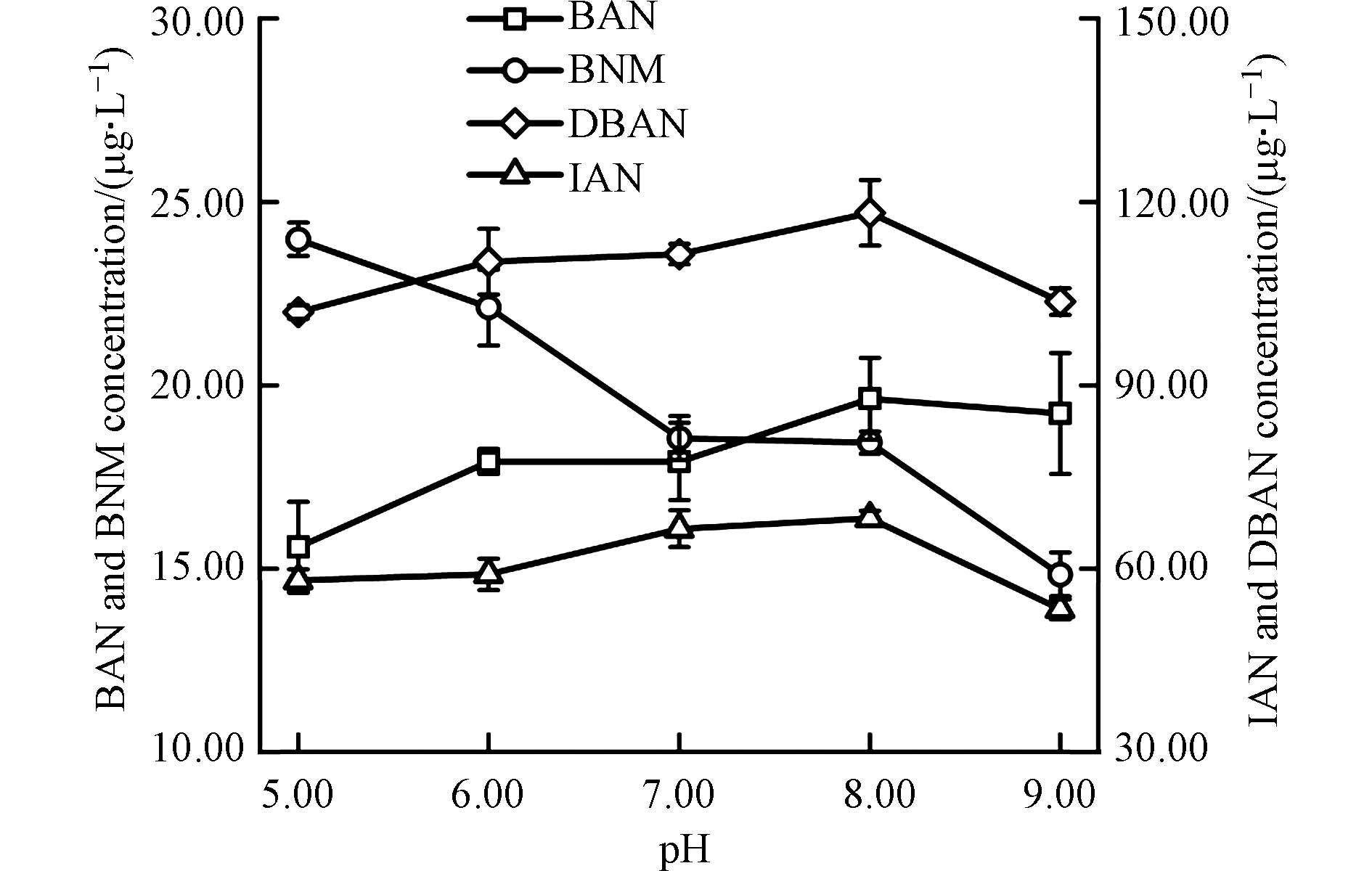 图 7 初始pH对溴代和碘代N-DBPs生成的影响Figure 7. Effect of pH on the formation of brominated and iodinated N-DBPs(起始反应条件:TOC= 10 mg·L−1,C(NH2Cl)= 50 mg·L−1,C(Br-)= 5 mg·L−1,C(I-)= 0.5 mg·L−1,反应时间72 h)(Initial reaction conditions: TOC= 10 mg·L−1, C(NH2Cl)= 50 mg·L−1, C(Br-)= 5 mg·L−1, C(I-)= 0.5 mg·L−1, disinfection time: 72 h)
图 7 初始pH对溴代和碘代N-DBPs生成的影响Figure 7. Effect of pH on the formation of brominated and iodinated N-DBPs(起始反应条件:TOC= 10 mg·L−1,C(NH2Cl)= 50 mg·L−1,C(Br-)= 5 mg·L−1,C(I-)= 0.5 mg·L−1,反应时间72 h)(Initial reaction conditions: TOC= 10 mg·L−1, C(NH2Cl)= 50 mg·L−1, C(Br-)= 5 mg·L−1, C(I-)= 0.5 mg·L−1, disinfection time: 72 h)3. 结论(Conclusions)
本研究选择鱼油作为模型化合物来模拟原水中广泛存在的天然有机物和生物源有机物的脂肪类组成成分,采用氯胺作为消毒剂,分别考察无机前体物(溴、碘离子)浓度、氯胺投加量、消毒时间、初始pH等因素对溴代和碘代N-DBPs生成的影响,得出了以下结论:
鱼油经氯胺消毒后,生成的溴代和碘代N-DBPs主要包括BAN、DBAN、BNM和IAN. 其中,BAN、DBAN与BNM的生成量随溴离子和TOC浓度的增加而增加,IAN的生成量则随碘离子浓度和TOC的增加而增加.
增加氯胺的投加量可使N-DBPs的生成量快速增加;当氯胺的投加量从5 mg·L−1增加到100 mg·L−1时,BAN、DBAN、BNM与IAN的生成量分别从4.62 μg·L−1、33.75 μg·L−1、3.75 μg·L−1和10.29 μg·L−1增加到49.69 μg·L−1、218.40 μg·L−1、22.34 μg·L−1和123.44 μg·L−1.
消毒时间与4种NDBPs的生成量高度正相关, 在氯胺消毒72 h后,4种N-DBPs的生成量均达到最大值.
pH能够影响一氯胺的形态、水解速率与N-DBPs的稳定性,进而影响溴代和碘代N-DBPs的生成. 3种卤乙腈类N-DBPs(BAN、DBAN与IAN)的生成量均随初始pH的增加呈现出先增加后减少的趋势,而BNM的生成量则随初始pH的增加而不断减少.
N-DBPs作为一类新兴的消毒副产物,由于具有较高的细胞毒性和遗传毒性,已成为当前消毒副产物领域研究的热点,未来关于N-DBPs的研究将从以下几个方面展开:一、目前关于N-DBPs的研究多集中在HNMs、HANs、HAcAms、NAs这几类物质,而其他的含氮消毒副产物,特别是一些极性较强的溴代和碘代N-DBPs,尚未被识别和检测出;二、氯代、溴代和碘代含氮消毒副产物间的相互转换路径及溴代和碘代含氮消毒副产物的生成机理仍未得到确定;三、溴代和碘代含氮消毒副产物的生成对水体整体生物毒性变化的影响仍有待毒理学研究进行确定.
-
-
[1] ROOK J. Formation of haloform during chlorination of natural water [J]. Water Treatment and Examination, 1972, 21: 259. [2] HU J, SONG H, ADDISON J W, et al. Halonitromethane formation potentials in drinking waters [J]. Water Research, 2010, 44(1): 105-114. doi: 10.1016/j.watres.2009.09.006 [3] JEONG C H, POSTIGO C, RICHARDSON S D, et al. Occurrence and comparative toxicity of haloacetaldehyde disinfection byproducts in drinking water [J]. Environmental Science & Technology, 2015, 49(23): 13749-13759. [4] WAGNER E D, PLEWA M J. CHO cell cytotoxicity and genotoxicity analyses of disinfection by-products: An updated review [J]. Journal of Environmental Sciences, 2017, 58: 64-76. doi: 10.1016/j.jes.2017.04.021 [5] XIA Y, LIN Y L, XU B, et al. Iodinated trihalomethane formation during chloramination of iodate-containing waters in the presence of zero valent iron [J]. Water Research, 2017, 124: 219-226. doi: 10.1016/j.watres.2017.07.059 [6] ZHANG H F, YANG M. Characterization of brominated disinfection byproducts formed during chloramination of fulvic acid in the presence of bromide [J]. Science of the Total Environment, 2018, 627: 118-124. doi: 10.1016/j.scitotenv.2018.01.215 [7] LI X F, MITCH W A. Drinking water disinfection byproducts (DBPs) and human health effects: Multidisciplinary challenges and opportunities [J]. Environmental Science & Technology, 2018, 52(4): 1681-1689. [8] PLEWA M J, WAGNER E D, RICHARDSON S D, et al. Chemical and biological characterization of newly discovered iodoacid drinking water disinfection byproducts [J]. Environmental Science & Technology, 2004, 38(18): 4713-4722. [9] MUELLNER M G, WAGNER E D, McCALLA K, et al. Haloacetonitriles vs. regulated haloacetic acids: Are nitrogen-containing DBPs more toxic? [J]. Environmental Science & Technology, 2007, 41(2): 645-651. [10] WHITEHEAD D C. The distribution and transformations of iodine in the environment [J]. Environment International, 1984, 10(4): 321-339. doi: 10.1016/0160-4120(84)90139-9 [11] SIDDIQUI M S, AMY G L, RICE R G. Bromate ion formation: A critical review [J]. Journal - American Water Works Association, 1995, 87(10): 58-70. doi: 10.1002/j.1551-8833.1995.tb06435.x [12] MAGAZINOVIC R S, NICHOLSON B C, MULCAHY D E, et al. Bromide levels in natural waters: Its relationship to levels of both chloride and total dissolved solids and the implications for water treatment [J]. Chemosphere, 2004, 57(4): 329-335. doi: 10.1016/j.chemosphere.2004.04.056 [13] WANG N, ZHANG G, XIONG R X, et al. Synchronous moderate oxidation and adsorption on the surface of γ-MnO2 for efficient iodide removal from water [J]. Environmental Science & Technology, 2022, 56(13): 9417-9427. [14] WANG Y, CUI Y S, CHEN C, et al. Stopping the supply of iodized salt alone is not enough to make iodine nutrition suitable for children in higher water iodine areas: A cross-sectional study in Northern China [J]. Ecotoxicology and Environmental Safety, 2020, 188: 109930. doi: 10.1016/j.ecoenv.2019.109930 [15] ZHA X S, LIU Y, LIU X, et al. Effects of bromide and iodide ions on the formation of disinfection by-products during ozonation and subsequent chlorination of water containing biological source matters [J]. Environmental Science and Pollution Research, 2014, 21(4): 2714-2723. doi: 10.1007/s11356-013-2176-x [16] ZHANG Y, ZHANG N, ZHAO P, et al. Characteristics of molecular weight distribution of dissolved organic matter in bromide-containing water and disinfection by-product formation properties during treatment processes [J]. Journal of Environmental Sciences, 2018, 65: 179-189. doi: 10.1016/j.jes.2017.03.013 [17] KRISTIANA I, LIEW D, HENDERSON R K, et al. Formation and control of nitrogenous DBPs from Western Australian source waters: Investigating the impacts of high nitrogen and bromide concentrations [J]. Journal of Environmental Sciences, 2017, 58: 102-115. doi: 10.1016/j.jes.2017.06.028 [18] 高乃云, 赵璐, 楚文海. 饮用水中典型含氮消毒副产物卤乙腈的质量浓度分布 [J]. 同济大学学报(自然科学版), 2012, 40(2): 251-255. doi: 10.3969/j.issn.0253-374x.2012.02.016 GAO N Y, ZHAO L, CHU W H. Concentration distribution of typical nitrogenous disinfection by-products HANs in drinking water [J]. Journal of Tongji University (Natural Science), 2012, 40(2): 251-255(in Chinese). doi: 10.3969/j.issn.0253-374x.2012.02.016
[19] ZHAI H Y, CHENG S Z, ZHANG L Y, et al. Formation characteristics of disinfection byproducts from four different algal organic matter during chlorination and chloramination[J]. Chemosphere, 2022, 308(Pt 1): 136171. [20] 付顺, 孙越. 碘代消毒副产物在净水工艺中的生成机制与控制措施 [J]. 环境化学, 2016, 35(6): 1153-1163. doi: 10.7524/j.issn.0254-6108.2016.06.2015111203 FU S, SUN Y. Formation mechanism and control measures of iodinated disinfection by-products in drinking water process [J]. Environmental Chemistry, 2016, 35(6): 1153-1163(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.06.2015111203
[21] LI X, RAO N R H, LINGE K L, et al. Formation of algal-derived nitrogenous disinfection by-products during chlorination and chloramination [J]. Water Research, 2020, 183: 116047. doi: 10.1016/j.watres.2020.116047 [22] WANG X X, LIU B M, LU M F, et al. Characterization of algal organic matter as precursors for carbonaceous and nitrogenous disinfection byproducts formation: Comparison with natural organic matter [J]. Journal of Environmental Management, 2021, 282: 111951. doi: 10.1016/j.jenvman.2021.111951 [23] HONG H C, MAZUMDER A, WONG M H, et al. Yield of trihalomethanes and haloacetic acids upon chlorinating algal cells, and its prediction via algal cellular biochemical composition [J]. Water Research, 2008, 42(20): 4941-4948. doi: 10.1016/j.watres.2008.09.019 [24] WEI Y Y, LIU Y, MA L M, et al. Speciation and formation of iodinated trihalomethane from microbially derived organic matter during the biological treatment of micro-polluted source water [J]. Chemosphere, 2013, 92(11): 1529-1535. doi: 10.1016/j.chemosphere.2013.04.019 [25] YANG Y, KOMAKI Y, KIMURA S Y, et al. Toxic impact of bromide and iodide on drinking water disinfected with chlorine or chloramines [J]. Environmental Science & Technology, 2014, 48(20): 12362-12369. [26] YE Z, LIU W J, SUN W J, et al. Role of ammonia on haloacetonitriles and halonitromethanes formation during Ultraviolet irradiation followed by chlorination/chloramination [J]. Chemical Engineering Journal, 2018, 337: 275-281. doi: 10.1016/j.cej.2017.12.073 [27] CARTER R A A, LIEW D S, WEST N, et al. Simultaneous analysis of haloacetonitriles, haloacetamides and halonitromethanes in chlorinated waters by gas chromatography-mass spectrometry [J]. Chemosphere, 2019, 220: 314-323. doi: 10.1016/j.chemosphere.2018.12.069 [28] 顾允轩, 仇付国, 刘子奇, 等. 水中溴代消毒副产物的生成综述 [J]. 环境化学, 2022, 41(6): 1934-1946. doi: 10.7524/j.issn.0254-6108.2021021801 GU Y X, QIU F G, LIU Z Q, et al. Brominated disinfection by-products formation in water: A review [J]. Environmental Chemistry, 2022, 41(6): 1934-1946(in Chinese). doi: 10.7524/j.issn.0254-6108.2021021801
[29] ALLARD S, HU W, le MENN J B, et al. Method development for quantification of bromochloramine using membrane introduction mass spectrometry [J]. Environmental Science & Technology, 2018, 52(14): 7805-7812. [30] ALLARD S, CADEE K, TUNG R, et al. Impact of brominated amines on monochloramine stability during in-line and pre-formed chloramination assessed by kinetic modelling [J]. Science of the Total Environment, 2018, 618: 1431-1439. doi: 10.1016/j.scitotenv.2017.09.281 [31] BOND T, TEMPLETON M R, GRAHAM N. Precursors of nitrogenous disinfection by-products in drinking water: A critical review and analysis [J]. Journal of Hazardous Materials, 2012, 235/236: 1-16. doi: 10.1016/j.jhazmat.2012.07.017 [32] HONG H C, QIAN L Y, XIAO Z Q, et al. Effect of nitrite on the formation of halonitromethanes during chlorination of organic matter from different origin [J]. Journal of Hydrology, 2015, 531: 802-809. doi: 10.1016/j.jhydrol.2015.10.046 [33] LIU Y S, LIU K Q, PLEWA M J, et al. Formation of regulated and unregulated disinfection byproducts during chlorination and chloramination: Roles of dissolved organic matter type, bromide, and iodide [J]. Journal of Environmental Sciences, 2022, 117: 151-160. doi: 10.1016/j.jes.2022.04.014 [34] YANG X, SHEN Q Q, GUO W H, et al. Precursors and nitrogen origins of trichloronitromethane and dichloroacetonitrile during chlorination/chloramination [J]. Chemosphere, 2012, 88(1): 25-32. doi: 10.1016/j.chemosphere.2012.02.035 [35] NIHEMAITI M, le ROUX J, HOPPE-JONES C, et al. Formation of haloacetonitriles, haloacetamides, and nitrogenous heterocyclic byproducts by chloramination of phenolic compounds [J]. Environmental Science & Technology, 2017, 51(1): 655-663. -




 下载:
下载: