-
石油是人类重要的能源和工业原料. 在石油的开采、运输和炼制过程中,会不可避免地发生泄漏. 海洋作为石油运输的重要通道及陆源污染物的汇集地,石油污染风险较高. 曾发生过如“埃克森·瓦尔迪兹号(Exxon Valdez)”溢油、“深水地平线(Deepwater Horizon)”溢油、“河北精神号(Hebei Spirit)”溢油、“桑吉轮(Sanchi)”溢油、“蓬莱19-3溢油”、“11·22中石化东黄输油管道泄漏事故”、“交响乐轮(Symphony)”溢油等溢油事故,海洋石油污染伴随着人类社会经济的发展. 石油是含有多种烃类的混合物,在短期和长期时间内都可对海洋生态系统造成严重危害. 溢油初期的大量泄露会引起浮游类生物、鱼类、鸟类的死亡[1-2]. 而长期存在于海洋环境的石油烃(如多环芳烃类),会对海洋植物-红树林造成基因水平上的损伤[3],会改变海洋生物体内激素水平而引起死亡[4]. 在溢油污染发生后,有效的处理技术或方法能够减轻石油污染对海洋环境的影响.
当前,海洋石油污染去除主要通过化学、物理、生物等技术方法,包括分散剂、凝油剂、原位燃烧、围油栏、撇油器、吸附材料以及生物修复等. 在溢油事故应急处理中,喷洒分散剂往往是采取较多的处理方式. 但分散剂的使用并不能直接去除海洋中的石油,而是通过自身的分子特性将水面的油分散成油滴进入水相. 另外,大量的使用致使分散剂成分长时间滞留于海洋环境中,从而造成二次污染. 当采用燃烧法对水面石油进行燃烧时,会向大气中释放大量的黑碳并会再次沉积到海底[5];另外,燃烧过程中会产生大量的二噁英和呋喃等有毒物[6]. 围油栏和撇油器等机械设备能够阻止水面浮油的扩散并进行回收,且不会对环境造成二次污染,但易受天气和海况影响. 生物修复技术是依靠微生物的新陈代谢从而降解石油污染物,其修复过程较为漫长,一般作为末端处理措施使用[7].
吸附是一种经济、简单直接的处理方法,能够弥补上述处理措施存在的缺陷和不足. 用于吸附溢油的材料主要包括天然有机、合成有机以及无机材料. 天然有机吸附剂,来源广泛、简单易得且生物降解性强. 作为天然有机吸附剂之一的碳材料由于其具备孔隙发达、比表面积大等优点近年来得到了较多的关注,其中最具代表性的就是生物炭. 生物炭具有适应性强、原料广泛、制备简单等特点,且在吸附石油后可作为燃料直接燃烧产能.
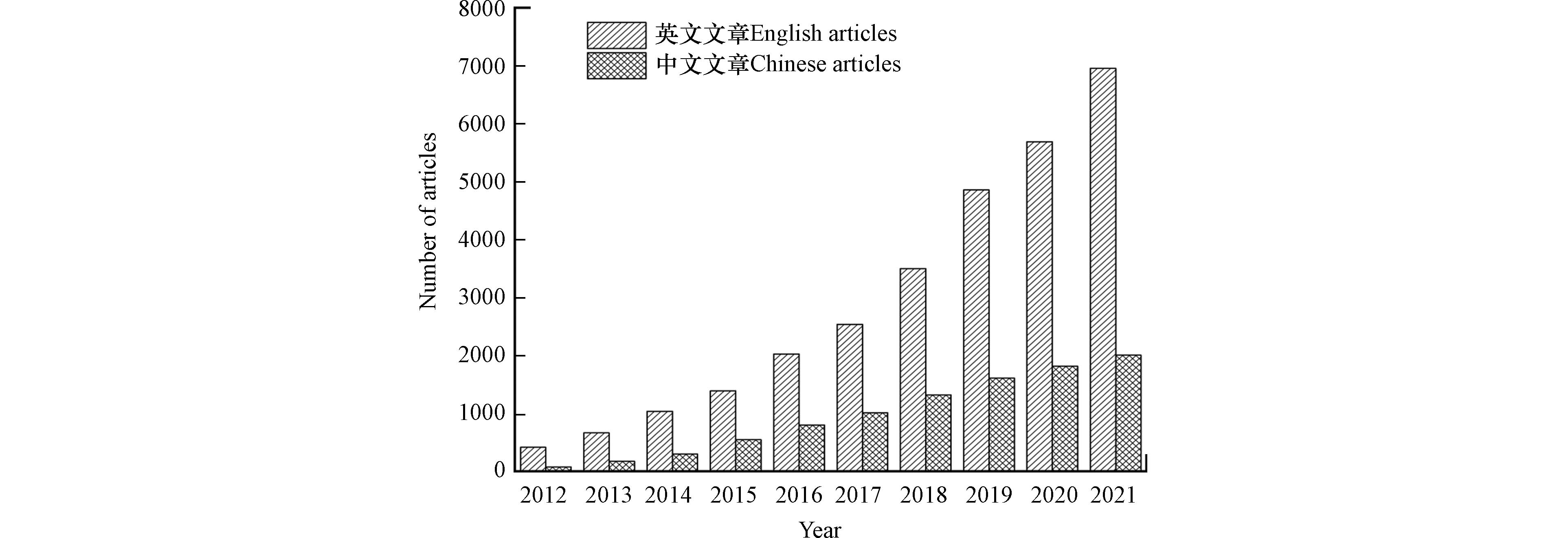
生物炭起源于亚马逊盆地发现的一种黝黑且肥沃的土壤—“Terra Preta”,其意为“黑土”. “Terra Preta”土壤保持较高肥沃性的原因是其中含有大量的“木炭”类物质,后经科学家研究将其称为“生物炭”. 生物炭是通过在缺氧环境中加热而形成的富含碳的固体物质,原料来源包含植物、粪便、活性污泥、废弃物等[8]. 生物炭的理化性质主要受原料类型和制备条件的影响. 总的来说生物炭具有孔隙度高、比表面积大、阳离子交换量高、结构稳定、原料易得、成本低等优点[9]. 因此,生物炭成为了近年来的研究热点,关于生物炭的文章也越来越多(图1). 生物炭作为一种较理想的吸附剂常用于去除环境中的各类污染物,例如重金属、农药、抗生素、油类等[8]. 其次,生物炭在用于土壤时可保持土壤肥力,改善土壤物理性质,提高农作物产量,减少氮排放[10]. 另外,作为减少全球废弃物碳足迹的有效策略,将固体废弃物转化为生物炭,能够减少温室气体排放,实现碳封存,有利于促进循环经济发展[11].
为适应应用时不同的环境条件,通常会对生物炭进行改性处理,提高其使用性能. 在已有的研究中,常采用酸碱、氧化剂、金属及有机物改性等方法对其进行处理[12]. 尤其,在利用生物炭从水环境中去除有机污染物时,其去除效果主要是由表面疏水性决定的. 因此,往往会对生物炭进行疏水化处理,增强生物炭和目标污染物之间的相互作用,从而提高吸附效率. 生物炭在石油烃污染修复方面,除了作为吸附剂外,还可利用自身多孔的性质固定化石油烃降解菌去除污染物. 此外,生物炭表面丰富的官能团及营养元素还可刺激本土微生物,增强其代谢活性,有利于污染物的去除[13].
相较于在其他污染物治理方面的应用,生物炭在海洋环境石油污染修复方面受到的关注较少. 在海洋环境日益恶化的背景下,具有诸多优异性能的生物炭在去除海洋石油污染方面将具有广泛的发展空间. 因此,本文将针对生物炭在治理海洋石油污染方面的研究进行综述,详细介绍生物炭的制备过程及影响因素、生物炭的改性或功能化方法以及在海洋溢油治理中的各种应用. 本文将有利于提高人们对生物炭在海洋溢油修复领域的认知和了解.
-
生物炭,英文名为“Biochar”,Bio- 意思是“生物的”,与英文单字“char”共同组成biochar. 一般来说,生物炭是在缺氧或无氧条件下热解生物质而得到的富含碳的多孔固体[14]. 而有些学者认为生物炭是在缺氧条件下热处理生物质后留下的一种稳定的、富含碳的多孔产品[15]. 两种定义的区别是对于制备过程描述的差异,前者强调的是热解,而后者则是热处理. 例如,有学者认为水热法作为热处理的一种方式,在对生物质进行水热处理之后,得到的生物炭称为“水热炭”(Hydrochar)[16]. 生物炭的概念上存在一定的争议,广义上来说生物炭是热处理生物质得到的,狭义上的生物炭指的是热解后的固体产物. 上述的两种定义都是从制备原料和制备方法进行的总结或概括,而有些学者在此定义基础上补充了制备温度的范围,进一步细化了生物炭的概念范围. 例如,300 ℃以下烘焙得到的固态产物碳含量较低,其颜色往往也未黑化,不是富碳材料,故不可称为“生物炭”[16]. 但目前仍有研究者称此类物质为生物炭. 此外,盛奎川等[17]对生物炭概念进行解释和辨析时认为还应该从生物炭的用途方面思考,其应用应该是绿色且有利于环境的;例如,传统的木炭、竹炭等用作能源的燃料炭不应归入生物炭范畴.
从上述的讨论可以看出,目前学者们对于生物炭的概念存在一定的争议,目前的定义也只是相对准确的总结性概念,并不能完全精确地说明什么是生物炭. 笔者认为在对于生物炭范围的划分上,除了基础的制备原料、制备方式、制备温度以及应用范围等方面,还应该更多地从生物炭本身的性质上进行规定,例如:含水率、含碳量、结构特点等. 这样一个包含全过程的概念才是准确的.
-
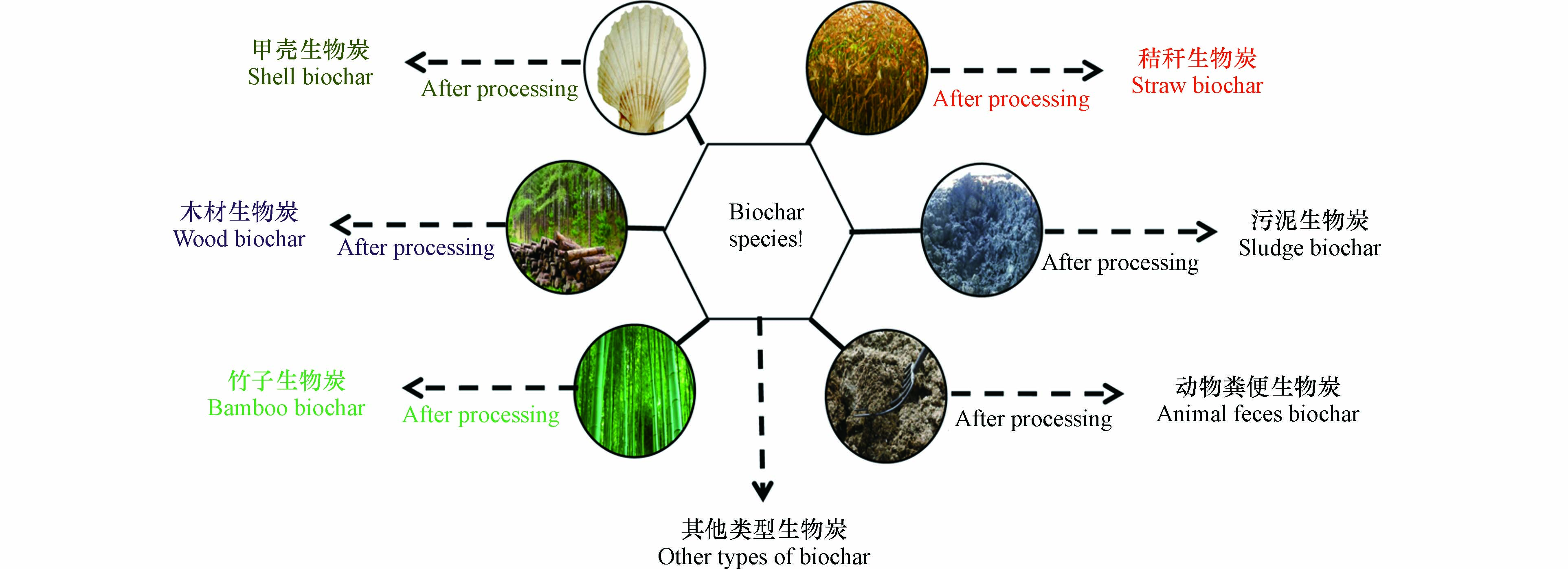
生物炭的定义中准确地描述了其来源是生物质. 适用于制备生物炭的生物质主要包括:农林业废弃物、固体废物、动物粪便及遗体、活性污泥及海洋甲壳类躯体等(图2). 不同原料制备出的生物炭理化性质会存在某些差异. 含有较多高挥发性含量的原料会导致较低的生物炭产量. 相同热解条件下,玉米秸秆、稻壳等原料的纤维素和半纤维素含量高,木质素含量低,其生物炭产量相应的就低;与之相反的类似于竹子、木材等原料木质素含变量高,其生物炭产量较高. 此外,原料中元素比例的不同,导致最终的生物炭中的元素比例较大差异;例如秸秆生物炭中的钾含量(961 mg·kg−1)高于木材生物炭(394 mg·kg−1)[18].
-
随着生物炭的不断应用,各种热化学方法被开发用来制备生物炭,主要包含热解、气化、水热炭化等. 热解是在300—900℃的进行的,需要缺氧或无氧环境,其主要目标产物就是生物炭. 气化是通过气化剂(一般为空气、氧气、蒸汽等)进行部分氧化原料. 相较于热解处理,气化往往需要更高的温度,其目标产物主要是气体产物,得到的固体产物相对较少[20]. 水热炭化则是将原料与水在反应器内混合,然后升高温度和压力,其温度往往高于250 ℃,得到的水热炭具有更多的表面含氧官能团及营养物质[21].
由于学者们对生物炭定义具有不同的阐述,进而对生物炭的制备方法也产生了不同的见解. 部分学者认为生物炭的制备工艺是热解,而气化和水热处理得到的碳材料不符合生物炭定义[22]. 实际上,气化或者水热处理其根本都是利用高温热分解原料的组分,其外部环境虽能改变生物炭的部分理化性质但并不能对其结构起决定性作用. 因此,笔者认为气化炭和水热炭同样属于生物炭的范畴.
在众多方法中,热解是最普遍应用的的生物炭制备技术. 在生物炭热解过程中,会产生固、液、气的3种产物,分别对应着生物炭、生物油以及合成气. 生物炭顾名思义就是以碳元素为主体,富含氮磷氧等其他元素的黑色固体;生物油是此过程的副产品,主要是水、羧酸、酚类、醇类、酮类、酯类等的混合物[23],可用于土壤改良,促进植物的生长[24];合成气主要是CO、CO2、CH4和H2组成的混合气体. 热解一般包括快速热解和慢速热解. 快速热解是在温度达到预定值后将原料加入反应器,短暂停留数秒;慢速热解是在开始升温时就将原料置于反应器中,整个过程往往持续数个小时. 快速热解相较于慢速热解而言,通常液体产物生物油较多,而气体和生物炭产量较低[25-26]. 此外,微波热解成为了制备生物炭的新技术,不同于传统热解的热量传递方式,微波穿透生物质表面在其内部转化为热能[27].
-
慢速热解工艺具有生物炭产量高、设备要求低、易操作等特点,是生物炭制备最常用的方法. 在制备过程中,生物炭性质主要受原料、升温速率、热解温度以及热解时间影响,特别是原料和热解温度影响最为显著.
生物炭的原料来源广泛,各类生物质间差异较大,不同原料具有不同的元素及组成特点,从而生产出的生物炭性质各不相同. 相较于植物衍生的生物炭,动物粪便制备的生物炭具有更多的氮磷营养元素、更高的金属吸附能力,可用于土壤增肥和改良修复[28-29]. 总之,不同原料制成的生物炭具有不同的表面积、孔隙率和有机官能团等特性.
升温速率一定程度上决定着生物炭的产量,较高的升温速率下热解会产生大量的液体和气体,减小生物炭的产量. 热解温度则影响生物质热解时内部组分的挥发。低温下轻挥发物易挥发,而分子量较大、较复杂的组分难以热解挥发. 较高的热解温度会增加生物炭的表面积、碳化程度以及芳香性[30],但伴随而来的是较低的生物炭产量. 生物质的热解过程主要分为3个阶段. 第一阶段是内部水分和轻挥发物的蒸发,温度一般低于200 ℃;第二阶段是半纤维素和纤维素等聚合物的分解和挥发,温度主要在200—500 ℃;第三阶段是在高温下(500 ℃以上)木质素等较复杂的有机物缓慢分解挥发[31]. 以植物生物质为例,在较低温度下获得的具有较低芳香性的生物炭主要由木质素和纤维素组成,而在较高温度下获得的生物炭是一种极性较低的富含芳香族化合物的材料[32]. 此外,高热解温度会增加生物炭中钙、磷元素含量、pH以及C/O比,并致使其逐渐石墨化. 但对于主要以轻挥发物为主的原料,较高的热解温度会破坏生物炭的孔隙结构,导致生物炭的大孔结构坍塌. 低温下,较长的停留时间是生物炭产量的保障. 停留时间对生物炭的孔隙率及表面积影响较大,但其具体的影响主要取决于原料和热解温度.
-
将大量的废弃生物质或固体废弃物转化为生物炭是实现碳封存的一项重要措施. 同时,生物炭具有孔隙结构发达、比表面积高、表面官能团丰富等特点,被广泛应用于环境修复研究中. 海洋石油污染是人类开发和利用海洋过程中不可避免的一个重要环境问题,而石油烃长期存在于海洋环境中会对海洋生态系统造成严重影响. 由于生物炭的多功能性和环境友好性,逐渐被开发利用于海洋石油烃污染的修复研究中.
-
吸附是溢油应急处理中有效的措施之一. 生物炭具有较强的吸附能力、良好的疏水性以及安全性. 生物炭作为吸附剂处理溢油逐渐被开发. 此外,生物炭在吸附溢油后形成“油炭”,可直接进行燃烧产生热量. 生物炭的孔结构、表面疏水性决定了其在水面溢油吸附中的优异性能. 生物炭发达的孔隙结构增加了其孔隙体积,为石油吸附提供了更多的吸附位点[12],一般来说大孔存在能够增加生物炭的吸油能力[33]. 生物质中的组分在经过热分解挥发后留了下大量的孔道。适宜的热解温度会产生较多的大孔结构,而过高的温度则会破坏大孔结构,从而产生较多的中孔和微孔,导致油吸附量的下降[34].
生物炭用于吸附溢油时,适宜的热解温度往往因原料的不同而不同. 一般来说农业秸秆需要较低的热解温度. 研究表明相比于550 ℃,450 ℃下制备的稻壳生物炭表现出了更高的油吸附量(3.23 g·g−1),而同样在450 ℃下制备的锯末生物炭表现出最低的吸附量(2.40 g·g−1)[35]. 张明远[36]以玉米秸秆、松木屑、玉米芯和水稻秸秆为原料,控制不同的热解温度和热解时间,得到了64种不同的生物炭. 在进行石油吸附实验后发现,热解温度和原料类型对生物炭的吸油性能影响较大,热解时间对其影响较小,其中在400 ℃下制备的玉米秸秆生物炭吸附量最大. Gheriany等[37]通过在不同温度(300—500 ℃)下将干橙皮废料转化为生物炭,并作为吸附剂进行油吸附研究,结果表明500 ℃下制备的生物炭对风化原油吸附容量为4.7 g·g−1.
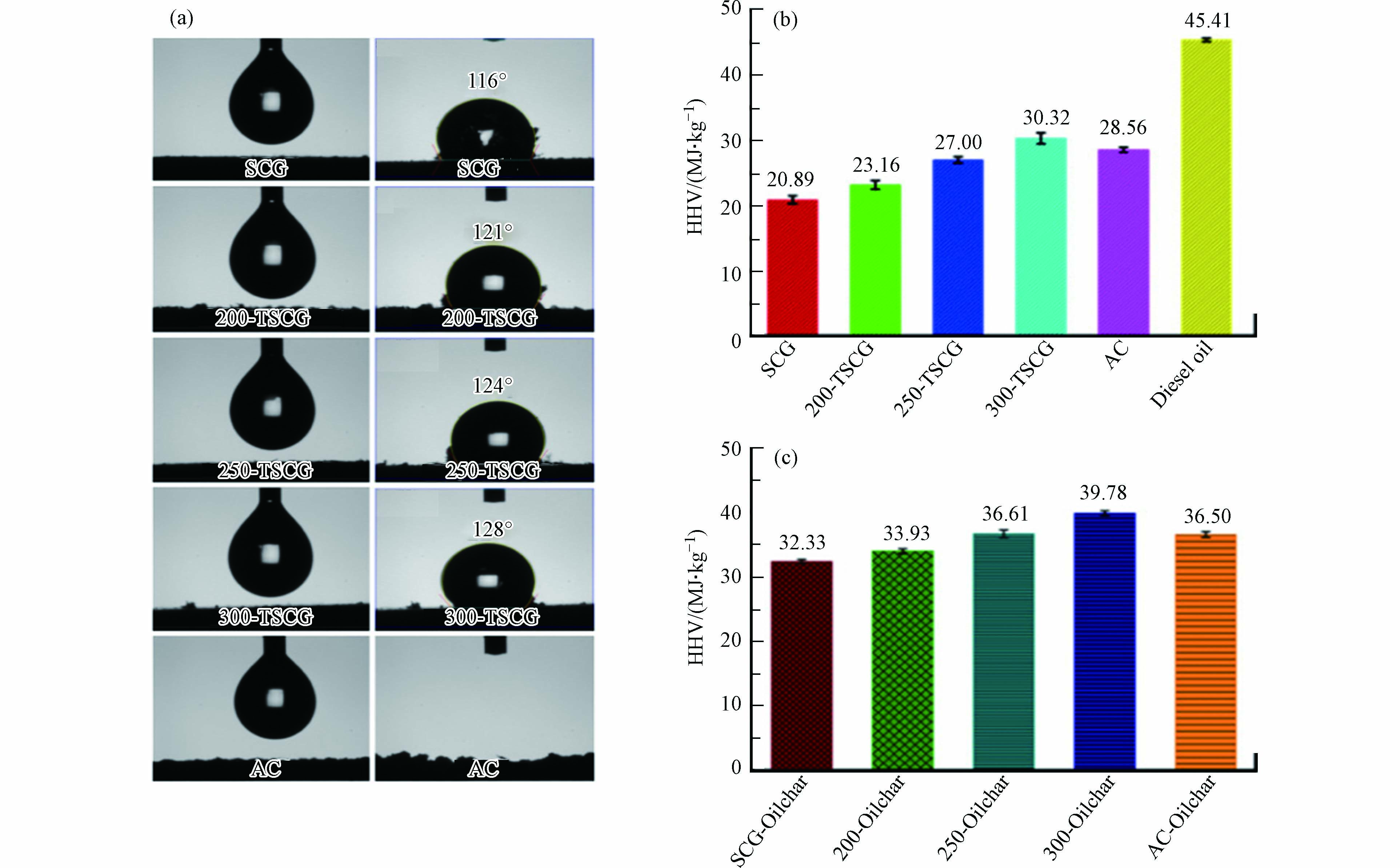
疏水性作为生物炭吸油能力的另一个决定性因素,一般随着热解温度的增高而增强. 较强的疏水性能够保证生物炭在油水环境中高效地吸附石油,从而保证其吸油效率. 废弃咖啡渣(Spent coffee grounds,SCG)在经过不同的温度热解后得到的废咖啡渣生物炭(Torrefied spent coffee grounds,TSCG),其比表面积、疏水性、柴油吸附能力随烧制温度的升高而增加. 300-TSCG对柴油的吸附能力是商业活性炭(AC)的1.36倍,在吸附柴油后的油炭热值是活性炭油炭的1.23倍[38](图3). 泥炭由植物聚合物(如纤维素)和分解的植物材料(如腐植酸)组成,将其热解转化为泥炭生物炭后,同样也表现出了较强的疏水性、更多的空腔以及更大的原油吸附量[39].
除了常见的植物生物质外,海洋生物的躯壳也被用来制备生物炭作为溢油吸附剂. 赵莹莹[40]以虾壳、蟹壳及蛤蜊壳为原料制备出36种生物炭. 经过比较发现热解温度通过影响生物炭的比表面积、芳香性和疏水性而决定着生物炭的吸油性能. 热解温度和原料对生物炭油吸附量的影响本质上是影响了生物炭内部的孔隙结构及疏水性.
原始生物炭用于溢油吸附时,自身的局限性阻碍了其进一步的应用. 因此,为了调节生物炭的性质,多种方法被用来改性生物炭. 酸改性能够改变生物炭的疏水性,增加生物炭表面官能团的数量,增加比表面积,从而提供良好的疏水吸附点位[41]. 孟蒙蒙等[42]采用盐酸对松木屑生物炭进行改性,在5 mol·L−1的浓度下获得的生物炭对海水中的石油吸附量最大. 原始的生物炭在吸附油后,其分离回收是需要面对的难题. 针对此情况,磁改性生物炭得到研究,以解决复杂环境下分离回收的问题,提高应急处理效率. 高温制备得到的磁性裙带菜生物炭在经过KOH活化后具有丰富的孔隙结构和较大的比表面积,投加量为0.1 g时对柴油的吸附量最高,且在5次循环实验后吸附量依旧保持较高吸附量,具有良好的循环稳定性和可重复使用性[43]. 类似地,赵莹莹[40]将虾壳生物炭(450 ℃)与Fe2+和Fe3+溶液混合后制备得到负载Fe3O4的磁性虾壳生物炭(MSS450),经5个循环周期MSS450对石油的吸附率仅下降10%左右,具有一定的循环利用性.
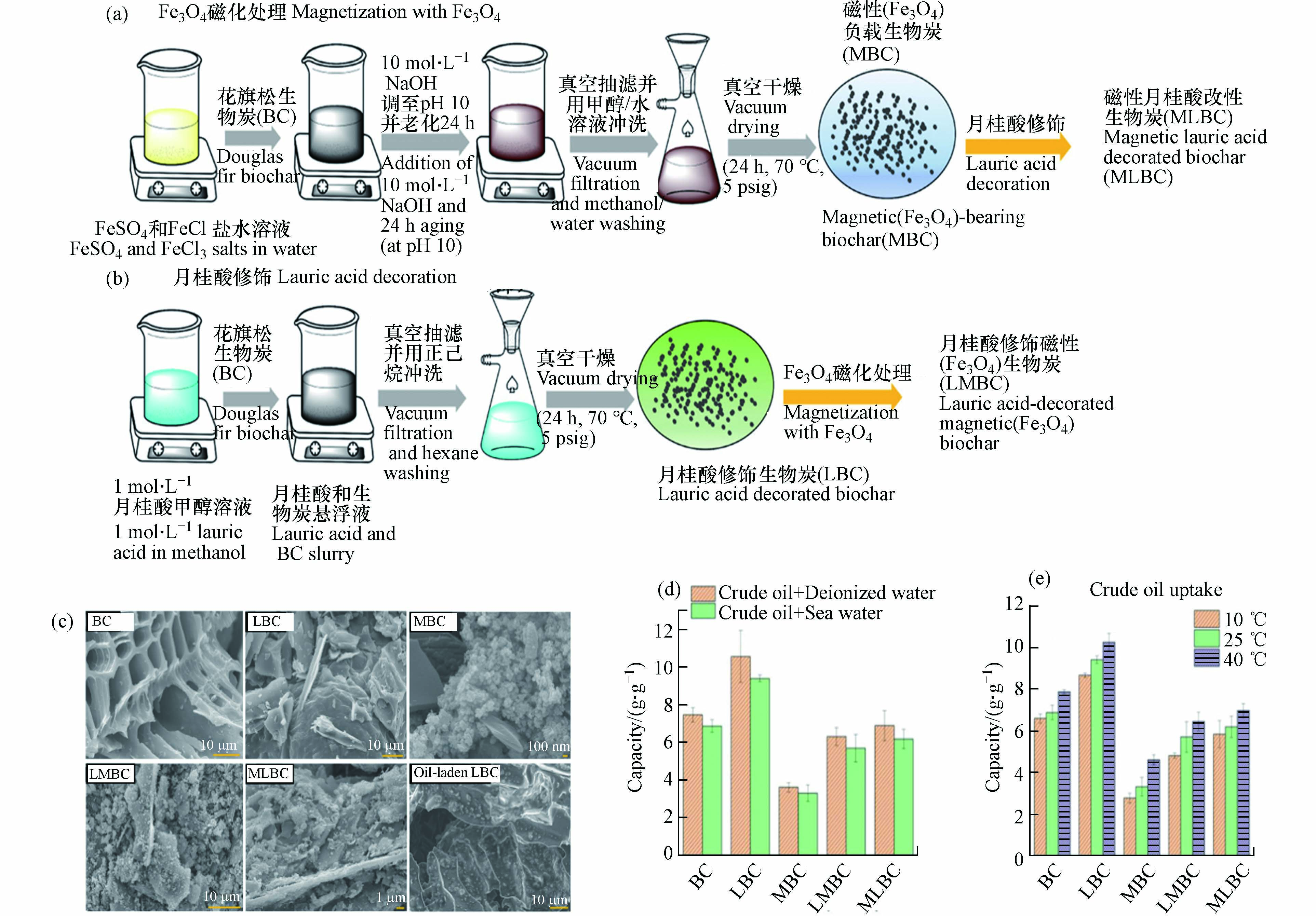
生物炭在水环境中吸附溢油时,自身一定的亲水性会导致下沉现象的出现,尤其是在海洋动力条件的干扰. 亲水性会导致生物炭与油类之间的疏水作用力减弱,生物炭对水的吸附量增加,油的空间吸附点位减少,从而减小油类的吸附量. 因此,生物炭的疏水化处理能够增强在水环境中对石油的吸附. Gurav等[44]在300 ℃、500 ℃、700 ℃下以松木木屑为原料烧制了生物炭,随着热解温度从350 ℃增加到700 ℃,形成了由大孔(5—20 μm)组成的多孔结构. 采用天然椰子油对高温(700 ℃)制备的松木生物炭进行改性,高温生物炭与椰子油中的脂肪酸的高结合率使其具有优异的疏水性(水接触角133.5°),并且可在60 min内实现对原油5.315 g·g−1的吸附量. Navarathna等[45]在900 ℃下采用快速热解制备了松木生物炭,并进行了改性形成了5种不同的生物炭:原始生物炭(BC)、月桂酸改性生物炭(LBC)、磁性氧化铁生物炭(MBC)、磁性月桂酸生物炭(LMBC)以及月桂酸磁性生物炭(MLBC). 经过月桂酸改性后的生物炭,疏水性均得到了提高. 4种改性后生物炭在海水环境中对原油的吸附量分别为9.4、3.31、5.70、6.18 g·g−1(图4).
除颗粒状的生物炭外,三维生物炭基气凝胶因其低密度、高比表面积、孔结构发达等特点也受到了广泛的关注. Yang等[46]使用一次性竹筷通过简单的水热碳化工艺制备多功能碳纤维(MCF)气凝胶,除了超轻和优异的热稳定性外,MCF气凝胶还表现出出色的疏水性,气凝胶与水之间的接触角为(145±2)°. MCF气凝胶对油类和有机液体具有中等吸附能力. 类似地,通过热解由木棉纤维(KFs)组成的气凝胶来制造生物炭基气凝胶(图5). 与常用的冷冻干燥方法不同,将抽滤后的纤维素直接通过在烘箱中干燥形成KF气凝胶,然后在N2氛围下1000 ℃热解得到生物炭气凝胶. 该生物炭基气凝胶展现出疏水/超亲油性,水接触角达到142°,并对各类有机溶剂具有良好的吸附效果[47].
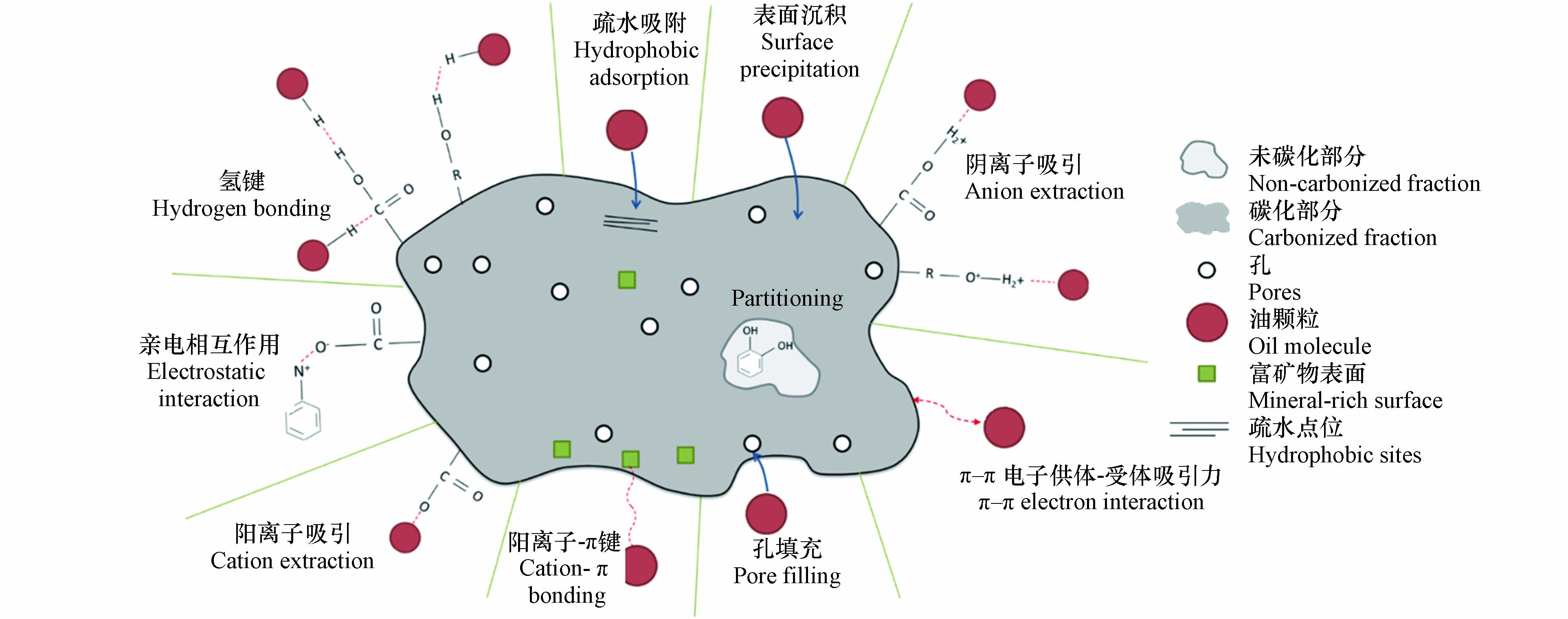
经过热解后形成的生物炭对油类及有机溶剂类展现出了较强的吸附能力,这主要和生物炭的多孔性及疏水性有关系. 疏水改性后,在水环境中保证了生物炭水面溢油的吸附效果. 经过一系列的前处理后,通过热解将生物质转变为生物炭气凝胶,重量轻、比表面积大、孔隙率高的特性能够保证生物炭气凝胶能够吸附高于自身重量数十倍乃至数百倍质量的油类(表1). 另外,对于生物炭、改性生物炭及衍生气凝胶等材料对油类的吸附能力,其吸附量和油品类型黏度和密度有关系. 综合来看,生物炭基材料对油类的吸附机理主要是孔隙填充、疏水作用力、静电吸附力、氢键作用力及π-π电子作用力等(图6). 孔隙填充和疏水作用力是其中最主要的两种机制,表面较强的疏水亲油性提高了表面对油类的吸附作用,保证了油分子被生物炭材料不断地吸收、扩散到内部孔孔隙中. 一般来说,较高的热解温度能够导致更高的孔隙率,提高生物炭材料的吸附效率,这也是高温下制备的生物炭具有较高吸附量的原因[48]. 如果油类中存在带正电的组分,会与带负电的生物炭产生静电作用,增强对油的吸附能力[49]. 氢键是在油的极性组分(尤其是树脂和沥青质)和生物炭的—COOH、—OH等含氧官能团之间形成的[50]. 此外,在较高温度下制备出的生物炭材料会含有富电子石墨烯层与油中的缺电子成分形成π-π电子作用力[51].
-
海洋环境被污染后,污染物在经过一系列的物理化学及生物作用后最终会汇集在沉积物中,石油烃污染也不例外. 海洋沉积物会成为石油污染的源和汇,在一定的海洋环境条件下,石油烃会再次释放. 多环芳烃是在沉积物中存在较多的一种石油烃污染物,具有环境持久性和致癌性,长时间的积累会对生态环境造成严重影响. 原位封盖是一种经济可行的污染沉积物修复技术,可有效隔离污染物,减少它们的最大通量,从而延迟它们向开阔水域的释放[60]. Silvani等[61]研究了将生物炭作为封盖材料对溢油沉积物的封盖效果,并将其性能与活性炭和有机粘土进行了比较(图7). 结果表明,生物炭显示出比活性炭和有机粘土更高的封盖效率. 1个月后,活性炭、有机黏土和生物炭盖层材料中的孔隙水中蒽浓度分别降低了69%、56%和99%.
生物炭具有较大的比表面积和丰富的官能团,对各类有机污染物具有较高的吸附潜力[62]. Jia等[63]在联合植物和生物炭修复红树林沉积物中多环芳烃污染时发现,生物炭的应用显着增加了沉积物中多环芳烃的吸附且与热解温度之间存在显著相关性,降低了植物组织中PAHs的生物利用度. 此外,研究人员还指出:在沉积物中,生物炭可以通过氧化还原反应加速有机底物的还原[64],它可以作为生物地球化学和污染物氧化还原反应的催化剂[65]. Gomez-Eyles等[66]在用松木生物炭作为改良剂评估在降低多环芳烃和多氯联苯污染的沉积物中的生物利用度有效性时,发现其大大降低了沉积物中多氯联苯和多氯环芳烃孔隙水浓度(>95%)和生物累积量(>93%).
-
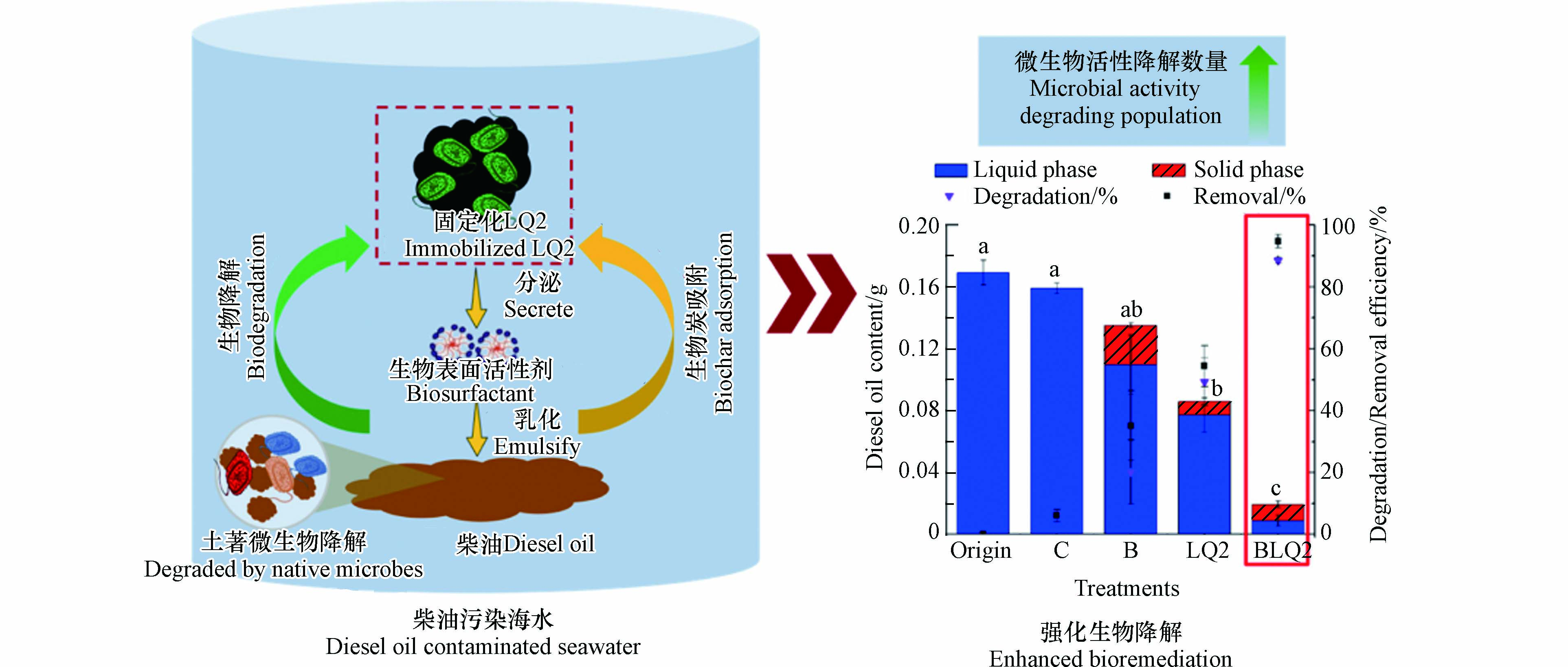
生物炭多孔的结构、富含各类营养元素、具有环境友好性,因此被用于固定石油烃降解菌修复环境中的石油烃污染. 生物炭能够对固定的石油烃降解菌起到保护作用,提供微生物生长所必须的营养元素,提高微生物对环境的耐受性,提供一定的生态位. Zhang等[67]将耐盐石油烃降解菌Corynebacterium variabile HRJ4固定于生物炭上用于石油烃降解,7 d后对总石油烃达到了78.9%的降解效果. 类似地,Chen等[68]将Acinetobacter venetianus固定于竹炭上,并进行了柴油降解实验. 在为期3 d的时间内,与游离培养降解实验(82%)相比,固定在竹炭上的菌在降解柴油方面表现出更高的效率(94%). 扫描电子显微镜(SEM)显示,通过吸附作用菌体很好地附着在竹炭的空腔中. Zhou等[69]从海洋冷泉区分离出一种产生生物表面活性剂的石油烃降解菌Vibrio sp(LQ2). 生物炭固定LQ2后,通过吸附和生物降解在7 d内去除柴油的效率达到94.7%,远高于游离细胞培养的降解率(54.4%)(图8). 此外,随着固定化LQ2的加入,微生物的生长和活性大大增强,与游离细胞处理相比,固定化LQ2中的降解相关基因alkB和CYP450-1分别高出3.8倍和15.2倍.
-
本文综述了生物炭材料在海洋石油污染处理修复中的研究进展. 首先对生物炭的定义和原料来源进行了讨论,重点阐述了目前关于生物炭定义存在的争议,并在文中提出了笔者的观点. 其次,针对目前生物炭的主要制备工艺进行了总结,主要分为热解、气化以及水热炭化,并讨论了各自的优缺点. 随后概述了生物炭制备过程中的主要影响因素,主要包含原料类型、升温速率、热解温度和热解时间,其中最为关键的是原料类型和热解温度,并对上述因素如何影响生物炭性质进行了讨论. 最后本文重点回顾了基于生物炭材料在海洋石油污染修复中的应用. 其中,包括生物炭材料对溢油的吸附、生物炭对石油污染沉积物中烃类的封存和修复以及生物炭固定微生物降解石油烃污染物. 当前,生物炭在海洋石油污染修复领域的研究及应用逐渐增多,但在制备和应用的过程中还应重点关注以下几点:
(1) 生物炭材料在海洋溢油中的大规模实际应用试验需要研究开展,这对其未来的研究和发展至关重要.
(2) 生物炭材料的改性方法应进一步优化,减少过程中化学药剂的使用,或多采用环境友好型试剂.
(3) 进一步明确生物炭制备过程对于石油烃吸附性能的影响和机质.
(4) 生物炭热解过程中会产生一些有害物质,因此其在水环境中的安全性评估有待研究.
(5) 在海洋环境中使用生物炭修复石油烃时,有意或无意地会导致生物炭进入水体和沉积物中,而生物炭对石油烃污染海洋环境的生态效应以及在沉积物的固碳作用有待评价和研究.
(6) 生物炭作为固定化材料时除起到载体作用外,自身含有的丰富的营养元素可以促进微生物的生长. 因此,可进一步开发生物炭作为微生物营养肥料的潜力.
生物炭材料在海洋石油类污染修复中的应用研究进展
Research progress on the application of biochar materials in the remediation of marine petroleum pollution
-
摘要: 时有发生的溢油事故以及沿海陆源输入性的石油污染会对海洋生态系统造成短期或长期的危害. 生物炭是一种原料来源广、低成本、环境友好的富含碳的材料,是解决全球废弃物碳足迹问题的重要措施. 近年来,基于生物炭的海洋石油烃修复材料被广泛关注. 因此,本文将详细介绍生物炭的制备及生物炭材料在海洋石油烃修复中的应用. 生物炭的制备过程中,其理化性质主要受原料类型、热解速率、热解温度和热解时间的影响. 生物炭的高孔隙率和丰富的表面官能团,使其具有溢油吸附的巨大潜力. 为提高溢油吸附效率,酸改性、磁改性和疏水改性等方法常用来改善生物炭的性质. 此外,生物炭基气凝胶因其独特的吸附性能,也得到了广泛的研究和关注. 除在水环境适用外,利用生物炭还可对沉积物中的石油烃进行封存和修复,以减少其扩散和生物利用度. 多孔、富含营养元素的特点使生物炭可以作为固定化材料来固定石油烃降解菌,以减少海洋环境条件对微生物的冲击,保证菌剂的降解效率. 综上,生物炭具备的各种优异性质使其在海洋石油污染修复中具有广阔的应用前景. 因此,生物炭实际应用的不足及自身存在的某些性质问题,是此后生物炭的研究重点,应当给予更多的关注.Abstract: Oil spills and the pollution of petroleum hydrocarbons from coastal land sources can cause short-term or long-term damage to marine ecosystems. Biochar is a carbon-rich material with a wide source of raw materials, low cost, and environmental friendliness. And it is an important measure to solve the global waste carbon footprint problem. In recent years, biochar materials for the remediation of marine oil pollution have attracted extensive attention. As a result, this paper discusses in great depth how biochar is prepared and used in the remediation of marine petroleum hydrocarbon pollution. In the preparation process of biochar, its physical and chemical properties are mainly affected by the type of raw materials, pyrolysis rate, pyrolysis temperature, and pyrolysis time. The high porosity and abundant surface functional groups of biochar make it have great potential for oil spill adsorption. In order to improve the oil spill adsorption efficiency, methods such as acid modification, magnetic modification, and hydrophobic modification are commonly used to improve the properties of biochar. Furthermore, biochar-based aerogels have received extensive research and attention due to their unique adsorption properties. Except in aquatic environments, biochar can be used to cap and remediate petroleum pollution in sediments to reduce diffusion and bioavailability. Biochar is porous and nutrient-rich, which can be used as an carrier material to immobilize petroleum hydrocarbon degrading bacteria, to reduce the impact of marine environmental conditions on microorganisms and ensure the degradation efficiency of hydrocarbon. In summary, the various excellent properties of biochar make it have broad application prospects in the remediation of marine oil pollution. Therefore, the deficiencies in the practical application of biochar and some of its problems are the focus of biochar research in the future, and more attention and attention should be paid to it.
-
Key words:
- biochar /
- marine oil pollution /
- adsorption /
- sediment.
-
随着我国水处理需求及能力的大幅度提升,剩余污泥的产量也逐渐增大。据预测,2020—2025年间,剩余污泥的年产量将突破6×107 t(以含水率80%计)[1]。相比污水的处理,我国的污泥处理能力相对滞后[2]。由于污泥中含有大量的重金属和有毒有害物质[3],80%以上的污泥由于处理不当,已成为造成环境二次污染的污染源[4]。因此,污泥的妥善处理处置已成为亟需解决的环境问题之一。
剩余污泥中的有机物主要包括蛋白质和多糖[5]。其中,蛋白质含量为20%~40%,是一种有机质资源,通过污泥蛋白质回收实现其资源化,是剩余污泥处理处置的重要途径之一[6]。剩余污泥中的蛋白质主要存在于微生物细胞内,通过水解破胞技术将微生物细胞内蛋白质释放到溶液中,是污泥蛋白质回收的前提[7]。目前,水解破胞技术主要包括物理法、化学法和生物法。XIAO等[8]采用热处理溶出污泥蛋白质,可使溶液中的蛋白质浓度提高12倍。肖本益等[9]采用碱法处理活性污泥,10 g·L−1的污泥在pH 12.0的条件下,处理12 h后,溶解性蛋白质浓度增加了2 058.6 mg·L−1。章文锋等[10]采用酶法回收污泥蛋白质,发现碱性蛋白酶在pH 8、温度55 ℃、酶投加量2%、反应时间4 h及污泥液固比4∶1条件下,污泥蛋白提取率可达52.5%。ASSAWAMONGKHOLSIRI等[11]采用热酸法溶出蛋白质,在pH为1.0的条件下,预处理6 h,然后在110 ℃下加热60 min,可溶性蛋白质浓度提高了4.8倍。CHO等[12]发现,在60 ℃和pH 12的条件下处理1 h,污泥释放的蛋白质是未预处理污泥的2.4倍,而单独碱解释放的蛋白质是未预处理污泥的2.1倍。LIU等[13]用超声联合碱处理的方法溶出污泥蛋白,在18 kHz和pH 12下处理1 h,蛋白质浓度增加到7.9 g·L−1。SAHINKAYA[14]采用超声联合酸处理的方法分解污泥,在超声功率密度为1 W·mL−1、处理时间为10 min、初始污泥pH为2.0的最佳条件下,蛋白质浓度可达1 750 mg·L−1。然而,目前污泥联合水解工艺多处于实验室研究阶段,其中试及产业化效果则有待考证。
为此,本研究建立了日处理规模为1 m3剩余污泥(含水率为80%)的中试水解系统。采用酶联合热碱水解技术,优化了影响蛋白质溶出效果的关键工艺条件,包括酶解时间、酶投加量及碱解时间等;同时,进一步研究了污泥水解的动力学特性,解析了联合水解过程的限速步骤,以期为剩余污泥联合水解工艺的产业化应用提供必要的技术参数。
1. 材料与方法
1.1 实验材料
实验所用污泥取自天津某污水处理厂脱水污泥,该厂采用A2/O工艺。脱水污泥含水率为80.52%、有机物含量为51.46%、粗蛋白含量为22.47%。水解用酶制剂为通用商品酶,木瓜蛋白酶和碱性蛋白酶酶活分别为8×105 U·g−1和1×105 U·g−1、最适pH分别为6.0~7.0和8.5~10.5、最适温度分别为(50~55) ℃和(40~60) ℃。
1.2 实验装置
处理规模为1 m3(含水率为80%)的中试污泥水解装置示意图及实物图如图1所示。水解罐内外均为不锈钢,水浴加热,功率为20 kW,容积为1.5 m3,内部直径为1.1 m。螺杆泵流量为5 m3·h−1,功率为2.2 kW。调浆桶体积为1.5 m3,使用PE材质。
1.3 酶-热碱联合水解的关键工艺条件优化
先将脱水污泥分别配制成20、30、40和50 g·L−1污泥混合液,在55 ℃条件下,分别投加1%、2%和3%污泥干重的复合酶(木瓜蛋白酶:碱性蛋白酶=12:1);然后,分别酶解1、1.5、2和2.5 h;接着,分别在70、80和90 ℃条件下,投加NaOH将污泥溶液pH调至12.5,进行热碱水解,水解时间分别为0.5、1、1.5、2、2.5和3 h,研究酶-热碱联合水解条件对蛋白质溶出效果的影响。
1.4 动力学特性研究
将脱水污泥配制成10、20、30、40和50 g·L−1的污泥混合液,在55 ℃条件下,分别投加污泥干重1%、2%和3%的复合酶,研究其污泥酶解动力学特性。
将脱水污泥配制成30 g·L−1的污泥混合液,在55 ℃条件下,分别投加污泥干重1%的复合酶,酶解1.5 h后,在80 ℃并调节pH至12.5进行碱解,研究其碱解动力学特性。
1.5 分析方法
污泥粗蛋白采用凯式定氮法[15]测定;TCOD(总化学需氧量)、SCOD(溶解性化学需氧量)、
NH+4 -N(氨氮)、PO3−4 -P(磷酸盐)和TP(总磷)均采用标准方法[16]测定。污泥含水率、有机物含量及pH等均参照《城市污水处理厂污泥检测方法》中的方法[17]进行测定。溶液中蛋白质浓度采用考马斯亮蓝G-250法[18]测定。蛋白质溶出率根据式(1)计算得出。
w1=cVm×100% (1) 式中:
w1 为蛋白质溶出率;c 为上清液蛋白质浓度,mg·L−1;V 为离心后所得上清液体积,L;m 为原始污泥中蛋白质质量,mg。COD溶出率根据式(2)计算得出。
w2=CSCOD−CSCOD0CTCOD−CSCOD0×100% (2) 式中:
w2 为COD溶出率;CSCOD 为处理后上清液SCOD浓度,mg·L−1;CSCOD0 为原污泥溶液初始SCOD,mg·L−1;CTCOD 为原污泥溶液的TCOD,mg·L−1。2. 结果与讨论
2.1 污泥酶解的关键因素优化及其动力学
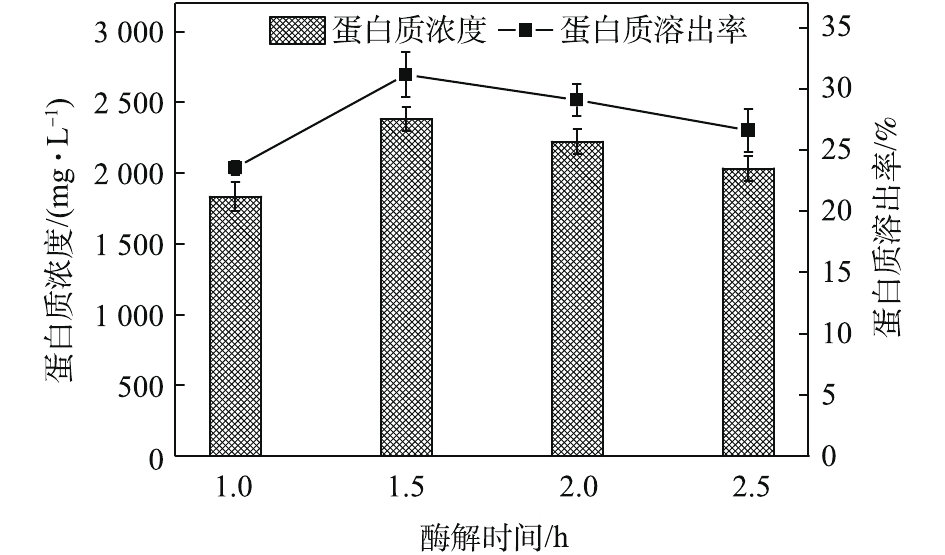
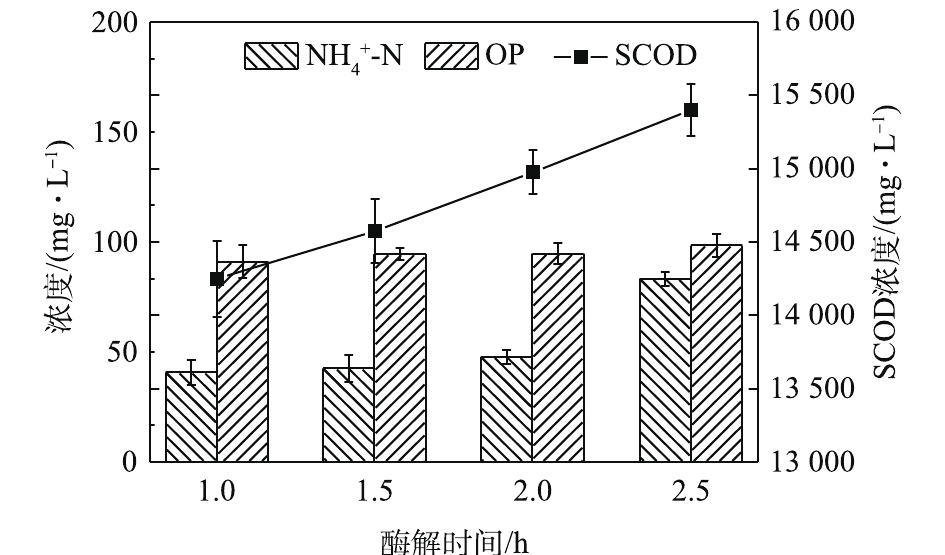
酶解时间对污泥蛋白质溶出效果的影响如图2所示,随着酶解时间的延长,蛋白质浓度和蛋白质溶出率均呈现出先增加再降低的趋势。酶解时间为1.5 h时,蛋白质浓度和蛋白质溶出率均达到最高,分别为2 381.05 mg·L−1和31.18%。酶可以破坏污泥的絮体结构[19],将细胞表面暴露出来,进一步分解微生物细胞壁[20],提高污泥的水解效果,利于蛋白质的溶出。然而,随着酶解时间的进一步提高,投加的酶会水解部分溶出的蛋白质,最终生成小分子酸、氨和CO2[21],从而导致水解液中蛋白质浓度降低,这也可以从图3中
NH+4 -N浓度的变化看出。如图3所示,NH+4 -N浓度在酶解2 h后明显上升,从47.87 mg·L−1上升到83.33 mg·L−1。这说明,过长的酶解时间会导致溶出的蛋白质分解。OP(有机磷,即总磷和磷酸盐之差)含量虽略有上升却较为接近。这说明酶解时间的延长对污泥内DNA、RNA等含有有机磷物质的溶出影响不大,即污泥破胞效果并没有随着酶解时间的延长而明显加强。这一点从SCOD的变化也能反映出来,SCOD从酶解1 h时的14 250 mg·L−1上升到酶解2.5 h时的15 400 mg·L−1,反应时间延长了1.5 h,SCOD却只增加了近1 000 mg·L−1,效果并不明显。因此,酶解时间为1.5 h时,污泥蛋白质溶出效果最佳。酶投加量对污泥蛋白质溶出效果的影响如图4所示,酶投加量为1%时,污泥水解液中蛋白质浓度为2 381.05 mg·L−1。当酶投加量由1%增加至3%时,水解液中蛋白质浓度及污泥蛋白质溶出率呈略微增加的趋势,蛋白质浓度只增加了3.8%。由图5可知,
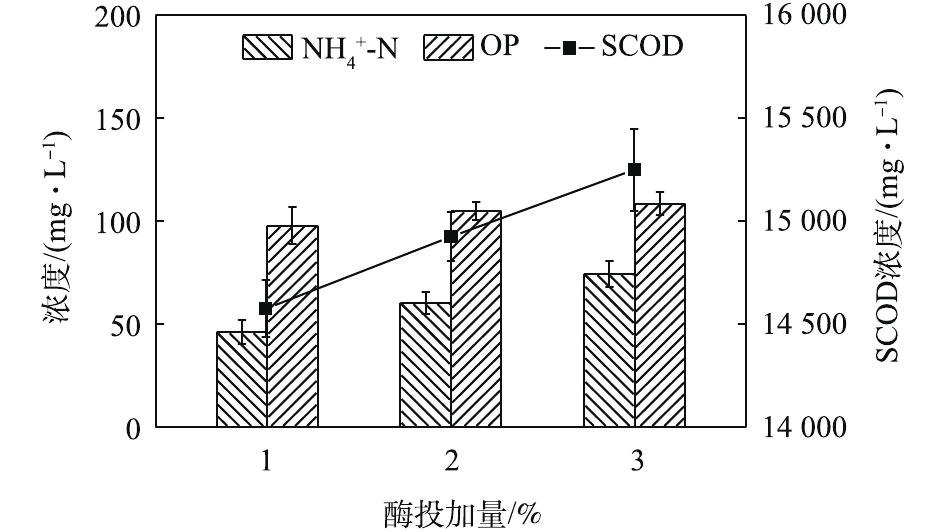
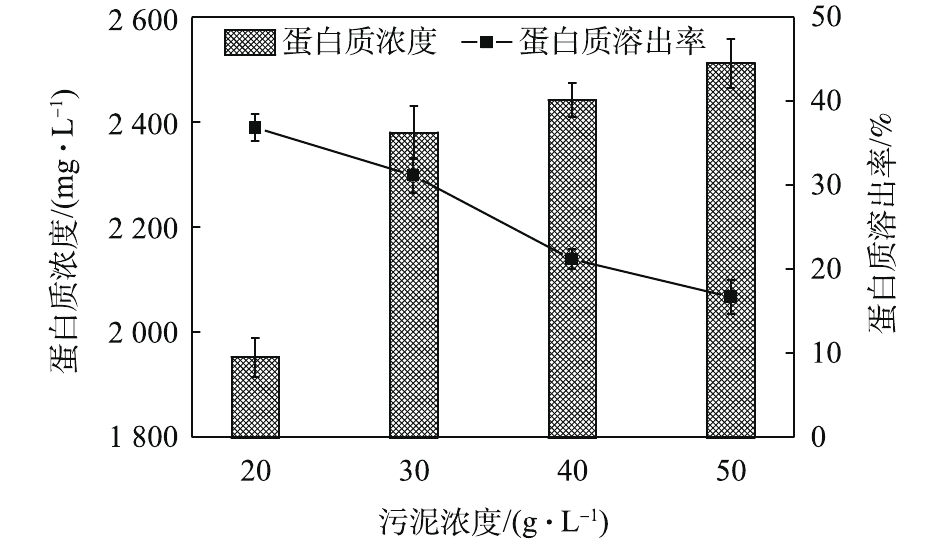
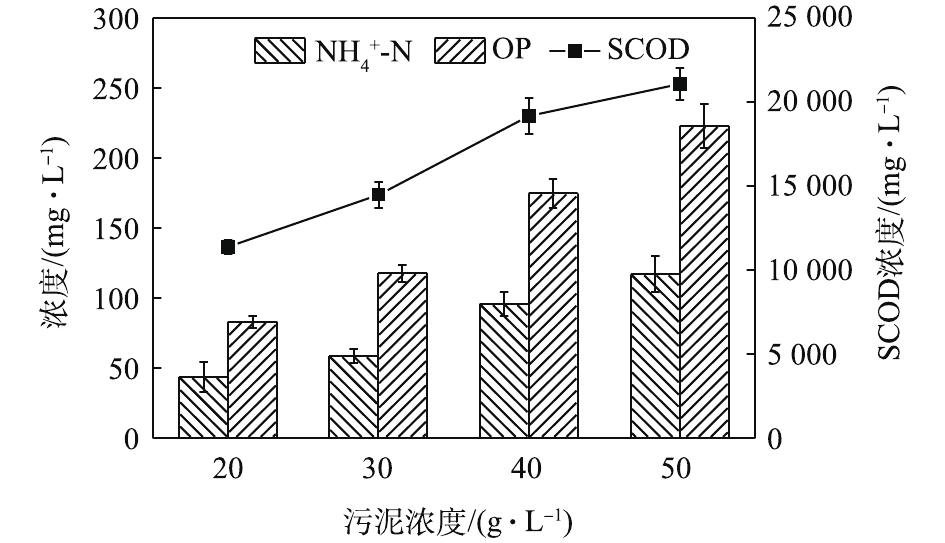
NH+4 -N浓度随着酶投加量的增加而显著的增加。酶的投加量为3%时,污泥水解液中NH+4 -N浓度为74.47 mg·L−1,相比酶投加量为1%,NH+4 -N浓度增加了62%。这可能是因为,酶量较多时,蛋白质易被降解并转化为多肽和氨基酸并进一步降解[22],这也与NH+4 -N浓度升高的结果一致。因此,酶投加量的增加对污泥蛋白质溶出效率几乎无影响,但成本却明显提高。从SCOD和OP含量变化也可发现,酶投加量的增加,对于污泥的破胞效果影响甚微。因此,综合考虑效果和成本,最佳的酶投加量为污泥干重的1%。污泥浓度对污泥蛋白质溶出率的影响如图6所示。由图6可以看出,随着污泥浓度的增加,水解液中蛋白质浓度先明显增加,后缓慢增加。当污泥浓度由20 g·L−1增加至30 g·L−1时,水解液中蛋白质浓度由1 952.47 mg·L−1增加至2 381.05 mg·L−1。然而,进一部提高污泥浓度,水解液中蛋白质浓度呈现略微增加的趋势,50 g·L−1时蛋白质浓度仅为2 512.63 mg·L−1。但是,蛋白质溶出率却随着污泥浓度的增加而降低,20 g·L−1时的蛋白质溶出率最高,达到了36.88%;其次是30 g·L−1时的31.18%,最低为50 g·L−1时的16.71%。与污泥浓度为20 g·L−1时的蛋白质浓度和溶出率相比,当污泥浓度分别为30和40·L−1时,其蛋白质浓度分别提高了21.95%和25.09%。但是,蛋白质溶出率却分别降低了15.46%和42.46%。可以发现,当污泥浓度高于30 g·L−1时,蛋白质浓度提升不明显,而且溶出率明显降低。这是因为,污泥浓度越高,底物所含的蛋白质含量更多,因此溶出的蛋白质浓度更高。但是,污泥浓度越高,碱及热量的传质越困难,可能导致污泥受热不均或不充分,水解效果越差[23],蛋白质溶出率越低。所以,综合考虑,污泥浓度为30 g·L−1时,蛋白质溶出效果最优。这也可以从图7中的SCOD含量变化得到印证,虽然污泥浓度的升高使水解液中的SCOD浓度也随之升高,但计算却发现COD溶出率随之降低;同时,污泥浓度的升高也会使溶液的传热效率降低,导致能耗更高,因此最佳污泥浓度为30 g·L−1。
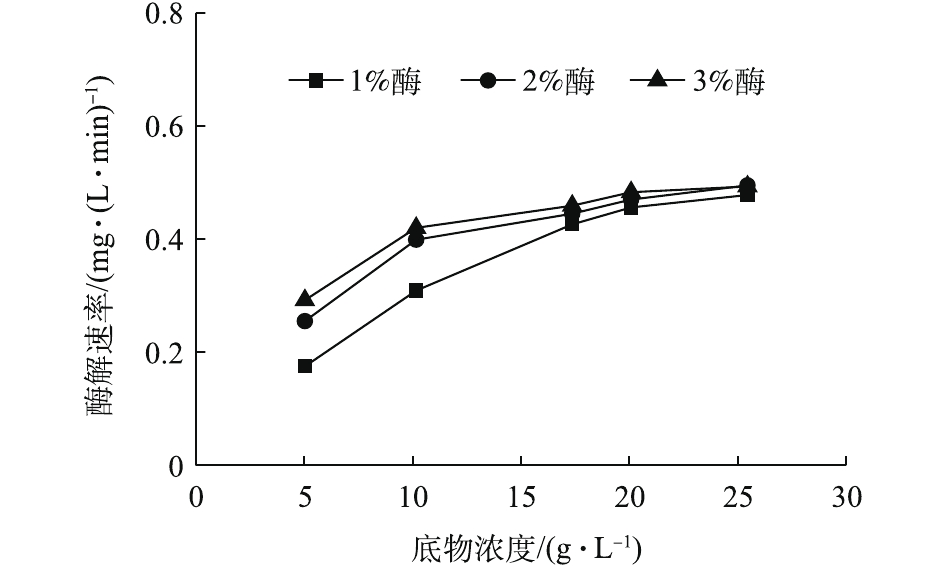
由于污泥成分复杂,而其中的无机物无法作为底物来参与酶解反应。因此,以污泥中的VSS(可挥发性悬浮物)作为底物,来研究底物浓度与酶解速率的关系。不同酶投加量条件下,各底物浓度下的酶解速率如图8所示。可以发现,酶解速率都随着底物浓度的增加先增加,再逐渐趋于稳定,在底物浓度较低时,反应速率与底物浓度几乎呈正比关系,呈一级反应;当底物浓度较高时,反应速率增加缓慢或不增加,呈零级反应。因此,底物浓度和反应速率的曲线,符合经典的米氏方程[24],故可用米氏方程对实验数据作进一步拟合。同时发现,酶投加量的增加,在底物浓度较低时,可以提高反应速率。然而,当底物浓度大于17.37 g·L−1,即污泥浓度高于30 g·L−1时,酶投加量的增加对反应速率并无明显影响,从这一点也可以说明1%的酶投加量为最佳酶投加量。
Michaelis-Menten假定了酶与底物的酶促反应分2步[25]进行。
E+SK1,K−1↔E−SK2,K−2↔E+P (3) 式中:
K1 、K−1 、K2 和K−2 分别为各向反应的速度常数;E 表示酶;S 表示底物;E-S表示酶-底物络合物,即中间产物;P 表示最终产物。酶(
E )与底物(S )结合生成中间产物(E-S),在中间产物分解成产物(P )的同时,E 重新游离出来。在反应初期,P 浓度极低,不足以引起可逆反应,故K−2 可忽略不计。因此,第2步反应是单向的,即可推出酶解动力学方程为式(4)。v=K−1CE0CSK−1+K2K1+CS (4) 式中:
v 为酶解速率;CS 为底物质量浓度;CE0=CE+CE−S ,CE−S 为中间产物浓度。令
Km=(K−1+K2)/K1 ,vmax=K−1CE0 ,则方程可以简化为式(5)。方程(5)即为复合酶水解污泥的米氏方程。v=vmaxCSKm+CS (5) 由方程(5)可以得出式(6)。
1v=Km+CSvmaxCS=1vmax+KmvmaxCS (6) 式中:
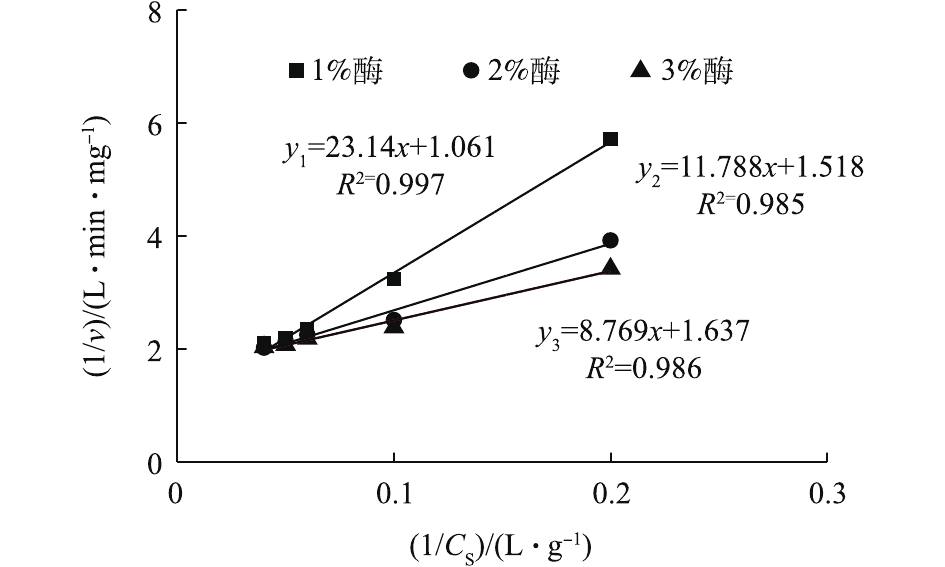
Km/vmax 为直线斜率;1/vmax 为截距。采用Lineweaver-Burk(双倒数作图法)[26]求解动力学模型参数,对Lineweaver-Burk图数据进行拟合,如图9所示。结果表明,动力学方程拟合效果较好,如表1所示。可见,随着酶投加量的增加,
vmax 和Km 值都呈降低趋势。其原因可能是酶浓度的升高增强了底物竞争,这反而不利于污泥的水解。因此,1%的酶投加量为最佳,这也与前面的结果一致。当酶投加量为1%时,vmax 为0.709 mg·(L·min)−1,Km 为13.13 mg·L−1。表 1 参数及动力学方程Table 1. Parameters and dynamic equations酶投加量/%  /(mg·L-1)
/(mg·L-1) /(mg·(L·min)-1)
/(mg·(L·min)-1)R2 显著性(α<0.05) 反应动力学方程 1 13.13 0.709 0.997 0.001 
2 7.77 0.659 0.985 0.001 
3 5.36 0.611 0.986 0.001 
2.2 污泥碱解的关键因素优化及其动力学
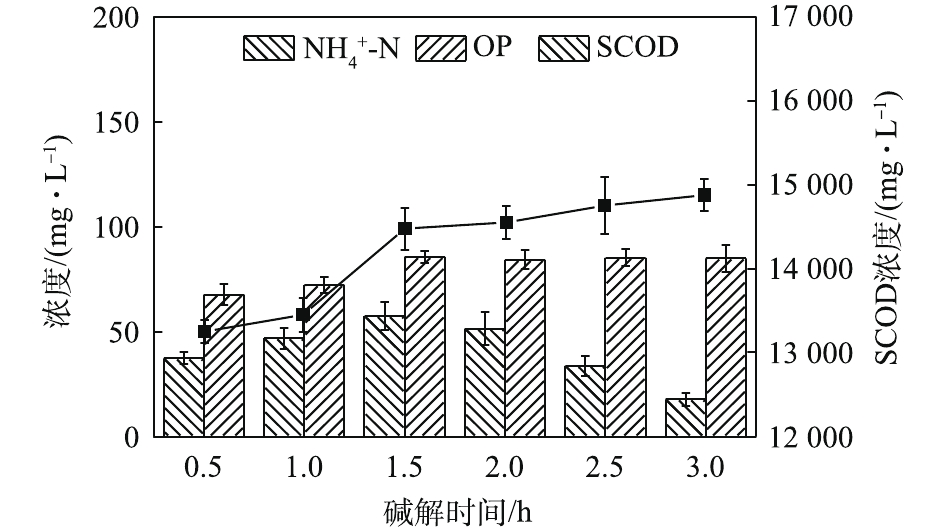
在酶解时间1.5 h、酶投加量1%和污泥浓度30 g·L−1的最佳条件下,继续进行污泥的热碱水解。图10给出了碱解时间对污泥蛋白质溶出效率的影响。由图10可知,碱解时间为1.5 h时,水解液中的蛋白质浓度最高,达2 149.47 mg·L−1,28.15%的蛋白质溶出率也为最高。过短或过长的碱解时间均导致污泥中蛋白质溶出效率降低。这是因为,碱能使膜脂皂化和微生物细胞损伤,破坏细胞结构[27],有效地释放胞内蛋白质;但是,在碱性条件下,蛋白质易发生水解[28],当碱解时间过长时,蛋白质水解速率超过其溶出速率,降低了水解液中蛋白质浓度,影响了整个污泥水解过程中蛋白质溶出效率。期间,SCOD和
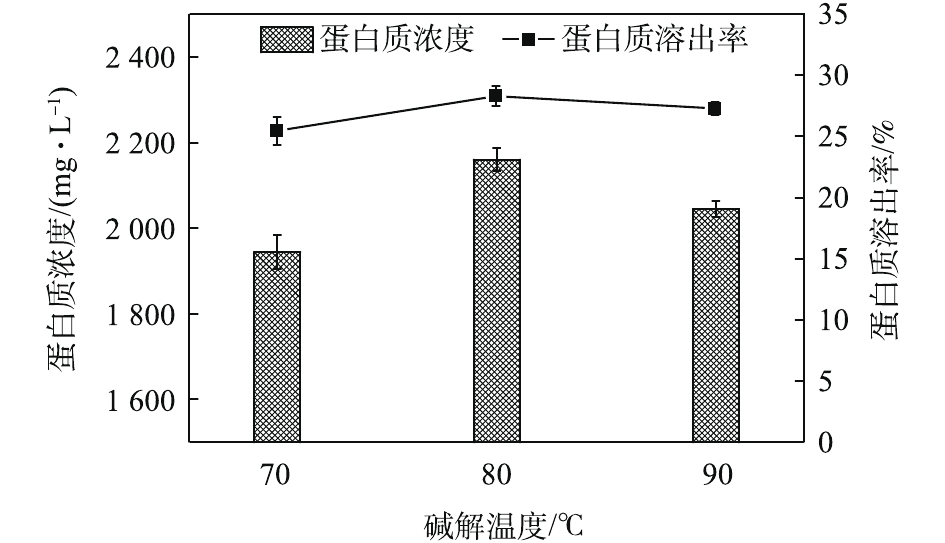
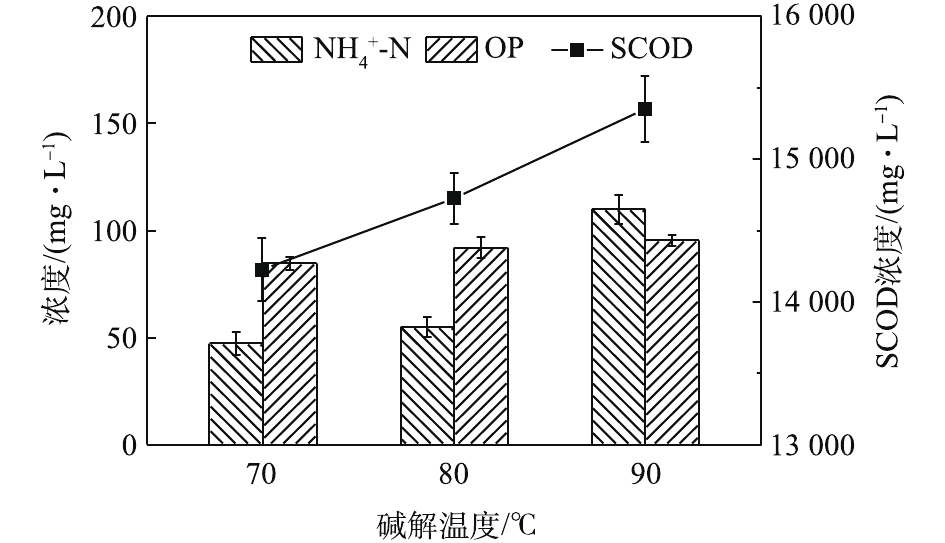
NH+4 -N及OP的浓度变化如图11所示。可见,随着碱解时间的延长,SCOD浓度先快速增加后缓慢增加。这是因为,更长的碱解时间导致更多的物质溶解溶入液相,提高了SCOD含量,而OP含量随着碱解时间的延长先增加后趋于稳定。NH+4 -N含量的变化趋势则有所不同,呈先增加后逐渐降低的趋势。其可能的原因是,在碱性条件下,NH+4 -N更容易与OH−结合呈NH3·H2O状态并从液相中挥发出来,造成NH+4 -N浓度的降低。这一点与BI等[29]的研究发现一致。因此,最佳碱解时间为1.5 h。如图12所示,不同碱解温度条件下,污泥水解液的蛋白质浓度及蛋白质回收率均随着碱解温度的升高先增加后减小,分别从70 ℃时的1 944.21 mg·L−1和25.56%上升到80 ℃时的2 160 mg·L−1和28.29%,然后下降到90 ℃时的2 044.21 mg·L−1和27.28%。蛋白质在高温强碱环境下易降解发生脱氨作用,生成氨气和不饱和羧酸盐,氨气在碱性条件下逸出[30],降低了溶解性蛋白质浓度。当酶解温度温度由70 ℃升高到80 ℃时,由于温度的升高,污泥受热分解效果更好,因而蛋白质浓度和蛋白质溶出率均有所升高。然而,当酶解温度温度由80 ℃升到90 ℃时,温度的升高及升温时间的增加导致部分蛋白质的降解或变性[31]。何玉凤[32]也发现,当温度在75~95 ℃时,蛋白质容易变性,导致蛋白质浓度和溶出率的降低。观察图13中SCOD等的变化发现,随着碱解温度的升高,SCOD浓度也呈上升趋势。这说明,有更多的有机物随着温度的升高而分解,污泥水解效果得到提高。
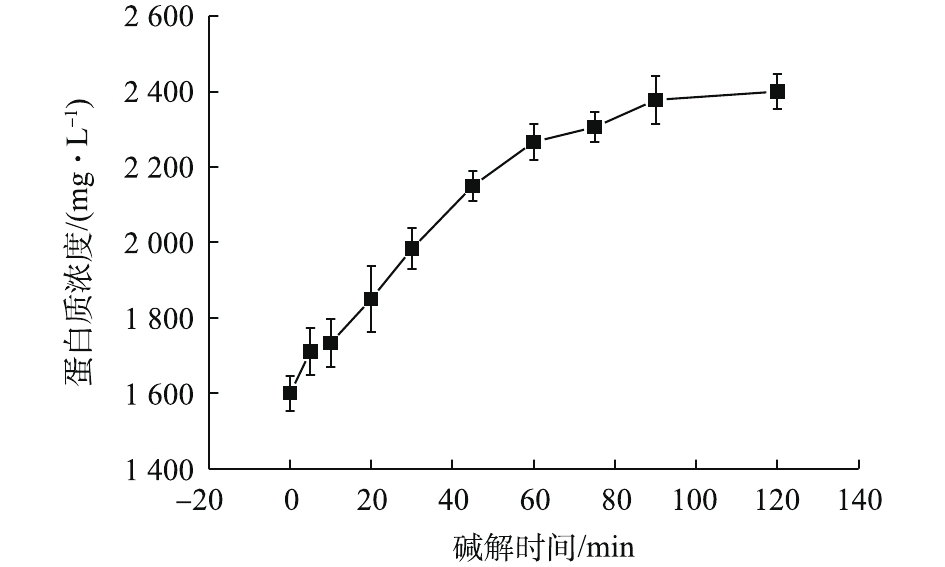
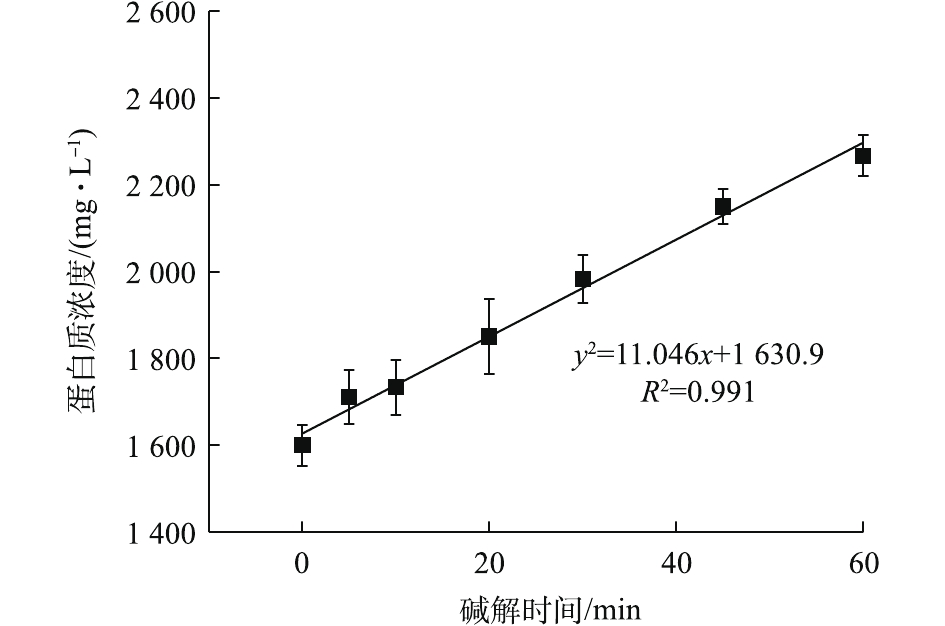
NH+4 -N浓度在90 ℃下明显升高,也说明了有更多的蛋白质在此温度下被降解。OP含量从70 ℃时的84.60 mg·L−1增加90 ℃时的95.40 mg·L−1。这说明温度的升高能提高污泥的破胞效果,但效果有限。因此综合分析,最佳碱解温度为80 ℃。由图14可知,当污泥浓度为30 g·L−1时,酶解1.5 h后进行碱解,蛋白质浓度随着碱解时间的延长而升高。酶解时间为0 min时,蛋白质浓度为1 600.01 mg·L−1。这是因为,加碱将pH调到12.5以后,升温过程中热解加上碱解,使得0 min时的蛋白质浓度较酶解完大幅上升。蛋白质浓度升高到20 min时的1 849.99 mg·L−1继而快速上升到30 min时的1 983.31 mg·L−1,一直快速上升到60 min时的2 266.61 mg·L−1。酶解时间为60~90 min时,蛋白质浓度上升变缓。酶解时间为90 min时,蛋白质浓度为2 377.71 mg·L−1,继续延长碱解时间,酶解时间到120 min时,蛋白质浓度为2 399.93 mg·L−1,趋于稳定。这可能是因为随着实验的进行,前期污泥细胞的破坏较为剧烈,导致蛋白质浓度快速升高,其后效果减弱,但是依然在进行蛋白质的溶出,最后反应接近完全。因此,蛋白质浓度趋于稳定。基于此,将60 min前结果进行线性拟合,以拟合得到的方程斜率作为该浓度下碱解反应的速率,方程拟合结果如图15所示,结果表明,动力学方程拟合效果较好。
进一步求得方程参数,结果发现动力学方程为y=11.046x+1 630.9(R2=0.991),拟合效果较好,即30 g·L−1的污泥溶液的碱解速率为11.046 mg·(L·min)−1。可以发现,与酶解相比,碱解速率提高了15.58倍,酶解是剩余污泥联合水解的限速步骤。这是因为,酶解效果跟多种因素有关。首先,可能是因为部分生物酶被截流或束缚在污泥结构中,与污泥细胞的充分接触受到了限制[33];其次,也可能是污泥成分复杂,对酶活性影响较大。而细胞壁中存在的脂类物质可以被碱分解,只要混合均匀,碱解效果就会较好;而且,碱解温度比酶解温度高25 ℃,一般反应温度每上升10 ℃,反应速率会提高2~3倍[34]。因此,碱解速率远高于酶解速率。
3. 结论
1)采用酶-热碱联合水解工艺,日处理量为1 m3剩余污泥(含水率80%)中试水解系统的最佳酶解时间为1.5 h、复合酶投加量为1%、污泥浓度为30 g·L−1、碱解时间为1.5 h、碱解温度为80 ℃。此时,水解上清液中蛋白质浓度为2 160 mg·L−1。以上研究结果可为该工艺的产业化应用提供必要的技术参数。
2)剩余污泥的酶解过程遵循米氏方程,最大酶解速率
vmax 和米氏常数Km 分别为0.709 mg·(L·min)−1和13.13 mg·L−1。剩余污泥的碱解过程符合零级动力学方程,碱解速率为11.046 mg·(L·min)−1。酶-热碱联合水解工艺中,酶解是限速步骤,如何在实践中进一步提高酶解速率是该工艺产业化应用成功与否的关键。 -
图 4 用Fe3O4制备磁化(a),月桂酸修饰生物炭(b),BC、LBC、MBC、LMBC、MLBC 和含油LBC的SEM照片(c),BC、LBC、MBC、LMBC、MLBC对原油的吸收(d)以及温度对原油吸附的影响(e)[45]
Figure 4. Preparation of Magnetization BC with Fe3O4(a), Lauric acid decoration of BC (b), SEM micrographs of BC, LBC, MBC, LMBC, MLBC, and oil-laden LBC (c), Crude oil uptake by BC, LBC, MBC, LMBC, and MLBC (d), and temperature dependence of crude oil uptake (e)[45]
表 1 不同生物质原料的生物炭气凝胶的吸油能力
Table 1. Oil sorption capacities of biochar aerogels derived from different biomass feedstock.
原料Feedstock 制备工艺Synthesis process 水接触角Water contact angle 油污Oil contaminants 吸附容量/(g·g−1)Sorption capacity 参考文献Reference 香蒲 亚氯酸钠处理,圆柱形模具,过滤,干燥,热解 151.0° 油和有机试剂 42.0—160.0 [52] 剑麻叶片 碱化和漂白处理,冻干纤维素,碳化 158.0° 油、有机试剂 77.7—147.3 [53] 甘蔗残渣 冷冻干燥,碳化 134.6° 有机试剂 31.9—55.02 [54] 玉米苞叶 碱化,漂白,冷冻干燥,碳化 152.0° 油、有机试剂 77.67—143.63 [55] 废弃榴莲壳 切割,水热处理,热解 112.3° 油、有机试剂 3.24—19.28 [56] 废弃报纸 冷冻干燥,热解 132.0° 油、有机试剂 29.0—51.0 [57] 香蕉皮和废报纸 冷冻干燥,热解 149.3° 油、有机试剂 35.0—115.0 [58] -
[1] ALY W, ABOUELFADL K Y. Impact of low-level water pollution on some biological aspects of redbelly tilapia (Coptodon zillii) in River Nile, Egypt [J]. The Egyptian Journal of Aquatic Research, 2020, 46(3): 273-279. doi: 10.1016/j.ejar.2020.08.001 [2] QUIGG A, PARSONS M, BARGU S, et al. Marine phytoplankton responses to oil and dispersant exposures: Knowledge gained since the Deepwater Horizon oil spill [J]. Marine Pollution Bulletin, 2021, 164: 112074. doi: 10.1016/j.marpolbul.2021.112074 [3] VELDKORNET D, RAJKARAN A, PAUL S, et al. Oil induces chlorophyll deficient propagules in mangroves [J]. Marine Pollution Bulletin, 2020, 150: 110667. doi: 10.1016/j.marpolbul.2019.110667 [4] WIKELSKI M, WONG V, CHEVALIER B, et al. Marine iguanas Die from trace oil pollution [J]. Nature, 2002, 417: 607-608. doi: 10.1038/417607a [5] PERRING A E, SCHWARZ J P, SPACKMAN J R, et al. Characteristics of black carbon aerosol from a surface oil burn during the Deepwater Horizon oil spill [J]. Geophysical Research Letters, 2011, 38(17): L17809. [6] AURELL J, GULLETT B K. Aerostat sampling of PCDD/PCDF emissions from the Gulf oil spill in situ burns [J]. Environmental Science & Technology, 2010, 44(24): 9431-9437. [7] KUMAR V, KUMAR M, PRASAD R. Microbial Action on Hydrocarbons[M]. Singapore: Springer Singapore, 2018. [8] WU L, LI B H, LIU M Z. Influence of aromatic structure and substitution of carboxyl groups of aromatic acids on their sorption to biochars [J]. Chemosphere, 2018, 210: 239-246. doi: 10.1016/j.chemosphere.2018.07.003 [9] LEHMANN J, JOSEPH S. Biochar for Environmental Management: Science, Technology and Implementation[M]. London: Routledge, 2015. [10] MORALES V L, PÉREZ-RECHE F J, HAPCA S M, et al. Reverse engineering of biochar [J]. Bioresource Technology, 2015, 183: 163-174. doi: 10.1016/j.biortech.2015.02.043 [11] WANG F, HARINDINTWALI J D, YUAN Z Z, et al. Technologies and perspectives for achieving carbon neutrality [J]. The Innovation, 2021, 2(4): 100180. doi: 10.1016/j.xinn.2021.100180 [12] AHMED M B, ZHOU J L, NGO H H, et al. Progress in the preparation and application of modified biochar for improved contaminant removal from water and wastewater [J]. Bioresource Technology, 2016, 214: 836-851. doi: 10.1016/j.biortech.2016.05.057 [13] NGUYEN H N, PIGNATELLO J J. Laboratory tests of biochars as absorbents for use in recovery or containment of marine crude oil spills [J]. Environmental Engineering Science, 2013, 30(7): 374-380. doi: 10.1089/ees.2012.0411 [14] YANG Y Y, YE S J, ZHANG C, et al. Application of biochar for the remediation of polluted sediments [J]. Journal of Hazardous Materials, 2021, 404: 124052. doi: 10.1016/j.jhazmat.2020.124052 [15] ONI B A, OZIEGBE O, OLAWOLE O O. Significance of biochar application to the environment and economy [J]. Annals of Agricultural Sciences, 2019, 64(2): 222-236. doi: 10.1016/j.aoas.2019.12.006 [16] MUMME J, SROCKE F, HEEG K, et al. Use of biochars in anaerobic digestion [J]. Bioresource Technology, 2014, 164: 189-197. doi: 10.1016/j.biortech.2014.05.008 [17] 盛奎川, 杨生茂. 生物炭概念的内涵及语词辨析 [J]. 核农学报, 2022, 36(2): 481-487. doi: 10.11869/j.issn.100-8551.2022.02.0481 SHENG K C, YANG S M. Biochar concept connotation and phrases discrimination [J]. Journal of Nuclear Agricultural Sciences, 2022, 36(2): 481-487(in Chinese). doi: 10.11869/j.issn.100-8551.2022.02.0481
[18] VAUGHN S F, KENAR J A, THOMPSON A R, et al. Comparison of biochars derived from wood pellets and pelletized wheat straw as replacements for peat in potting substrates [J]. Industrial Crops and Products, 2013, 51: 437-443. doi: 10.1016/j.indcrop.2013.10.010 [19] DAI Y J, ZHANG N X, XING C M, et al. The adsorption, regeneration and engineering applications of biochar for removal organic pollutants: A review [J]. Chemosphere, 2019, 223: 12-27. doi: 10.1016/j.chemosphere.2019.01.161 [20] YOU S M, OK Y S, CHEN S S, et al. A critical review on sustainable biochar system through gasification: Energy and environmental applications [J]. Bioresource Technology, 2017, 246: 242-253. doi: 10.1016/j.biortech.2017.06.177 [21] FANG J E, ZHAN L, OK Y S, et al. Minireview of potential applications of hydrochar derived from hydrothermal carbonization of biomass [J]. Journal of Industrial and Engineering Chemistry, 2018, 57: 15-21. doi: 10.1016/j.jiec.2017.08.026 [22] WANG J L, WANG S Z. Preparation, modification and environmental application of biochar: A review [J]. Journal of Cleaner Production, 2019, 227: 1002-1022. doi: 10.1016/j.jclepro.2019.04.282 [23] MOHAN D, PITTMAN C U Jr, STEELE P H. Pyrolysis of wood/biomass for bio-oil: A critical review [J]. Energy & Fuels, 2006, 20(3): 848-889. [24] ZHANG Y C, WANG X, LIU B J, et al. Comparative study of individual and Co-Application of biochar and wood vinegar on blueberry fruit yield and nutritional quality [J]. Chemosphere, 2020, 246: 125699. doi: 10.1016/j.chemosphere.2019.125699 [25] BRIDGWATER A V. Review of fast pyrolysis of biomass and product upgrading [J]. Biomass and Bioenergy, 2012, 38: 68-94. doi: 10.1016/j.biombioe.2011.01.048 [26] SHAKOOR M B, ALI S, RIZWAN M, et al. A review of biochar-based sorbents for separation of heavy metals from water [J]. International Journal of Phytoremediation, 2020, 22(2): 111-126. doi: 10.1080/15226514.2019.1647405 [27] GE S B, YEK P N Y, CHENG Y W, et al. Progress in microwave pyrolysis conversion of agricultural waste to value-added biofuels: A batch to continuous approach [J]. Renewable and Sustainable Energy Reviews, 2021, 135: 110148. doi: 10.1016/j.rser.2020.110148 [28] UCHIMIYA M, LIMA I M, KLASSON K T, et al. Contaminant immobilization and nutrient release by biochar soil amendment: Roles of natural organic matter [J]. Chemosphere, 2010, 80(8): 935-940. doi: 10.1016/j.chemosphere.2010.05.020 [29] HIGASHIKAWA F S, CONZ R F, COLZATO M, et al. Effects of feedstock type and slow pyrolysis temperature in the production of biochars on the removal of cadmium and nickel from water [J]. Journal of Cleaner Production, 2016, 137: 965-972. doi: 10.1016/j.jclepro.2016.07.205 [30] TANG J C, ZHU W Y, KOOKANA R, et al. Characteristics of biochar and its application in remediation of contaminated soil [J]. Journal of Bioscience and Bioengineering, 2013, 116(6): 653-659. doi: 10.1016/j.jbiosc.2013.05.035 [31] YUAN P, WANG J Q, PAN Y J, et al. Review of biochar for the management of contaminated soil: Preparation, application and prospect [J]. Science of the Total Environment, 2019, 659: 473-490. doi: 10.1016/j.scitotenv.2018.12.400 [32] KEILUWEIT M, NICO P S, JOHNSON M G, et al. Dynamic molecular structure of plant biomass-derived black carbon (biochar) [J]. Environmental Science & Technology, 2010, 44(4): 1247-1253. [33] YANG M Y, WANG J Q, CHEN Y, et al. Biochar produced from cotton husks and its application for the adsorption of oil products [J]. IOP Conference Series:Earth and Environmental Science, 2020, 545(1): 012022. doi: 10.1088/1755-1315/545/1/012022 [34] ZHAO M Y, CUI Y B, LI X, et al. Study on purification of oil-polluted sea water by rice hull adsorbent[J]. Applied Mechanics and Materials, 2013, 295/296/297/298: 1245-1248. [35] KANDANELLI R, MEESALA L, KUMAR J, et al. Cost effective and practically viable oil spillage mitigation: Comprehensive study with biochar [J]. Marine Pollution Bulletin, 2018, 128: 32-40. doi: 10.1016/j.marpolbul.2018.01.010 [36] 张明远. 利用生物炭去除海水及沙砾中石油污染的研究[D]. 青岛: 青岛理工大学, 2019. ZHANG M Y. Study on using biochar to remove oil pollution from seawater and sand[D]. Qingdao: Qingdao Tehcnology University, 2019 (in Chinese).
[37] EL GHERIANY I A, AHMAD EL SAQA F, ABD EL RAZEK AMER A, et al. Oil spill sorption capacity of raw and thermally modified orange peel waste [J]. Alexandria Engineering Journal, 2020, 59(2): 925-932. doi: 10.1016/j.aej.2020.03.024 [38] LEE K T, CHENG C L, LEE D S, et al. Spent coffee grounds biochar from torrefaction as a potential adsorbent for spilled diesel oil recovery and as an alternative fuel [J]. Energy, 2022, 239: 122467. doi: 10.1016/j.energy.2021.122467 [39] AlAMERI K, GIWA A, YOUSEF L, et al. Sorption and removal of crude oil spills from seawater using peat-derived biochar: An optimization study [J]. Journal of Environmental Management, 2019, 250: 109465. doi: 10.1016/j.jenvman.2019.109465 [40] 赵莹莹. 利用海产废弃物制备生物炭吸附海水中石油的研究[D]. 青岛: 青岛理工大学, 2021. ZHAO Y Y. Study on useing biochar prepared by marine waste to adsorb oil from seawater[D]. Qingdao: Qingdao Tehcnology University, 2021 (in Chinese).
[41] PENG P, LANG Y H, WANG X M. Adsorption behavior and mechanism of pentachlorophenol on reed biochars: pH effect, pyrolysis temperature, hydrochloric acid treatment and isotherms [J]. Ecological Engineering, 2016, 90: 225-233. doi: 10.1016/j.ecoleng.2016.01.039 [42] 孟蒙蒙, 夏文香, 许如康, 等. 盐酸改性松木屑生物炭吸附海洋溢油的模拟研究 [J]. 海洋环境科学, 2022, 41(3): 474-480,488. doi: 10.12111/j.mes.20210024 MENG M M, XIA W X, XU R K, et al. Study on adsorption of marine oil spill by hydrochloric acid modified pine sawdust biochar [J]. Marine Environmental Science, 2022, 41(3): 474-480,488(in Chinese). doi: 10.12111/j.mes.20210024
[43] 姚鑫鑫. 裙带菜磁性生物炭复合材料对油污的吸附性能研究[D]. 舟山: 浙江海洋大学, 2020. YAO X X. Study on the absorption performance of wakame magnetic biochar composite material to oil[D]. Zhoushan: Zhejiang Ocean University, 2020 (in Chinese).
[44] GURAV R, BHATIA S K, CHOI T R, et al. Adsorptive removal of crude petroleum oil from water using floating pinewood biochar decorated with coconut oil-derived fatty acids [J]. Science of the Total Environment, 2021, 781: 146636. doi: 10.1016/j.scitotenv.2021.146636 [45] NAVARATHNA C M, DEWAGE N B, KEETON C, et al. Biochar adsorbents with enhanced hydrophobicity for oil spill removal [J]. ACS Applied Materials & Interfaces, 2020, 12(8): 9248-9260. [46] YANG S D, CHEN L, MU L, et al. Low cost carbon fiber aerogel derived from bamboo for the adsorption of oils and organic solvents with excellent performances [J]. RSC Advances, 2015, 5(48): 38470-38478. doi: 10.1039/C5RA03701H [47] ZHANG J P, LI B C, LI L X, et al. Ultralight, compressible and multifunctional carbon aerogels based on natural tubular cellulose [J]. Journal of Materials Chemistry A, 2016, 4(6): 2069-2074. doi: 10.1039/C5TA10001A [48] OLIVEIRA F R, PATEL A K, JAISI D P, et al. Environmental application of biochar: Current status and perspectives [J]. Bioresource Technology, 2017, 246: 110-122. doi: 10.1016/j.biortech.2017.08.122 [49] XU R K, XIAO S C, YUAN J H, et al. Adsorption of methyl violet from aqueous solutions by the biochars derived from crop residues [J]. Bioresource Technology, 2011, 102(22): 10293-10298. doi: 10.1016/j.biortech.2011.08.089 [50] JIANG Y F, SUN H, YVES U J, et al. Impact of biochar produced from post-harvest residue on the adsorption behavior of diesel oil on loess soil [J]. Environmental Geochemistry and Health, 2016, 38(1): 243-253. doi: 10.1007/s10653-015-9712-1 [51] AHMAD M, RAJAPAKSHA A U, LIM J E, et al. Biochar as a sorbent for contaminant management in soil and water: A review [J]. Chemosphere, 2014, 99: 19-33. doi: 10.1016/j.chemosphere.2013.10.071 [52] YANG J, XU P, XIA Y F, et al. Multifunctional carbon aerogels from typha orientalis for oil/water separation and simultaneous removal of oil-soluble pollutants [J]. Cellulose, 2018, 25(10): 5863-5875. doi: 10.1007/s10570-018-1994-x [53] ZHANG T, YUAN D S, GUO Q, et al. Preparation of a renewable biomass carbon aerogel reinforced with sisal for oil spillage clean-up: Inspired by green leaves to green Tofu [J]. Food and Bioproducts Processing, 2019, 114: 154-162. doi: 10.1016/j.fbp.2018.12.007 [54] LI Z X, LEI S J, XI J C, et al. Bio-based multifunctional carbon aerogels from sugarcane residue for organic solvents adsorption and solar-thermal-driven oil removal [J]. Chemical Engineering Journal, 2021, 426: 129580. doi: 10.1016/j.cej.2021.129580 [55] JING Z F, DING J C, ZHANG T, et al. Flexible, versatility and superhydrophobic biomass carbon aerogels derived from corn bracts for efficient oil/water separation [J]. Food and Bioproducts Processing, 2019, 115: 134-142. doi: 10.1016/j.fbp.2019.03.010 [56] WANG Y, ZHU L, ZHU F Y, et al. Removal of organic solvents/oils using carbon aerogels derived from waste durian shell [J]. Journal of the Taiwan Institute of Chemical Engineers, 2017, 78: 351-358. doi: 10.1016/j.jtice.2017.06.037 [57] HAN S J, SUN Q F, ZHENG H H, et al. Green and facile fabrication of carbon aerogels from cellulose-based waste newspaper for solving organic pollution [J]. Carbohydrate Polymers, 2016, 136: 95-100. doi: 10.1016/j.carbpol.2015.09.024 [58] YUE X J, ZHANG T, YANG D Y, et al. Hybrid aerogels derived from banana peel and waste paper for efficient oil absorption and emulsion separation [J]. Journal of Cleaner Production, 2018, 199: 411-419. doi: 10.1016/j.jclepro.2018.07.181 [59] MADHUBASHANI A M P, GIANNAKOUDAKIS D A, AMARASINGHE B M W P K, et al. Propensity and appraisal of biochar performance in removal of oil spills: A comprehensive review [J]. Environmental Pollution, 2021, 288: 117676. doi: 10.1016/j.envpol.2021.117676 [60] EEK E, CORNELISSEN G, KIBSGAARD A, et al. Diffusion of PAH and PCB from contaminated sediments with and without mineral capping;measurement and modelling [J]. Chemosphere, 2008, 71(9): 1629-1638. doi: 10.1016/j.chemosphere.2008.01.051 [61] SILVANI L, di PALMA P R, RICCARDI C, et al. Use of biochar as alternative sorbent for the active capping of oil contaminated sediments [J]. Journal of Environmental Chemical Engineering, 2017, 5(5): 5241-5249. doi: 10.1016/j.jece.2017.10.004 [62] O'CONNOR D, PENG T Y, ZHANG J L, et al. Biochar application for the remediation of heavy metal polluted land: A review of in situ field trials [J]. Science of the Total Environment, 2018, 619/620: 815-826. doi: 10.1016/j.scitotenv.2017.11.132 [63] JIA H, LI J, LI Y, et al. The remediation of PAH contaminated sediment with mangrove plant and its derived biochars [J]. Journal of Environmental Management, 2020, 268: 110410. doi: 10.1016/j.jenvman.2020.110410 [64] OH S Y, SON J G, LIM O T, et al. The role of black carbon as a catalyst for environmental redox transformation [J]. Environmental Geochemistry and Health, 2012, 34(1): 105-113. [65] KLÜPFEL L, KEILUWEIT M, KLEBER M, et al. Redox properties of plant biomass-derived black carbon (biochar) [J]. Environmental Science & Technology, 2014, 48(10): 5601-5611. [66] GOMEZ-EYLES J L, GHOSH U. Enhanced biochars can match activated carbon performance in sediments with high native bioavailability and low final porewater PCB concentrations [J]. Chemosphere, 2018, 203: 179-187. doi: 10.1016/j.chemosphere.2018.03.132 [67] ZHANG H R, TANG J C, WANG L, et al. A novel bioremediation strategy for petroleum hydrocarbon pollutants using salt tolerant Corynebacterium variabile HRJ4 and biochar [J]. Journal of Environmental Sciences, 2016, 47: 7-13. doi: 10.1016/j.jes.2015.12.023 [68] CHEN Y, YU B, LIN J J, et al. Simultaneous adsorption and biodegradation (SAB) of diesel oil using immobilized Acinetobacter venetianus on porous material [J]. Chemical Engineering Journal, 2016, 289: 463-470. doi: 10.1016/j.cej.2016.01.010 [69] ZHOU H H, JIANG L J, LI K L, et al. Enhanced bioremediation of diesel oil-contaminated seawater by a biochar-immobilized biosurfactant-producing bacteria Vibrio sp. LQ2 isolated from cold seep sediment [J]. Science of the Total Environment, 2021, 793: 148529. doi: 10.1016/j.scitotenv.2021.148529 -





 下载:
下载: