-
高氮磷废水的过量排放会导致水体富营养化和生态破坏[1]。微藻是一种光合微生物,能够吸收氮、磷和有机物等,被用处理各种废水[2]。另一方面,微藻细胞脂类含量高是生物柴油生产的主要原料[3-9],因此,将废水处理与微藻生物量生产相结合可以降低二者生产成本。由于微藻对废水中氮/磷的去除是藻细胞生长代谢的结果即平均去除速率和去除率与藻细胞生长速率和生物量呈正相关,而部分细菌和真菌能够促进微藻的生长(如地衣中的细菌和真菌促进其共生绿藻的生长),因此,将微藻与细菌[10-16]或者真菌[17-26]混合培养,利用微藻和细菌或者真菌之间的协同效应促进微藻生长进而提高氮/磷的去除率成为研究热点。
雨生红球藻能够在适宜的条件下快速吸收氮和磷进行自养/混合营养生长,而在不利条件下大量合成脂类和高附加值的虾青素(一种红色类胡萝卜素)[27-28],目前已被用于处理不同的废水,并取得了良好的效果[29-33]。然而,与其他藻类相比,雨生红球藻对有害细菌更敏感,这些细菌严重抑制藻细胞生长,限制了其在废水处理中的应用。实际上,有害细菌对所有微藻的生长均构成严重威胁[34]。为了控制微藻培养过程中的有害细菌,通常采用的方法为添加抗生素、高温处理、强光照射[35-36],以及使用次氯酸钠对废水进行预处理[37]。因此,有效控制有害细菌是利用微藻尤其是雨生红球藻处理废水的关键问题。
在此前的研究[37-38]中我们分离到一种蓝藻共生真菌Simplicillium lanosoniveum(DT06)。DT06能够合成一种新抗生素[39]并且能促进衣藻(Chlamydomonas reinhardtii)生长和脂类合成[40]。因此,本研究将雨生红球藻与真菌DT06在高含氮磷废水中混合培养,以期提高雨生红球藻类生长速率和产量以及废水氮/磷的去除速率和去除率。
-
1)废水样本。废水来自天津市的某污水处理厂。废水通过0.45 µm滤膜去除不溶性大分子物质,并在4 ℃保存。废水主要性质如下:pH为6.5±0.4;总氮(TN)质量浓度为(553.8±17) mg·L–1;总磷(TP)质量浓度为(90.7±8) mg·L–1,化学需氧量(COD)为(750±22) mg·L–1。
2)微生物菌株。雨生红球藻购自中国武汉水生生物研究所;真菌Simplicillium lanosoniveum DT06由河北工业大学代谢工程与生物合成实验室分离获得,并保藏于中国科学院微生物学研究所菌物标本馆(编号HMAS 242045)。
-
1)微藻接种液:5 mL雨生红球藻培养液接种到装有60 mL BBM培养基[27]的100 mL锥形瓶中,置于光照摇床中培养7 d(115 r·min–1、25 °C恒温、60 μmoL·(m2·s)–1持续光照)。雨生红球藻接种液最终的细胞浓度为1.5×105 细胞·mL–1。
2)真菌孢子悬浮液:将真菌DT06划线于PDA培养基平板上,于培养箱(28 ℃)中恒温培养7 d后,从菌落表面轻轻刮取收集DT06孢子,并悬浮于50 mL无菌水中。真菌孢子悬浮液最终细胞浓度为5×106 细胞·mL–1。雨生红球藻细胞和真菌DT06孢子的数量均通显微镜进行计数。
-
雨生红球藻与真菌DT06混合培养(简称M组):按10%接种量将雨生红球藻接种到含有200 mL废水的500 mL锥形瓶中,并分别接种对应体积的DT06孢子悬浮液,以达到5∶1、10∶1、30∶1、50∶1的细胞数量接种比例(雨生红球藻:DT06)。以雨生红球藻单独培养(1∶0,雨生红球藻:DT06)作为对照(CK)。
雨生红球藻-DT06混合添加NaHCO3培养(简称MC组):在每组含有200 mL废水的500 mL锥形瓶中分别添加不同体积的NaHCO3母液(10 g·L–1),使NaHCO3质量浓度达到0(对照,MCK)、0.2、0.4、0.6和0.8 g·L–1,以最佳细胞接种比例分别接种雨生红球藻和DT06孢子悬浮液。
所有实验均置于光照培养箱中培养12 d(25 °C恒温、60 μmoL·(m2·s)–1持续光照),每天手摇2次,每组实验设置3个重复。
-
1)雨生红球藻生物量。雨生红球藻生物量以细胞干重表示,每隔2 d取培养液并采用显微镜计数法计数,根据式(1)计算雨生红球藻生物量,根据式(2)计算雨生红球藻比生长速率。
式中:X为细胞干质量,g·L–1;N为细胞浓度, 细胞·mL–1;μ为比生长速率,d−1;X0和Xn分别为第t0天和第tn天的雨生红球藻生物量,g·L–1。
2)细菌总数。根据实验室之前的方法[40-42]对废水中细菌总数做了部分修改。灭菌的LB琼脂板接种1 mL稀释105倍的废水样品,并在培养实验相同的条件下培养3 d。总细菌数表示为每毫升菌落形成单位(CFU·mL−1)。
3)废水水质。每隔两天取废水样本进行分析。总氮使用过硫酸钾氧化紫外分光光度法;总磷使用钼锑抗分光光度法;COD 使用重铬酸盐法测定;氮、磷的去除率和去除速率根据式(3)和式(4)进行计算。
式中:N为COD和氮、磷的去除率,%;R为COD和氮、磷的去除速率,mg·(L·d)–1;N0和Nt分别为第t0天和第tn天的COD和氮、磷质量浓度,mg·L–1。
4)脂类和虾青素含量。 雨生红球藻脂类和虾青素含量参照我们此前的方法[43]测定。
-
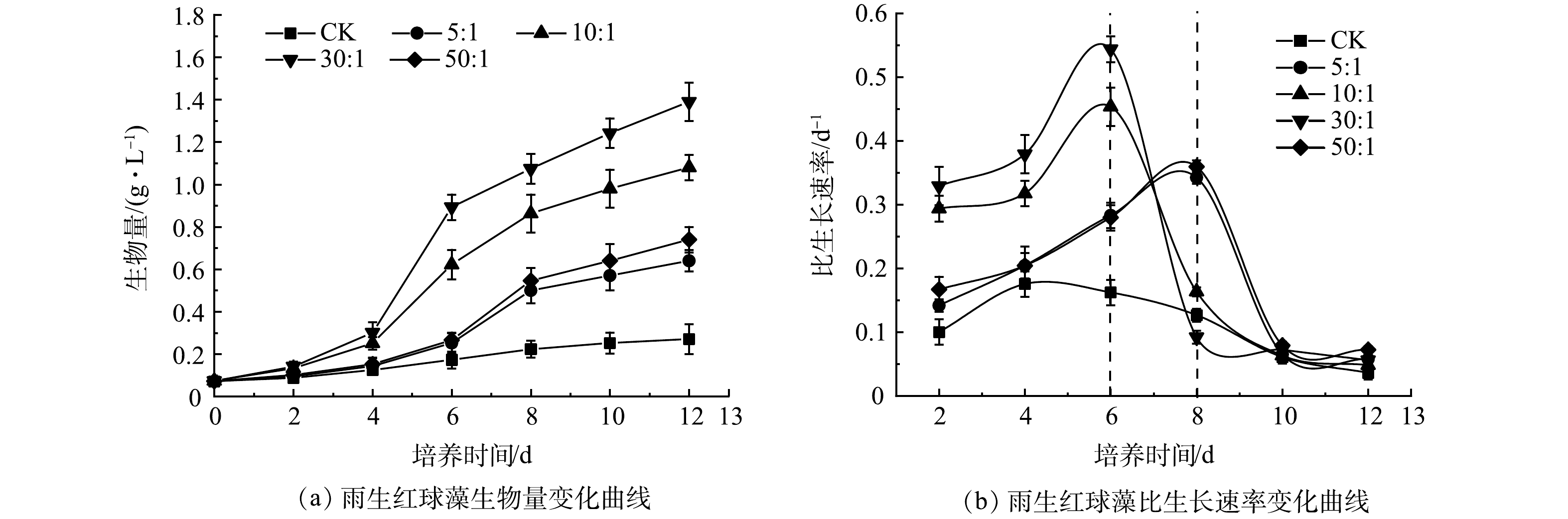
1)混合培养对微藻生长的影响。如图1(a)所示,CK中雨生红球藻的生物量在前8 d内缓慢上升,第10天后趋于平稳,最终达到0.27 g·L–1;而雨生红球藻与DT06混合培养过程中雨生红球藻的生物量在前4 d缓慢上升(适应期),在第6天(10:1、30:1)和第8天(5:1、50:1)快速上升,第8天后趋于平稳。最终,雨生红球藻的生物量在5:1、10:1、30:1和50:1下分别为0.64、1.08、 1.39 和 0.74 g·L–1。
生长动力学分析结果(图1(b))显示, CK中雨生红球藻的比生长速率在第4天达到最大值(0.18 d–1),第6天后逐渐降低至0。雨生红球藻与DT06混合培养过程中雨生红球藻的比生长速率均高于CK。比生长速率在10∶1和30∶1时在第6天达到最大值,分别为0.45 d−1和0.54 d−1;在5∶1和50∶1时在第8天达到最大值,分别为0.34 d−1和0.36 d−1。比生长速率此后逐渐降低至0。雨生红球藻与DT06混合培养过程中30∶1表现出最高的生长速率和最高平均比生长速率(0.25 d−1),因此,后续实验以最佳藻菌细胞比30∶1进行实验。
混合培养中藻类生物量的增加是由于比生长速率的提高,这可归因于2个方面:1)藻类(雨生红球藻)和真菌DT06的共生作用。DT06释放CO2促进雨生红球藻光合作用,并吸收雨生红球藻释放的O2进行有氧代谢,从而解除O2对藻类生长的抑制作用,这与其他菌藻混合培养类似[27,44-47];2)抑制有害细菌的生长。与混合培养相比,对照的生物量异常低,比生长速率过早地下降,表明废水中有害细菌对藻类的生长有显著的抑制作用,混合培养中的生物量持续增加表明DT06释放的抗生素表现出对有害细菌显著的抑制作用。
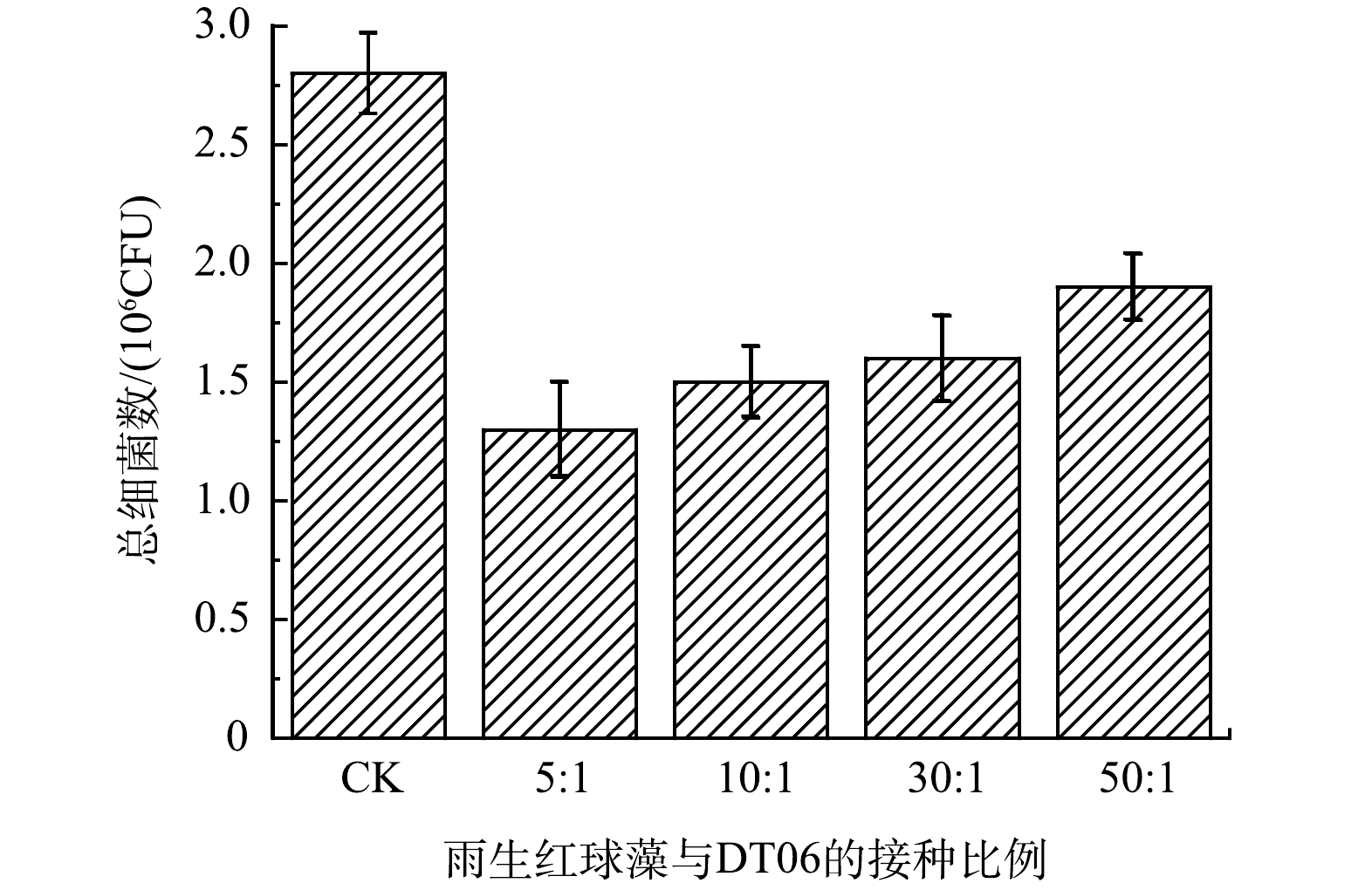
2)总细菌数。如图2所示,实验结束时5∶1、10∶1、30∶1和50∶1中细菌总数分别为1.3、1.5、1.6、1.9×106 CFU。雨生红球藻与DT06混合培养过程中的细菌总数与CK(2.8×106 CFU)相比分别下降了54.8%、46.4%、42.9%和30.4%。这表明DT06能够抑制废水中细菌的增长。
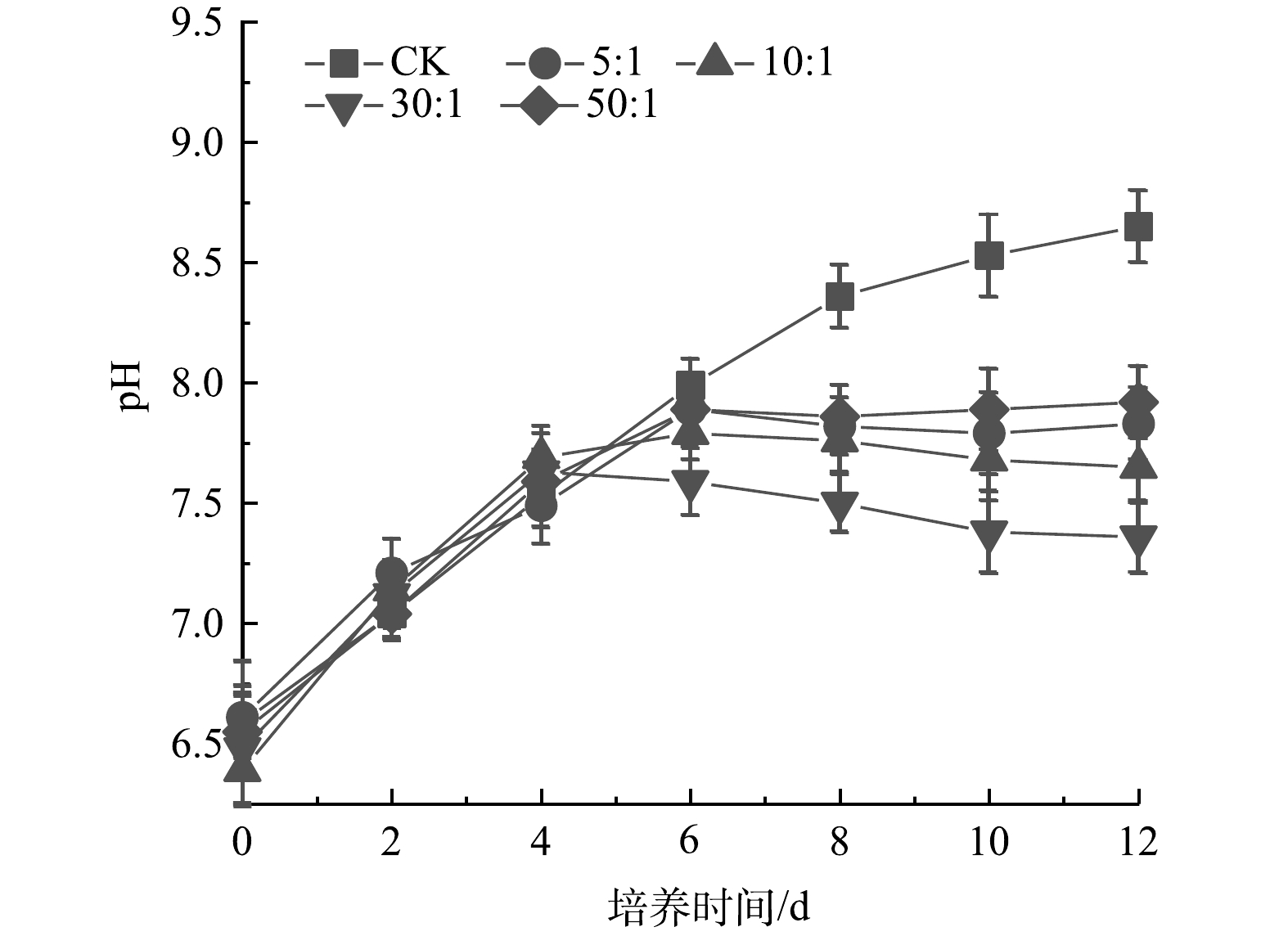
3)如图3所示,CK中pH持续上升,在实验结束时达到8.65。雨生红球藻与DT06混合培养过程中pH在前4 d持续升高,之后保持相对稳定且显著低于CK。实验结束时5: 1、10: 1、30: 1和50: 1的pH分别稳定在7.83、7.65、7.36和7.92。pH快速升高主要原因是雨生红球藻吸收了生理碱性盐(如硝酸盐)。混合培养中pH保持相对稳定,原因是真菌DT06释放的CO2中和培养液的碱性以及雨生红球藻吸收废水中的NH4+降低了培养液的pH。
4)混合培养对COD去除的影响。如图4(a)所示,CK中COD下降缓慢,最终的去除率仅为28.5%,平均去除速率为18.4 mg·(L·d)–1(图4(b))。这表明雨生红球藻和原有的微生物对耗氧有机物(以COD计)的降解能力有限。而在30∶1、10∶1、5∶1和50∶1中,COD分别在第4、6和8天内降至0(去除率100 %)(图4(a)),平均去除率分为183.9、127. 4、96. 8、93.1 mg·(L·d)–1 (图4(b))。结果表明,废水中的难降解耗氧有机化合物(以COD计)可被DT06完全降解为小分子物质和CO2,这些小分子物质被雨生红球藻利用进行混合营养生长。因此,在难降解有机化合物完全降解前后,雨生红球藻的比生长速率快速上升,之后迅速下降(图1(b))。
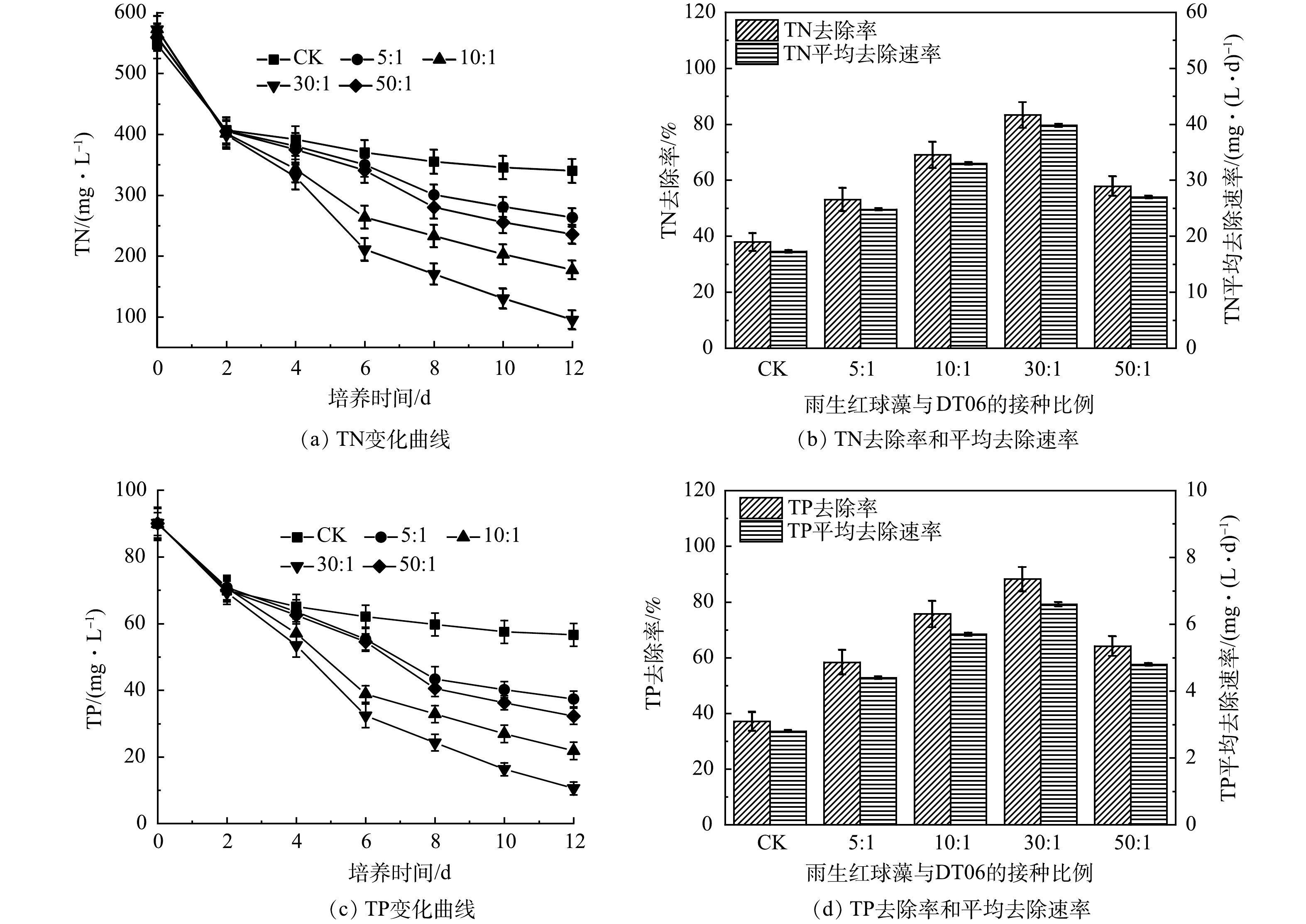
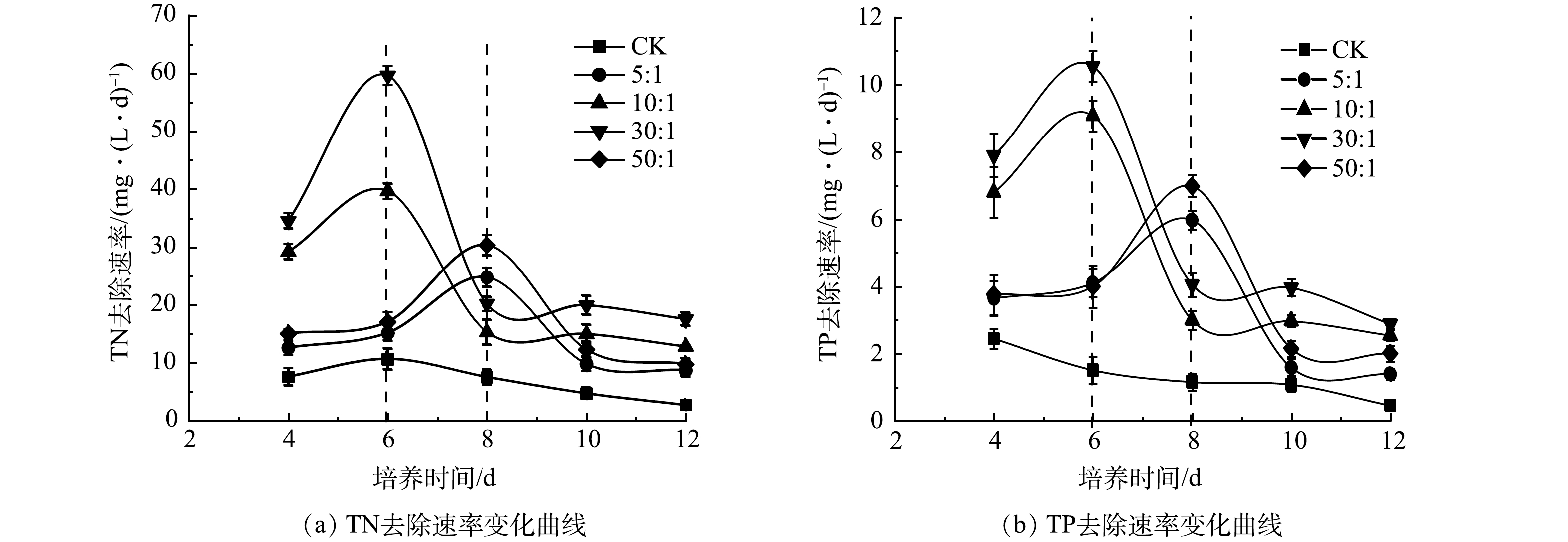
5)混合培养对氮磷去除的影响。如图5(a)所示,CK中TN质量浓度在前2 d迅速下降,之后缓慢下降,最终达到340 mg·L–1,去除率为37.9 %,平均去速除率为17.3 mg·(L·d)–1 (图5(b))。相比之下,雨生红球藻与DT006混合培养过程中TN质量浓度持续下降,下降速度均高于CK(图5(a))。其中, 30∶1中TN去除率最高为83.33%,平均去除速率为39.8 mg·(L·d)–1。而5∶1、10∶1、50∶1中TN的平均去除速率分别为24.8、33.0、27.0 mg·(L·d)–1;去除率分别为53.1%、69.1 %、57.9 % (图5(b))。
TP变化与TN变化规律相似(图5(c)),TP在CK中下降最慢,最终为56.6 mg·L–1;在 30:1中下降最快,最终为10.6 mg·L–1。最低和最高的TP去除率分别为37.1%和88.2%,平均TP去除率分别为2.8 mg·(L·d)–1和6.6 mg·(L·d)–1 (图5(d))。
混合培养氮、磷去除率的提高归因于藻类生长速率的提高。如图6所示,在第6天和第8天之前,所有混合培养中的TN和TP去除速率持续增加,随后骤然下降,这与雨生红球藻比生长速率在初始升高和随后下降一致(图1(b))。而如上所述,雨生红球藻比生长速率的骤然下降主要是由于雨生红球藻进行快速异养生长对作为碳源的COD的快速消耗。也就是说,混合培养中有机碳源(如COD)的存在促进了雨生红球藻的生长,进而提高氮、磷的去除率。然而,在实验结束时,雨生红球藻与DT06混合培养组中残余的氮、磷含量仍然很高(图5(a)和5(c))。因此,在混合培养中需要添加额外的碳源来进一步提高氮、磷的去除率。
有研究表明,添加有机碳源会造成不可避免的二次污染[47],并提高废水处理成本。廉价的无机碳源,例如碳酸氢盐(NaHCO3),是产生HCO3−促进雨生红球藻光合营养生长的最佳替代物。因此,为了进一步提高氮磷去除率,本研究在最佳细胞接种比例30∶1的基础上添加NaHCO3进行后续的实验。
-
1)添加NaHCO3混合培养对微藻生长的影响。如图7(a)所示,MCK中雨生红球藻生物量在第4天后快速上升,第6天后缓慢上升,最终达到1.36 g·L–1。而添加NaHCO3混合培养过程中雨生红球藻的生物量在第2天后快速上升,第8天后达到稳定期,最终添加0.2、0.4、0.6、0.8 g·L–1 NaHCO3中雨生红球藻的生物量分别为1.58、1.71、1.95、1.44 g·L–1。生长动力学分析结果表明(图7(b)),添加NaHCO3混合培养组中雨生红球藻的比生长速率在第2天上升,并在第4天达到最大值,随后快速下降。添加0.6 g·L–1 NaHCO3中雨生红球藻的比生长速率最高,为0.85 d–1,比MCK(0.51 d–1)高1.66倍。以上结果表明混合培养中添加0.6 g·L–1 的NaHCO3最适合雨生红球藻的生长。
与MCK相比,添加NaHCO3混合培养过程中雨生红球藻的适应期缩短,比生长速率有所升高。这表明NaHCO3产生的HCO3−被雨生红球藻同化为光合底物,从而促进微藻的光合作用。而延长的指数期和比生长速率的下降是由于以下2点:HCO3−的吸收导致pH升高限制了雨生红球藻细胞的生长, 这也是添加0.8 g·L–1 NaHCO3中雨生红球藻的生物量低于添加0.6 g·L–1 NaHCO3的原因(图8);废水中氮、磷质量浓度的下降(图9)导致雨生红球藻细胞生长停止以及孢子的形成(图7)。
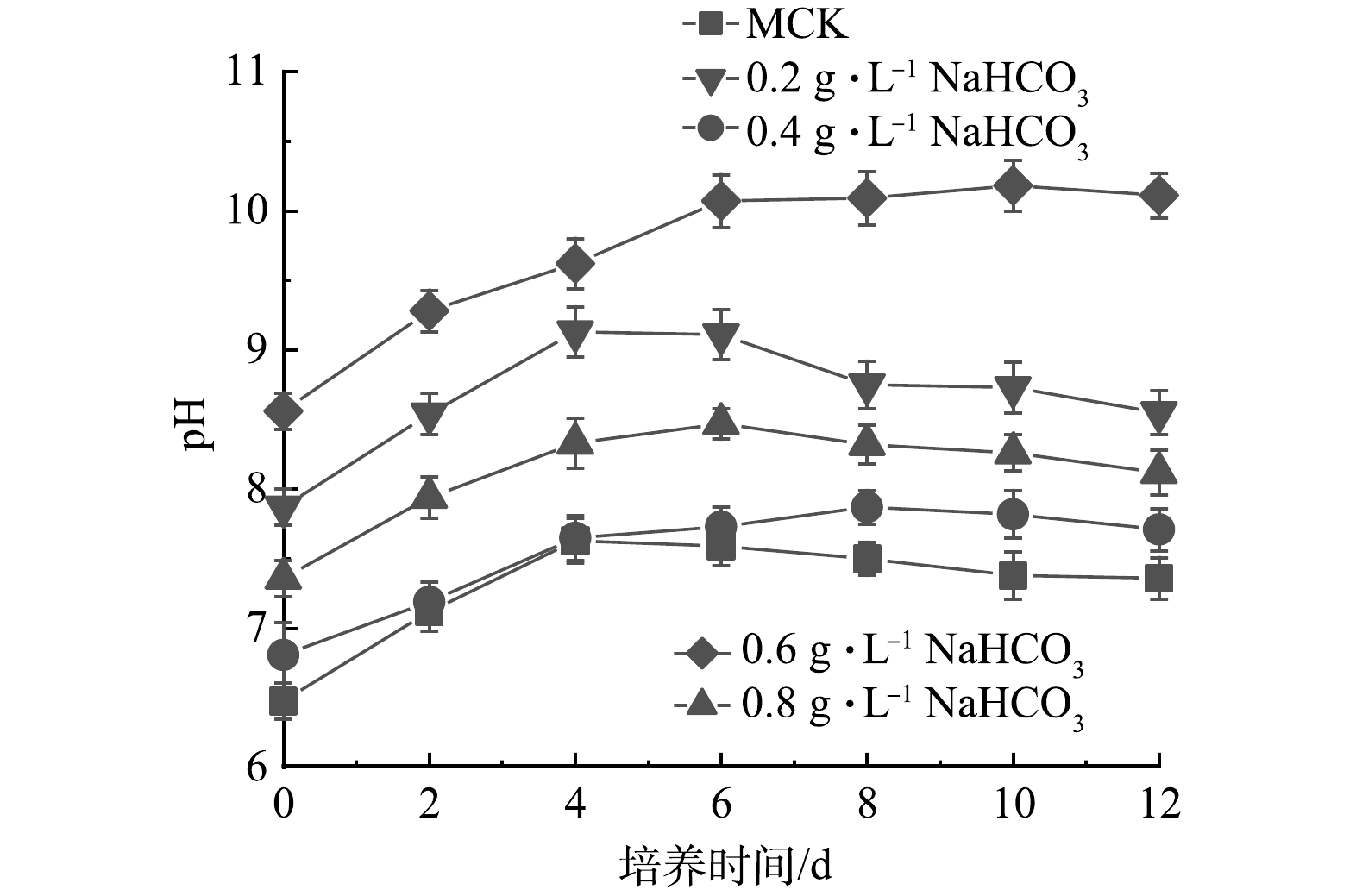
2)如图8所示,MCK 中pH在前4 d持续升高,之后稳定在7.3~7.5直到实验结束。由于添加了NaHCO3,添加NaHCO3混合培养过程中初始pH均高于MCK。添加0.2、0.4和0.6 g·L–1 NaHCO3的pH在前4 d逐渐升高,之后保持相对稳定,实验结束时pH分别7.71、8.12和8.55。而添加0.8 g·L–1 NaHCO3的pH持续升高,最终达到10.11。
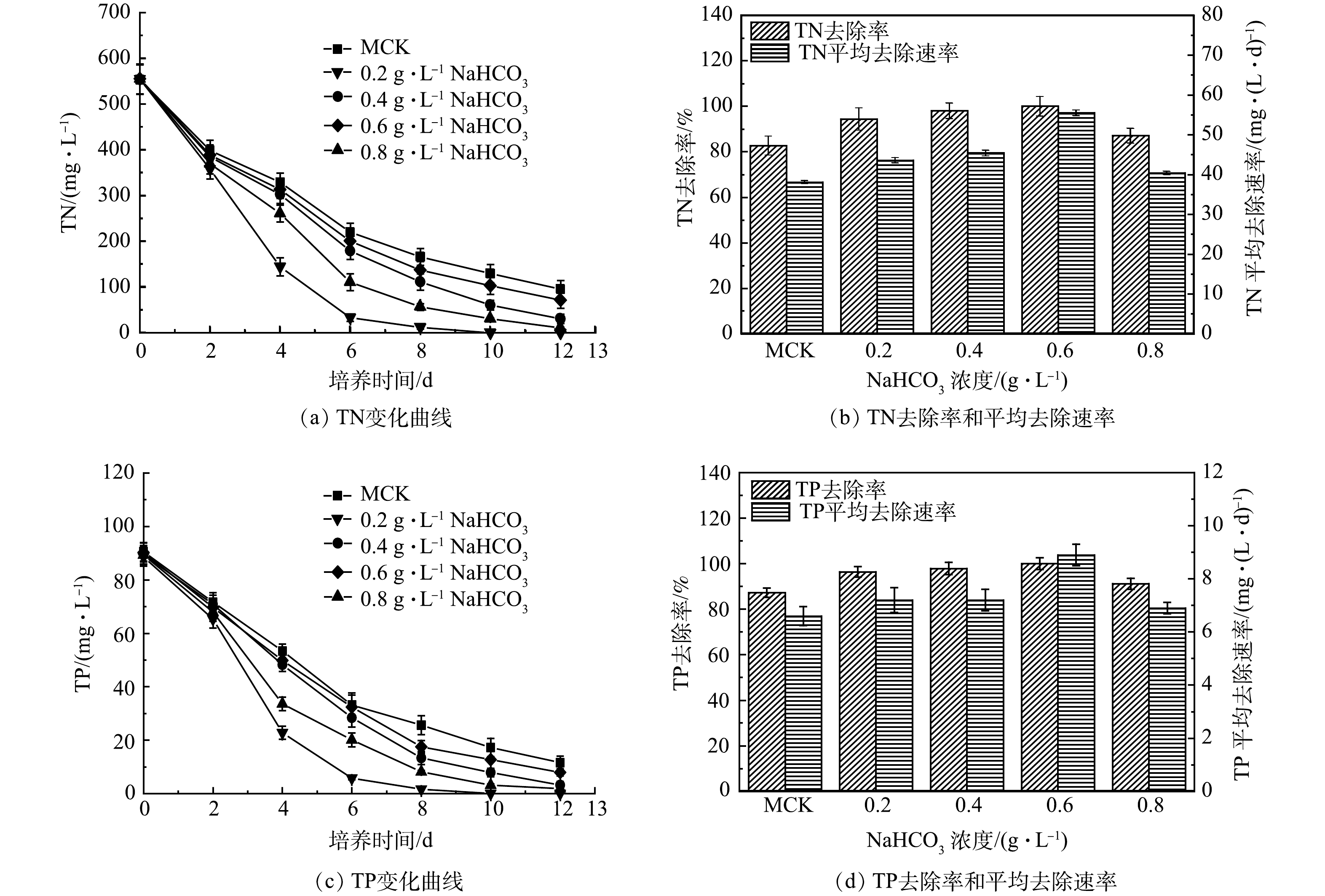
3)添加NaHCO3混合培养过程中混合培养对氮磷去除的影响。如图9(a)所示,添加NaHCO3混合培养过程中TN质量浓度急剧下降。其中添加0.6 g·L–1 NaHCO3中TN质量浓度下降最快,在第10天达到检出限,达到最高去除率(100%),平均去除速率为55.5 mg·(L·d)–1 (图9(b))。相比之下,添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TN质量浓度下降缓慢,最终分别为30.8、10.9、71.5和95.7 mg·L–1。添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TN平均去除速率分别为 43.6、45.4、40.4、38.1 mg·(L·d)–1,去除率分别为94.4%、98%、87.1%、82.7%。
TP变化与TN变化规律相似,TP质量浓度在添加0.6 g·L–1 NaHCO3中的第8天便达到检出限,达到最高去除率100%,平均去除速率为8.9 mg·(L·d)–1。而添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TP质量浓度在实验结束时分别为3.2、1.9、7.9和11.6 mg·L–1(图9(c))。添加0.2、0.4、0.8 g·L–1 NaHCO3和MCK中TP平均去除速率分别为7.2、7.2、6.9、6.6 mg·(L·d)–1;去除率分别为96.4%、97.9%、91.2%、87.9% (图9(d))。
添加NaHCO3混合培养过程和MCK中TN/TP的变化表明,混合培养中添加NaHCO3促进藻类生长,可提高氮、磷去除率。添加NaHCO3混合培养过程中的TN/TP去除率和平均去除速率(图9(b)和图9(d))与细胞比生长速率和生物量(图7)变化同步,在MC0.6中达到最大值。
-
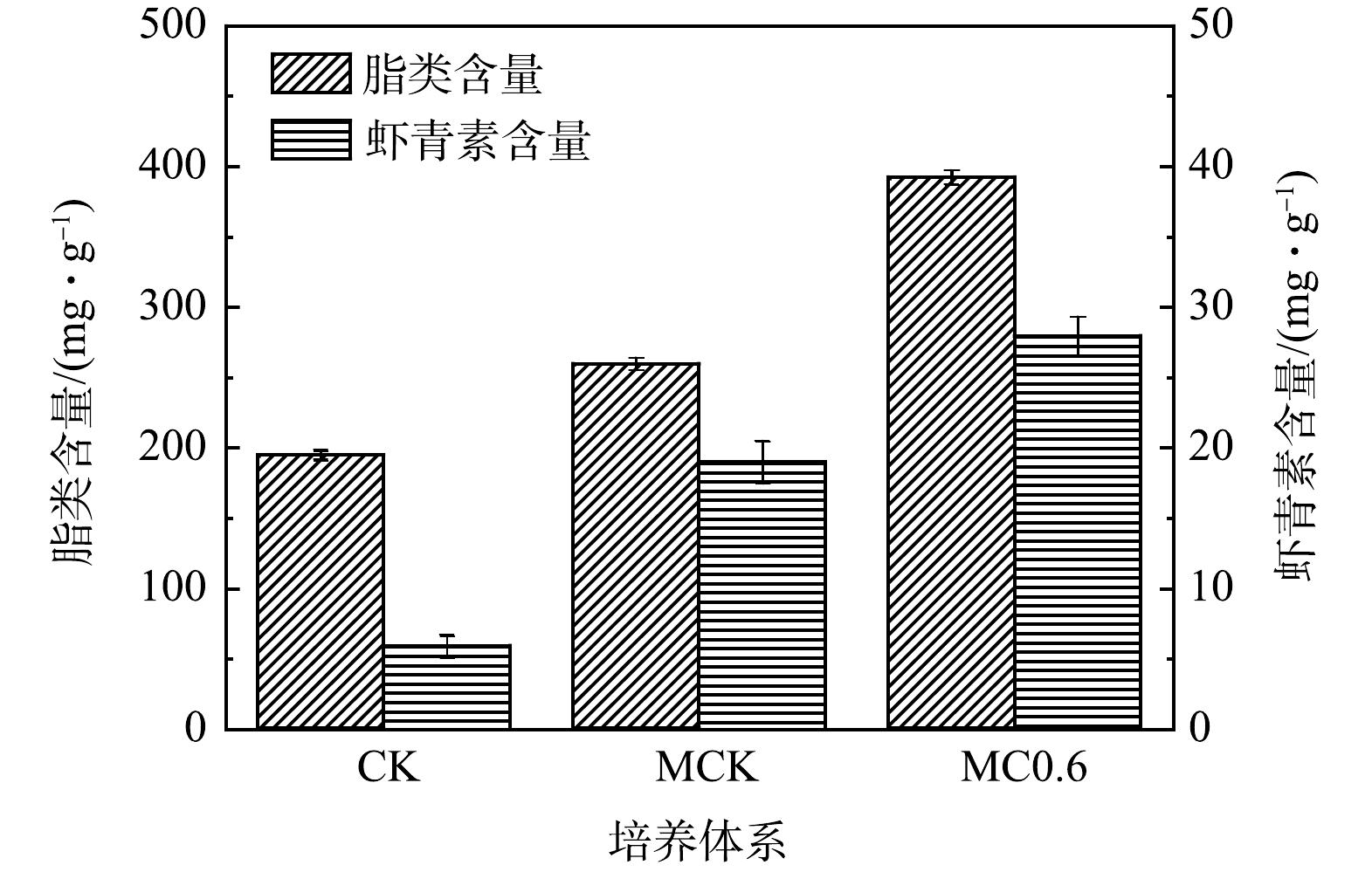
为了评估不同培养体系对雨生红球藻脂类和虾青素合成的影响,分析比较了雨生红球藻添加0.6 g·L–1 NaHCO3、 30:1(MCK)和CK中的脂类和虾青素含量。如图10所示,添加0.6 g·L–1 NaHCO3中脂类含量最高(392.2 mg·g–1),分别比MCK(259.6 mg·g–1)和CK(194.7 mg·g–1)提高了51.1%和101.4%。添加0.6 g·L–1 NaHCO3中雨生红球藻的虾青素含量达到最高(27.9 mg·g–1),分别是MCK(19.0 mg·g–1)和CK(5.9 mg·g–1)的1.5倍和4.7倍。脂类和虾青素的变化规律相似,主要是由于呈脂溶性虾青素分散在藻类细胞的脂滴中[48],因此,与脂类的合成呈相同的变化趋势(图10)。
与CK和MCK相比,添加0.6 g·L–1 NaHCO3中雨生红球藻的脂类和虾青素含量逐渐增加。主要原因是氮、磷质量浓度的快速下降,尤其是氮(图7(a))。添加0.6 g·L–1 NaHCO3对总氮的快速去除导致早期氮的含量相对不足/缺乏(氮饥饿),使得藻细胞将碳通量引导至脂类合成路径,从而促进脂类和虾青素的合成[48-49]。
-
1)与雨生红球藻的单独培养(CK)相比,雨生红球藻与DT06混合培养促进了雨生红球藻生长。雨生红球藻与DT06混合培养过程的COD先后均被完全去除,氮、磷的去除效果也得到显著提升。
2)添加NaHCO3的混合培养可进一步促进藻类生长和对氮、磷的去除。在NaHCO3质量浓度为0.6 g·L–1时,雨生红球藻比生长速率达到最高,氮和磷几乎被完全去除,其平均去除速率分别达到55.5 mg·(L·d)–1和8.9 mg·(L·d)–1。
3)在CK、M和MC体系中,MC中雨生红球藻的脂类和虾青素含量最高,分别达到259.6 mg·L–1和27.9 mg·L–1。
雨生红球藻与真菌Simplicillium lanosoniveum混合培养并添加NaHCO3处理高含氮磷废水
Treatment of wastewater with high nitrogen/phosphorous content by mix-cultivation of Haematococcus pluvialis and Simplicillium lanosoniveum supplemented with NaHCO3
-
摘要: 为有效地去除废水中氮磷,使用未灭菌的废水混合培养雨生红球藻和抗生素合成真菌Simplicillium lanosoniveum DT06 (DT06) 。结果表明:最佳藻菌细胞比为30:1。在此条件下:COD、总氮、总磷的去除率分别为100%、83.3%和88.2%;添加0.6 g·L–1NaHCO3后,氮磷去除率进一步提高至100%,同时微藻生物量、脂类和虾青素含量分别增加至1.95 g·L–1、0.39 g·g–1和27.9 mg·g–1。因此,雨生红球藻-真菌DT06添加NaHCO3的培养模式为废水处理和生物柴油/虾青素生产提供了一种经济高效的策略。Abstract: In order to efficiently remove nitrogen/phosphorus, the astaxanthin-producing green alga Haematococcus pluvialis and antibiotic-synthesizing fungus Simplicillium lanosoniveum DT06 (DT06) was mix-cultivated in the unsterilized wastewater without/with addition of NaHCO3. Experimental results showed that the removal rates of COD, nitrogen and phosphorus were 100%, 83.3% and 88.2% when the optimal cell ratio of algae-bacteria was 30:1, respectively; the removal rates of nitrogen and phosphorus increased further to 100 % after addition of 0.6 g·L–1 NaHCO3 to mixed culture, and the contents of algal biomass, lipid and astaxanthin increased to 1.95 g·L–1, 0.39 g·g–1 and 27.9 mg·g–1, respectively. Hence, mix-cultivation of H. pluvialis and DT06 supplemented with NaHCO3 provides a cost-effective strategy for wastewater treatment and biodiesel/astaxanthin production.
-
我国幅员辽阔,湖泊众多,全国1 km2以上的湖泊有2 759个,总面积达91 019 km2,占国土面积的0.95%[1]。近年来,随着社会发展和人们生活水平的不断提高,城市建设越来越强调生态元素及理念,因此建设了大量的水体景观工程,即人工湖[2]。城市小型湖泊及人工湖能够影响城市微气候,促进物质和能量循环并参与生物修复过程,还具重要的美学和娱乐价值[2-3],以及重要的生态意义[4-5]。然而,这类湖泊通常水域面积较小、水深较浅、流速小、污染源受纳量较高且自净能力有限,容易出现水体富营养化[6-9]。近5年来,我国城市湖泊富营养化日趋严重,浮游藻类大量繁殖会破坏湖泊原有的自然景观,限制城市旅游业的发展,也降低了人民群众的幸福感[5]。
富营养化城市湖泊的治理已成为国内外学者广泛关注的焦点。自20世纪80年代初开始,国内外学者就开展了湖泊生态治理的实践研究。经过近40年的发展,底泥疏浚、人工曝气、水生植物种植等[10-13]生态治理技术得到广泛应用,且均取得了一定成效。但在实际应用中还需要依据每个湖泊的特点,因地制宜地选择相应的某种或者多种生态治理技术对湖泊进行治理。
温州大学明心湖是一个小型人工湖,占地面积约20 000 m2,平均水深0.50 m,因在湖中养有黑天鹅等水禽,又称“天鹅湖”。近年来,明心湖水体富营养化问题日趋严重,湖水透明度低且TN、TP、COD等多项指标高于地表Ⅴ类标准,浮游植物大量繁殖聚集而形成水华。为提升明心湖景观、改善水质,学校于2020年4~5月实施了疏浚、曝气以及水生植物种植等多项生态治理措施。为探究此次生态治理工程的治理效果,本研究分别对工程治理前后的水质及浮游生物群落结构变化进行了为期6个月的连续监测,对明心湖的主要水源温瑞塘河河道进行了同步监测并以此作为对照进行对比分析;在对生态治理工程治理前后明心湖水质及浮游生物群落结构变化的监测分析的基础上,评估生态治理工程对小型富营养化湖泊的治理效果,旨在为此类小型人工湖的日常维护与生态治理治理提供参考样本和数据支持。
1. 研究区域与生态治理措施
1.1 研究区域
温瑞塘河位于瓯江以南、飞云江以北的温瑞平原,是温州市境内十分重要的河道水系。水源主要来自瞿溪、雄溪、郭溪以及大罗山和集云山的山涧溪流,整个流域面积740 km2,水面面积22 km2,灌溉面积3 213 km2。温瑞塘河水质满足Ⅳ类水要求的河段长度仅占15.0%,Ⅴ类及劣于Ⅴ类河段占85.0%,河床平均淤积层达0.8 m,最深达2.2 m,有大量的内源污染[14]。
明心湖位于浙江省温州市温州大学校园内,主要靠从旁边的温瑞塘河支流抽取河水进行补水。为了全面监治理前后明心湖水体理化指标及浮游生物群落的变化,在明心湖内设置了4个采样位点 ,分别为位点1# (27°55′02″N, 120°41′48″E)、位点2# (27°55′03″N, 120°41′46″E)、位点3# (27°55′03″N, 120°41′45″E)、位点4# (27°55′05″N, 120°41′44″E)。此外,由于明心湖补水主要从旁边的温瑞塘河抽取,所以在温瑞塘河河道内也设置了4个采样位点作为对照,分别为位点5# (27°55′12″N, 120°41′41″E)、位点6# (27°55′09″N, 120°41′46″E)、位点7#(27°55′05″N, 120°41′52″E)、位点8# (27°55′01″N, 120°41′57″E)。
1.2 明心湖生态治理措施
理治措施主要包括3方面: 将湖中水体排空,对湖底进行冲洗并清淤,厚度约0.20 m,清除明心湖底表层沉积物,防止沉积物中营养盐再次向上覆水体释放; 从温瑞塘河支流中抽取河水,经砂砾过滤后注入湖中,水深达到0.50 m左右,在湖底种植莲属植物(荷花、睡莲)、苦草和轮叶黑藻等水生植物,种植面积约占湖底面积的80%,以改善景观并利用水生植物吸收水体中的营养盐与污染物,净化水质并恢复水体生态功能; 禁养黑天鹅等水禽并采用喷泉曝气机进行曝气,以减少有机污染源并增加水体溶解氧含量,从而提高有机污染物的氧化降解速率。采用以上生态治理措施对明心湖治理后,温州大学明心湖的景观改善显著,水生植物生长状况良好、水生动物丰富度增加、生态系统质量优良。
2. 样品的采集与分析方法
2.1 样品的采集与处理
参照《水质采样方案设计技术规定:HJ 495—2009》和《水质采样技术指导:HJ 494—2009》的相关要求,依据《水质样品的保存和管理技术规定:HJ 493—2009》相关规范,采用便携式多参数水质分析仪 (HACHHQ40d,哈希,美国) 现场测定水温、pH、DO;采用便携式电导率仪 (DDBJ-350F,上海雷磁,中国) 现场测定电导率;采用塞氏黑白盘测定SD;采用丙酮法测定Chl-a质量浓度;采用重铬酸盐法测定COD;采用碱性过硫酸钾消解紫外分光光度法测定TN质量浓度;采用过硫酸钾消解钼酸铵分光光度法测定TP质量浓度;采用分光光度法测定NO3-N质量浓度;采用纳氏试剂分光光度法测定NH4+-N质量浓度;采用钼酸铵分光光度法测定PO43-P质量浓度。
2.2 浮游植物样品
浮游植物样品采集方法参照章宗涉等[15]的研究。在采集样品过程中,使用伸缩杆控制网孔直径为0.064 mm的25号浮游生物网,在水面以“∞”状拖动浮游生物网,重复多次。采集的水样装入50 mL聚乙烯样品瓶,加入样品体积2%~4%的甲醛溶液固定保存样品,用于浮游植物的定性检测。用采水器采集水样1 L,注入聚乙烯样品瓶中并加入15 mL鲁哥氏液 (Lugol’s solution) 及样品体积2%~4%的甲醛溶液混匀,用于浮游植物样品的固定保存与定量检测。浮游植物定量检测时,充分摇匀后,吸取0.1 mL水样置于0.1 mL浮游生物计数框内 (面积为20 mm×20 mm),在10×40倍光学显微镜下进行计数。浮游植物丰度的计算,见式 (1):
stringUtils.convertMath(!{formula.content}) (1) 式中:N为1 L水样中浮游植物个体数,个/mL(浮游动、植物细胞以“个”计数) ;V为水样体积 ,mL;Vs为浓缩样体积,mL;Va为计数体积,mL;n为计数所获得的个体数。浮游植物生物量浓度采用各种浮游植物的平均质量乘以丰度来计算,平均质量的计算参照《湖泊生态调查观测与分析》中的方法。
2.3 不同类群浮游植物相对丰度的确定
本研究采用Phyto-PAM浮游植物分析仪 (Heinz Walz GmbH,Effeltrich,Germany) 测定水样的Chl-a浓度,并将水样中的浮游植物按照蓝藻、绿藻、褐藻 (硅藻+甲藻) 种群进行群落类型的区分[16-18]。
2.4 浮游动物样品
使用伸缩杆控制25号浮游生物网做“∞”字形运动,缓慢拖动3~5 min,将样品用100 mL聚乙烯样品瓶收集,并立即加入样品体积3%~5%的甲醛溶液,用于浮游动物的定性检测。定量样品用2 L采水器采集,采集水样总计20 L。所有水样经25 号浮游生物网过滤后,用1 L聚乙烯样品瓶收集,之后加入甲醛溶液固定。带回实验室静置24 h,浓缩至100 mL后,倒置显微镜下鉴定并计数。浮游动物丰度的计算方法与浮游植物丰度的计算方法相同。浮游动物生物量浓度采用各类群浮游动物的平均质量乘以丰度来计算。平均质量参照《淡水浮游动物的定量方法》中的方法。
2.5 数据统计与分析
采用 SPSS 22.0软件对水质参数进行单因素方差分析 (One-way ANOVA),以检验各采样点之间水环境因子是否存在显著差异。采用OriginPro 2020进行浮游植物与水质相关性分并绘图。采用优势度 Y 来表征浮游动、植物种类结构特征,计算方法,见式 (2) :
stringUtils.convertMath(!{formula.content}) (2) 式中:N为样品中所有种的细胞总数;Ni为样品中第i种的细胞数;fi为第i种在各采样点出现的频率。取浮游生物优势度 Y ≥ 0.02为优势种[19]。
3. 结果与讨论
3.1 生态治理前后明心湖水质的变化
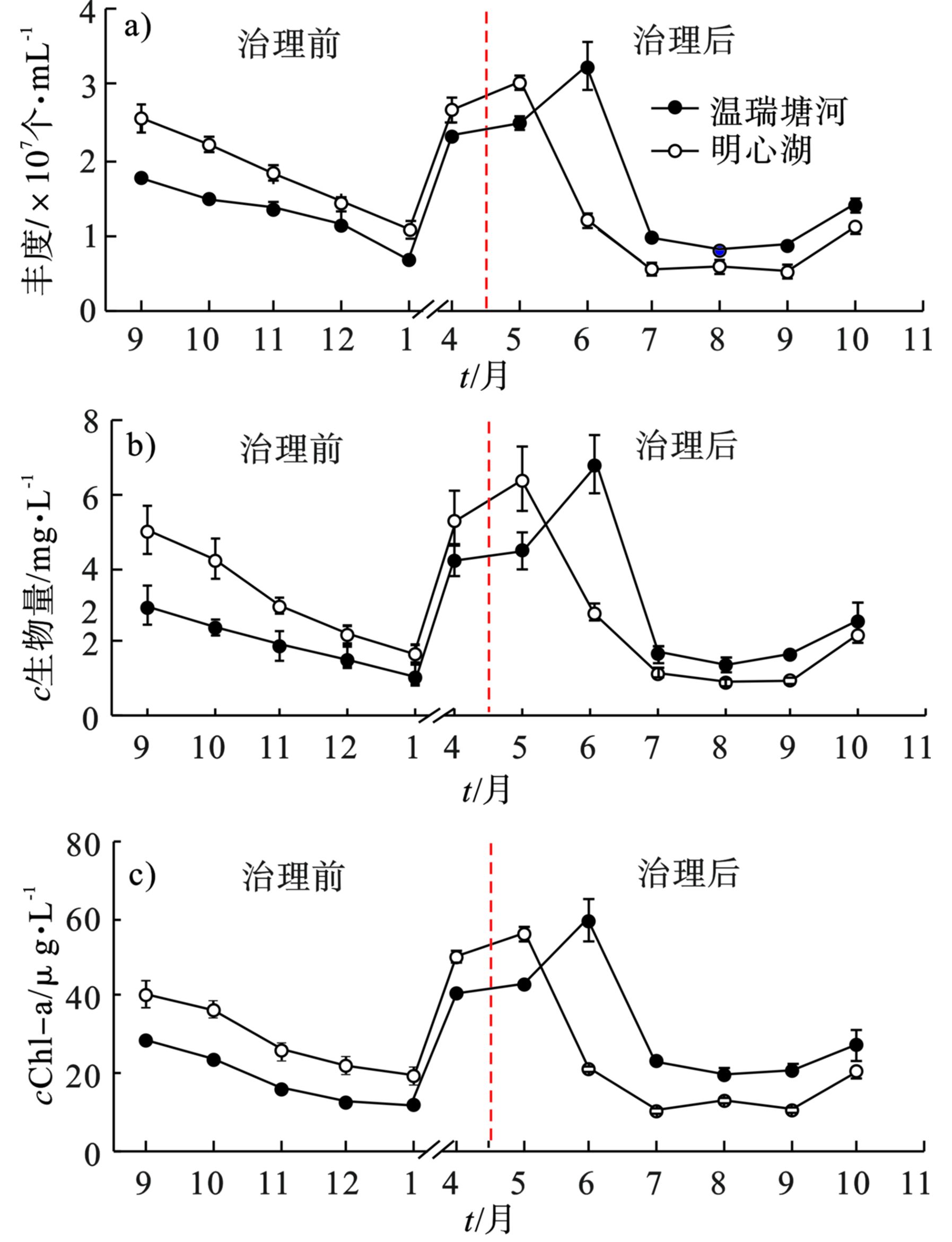
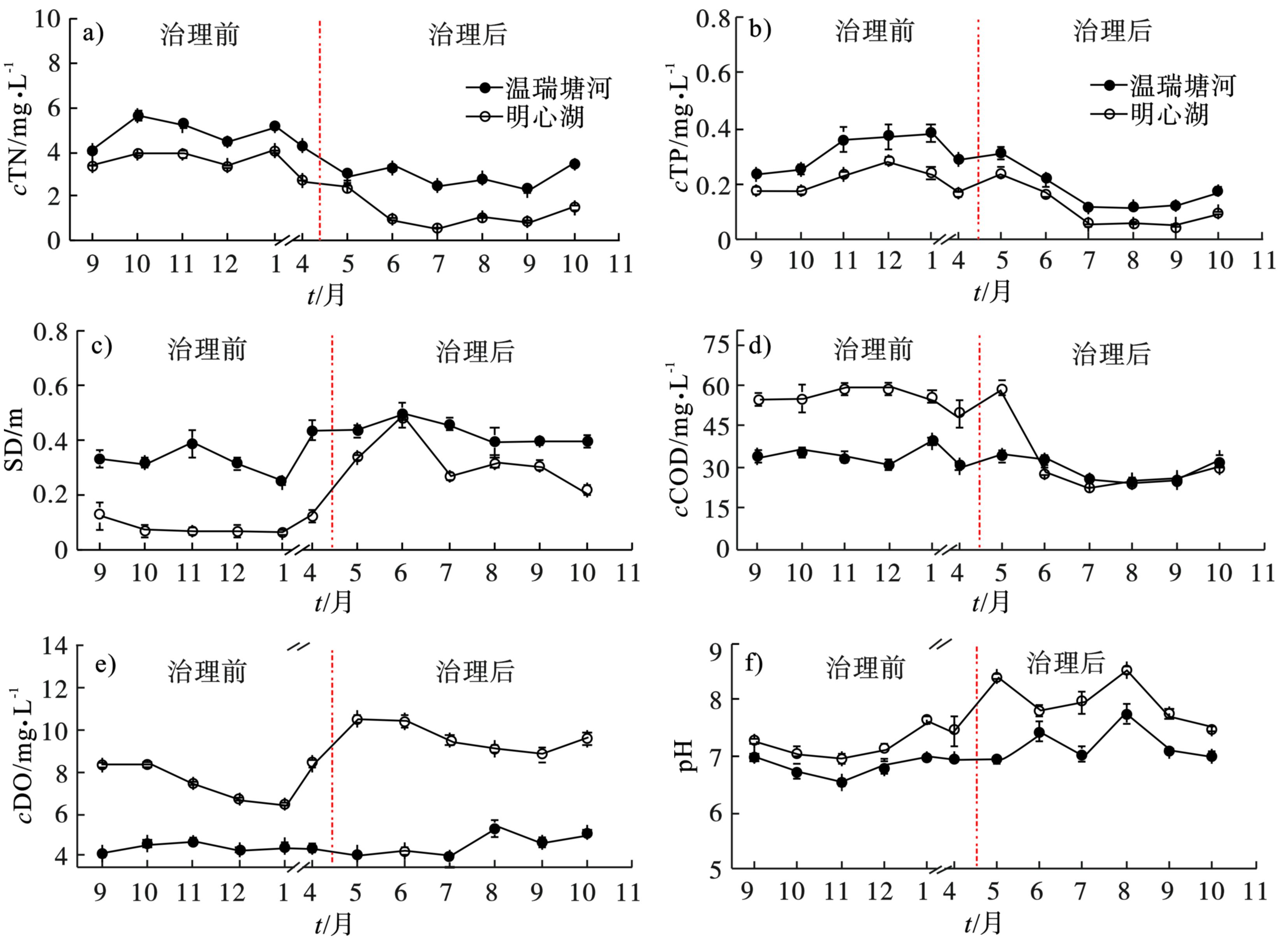
检测结果表明,生态治理后,明心湖水体透明度显著升高,有机污染物含量显著下降,水质明显改善。明心湖和温瑞塘河治理前水质的变化,见图1。
图1 可知,治理后,明心湖表层水体的COD、TN、TP显著 (P<0.05) 下降。根据《地表水环境质量标准:GB 3838—2002》,治理后明心湖水体的TN平均质量浓度由Ⅴ类水水平 (>2.00 mg/L) 降至Ⅱ类水水平 (0.50~1.00 mg/L);TP平均质量浓度由Ⅴ类水水平 (0.20 mg/L)降至Ⅲ类水水平 (0.05 mg/L);平均COD由Ⅴ类水水平 (>40.00 mg/L)降至Ⅲ类水水平(20.00~30.00 mg/L),显示出了较好的治理效果。已有研究[20]表明,水生植物种植等生态治理措施能有效去除水体中的重金属、营养盐、有机与无机污染物,从而使湖泊的水质得到改善。
此外,SD平均值由治理前的0.14 m上升至0.31 m以上,DO平均质量浓度由治理前的7.06 mg/L上升至10.53 mg/L,而pH平均值由7.28上升至8.10。SD的显著 (P<0.05) 提升可能与底泥疏浚与水生植物种植有关[21]。水生植物可以通过吸附和过滤作用,降低生物性和非生物性悬浮物,增加透明度,净化水质[22];此外,其还可通过与浮游植物竞争营养物质和生长空间,形成遮光效应并分泌克藻物质,可以很好地抑制浮游藻类的过量繁殖,减少水华的暴发,维持较高的生物多样性和健康的水环境[23]。生态治理后,明心湖水体的DO显著 (P<0.05) 升高,这可能与曝气及禁养水禽后水体中有机污染物含量降低有关。
3.2 生态治理前后明心湖浮游植物群落结构的变化
治理措施对明心湖浮游植物群落结构起到了改善作用。治理前后明心湖和温瑞塘河浮游植物的变化,见图2。
图2可知,治理前,明心湖中的浮游植物丰度、生物量和Chl-a质量浓度均显著 (P<0.05) 高于温瑞塘河,且变化趋势相似。治理前明心湖中的浮游植物的平均丰度为1.40×107 个/mL,平均生物量为3.14 mg/L,平均Chl-a质量浓度为28.34 µg/L;温瑞塘河中的平均浮游植物丰度为1.20×107 个/mL,平均生物量为3.37 mg/L,平均Chl-a质量浓度为18.25 µg/L。治理后,除5月份外,明心湖中的浮游植物丰度、生物量和Chl-a质量浓度均低于温瑞塘河,分别降低了17%、14%、18%。通常情况下,清洁水体中浮游植物的种类较多,而生物量较小[24-25]。治理后,明心湖中的浮游植物丰度、生物量及Chl-a质量浓度均显著 (P<0.05) 降低。已有研究[18, 26-27]表明,浮游植物丰度与水温、TN、TP、COD之间呈显著相关。
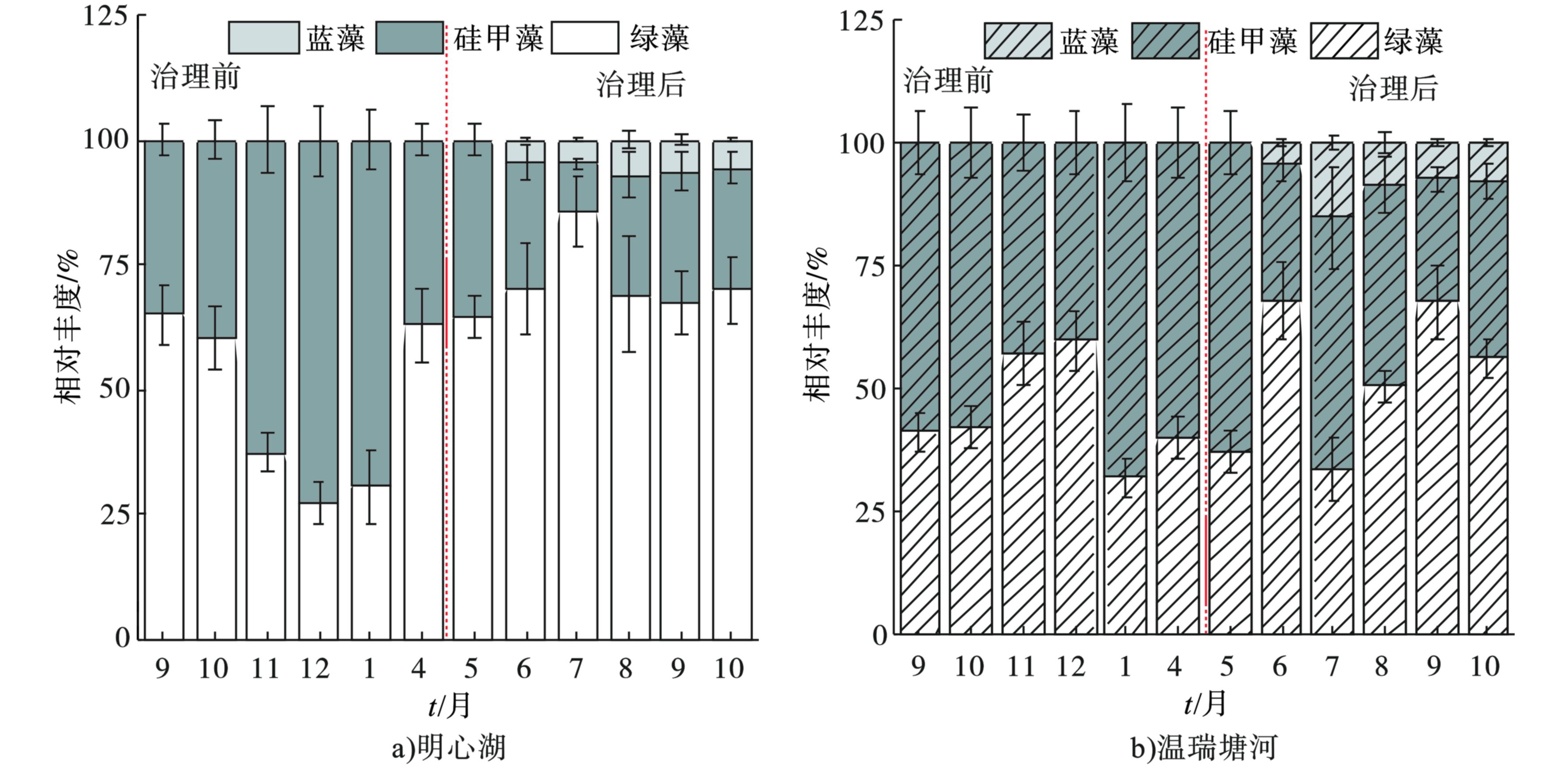
以不同类群浮游藻类即蓝藻、绿藻、硅藻的Chl-a含量与水体中总Chl-a含量的比值随时间的变化表示各种群相对丰度在一年中的消长状况,结果表明,明心湖和温瑞塘河的浮游植物全年以绿藻和硅藻为主,蓝藻主要在夏秋季出现,并且占比很小 。治理前后明心湖和温瑞塘河表层水体中浮游植物种群相对丰度的变化,见图3。
图3可知,治理前,明心湖和温瑞塘河的绿藻平均相对丰度分别为50%和45%,硅藻的平均相对丰度分别为50%和55%,未出现蓝藻。治理后,明心湖和温瑞塘河绿藻的平均相对丰度分别为69%和51%,硅藻的平均相对丰度分别为27%和42%,蓝藻的平均相对丰度分别为4%和7%。这表明生态治理后明心湖的水体更适宜绿藻生长。此外,明心湖和温瑞塘河全年的浮游植物群落类型为绿藻-硅藻型。
治理后,明心湖中绿藻种群的相对丰度显著增加 。监测结果表明,治理后绿藻单角盘星藻和空球藻的丰度和优势度显著 (P<0.05) 增加 ,见表2。文献[28-30]表明,曝气引起的浮游植物在垂直方向上的重新分布有利于浮游植物获取光和营养,能够显著提升绿藻和硅藻种群的生长。一般来说,硅藻的最佳生长温度为5~20 ℃ ,绿藻为15~30 ℃,而蓝藻在温度30 ℃以上也可以较好地生长[31-32]。因此,在春夏季节交替时,随着水温的升高,绿藻丰度会增加[33-34],相对丰度也会相应提高。治理前后,明心湖浮游植物种类数变化微小,且与温瑞塘河一致性较强。这可能是由于明心湖经常抽取温瑞塘河的河水进行补水所致。有研究[35-36]表明,引水水源与湖泊水质和浮游生物有显著相关性。而明心湖和温瑞塘河均在夏秋季节出现少量蓝藻,这也与已有的研究结果[18]一致。
表 2 治理前后明心湖和温瑞塘河浮游动物优势种及其优势度的变化门类 优势种 治理前 治理后 明心湖 温瑞塘河 明心湖 温瑞塘河 轮虫 矩形龟甲轮 Keratella quadrata 0.05 0.06 0.04 0.20 针簇多肢轮 Polyarthra trigla 0.12 0.20 0.13 0.05 壶状臂尾轮 Brachionus urceus 0.20 - 0.02 0.03 晶囊轮 Asplanchna 0.06 0.08 0.06 0.11 真翅多肢 Polyarthra euryptera - 0.08 0.03 0.06 截头皱甲轮 Ploesoma truncatum - 0.04 0.02 0.11 长三肢轮 Filinia longiseta - - 0.04 0.05 脾状四肢轮 Tetramastix opoliensis - - 0.11 0.04 圆筒异尾轮 Trichcerca cylindrica - - 0.05 - 萼花臂尾轮 Brachionus calyciflorus 0.02 0.04 0.03 0.11 独角聚花轮 Conochilus unicornis - - - 0.06 枝角类 长肢秀体 Diaphanosoma leuchtenbergianum 0.08 0.07 0.03 0.04 微型裸腹 Moina micrura - 0.04 0.17 - 多刺裸腹 Moina macrocopa 0.03 0.03 0.04 0.03 长额象鼻 Bosmina longirostris 0.02 0.09 0.06 0.08 平突船卵 Scapholeberis kingi 0.21 - - - 桡足类 近邻剑水 Cyclops vicinus 0.02 0.03 0.03 0.03 广布中剑水 Mesocyclops leuckarti 0.02 0.06 0.03 0.06 注:“-”表示优势度未达到0.02。 治理前后,明心湖与温瑞塘河的浮游植物优势种均为硅藻和绿藻。治理前后明心湖和温瑞塘河浮游植物优势种及其优势度的变化,见表1。
表 1 治理前后明心湖和温瑞塘河浮游植物优势种及其优势度的变化门类 优势种 治理前 治理后 明心湖 温瑞塘河 明心湖 温瑞塘河 硅藻门 脆杆 Fragilaria sp. 0.04 0.07 0.02 0.09 针杆 Synedra sp. 0.03 0.06 0.02 0.04 桥弯 Cyclotella sp. 0.02 0.03 - - 异极 Gomphonema sp. 0.03 0.02 0.02 - 变异直链 Aulacoseira varians 0.04 0.06 0.03 0.03 小环 Cyclotella sp. 0.04 0.06 0.04 0.03 舟形 Navicula sp. 0.04 - - 0.02 颗粒直链 Aulacoseira granulate 0.09 0.09 0.09 0.09 绿藻门 衣 Chlamydomonas sp. 0.02 0.04 0.03 0.03 空球 Eudorina sp. 0.03 - 0.09 - 弓形 Schroederia sp. 0.02 - 0.02 - 小球 Chlorella sp. - 0.03 0.02 0.02 针形纤维 Ankistrodesmus acicularis 0.03 0.03 0.02 - 单角盘星 Pediastrum simplex 0.06 - 0.09 0.05 二形栅 Scenedesmusdimorphus 0.02 0.04 0.02 - 二尾栅 Scenedesmus bicauda 0.02 0.03 - - 四尾栅 Scenedesmus quadricauda 0.04 0.05 0.03 0.03 四足十字 Crucigenia tetrapedia 0.03 - - - 新月 Closterium sp. 0.03 0.03 0.02 - 纺锤 Elakatothrix sp. - - - 0.02 鼓 Cosmarium sp. 0.04 0.03 0.02 0.02 隐藻门 隐 Cryptomonas sp. 0.05 0.05 0.03 - 裸藻门 裸 Euglena sp. - 0.07 - 0.03 梭形裸 Euglena acus - 0.06 - 0.08 裸囊 Trachelomonas sp. 0.02 0.04 - 0.04 蓝藻门 隐球 Aphanocapsa sp. - 0.05 - 0.04 注:“-”表示优势度未达到0.02。 表1可知,治理前,明心湖中优势度最大的浮游植物是颗粒直链藻 (Aulacoseira granulate) 和单角盘星藻 (Pediastrum simplex)、空球藻 (Eudorina sp.);温瑞塘河中优势度最大的浮游植物是脆杆藻 (Fragilaria sp.)和颗粒直链藻。治理后,明心湖与温瑞塘河浮游植物优势种仍有很多是相同的,包括脆杆藻、针杆藻 (Synedra sp.)、桥弯藻 (Cyclotella sp.)、变异直链藻 (Aulacoseira varians)、小环藻 (Cyclotella sp.)、衣藻 (Chlamydomonas sp.)、四尾栅藻 (Scenedesmus quadricauda)和鼓藻 (Cosmarium sp.) 等。但是优势度有较大差别,其中明心湖中脆杆藻和针杆藻的优势度显著 (P<0.05) 低于温瑞塘河。治理后,明心湖裸藻的优势度显著 (P<0.05) 降低,而单角盘星藻和空球藻优势度显著 (P<0.05) 增加。
3.3 生态治理前后明心湖浮游动物群落结构的变化
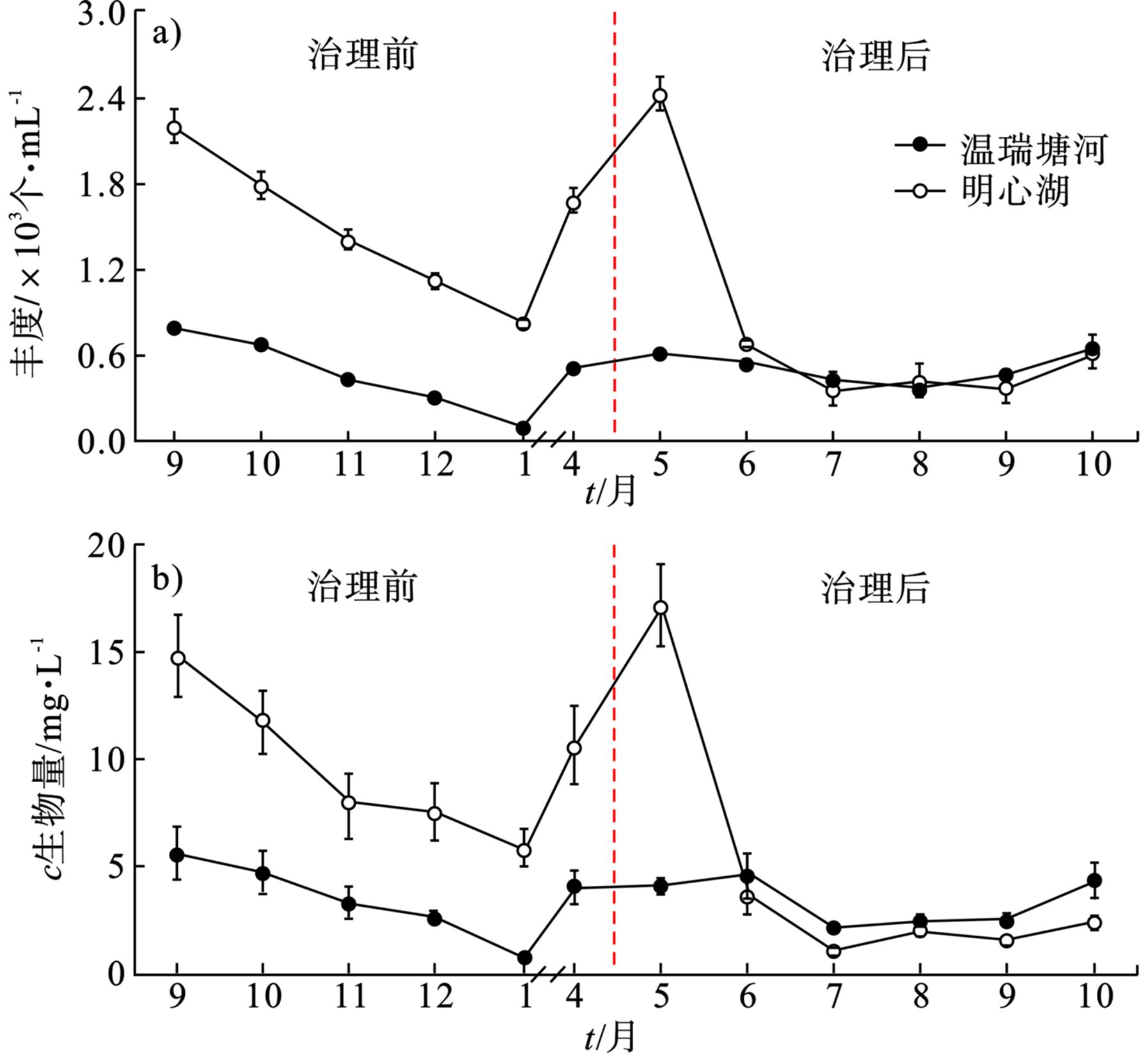
治理后明心湖浮游动物的丰度与生物量显著 (P<0.05) 降低 ,并且与水体中浮游植物丰度的变化趋势一致。治理前后明心湖和温瑞塘河中浮游动物丰度和浓度的变化,见图4。
治理前,明心湖中的浮游动物丰度 (图4a) 和生物量 (图4b) 均显著 (P<0.05) 高于温瑞塘河,其平均丰度分别为1 508.00和486.00个/L,平均生物量分别为9.60和3.47 mg/L。治理后,除了在5月份明心湖的浮游动物丰度和生物量显著 (P<0.05) 高于温瑞塘河外,其他月份均略低于温瑞塘河。治理后,明心湖和温瑞塘河中浮游动物的平均丰度分别为825.00和514.00个/L,平均生物量分别为4.63和3.25 mg/L。这可能与浮游动物种群丰度的变化主要受饵料供应调控有关[29, 37]。浮游动物是水体中较为敏感的环境指示生物[38],同时水体中其他环境因素 (如水温、溶解氧等,以及鱼类等) 对浮游动物的摄食压力都会对其群落结构产生重要影响[39-40]。
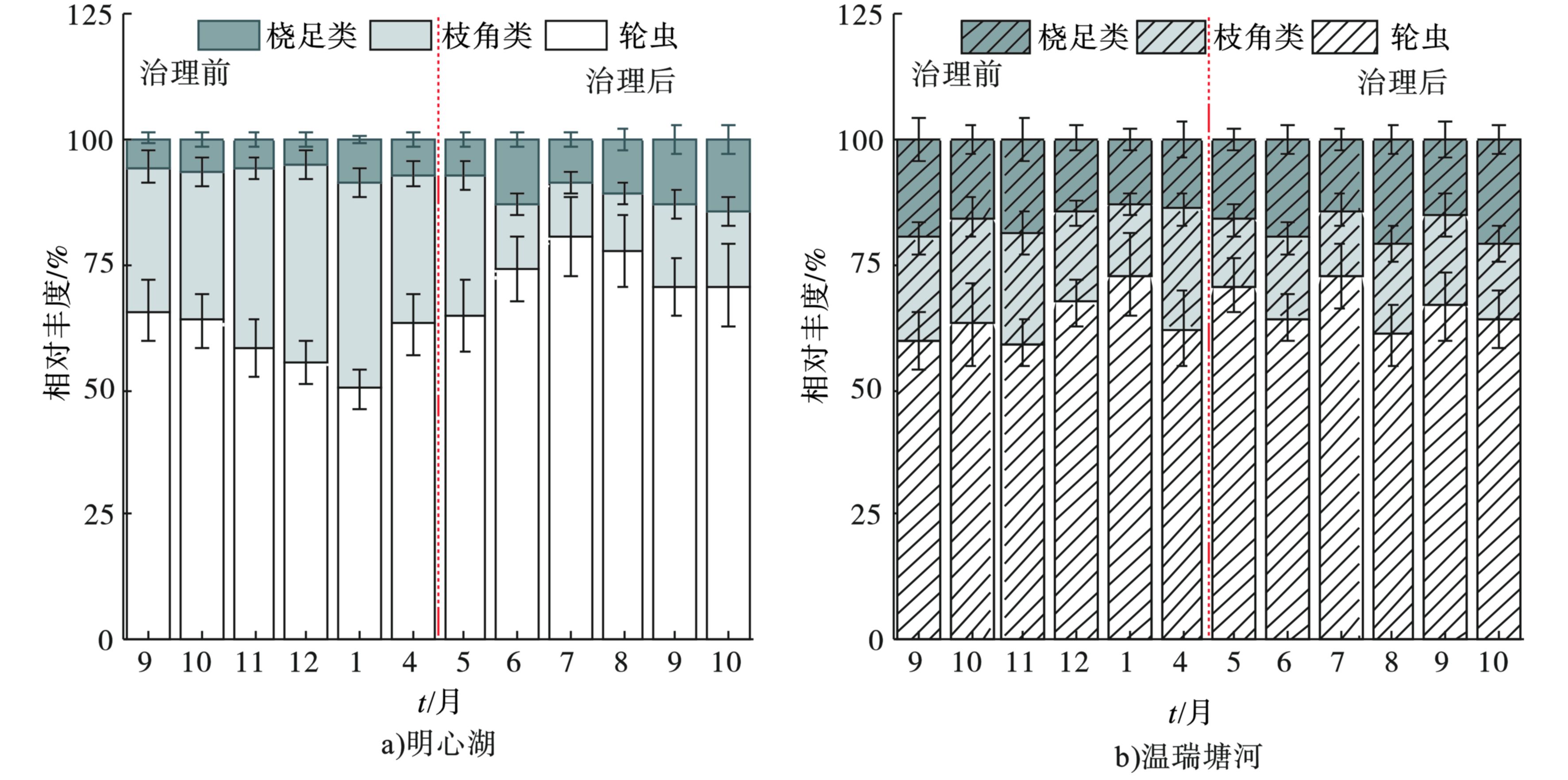
与温瑞塘河相比,治理后明心湖中的桡足类中近邻剑水蚤优势度显著增加。治理前后明心湖和温瑞塘河表层水体中浮游动物种群相对丰度的变化,见图5。
治理前,明心湖 (图5a) 与温瑞塘河 (图5b) 浮游动物相对丰度的变化均不显著 (P>0.05) ,且轮虫占比均较大。治理后,明心湖中桡足类占比有所增加,枝角类占比则有所降低,轮虫仍占绝对优势。治理前明心湖中桡足类、枝角类和轮虫类的平均相对丰度为7%、36%和57%,而治理后三者的平均相对丰度为11%、14%和75%。与之相对应,治理前,同一时段温瑞塘河中桡足类、枝角类和轮虫类的平均相对丰度为17%、22%和61%,而治理后同一时段三者的平均相对丰度为20%、15%和65%。
治理后,明心湖与温瑞塘河中浮游动物优势种的多样性有所增加。治理前后明心湖和温瑞塘河浮游动物优势种及其优势度的变化,见表2。
表2可知,治理前后,明心湖与温瑞塘河中浮游动物优势种均为轮虫和枝角类 ,且治理前后明心湖中优势度最大的浮游动物分别是平突船卵溞 (Scapholeberis kingi) 和螺形龟甲轮虫 (Keratella cochlearis);温瑞塘河中优势度最大的浮游动物分别是针簇多肢轮虫 (Polyarthra trigla) 和矩形龟甲轮虫 (Keratella quadrata)。治理前后,明心湖与温瑞塘河中相同的浮游动物优势种包括裂足臂尾轮虫 (Brachionus diversicornis)、裂痕龟纹轮虫 (Brachionus fissa)、螺形龟甲轮 、矩形龟甲轮虫、针簇多肢轮虫、萼花臂尾轮虫 (Brachionus calyciflorus)、长肢秀体溞 (Diaphanosoma leuchtenbergianum)、近邻剑水蚤 (Cyclops vicinus)和广布中剑水蚤 (Mesocyclops leuckarti)等。治理后,明心湖中枝角类平突船卵溞和长肢秀体溞的优势度显著 (P<0.05) 降低,而长额象鼻溞 (Bosmina longirostris) 和多刺裸腹溞 (Moina macrocopa) 的优势度有所增加。治理后,明心湖与温瑞塘河中浮游动物优势种的多样性有所增加,这可能与水质改善有关。水体富营养化会降低浮游动物的物种多样性,抑制非耐污种的生长[41-42]。治理前后,轮虫的相对丰度在温瑞塘河与明心湖中均占比较高 ,见图5,壶状臂尾轮虫 (Brachionus urceus) 优势度显著 (P<0.05) 降低。耐污的枝角类平突船卵溞、长肢秀体溞以及壶状臂尾轮虫丰度的优势度的降低(图5 b, 表3) 可能也与水质改善有关。枝角类作为浮游甲壳动物的一种,广泛分布在淡水中,经常在在富营养化的水体中大量暴发,当水体富营养化程度降低时,暴发情况会减弱[5, 43]。如耐污种微型裸腹溞,一定程度上可以作为判别水体富营养化程度的指示生物[44]。在对江苏省宜兴市的临溪河进行生态治理后,该水体中的轮虫优势种由治理前的壶状臂尾轮虫等耐污种转变为了针簇多肢轮虫等寡污种[45]。
4. 结论
(1)生态治理治理后,温州大学明心湖的水质得到了明显改善,COD、TN 、生物量和TP质量浓度显著降低,DO、SD和pH显著上升,表明生态治理对该类型湖泊的水质改善效果较好。
(2)治理后,浮游植物种类及优势种变化不显著,但浮游植物丰度、浓度和Chl-a质量浓度显著降低。同时,绿藻的相对丰度显著增加,单角盘星藻和空球藻等绿藻的优势度显著上升,表明治理后水质改善有利于绿藻的生长。
(3)治理后,浮游动物的丰度和生物量均显著降低,枝角类的相对优势度显著下降。而桡足类和轮虫类的相对丰度显著增加。这表明水质改善及浮游植物丰度的变化对浮游动物种群具有调控作用。
-
-
[1] DALU T, WASSERMAN R J, MAGORO M L, et al. River nutrient water and sediment measurements inform on nutrient retention, with implications for eutrophication[J]. Science of the Total Environment, 2019, 684(9): 296-302. [2] MOHSENPOUR S F, HENNIGE S, N WILLOUGHBY, et al. Integrating micro-algae into wastewater treatment: A review[J]. Science of the Total Environment, 2021, 752: 142168. doi: 10.1016/j.scitotenv.2020.142168 [3] ABOU-SHANAB R A I, JI M K, KIM H C, et al. Microalgal species growing on piggery wastewater as a valuable candidate for nutrient removal and biodiesel production[J]. Journal of Environmental Management, 2013, 115(1): 257-264. [4] CHINNASAMY S, BHATNAGAR A, CLAXTON R, et al. Biomass and bioenergy production potential of microalgae consortium in open and closed bioreactors using untreated carpet industry effluent as growth medium[J]. Bioresource Technology, 2010, 101(17): 6751-6760. doi: 10.1016/j.biortech.2010.03.094 [5] CHRISTENSON L, SIMS R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances, 2011, 29(6): 686-702. doi: 10.1016/j.biotechadv.2011.05.015 [6] SUTHERLAND D L, RALPH P J. Microalgal bioremediation of emerging contaminants Opportunities and challenges[J]. Water Research, 2019, 164(11): 114921. [7] LI X, HU H Y, GAN K, et al. Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake, and lipid accumulation of a freshwater microalga Scenedesmus sp.[J]. Bioresource Technology, 2010, 101(14): 5494-5500. doi: 10.1016/j.biortech.2010.02.016 [8] ZAMBRANO J, KRUSTOK I, NEHRENHEIM E, et al. A simple model for algae-bacteria interaction in photo-bioreactors[J]. Algal Research, 2016, 19: 155-161. doi: 10.1016/j.algal.2016.07.022 [9] ZHU L, WANG Z, SHU Q, et al. Nutrient removal and biodiesel production by integration of freshwater algae cultivation with piggery wastewater treatment[J]. Water Research, 2013, 47(13): 4294-4302. doi: 10.1016/j.watres.2013.05.004 [10] CHO D H, RAMANAN R, HEO J, et al. Enhancing microalgal biomass productivity by engineering a microalgal-bacterial community[J]. Bioresource Technology, 2015, 175: 578-585. doi: 10.1016/j.biortech.2014.10.159 [11] DE-BASHAN L E, HERNANDEZ J P, MOREY T, et al. Microalgae growth-promoting bacteria as "helpers" for microalgae: A novel approach for removing ammonium and phosphorus from municipal wastewater[J]. Water Research, 2004, 38(2): 466-474. doi: 10.1016/j.watres.2003.09.022 [12] HERNANDEZ D, RIANO B, COCA M, et al. Treatment of agro-industrial wastewater using microalgae–bacteria consortium combined with anaerobic digestion of the produced biomass[J]. Bioresource Technology, 2013, 135: 598-603. doi: 10.1016/j.biortech.2012.09.029 [13] HIGGINS B T, INGRID G, FITZGERALD P S, et al. Algal–bacterial synergy in treatment of winery wastewater[J]. NPJ Clean Water, 2018, 1(1): 6-10. doi: 10.1038/s41545-018-0005-y [14] NGUYEN T, NGUYEN T T, BINH Q A, et al. Co-culture of microalgae-activated sludge for wastewater treatment and biomass production: Exploring their role under different inoculation ratios[J]. Bioresource Technology, 2020, 314: 123754. doi: 10.1016/j.biortech.2020.123754 [15] POSADAS E, PA G, SOLTAU A, et al. Carbon and nutrient removal from centrates and domestic wastewater using algal–bacterial biofilm bioreactors[J]. Bioresource Technology, 2013, 139: 50-58. doi: 10.1016/j.biortech.2013.04.008 [16] SU Y, MENNERICH A, URBAN B. Municipal wastewater treatment and biomass accumulation with a wastewater-born and settleable algal-bacterial culture[J]. Water Research, 2011, 45(11): 3351-3358. doi: 10.1016/j.watres.2011.03.046 [17] CAO W X, WANG X, SUN S Q, et al. Simultaneously upgrading biogas and purifying biogas slurry using cocultivation of Chlorella vulgaris and three different fungi under various mixed light wavelength and photoperiods[J]. Bioresource Technology, 2017, 241(10): 701-709. [18] CHEN J, DING L, LIU R, et al. Hydrothermal carbonization of microalgae-fungal pellets: Removal of nutrients from the aqueous phase fungi and microalgae cultivation[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(45): 16823-16832. [19] DASH A, BANERJEE R. Enhanced biodiesel production through phyco-myco co-cultivation of Chlorella minutissima and Aspergillus awamori: An integrated approach[J]. Bioresource Technology, 2017, 238(8): 502-509. [20] GUO G, CAO W, SUN S, et al. Nutrient removal and biogas upgrading by integrating fungal–microalgal cultivation with anaerobically digested swine wastewater treatment[J]. Journal of Applied Phycology, 2017, 29(6): 2857-2866. doi: 10.1007/s10811-017-1207-2 [21] NAIM, RASHID, WON-KUN, et al. Binary culture of microalgae as an integrated approach for enhanced biomass and metabolites productivity, wastewater treatment, and bioflocculation[J]. Chemosphere, 2018, 194(5): 67-75. [22] SIRASIT S, ARUNOTHAI C, SUPAVADEE C, et al. A rapid method for harvesting and immobilization of oleaginous microalgae using pellet-forming filamentous fungi and the application in phytoremediation of secondary effluent[J]. International Journal of Phytoremediation, 2018, 20(10): 1017-1024. doi: 10.1080/15226514.2018.1452187 [23] YANG L, LI H, WANG Q. A novel one-step method for oil-rich biomass production and harvesting by co-cultivating microalgae with filamentous fungi in molasses wastewater[J]. Bioresource Technology, 2019, 275: 35-43. doi: 10.1016/j.biortech.2018.12.036 [24] ZHAO Y, GUO G, SUN S, et al. Co-pelletization of microalgae and fungi for efficient nutrient purification and biogas upgrading[J]. Bioresource Technology, 2019, 289: 121656. doi: 10.1016/j.biortech.2019.121656 [25] ZHOU K, ZHANG Y, JIA X. Co-cultivation of fungal-microalgal strains in biogas slurry and biogas purification under different initial CO2 concentrations[J]. Scientific Reports, 2018, 8(1): 7786. doi: 10.1038/s41598-018-26141-w [26] ZHOU W, CHENG Y, YUN L, et al. Novel fungal pelletization-assisted technology for algae harvesting and wastewater treatment[J]. Appllied Biochemistry and Biotechnology, 2012, 167(2): 214-228. doi: 10.1007/s12010-012-9667-y [27] DONG Q L, ZHAO X M. In situ carbon dioxide fixation in the process of natural astaxanthin production by a mixed culture of Haematococcus pluvialis and Phaffia rhodozyma[J]. Catalysis Today, 2004, 98(4): 537-544. doi: 10.1016/j.cattod.2004.09.052 [28] REN Y, DENG J, HUANG J, et al. Using green alga Haematococcus pluvialis for astaxanthin and lipid co-production: Advances and outlook[J]. Bioresource Technology, 2021, 340: 125736. doi: 10.1016/j.biortech.2021.125736 [29] HAGUE, F, DUTTA A, THIMMANAGARI M, et al. Integrated Haematococcus pluvialis biomass production and nutrient removal using bioethanol plant waste effluent[J]. Process Safety and Environmental Protection, 2017, 111(10): 128-137. [30] LEDDA C, TAMIAZZO J, BORIN M, et al. A simplified process of swine slurry treatment by primary filtration and Haematococcus pluvialis culture to produce low cost astaxanthin[J]. Ecological Engineering, 2016, 90: 244-250. doi: 10.1016/j.ecoleng.2016.01.033 [31] PAN M, ZHU X, PAN G, et al. Integrated valorization system for simultaneous high strength organic wastewater treatment and astaxanthin production from Haematococcus pluvialis[J]. Bioresource Technology, 2021, 326: 124761. doi: 10.1016/j.biortech.2021.124761 [32] WU Y H, YANG J, HU H Y, et al. Lipid-rich microalgal biomass production and nutrient removal by Haematococcus pluvialis in domestic secondary effluent[J]. Ecological Engineering, 2013, 60(11): 155-159. [33] SHAHID A, MALIK S, ZHU H, et al. Cultivating microalgae in wastewater for biomass production, pollutant removal, and atmospheric carbon mitigation; a review[J]. Science of the Total Environment, 2020, 704: 135303. doi: 10.1016/j.scitotenv.2019.135303 [34] FERGOLA P, CERASUOLO M, POLLIO A, et al. Allelopathy and competition between Chlorella vulgaris and Pseudokirchneriella subcapitata: Experiments and mathematical model-ScienceDirect[J]. Ecological Modelling, 2007, 208(2): 205-214. [35] JEMLI M, ALOUINI Z, SABBAHI S, et al. Destruction of fecal bacteria in wastewater by three photosensitizers[J]. Journal of Environmental Monitoring, 2002, 4(4): 511-516. doi: 10.1039/b204637g [36] LU Q, ZHOU W, MIN M, et al. Growing Chlorella sp. on meat processing wastewater for nutrient removal and biomass production[J]. Bioresource Technology, 2015, 198(12): 189-197. [37] XH A, YEMA B, AAHC D. Integration of sodium hypochlorite pretreatment with co-immobilized microalgae/bacteria treatment of meat processing wastewater[J]. Bioresource Technology, 2020, 304(5): 122953. [38] DONG Q L, LIN T Y, XING X Y, et al. Identification of a symbiotic fungus from blue–green alga and its extracellular polysaccharide[J]. Letters in Applied Microbiology, 2014, 58(4): 303-310. doi: 10.1111/lam.12192 [39] DONG Q, DONG R, XING X, et al. A new antibiotic produced by the cyanobacterium-symbiotic fungus Simplicillium lanosoniveum[J]. Natural Product Research, 2017, 32(1): 1348-1352. [40] 董庆霖, 王瑜琴, 邢向英, 等. 共生真菌Simplicillium lanosoniveum促进衣藻生长和脂类合成[J]. 微生物学通报, 2018, 45(12): 2639-2647. [41] 董庆霖, 陈博, 邢向英, 等. 一株蓝藻内生真菌的鉴定及其产物抑菌活性[J]. 化工学报, 2011, 62(6): 1656-1661. doi: 10.3969/j.issn.0438-1157.2011.06.027 [42] DONG Q S, WANG H, XING X Y, et al. Identification and characterization of a special species of Paecilomyces[J]. Annals of Microbiology, 2012, 62(4): 1587-1592. doi: 10.1007/s13213-011-0414-3 [43] 董庆霖, 王瑶, 邢向英, 等. 淡紫拟青霉TD16促进雨生红球藻生长和油脂合成的研究[J]. 中国油脂, 2019, 44(8): 102-108. [44] HOLMES B, PADDOCK M B, VANDERGHEYNST J S, et al. Algal photosynthetic aeration increases the capacity of bacteria to degrade organics in wastewater[J]. Biotechnology and Bioengineering, 2019, 117(1): 62-72. [45] MAKUT B B, DAS D, GOSWAMI G. Production of microbial biomass feedstock via co-cultivation of microalgae-bacteria consortium coupled with effective wastewater treatment: A sustainable approach[J]. Algal Research, 2019, 37: 228-239. doi: 10.1016/j.algal.2018.11.020 [46] MOUGET J L, DAKHAMA A, LAVOIE M C, et al. Algal growth enhancement by bacteria: Is consumption of photosynthetic oxygen involved?[J]. FEMS Microbiology Ecology, 1995, 18(9): 35-43. [47] ZAMALLOA C, VULSTEKE E, ALBRECHT J, et al. The techno-economic potential of renewable energy through the anaerobic digestion of microalgae[J]. Bioresource Technology, 2010, 102(2): 1149-1158. [48] HIGUERA-CIAPARA I, FELIX-VALENZUELA L, GOYCCOLEA F M. Astaxanthin: A review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196. doi: 10.1080/10408690590957188 [49] DONG Q L, ZHAO X M, MA H W, et al. Metabolic flux analysis of the two astaxanthin-producing microorganisms Haematococcus pluvialis and Phaffia rhodozyma in the pure and mixed cultures[J]. Biotechnology Journal:Healthcare Nutrition Technology, 2006, 1(11): 1283-1292. -






 下载:
下载: