-
石油、化工、印刷、制药等工业生产会产生大量含芳香族化合物废气[1]。苯是一种芳香族化合物,是大气光化学污染的重要反应物,亦是臭氧和二次有机气溶胶(secondary organic aerosols,SOA)的关键前体物[2]。生物技术因其绿色安全、处理效果好、运行费用低、操作简单等优点,已成为近年来大气污染控制技术的研究热点[3-4]。相比于生物滴滤和生物过滤技术,生物洗涤技术具有压降小、驯化周期短、不易酸化、不易堵塞、高污染物负荷、抗负荷冲击能力强等优点[5-8]。生物洗涤器内含微生物的活性污泥对降解污染物起关键作用。将活性污泥驯化后可提升其降解能力,然而针对目标污染物的有效微生物比例和活性一般较低,缓慢的演替过程亦会导致反应器启动时间长、处理难降解物质的能力有限[9]。因此,筛选高效降解菌株,探究其降解能力、适宜条件及代谢途径十分重要。
目前,已发现Pseudomonas sp.,Rhodococcus sp.,Klebsiella sp.,Alcaligenes xylosoxidans Y234.和Pseudomonas putida.等菌株对苯具良好的降解能力[10-13]。然而,在单一苯降解高效菌株降解复杂疏水性化合物时,由于代谢途径单一、反应速率有限,积累的中间代谢产物易毒害微生物[14-15]。混合菌群内的不同种群间代谢酶与代谢途径互补,可减少中间产物的积累效应,且污染物易矿化完全[16-18],从而使得复合菌系统具有降解效率高、抗冲击能力强、可实现多元污染物共处理等优势[19-20]。因此,可研究复合菌系统降解苯的菌落结构及降解条件,为苯的生物法处理提供参考。
在有氧情况下,好氧菌对苯系物代谢途径一般为,先在氧分子及加氧酶的作用下形成邻苯二酚或其衍生物的代谢中间体,然后在过氧分子及开环酶的作用下进行邻位切割或间位切割,使其形成直链分子,最后再进入三羧酸(tricarboxylic acid,TCA)循环[21]。在降解较复杂化合物时,中间代谢产物容易积累,降低反应速率且易对微生物造成毒害[14-15]。本研究拟通过筛选出高效苯降解优势菌,考察其最佳苯降解条件,探究其降解能力与代谢途径,以配制人工复合菌剂,并研究复合菌剂对活性污泥以及本实验室设计的泡沫生物洗涤反应器的影响,达到缩短反应器启动时间、提高去除效率、优化运行参数等目的,以期为人工复合菌剂强化生物洗涤法处理含苯废气提供参考。
-
1)固体培养基:蛋白胨10 g·L−1,牛肉膏3 g·L−1,氯化钠5 g·L−1,琼脂17 g·L−1,用5 mol·L−1 NaOH调pH为7.0。2)液体培养基:蛋白胨10 g·L−1,酵母提取物5 g·L−1,氯化钠10 g·L−1,用5 mol·L−1 NaOH调pH为7.0。3)液体无机盐培养基:(NH4)2SO4 1 g·L−1,K2HPO4 3.2 g·L−1,KH2PO4 0.4 g·L−1,MgSO4 0.2 g·L−1,NaCl 0.1 g·L−1,CaCl2 0.01 g·L−1,5 mol·L−1 NaOH调pH为7.0。4)营养液:尿素1 g·L−1,K2HPO4 3 g·L−1,CaCl2 5.5 g·L−1,MgSO4 4.5 g·L−1[22~25]。
-
采用处理含苯废气的生物洗涤塔内循环洗涤液作为菌种来源。生物洗涤塔运行条件:停留时间60~70 s、pH为6.8、气体流量为0.14 m3·h−1(气液比7∶1)。为从驯化污泥中筛选出功能细菌,以传代培养的方式进行菌群富集,取洗涤液200 mL加入装有营养液的1 L细口瓶中。以苯作为唯一碳源和能源进行驯化[26-27],苯的初始质量浓度为10 mg·L−1。在37℃的振荡培养箱中保存,以一定时间间隔取样,当苯的质量浓度降至起始质量浓度的50%以下时,进行下一代培养。同时,加大苯的初始质量浓度直至100 mg·L−1。富集后分别将驯化中的菌液稀释涂布在无机盐固体培养基中,获取单菌落后进行分离,以平板划线法对单菌落进行纯化。在无菌环境下,挑取试管中的一种菌接种到装有无机盐培养基的锥形瓶内,将接种好的锥形瓶塞好无菌棉,放在温度为30 ℃、转速120 r·min−1的条件下进行培养。当一种菌接种完毕后,进行下一个菌种的接种实验。重复以上操作直至所有菌种接种完毕。菌种富集、分离与纯化步骤较多,细节参考文献[25,28-29]。
-
1)形态学鉴定。菌株采用革兰氏染色后,利用显微镜进行形态观察。
2)分子生物学鉴定[29-30]。分别对100 mL液体培养基接种,接种量2%,置于30℃、转速150 r·min−1的恒温培养箱中培养至对数期,取4 mL菌液于离心管中,置于转速1 000 r·min−1的离心机中离心10 min,移去上层清液,留下菌体于−80℃冰箱中冷冻保存。每种细菌样本均有3个平行样。最后交由上海美吉生物医药科技有限公司进行菌种鉴定。
以菌株细胞基因组DNA为模板扩增16SrDNA。扩增采用细菌通用引物,PCR反应体系(20 μL)为:10 × Taq buffer 2.0 μL,5U Ex Taq 0.2 μL,2.5 mmol·L−1 dNTP Mix 1.6 μL,5P Primer1 1 μL,5P Primer2 1 μL,DNA 0.5 μL,ddH2O 13.7 μL。PCR 反应条件为:95℃预变性5 min;95℃ 30 s,56℃ 30 s,72℃ 1 min 30 s;第2步25次循环;72℃延伸10 min;4 ℃保存。在美国国立生物技术信息中心(nationalcenter for biotechnology information,NCBI)上通过使用BLAST (N)同源比对分析,并利用MEGA 7.0软件构建系统发育树。
-
气相中苯的浓度通过气相色谱-质谱(GC-MS)(7890B-5977 Agilent Technologies,US)进行浓度测定和产物定性分析。色谱柱型号规格HP-5MS(15 m length,0.250 mm ID)。色谱条件:样品进口温度为200°C;载气为氦气;分流比为5:1;柱流速(恒流模式)为1.2 mL·min−1;升温程序为初始温度30°C,保持3.2 min,以11°C·min−1升至200°C保持3 min。质谱条件:扫描模式为全扫描;扫描范围为35~270 amu;电离能为70 eV;界面温度为280°C。用微量进样器取样,进样量为0.1 mL。
-
为明确菌株降解苯能力,利用摇瓶实验法[31]考察在有无表面活性剂皂角苷促进下菌株对苯的降解能力。部分表面活性剂在适宜浓度下对憎水污染物苯增溶的同时与之共降解,会大大促进微生物对苯的利用[32]。本研究选择表面活性剂为来自植物且环境友好的非离子表面活性剂皂角苷[33~35]。调节液体无机盐培养基在600 nm下的吸光度为0,分别接种纯菌液使之吸光度均为0.015,从而制备成菌悬液。取5%(体积分数,下同)的菌悬液、定量的液体无机盐培养基、0.5 mL苯、50 mg·L−1皂角苷于250 mL的血清瓶中,使反应体系保持在100 mL,记为体系1。体系2的制备过程与体系1类似,但菌悬液内无皂角苷的添加。血清瓶采用塑料盖和橡胶塞双重密封(下同),然后放入温度为30℃、转速150 r·min−1的恒温培养箱中,每隔2 h用微量进样器从瓶口橡胶塞穿刺取得顶空气体样品进行检测。每个时间点重复3次取平均值。
-
采用正交实验探究菌株Bacillus sp. W降解苯的最佳条件,阐明皂角苷添加量、pH、苯质量浓度对菌株Bacillus sp. W生长的影响。设计3因素(皂角苷添加量、pH及苯浓度) 4水平正交实验,均在250 mL的血清瓶中进行。实验因素与水平设计见表1,步骤为分先后加入30 mL菌悬液、70 mL液体无机盐培养基,测定不同条件下Bacillus sp. W对苯的去除效率,均重复3次取平均值。
-
移取10%的菌悬液接种于盛有无机盐培养基的血清瓶中,按正交实验设置调节无机盐培养基pH为7,起始苯质量浓度为50 mg·L−1,皂角苷添加量为75 mg·L−1后,置于30℃、摇床转速150 r·min−1的恒温培养箱中振荡培养。定时取适量菌液至比色皿中,以蒸馏水为空白对照利用UV1102型分光光度计测定测其OD600,每个时间点重复测定3次取平均值。
-
采用丁香醛连氮(SGZ)为底物定时监测菌液漆酶活性[36],3 mL底物的反应体系中含1 mL的菌株漆酶悬液,1 mL的0.1 mol·L−1柠檬酸-磷酸盐缓冲液(pH 7.0),1 mL的0.1 mmol·L−1 的SGZ,于30 ℃下反应3 min后在525 nm处测定吸光值。以1 min内催化氧化1 μmol底物所需的酶量为1个酶活单位(U),每20 h检测1次,每次检测均设3次重复取平均值。
-
以文献[37-38]中对苯系物代谢产物的研究为基础,将5%的Bacillus sp. W菌悬液分别接种于以苯、苯酚、邻苯二酚为唯一碳源的250 mL密封血清瓶内的液体无机盐培养基中,并设置以邻苯二酚为唯一碳源但添加浓度为1.0 mmol·L−1的漆酶抑制剂半胱氨酸[36]同体系对照组。通过固相萃取(SPE)和GC-MS测定发酵液中的代谢产物,每种发酵菌液均有3个平行样。固相萃取方法:用5 mL二氯甲烷活化C18SPE柱(Waters,US),弃去流出物,然后通过5 mL甲醇和5 mL超纯水。在柱清空之前,连接200 mL样品储存装置并以5 mL·min−1的泵送速度过滤。泵出所有水样后,用5 mL超纯水清洗柱床,干燥后用10 mL二氯甲烷洗脱。将洗脱液氮吹浓缩至1 mL,取1 μL用于GC-MS分析。色谱条件:样品入口温度为250℃;载气为氦气;分流比为10:1;柱流速(恒流模式)为1.0 mL·min−1。加热程序:初始温度40℃,保持2 min,以4℃·min−1升温至120℃保持3 min,然后以10℃·min−1升温至230℃,并保持5 min。质谱条件:扫描模式为全扫描;扫描范围为35~300 amu;电离能为70 eV;界面温度为280℃。用微量进样器取样,进样量为1 μL。
-
将前期纯化培养得到的纯菌Kocuria rosea sp. R、Bacillus sp. W及Arthrobacter sp. Y分别接种至无机盐培养基中,置于30℃、转速150 r·min−1的恒温培养箱中培养至对数期,获得菌种菌悬液。将优势菌种Kocuria rosea sp. R、Bacillus sp. W及Arthrobacter sp. Y的菌悬液以体积比1:2:1配制复合菌剂。活性污泥取自石家庄某药厂污水处理站,混合液悬浮物浓度(MLSS)为3 500 mg·L−1。活性污泥中投加10%的复合菌剂(即1 L)作为实验组,对照组为未添加复合菌剂的活性污泥。总反应体系为10 L,控制液相中皂角苷为50 mg·L−1,苯质量浓度为300~500 mg·L−1。将配好含复合菌剂的活性污泥加入到驯化初期的生物洗涤反应器中,每24 h测定液相苯质量浓度,运行22 d,并观察苯的去除效率。将复合菌剂接种至本实验室设计的泡沫生物洗涤反应器[39]中,在含苯废气质量浓度为13 000 mg·m−3、MLSS约3 300 mg·L−1、泡沫层高40 cm、废气体积流量为0.39 m3·h−1、回淋比为1.5、pH 6.5~7.0、皂角苷质量浓度不低于40.40 mg·L−1的条件下长期运行。计算苯去除率、MLSS和液相中苯质量浓度,均重复3次取平均值。期间每2 d用等体积营养液(1 L)置换体系内上清液。
-
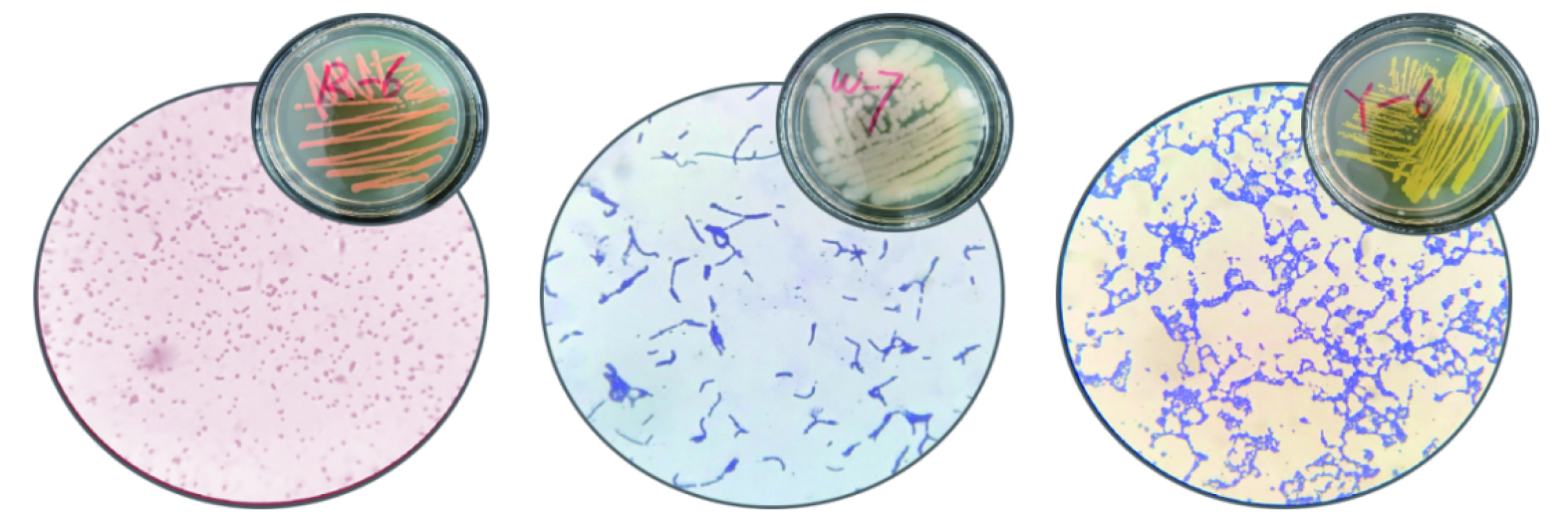
经4次富集筛选得到8株苯降解菌株,根据观察其相对丰度大小及对降解能力进行检测,复筛出3株高效苯降解优势菌株R、W和Y。R、W和Y革兰氏染色均为阳性,如800倍镜检图1所示。菌株R在固体培养基上菌落呈粉红色,边缘整齐凸起呈圆形,表面湿润、不透明、无褶皱、无绒毛、质地粘稠;光学显微镜观察发现为球形菌体。菌株W在固体培养基上菌落呈灰白色,近似圆形,表面较粗糙呈毛玻璃状,其边缘向四周不规则扩散,质地较软;镜检发现其为首尾联结成链的杆菌。菌株Y在固体平板培养后可见黄色圆形、中间凸起、边缘规则不向四周扩散、表面光滑、不透明、无皱褶、无绒毛、质地粘稠的菌落;镜检发现,其细胞呈不规则米粒状,相互黏连成堆。
根据16S rDNA 序列比对结果和细菌的系统发育树(图2)发现,筛选出的3株高效苯降解优势菌R、W和Y分别属玫瑰色考克氏菌属 (Kocuria rosea sp.)、芽孢杆菌属 (Bacillus sp.)和节杆菌属(Arthrobacter sp.),BLAST (N)同源比对分析同源性分别达到98 %、99 % 和98 %。优势菌R、W、Y分别命名为Kocuria rosea sp. R、Bacillus sp. W以及Arthrobacter sp. Y。
-
生物降解过程为单反应物反应体系,拟定选用一级动力学模型进行降解动力学研究[23,40],一级动力学方程为式(1)。
式中:t表示时间,h;c0表示初始底物的质量浓度,mg·L−1;ct表示时间t时的底物质量浓度,mg·L−1。
根据
ln(ctc0) 和时间t的斜率可求出k值。原始基质浓度减低到二分之一所花费的时间称为半衰期[41]。半衰期(t1/2)见式(2)。菌株Kocuria rosea sp. R、菌株Bacillus sp. W及菌株Arthrobacter sp. Y分别在体系1与体系2(即添加50 mg·L−1皂角苷与不添加皂角苷)苯降解的一级动力学拟合结果如图3,其拟合方程见表2。
半衰期越短,比降解速率K(绝对值)就越大,故菌株降解速率也就越快,其降解能力越强。Bacillus sp. W在2个体系中半衰期均最短,且比降解速率K(绝对值)最大,因此,其对苯的降解能力最强,其次是Kocuria rosea sp. R与Arthrobacter sp. Y。质量浓度为50 mg·L−1的皂角苷对Kocuria rosea sp. R和Bacillus sp. W的苯降解有明显促进作用;而Arthrobacter sp. Y在2种条件下拟合曲线斜率相差不大,半衰期变化也较小,故50 mg·L−1皂角苷对其苯降解能力的影响较弱。无论有无皂角苷,Bacillus sp. W对苯的降解能力均为最优,故认定Bacillus sp. W为研究目标进行最佳降解条件、生长特点及代谢途径等的研究。当皂角苷存在时,对 Kocuria rosea sp. R、Bacillus sp. W降解苯有明显促进作用,然而对Arthrobacter sp. Y的促进作用不明显。由于不同菌种中降解酶存在不同代谢通路,且降解通路种类多样,因此,推测这是由于皂角苷与苯共代谢时不同菌株间代谢通路的差异所致[42]。
-
以皂角苷添加量、pH、苯浓度3个因素作为自变量,苯去除率为因变量进行正交实验优化分析,根据单因素实验结果确定水平范围,因素水平实验设计及正交实验结果见表3。根据均值分析得Bacillus sp. W的最佳苯降解条件为:pH 为7,起始苯质量浓度为50 mg·L−1,皂角苷添加量为75 mg·L−1。根据极差分析各因素影响强度依次为:pH>苯浓度>皂角苷添加量。
-
Bacillus sp. W生长曲线见图4。接种后0~3 h内增殖缓慢,此时为Bacillus sp. W的停滞期。3 h后OD600 迅速上升,进入对数生长期;在70~132 h时,曲线平缓趋于一条直线,处于稳定期。由此说明,该条件下Bacillus sp. W滞期较短,很快进入对数期,且稳定期较长。漆酶活性随着生长曲线趋势先上升后下降,在对数增长中后期达最高,为490.21 U·L−1。
漆酶对于酚类和芳香胺类等多种有机化合物具有较好催化氧化性能[43-44],具有较高酶活。其中,真菌漆酶的活性要高于细菌漆酶,但真菌漆酶对反应条件较为苛刻,而细菌漆酶稳定性更好,适用于实际工业生产环境中。通过研究漆酶活性,为考察菌株应用潜力,以推动细菌漆酶的工业化应用提供参考[29,45]。
本研究中芽孢杆菌Bacillus sp. W产生的漆酶应为芽孢漆酶,其活性在对数增长期的中后期达最高,为490.21 U·L−1。此时菌的增长速率减缓,芽孢大量产生又未完全休眠,而是利用苯生长,故此时漆酶活性最强。在稳定期,形成的芽孢大部分进入休眠,故漆酶活性明显降低。芽孢的产生并非仅仅是芽孢杆菌为应对逆境所产生的休眠体,也是其生命周期的一部分,可通过介体强化、酶固定化等手段有效诱导并高效利用芽孢漆酶[46-47]。目前,对于芽孢杆菌(Bacillus sp.)降解苯的研究很少,KUREEL等[28]从石油污染土壤中分离纯化出芽孢杆菌(Bacillus sp.),在pH为7、温度为37 oC及接种量为6.0×108 CFU·mL−1时,苯最高去除率达到90%,其中苯酚、1,2苯二醇、对苯二酚和苯甲酸盐作为代谢物存在。LIU等[48]从多种微生物菌株中筛选出6种芽孢杆菌属的分离株,并将其进行组合,发现分离株的所有组合均具备苯降解能力。芽孢杆菌对石油、烷基酚、苯并(a)芘,以及蒽和萘等多环芳烃[49-52]具有突出的降解能力。芽孢杆菌在工业、农业及医学等领域都有十分广泛的应用与研究价值[53-55]。芽孢杆菌是多种新型酶的来源,也是复杂底物生物加工的理想候选者[56]。芽孢杆菌分泌的芽孢漆酶比真菌漆酶的催化活性与稳定性更好,更具工业化前景[57-58]。
-
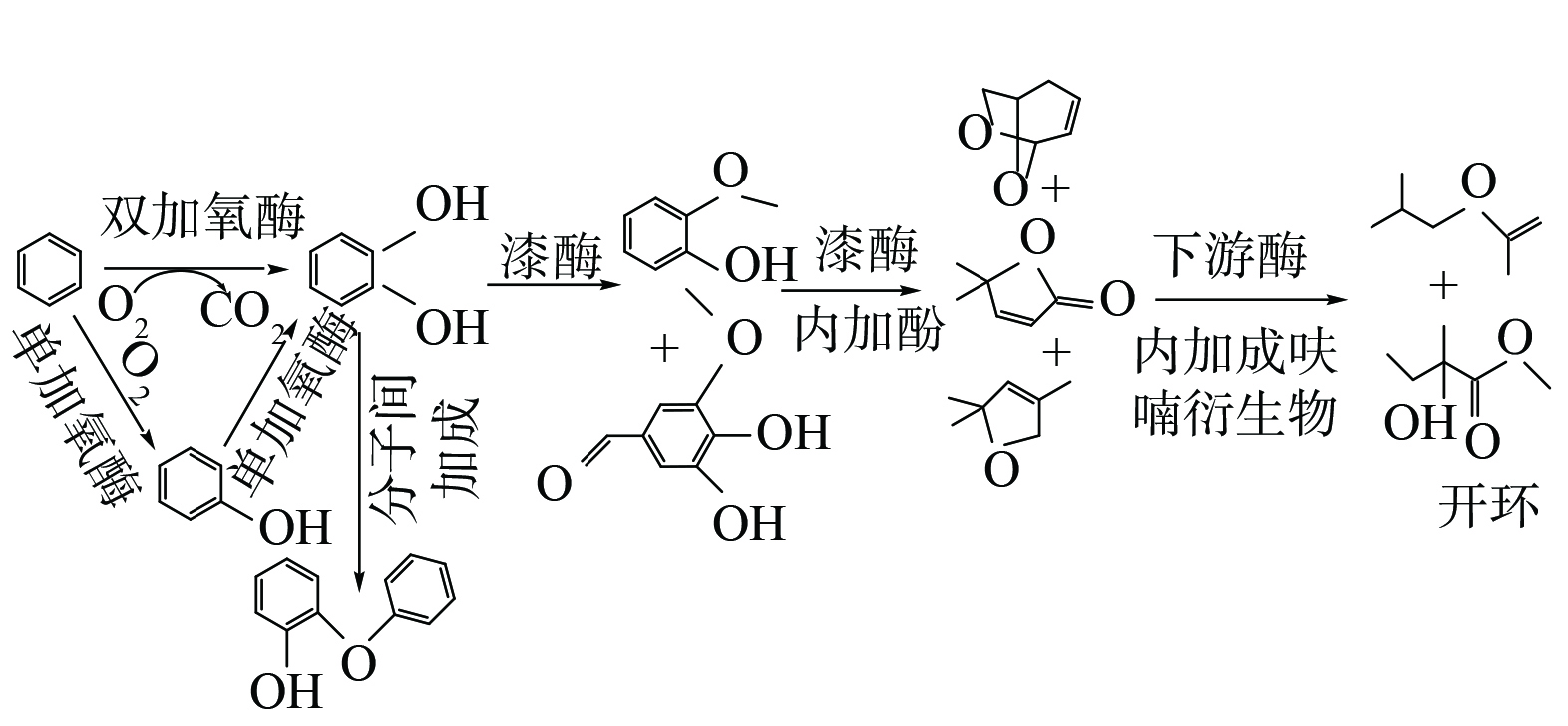
Bacillus sp. W在pH为7、苯的质量浓度为50 mg·L−1的降解条件下,得到相关代谢产物如图5,其中以甲氧基取代酚(3, 4-二羟基-5-甲氧基苯甲醛、2-甲氧基苯酚)与苯酚聚合物(2-苯氧基苯酚)为主,另有呋喃衍生物(5, 5-二甲基-2(5H)-呋喃酮、2, 5-二氢-2, 2, 4-三甲基-呋喃)与开环后直连化合物(乙酸异丁酯、2-羟基-2-甲基-甲酯丁酸)。
苯系物的好氧代谢途径共同点是在加氧酶等作用下形成邻苯二酚或其衍生物,通过裂解酶再进一步开环[59]。而在漆酶等催化下,苯将进入不同代谢通路。陈明等[60]研究了漆酶催化下邻苯二酚的氧化与转化,半醌自由基是邻苯二酚在催化反应中的初始氧化产物,随后主要途径有2种:1)发生分子间加成,产生二聚体和三聚体;2)分子内加成,产生呋喃衍生物。漆酶是一种多功能酶,能氧化多种芳香族和非芳香族化合物,如多酚、芳基二胺、苯胺、甲氧基取代酚、有机/无机金属化合物等[61]。另有研究表明,漆酶可催化难溶降解酚类污染物,从而促进酚类和二元胺的甲氧基取代;且在漆酶介导的催化作用下可产生多种酚类聚合物[62]。发现的一些呋喃衍生物,如2, 5-二氢-2, 2 ,4-三甲基-呋喃、5, 5-二甲基-2(5H)-呋喃酮等,为Bacillus sp. W经上述途径1)在分子内加成的产物。2-苯氧基苯酚等则是通过上述途径2)产生的二聚体。这些代谢产物再经一系列下游酶的代谢作用成为小分子。
Bacillus sp. W通过加氧酶等将苯转化为邻苯二酚后,在其分泌的漆酶作用下,生成多种甲氧基取代物(2-甲氧基苯酚、3, 4-二羟基-5-甲氧基苯甲醛等)和酚类聚合物(2-苯氧基苯酚等)。为排除干扰,将底物苯换为其次级物质代谢产物邻苯二酚,仍检测出2-甲氧基苯酚;将底物苯换为其次级物质代谢产物苯酚,则检测得到邻苯二酚与2-甲氧基苯酚;当添加漆酶抑制剂半胱氨酸后三者(苯、邻苯二酚、苯酚),则均未检测到代谢中间产物2-甲氧基苯酚的存在。这表明漆酶可催化酚羟基邻位的甲氧基取代,生成2-甲氧基苯酚、3, 4-二羟基-5-甲氧基苯甲醛等甲氧基取代物。因此,推测Bacillus sp. W漆酶的降解途径如图5所示。
-
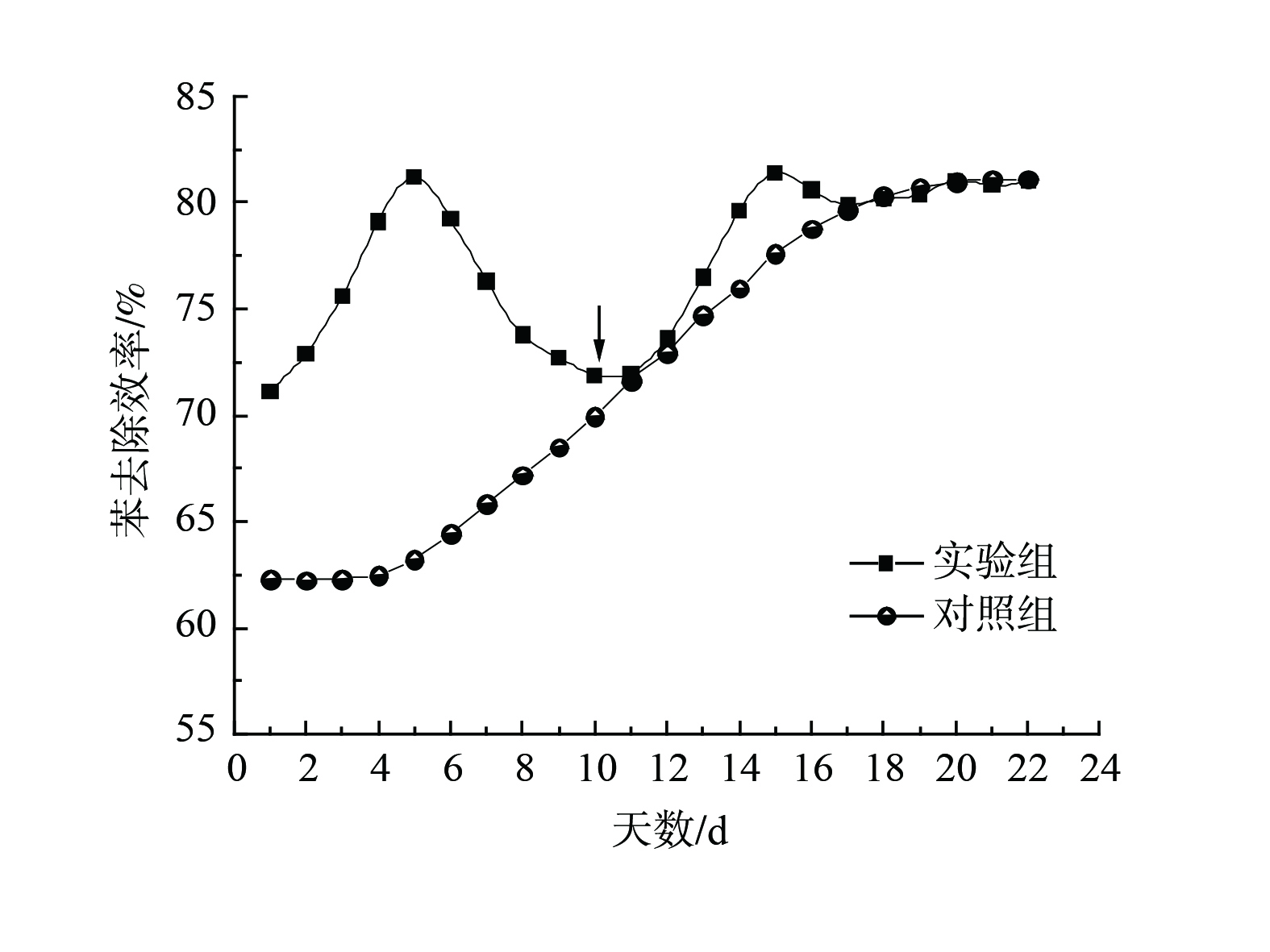
添加复合菌剂可在短时间内大幅提升苯的去除率,相关对比效果如图6所示。在运行的第1天,添加菌剂实验组的苯去除效率明显比对照组高8.80%。实验组苯去除效率在第5天达到最高81.21%后逐步下降,渐近对照组。在第10天补加同剂量菌剂,苯去除效率在补加后攀升,于第5天达到峰值81.42%;随后稍见下降趋势并逐渐稳定在81.01%,与对照组重合。对照组的苯去除效率变化同常规驯化规律,活性污泥经短暂适应后对苯的去除效率缓慢上升,在运行22 d后达到81.12%。
添加菌剂可使活性污泥提前17 d达到80%以上的苯去除效率,因此,本研究中人工配制的复合菌剂可在短时间内大幅提升活性污泥对苯的去除效率,但该菌剂不能在初期活性污泥群落中稳定维持,在第5天即呈衰退趋势,故合理补加菌剂即可保持其较高的苯去除效率。随着活性污泥驯化成熟,可不必再持续添加菌剂。因此,可将该菌剂用于活性污泥驯化初期以提升苯降解效率,并改善系统的抗冲击负荷能力,最终缩短反应器启动时间。体系中芳香族化合物等污染物是以微生物共代谢的方式降解[63]。
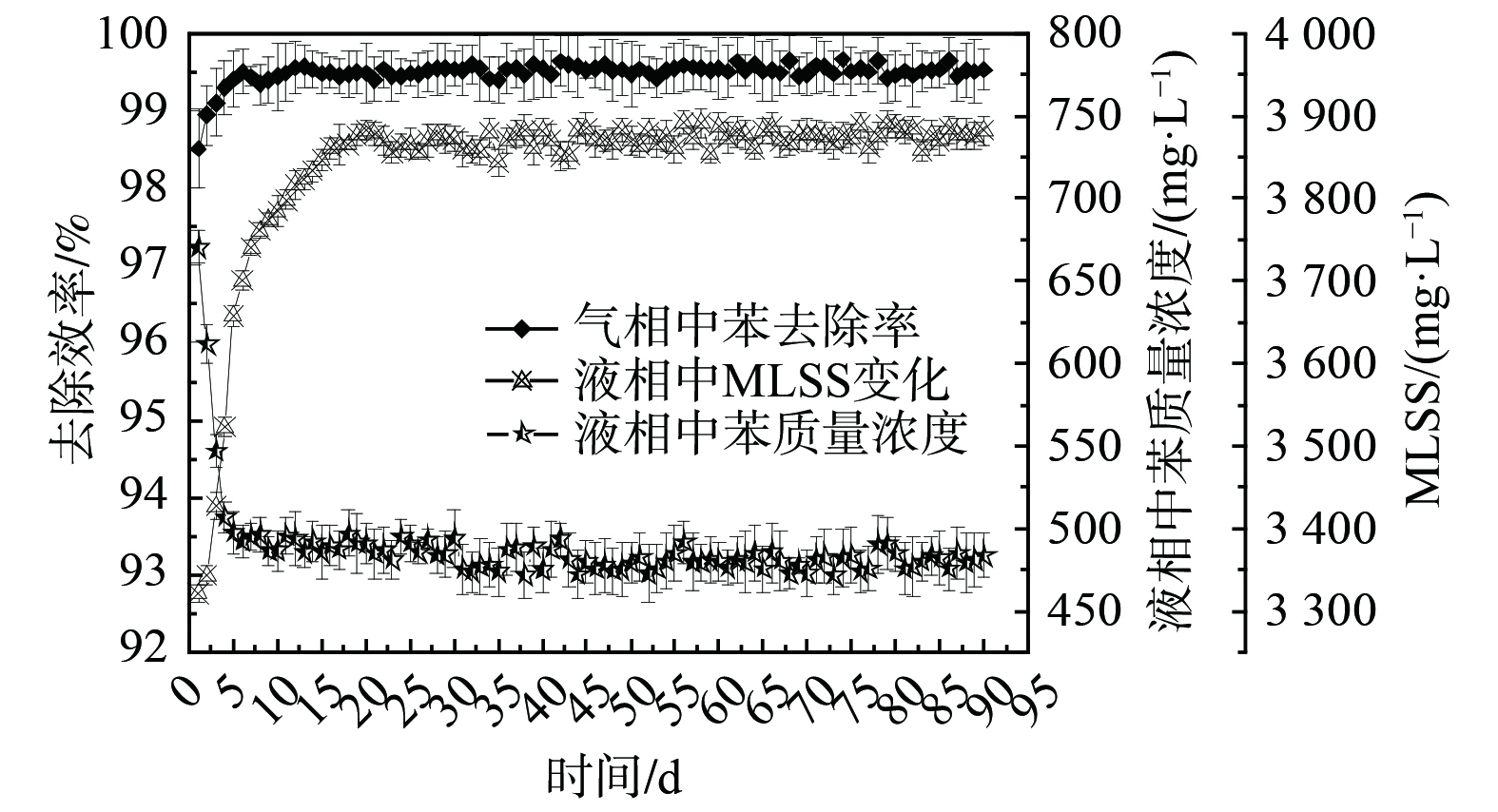
确定高效生物反应器中活性污泥的群落结构,能快速驯化污泥并缩短反应器启动时间。将复合菌剂接种至本实验室设计的泡沫生物洗涤反应器中[39](图7),实现了为期5 d的反应器快速启动。在液相中,前5 d内MLSS迅速增长,洗涤液中的苯质量浓度随之降低,稳定在约500 mg·L−1,去除率也稳定在99%以上。因此,通过接种拥有合理菌群结构的活性污泥,可实现反应器的快速启动,简便且经济。
-
1)筛选出的株苯降解菌株,分别鉴定为玫瑰色考克氏菌属(Kocuria rosea sp. R)、芽孢杆菌属(Bacillus sp. W)和节杆菌属(Arthrobacter sp. Y);3种菌株对苯降解效果较好,其中Bacillus sp. W降解苯的能力最强,在皂角苷促进下半衰期为4.90 h。
2)菌株Bacillus sp. W菌酶系丰富,是产芽孢漆酶的高效菌株,更具工业化前景。Bacillus sp. W苯降解最优条件为:pH 7、苯质量浓度50 mg·L−1、皂角苷添加量75 mg·L−1。菌群在约3 h可进入对数生长期,60 h后进入稳定期,漆酶酶活在对数增长中后期达最高,为490.21 U·L−1。分析Bacillus sp. W降解苯的代谢产物,明确其漆酶等降解苯的部分代谢途径,苯在加氧酶的作用下转化为邻苯二酚,漆酶可催化酚羟基邻位发生甲氧基取代,进而分子内加成为呋喃衍生物,再经一系列下游酶的作用降解成小分子。
3)以3种菌株配置的复合菌剂可用于生物反应器驯化初期提升苯降解效率,增强抗冲击能力,缩短反应器启动时间。
生物洗涤塔内产漆酶苯降解菌的分离鉴定及菌剂制备应用
Isolation, identification and preparation of laccase benzene degrading bacteria in biological scrubber tower
-
摘要: 从生物洗涤塔内循环洗涤液中分离鉴定得到3株苯降解菌Kocuria rosea sp. R(玫瑰色考克氏菌属)、Bacillus sp. W(芽孢杆菌属),以及Arthrobacter sp. Y(节杆菌属),通过研究其苯降解动力学,确定苯降解优势菌为Bacillus sp. W,优化其降解条件并探究其代谢途径。结果表明,添加皂角苷可促进苯的生物降解,但根据不同细菌的代谢特点,其影响存在显著差异。在产漆酶菌Bacillus sp. W的降解下,苯的半衰期为8.08 h,而皂角苷与苯共代谢时,苯的半衰期缩短为4.90 h。在最优条件下,即pH为7、起始苯浓度为50 mg·L−1、皂角苷添加量为75 mg·L−1,Bacillus sp. W的漆酶酶活最高为490.21 U·L−1。在漆酶等参与下苯存在独特苯降解通路,苯在加氧酶作用下转化为邻苯二酚,漆酶可催化酚羟基邻位发生甲氧基取代,进而分子内加成为呋喃衍生物,再经一系列下游酶的作用降解成小分子。在生物反应器中添加由分离得到3株菌株复合而成的菌剂,苯去除效率在第5 d达最高81.21%,比常规驯化活性污泥提前了17 d,还增强了反应器的抗冲击能力。将菌剂接种到实验室的泡沫生物洗涤反应器中,实现了反应器快速启动,启动期仅为5 d。本研究可为生物技术治理疏水性和难降解性VOCs提供参考。Abstract: Three strains of benzene degrading bacteria, Kocuria rosea sp. R, Bacillus sp. W and Arthrobacter sp. Y were isolated from the circulating scrubbing liquid in a bioscrubber. Bacillus sp. W was identified as the highly efficient strain for benzene-degrading by studying the kinetics of benzene degradation. the degradation conditions of wich were optimized and the metabolic pathways were explored. The results showed that the existence of saponin could promote benzene biodegradation, but the effects were significantly different depending on the metabolic properties of different bacteria. The half-life of benzene was 8.08 h under degradation by laccase producing bacteria Bacillus sp. W, while the half-life of benzene was shortened to 4.90 h under the cometabolism of saponin and benzene. Bacillus sp. W showed a maximum laccase enzyme activity of 490.21 U·L−1 under optimal conditions with the pH at 7, an initial benzene concentration of 50 mg·L−1 and a saponin addition of 75 mg·L−1 . There was a unique benzene degradation pathway with the participation of laccase. Benzene was converted to catechol by the action of oxygenase, and laccase catalyzed methoxy substitution of phenol hydroxyl ortho positions, and then furan derivatives were generated by intramolecular addition, which were then degraded to small molecules by the action of a series of downstream enzymes. With the addition of microbial agent compounded with 3 strains, the removal efficiency of benzene reached 81.21 % on the fifth day, which was 17 days earlier than the conventional domesticated activated sludge, the shock resistance of the reactor was also enhanced . A rapid reactor start-up with a start-up period of only 5 d was achieved by inoculation of the bacterial agent into the laboratory foam bioscrubber reactor. This study can provide a reference for biotechnological treatment of hydrophobic and non-degradable VOCs.
-
Key words:
- saponin /
- laccase /
- Bacillus /
- degradation /
- metabolic pathway /
- microbial agent
-
表 1 正交实验的因素与水平的设置
Table 1. Factors of orthogonal experiment and level Settings
水平 因素 皂角苷添加量/(mg·L−1) pH 苯质量浓度/(mg·L−1) 1 25 5 20 2 50 6 50 3 75 7 100 4 100 8 200 表 2 动力学拟合结果对比表
Table 2. Comparison of kinetic simulation Results
菌株 体系 模拟方程 比降解速率|K| R2 半衰期/h R R2 lnc=−0.073 8t+0.090 7 0.073 8 0.931 6 9.39 R1 lnc=−0.116 1t+0.106 6 0.116 1 0.984 6 5.97 W W2 lnc=−0.085 8t+0.004 1 0.085 8 0.974 6 8.08 W1 lnc=−0.141 6t+0.233 9 0.141 6 0.944 2 4.90 Y Y2 lnc=−0.054 5t+0.040 3 0.054 5 0.976 5 12.72 Y1 lnc=−0.063 8t+0.066 6 0.063 8 0.958 8 10.86 表 3 正交实验结果分析表
Table 3. Analysis table of orthogonal experiment results
序号 皂角苷添加量/(mg·L−1) pH 苯质量浓度/(mg·L−1) 去除效率% 实验1 100 6 50 78.98 实验2 50 6 20 78.80 实验3 100 8 20 62.59 实验4 25 7 50 79.98 实验5 75 7 20 80.10 实验6 100 5 100 70.62 实验7 25 5 20 72.02 实验8 50 5 200 68.26 实验9 100 7 200 71.75 实验10 75 5 50 74.70 实验11 50 8 50 69.76 实验12 75 8 200 62.74 实验13 25 6 200 73.68 实验14 50 7 100 80.42 实验15 25 8 100 66.82 实验16 75 6 100 80.63 -
[1] 杨会玲. 我国VOC废气治理的现状及展望[J]. 化工管理, 2017(16): 135. [2] JI Y Y, GAO F H, WU Z H, et al. A review of atmospheric benzene homologues in China: Characterization, health risk assessment, source identification and countermeasures.[J]. Journal of Environmental Sciences, 2020, 95(9): 225-239. [3] 张昊. 挥发性有机物废气处理技术进展与前瞻[J]. 环境与发展, 2019, 31(6): 80. [4] 吴成强, 桂湘也, 邵倩, 等. 生物净化装置现场处理汽车轮毂涂装车间的VOCs[J]. 环境工程学报, 2021, 15(3): 1060-1066. [5] NISOLA G M, CHO E, ORATA, et al. NH3 gas absorption and bio-oxidation in a single bioscrubber system[J]. Process Biochemistry, 2009, 44(2): 161-167. doi: 10.1016/j.procbio.2008.10.004 [6] KANG J, WANG T, XIN H, et al. A laboratory study of microalgae-based ammonia gas mitigation with potential application for improving air quality in animal production operations[J]. Journal of the Air & Waste Management Association. 2014, 64(3): 330-339. [7] BARBUSINSKI K, KALEMBA K, KASPERCZYK D, et al. Biological methods for odor treatment-A review[J]. Journal of Cleaner Production, 2017, 152: 223-241. doi: 10.1016/j.jclepro.2017.03.093 [8] SAN-VALERO P, PENYA-ROJA J M, ÁLVAREZ-HORNOS F J, et al. Fully aerobic bioscrubber for the desulfurization of H2S-rich biogas[J]. Fuel, 2019, 241: 884-891. doi: 10.1016/j.fuel.2018.12.098 [9] 刘建伟, 马文林, 王志良. 废气生物处理微生物学研究进展[J]. 环境科学与技术, 2012, 35(8): 74. [10] SINGH D, FULEKAR M H, Benzene bioremediation using cow dungmicroflora in two phase partitioning bioreactor[J], J. Hazard[J]. Mater, 2010, 175(1/2/3): 336-343. [11] SARA B, MASSIMO M, LORENZO B, et al. , Microbial succession in a compost-packed biofilter treating benzene-contaminated air[J]. Biodegradation, 2006, 17(2): 181-191. [12] SUNG Y H, YOUNG Y J. Removal of benzene in a hybrid bioreactor[J]. Process Biochemistry, 1999, 34(3): 281-288. doi: 10.1016/S0032-9592(98)00094-6 [13] SUNG-HO Y, ANDREW D J, Benzene degradation in a two-phase partitioning bioreactor by Alcaligenes xylosoxidansY234[J]. Process Biochemistry, 2001, 36(8/9): 765–772. [14] SCHIAVON M, RAGAZZI M, RADA E C, et al. Air pollution control through biotrickling filters: A review considering operational aspects and expected performance[J]. Critical Reviews in Biotechnology, 2016, 36(6): 1143-1155. doi: 10.3109/07388551.2015.1100586 [15] 李远啸, 郭斌, 刘烁. 微生物生物技术处理气态污染物的研究进展[J]. 微生物学通报, 2019, 46(12): 3475-3482. [16] 张秀芳, 陈翰琳, 李哲, 等. 不动杆菌与假单胞菌对17β-雌二醇的协同降解特性[J]. 吉林大学学报(理学版), 2017, 55(6): 1631-1636. [17] 刘鸿泉,张桓,廖雷,等. 活性污泥洗涤净化餐饮油烟VOCs及其生物降解过程[J]. 环境工程学报, 2022, 16(4): 1111-1122. doi: 10.12030/j.cjee.202106120 [18] 罗霂. 高效降解高分子量多环芳烃的混合菌剂的开发[D]: 北京: 轻工业环境保护研究所, 2013. [19] 周月明. 耐低温高效复合苯系物、硝基苯、苯胺降解菌剂的研制[D]. 长春: 吉林大学, 2012. [20] 张燕可. 苯系物降解菌及生物除苯初步研究[D]. 无锡: 江南大学, 2017. [21] 刘远峰, 孔令迎, 耿凤华, 等. 生物法处理甲苯和二甲苯废气研究[J]. 青岛科技大学学报(自然科学版), 2018, 39(3): 89-96. [22] 刘庆辉, 李剑, 杨航, 等. 高效苯酚降解菌Bacillus sp. L5-1的分离及其降解特性[J]. 中国环境科学, 2021, 41(5): 2441-2448. [23] 肖建军, 李亚龙, 杨琦. 苯降解菌的筛选及其对苯的降解研究[J]. 环境工程, 2018, 36(6): 159-162. [24] 张燕可, 冯守帅, 杨海麟, 等. 苯系物降解菌PseudomonasputidaSW-3的筛选及其降解苯的研究[J]. 微生物学通报, 2017, 44(9): 2096-2103. [25] 门娟. 高效降解菌对典型苯系物的降解特性研究[D]. 天津: 天津大学, 2012. [26] 胡忠, 吴奕瑞, 徐艳, 等. 海洋苯酚降解菌 Candida sp. P5 的分离鉴定及其降解特性[J]. 应用与环境生物学报, 2007, 13(2): 243-247. [27] 胡献国, 丁恒, 徐玉福, 等. 生物油降解菌的分离鉴定及其在土壤中的降解特性[J]. 环境科学研究, 2008, 21(6): 182-186. [28] KUREEL M K, GEED S R, GIRI B S, et al. Biodegradation and kinetic study of benzene in bioreactor packed with PUF and alginate beads and immobilized with, Bacillus sp. M3[J]. Bioresource Technology, 2017, 242: 92-100. doi: 10.1016/j.biortech.2017.03.167 [29] 马若兰. 不同菌种对苯系气体处理效果的研究[D]. 天津: 河北工业大学, 2017. [30] 史可, 郭晨蕾, 马晓丹, 等. 一株氯霉素降解细菌的分离鉴定与代谢特性研究[J]. 生物工程学报, 2021, 37(10): 3653-3662. [31] WANG J, TIAN Z, HUO Y B, et al. Monitoring of 943 organic micropollutants in wastewater from municipal wastewater treatment plants with secondary and advanced treatment processes[J]. Journal of Environmental Sciences, 2018, 67(5): 309-317. [32] AIAD I, EL-SUKKARY M M, SOLIMAN E A, et al. Characterization, surface properties and biological activity of new prepared cationic surfactants[J]. Journal of Industrial and Engineering Chemistry, 2014, 20(4): 1633-1640. doi: 10.1016/j.jiec.2013.08.010 [33] KACZOREK E, SMULEK W, ZDARTA A, et al. Influence of saponins on the biodegradation of halogenated phenols[J]. Ecotoxicology and Environmental Safety, 2016, 131: 127-134. doi: 10.1016/j.ecoenv.2016.05.015 [34] QIAN H, CHENG Y, YANG C, et al. Performance and biofilm characteristics of biotrickling filters for ethylbenzene removal in the presence of saponins[J]. Environmental Science and Pollution Research, 2018, 25(30): 30021-30030. doi: 10.1007/s11356-017-0776-6 [35] SARAYU K, SANDHYA S. Rotating biological contactor reactor with biofilm promoting mats for treatment of benzene and xylene containing wastewater[J]. Applied biochemistry and biotechnology, 2012, 168(7): 1928-1937. doi: 10.1007/s12010-012-9908-0 [36] 徐腾飞, 卢磊, 赵敏, 等. 一株产漆酶细菌的分离鉴定及酶学性质研究[J]. 微生物学通报, 2013, 40(3): 434-442. [37] 张磊. 高效苯系物降解菌强化生物滤池及其处理甲苯性能研究[D]. 上海: 华东理工大学, 2021. [38] 谭自航, 解庆林, 章春芳, 等. 4株正十六烷降解菌的降解能力及代谢动力学特性[J]. 化工环保, 2018, 38(1): 46-51. [39] 李远啸. 生物洗涤法净化含苯废气及其强化技术研究[D]. 石家庄: 河北科技大学, 2019. [40] MAJEAU J A, BRAR S K, TYAGI RD. Laccases for removal of recalcitrant and emerging pollutants[J]. Bioresource Technology, 2010, 101(7): 2331-2350. doi: 10.1016/j.biortech.2009.10.087 [41] 赵家贺. 环境条件对菊酯杀虫剂手性降解的影响[D]. 石家庄: 河北科技大学, 2014. [42] 吴应琴, 马明广, 张媛, 等. 皂角苷及腐殖酸对微生物降解蒽的影响[J]. 环境科学学报, 2007, 27(11): 1818-1822. [43] SHARMA P, GOEL R, CAPALASH N. Bacterial laccases[J]. World Journal of Microbiology and Biotechnology, 2007, 23(6): 823-832. doi: 10.1007/s11274-006-9305-3 [44] FANG Z M, LI T L, CHANG F, et al. A new marine bacterial laccase with chloride-enhancing, alkaline-dependent activity and dye decolorization ability[J]. Bioresource Technology, 2012, 111: 36-41. doi: 10.1016/j.biortech.2012.01.172 [45] 贾晨波, 苏一黄, 马秀梅, 等. 端梗霉Z45产漆酶培养基的优化及其对染料的脱色[J]. 生物技术通报, 2022, 38(6): 252-260. [46] 栗君. 产漆酶细菌菌株的筛选及其应用[D]. 哈尔滨: 东北林业大学, 2013. [47] 李凡姝, 刘海洋, 戴绍军, 等. 高产漆酶菌株Bacillus sp. CLb的筛选及其对染料脱色效果的研究[J]. 安徽农业科学, 2014, 42(6): 1614. [48] LIU J H, MAITY J P, JEAN J S, et al. Biodegradation of benzene by pure and mixed cultures of Bacillus spp[J]. World Journal of Microbiology and Biotechnology, 2010, 26(9): 1557-1567. doi: 10.1007/s11274-010-0331-9 [49] HENTATI D, CHEBBI A, HADRICH F, et al. Production, characterization and biotechnological potential of lipopeptide biosurfactants from a novel marine Bacillus stratosphericus strain FLU5[J]. Ecotoxicology and Environmental Safety, 2019, 167(1): 441-449. [50] REDDY M V, MAWATARI Y, YAJIMA Y, et al. Poly-3-hydroxybutyrate (PHB) production from alkylphenols, mono and poly-aromatic hydrocarbons using Bacillus sp. CYR1: A new strategy for wealth from waste[J]. Bioresource Technology, 2015, 192(9): 711-717. [51] LU Q Y, CHEN K Y, LONG Y, et al. Benzo(a)pyrene degradation by cytochrome P450 hydroxylase and the functional metabolism network of Bacillus thuringiensis[J]. Journal of Hazardous Materials, 2019, 366(3): 329-337. [52] BISHT S, PANDEY P, KAUR G, et al. Utilization of endophytic strain Bacillus sp. SBER3 for biodegradation of polyaromatic hydrocarbons (PAH) in soil model system[J]. European Journal of Soil Biology, 2014, 60(2): 67-76. [53] HU W, MIN X, LI X, et al. Enhanced degradation of 1-naphthol in landfill leachate using Arthrobacter sp.[J]. Environmental Technology, 2019, 40(7): 835-842. doi: 10.1080/09593330.2017.1408695 [54] NOGUEIRA FELIX A K, MARTINS J J L, LIMA A, et al. Purification and characterization of a bio-surfactant produced by Bacillus subtilis in cashew apple juice and its application in the remediation of oil-contaminated soil[J]. Colloids and Surfaces B:Biointerfaces, 2019, 175: 256-263. doi: 10.1016/j.colsurfb.2018.11.062 [55] VANDERA E, SAMIOTAKI M, PARAPOULI M, et al. Comparative proteomic analysis of Arthrobacter phenanthrenivorans Sphe3 on phenanthrene, phthalate and glucose[J]. Journal of Proteomics, 2015, 113(1): 73-89. [56] SHAH T A, LEE C C, WILLAM J O, et al. Biological pretreatment of rice straw by ligninolytic Bac-illus sp. strains for enhancing biogas production[J]. Environmental Progress & Sustainable Energy, 2019, 38(3): 288-296. [57] 王佳懿, 李泰仑, 王天女, 等. 短小芽孢杆菌LC01的鉴定及其芽孢漆酶性质的研究[J]. 南京林业大学学报(自然科学版), 2018, 42(5): 113-120. [58] RIESENMAN P J, NICHOLSON W L. Role of the spore coat layers in Bacillus subtilis spore resistance to hydrogen peroxide, artificial UV-C, UV-B, and solar UV radiation[J]. Applied and Environmental Microbiology, 2000, 66(2): 620-626. doi: 10.1128/AEM.66.2.620-626.2000 [59] 倪宇洋, 黄顺生, 张勇, 等. 苯系污染物微生物降解及其合成聚羟基脂肪酸酯的研究进展[J]. 上饶师范学院学报, 2017, 37(3): 96-102. [60] 陈明, 王林, 谭天, 等. 漆酶催化邻苯二酚开环的自由基反应机制(英文)[J]. 物理化学学报, 2017, 33(3): 620-626. [61] CATHERINE H, PENNINCKX M, FRÉDÉRIC D. Product formation from phenolic compounds removal by laccases: A review[J]. Environmental Technology & Innovation, 2016, 5: 250-266. [62] SU J, FU J J, SILVA C, et al. Can laccase-assisted processing conditions influence the structure of the reaction products[J]. Trends in Biotechnology, 2019, 37(7): 683-686. doi: 10.1016/j.tibtech.2019.03.006 [63] SEO J S, KEUM Y S, LI Q X. Bacterial degradation of aromatic compounds[J]. International Journal of Environmental Research and Public Health, 2009, 6(1): 278-309. doi: 10.3390/ijerph6010278 -




 下载:
下载: