-
氟喹诺酮类抗生素(fluoroquinolone antibiotics,FQs)作为全球最广泛的抗生素处方药之一,被广泛应用于防治人类及动物疾病。与许多抗生素类似,FQs不能被完全吸收,30%—90%以母体形式或代谢物形式进入各类环境中,对生态系统、食品卫生和人类安全造成威胁[1-3]。有调查发现,再生水中检测到的FQs最高浓度达1190 ng·L−1,地下水中FQs的浓度为未检出—503 ng·L−1 [4]。根据美国食品和药物管理局和欧洲药品管理局,长时间接触低水平的FQs会造成长期(长达数月或数年)的严重的致残性和不可逆的药物反应,从而影响到多个器官和感官,这种情况被称为“氟喹诺酮相关的残疾”(FADS)[5]。因此,寻找有效的处理手段以高效去除FQs成为亟待解决的问题。据报道,目前许多学者已经尝试将传统水处理技术、生物降解、化学氧化法、吸附技术等用于去除抗生素[6]。然而,每种处理方法都有其局限性,如污泥寿命有限,产生有毒中间体[7],且共同的缺点是处理成本高。相比之下,吸附法因其成本低、操作简便、去除率高而成为一种高效的抗生素废水处理方法[8]。
石墨烯(graphene,G)独特的蜂窝状二维晶体结构赋予其特殊的物理特性、化学可调性,如为其碳主链的修饰或功能化提供了无限的可能性[9]。同时,石墨烯因极高的电荷载流子迁移率,已经吸引了众多学者的研究兴趣。目前有研究学者为了解决吸附剂分离回收难的问题而将磁性铁氧体和石墨烯材料复合,其中CoFe2O4因具有较高的饱和磁化强度、矫顽力、良好的机械硬度及化学稳定性等显著特性[10-11]而被广泛使用。有研究表明,在微波场中,石墨烯是良好的介电损耗型材料,而CoFe2O4属于介电损耗型和磁损耗型吸波材料[12],石墨烯和CoFe2O4结合可增加相对介电常数,改善电磁波的阻抗匹配,同时CoFe2O4和石墨烯之间的界面极化和相关弛豫对微波利用率的提高有一定贡献。在此基础上,本文通过接枝阿仑膦酸对材料进行磷酸化改性,磷酸基团特殊的磷氧四面体结构可增加其与石墨烯的接触面积,使磷酸基团负载于石墨烯表面而非边缘,同时也提高了材料表面酸性基团的数量,一定程度上增加了材料对亲水性药物的吸附量。
本文采用微波法合成磷酸化石墨烯@CoFe2O4(PG@CoFe2O4)。相较于传统加热法,微波具有绿色、安全、低耗、耗时短等优点[13],且微波辅助加热过程中大量的微波能直接与反应体系内的溶剂或试剂耦合,避免出现加热不均匀的现象[14]。基于此,本文研究PG@CoFe2O4、pH、共存离子等对FQs吸附的影响,同时结合吸附等温线和吸附动力学参数探讨了PG@CoFe2O4吸附FQs的可能的吸附机理。
-
试剂:6种氟喹诺酮类标准品:环丙沙星(CIP,83.1%)、恩诺沙星(ENR,99.7%)、左氧沙星(LEV,≥98.0%)、氟罗沙星(FLE,98.4%)、司帕沙星(SPA,99.0%)、丹诺沙星(DAN),及乙酰丙酮钴[Co(acac)2]均购于美国Sigma-Aldrich公司。将上述标准品用色谱纯甲醇制成200 mg·L−1的单标储备液,储存于4 ℃的冰箱。继续用色谱纯甲醇将单标储备液混合稀释成1.0 mg·L−1 的工作标准溶液;阿仑膦酸购于东京化成工业株式会社;石墨烯购于江苏先丰纳米材料有限公司;乙二醇[(CH2OH)2]购于上海麦克林公司;氢氧化钠(NaOH)、冰醋酸(CH3COOH)、无水乙醇(C2H5OH)、氯化钠(NaCl)、盐酸(HCl)均为分析纯,购于国药集团化学试剂有限公司;实验室用水为Milli-Q所制的超纯水;
仪器:TSQ Quantum Ultra三重四极杆超高效液相色谱质谱联用仪(LC-MS)(Quantum ultra,赛默飞世尔科技有限公司);微波合成仪(UWave-2000,上海新仪微波化学有限公司);多点磁力搅拌器(CJB-S-10D,河南爱博特科技发展有限公司);pH计(PHS-3C,上海仪电科学仪器股份有限公司);冷冻干燥箱(FD-1C-50,北京博医康实验仪器有限公司)。
-
称取40.0 mg石墨烯均匀分散于含有去离子水和乙二醇(40 mL,体积比为1∶3)的混合溶液中。准确称取0.5143 g Co(acac)2和1.0812 g FeCl3·6H2O于上述溶液中经搅拌至溶解。将上述溶液转移至四颈烧瓶中再置于微波合成仪中,在N2保护下,pH值调至10,120 ℃下反应1 h。缓慢冷却至室温,而后加入10 mL 8.0 mg·mL−1的阿仑膦酸溶液,再于80 ℃下反应30 min。缓慢冷却后于外加磁场作用下分离磁性初产品,然后用无水乙醇和去离子水交替洗涤3次。冷冻干燥后得最终磁性纳米颗粒PG@CoFe2O4,最终得到0.4801 g PG@CoFe2O4材料。
-
在室温下,定量移取含有1.0 mg·L−1 FQs的水样100 mL,调节相应的pH。加入20.0 mg PG@CoFe2O4的同时开始计时。磁力搅拌一段时间后,移取1 mL上述溶液经0.45 μm滤膜过滤于液质瓶中,经LC-MS进行定量分析。上述实验重复3次。去除率Y(%)和吸附容量q(mg·g−1)计算公式如下:
式中,C0为溶液初始FQs浓度(mg·L−1),Ce为溶液平衡时FQs浓度(mg·L−1),V为溶液体(L),m为吸附剂质量(g),q为PG @CoFe2O4对FQs的吸附量(mg·g−1),Y为去除率(%)。
-
利用LC-MS对FQs进行定量分析。色谱柱:Zorbax Eclipse XDB-C18反相色谱柱(3.0 mm×50 mm,1.8 μm);流动相:0.1%的甲酸(A)和甲醇(B),梯度洗脱程序:0 min—1.0 min 10% B—75% B;1.0 min—6.0 min 75% B;6.0 min—6.5 min 75% B—10% B;6.5 min—9.0 min 10% B;柱温:30 ℃;流速为:0.2 mL·min−1;进样量为3.0 μL。
-
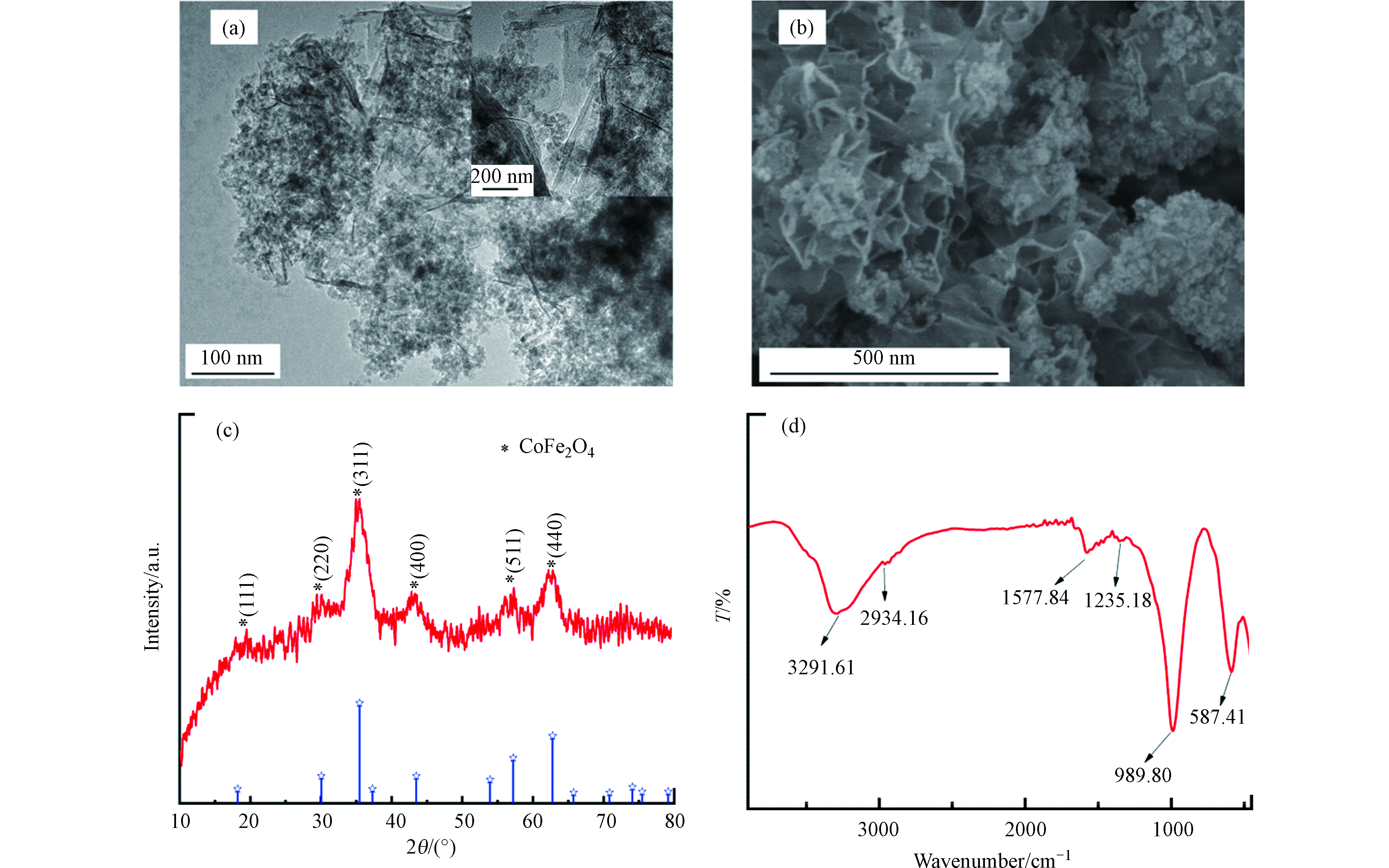
利用扫描电镜(SEM)对PG@CoFe2O4的微观形貌进行表征,结果见图1a。从图1a可看出,石墨烯的褶皱状片层结构,说明负载磁性粒子不会破坏石墨烯的结构。CoFe2O4纳米粒子较均匀地分散在磷酸化石墨烯的表面和片层之间,CoFe2O4纳米粒子未发生明显团聚现象。磷酸功能化磁性石墨烯的表面粗糙程度有利于其对FQs的吸附。图1b透射电镜(TEM)的表征结果。从图1b可以看出,石墨烯边缘存有褶皱,CoFe2O4较均匀地分散在石墨烯上。此外,片层结构较薄,可能是磷酸基团的引入避免了片与片之间的堆积。
PG@CoFe2O4的XRD谱图如图1c所示。从图1c中可以观察到,在2θ=18.5°、30.1°、35.4°、43.1°、57.1°、62.6°等处出现了CoFe2O4的特征衍射峰,分别对应于CoFe2O4的(111)、(220)、(311)、(400)、(511)、(440)立方尖晶石晶面,与CoFe2O4的标准图谱(JCPDS22—1086)基本吻合。故X-射线衍射仪的分析结果可初步说明本实验CoFe2O4成功被负载在石墨烯上。
图1d是PG@CoFe2O4的FTIR图谱。PG@CoFe2O4在3291.61cm−1处存在一个宽且强的吸收峰,这是水分子中O—H的伸缩振动峰所致。PG@CoFe2O4在1577.84 cm−1和2934.16 cm−1处的特征峰归属于石墨分子碳骨架结构中的C=C的伸缩振动和C—H拉伸振动峰。磷酸基团的引入,使PG@CoFe2O4在989.80 cm−1和1235.18 cm−1出现了P—O和P=O的伸缩振动峰[15]。同时,在587.41 cm−1处出现了尖锐的吸收峰,该峰由Co—O或 Fe—O的振动产生,说明CoFe2O4已负载于GO表面[16]。
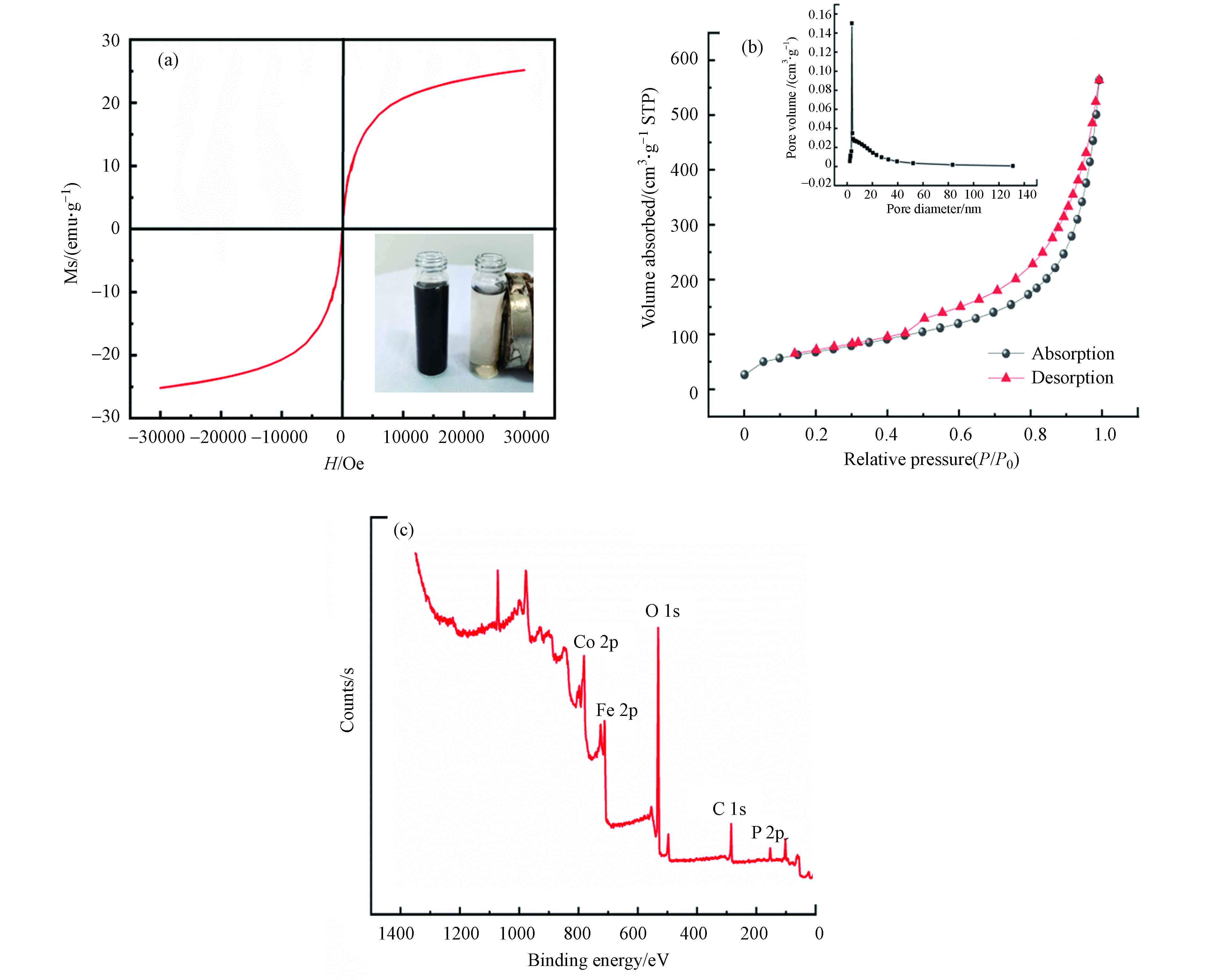
图2a是PG@CoFe2O4的磁化强度曲线。右下角插图是PG@CoFe2O4分散于水中被磁铁吸引的前后情况。在室温条件下,PG@CoFe2O4的磁化强度随着外加磁场强度的增加而增加。但到了一定程度后,PG@CoFe2O4的磁化强度趋于平稳,最终达到饱和磁化强度为25.18 emu·g−1
通过BET比表面积测试法得到了PG@CoFe2O4的N2吸附-脱附等温线,如图2b所示。PG@CoFe2O4的N2吸脱附曲线存在明显的迟滞环,表明其属于标准的Ⅳ型介孔材料的等温线。PG@CoFe2O4的比表面积和孔体积分别为250.20 m2·g−1和0.87 cm3·g−1,这不仅提供更多的活性位点,也增加了吸附剂与目标污染物的接触机会,故PG@CoFe2O4表现出优良的吸附效果。同时,PG@CoFe2O4的较高比表面积提供更多丰富的活性位点用于电磁波的有效反射和散射,促进了电磁波的多重吸收过程。
图2c是PG@CoFe2O4的XPS谱图。从图2c中可看出,C、O、Fe、Co及P这5个元素的特征峰值分别出现在284.4、530.78、711.3、780.96、132.68 eV处,证明了PG@CoFe2O4材料合成成功。根据XPS结果计算出C、O、Fe、Co及P的含量分别为30.69%、51.25%、8.33%、5.66%和2.33%。C 1s特征峰的出现说明了石墨烯与CoFe2O4复合成功,P 2p特征峰的出现说明成功对材料进行了磷酸化。
-
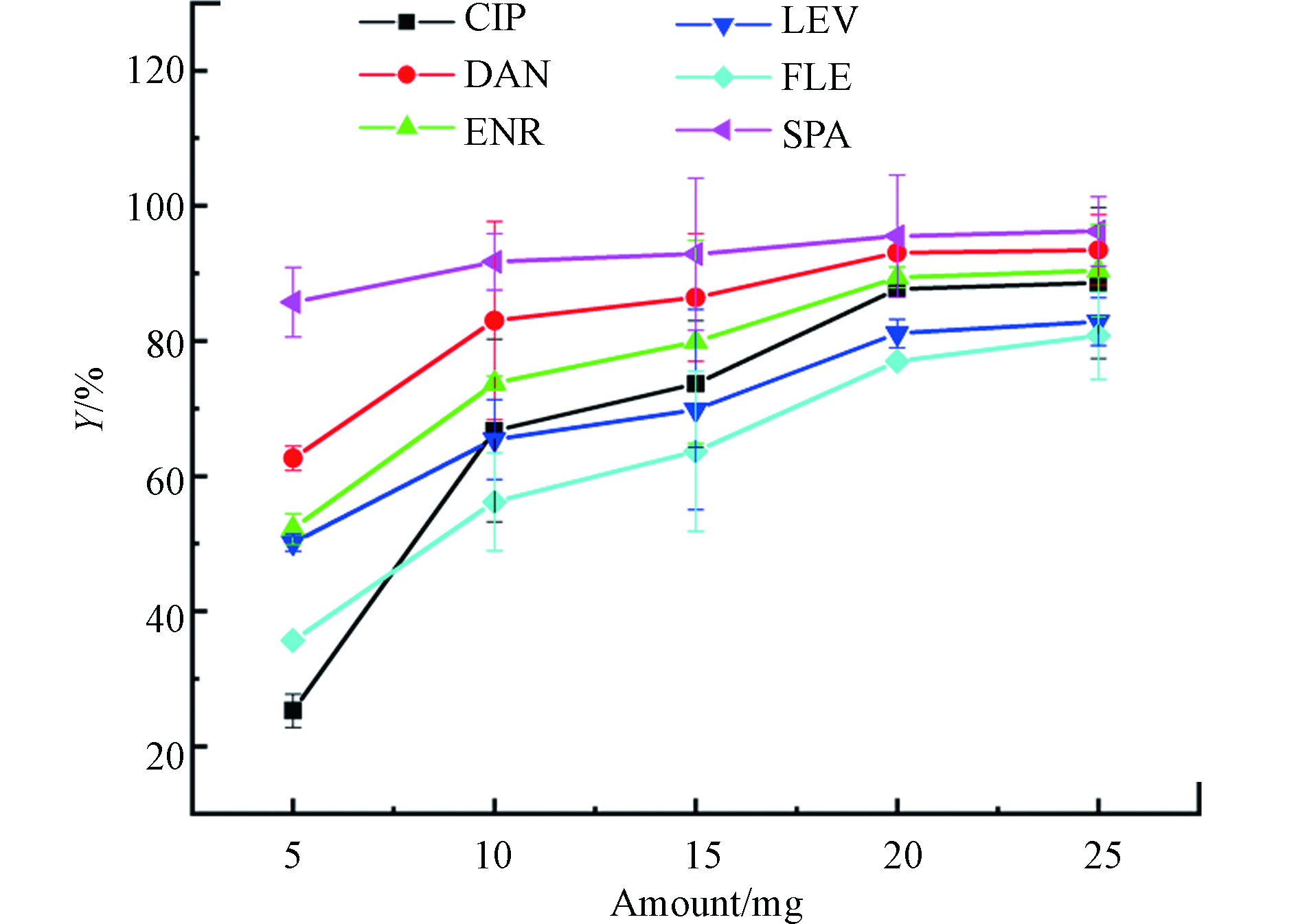
图3为不同PG@CoFe2O4投加量对吸附性能的影响。结果表明,当投加量从5.0 mg增加到20.0 mg时,FQs的去除率不断增加,这是因为随着吸附剂的增加,吸附位点也相应增多,从而FQs与PG@CoFe2O4的接触机率增加。当吸附剂投加量从20.0 mg增至25.0 mg时,去除率没有明显的增加。因此,考虑到PG@CoFe2O4对FQs的去除率和经济效益,选择20.0 mg作为后续实验吸附剂用量。
-
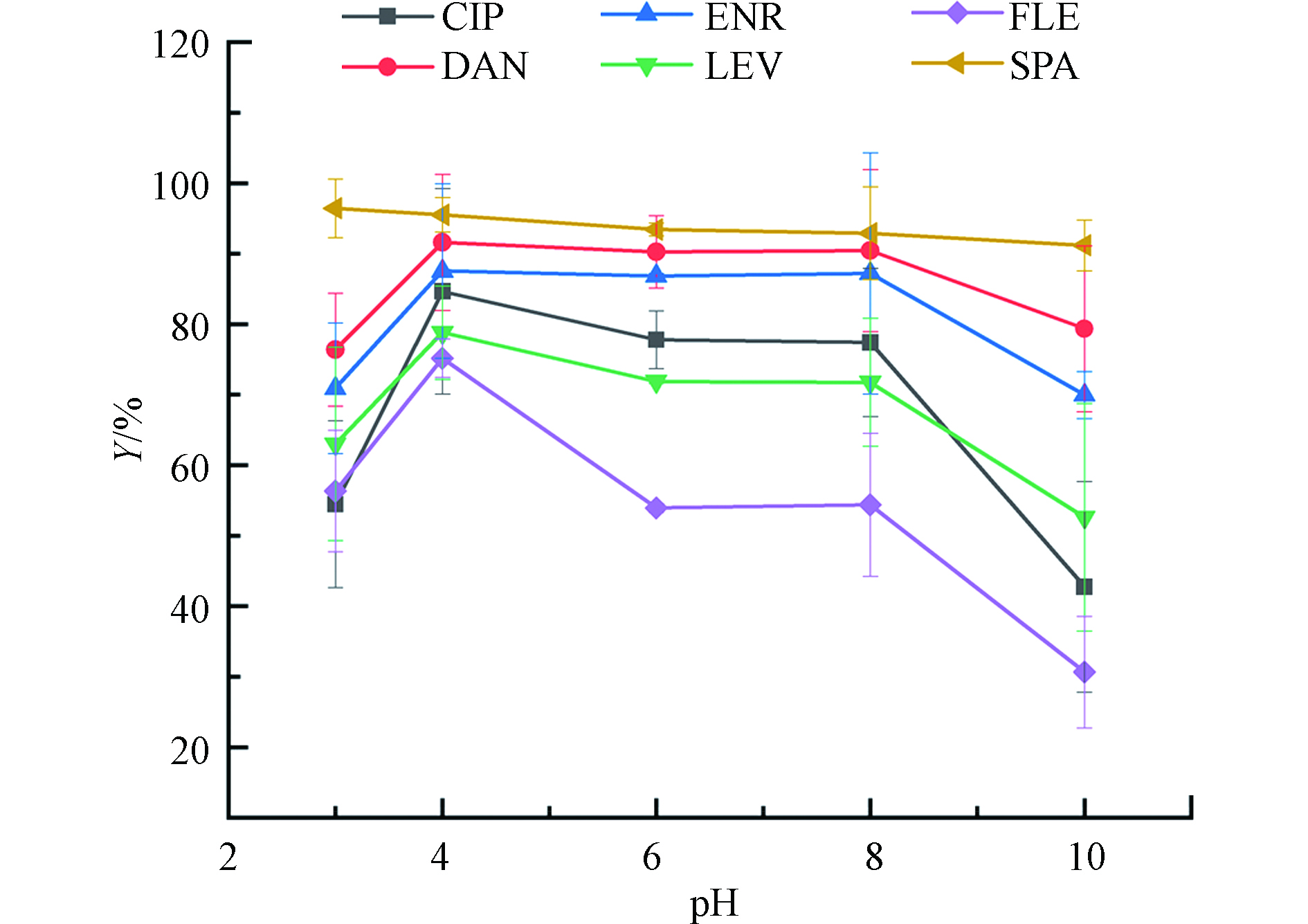
溶液的pH可能会影响污染物的存在形态,以及改变吸附剂的表面电荷,这可能会对吸附性能有很大的影响,因此有必要研究不同pH下FQs的去除情况。图4为溶液初始pH(2.0—10.0)对PG@CoFe2O4吸附FQs造成的影响结果。从图4中可看出,pH为4.0时,PG@CoFe2O4对6种FQs的去除率达到最大化,分别为84.7%、91.6%、87.5%、78.8%、75.2%和95.2%。一般来说,FQs通常有两个pKa值,CIP、LEV、FLE、SPA、ENR和DAN的pKa1为6.14、5.33、5.46、6.09、6.20和6.18,pKa2分别为8.85、8.07、8.00、8.79、8.13和8.78。
当pH<4.0时,溶液中
H+ 较多,PG@CoFe2O4表面的活性位置更多的被H+ 占据,导致吸附效果不佳。由于阿仑膦酸中双磷酸基团的引入,使得PG@CoFe2O4表面负电荷偏多。在pH=4.0的溶液中,磷酸基团发生水解,增加了离子交换的几率,同时FQs以阳离子形式存在,其中氟原子、胺基等强吸电子基团与磷酸基团发生静电吸引作用而使去除率达到最高水平。当pH在6.0—8.0范围内时,以阳离子形式存在的FQs含量减少,而兼性离子含量增加。FQs抗生素所特有的基团(—F、—OH)都是很好的吸电子基团,而随着pH的升高,特有基团去质子化的程度增加,电子接收能力降低,FQs与PG@CoFe2O4中石墨化结构(给电子体)之间π-π电子供体受体作用受到抑制[17],故FQs的吸附效果下降。而从图中看出FLE的吸附效果下降明显,是因为FLE结构中含有两个氟原子,诱导力较强。8.0<pH<10.0时,FQs主要以阴离子形式存在,静电斥力导致吸附效果降低。 -
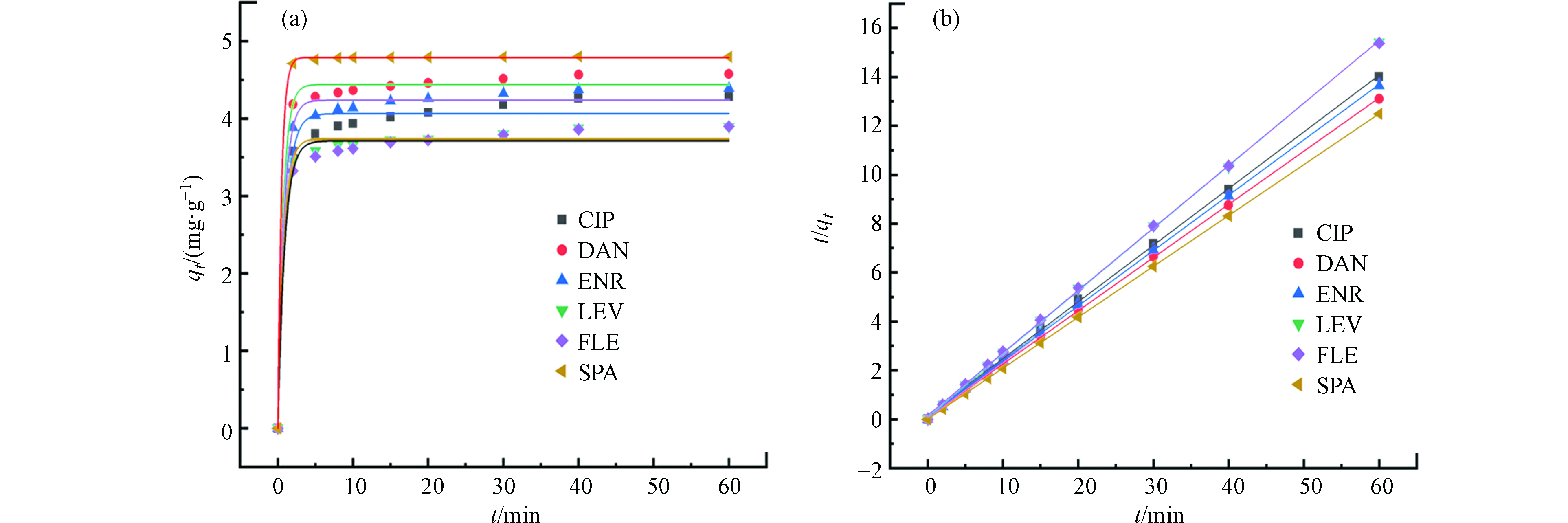
为了研究PG@CoFe2O4对FQs的吸附动力学特性,本文选用准一级动力学方程(3)和准二级动力学方程(4)对吸附数据进行动力学拟合,得到准一级拟合曲线和准二级拟合曲线(图5)。
式中,Qt和Qe分别为吸附时间为t和吸附达到平衡时的吸附量(mg·g−1);k1为准一级吸附速率常数(min−1);k2为准二级吸附速率常数(g·(mg·min)−1)。
一般认为R2越接近1该模型与实验结果越符合。表1显示,准一级模型和准二级模型均能较好地描述吸附过程,但准二级模型(0.9996—0.9998)比准一级模型(0.9795—0.9999)具有更高的相关系数,且准二级模型的qe值和实验值相似,说明PG@CoFe2O4吸附FQs的机理更符合准二级模型,即吸附过程主要以化学吸附为主,物理吸附为辅[18],该结果与文献报道的ENR[19]、CIP[20]等拟合结论一致。
-
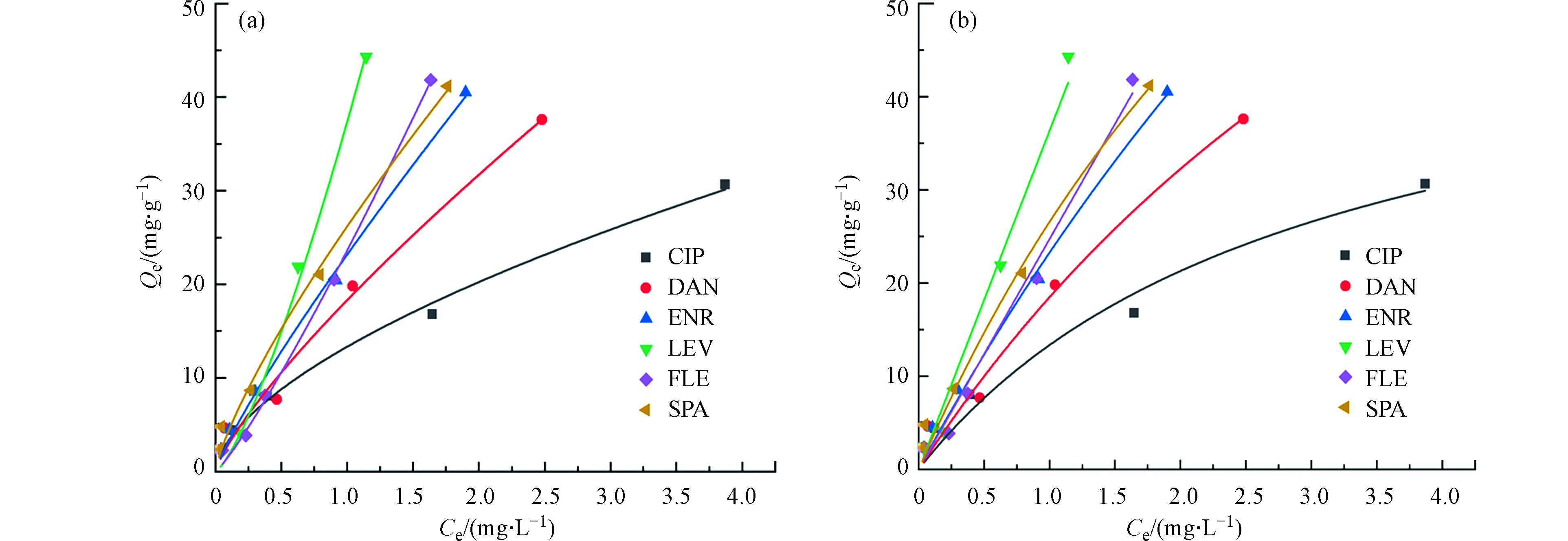
Freundlich模型解释的是不均匀表面上的多层物理吸附,而Langmuir模型解释的是单层均匀表面上的吸附[21]。本文分别利用Freundlich和Langmuir模型考察了PG@CoFe2O4对FQs的吸附行为。Freundlich模型和Langmuir模型方程如下:
式中,Qe为PG@CoFe2O4对FQs的平衡吸附量(mg·g−1),Ce为吸附平衡时溶液中FQs浓度(mg·L−1),KF为Freundlich模型常数,n为吸附强度常数,KL为Langmuir模型常数,Qm为饱和吸附容量(mg·g−1)。
图6和表2分别给出了Freundlich模型和Langmuir模型及各参数拟合结果。在本研究中,Freundlich模型较好地拟合了实验数据,说明本实验的吸附过程存在物理吸附,与已报道的文献结论一致[22-23]。研究表明,Freundlich常数0.1<1/n <0.5时,表明吸附容易发生;n=1时为线性吸附;1/n>2时,表明吸附较难[24]。Freundlich模型中环丙、丹诺、恩诺、司帕的1/n值均小于1,左氧和氟罗1/n值分别为1.33和1.16均小于2,说明6种FQs在PG@CoFe2O4表面的多相多层吸附过程是简单有利的。通过Freundlich模型得出PG@CoFe2O4对6种FQs吸附能力顺序为LEV>FLE>ENR>SPA>DAN>CIP,由于6种FQs不同的辛醇水分配系数(log Kow)疏水分配作用会导致PG@CoFe2O4对6种FQs产生不同的吸附效果。有研究也发现,由于ENR和CIP的log Kow分别为0.54和-0.86,故导致ENR和CIP的最大吸附容量存在较大差异[25],也验证了本实验的结果。
-
在已处理的废水和自然水体等现实水体中,存在
HCO−3 、SO2−4 、Cl− 等各种无机阴离子、腐殖酸、蛋白质、碳水化合物等溶解性有机物以及金属离子。它们的存在可能会竞争性的占据吸附位点,从而一定程度上影响吸附效果,因此考察了其对FQs去除效率的影响。 -
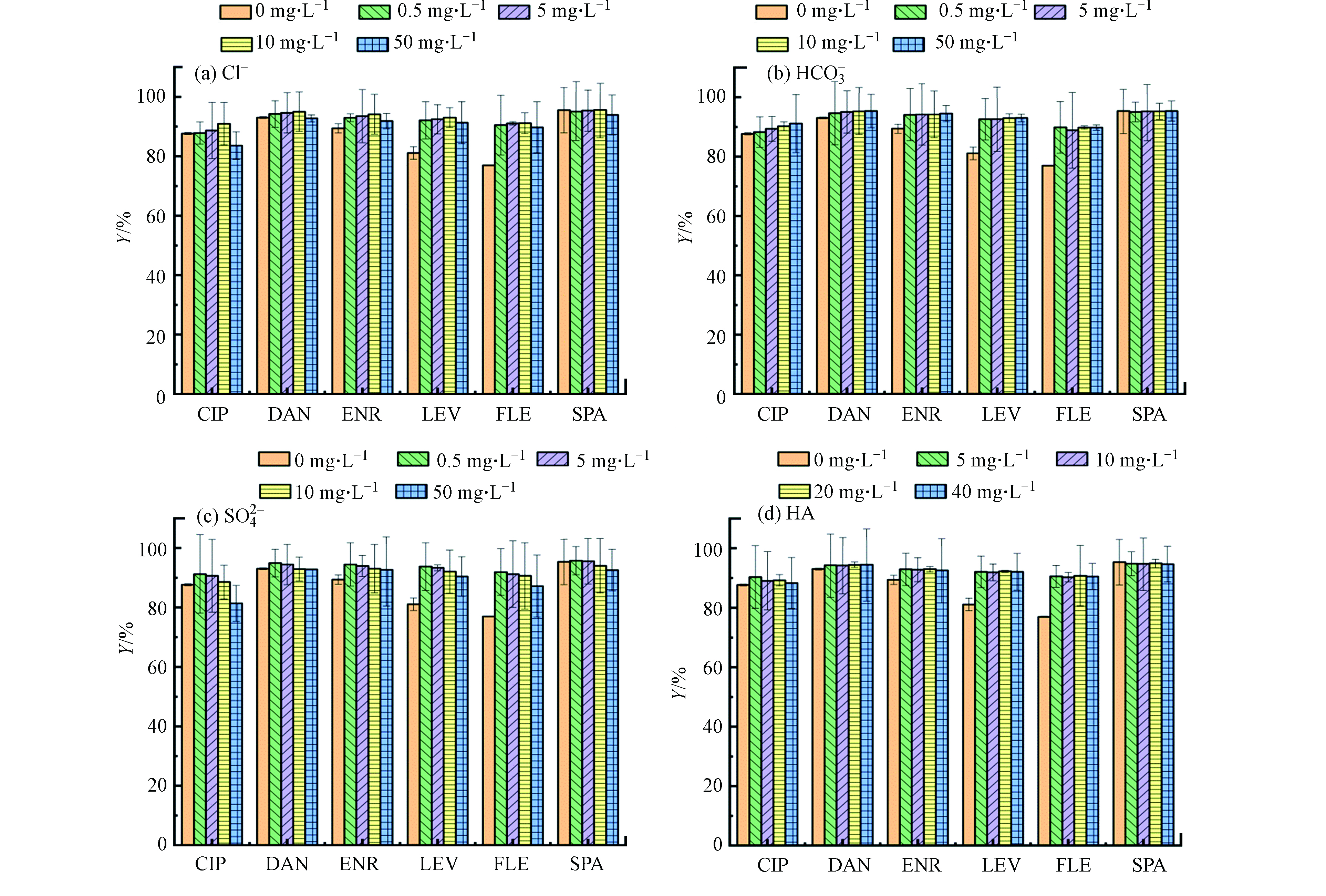
在溶液中加入NaCl(0—50 mg·L−1)并进行一系列批次试验。如图7a所示,随着离子强度从0 mg·L−1增加到10 mg·L−1,CIP、DAN、ENR、LEV、FLE和SPA的去除率呈上升趋势,分别提高了3.6%、2.1%、4.8%、11.9%、14.1%和0.1%,这可以归因于静电屏蔽效应和盐析效应[25-26]。首先,随着离子强度的增加,静电排斥力被屏蔽,因此吸附能力增强。其次,盐析效应可能是吸附的另一个原因,这可促进FQs向PG@CoFe2O4材料表面扩散,最终去除率得到提升。然而当NaCl浓度升至50 mg·L−1时,吸附去除率略有下降,可能是高浓度的Na+会中和材料表面的负电荷抑制静电吸引作用。这一结果也证明了静电相互作用是吸附机理之一。
图7b和7c显示了共存阴离子
HCO−3 和SO2−4 对FQs吸附去除率的影响。结果表明,在浓度(0—50 mg·L−1)情况下,HCO−3 几乎不影响FQs吸附去除率,但高浓度的HCO−3 对FLE的去除产生一定的抑制作用。高浓度SO2−4 的存在对PG@CoFe2O4吸附FQs的影响总体呈一定的抑制趋势。也就是说,电荷是阴离子影响关键参数,SO2−4 带两个负电荷多于HCO−3 所带电荷,对周围吸附位点电荷的分布影响更大,从而减弱FQs与PG@CoFe2O4之间的静电引力。 -
水体中70%的有机质由腐殖酸(HA)组成,因此选择腐殖酸为代表来研究对FQs吸附去除率的影响。图7d展示了吸附去除率随HA浓度变化的情况,结果显示即使在高浓度的HA情况下,PG@CoFe2O4仍对FQs有着较高的吸附性能,因此可以说HA几乎不干扰PG@CoFe2O4对FQs的吸附,仅显示出一定的抑制作用。有文献报道,HA可以通过疏水作用及π-π作用被吸附到化学还原石墨烯上[27],进而和FQs在PG@CoFe2O4上发生竞争吸附,这就对吸附去除率有所下降进行了很好的说明。
-
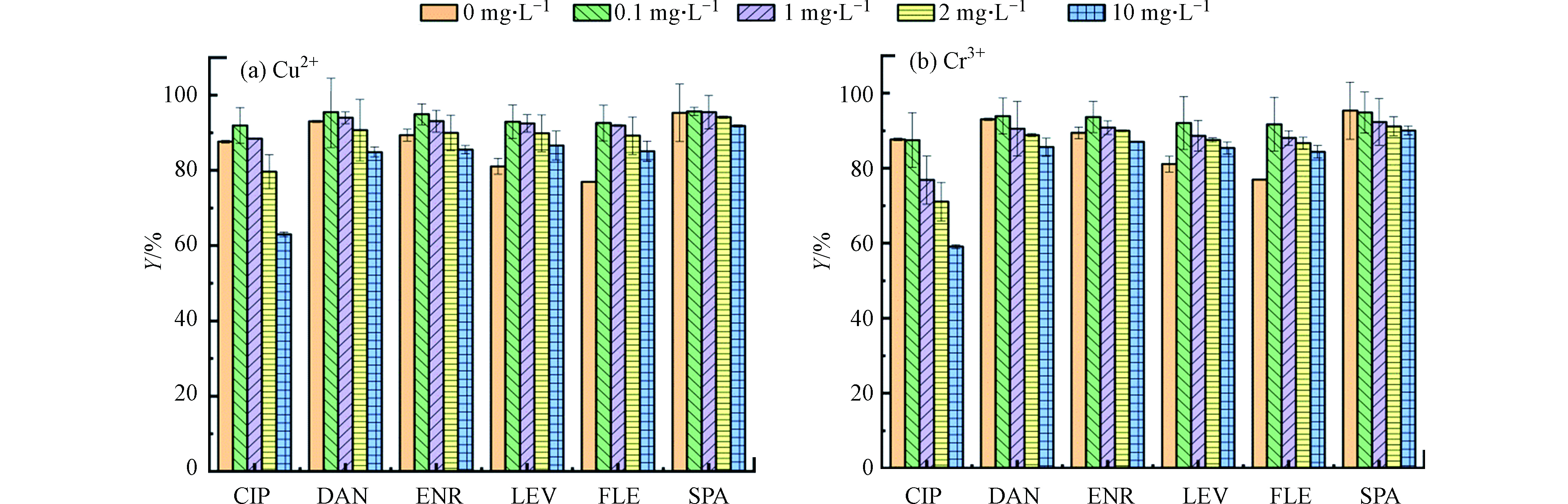
本研究选择了典型的重金属离子(Cu2+和Cr3+)作为影响离子。图8a和8b分别出示了Cu2+和Cr3+对吸附去除FQs的影响。如结果所示,Cu2+和Cr3+的存在对FQs去除的影响相似,均表现为低浓度促进FQs的吸附,随着浓度的增加FQs去除率逐渐降低,这与其他报道的体系中金属阳离子对抗生素的吸附能力有明显的促进不同[28-29]。
有文献报道[30],在吸附过程中,金属离子会从以下几个方面对FQs的吸附产生影响:(1)离子强度变化;(2)金属离子吸附在吸附剂表面[31];(3)在吸附剂与FQs之间形成阳离子桥接[32];(4)FQs中—F、—COOH及C=O容易和金属离子形成重金属离子—FQs络合物[33]。从本实验得到的结果来看,(2)和(4)用来描述金属离子影响FQs吸附的过程更为贴切。首先,当Cu2+和Cr3+在溶液中浓度较低时,竞争作用较弱,该环境下其主要和FQs络合生成络合物,从而促进FQs在PG@CoFe2O4表面的吸附。其次,Cu2+会形成内球配合物优先与吸附剂结合,从而与FQs竞争吸附位点,因此随着Cu2+和Cr3+浓度的增加,FQs的吸附去除受到了抑制。一些研究通过Cu2+和CIP的较高络合常数发现,Cu2+存在时可显著改变CIP的环境行为,即Cu2+ 会和CIP形成络合物而促进亦或抑制CIP的吸附[34],而本实验的显著改变体现在CIP的吸附受到显著抑制。
-
自然水体中存在阴离子(Cl−、
SO2−4 等)、阳离子(NH+4 、K+、Ca2+、Mg2+、Na+等)、腐殖酸等,本文着重研究实际水样中Cl−、SO2−4 、Cu2+、Cr3+对FQs吸附效果的影响。为了研究PG@CoFe2O4在实际水样中的应用性,本研究选择苏州地区的两处地表水样作为样品。通过加标的方法(加标浓度为1.0 mg·L−1),在上述实验得到的最佳条件下进行吸附试验。从表3的数据可以看出,对太湖和石湖两种实际水样中6种FQs的去除率均在90%以上,说明天然水中的共存物质(Cl−、SO2−4 等)通过协同作用有助于PG@CoFe2O4吸附FQs。从实验结果看出,本文制备的PG@CoFe2O4可作为高效吸附剂用于实际生产生活中FQs的去除。 -
(1)本文采用微波辐射法合成了PG@CoFe2O4用于吸附环境水体中的6种FQs。实验数据表明,在室温条件下,PG@CoFe2O4投加量为20.0 mg,溶液pH 4.0时,PG@CoFe2O4能在60 min内对6种FQs去除率达到最高水平,DAN、CIP、ENR、SPA、FLE和LEV的最大去除率分别为91.6%、84.7%、87.5%、95.5%、75.2%和78.8%。
(2)准二级动力学模型和Freundlich模型能较好地拟合吸附过程,说明吸附过程是以化学吸附为主,物理吸附为辅的多相吸附过程。Cl−对吸附有双重作用,
HCO−3 、SO2−4 和HA对吸附的干扰作用较小,而Cu2+和Cr3+抑制了吸附过程。(3)鉴于pH影响因素实验,静电作用对FQs在PG@CoFe2O4上的吸附起着关键作用。其次,PG@CoFe2O4的片状褶皱结构及大的脱位π-电子系统,同时FQs分子中存在吸电子能力极强的氟基团、芳香环和不饱和结构,这使得π-π电子供体-受体作用和孔道填充效应成为吸附机理之一。再者,FQs吸附实验中也伴随有氢键作用。
微波法制备磷酸化石墨烯@CoFe2O4及其对氟喹诺酮类抗生素的吸附
Synthesis of phosphorylated graphene@CoFe2O4 by microwave method for the adsorption of fluoroquinolone antibiotics
-
摘要: 本研究通过微波法制备了磷酸功能化磁性石墨烯(PG@CoFe2O4)材料,并用其吸附水中6种氟喹诺酮类抗生素(FQs)。采用扫描电镜、透射电镜、X射线衍射、磁滞回线等对复合材料进行系统的表征。系统考察了
Cl− 、HCO−3 、SO2−4 和腐殖酸(HA)等对FQs吸附的影响。实验结果显示,在pH=4.0的情况下,PG@CoFe2O4投加量20.0 mg,30 min内6种目标物的去除率最高可达到95.5%。低浓度Cl− 促进吸附而高浓度则抑制吸附,HCO−3 、SO2−4 和HA几乎不影响吸附过程,而Cr3+ 和Cu2+ 抑制FQs的吸附。准一级动力学模型和Freundlich模型拟合效果较好,说明吸附过程以化学吸附为主。两种实际水样中FQs的去除率均高达89.6%以上。实验表明,PG@CoFe2O4对含有氨基和卤素基团的污染物存在特异性吸附。Abstract: Phosphorylated magnetic graphene (PG@CoFe2O4) were fabricated by microwave radiation method and used to adsorb six fluoroquinolone antibiotics (FQs) in water. The composites were systematically characterized by X-ray diffraction (XRD), Fourier transform infrared spectrometry (FTIR), scanning electron microscopy (SEM), transmission electron microscopy (TEM) and X-ray photoelectron spectroscopy (XPS). The effects ofCl− ,HCO−3 ,SO2−4 and humic acid (HA) on the adsorption of FQs were systematically investigated. The experimental results showed that the maximum removal efficiency of six targets could recah up to 95.5% within 30 min based on the condition of pH=4.0, PG@CoFe2O4 20.0 mg. Also, low concentrations ofCl− promoted adsorption while high concentrations inhibited adsorption,HCO−3 ,SO2−4 and HA hardly affected the adsorption process, whileCr3+ andCu2+ inhibited the adsorption of FQs. Besides, the quasi-first-order kinetic model and Freundlich model fit well, indicating that the adsorption process is dominated by chemisorption. The removal efficiency of FQs in both actual water samples were above 89.6%. The experiments showed that the PG@CoFe2O4 was specific for the adsorption of pollutants containing amino and halogen groups. -
水质安全是污水排放与再生回用的关键。病原微生物风险是保障水质安全需要优先控制的问题。总大肠菌群、粪大肠菌群和大肠埃希氏菌(E.coli)常被作为粪便污染的指示微生物,被国内外学者广泛用于评价水的生物安全性[1]。大肠菌群主要以粪口途径传播、通过侵染肠道系统引发疾病,甚至危及人的生命[2]。污水处理厂既是各种污水的汇集地,又是污水经过处理达到一定标准后重新回到生态系统或加以再生利用的重要环节[3]。污水处理厂被认为是大肠菌群的重要来源及传播场所[4]。消毒作为污水处理的最后一道工序,在灭活病原微生物、减少水传染疾病的传播等方面发挥着重要作用。在污水处理厂中,通常采用UV或NaClO消毒对大肠菌群进行灭活[5]。
有研究表明,NaClO消毒可有效灭活细菌,同时水中残留的氯具有持续消毒作用,可保证消毒后水的生物稳定性,但次氯酸钠消毒会产生消毒副产物(DBPs),威胁再生水的用水安全[6]。UV消毒可以在较低剂量下有效灭活病原微生物[7],但UV消毒无持续杀菌能力,且经UV消毒后部分细菌难以被完全杀灭而处于亚致死或活的但不可培养状态[8],这些细菌可在一定条件下通过光复活或暗修复的方式重新获得活性,进而增加再生水储存和输送过程中病原微生物二次滋生的潜在风险。
迄今为止,已有学者在UV-NaClO顺序消毒灭活病原微生物方面开展了相关的研究工作[9-10],但达到与UV或NaClO相同的消毒效果时,UV-NaClO顺序消毒在投加量的优势,消毒后水在输送,储存及再生利用过程中UV-NaClO顺序消毒控制大肠菌群二次滋生的研究却相对较少。本研究以青岛市某市政污水处理厂消毒前的深度处理出水为研究对象,分别采用UV、NaClO以及UV-NaClO顺序消毒,对比分析了在达到排放要求以及再生水不同回用标准时,UV-NaClO顺序消毒对微生物光复活与暗修复的抑制能力及其对DBPs生成量的削减作用。本研究结果可为强化污水消毒,降低污水排放与再生回用的生物安全风险提供参考。
1. 材料与方法
1.1 实验原水
本实验原水取自青岛市某市政污水处理厂,该厂进水主要为生活污水,生物处理采用A2O+MBBR工艺,深度处理工艺为混凝/沉淀/过滤及UV消毒工艺,实验期间该厂过滤后出水,水质的pH为6.93~7.17、PO43--P为0.11~0.19 mg·L−1、NH4+-N为2.26~3.40 mg·L−1、COD为27.00~30.00 mg·L−1、TOC为9.01~11.10 mg·L−1和浊度为1.69~2.94 NTU。采用经过灭菌处理的取样设备取该厂过滤后出水,将水样于4 ℃下保存并尽快进行消毒实验。
1.2 实验方法
通过系列实验研究了不同消毒方式消毒后污水中大肠菌群的灭活效果、复活特性和DBPs生成的影响。每个实验均设3次重复。
1) UV消毒实验。UV消毒实验在自制的平行光束仪下进行。平行光束仪上部有2个功率为20 W的UV灯管,开启UV灯30 min后,用紫外辐照计检测紫外线强度。每次实验时将300 mL水样注入500 mL灭菌后的烧杯中,放入灭菌后的转子,将烧杯置于磁力搅拌器上均匀接受UV辐射,通过调节紫外强度和照射时间确定紫外辐射剂量[11]。
2) NaClO消毒实验。将一定量的NaClO溶液投加到已盛装一定体积水样的500 mL灭菌烧杯中,在磁力搅拌器的搅拌作用下接触反应30 min,用硫代硫酸钠终止反应,取消毒反应前后的水样测定其中的大肠菌群类微生物的数量。
3) UV-NaClO顺序消毒实验。将水样先经一定剂量的UV消毒后,再向其中投加一定量的NaClO溶液,在磁力搅拌器的搅动作用下消毒反应30 min,用硫代硫酸钠终止反应。
4)光复活和暗修复实验。取一定剂量消毒后的水样,分别在日光灯照射(光复活)或避光(暗修复)条件下于25 ℃恒温搅拌放置一定时间,期间定时取样,测定细菌的菌落数。
1.3 分析检测方法
采用孔径为0.45 μm的滤膜对消毒前后的水样进行预处理,之后采用滤膜法对大肠菌群进行测定。截留了菌体的滤膜分为3份,1份置于品红亚硫酸钠培养基上,于37 ℃下培养24 h后转至乳糖蛋白胨半固体培养基上,于37 ℃下培养6~8 h,测定总大肠菌群的数量;1份置于M-FC培养基上,于45 ℃下培养24 h后测定粪大肠菌群的数量;1份置于品红亚硫酸钠培养基上,于37 ℃下培养24 h后转至MUG培养基上,于37 ℃下继续培养4 h后,计算大肠埃希氏菌(E.coli)的菌落数。采用顶空气相色谱法测定水中DBPs的浓度[12]。
1.4 数据分析
采用对数灭活率来评价消毒后细菌的灭活效果,灭活率根据式(1)进行计算。利用复活百分比来表征光复活和暗修复程度,复活率百分比根据式(2)进行计算。
A=lg(N0N) (1) B=NP−NN0−N×100% (2) 式中:A为灭活率,%;B为复活百分比,%;N0和N分别为消毒前和消毒后水样中的大肠菌群数量,CFU·L−1;NP 为光复活或暗修复后水样中的大肠菌群数量,CFU·L−1。
2. 结果与讨论
2.1 单独UV或NaClO消毒对大肠菌群的灭活
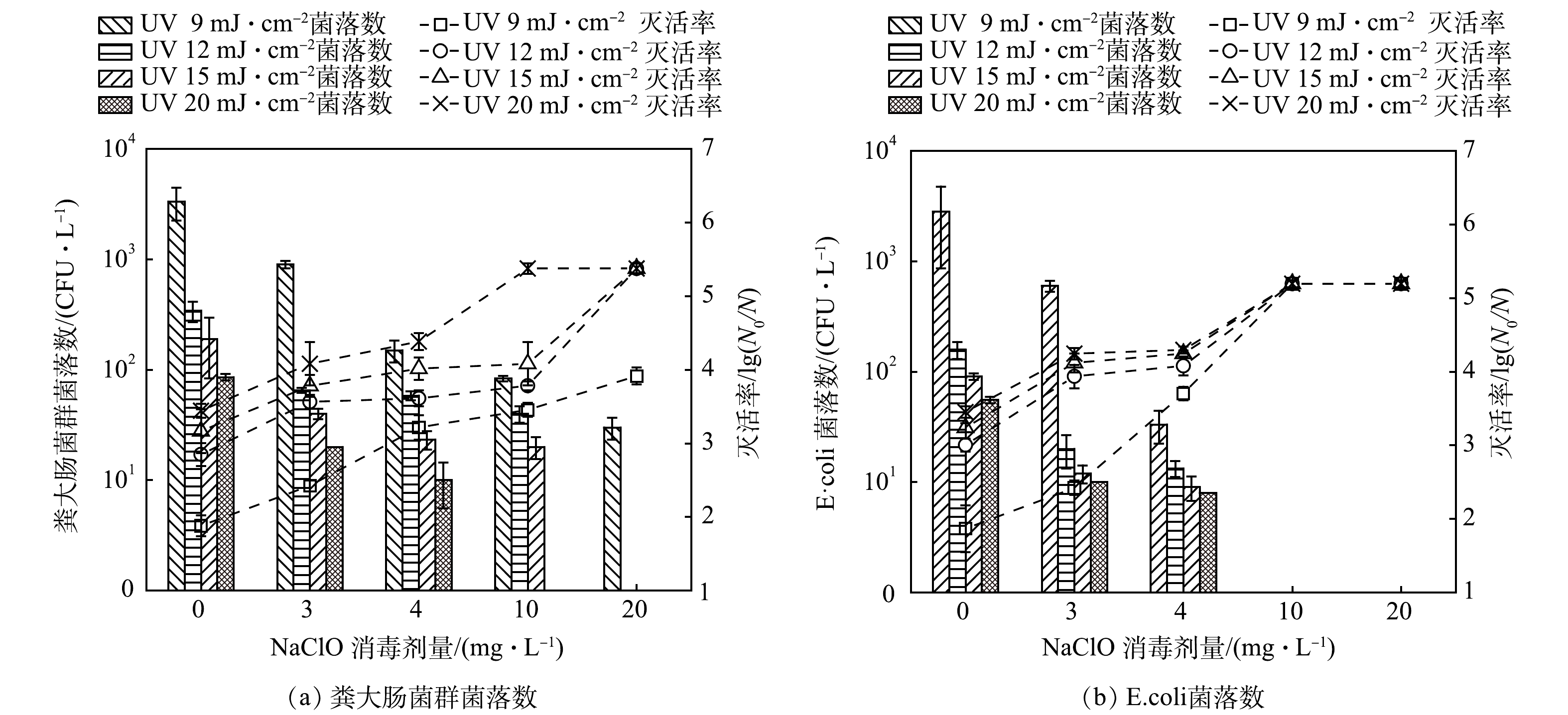
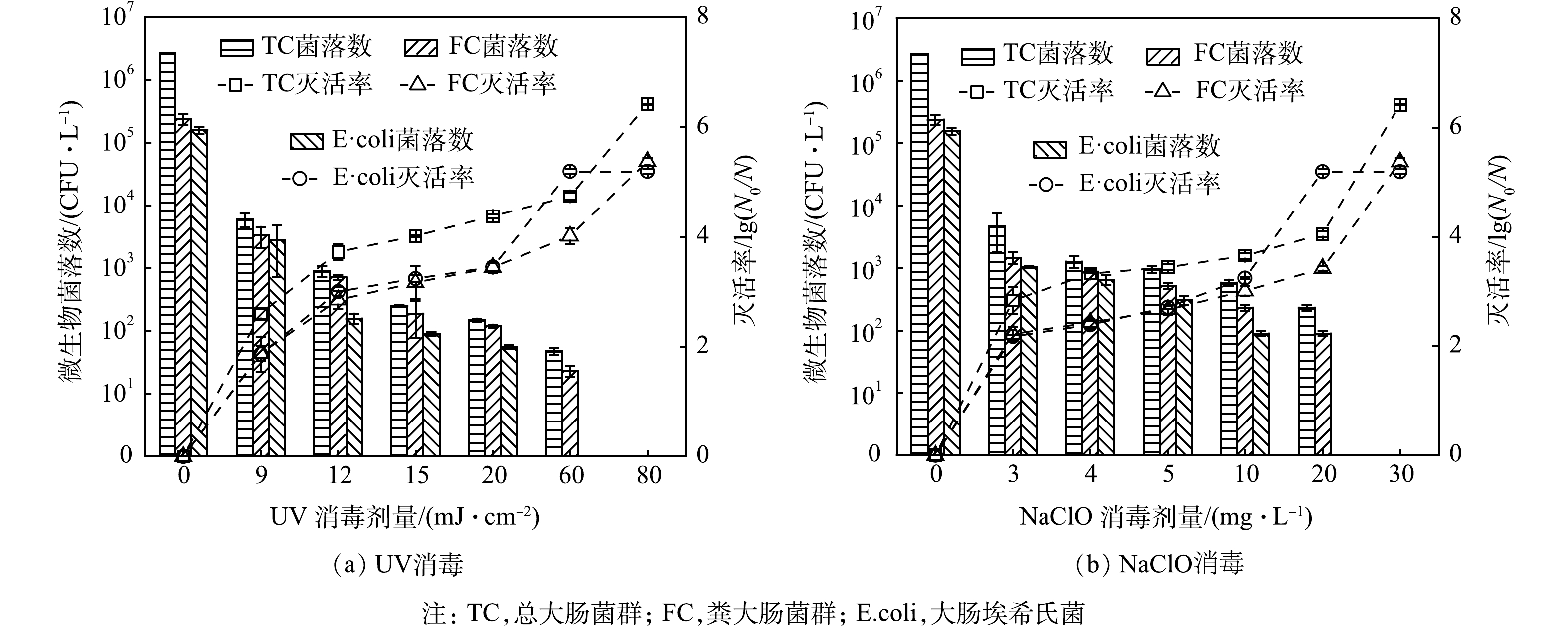
不同剂量下单独UV消毒或NaClO消毒对总大肠菌群、粪大肠菌群和大肠埃希氏菌(E.coli)的灭活情况如图1所示。消毒剂量对大肠菌群类微生物的灭活影响较大,随着UV剂量或NaClO投加量的增加,大肠菌群数量随之下降。当UV剂量仅为12 mJ·cm−2时,大肠菌群类微生物的灭活率即可达到接近或超过3个对数级;当NaClO投加量仅为3 mg·L−1时,大肠菌群类微生物可达到2个对数级的灭活率。此后,进一步增加消毒剂量,微生物数量下降幅度趋缓,如当UV剂量由12 mJ·cm−2增加到60 mJ·cm−2时,总大肠菌群和粪大肠菌群的灭活率仅提高不足1个对数级,当NaClO的投加量从3 mg·L−1增加到20 mg·L−1时,总大肠菌群的灭活率也仅增加了1.22个对数级。相较于其他的粪大肠菌,E.coli更易被灭活,当UV剂量达到60 mJ·cm−2时,已检测不到E.coli。完全灭活总大肠菌群或粪大肠菌群需要80 mJ·cm−2 UV或30 mg·L−1 NaClO。
当UV消毒剂量达到12 mJ·cm−2和20 mJ·cm−2时,粪大肠菌群数量可分别满足《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A排放标准[13](简称“一级A标准”)中“≤1 000 CFU·L−1”以及《城市污水再生利用绿地灌溉水质》(GB/T 25499-2010)(简称“绿地灌溉标准”)中非限制性绿地的“≤200 CFU·L−1”的要求[14]。当UV消毒剂量达到60 mJ·cm−2时,E.coli可满足《城市污水再生利用 城市杂用水水质》(GB/T 18920-2020)中“大肠埃希氏菌不得检出”的要求[15](简称“杂用水标准”)[16]。消毒后的水样要达到一级A标准、绿地灌溉标准以及杂用水标准,NaClO投加量分别需达到4、10和20 mg·L−1。
2.2 UV-NaClO顺序消毒对大肠菌群灭活的影响
为探究UV-NaClO顺序消毒应用于污水消毒的可行性,在不同UV和NaClO剂量组合条件下分析了UV-NaClO顺序消毒对水样中大肠菌群的灭活效果,结果如图2所示。UV-NaClO顺序消毒更有利于大肠菌群的灭活,顺序消毒的效果好于UV或NaClO单独消毒的效果。仅采用UV消毒,当UV剂量为9 mJ·cm−2时,粪大肠菌群的菌落数可由2.4×105 CFU·L−1降至3.4×103 CFU·L−1;仅采用NaClO消毒,当NaClO投加量为3 mg·L−1时,消毒后粪大肠菌群的数量降为1.5×103 CFU·L−1;若采用UV-NaClO 顺序消毒,UV和NaClO的剂量分别为9 mJ·cm−2和3 mg·L−1时,消毒后粪大肠菌群的数量可降至9.0×102 CFU·L−1,与单独UV或单独NaClO消毒相比,粪大肠菌群的数量分别降低了73.5%和40.0%。
表1对比了达到不同处理效果时不同消毒方式所需消毒剂的最低投加量。由对比结果可知,采用UV-NaClO顺序消毒,可以在相对较低的消毒剂投加量下就可达到单一消毒剂在较高剂量下所达到的消毒效果,尤其是当需要达到的排放标准较高时,采用UV-NaClO顺序消毒的优势更加明显。例如,当出水仅需满足一级A标准,即粪大肠菌群数量≤1000 CFU·L−1时,采用UV-NaClO顺序消毒需要的UV及NaClO剂量分别为9 mJ·cm−2和3 mg·L−1,同单独UV或NaClO消毒在消毒剂投加量上相比未表现出较大优势;若出水需满足杂用水标准规定的E.coli不得检出的要求,单独UV或NaClO消毒需要的UV或NaClO剂量分别为60 mJ·cm−2或20 mg·L−1,而采用UV-NaClO顺序消毒则仅需9 mJ·cm−2 UV和10 mg·L−1 NaClO。若达到完全灭活粪大肠菌群的目标,UV-NaClO顺序消毒在投加量上的优势则更加明显。
表 1 不同污水排放标准下不同消毒方式所需的最小消毒剂量Table 1. Minimum disinfection dosage required by different disinfection methods for different sewage discharge standards出水标准 限值要求/(CFU·L−1) UV消毒/(mJ·cm−2) NaClO消毒/(mg·L−1) UV- NaClO顺序消毒UV(mJ·cm−2)/NaClO(mg·L−1) 一级A标准 FC≤1000 12 4 9/3 绿地灌溉标准 FC≤200 20 10 9/4 杂用水标准 E.coli 不得检出 60 20 9/10 完全灭活FC 80 30 20/10 UV-NaClO顺序消毒相比单一消毒剂所具有的优势,可能是由于微生物对不同消毒方式的耐受程度不同。有研究表明,经UV消毒后磺胺类抗生素耐药菌的比例显著升高,而低剂量的NaClO消毒则能有效降低此类细菌的比例[17-18],因而投加低剂量的NaClO即可达到或超过高剂量UV消毒所达到的效果。同样有一些细菌(Cryptosporidium)对氯消毒具有很强的耐受能力[19],对于这类细菌采用低剂量的UV辐射也可能达到较好的灭活效率。因而,UV-NaClO顺序消毒中UV和NaClO具有协同效应,可以灭活单一消毒剂所不能完全灭活的微生物,且可以在UV和NaClO剂量均不高的组合方式下即可达到更优的消毒效果。
2.3 UV-NaClO顺序消毒对微生物复活的抑制作用
在满足相同出水标准时,经UV-NaClO顺序消毒后微生物的复活能力明显低于单独UV消毒(图3),尤其是当NaClO的投加量较高时,对微生物复活的抑制作用更为明显。在满足一级A排放标准的消毒剂投加量下,单独UV(12 mJ·cm−2)消毒后分别经24 h光复活和暗修复后,粪大肠菌群的复活率为7.97%和4.96%,而经UV-NaClO(UV剂量9 mJ·cm−2和3 mg·L−1 NaClO )顺序消毒后粪大肠菌群复活率仅为3.21%和0.84%,较单独UV消毒分别减少了4.76%和4.12%。当UV剂量不变,NaClO投加量增加到4 mg·L−1时,UV-NaClO顺序消毒后在相同的复活时间内,粪大肠菌群的复活率仅为0.3%(光复活)和0.01%(暗修复),虽然NaClO投加量仅增加了1 mg·L−1,但细菌复活率明显降低。
当UV剂量为60 mJ·cm−2时,单独UV消毒可完全灭活E.coli,但在光照下经3 h复活后,E.coli的数量即可增加为33 CFU·L−1;经24 h的暗修复,E·coli可增加至66 CFU·L−1(图3(e))。采用UV-NaClO顺序消毒,当UV剂量为9 mJ·cm−2和NaClO投加量10 mg·L−1也可完全灭活E.coli,但是,消毒后的水样无论是在光照下还是在暗处,24 h内均未出现细菌复活的现象。因而,在UV消毒后,继续投加少量的NaClO可以减小微生物复活的概率。UV-NaClO顺序消毒之所以可以抑制微生物的复活主要是由于NaClO作为强氧化剂,其对微生物的灭活作用是通过氧化细胞中的酶、阻止蛋白质合成这一途径实现的,这种对细胞的破坏作用不具有可逆性,因此,被NaClO灭活的微生物不会出现复活的现象。
当处理后出水再生回用于绿地灌溉时,仅采用UV消毒,在光照条件下,3 h后再生水中的粪大肠菌群数即会超标,采用UV-NaClO顺序消毒,6 h后粪大肠菌群数可能会超标;当处理后出水再生回用于城市杂用时,仅采用UV消毒,在光照条件下,3 h后E.coli的数量超标,而采用UV-NaClO顺序消毒,24 h后E·coli数量仍然可以满足标准要求。同光复活相比,细菌暗修复的能力较弱,如仅采用UV消毒满足绿地灌溉或城市杂用标准时,经24 h暗修复后,细菌数量才出现超标的现象,采用UV-NaClO顺序消毒后的水样,在暗处放置24 h后,细菌数量均未出现超标的现象。因而,考虑到再生水输配管网的长度以及再生水使用的非连续性特点,采用UV-NaClO顺序消毒更有利于保证再生水的水质安全。同时在实际工程中,再生水的输送及储存应尽量采用密闭式系统,以降低消毒后细菌复活的可能性。
通过本研究可知,单独 UV 消毒不能有效的防止大肠菌群从污水处理厂向环境中传播,而采用UV-NaClO顺序消毒可在一定程度上抑制大肠菌群的二次滋生,减少了消毒后水在输送,储存及再生利用过程中潜在的生物风险。
2.4 UV-NaClO顺序消毒对DBPs生成的影响
为考察UV-NaClO顺序消毒对DBPs生成的影响,采用顶空气相色谱法分析了不同方式消毒后三氯甲烷、四氯化碳、二溴一氯甲烷和一溴二氯甲烷的生成量,并计算了DBPs的总生成量,结果如表2所示。在满足相同出水标准时,UV-NaClO顺序消毒DBPs的生成量明显低于单独NaClO消毒。尤其是当需要达到的出水标准越高时优势越明显。满足一级A排放标准时,采用UV-NaClO顺序消毒产生的总DBPs比单独NaClO消毒可减少24.53%;达到绿地灌溉标准时,单独NaClO消毒生成的总DBPs量为11.56 μg·L−1,UV-NaClO顺序消毒生成的总DBPs为5.79 μg·L−1,比NaClO消毒DBPs生成量降低了49.91%;满足杂用水标准时,UV-NaClO顺序消毒总DBPs的生成量比单独NaClO消毒可降低76.87%;在达到完全灭活粪大肠菌群的条件下,DBPs的减量可高达77.85%。
表 2 NaClO和UV-NaClO顺序消毒时DBPs生成量的比较Table 2. Comparison of DBPs generation after NaClO and UV-NaClO disinfection出水标准 NaClO消毒/(mg·L−1) DBPs生成量/(μg·L−1) UV- NaClO顺序消毒UV(mJ·cm−2)/NaClO(mg·L−1) DBPs生成量/(μg·L−1) 一级A标准 4 3.18±2.14 9/3 2.4±1.68 绿地灌溉标准 10 11.56±2.03 9/4 5.79±1.76 杂用水标准 20 52.27±2.65 9/10 12.09±2.23 完全灭活FC 30 65.32±2.87 20/10 14.47±1.89 DBPs的生成量同氯的投加量密切相关,随着氯投加量的增加,DBPs的生成量显著增加[20]。采用UV-NaClO顺序消毒之所以可以降低DBPs的生成量,主要是由于在达到相同消毒效果时UV-NaClO顺序消毒所需的NaClO投加量低于单独NaClO消毒时的投加量,而且,当需要达到的消毒标准越高时,所需NaClO投加量低的优势越明显,如完全灭活粪大肠菌群时,单独NaClO消毒需要的NaClO投加量为30 mg·L−1,而采用UV-NaClO顺序消毒则只需投加10 mg·L−1的NaClO,因而,采用UV-NaClO顺序消毒可大幅降低DBPs的生成量。
大部分DBPs具有潜在的致癌、致畸和致突变毒性,较高浓度DBPs排入水体或再生利用时会威胁生态系统安全,并对人体健康具有潜在危害[21],UV-NaClO顺序消毒可避免大量的DBPs排入水体或进入再生水利用系统,因而,其在保护人体健康与生态环境等方面更具优势。
3. 结论
1) UV和NaClO对大肠菌群的灭活具有协同效应,采用UV-NaClO顺序消毒,在UV和NaClO投加量均不高的组合方式下即可达到单独UV或单独NaClO高剂量下的消毒效果,且当需要达到的消毒标准越高时,UV-NaClO顺序消毒的优势越明显。
2)经UV-NaClO顺序消毒后,大肠菌群的光复活和暗修复能力相比单独UV消毒有所下降,NaClO投加量越高下降幅度越明显,因而,采用UV-NaClO顺序消毒可在一定程度上抑制大肠菌群的二次滋生。
3)由于在达到相同消毒效果的前提下,UV-NaClO顺序消毒可以有效降低NaClO的投加量,因而,采用UV-NaClO顺序消毒可以降低DBPs的生成量,从而降低消毒对人体健康与生态环境的潜在危害。
-
表 1 FQs在PG@CoFe2O4上的吸附动力学参数
Table 1. Kinetic parameters for adsorption of FQs on PG@CoFe2O4
FQs 拟一级动力学模型 Quasi-first-order kinetic model 拟二级动力学模型 Quasi-second-order kinetic model qe/(mg·g−1) k1/min−1 R2 qe/(mg·g−1) k2/(g·(mg·min)−1) R2 CIP 4.0657 1.0325 0.9846 4.3154 0.3307 0.9995 DAN 4.4430 1.4097 0.9948 4.5956 0.5816 0.9998 ENR 4.2407 1.2265 0.9923 4.4163 0.4939 0.9998 LEV 3.7409 1.2737 0.9924 3.9079 0.5058 0.9997 FLE 3.7134 1.1053 0.9885 3.9162 0.4086 0.9996 SPA 4.7926 2.0622 0.9999 4.8054 7.0416 1.0000 表 2 FQs在PG@CoFe2O4上的吸附等温线拟合参数
Table 2. Adsorption isotherm fitting parameters for adsorption of FQs on PG@CoFe2O4
FQs Freundlich Langmuir KF 1/n R2 qm/(mg·g−1) KL R2 CIP 0.2069 0.6029 0.9938 52.7382 0.3381 0.9602 DAN 0.0766 0.7927 0.9795 126.5833 0.1708 0.9756 ENR 0.0637 0.8536 0.9956 213.9142 0.1219 0.9909 LEV 0.0039 1.3270 0.9880 413.9253 0.0002 0.9474 FLE 0.0079 1.1575 0.9965 315.8589 0.0003 0.9865 SPA 0.1192 0.7805 0.9895 141.8438 0.2302 0.9814 表 3 两种实际水样对FQs在PG@CoFe2O4上吸附的影响
Table 3. Influence of two actual water samples on FQs adsorption on PG@CoFe2O4
实际水样Actual water samples 基础数据/(mg·L−1)Basic data 去除率/%Removal rate CIP DAN ENR LEV FLE SPA 水样1Water sample 1 TOC 12.95 89.62 94.49 93.48 93.85 94.99 95.91 SO2−4 46.39 Cl- 46.39 Cr3+ — Cu2+ — 水样2Water sample 2 TOC 10.51 89.83 94.55 93.62 93.85 94.97 96.12 SO2−4 50.89 Cl- 35.51 Cr3+ — Cu2+ — -
[1] CHEN J, YING G G, DENG W J. Antibiotic residues in food: Extraction, analysis, and human health concerns [J]. Journal of Agricultural and Food Chemistry, 2019, 67(27): 7569-7586. doi: 10.1021/acs.jafc.9b01334 [2] KOVALAKOVA P, CIZMAS L, MCDONALD T J, et al. Occurrence and toxicity of antibiotics in the aquatic environment: A review [J]. Chemosphere, 2020, 251: 126351. doi: 10.1016/j.chemosphere.2020.126351 [3] FELSEN C B, DODDS ASHLEY E S, BARNEY G R, et al. Reducing fluoroquinolone use and Clostridioides difficile infections in community nursing homes through hospital-nursing home collaboration [J]. Journal of the American Medical Directors Association, 2020, 21(1): 55-61. doi: 10.1016/j.jamda.2019.11.010 [4] DING G Y, CHEN G L, LIU Y D, et al. Occurrence and risk assessment of fluoroquinolone antibiotics in reclaimed water and receiving groundwater with different replenishment pathways [J]. Science of the Total Environment, 2020, 738: 139802. doi: 10.1016/j.scitotenv.2020.139802 [5] RICHARDS G A, BRINK A J, FELDMAN C. Rational use of the fluoroquinolones [J]. South African Medical Journal, 2019, 109(6): 378-381. doi: 10.7196/SAMJ.2019.v109i6.14002 [6] YANG W J, FULIDONG F, MA J W, et al. Research progress of antibiotic pollution and treatment technologies in China [J]. E3S Web of Conferences, 2020, 194: 04004. doi: 10.1051/e3sconf/202019404004 [7] TZENG T W, LIU Y T, DENG Y, et al. Removal of sulfamethazine antibiotics using cow manure-based carbon adsorbents [J]. International Journal of Environmental Science and Technology, 2016, 13(3): 973-984. doi: 10.1007/s13762-015-0929-4 [8] LUO J W, LI X, GE C J, et al. Sorption of norfloxacin, sulfamerazine and oxytetracycline by KOH-modified biochar under single and ternary systems [J]. Bioresource Technology, 2018, 263: 385-392. doi: 10.1016/j.biortech.2018.05.022 [9] ZHU Y W, MURALI S, CAI W W, et al. Graphene and graphene oxide: Synthesis, properties, and applications [J]. Advanced Materials, 2010, 22(35): 3906-3924. doi: 10.1002/adma.201001068 [10] EL-SHOBAKY G A, TURKY A M, MOSTAFA N Y, et al. Effect of preparation conditions on physicochemical, surface and catalytic properties of cobalt ferrite prepared by coprecipitation [J]. Journal of Alloys and Compounds, 2010, 493(1/2): 415-422. [11] ATI A, OTHAMAN Z, SAMAVATI A. Influence of cobalt on structural and magnetic properties of nickel ferrite nanoparticles [J]. Journal of Molecular Structure, 2013, 1052: 177-182. doi: 10.1016/j.molstruc.2013.08.040 [12] 匡嘉敏. CoFe2O4/rGO复合纳米材料的制备及其性能研究[D]. 吉林: 东北电力大学, 2017. KUANG J M. Study on the preparation and properties of cobalt ferrite/reduced graphene oxide nanocomposites[D]. Jilin, China: Northeast Dianli University, 2017(in Chinese).
[13] MENG L Y, WANG B, MA M G, et al. The progress of microwave-assisted hydrothermal method in the synthesis of functional nanomaterials [J]. Materials Today Chemistry, 2016, 1/2: 63-83. doi: 10.1016/j.mtchem.2016.11.003 [14] RATHI A K, GAWANDE M B, ZBORIL R, et al. Microwave-assisted synthesis – Catalytic applications in aqueous media [J]. Coordination Chemistry Reviews, 2015, 291: 68-94. doi: 10.1016/j.ccr.2015.01.011 [15] 张志宾, 张昊岩, 邱燕芳, 等. 磷酸化石墨烯吸附铀的性能研究 [J]. 中国科学:化学, 2019, 49(1): 195-206. doi: 10.1360/N032018-00153 ZHANG Z B, ZHANG H Y, QIU Y F, et al. Adsorption of uranium by phosphorylated graphene oxide [J]. Scientia Sinica (Chimica), 2019, 49(1): 195-206(in Chinese). doi: 10.1360/N032018-00153
[16] LU X F, YANG L, BIAN X J, et al. Rapid, microwave-assisted, and one-pot synthesis of magnetic palladium-CoFe2O4 -graphene composite nanosheets and their applications as recyclable catalysts [J]. Particle & Particle Systems Characterization, 2014, 31(2): 245-251. [17] 戴江栋. 多孔碳基材料的可控制备及其高效分离抗生素行为和机理研究[D]. 镇江: 江苏大学, 2016. DAI J D. Controlled preparation of porous carbon-based materials and study on behavior and mechanism of high-efficiency antibiotic separation[D]. Zhenjiang, China: Jiangsu University, 2016(in Chinese).
[18] BULUT E, OZACAR M, SENGIL I A. Equilibrium and kinetic data and process design for adsorption of Congo Red onto bentonite [J]. Journal of Hazardous Materials, 2008, 154(1/2/3): 613-622. [19] CHOWDHURY S, SIKDER J, MANDAL T, et al. Comprehensive analysis on sorptive uptake of enrofloxacin by activated carbon derived from industrial paper sludge [J]. The Science of the Total Environment, 2019, 665: 438-452. doi: 10.1016/j.scitotenv.2019.02.081 [20] ZHAO J, LIANG G W, ZHANG X L, et al. Coating magnetic biochar with humic acid for high efficient removal of fluoroquinolone antibiotics in water [J]. The Science of the Total Environment, 2019, 688: 1205-1215. doi: 10.1016/j.scitotenv.2019.06.287 [21] TANG L, YU J F, PANG Y, et al. Sustainable efficient adsorbent: Alkali-acid modified magnetic biochar derived from sewage sludge for aqueous organic contaminant removal [J]. Chemical Engineering Journal, 2018, 336: 160-169. doi: 10.1016/j.cej.2017.11.048 [22] 周俊, 李燕, 管益东, 等. 杨木生物炭对水溶液中3种磺胺类抗生素的混合吸附 [J]. 环境工程, 2021, 39(3): 1-6,13. doi: 10.13205/j.hjgc.202103001 ZHOU J, LI Y, GUAN Y D, et al. Mixed sorption of three aqueous sulfonamides onto the biochar derived from poplar wood chips [J]. Environmental Engineering, 2021, 39(3): 1-6,13(in Chinese). doi: 10.13205/j.hjgc.202103001
[23] HUANG P, GE C J, FENG D, et al. Effects of metal ions and pH on ofloxacin sorption to cassava residue-derived biochar [J]. Science of the Total Environment, 2018, 616/617: 1384-1391. doi: 10.1016/j.scitotenv.2017.10.177 [24] AKSU Z, DÖNMEZ G. Binary biosorption of cadmium(II) and nickel(II) onto dried Chlorella vulgaris: Co-ion effect on mono-component isotherm parameters [J]. Process Biochemistry, 2006, 41(4): 860-868. doi: 10.1016/j.procbio.2005.10.025 [25] 王琦, 胡碧波, 阳春, 等. 烷基功能化磁性介孔硅的制备及其对氟喹诺酮类抗生素的吸附 [J]. 环境工程学报, 2020, 14(9): 2450-2462. doi: 10.12030/j.cjee.202001019 WANG Q, HU B B, YANG C, et al. Fabrication of alkyl-functionalized magnetic mesoporous silica and its adsorption of fluoroquinolone antibiotics [J]. Chinese Journal of Environmental Engineering, 2020, 14(9): 2450-2462(in Chinese). doi: 10.12030/j.cjee.202001019
[26] PENG X M, HU F P, ZHANG T, et al. Amine-functionalized magnetic bamboo-based activated carbon adsorptive removal of ciprofloxacin and norfloxacin: A batch and fixed-bed column study [J]. Bioresource Technology, 2018, 249: 924-934. doi: 10.1016/j.biortech.2017.10.095 [27] ZHAO J, WANG Z Y, WHITE J C, et al. Graphene in the aquatic environment: Adsorption, dispersion, toxicity and transformation [J]. Environmental Science & Technology, 2014, 48(17): 9995-10009. [28] GU X Y, TAN Y Y, TONG F, et al. Surface complexation modeling of coadsorption of antibiotic ciprofloxacin and Cu(Ⅱ) and onto goethite surfaces [J]. Chemical Engineering Journal, 2015, 269: 113-120. doi: 10.1016/j.cej.2014.12.114 [29] PEI Z G, SHAN X Q, KONG J J, et al. Coadsorption of ciprofloxacin and Cu(II) on montmorillonite and kaolinite as affected by solution pH [J]. Environmental Science & Technology, 2010, 44(3): 915-920. [30] LI X Z, BI E P. The impacts of Cu(II) complexation on gatifloxacin adsorption onto goethite and hematite [J]. Journal of Environmental Quality, 2020, 49(1): 50-60. doi: 10.1002/jeq2.20016 [31] HUANG D F, XU Y B, YU X Q, et al. Effect of cadmium on the sorption of tylosin by polystyrene microplastics [J]. Ecotoxicology and Environmental Safety, 2021, 207: 111255. doi: 10.1016/j.ecoenv.2020.111255 [32] MA J, XIONG Y C, DAI X H, et al. Coadsorption behavior and mechanism of ciprofloxacin and Cu(Ⅱ) on graphene hydrogel wetted surface [J]. Chemical Engineering Journal, 2020, 380: 122387. doi: 10.1016/j.cej.2019.122387 [33] ZHANG H C, HUANG C H. Adsorption and oxidation of fluoroquinolone antibacterial agents and structurally related amines with goethite [J]. Chemosphere, 2007, 66(8): 1502-1512. doi: 10.1016/j.chemosphere.2006.08.024 [34] 童非, 顾雪元. 重金属离子与典型离子型有机污染物的络合效应研究 [J]. 中国环境科学, 2014, 34(7): 1776-1784. TONG F, GU X Y. Study on complexation effect between heavy metal cations and typical ionic organic pollutants [J]. China Environmental Science, 2014, 34(7): 1776-1784(in Chinese).
-






















 下载:
下载: