-
腐殖质是动植物或微生物残体经过生物、非生物的氧化、降解及聚合等多种作用形成的一种天然有机化合物,广泛存在于土壤、沉积物及河流、湖泊等水生环境中。土壤中腐殖质含量约占总有机质含量的 85%—90%,是有机质的主要组成部分[1]。腐殖质呼吸是近年来新发现的可参与环境污染生物降解的微生物能量代谢方式。腐殖质本身矿化率低,不易被微生物分解,但可作为微生物呼吸的电子受体参与有机物矿化过程,氧化小分子易降解有机质,产生 CO2,从而影响自然界的碳循环。在厌氧条件下,某些土壤与水体沉积物中,80%以上的有机碳矿化由微生物的腐殖质呼吸直接完成,超过产甲烷呼吸、硝酸盐呼吸、硫酸盐呼吸等其它代谢方式的总和[2]。同时腐殖质可作为氧化还原介体促进其他难降解污染物的生物还原,如偶氮染料[3-4],Fe(Ⅲ)和Cr(Ⅵ)[5],以及硝酸盐[6]等。可进行腐殖质呼吸的微生物被称为腐殖质还原菌[7],腐殖质还原菌以环境中有机底物为电子供体,以腐殖质及其醌类模式物为唯一电子受体进行电子传递。最早Lovley发现Geobacter metallireducens和Shewanellaalga可以利用蒽醌-2,6-双磺酸(AQDS)为电子受体加速有机质和H2的厌氧氧化[8]。腐殖质还原菌与腐殖质之间的电子穿梭对于有机污染物的降解转化具有重要意义。
腐殖质上的醌类结构是其作为氧化还原介体的活性组分[9],目前学者们以醌类物为腐殖质模式物已在土壤、河湖沉积物、堆肥以及水体等环境介质中富集分离出多种腐殖质还原菌[10—14],按照对氧气需求不同分为严格厌氧菌和兼性厌氧菌,主要以Proteobacteria、Acidobacteria与Firmicutes这3个门为主[9]。在腐殖质还原菌生物还原体系中,腐殖质还原菌的浓度和活性是醌类物发挥氧化还原介体作用催化生物反应的关键因素[15]。然而目前对腐殖质还原菌的生长特性及醌还原特性研究较少。
因此,本研究的主要对已经鉴定完的腐殖质还原菌Citrobacter freundii从碳源比、碳源浓度、C/N等角度优化其生长条件;了解腐殖质还原菌的生长与醌还原特性,并通过红外测定沉积物的结构,为其应用到河道沉积物修复领域提供理论依据;将腐殖质还原菌应用到河道沉积物修复领域,考察其降解沉积物有机质的能力,拓展修复河道沉积物的方法。
-
本研究从沉积物富集、分离、筛选得到一株生长速度最快且还原能力较强的腐殖质还原菌。经16S rDNA序列分析,鉴定筛选出的腐殖质还原菌为弗氏柠檬酸杆菌(Citrobacter freundii),属兼性厌氧菌。
菌种子液制备方法:将纯菌菌液在10000 r·min−1转速下离心10 min,弃去上清液,加入无菌生理盐水冲洗菌株以去除原培养基残留,反复进行2次,最后制成OD600 nm为1.0的菌悬液。
-
根据菌株的生长、醌还原以及经济效益情况,Citrobacter freundii生长培养基:碳源选择柠檬酸钠和葡萄糖,氮源选择氯化铵,α-AQS 0.25 mmol·L−1,KH2PO4 0.5 g·L−1,MgSO4 0.2 g·L−1。设置碳源比(A)(葡萄糖/(葡萄糖+柠檬酸钠))、碳源浓度(B)和C/N (C) 3个影响因素,通过Box-Behnken设计响应曲面,最终确定的因素水平如表1所示。为统一碳源浓度的量化标准,各碳源浓度均以当量葡萄糖表示。
-
实验选取3种醌类物:2-羟基-1,4-萘醌(指甲花醌,纯度98%),蒽醌-1-磺酸钠(α-AQS,纯度97%),蒽醌-2-磺酸钠(AQS,纯度98%),均购自上海阿拉丁生化科技股份有限公司。
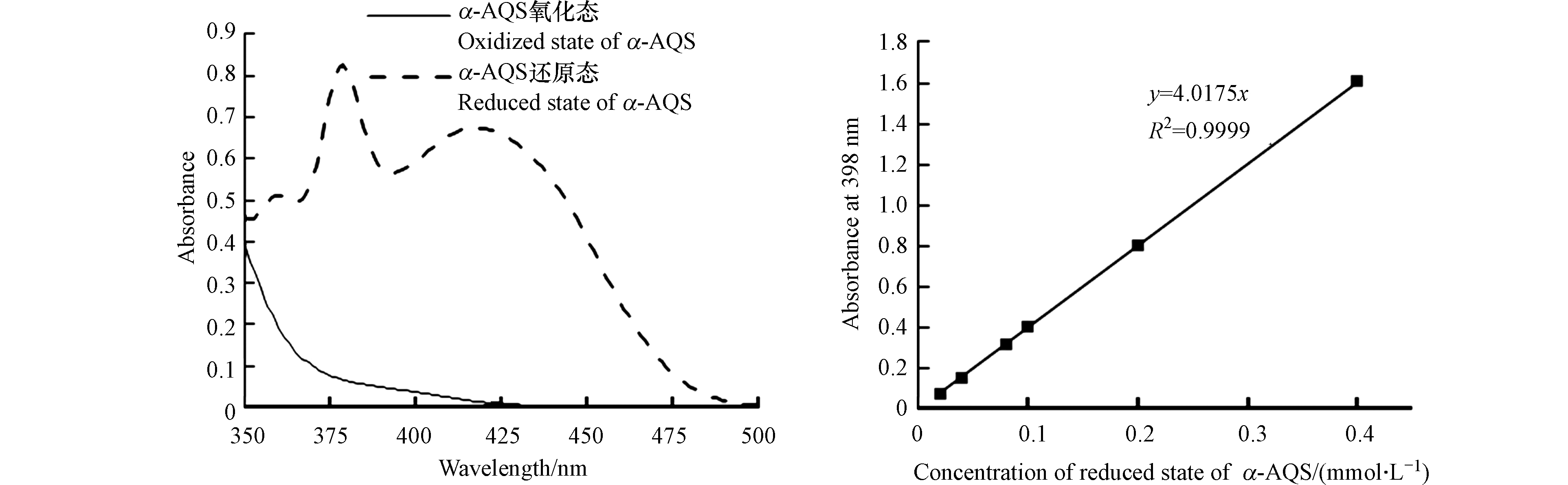
指甲花醌还原态产物含量参考文献[16]进行测定;蒽醌-2-磺酸钠(AQS)还原态产物含量采用分光光度法在398 nm波长下测定[17];α-AQS与AQS同属醌类物,且结构相近,还原态α-AQS测定参考AQS的测定方法。本实验中,采用连二亚硫酸钠法化学还原α-AQS,利用全波长扫描图谱以及吸光度与浓度的线性度选取合适的测定波长。0.10 mmol·L−1 α-AQS的全波长扫描曲线如图1所示,结合文献[18],选择最大吸收峰及曲线平坦处,通过比较特定波长吸光度-浓度标准曲线的线性相关系数R2,发现398 nm波长下R2最大,最终确定α-AQS还原态产物的检测波长为398 nm。
-
按照Box-Behnken生成的设计方案(表2)配制17种培养基,搅拌加热溶解后调至pH 7,120℃灭菌15 min。分别取200 mL加入血清瓶中,接种活化后的菌种子液,接种量5%(菌液体积/培养基体积),置于厌氧生化培养箱中37℃培养2 d后,取样测定培养液中OD600值(Y1)及α-AQS还原率(Y2)。
-
为了考察Citrobacter freundii还原醌类物的广谱性,选取萘醌类的指甲花醌及蒽醌类的AQS、α-AQS作为研究对象。实验培养基:指甲花醌、AQS以及α-AQS 0.25 mmol·L−1,KH2PO4 0.5 g·L−1,酵母浸粉0.3 g·L−1,MgSO4 0.2 g·L−1,NH4Cl 0.5 g·L−1;搅拌加热溶解后调至pH 7,120℃灭菌15 min。分别取200 mL加入血清瓶中,接种活化后的菌种子液,接种量5%(菌液体积/培养基体积),每隔12 h测定吸光度。
-
沉积物a、b、c、d取自天津市4条不同的河道,采用傅立叶红外光谱测定沉积物的结构。
-
采用约300 mL 沉积物b注入1 L广口瓶中,加入河水至1 L,设置空白组、对照组和修复组。其中空白组不投加菌液,修复组向底泥中投加在最优条件下培养的Citrobacter freundii种子液,对照组投加非最优条件下培养的种子液;投加量均为5‰(菌剂体积/底泥体积),并采用散点注射法注入底泥中,监测底泥有机质的变化情况,实验周期为42 d。沉积物有机质采用重铬酸钾法测定。
-
采用Origin Pro 8制作图表;采用SPSS 21.0对实验数据进行处理;采用Design Expert 10设计响应曲面。
-
按照Box-Behnken生成的设计方案进行实验,具体实验条件及实验结果见表2。
由表3可知,模型的P值小于0.05,表明该模型差异显著。模型的相关系数R2=0.9473,表明该模型拟合度良好;模型的调整确定系数R2adj=0.8795,表明该模型能够解释87.95%的响应值的变化。因此,用此模型来分析和预测不同培养基成分对OD600的影响是可行的。从方差分析结果来看一次项A,交互项AC,二次项A2对OD600的影响是显著的;从而表明各影响因素对OD600的影响不是简单的线性关系。最终得出各因素对OD600的影响为碳源比> C/N>碳源浓度。
由表4可知,模型的P值小于0.05,表明该模型差异显著。模型的相关系数R2= 0.9414,表明该模型拟合度良好;模型的调整确定系数R2adj=0.8661,表明该模型能够解释86.61%的响应值的变化。用此模型来分析和预测不同培养基成分对α-AQS还原率的影响是可行的。从方差分析结果可见,一次项A、B,二次项A2、B2对α-AQS还原率的影响是显著的;从而表明各影响因素对α-AQS还原率的影响不是简单的线性关系。最终得出各因素对α-AQS还原率的影响为碳源比>碳源浓度> C/N。
用Design-Expert 10软件对数据进行处理,得OD600 (Y1)和α-AQS还原率(Y2)对碳源比、碳源浓度和C/N的二项式多项回归方程为:
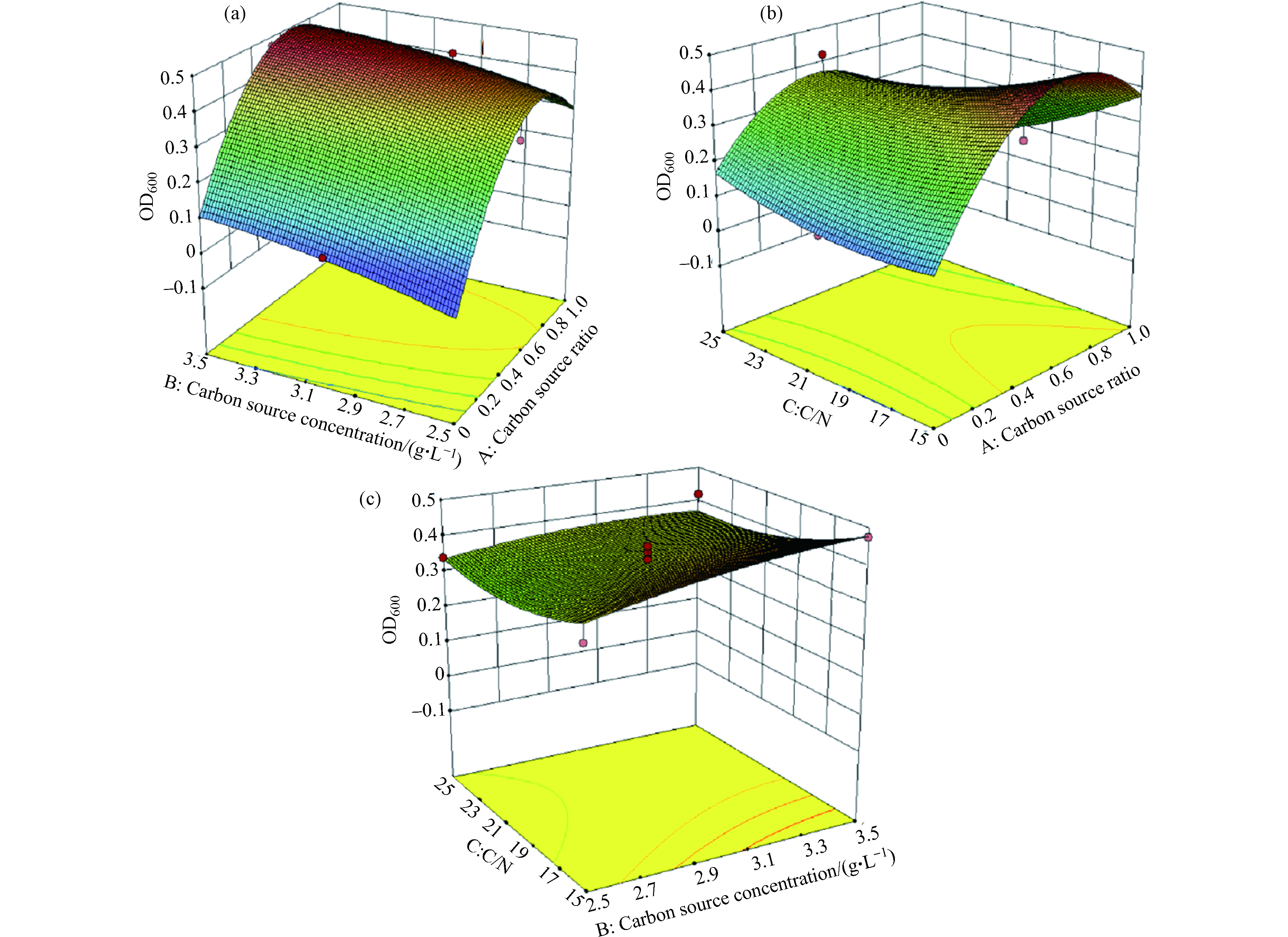
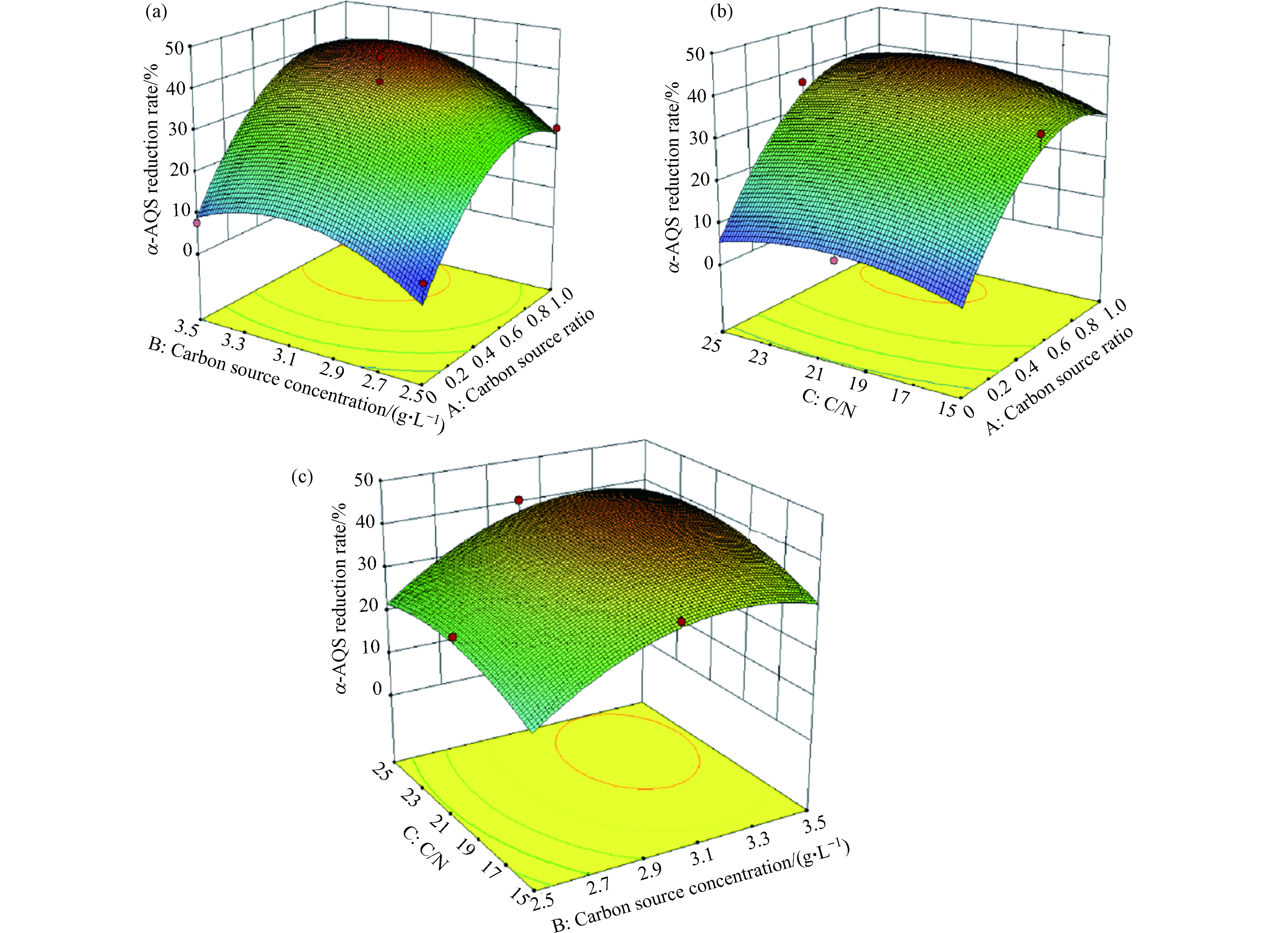
根据回归方程得出,碳源比、碳源浓度、C/N对OD600 及α-AQS还原率影响的响应曲面图及等高线图。
碳源比(A)与碳源浓度(B)的交互作用对OD600 的影响见图2a。当固定条件为C/N时,随着碳源比的升高,OD600 值呈现先升高再下降的趋势;随着碳源浓度的升高,OD600 值呈现微弱的升高趋势。碳源比(A)与C/N(C)的交互作用对OD600 的影响见图2b。当固定条件为碳源浓度时,随着碳源比的升高,OD600 值呈现先升高再下降的趋势;随着C/N的升高,OD600 值呈现先降低再升高的趋势。碳源浓度(B)与C/N(C)的交互作用对OD600 的影响见图2c。当固定条件为碳源比时,碳源浓度与C/N对OD600值影响不显著,结合表2可以得出,碳源比是影响OD600 值的最主要因素。
碳源比(A)与碳源浓度(B)的交互作用对α-AQS还原率的影响见图3a。当固定条件为C/N时,随着碳源比及碳源浓度的升高,α-AQS还原率呈现先升高再降低的趋势,即在实验范围内,α-AQS还原率存在最大值。碳源比(A)与C/N(C)的交互作用对α-AQS还原率的影响见图3b。当固定条件为碳源浓度时,随着碳源比的升高,α-AQS还原率呈现先升高再降低的趋势;而C/N对α-AQS还原率影响不大。碳源浓度(B)与C/N(C)的交互作用对α-AQS还原率的影响见图3c。当固定条件为碳源比时,随着碳源比的升高,α-AQS还原率呈现先升高再降低的趋势;随着C/N的升高,α-AQS还原率呈现微弱的先升高再降低趋势。
通过回归模型和响应曲面法对参数的最优化分析,得出获得菌生长及醌还原特性最优条件为碳源比(A)为0.691,碳源浓度(B)为3.24 g·L−1,C/N(C)为15.096,在此实验条件下,得到OD600与α-AQS还原率的最大预测值分别为0.481及36.84%。
-
实验结果见表5,在前24 小时,3种醌类物的还原率皆较低,48 h后还原率逐渐升高并在72 h达到最高值,α-AQS还原率最高,AQS次之,指甲花醌最低。因为指甲花醌分子结构中存在羟基,对微物有一定的毒害作用[19-20],因此指甲花醌还原率不高。总体而言,Citrobacter freundii对萘醌和蒽醌类的醌类物均具有还原活性,即具有较好的醌还原广谱性。
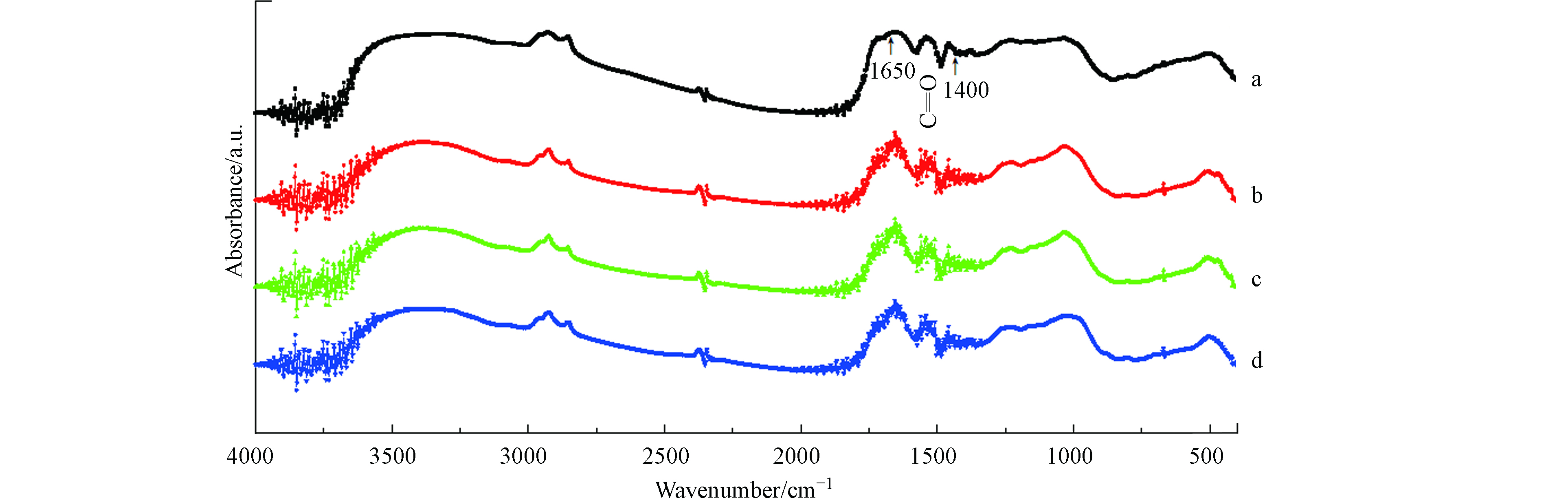
对4种不同河道沉积物a、b、c和d进行傅立叶红外光谱测定,FTIR(图4)分析显示,4种沉积物均含有醇羟基振动峰(1400 cm−1)、C=C振动峰(1650 cm−1)和—C—O—拉伸振动峰(1000 cm−1),这些与FA标准物质的光谱特征和吸收峰信息相似。此外,还有C=O、芳香C=C和—COO—基团(1593 cm−1),这些基团与醌结构的主要成分有关[21-22]。也就是说河道沉积物中含有相对丰富的醌类基团,可作为电子介体参与到腐殖质还原中;此外沉积物的固相中也可发生腐殖质呼吸作用,加速物质的转化。河道沉积物富含醌基特征是Citrobacter freundii强化有机质削减的物质基础[23],为Citrobacter freundii应用于沉积物修复领域提供了理论依据。
-
实验结果如图5可知,第0天空白组、对照组、修复组有机质含量为25.26 g·kg−1;第42天空白组、对照组、修复组有机质含量分别为21.37、18.44、17.68 g·kg−1,削减率分别为15.39%、26.99%、30%。空白组有机质含量的下降主要是由于厌氧微生物代谢活动以及体系混入氧气之后好氧菌在氧气的条件下消耗有机质。去除空白组的削减,对照组与修复组菌剂削减率为11.6%和14.61%。虽然修复组比对照组削减率仅提高了3.01%,但修复组削减速度要高于对照组,第28天修复组削减率为26.05%,与对照组第42天削减率26.99%接近。说明优化后的Citrobacter freundii加速了体系中有机质的降解。涂玮灵等[24]采用0.5 g·m−3反硝化菌制剂修复黑臭水体和底泥,6 周后底泥有机质降解率达到13.6%;胡湛波等[25]使用曝气协同生物促生剂修复城市黑臭河道水体,修复60 d后,底泥有机质削减率达10.5%。而本研究中的Citrobacter freundii可以利用沉积物中广泛存在的腐殖质中的醌类结构,进行有机质的降解,降解效果与其他修复方式相近。
-
(1)利用响应曲面法,从菌生长及醌还原特性分析,确定最佳培养条件为碳源比0.691,碳源浓度3.24 g·L−1,C/N15.096,此时得到Citrobacter freundii的OD600与α-AQS还原率的最大预测值分别为0.481及36.84%。
(2)Citrobacter freundii对α-AQS、AQS和指甲花醌的还原率在第72 h分别为60.17%、31.84%及18.18%,表明其对萘醌和蒽醌类的醌类物均具有还原活性。
(3)FTIR表明研究选取的4种沉积物均具有醌类结构,意味着河道沉积物中含有相对丰富的醌类基团,可作为电子介体参与到腐殖质还原中。
(4)Citrobacter freundii修复沉积物实验表明:修复组第42天有机质削减率为30%,对比空白组有机质削减率提高了14.61%,修复组的修复速度优于对照组。说明优化后的Citrobacter freundii可以通过腐殖质还原作用加速体系中有机质的降解,为其能够应用于河道沉积物修复领域提供依据。
腐殖质还原菌特性及其在河道修复中的应用
Characteristics of humus reducing bacteria and their application in river remediation
-
摘要: 腐殖质呼吸是近年来新发现的可参与环境污染生物降解的微生物能量代谢方式,腐殖质可作为氧化还原介体促进其他难降解污染物的生物还原,对有机污染物的降解转化具有重要意义。本研究采用响应曲面法优化菌株Citrobacter freundii的生长条件,并探究厌氧条件下Citrobacter freundii的醌还原广谱性;通过红外测定4种沉积物的官能团结构,探究Citrobacter freundii应用于河道沉积物修复领域的可行性。结果显示,当碳源比(葡萄糖/葡萄糖+柠檬酸钠)为0.691,碳源浓度为3.24 g·L−1,C/N(碳氮比)为15.096时,Citrobacter freundii的OD600与α-AQS还原率的最大预测值分别为0.481及36.84%;Citrobacter freundii对萘醌和蒽醌类的醌类物均具有还原活性;所选4种河道沉积物均含有C=O官能团,与醌类物结构相似;优化后的Citrobacter freundii削减沉积物有机质速度远高于未优化的削减速度,42 d有机质削减率为14.61%。本研究验证了Citrobacter freundii醌还原特性,拓展了腐殖酸还原菌的应用领域,为沉积物修复提供了新手段。Abstract: Humus respiration is a newly discovered microbial energy metabolism that can participate in the biodegradation of environmental pollution in recent years. Humus can be used as a redox mediator to promote the biological reduction of other refractory pollutants, which is of great significance for the degradation and transformation of organic pollutants. In this study, response surface methodology was used to optimize the growth conditions of Citrobacter freundii, and to explore the quinone reduction broad-spectrum of Citrobacter freundii under anaerobic conditions. The functional group structure of four kinds of sediments was measured by infrared to explore the feasibility of Citrobacter Freundii application in the field of river channel sediment remediation. The results showed that when the carbon source ratio (glucose/(glucose + sodium citrate)) was 0.691, the carbon source concentration was 3.24 g·L−1, and the C/N ratio was 15.096, the maximum predictive values of OD600 and α-AQS reduction rate of Citrobacter freundii were 0.481 and 36.84%, Citrobacter freundii has reductive activity on both naphthoquinone and anthraquinone quinones. The four selected river sediments contain C=O functional groups, which are similar to quinones in structure. The optimized Citrobacter freundii reduced the organic matter in sediments at a much higher rate than the unoptimized Citrobacter freundii, with a 42 d reduction rate of 14.61%. This study verified the reducing properties of Citrobacter freundii quinone, expanded the application field of humic acid reducing bacteria, and provided a new means for sediment remediation.
-
Key words:
- humus respiration /
- quinone reduction /
- response surface /
- river remediation
-

-
表 1 响应曲面实验因素水平表
Table 1. Response surface experimental factor level table
因素水平 A B/(g·L−1)当量葡萄糖 C/N -1 0 2.5 15 0 0.5 3.0 20 1 1 3.5 25 表 2 响应曲面实验设计方案与结果
Table 2. Response surface experimental design scheme and results
试验号 Experiment number 因素水平 Factor level 测定指标 Measurement index A B C Y1 Y2/% 1 1 1 0 0.160 33.7 2 0 0 0 0.335 37.8 3 0 0 0 0.411 37.4 4 0 1 −1 0.474 33.8 5 1 −1 0 0.154 25.5 6 0 0 0 0.341 35.1 7 −1 −1 0 0.066 6.76 8 0 1 1 0.419 36.9 9 0 −1 −1 0.332 17.5 10 −1 1 0 0.103 7.74 11 0 0 0 0.395 39.4 12 0 −1 1 0.341 18.0 13 0 0 0 0.375 45.1 14 1 0 −1 0.402 33.4 15 −1 0 1 0.117 8.18 16 1 0 1 0.109 40.4 17 −1 0 −1 0.074 6.41 表 3 OD600回归方程方差分析
Table 3. OD600 regression equation variance analysis
来源
Source平方和
Sum of squares自由度
Freedom均方
Mean squareF值
FP值
P显著性
Significance模型 0.31 9 0.035 13.97 0.0011 ** A 0.027 1 0.027 10.92 0.0131 * B 0.008646 1 0.008646 3.49 0.1039 C 0.011 1 0.011 4.42 0.0735 AB 0.0002403 1 0.0002403 0.097 0.7645 AC 0.028 1 0.028 11.4 0.0118 * BC 0.001024 1 0.001024 0.41 0.5407 A2 0.23 1 0.23 92.57 < 0.0001 ** B2 0.001264 1 0.001264 0.51 0.4981 C2 0.005897 1 0.005897 2.38 0.1667 残差 0.017 7 0.002476 失拟项 0.013 3 0.004315 3.93 0.1094 纯误差 0.004387 4 0.001097 总离差 0.33 16 注: **为差异高度显著(p<0.01);*为差异显著(p<0.05),下同.
Note: ** is highly significant difference (P < 0.01); * is highly significant difference (P < 0.05),the same below.表 4 α-AQS还原率回归方程方差分析
Table 4. Analysis of variance of regression equation for reduction rate of α-AQS
来源
Source平方和
Sum of squares自由度
Freedom均方
Mean squareF值
FP值
P显著性
Significance模型 2746.5548 9 305.1728 12.5016 0.0015 ** A 1349.6157 1 1349.6157 55.2881 0.0001 ** B 246.4932 1 246.4932 10.0978 0.0155 * C 19.1482 1 19.1482 0.7844 0.4052 AB 13.1916 1 13.1916 0.5404 0.4862 AC 6.8343 1 6.8343 0.2800 0.6131 BC 1.7438 1 1.7438 0.0714 0.7970 A2 659.6553 1 659.6553 27.0233 0.0013 ** B2 272.9482 1 272.9482 11.1815 0.0124 * C2 81.0666 1 81.0666 3.3210 0.1112 残差 170.8743 7 24.4106 失拟项 113.6563 3 37.8854 2.6485 0.1851 纯误差 57.2180 4 14.3045 总离差 2917.4291 16 表 5 Citrobacter freundii对不同醌类物的还原性能
Table 5. Reduction properties of Citrobacter freundii for different quinones
醌类物
Quinones醌还原率/%
Reduction rate of quinones12 h 24 h 48 h 72 h 96 h 指甲花醌 2.05 ± 0.15 4.55 ± 0.13 13.64 ± 0.54 18.18 ± 0.74 16.82 ± 0.13 AQS 2.56 ± 0.03 2.88 ± 0.48 27.93 ± 0.36 31.84 ± 0.43 24.16 ± 0.52 α-AQS 2.51 ± 0.47 5.73 ± 0.4 37.18 ± 0.86 60.17 ± 0.37 52.85 ± 1.11 -
[1] 卢静, 朱琨, 赵艳锋, 等. 腐殖酸在去除水体和土壤中有机污染物的作用 [J]. 环境科学与管理, 2006, 31(8): 151-154. doi: 10.3969/j.issn.1673-1212.2006.08.050 LU J, ZHU K, ZHAO Y F, et al. Effects of hmic substances for removing organic pollutants from water and soil [J]. Environmental Science and Management, 2006, 31(8): 151-154(in Chinese). doi: 10.3969/j.issn.1673-1212.2006.08.050
[2] 武春媛, 李芳柏, 周顺桂. 腐殖质呼吸作用及其生态学意义 [J]. 生态学报, 2009, 29(3): 1535-1542. doi: 10.3321/j.issn:1000-0933.2009.03.052 WU C Y, LI F B, ZHOU S G. Humus respiration and its ecological significance [J]. Acta Ecologica Sinica, 2009, 29(3): 1535-1542(in Chinese). doi: 10.3321/j.issn:1000-0933.2009.03.052
[3] LIPCZYNSKA-KOCHANY E. Humic substances, their microbial interactions and effects on biological transformations of organic pollutants in water and soil: A review [J]. Chemosphere, 2018, 202: 420-437. doi: 10.1016/j.chemosphere.2018.03.104 [4] VOLIKOV A B, PONOMARENKO S A, KONSTANTINOV A I, et al. Nature-like solution for removal of direct brown 1 azo dye from aqueous phase using humics-modified silica gel [J]. Chemosphere, 2016, 145: 83-88. doi: 10.1016/j.chemosphere.2015.11.070 [5] LEE S, ROH Y, KOH D C. Oxidation and reduction of redox-sensitive elements in the presence of humic substances in subsurface environments: A review [J]. Chemosphere, 2019, 220: 86-97. doi: 10.1016/j.chemosphere.2018.11.143 [6] DONG S S, LI M, CHEN Y G. Inherent humic substance promotes microbial denitrification of landfill leachate via shifting bacterial community, improving enzyme activity and up-regulating gene [J]. Scientific Reports, 2017, 7: 12215. doi: 10.1038/s41598-017-12565-3 [7] XI B D, ZHAO X Y, HE X S, et al. Successions and diversity of humic-reducing microorganisms and their association with physical-chemical parameters during composting [J]. Bioresource Technology, 2016, 219: 204-211. doi: 10.1016/j.biortech.2016.07.120 [8] LOVLEY D R, COATES J D, BLUNT-HARRIS E L, et al. Humic substances as electron acceptors for microbial respiration [J]. Nature, 1996, 382(6590): 445-448. doi: 10.1038/382445a0 [9] SCOTT D T, MCKNIGHT D M, BLUNT-HARRIS E L, et al. Quinone moieties act as electron acceptors in the reduction of humic substances by humics-reducing microorganisms [J]. Environmental Science & Technology, 1999, 33(2): 372. [10] MARTINEZ C M, ALVAREZ L H, CELIS L B, et al. Humus-reducing microorganisms and their valuable contribution in environmental processes [J]. Applied Microbiology and Biotechnology, 2013, 97(24): 10293-10308. doi: 10.1007/s00253-013-5350-7 [11] LI J B, LU Q, LIU T, et al. Paenibacillus guangzhouensis sp. nov., an Fe(Ⅲ)- and humus-reducing bacterium from a forest soil [J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt_11): 3891-3896. doi: 10.1099/ijs.0.067173-0 [12] GUO J H, WANG Y Q, YANG G Q, et al. Bacillus nitroreducens sp. nov., a humus-reducing bacterium isolated from a compost [J]. Archives of Microbiology, 2016, 198(4): 347-352. doi: 10.1007/s00203-016-1193-9 [13] 曹静, 李永慧, 李玉成, 等. 腐殖质还原菌的筛选及其对污染物的生物降解 [J]. 应用与环境生物学报, 2013, 19(3): 506-510. doi: 10.3724/SP.J.1145.2013.00506 CAO J, LI Y H, LI Y C, et al. Isolation of a humus-reducing bacterium strain and its biodegradation of pollutants [J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(3): 506-510(in Chinese). doi: 10.3724/SP.J.1145.2013.00506
[14] 赵昕宇, 范钰莹, 席北斗, 等. 不同来源堆肥腐殖质还原菌异化铁还原能力评估与调控 [J]. 中国环境科学, 2018, 38(10): 3815-3822. doi: 10.3969/j.issn.1000-6923.2018.10.028 ZHAO X Y, FAN Y Y, XI B D, et al. A regulating method for humic-reducing microorganisms and assessment of the reduction of dissimilatory Fe(Ⅲ)in composting [J]. China Environmental Science, 2018, 38(10): 3815-3822(in Chinese). doi: 10.3969/j.issn.1000-6923.2018.10.028
[15] CERVANTES F J, van der VELDE S, LETTINGA G, et al. Quinones as terminal electron acceptors for anaerobic microbial oxidation of phenolic compounds [J]. Biodegradation, 2000, 11(5): 313-321. doi: 10.1023/A:1011118826386 [16] OLIVO-ALANIS D, GARCIA-REYES R B, ALVAREZ L H, et al. Mechanism of anaerobic bio-reduction of azo dye assisted with lawsone-immobilized activated carbon [J]. Journal of Hazardous Materials, 2018, 347: 423-430. doi: 10.1016/j.jhazmat.2018.01.019 [17] RAU J, KNACKMUSS H J, STOLZ A. Effects of different quinoid redox mediators on the anaerobic reduction of azo dyes by bacteria [J]. Environmental Science & Technology, 2002, 36(7): 1497-1504. [18] 王冬. 腐殖质还原菌的筛选、优化及其在河道修复中的应用[D]. 天津: 天津大学, 2018. WANG D. Screening and optimization of humus reducing bacteria and its application in river restoration[D]. Tianjin: Tianjin University, 2018(in Chinese).
[19] 薛晓红, 张芝涛, 白敏冬, 等. 船舶压载水中海洋微生物的羟基自由基致死特性研究 [J]. 环境科学学报, 2013, 33(3): 749-753. XUE X H, ZHANG Z T, BAI M D, et al. Treatment characteristics of marine microalgae hydroxyl radicals in ship's ballast water [J]. Acta Scientiae Circumstantiae, 2013, 33(3): 749-753(in Chinese).
[20] 王雅婧. 羟基自由基防控斜带石斑鱼副溶血弧菌病和刺激隐核虫病的研究[D]. 厦门: 厦门大学, 2018. WANG Y J. Studies on ·OH treatment of Vibrio parahaemolyticus and crytocaryon irritans in Epinephelus coioides[D]. Xiamen, China: Xiamen University, 2018(in Chinese).
[21] CORY R M, MCKNIGHT D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter [J]. Environmental Science & Technology, 2005, 39(21): 8142-8149. [22] JIANG J, KAPPLER A. Kinetics of microbial and chemical reduction of humic substances: Implications for electron shuttling [J]. Environmental Science & Technology, 2008, 42(10): 3563-3569. [23] LI M, SUN J M, LIU C, et al. The remediation of urban freshwater sediment by humic-reducing activated sludge [J]. Environmental Pollution, 2020, 265: 115038. doi: 10.1016/j.envpol.2020.115038 [24] 涂玮灵, 胡湛波, 梁益聪, 等. 反硝化细菌修复城市黑臭河道底泥实验研究 [J]. 环境工程, 2015, 33(10): 5-9,25. TU W L, HU Z B, LIANG Y C, et al. Experimental study on remediation of sediments in urban black-odorous rivers by denitrifying bacteria [J]. Environmental Engineering, 2015, 33(10): 5-9,25(in Chinese).
[25] 胡湛波, 刘成, 周权能, 等. 曝气对生物促生剂修复城市黑臭河道水体的影响 [J]. 环境工程学报, 2012, 6(12): 4281-4288. HU Z B, LIU C, ZHOU Q N, et al. Effects of aeration to remediation of black-odorous urban river by using biostimulants [J]. Chinese Journal of Environmental Engineering, 2012, 6(12): 4281-4288(in Chinese).
-



 下载:
下载: