-
《土壤污染防治法》规定“国务院生态环境主管部门根据土壤污染状况、公众健康风险、生态风险和科学技术水平,并按照土地用途,制定国家土壤污染风险管控标准”。《生态环境标准管理办法》指出“制定生态环境风险管控标准,应当根据环境污染状况、公众健康风险、生态环境风险、环境背景值和生态环境基准研究成果等因素,区分不同保护对象和用途功能,科学合理确定风险管控要求”。因此,土壤生态风险是我国土壤污染防治的重要目标,建立基于生态风险的土壤风险管控标准(土壤生态筛选值),是我国土壤生态环境法律法规的要求。然而,《土壤环境质量 农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中仅部分指标考虑了污染物对农作物生长和土壤生态的影响[1],《土壤环境质量 建设用地土壤污染风险管控标准(试行)》(GB 36600—2018)未考虑土壤污染物的生态风险[2]。
欧美发达国家更早开展了土壤生态筛选值的相关研究,部分国家已制定了土壤生态筛选值。美国环境保护局(Environmental Protection Agency,EPA)于2003年颁布了土壤生态筛选值制定技术导则,逐步建立了21种污染物的土壤生态筛选值(Ecological Soil Screening Levels,Eco-SSL)[3]。英国环境署(Environment Agency,EA)针对9种重金属和10种有机物,建立了适用于土壤生态风险评估的土壤筛选值(Soil Screening Values,SSV)[4]。荷兰住房、空间规划和环境部(The Ministry of Housing,Spatial Planning and the Environment,VROM)发布了基于生态和健康风险的土壤质量标准[5]。加拿大环境部长理事会(Canadian Council of Ministers of the Environment,CCME)制定了不同用地方式下,基于生态风险和人体健康的土壤质量指导值(Soil Quality Guideline,SQG)[6]。与上述国家相比,我国土壤污染生态风险研究基础相对薄弱,有关土壤生态筛选值的综述研究相对较少。因此,本研究通过对英国、美国、荷兰和加拿大土壤生态筛选值的定位、关键受体、暴露途径、推导方法和生物有效性等方面进行对比分析,结合我国土壤生态风险的研究基础和现状,提出我国土壤生态筛选值的制定建议,以期为我国土壤风险管控标准的优化和完善提供参考。
-
与人体健康风险相比,不同国家对土壤生态系统保护的认知和重视程度各不相同。相比相对成熟的健康风险评估方法,各国土壤生态风险评估研究和技术水平相对滞后。但土壤生态筛选值作为土壤污染生态风险初步识别与筛选的重要管理工具,目前已成为环境管理者和土壤生态研究学者的普遍共识[7]。
美国作为最早开展土壤污染生态风险研究的国家,分别于1992年和1998年发布了《生态风险评价框架》[8]和《生态风险评价指南》[9]。在此基础上,美国建立了包含8个步骤的《超级基金生态风险评价方法》[10],用于指导和规范超基金场地的生态风险评价。其中,在超基金场地调查的第二阶段,调查人员通过对比场地内土壤污染物的最大暴露浓度和土壤Eco-SSL,判断是否需对场地内土壤开展更加深入的调查和风险评估。
英国为响应《环境保护法》等法律法规中对污染土壤的相关要求,针对可能产生生态风险的污染场地(主要为自然保护区和鸟类保护区),构建了层次化的生态风险评估框架,评估土壤中污染物对生态系统产生的潜在风险[11]。在初步构建污染场地概念模型后,土壤SSV作为现场调查的筛选工具(第一层次),用来筛选关注污染物,确定是否开展的定量风险评估(第二层次)和因果归因分析(第三层次)[12]。
荷兰于2008年重新修订了《土壤质量法令》,首次提出了可持续土壤治理概念。通过计算土壤污染对食品安全、生态风险和人体健康的环境风险限值构建土壤质量标准,包括背景值、最大值(maximal values,MV)和干预值(intervention values,IV)。其中,居住和工业用地的土壤MV和IV取生态风险限值和人体健康限值的最小值,通常由生态风险限值决定[5]。当土壤污染物浓度低于居住或工业用地的MV时,土壤被认为适用于居住或工业用地;当土壤污染物浓度超过IV时,应启动特定场地的标准生态风险评估(毒性单元法)和详细生态风险评估(证据权重分析法),判断开展修复的紧迫性;当土壤污染物浓度介于两者之间,土壤不可被开发利用。
加拿大于1996年依据保护生态和人体健康的原则,计算保护生态环境的土壤质量指导值(environmental soil quality guideline,SQGE)和保护人体健康的土壤质量指导值(human health soil quality guideline,SQGHH),取二者的低值作为最终指导值(SQGF)[6]。当土壤污染物浓度低于指导值时,土壤污染风险可忽略,当土壤污染物浓度高于指导值时,应开展调查以确定是否需要采取修复措施。但加拿大土壤质量指导值不具有法律约束力,在具体管控过程中土地拥有者可采用各省制定的标准值,如安大略省和哥伦比亚省在各省污染场地条例中规定的强制性土壤筛选值,但各省制定的筛选值在土地利用方式划分和标准值推导方法等方面与SQG存在差异。
-
由于土壤生态系统的复杂性,不同生物对污染物的毒害响应可能存在差异,然而土壤生态筛选值在制定过程中无法将整个陆生生态系统的生物均纳入考虑范围。因此,各国土壤生态筛选值的计算均依赖于少数具有代表性的关键受体[13]。如表1所示,不同国家土壤生态筛选值考虑的关键受体根据暴露途径分成土壤直接接触、土壤和食物摄入和土壤-地下水迁移3类。
土壤直接接触途径是各国土壤生态筛选值均考虑的暴露途径,多数机构将陆生植物(生产者)、无脊椎动物(消费者)和土壤微生物(分解者)及其主导的生态功能作为该途径的关键受体。美国Eco-SSL分别计算保护陆生植物和无脊椎动物的筛选值,未考虑保护土壤微生物或生态功能。英国和荷兰根据欧盟风险评价技术导则文件(Technical Guidance Document on Risk Assessment,TGD),将陆生植物和无脊椎动物作为一组,土壤微生物及其生态功能作为一组,取两组风险限值的最小值作为保护直接接触途径受体的筛选值[14]。加拿大直接接触途径的土壤质量指导值(soil quality guideline for soil contact,SQGsc)基于植物和无脊椎动物的直接接触毒性数据,根据毒性数据的获取情况,选择将植物和无脊椎动物分组或统一计算限值。此外,加拿大将土壤微生物过程推导的土壤质量指导值(soil quality guideline for nutrient and energy cycling,SQGNEC)作为检查机制,通过专家判断后与基于植物和无脊椎动物推导的限值进行比较,通常取最小值作为最终SQGsc。
土壤和食物摄入途径主要保护土壤污染经食物链威胁的高等生物(生物累积和生物放大的二次毒性)。英国针对lg Kow大于3的污染物考虑了食物链的二次毒性。荷兰与英国类似,在计算具有生态价值的绿地(体育公园、休闲区和公园等)土壤MV时,考虑土壤污染对食肉动物(鸟类和哺乳动物)的二次毒性,但在IV推导过程中未考虑二次毒性[14]。美国鸟类和哺乳动物的Eco-SSL考虑保护食草动物、地面食虫动物和食肉动物,根据6种通用替代受体(3种鸟类和3种哺乳动物)和暴露途径推导。加拿大仅农业用地制定了保护经放牧摄取土壤和食物中污染物的野生动物和牲畜的指导值(soil quality guideline for soil and food ingestion,SQGI),且只考虑食草动物。但针对具有强烈生物累积或生物放大特征的持久性物质(如多氯联苯等),加拿大农业和住宅/公园用地进一步制定了保护经食物链途径的一级、二级和三级消费者(包括食草和食肉动物)的SQGI。除美国Eco-SSL外,其余国家土壤二次毒性推导的限值通常与直接接触限值比较后取较小值作为最终筛选值。
土壤污染可能迁移至地下水,对周边地表水和牲畜饮水以及灌溉用水产生危害。加拿大制定了保护土壤-地下水迁移途径的指导值,包括保护淡水生物的指导值(soil quality guideline for freshwater life,SQGFL)和牲畜饮水/灌溉水安全的指导值(soil quality guideline for livestock watering/irrigation water,SQGLW/SQGIW)。
-
土壤直接接触是土壤生态筛选值制定的最重要暴露途径。通常根据单一污染物和单一物种的生态毒理实验获得毒性数据,采用生态风险评估的外推方法制定筛选值。但具体制定过程中,各国在毒性数据选择、外推方法使用和筛选值确定等存在差异(表2)[15]。
通常,毒性数据优先选择影响关键受体个体或种群特性的慢性毒性指标,如生长和繁殖指标,但不同国家的毒性参数选择存在差异。常用的毒性参数包括预测无效应浓度(NOEC)、最大允许阈值(MATC)、最低效应浓度(LOEC)、效应浓度(EC10、EC20、EC25和EC50)和半致死浓度(LC50)等。尽管NOEC、MATC和LOEC受到广泛的质疑(易受生态毒理试验的浓度梯度影响),但NOEC等参数依然被欧洲多数国家用于土壤生态筛选值的推导[13]。效应浓度通过剂量-效应曲线获得,欧盟推荐将EC10和NOEC等效使用,美国和加拿大优先选择具有统计学意义的低水平效应数据(EC20和EC25)。当慢性毒性数据无法满足外推方法要求时,可选择急性毒理试验的LC50或EC50等参数。
将关键受体的毒性数据(个体水平)通过保守的假设模型外推至种群、群落甚至生态系统水平是土壤生态筛选值制定的关键[16]。欧洲土壤生态筛选值的外推方法相对统一,参考欧盟TGD技术导则中预测无效应浓度(predicted no effect concentration,PNEC)的计算方法。当毒性数据足够多时,采用物种敏感性分布法(species sensitivity distribution,SSD)描述生态系统内有限物种对环境中特定污染物毒性响应效应差异;当毒性数据的生物种类和营养级别单一且数据量较少,选择基于评估因子(assessment factor,AF)的确定性方法;当陆生毒性数据缺失时,可采用基于水生毒性数据和水土分配系数的平衡分配法。加拿大同样优先选择基于分布的方法(证据权重法),将毒性数据排序分布取相应的百分位值作为指导值;当毒性数据不足时,加拿大选择最低效应浓度法(LOEC)或中位效应法(EC50或LC50)。美国Eco-SSL直接取毒性数据的几何均值,由于未能充分利用已有的毒理研究,因此Eco-SSL在筛选能力上存在局限性。
除毒性数据和外推方法外,土壤生态筛选值的确定还受各国土壤环境管理政策的影响。英国SSV作为指示低风险的筛选值,取PENC即5%物种受危害的浓度(5% hazardous concentration,HC5)作为筛选值(低于该值,95%的物种是相对安全的);荷兰MV作为不同用地方式下土壤可持续管理的筛选值,指示中度风险,通常取HC5和HC50(50% hazardous concentration)的几何均值;荷兰IV作为界定严重风险的筛选值,取HC50作为筛选值(低于该值,50%的物种是相对安全的)。此外,加拿大在制定筛选值时充分考虑了不同土地利用方式土壤提供的生态服务功能差异,其中农用地和居住用地/公园的SQGsc指示土壤中污染物对生态系统产生的最小不利作用,而商业和工业用地的SQGsc指示低水平不利作用。当采用证据权重法时,SQGsc分别取25%(农用地和居住用地/公园)和50%(商业和工业用地)百分位值;采用确定性方法时,SQGsc分别取毒性数据的最小值(农用地和居住用地/公园)和几何均值(商业和工业用地)。
基于二次毒性的土壤筛选值推导与土壤直接接触途径不同,通常通过构建野生生物模型推导。荷兰和英国构建了“土壤-蚯蚓-哺乳动物或鸟类”的食物链模型,美国构建了三类关键替代物种(食草动物、地面食虫动物和食肉动物)的哺乳动物和鸟类食物链模型。当污染物的生物富集数据可获得时,将哺乳动物或鸟类的毒性数据采用土壤直接接触途径的推导方法得到毒性阈值,通过生物富集数据和构建的模型反推获得土壤二次毒性的筛选值[13]。
为保护土壤-地下水途径,加拿大不列颠哥伦比亚污染场地土壤组构建了土壤-地下水迁移模型,基于加拿大水质指导值(水生生物指导值、牲畜饮水指导值和灌溉水指导值)通过模型反推获得相应的SQGFL和SQGLW/SQGIW[6]。
-
与传统的土壤环境质量标准相比,基于风险的土壤生态筛选值更加强调土壤性质差异、元素形态差异、土壤老化和淋洗等因素对土壤污染物的生物有效性影响[17-18]。如表3所示,各国在筛选值制定和使用过程中主要从三个方面评估污染物的生物有效性,包括土壤背景含量、关键理化性质和毒性试验的淋洗和老化情况。
土壤背景含量指仅受地球化学过程和非点源输入影响的元素或化合物含量。由于生态筛选值主要基于室内外源添加污染的毒性试验,得出污染物的筛选值可能低于土壤背景含量,因此土壤背景含量通常作为检验机制与推导的筛选值进行比较,如美国和加拿大[3]。荷兰和英国认为,环境中自然产生的物质在背景水平上的浓度对于生态系统中的生物多样性和微量营养素是必要的,因此保守的假设土壤背景含量的生物有效性和生物毒性可忽略不计,将实验室推导的阈值与背景值相加获得最终的筛选值(风险附加法)[19]。
土壤理化性质被认为是影响污染物生物有效性的关键,不同供试土壤毒性试验获得的毒性数据可能存在较大差异。因此,在推导土壤生态筛选值时,应根据影响生物有效性的土壤关键理化性质对毒性数据进行充分筛选和评估。通常毒性试验的供试土壤理化性质应具有代表性,不应包括极端条件下获得的毒性数据。美国根据pH和有机质含量将毒性数据划分为生物有效性高、中和低的3个等级,推导筛选值时优先选择生物有效性较高的毒性数据。加拿大和美国类似,当超过50%的数据反映出较低的生物有效性,应采用不确定性因子,或将推导的筛选值归类为临时指导值。英国和荷兰通过建立归一化方程,对有机物的毒性数据归一到标准土壤(有机质含量为3.4%),但不建议对重金属毒性数据进行归一化。这主要是因为重金属生物有效性更加复杂,依赖土壤pH等土壤性质的归一方程实际仅模拟土壤孔隙水中重金属浓度,而对于无脊椎动物等摄取土壤的生物,通过孔隙水吸收的重金属浓度往往是可忽略的,因此对重金属归一化不能真实的反映土壤理化性质对污染物生物有效性的影响[13]。
毒性试验外源添加的可溶性金属盐可能引起土壤中离子强度的增加和pH值的下降(淋洗作用),且室内培养条件和培养时间往往无法模拟野外真实污染土壤的老化过程(扩散、固定、成核/沉淀、矿物表面氧化或与土壤中固相形成配合物等)。因此,基于室内外源添加污染的毒性试验往往无法真实反映野外田间土壤污染的真实毒性,导致推导筛选值的不确定性[20]。美国等建议在条件允许的情况下,应对生态毒理试验的供试土壤开展淋洗和老化处理,并在不确定分析中充分考虑毒理试验的淋洗和老化情况,除以相应的不确定性因子获得最终的筛选值。此外,英国等建议可根据经验方程获得的淋洗/老化(leaching/aging factor,L/A)因子对毒性数据进行校准,以获得更能反映真实毒性的毒性数据[4]。
-
我国土壤环境标准工作最早开始于上世纪七十、八十年代的农业环境质量普查评价、土壤环境容量的临界含量和土壤环境背景值等相关研究[21-22],在上述研究基础上,我国制定了《土壤环境质量标准》(GB 15618—1995)。其中,一级标准(背景值)采用地球化学法,根据土壤中元素的地球化学含量状况和分布特征制定;二级和三级标准采用生态环境效应法,该方法体现了我国对土壤生态环境安全的最初探讨,规定了保护农产品质量、农作物生长、土壤生态(生化指标和微生物指标)和水环境安全的土壤中污染物最大允许含量(表4)[23]。
为落实《土壤污染防治行动计划》(土十条)的要求,满足农用地土壤污染风险管控的需要。GB 15618—2018土壤风险管控标准借鉴了GB 15618—1995标准的生态环境效应法(表4),以保护农产品质量为主要目标,兼顾保护农作物生长和土壤生态的需要,结合技术、经济和社会等情况,对控制指标和数值进行修订。其中,Cd、Hg、As、Pb和Cr主要保护农产品质量,Cu、Ni和Zn主要保护农作物生长,并兼顾保护土壤生态。但8种重金属中,仅Ni元素的筛选值是基于我国20多种代表性物种(植物、动物和微生物)和17种代表性土壤的EC10数据,采用了国际生态风险评估方法的SSD法推导。因此,尽管GB 15618—2018标准部分考虑了土壤污染生态风险,但仅土壤Ni的风险筛选值可作为生态筛选值使用。
实际上,我国生态环境效应法中土壤-微生物体系和土壤-作物生长体系与国际土壤生态筛选值中的直接接触途径相似,土壤-农产品质量体系类似于国生态筛值的二次毒性途径,土壤-水体系与加拿大保护水环境的指导值相似,但标准制定的试验和推导方法与国际土壤筛选值存在较大差异(表4)。但根据我国《生态环境标准管理办法》和《环境基准管理办法(试行),土壤环境基准是土壤风险管控标准的制修订基础,而在法律和管理层面我国已将保护农产品质量和保护地下水的土壤环境基准与保护陆生生态的土壤环境基准进行区分。因此,我国土壤生态筛选值的研究范畴应与美国、荷兰和英国等国家相似,以保护直接接触毒性和二次毒性的陆生生态土壤环境基准为基础,不应包括保护农产品质量和保护地下水的土壤环境基准。
-
(1)明确土壤生态筛选值的定位、作用和使用形式
土壤生态筛选值是土壤污染生态风险初步识别与筛选的环境管理工具,然而我国尚未构建本土化的土壤生态风险评估框架体系[24]。因此,“十四五”期间应首先尝试建立我国土壤生态风险评估的基本框架,明确土壤生态筛选值的筛选作用。当前我国土壤风险管控标准按照土地用途制定。其中,GB 15618—2018农用地土壤风险管控标准在控制项目选择和筛选值制定部分考虑了土壤污染生态风险。因此,农用地应继续以当前标准体系为主线,其中土壤-微生物体系和土壤-作物生长体系应以保护直接接触毒性和二次毒性的陆生生态土壤环境基准研究为基础,关键受体、毒性数据和推导方法逐步与国际土壤生态筛选值接轨,进一步完善现有控制项目的筛选值。GB 36600—2018建设用地土壤风险管控标准根据人体健康风险评估方法制定,未考虑污染物的土壤生态风险。然而,无论是公园、绿地与广场、居住用地或是工业用地,其土壤均提供了不同程度的生态服务功能。因此,我国建设用地同样应考虑污染物对土壤生态环境的危害,制定相应的土壤生态筛选值,并根据管理政策需要,选择单独作为1套标准使用,或是与GB 36600—2018标准结合使用。
(2)加强土壤生态毒理学等基础研究
保护陆生生态的土壤环境基准研究是土壤生态筛选值的基础,建立足够数量和质量的生态毒性数据库是合理制定土壤生态筛选值的关键[25-26]。美国石油学会指出国际土壤生态筛选值的数据基础是互通的,除各国管理政策导致的差异外,筛选值的差异更多来自于各国对本土生态毒理数据的使用[13]。我国土壤污染生态毒理研究起步较晚,早期生态环境效应法在试验规范性与标准生态毒理学实验存在不少差距,不同研究团队的培养条件和培养时间等试验条件差异较大[25-26]。因此,缺乏我国代表性物种和典型土壤的生态毒理数据已成为合理制定土壤生态筛选值的瓶颈。此外,国内生态毒理数据分布于各个研究团队,缺少国家级的官方共享平台对国内毒理数据进行整合,类似美国ECOTOX数据库[27-28]。因此,“十四五”应针对关键污染物开展基于我国代表性物种和典型土壤的生态毒理实验,构建适合我国土壤生态系统的基础毒性数据库和共享平台,为土壤生态筛选值制定提供充足的数据基础。
(3)建立科学、规范的土壤生态筛选值制定方法
规范性文件的缺失是制约我国土壤生态筛选值制定的重要因素。2019年,生态环境部发布了《生态安全土壤环境基准技术指南(征求意见稿)》,以期作为指导性文件开展保护直接接触途径的陆生生态土壤环境基准研究。但由于当时条件未成熟,技术指南未能正式发布,目前由生态环境部南京环境科学研究所继续对指南进行修改和完善。除技术导则外,我国尚缺指导开展生态毒理试验的相关配套指南,包括代表性物种名录、生物试验方法和毒性数据筛选和评估等。目前已开展的毒性试验主要依赖于国外机构推荐的物种和试验方法,如经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)、美国试验与材料学会(American Society of Testing Materials,ASTM)和美国EPA等。因此,“十四五”期间建议结合我国土壤生态系统特征和环境管理需求,确定能够反映我国区域特征的代表性生态物种;参考国内外土壤质量或化学品评价的标准生态毒理方法,制订本土化生态毒理试验系列导则;参考国外土壤生态筛选值制定技术指导,进一步完善保护陆生生态的土壤环境基准制定技术方法。
(4)持续开展土壤污染物的生物有效性研究
土壤污染物的生态毒性取决于生物有效性。尽管存在争议,归一化方程被认为是定量表征毒性数据与土壤理化性质关系的有效工具。实际上,我国GB 15618—2018标准在推导过程中已使用基于生物富集因子(Bioconcentration Factor,BCF)的归一化方程,但当前保护陆生生态的土壤环境基准研究中缺乏对污染物生物有效性的探讨,大部分研究没有量化土壤理化性质对毒性数据的影响[29]。此外,我国已开展的土壤生态毒理试验缺少对供试土壤进行淋洗和老化处理,且针对我国土壤区域特征的污染物L/A因子研究相对较少,导致室内毒性试验结果不能真实反映污染物的真实毒性,影响土壤生态筛选值制定的合理性[30-31]。因此,建议持续开展土壤污染物的生物有效性研究,建立针对性和适用性强的归一化方程和L/A因子,在充分考虑生物有效性的情况下,完善我国土壤生态筛选值的表征形式,如参考GB 15618—2018标准,基于关键土壤理化性质制定合理的筛选值。
-
(1)土壤生态筛选值是土壤污染生态风险初步识别与筛选的重要环境管理工具。十四五期间,应初步构建我国土壤生态风险评估框架,明确土壤生态筛选值的定位、作用和使用形式。
(2)保护陆生生态的土壤环境基准研究是制定合理生态筛选值的基础。建议加强土壤生态毒理学等基础研究,建立科学、规范的土壤生态筛选值制定方法和配套指南,为合理制定土壤生态筛选值提供理论、方法和数据基础。
(3)土壤污染物的生态毒性取决于生物有效性,土壤理化性质等多种因素可能影响污染物的生物有效性。建议持续开展土壤污染物的生物有效性研究,尝试建立适合我国土壤区域特征的污染物归一化方程和L/A因子经验方程。
不同国家土壤生态筛选值比较与启示
Ecological soil screening values among different countries and implication for China
-
摘要: 土壤污染生态风险防控是我国土壤环境保护和管理的重要目标。与国外发达国家相比,我国尚未建立基于生态风险的土壤筛选值(土壤生态筛选值),当前有关土壤生态筛选值的综述相对较少。本文系统梳理了美国环境保护局(EPA)、英国环境署(EA)、荷兰住房、空间规划和环境部(VROM)和加拿大环境部长理事会(CCME)制定的土壤生态筛选值,从标准定位、关键受体、暴露途径、推导方法和生物有效性等方面进行对比分析。结果表明,不同国家土壤生态筛选值均考虑了土壤直接接触毒性和经生物富集和生物放大的二次毒性,推导方法普遍采用生态风险评估方法,并充分考虑污染物的生物有效性。然而,当前我国土壤风险管控标准中仅GB 15618—2018农用地标准的部分考虑了污染物对农作物生长和土壤生态的影响,且试验和推导方法与国外筛选值存在较大差异。因此,“十四五”期间建议初步构建我国土壤生态风险评估框架,明确土壤生态筛选值的定位、作用和使用形式,加强代表性物种和典型土壤的陆生生态毒理学等基础研究,建立科学、规范的土壤生态筛选值制定方法和配套指南,尝试建立适合我国土壤区域特征的土壤污染归一方程和淋洗/老化因子,为我国土壤生态筛选值的制定提供建议和参考。Abstract: Ecological risk control of soil contamination is an essential target for soil environment protection and management. However, there is still lack of ecological soil screening values (Eco-SSVs) in China and the foundation of the works concerning soil environmental criteria aimed at protecting the terrestrial ecology is also rather weak. In this paper, we systematically compared and analyzed the difference in Eco-SSVs among US Environmental Protection Agency (EPA), UK Environmental Agency (EA), Ministry of Housing, Spatial Planning and the Environment (VORM) of the Netherlands and Canadian Council of Ministers of the Environment (CCME), in aspect of standard positioning, protection objective, derivation method, protective level as well as bioavailability factors. The result showed that both the toxicity induced by direct exposure to soil and the secondary poisoning via bioaccumulation/ biomagnification are taken into account for the derivation of Eco-SSVs with a widely applied method of ecological risk assessment in all the aforementioned countries. Meanwhile, the bioavailability of pollutants was well considered. However, among all the current risk control standard of soil contamination in our country, the consideration of ecological risk on crop growth and soil ecosystem was only observed in GB 15618—2018. On such a basis, constructing the framework of soil ecological risk assessment and specifying the role, function and the application form of Eco-SSVs were highly proposed during the 14th Five-Year Plan of our country. Moreover, we highlight strengthening the research of terrestrial ecotoxicity involved in local species and typical soil types in China, establishing the scientific and standardized derivation method of Eco-SSVs as well as the corresponding guideline, and establishing the normalized model and leaching/aging factor, which could provide scientific and technological base for the formulation of Eco-SSVs in our country.
-
自1929年发现青霉素来,抗生素作为一种能够有效对抗细菌感染的药物已被广泛应用于人类和牲畜疾病的预防与治疗. Klein等[1]的研究表明,在2000年至2015年间,全球抗生素的消费量增加了65%,并且预测在没有政策干预的情况下,2030年全球抗生素消费量可能比2015年高出200%. 由抗生素大量使用诱导产生的抗生素耐药问题是人类面临的重要公共卫生挑战之一. 据估计,每年死于抗生素耐药性问题的人数高达70万,如果不采取适当的预防措施,到2050年,每年的死亡人数将接近1000万,超过癌症的死亡人数[2]. 存在于抗生素耐药菌(antibiotic resistant bacteria, ARB)中的抗生素抗性基因(antibiotic resistance genes, ARGs),作为一种新污染物,与传统污染物不同,可以通过细菌的繁殖,进行垂直基因转移(vertical gene transfer, VGT),在环境中大量扩增,也可以通过水平基因转移(horizontal gene transfer, HGT)在不同细菌间扩散,进一步诱导抗生素耐药性的产生,因而引起了广泛的关注[3-4].
覆盖地球71%表面积的海洋对人类的生存和发展具有重要意义,反过来也受到了人类活动的广泛影响,它不仅是各类陆源污染物的汇,同样也是ARGs的重要天然储库. 海洋环境中的ARGs可以存在于细菌等微生物体内,也可以在微生物死亡后释放到海水和沉积物中并长期存在[5-6]. 这些ARGs可以在海洋生物之间传播,也可以在海洋生物与人类之间传播,显然海洋介质在ARGs的传播中发挥着重要作用,但这种作用在很大程度上无法量化[6-7]. 全球约40%的人口居住在海岸线100 km2以内的沿海地区,海洋环境中ARGs的存在会对这一区域的人类健康带来前所未有的挑战[8]. 但目前人们对于海洋环境中ARGs的来源、组成和影响因素,仍缺乏系统的认识. 本研究在总结国内外最新研究的基础上,重点讨论了海洋环境中ARGs的主要来源,对比分析了不同海域ARGs的优势类型、浓度水平,以及多个影响因子对海水和沉积物中ARGs的潜在影响,探讨了海洋环境中ARGs的传播扩散路径以及潜在影响等,为深入研究和治理海洋环境ARGs污染,降低ARGs的生态和健康风险提供参考.
1. 海洋环境中抗生素抗性基因的来源(Sources of antibiotic resistance genes in marine environment)
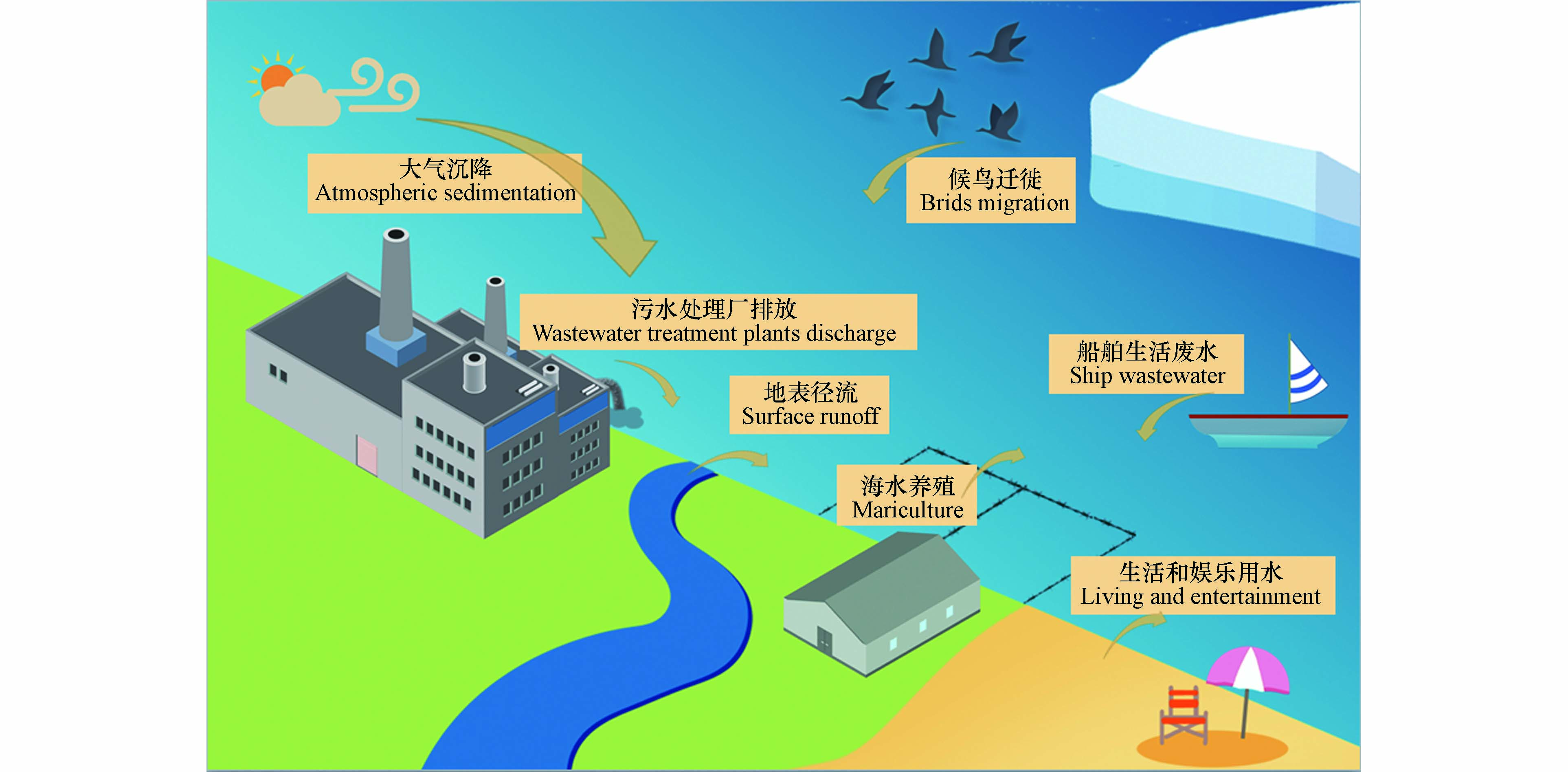
海洋环境中的污染物往往存在着复杂的来源,如污水处理厂排放、地表径流、船舶污染、人类近岸活动、大气远距离传输和候鸟迁徙等过程,这些过程给海洋环境带来了大量的污染物[9-12],其中就包括ARGs.
大多数污水处理厂的现有水处理方法不能有效地去除抗生素和ARGs,残留的抗生素和ARGs会通过污水处理厂的出水口排放到环境中,是河口和近海环境中ARGs的一大来源[13-15]. 在国内外许多海域,近海污水处理厂的废水排放是ARGs的重要来源之一. Huang等[16]的研究发现,市政污水处理厂的废水可能是福建九龙江口和闽江口的主要ARGs污染源. Makkaew等[17]的研究表明,污水直排输入会提高泰国邦盛和芭提雅海滩附近海水中ARGs的丰度. Fonti等[18]研究发现,在中亚得里亚海排放入海的废水中存在大量的ermB、qnrS、sul2和tetA等ARGs.
除此之外,地表径流也是海洋环境中ARGs的一个重要来源,人类和动物疾病治疗残留的大量抗生素和诱导产生的ARGs随着人为排放、雨水冲刷等途径直接入海或者进入河流,最终将排放到河口和近海环境中[13,19]. Dewi等[20]研究发现,澳大利亚悉尼海滩附近海水中的碳青霉素烯耐药菌很可能是通过雨水和其他淡水径流从陆源输入的. 河流排放是渤海[21]ARGs的重要来源之一,而胶州湾的ARGs则可能来自于河水和/或陆地废水排放[22].
包括近海海水养殖、居民生活、娱乐用水等的人类活动也会给海洋环境带来ARGs污染. 为了治疗和预防动物疾病,海水养殖过程中往往会投加大量的抗生素,这些抗生素将会导致海洋环境的ARGs污染[23-24]. 与自然海域相比,海水养殖场中ARGs丰度更高[25]. 在土耳其爱琴海居鲁克湾[26]进行的观测表明,水产养殖区具有更高的抗生素耐药风险. 韩国巨济附近海水中ARGs来源可能是沿海地区的港口和造船厂活动,而莞岛附近海水中ARGs的来源可能是水产养殖或农业活动[27].
候鸟尤其是海鸟在迁徙的过程中,也会携带ARGs并将其传播到更远的区域. 在美国东北部沿海水域,海鸟中分离出来的细菌的耐药性比在海洋哺乳动物中更普遍[28]. 斯瓦尔巴群岛朗伊尔城繁殖区的北极燕鸥泄殖腔内存在大量β-内酰胺类和喹诺酮类耐药菌[29]. 这些存在于海鸟体内的ARGs,将会随着海鸟的长距离迁移,传播到更远的区域.
除此之外,大气远距离传输和船舶生活污水排放等途径也将给海洋环境尤其是远洋环境带来ARGs污染,但目前仍缺乏相应的研究,人们对这些来源的贡献以及影响这些传播途径的因素知之甚少(图1).
2. 海洋环境中抗生素抗性基因的检测方法(Detection of antibiotic resistance genes in marine environment)
对于海洋环境中微生物抗生素耐药性的检测,主要包括传统的微生物培养-药敏试验的方法和采用分子生物学技术的聚合酶链式反应(polymerase chain reaction, PCR)、定量PCR(quantitative real-time PCR, qPCR)、高通量qPCR(high-throughput qPCR, HT-qPCR)以及宏基因组检测等方法. 前者仅能检测海洋环境中可培养的ARB,而后者分析的对象则包括了可培养和不可培养的微生物,并可以进一步检测海洋环境中的ARGs,使得到的结果更为全面.
在一些早期的研究中,大多采用细菌培养-药敏试验的方法对海洋环境中细菌的耐药性进行检测[30-32]. 这种方法较为简单,且成本较低,可以检测细菌的耐药率,鉴别多重耐药菌. 其中,药敏试验部分主要包括纸片扩散法(K-B琼脂法)和稀释法,前者主要通过测量含抗生素在琼脂平板培养基上形成的抑菌环的直径,测定细菌的耐药强度;后者则是通过配置药物浓度梯度稀释的培养基,测定抗生素的最小抑菌浓度(minimum inhibitory concentration, MIC),进而得到细菌耐药强度[33].
一些研究会对得到的细菌进行进一步的DNA提取,并进行PCR检测,以进一步鉴定其中的ARGs种类[34-36]. 也有一些研究直接对海水或沉积物进行DNA提取,进一步PCR检测[37-38]. PCR检测主要是对特定DNA片段进行指数扩增,再采用琼脂糖凝胶电泳对扩增产物进行检测,以鉴别原始样品中是否存在目标DNA片段,这种检测方法耗时短、准确性强,能够定性分析海水和沉积物中的ARGs,但不能对其定量. 因此,近年来的许多研究采用了qPCR方法,对ARGs进行定量检测[39-41]. qPCR检测是在PCR检测的基础上,通过分析荧光信号在特定DNA片段指数扩增过程中的累积,对目标DNA片段进行定量的检测方法,这种方法可以更直观的表征海洋环境中ARGs组成和丰度的变化. 随着检测技术的发展,也有一些新的研究采用微滴式数字PCR(droplet digital PCR, ddPCR)[42]和HT-qPCR[43-44]对海洋环境中ARGs的组成进行分析,这些方法的灵敏度和检测效率更高.
随着测序技术的逐步发展,越来越多的研究采用了宏基因组检测的方法对海洋环境中ARGs的组成进行分析[45-47]. 宏基因组又名微生物环境基因组或环境基因组,主要是从环境中直接提取全部的DNA,并构建宏基因组文库,进行测序,更全面地识别出环境中ARGs的组成;也可通过基因克隆,构建文库进行筛选分析,发现新的ARGs[48].
3. 海洋环境中抗生素抗性基因污染现状(Current status of antibiotic resistance gene pollution in marine environment)
3.1 海水中抗生素抗性基因污染现状
海洋环境中的污染物既会受到附近人为污染源的强烈影响,也会随着海洋环流不断扩散,对遥远的大洋和极地产生影响,并长期存在于海水和沉积物中(图2). 因此,不同区域海水中ARGs的组成和丰度往往存在较大的差异,但总的来说,多药耐药基因,β-内酰胺类抗性基因和磺胺类抗性基因是常被检出的类型(表1).
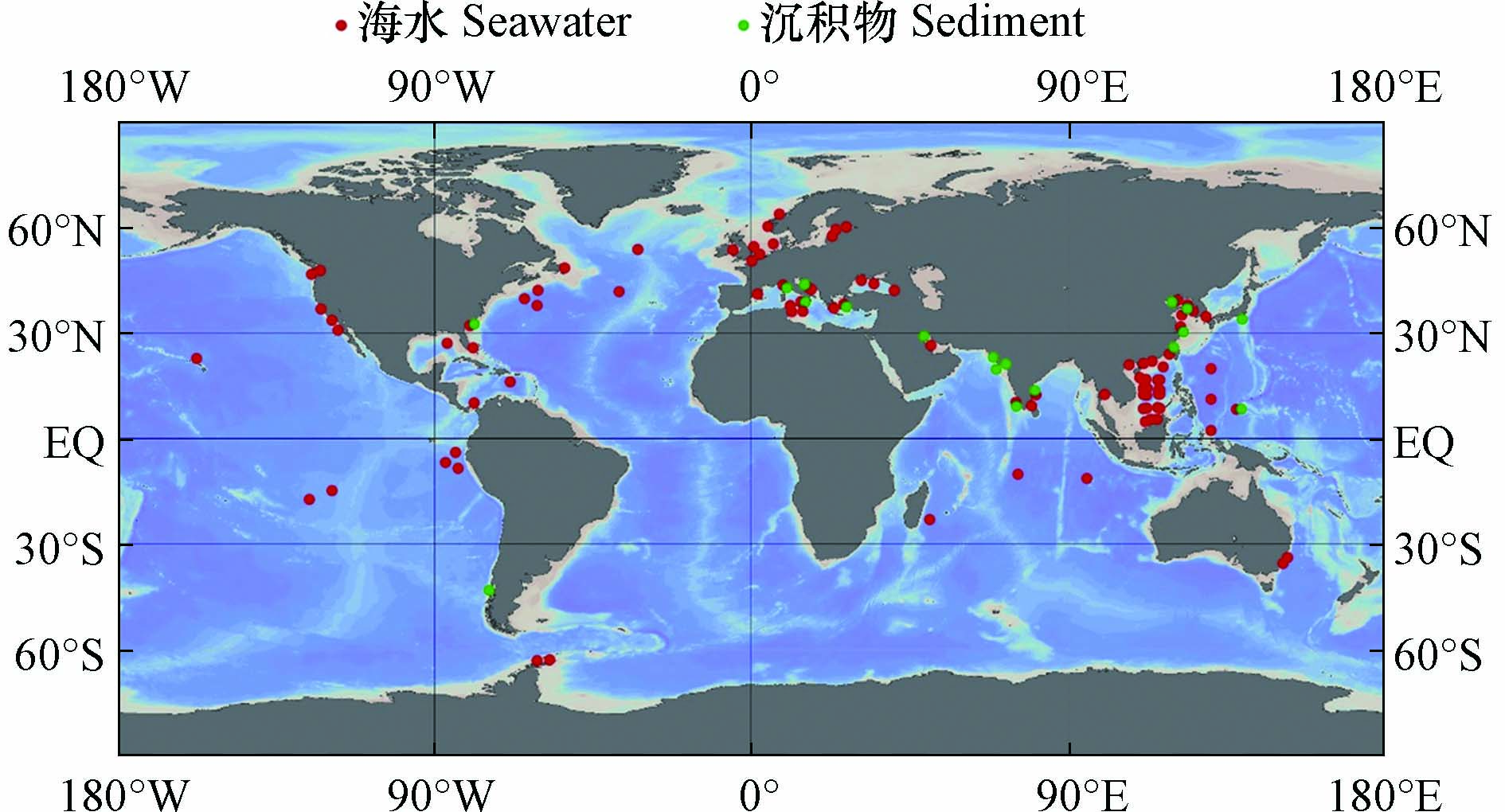 图 2 海水和沉积物中ARGs的相关研究(采用Ocean Data View[69]绘制)Figure 2. Researches of ARGs in seawater and sediments (Draw with Ocean Data View)
图 2 海水和沉积物中ARGs的相关研究(采用Ocean Data View[69]绘制)Figure 2. Researches of ARGs in seawater and sediments (Draw with Ocean Data View)河口和近海生态系统是陆源抗生素和ARGs入海的起点[39,49-50]. 对于印度洋附近海域,科钦河口肠外致病性大肠杆菌对β-内酰胺类抗生素氨苄西林耐药性最强(23.07%),其次是四环素(19.23%)[51]. 对于大西洋附近海域,西西里岛西北部近海地区的海水中β-内酰胺类抗性基因bla-TEM的检出率最高[38],亚得里亚海东部卡什泰拉湾的海水中β-内酰胺类抗生素耐药最强,其中检出率最高的抗性基因是bla-TEM[52],黑海近海地区海水中万古霉素类抗性基因vanB(2×10−1±1×10−1)和β-内酰胺类抗性基因bla-SHV(4×10−2±1×10−2)是相对丰度最高的ARGs[53],英吉利海峡和北海海域磺胺类抗性基因sul1占主导[54]. 在太平洋沿岸海域,泰国邦盛和芭堤雅海滩的海水中,bla-TEM在所有样品中均能检测到,磺胺类抗性基因sul1检出率为97.6%,四环素类抗性基因tetQ检出率为85.4%[17];我国通向南海的河口中,β-内酰胺类抗性基因和磺胺类抗性基因占主导[55-56];在渤海湾检出率最高的ARGs为磺胺类抗性基因sul1、sul2,β-内酰胺类抗性基因bla-TEM和四环素类抗性基因tetB,四者检出率均为100%[6]
而与近海环境相比,更开阔且受人类活动影响较小的大洋区域,ARGs的丰度相对较低. 在相对封闭的地中海,检测到的ARGs的平均相对丰度明显高于开阔的南大西洋[57]. 对于不同大洋区域,ARGs丰度也存在差异,西太平洋海水中ARGs的丰度((3.0×106±1.6×106) copies·mL−1)高于南大洋((1.7×106±1.0×106) copies·mL−1),ARGs丰度从最远的采样点到靠近陆地的采样点呈增加趋势,与人类活动或人为污染源有关[58]. 而对于同一区域,西太平洋中层和深层海水中观察到的ARGs丰度与在浅海中的差异并不显著,表明深海也是ARGs的汇[58]. 此外,在大西洋和北海的海水中,sul2基因在40年间无显著变化,但造成这一奇怪现象的原因仍不清楚[42].
极地通常被认为是脆弱且受人类影响最小的区域,但极地海洋环境中仍有ARGs的存在,不过南极海水中ARGs的丰度比地中海中低3—5个数量级,bla-TEM和tetW是地中海中最丰富的ARGs,而bla-TEM和bla-CTX-M-1是南极海域最丰富的ARGs,这种差异主要与人为污染有关. 地中海海水中ARGs的丰度更高,主要是由于受到沿岸人类活动带来的高抗生素选择压力和人类粪便污染的影响[63]. 在南极洲菲尔德斯地区,多肽、多药耐药和β-内酰胺抗性基因在海水中的含量也较为丰富.
表 1 不同海域海水中的ARGs的丰度Table 1. Abundance of ARGs in seawater of different areas海域Sea area 研究时间Time 研究方法Method ARGs 相对丰度(16S rRNA−1)Relative abundance 绝对丰度Absolute abundance 参考文献Reference 中国渤海湾 2015.07.12 qPCR tetM 5.15×10−5 [59] sul 10−5—10−3 泰国邦盛和芭堤雅海滩 2018.12, 2019.02—2019.08 qPCR bla-TEM 2.08—4.12 lg copies·100 mL−1 [17] 中国黄海和渤海 2018.08.18—2018.09.07 qPCR sul1, sul2, tetB, tetG, tetX, ermF, ermT, qnrA, qnrB, qnrS 21.1—8.00×103 copies·mL−1 [60] 西太平洋和南大洋 2019.10.31—2019.12.04 qPCR tetA, tetB, tetBP, tetD, tetZ, sul1, ermB, blaTEM, qnrD, oqxA (3.0×106±1.6×106) copies·mL−1 [58] 爱尔兰海 2018.09—2019.10 qPCR bla-TEM 2.6×103—6.3×103 GC·100 mL−1 [41] sul1 3.7×102—4.8×103 GC·100 mL−1 黑海 2019.07—08 qPCR vanB 2×10−1±1×10−1 [53] bla-SHV 4×10−2±1×10−2 bla-CMY 1×10−2±3×10−3 mcr-1 3×10−2±2×10−2 ermB 1×10−3±5×10−4 vanA 1×10−5±5×10−4 悉尼港河口玫瑰湾 2019.08—09 qPCR sul1 (7.96×101±2.16×102) copies·100 mL−1 [61] qnrS (1.38×103±3.23×103) copies·100 mL−1 tetA (9.98×103±3.03×103) copies·100 mL−1(2.87×105±2.50×105) copies·100 mL−1 波罗的海 2008.08,2009.09 qPCR tetB 1.8×102—7.3×102 copies·L−1 [62] bla-SHV 2.5×102—1.0×103 copies·L−1 ermB 5.0×101—3.0×102 copies·L−1 tetM 4.2×101—7.8×103 copies·L−1 sul1 2.5×101—1.7×104 copies·L−1 英吉利海峡和北海海域 2020.01 qPCR tetA 2.24 lg copies·mL−1 [54] sul1 1.52—3.55 lg copies·mL−1 3.2 沉积物中抗生素抗性基因污染现状
与流动的海水环境相比,沉积物更具有区域稳定性,因此ARGs更倾向于在沉积物中积累,沉积物中的ARGs丰富且持久[21,60](表2),所以沉积物的再悬浮也是海水中ARGs的一种重要来源[17,49,64]. 总的来说,多药耐药基因和磺胺类抗性基因是海洋沉积物中常被检出的类型(表2和图2).
表 2 不同海域沉积物中的ARGs丰度Table 2. Abundance of ARGs in sediment of different areas海域Sea area 研究时间Time 研究方法Method ARGs 相对丰度(16S rRNA−1)Relative abundance 绝对丰度(copies·g−1)Absolute abundance 参考文献Reference 中国渤海湾 2015.07.12 qPCR tetM 1.7×10−4 [59] sul 10−4—10−2 中国九龙江口和闽江口 2016.04 宏基因组 289种ARGs 1.05×10−1—2.93×10−1 [16] 中国黄海和渤海 2018.08.18—2018.09.07 qPCR sul1, sul2, tetB, tetG, tetX, ermF, ermT, qnrA, qnrB, qnrS 4.67×103—1.08×107 [60] 白令海北部 2007.05—06,2016.07,2015.11 qPCR sul1, sul2, sul3, tetA, tetB, tetM, tetC, tetD, aacC2, aacC3, aacC4, qepA, qnrB, qnrA, qnrS, qnrD, ermC, blaOXA-1, blaTEM-1, blaOXA-2, blaDHA-1, blaVIM-1, ampC, blaCMY-2, blaOXA-10, blaSHV-1, blaGES-1, blaNDM-1, blaKPC 10−9—10−5 [68] 中国渤海附近海河河口 2018.05 HT-qPCR 85种ARGs 9.06×106—2.93×108 [43] 对于印度洋周边海域,在科威特附近海域沉积物中β-内酰胺类、头孢菌素类和青霉素类抗性基因被频繁检出[65],而在库奇湾、康巴特湾和阿拉伯海的沉积物中,多药耐药抗性基因的占比几乎>40%[66]. 对于太平洋周边海域,多药耐药基因是东中国海九龙江口和闽江口主要的ARGs类型[16],氨基糖苷类、多药耐药和磺胺类耐药是渤海湾西部海河河口3种最主要的耐药类型,其主要的耐药机制为抗生素失活和外排泵(共占81.4%)[43].
在大洋区域的沉积物中,情况与近海不同,ARGs的检出率和种类数目明显低于海水中. Su等[67]在西太平洋雅浦海沟的一个沉积物样品中检出了杆菌肽抗性基因,在另外两个沉积物样品中则未检出任何ARGs,而在海水样品中则检出了包括万古霉素、大环内酯和多药耐药等多种ARGs,这可能与海沟的极端深度和远离人为污染有关.
在极地海洋沉积物中也检出了ARGs. 在北极和亚北极的白令海北部区域,sul1、sul2和sul3是最普遍存在的ARGs,但其丰度与渤海湾的海河河口和其他受人类严重影响的海域相比低约2—5个数量级[68].
4. 海洋环境中抗生素抗性基因的影响因素(Influencing factors of antibiotic resistance genes in marine environment)
除污水处理厂的排放、地表径流、船舶污染、人类近岸活动等常见ARGs污染源的影响外,海洋环境中ARGs的组成还受到多种生物和环境因素的影响.
微生物作为ARGs的直接宿主,其群落组成会对ARGs的组成产生重要影响,但在不同区域,ARGs往往有着不同的潜在宿主. 蛭弧菌门(Bdellovibrionota)、蓝细菌(Cyanobacteria)和Margulisbacteria是西太平洋和南大洋海水中ARGs的主要潜在宿主[58]. γ‐变形菌(Gammaproteobacteria)和α-变形菌(Alphaproteobacteria)是西太平洋和深海ARGs的主要潜在宿主[70]. 而拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)与黄海沉积物中大部分ARGs正相关,可能是其潜在宿主[71]. Yang等[57]通过对Tara Oceans项目收集的全球132个海水样品中ARGs组成分析发现,海杆菌(Marinobacter)、交替单胞菌(Alteromonas)、黄杆菌(Flavobacterium)和假交替单胞菌(Pseudoalteromonas)是这些样品中ARGs的主要潜在宿主. 这种差异可能是不同区域理化因子和优势菌群的差异导致的. 与大多数化学污染物不同,ARGs不仅能够长期存在于海洋环境中,而且还能够通过VGT随着宿主的增殖进一步扩增. Li等[72]对龟山岛附近浅海热液口海水的调查显示,细菌群落和物理化学因素对ARGs的组成存在较强的共同影响,细菌群落介导的VGT过程可能对浅海生态系统中ARGs的组成存在重要影响. 此外,它们还能通过HGT作用在不同细菌之间传递,在环境中逐渐增加[73-74]. 包括质粒、转座子、整合子等在内的可移动遗传元件(Mobile Genetic Elements, MGEs)通过接合、转化、转导等方式实现HGT[75]. 许多研究都发现intI1能够促进海水和沉积物中一些基因的传递[43,58-59,76]. 例如,Na等[77]研究显示,1类整合子intI1与sul1和sul2显著相关,表明1类整合子可以促进黄海海水和沉积物中这两种抗性基因的传播. 而亚得里亚海沉积物中,具有β-内酰胺抗性的大肠杆菌菌株则与IncF质粒之间表现出显著相关[78].
此外,抗生素作为诱导产生ARGs的直接驱动力,是许多区域ARGs组成和丰度的重要影响因素. 例如,在一些海水养殖区,抗生素的浓度与一些相应ARGs丰度呈显著正相关关系[64,79]. 在厦门西溪河口和台州椒江口也发现了相同的情况[44]. 在珠江口的沉积物、北黄海的海水和渤海湾水和沉积物中,sul1和sul2都与磺胺类抗生素均呈显著正相关[56,59,77],此外,在渤海湾的海水和沉积物中,tetW与土霉素也呈显著正相关[59]. 但这种情况并非是绝对的,同样是在黄、渤海沉积物中,Lu等[60]的研究则发现,ARGs与相应抗生素间无明显相关关系. 在辽河河口海水、泰国沿海海水、香港沿岸沉积物中,抗生素浓度也与ARGs无明显相关关系[39,80-81]. 这可能与抗生素浓度和水文动力学过程对污染物的影响有关,在抗生素浓度高的养殖等区域,对ARGs存在更强的选择压力,并且海水的运动也会稀释近海水体中的抗生素和ARGs,减弱二者的相关性[39].
非抗生素污染因素也可以通过共同选择过程等影响ARGs的组成和丰度[39,82]. 越来越多的证据表明,重金属[39]、微塑料[46]、有机污染物(包括苯扎氯铵消毒剂[83]、多环芳烃(polycyclic aromatic hydrocarbons, PAHs)[84]、多氯联苯(polychlorinated biphenyls, PCBs)[85]、杀虫剂[86]、等离子液体[87]、纳米粒子[88]等在内的多种因素都会影响环境中ARGs的组成和丰度. Yang等[46]研究发现,与海水相比,微塑料和大塑料中ARGs和MRGs的相对丰度均较高,塑料是ARGs的重要载体. Wang等[84]研究发现,PAHs促进了海水中intI1介导的ARGs的共轭转移. Li等[50]研究发现,有机污染物PAHs、PCBs和六溴环十二烷的浓度也与ARGs丰度呈正相关,这一结果可以通过上述污染物对intI1的上调来解释. 此外,也有许多研究表明,海水和沉积物中的重金属与ARGs间存在显著正相关,这与共选择机制作用有关[39,44,50].
与淡水环境相比,海洋具有独特的物理化学性质,包括pH、盐度、营养盐和微量元素水平等,这些因素也会影响ARGs的组成. Zhang等[6]研究表明,海水中溶解氧(dissolved oxygen, DO)和sul2、bla-TEM有强负相关,DO是表示海水自净能力的重要因素,ARGs与DO呈负相关,表明海水的自净能力越低,ARGs的丰度越高,即在低氧海水环境中,ARGs具有更高的浓度. 盐度是衡量海水性质的重要指标,不同研究区域地理位置和盐度变化范围存在差异,对ARGs的影响也就不同. 在大洋海域,盐度高且变化小,而河口和近海区域盐度低且变化幅度大[58]. 在西太平洋和南大洋海水中,盐度和ARGs丰度呈正相关关系[58]. 而在太平洋海域的南海珊瑚礁海域的海水中、渤海湾海河河口沉积物中、厦门西溪河口沉积物中,以及大西洋海域英吉利海峡和北海海水中,盐度和ARGs丰度则呈现负相关关系[43-44,90]. 这可能与污水排放和地表径流对海水的冲淡有关,携带有大量ARGs的污水和河水盐度较低,但会带来大量的ARGs输入,因而导致了这种负相关关系. 与盐度类似,不同海域海水和沉积物中ARGs与不同理化因子的关系也不同. 渤海和黄海海水中ARGs的组成主要受铵盐、硝酸盐和海水盐度的影响[60]. Lu等[44]研究表明,沉积物中ARGs的相对丰度与沉积物粒径和总有机碳(total organic carbon, TOC)含量呈正相关,与沉积物pH和氧化还原电位呈负相关,其中,沉积物粒径是影响ARGs丰度的主要因子. 英吉利海峡和北海海水中sul1与DO、pH和浊度显著正相关[54]. 福建闽江口沉积物中ARGs与TOC、总氮(Total Nitrogen, TN)和总磷(total phosphorus, TP)显著正相关,而九龙江口沉积物中ARGs则与TOC显著正相关,与TN和TP显著负相关[16]. 西太平洋和渤海海水中的糖肽、三氯生、磷霉素和大环内酯-林可酰胺-链阳菌素抗性基因与亚硝酸盐、硝酸盐、叶绿素a、DO呈正相关,而糖肽、三氯生、大环内酯-林可酰胺-链阳菌素和β-内酰胺抗性基因与盐度和DO呈负相关[70]. 总的来说,TOC与海水和沉积物中ARGs呈明显正相关,而不同区域营养盐和pH则对ARGs的组成呈现不同的影响. 有机碳作为微生物尤其是异养细菌的重要营养来源,可以影响微生物群落[90-91],因而与ARGs呈明显正相关;而不同区域营养盐浓度和微生物群落组成差异较大,因此对ARGs的影响也不同.
综上所述,ARGs与环境因子和生物因素的相关性存在区域差异,可能与不同环境中这些理化因子差异较大、以及微生物的适应过程不同有关. 在复杂的海洋生态系统中,存在多种影响ARGs组成和丰度的因素,但对此仍没有一致性认识,因此需要进一步的识别和量化,并揭示相关机制.
5. 海洋环境中抗生素抗性基因污染的生态与健康风险(Ecological and health risks of antibiotic resistance gene pollution in marine environment)
海洋微生物群落是地球上最丰富、最复杂的群落之一[92],因此海洋也成了ARGs巨大的汇. 虽然海洋环境中ARGs的污染目前可能是局部性的,但其后果具有全球相关性,这些首先存在于局域环境中的ARGs可以通过海洋环流运输、海鲜运输和消费、旅游等过程扩大污染范围,对公共卫生、生态系统功能和动物疾病防治等造成严重危害[93].
首先,沿海地区会受到ARGs污染,并给附近生活的人类造成健康威胁. 例如,公共海滩是潜在ARGs污染源,这些区域的休闲海水、沉积物和沙子中存在的ARGs会给海滩使用者带来潜在的健康风险[17,30,36,94-95]. 在大连的傅家庄海水浴场,海水中检出了多种抗生素耐药大肠杆菌,其中38%(26/69)的菌株对至少一种抗生素具有耐药性[96]. 在巴西的海滩,休闲水域的海水和沙子中,也检测出了多种ARGs[97].
其次,海洋环境中的ARGs可以通过洋流输送到遥远的地区,构成全球风险,最终对人类健康构成威胁. 例如,极地区域和深海中也检出了多种ARGs[47,63,70]. Tan等[68]研究发现,北极/亚北极区域存在多种ARGs,这些ARGs与人类特异性分子标记物显著相关,这意味着极地区域已受到人为源ARGs的污染,而这些人为源ARGs很可能是通过海洋环流等过程传输而来的. 除此之外,陆源ARGs可以通过大气传输影响海洋,而海洋环境中的ARGs也可以通过海-气交换进入大气环境,并通过大气长距离运输,进一步传播到更远的地区. 候鸟迁徙也是ARGs从海洋环境向外扩散的一个重要途径,多项研究表明,海鸟胃肠道和粪便中存在多种ARB和ARGs,它们即是环境中的被感染对象也是潜在的传播源[98-100].
此外,海水养殖设施对海水和沉积物中ARGs的积累和传播也具有重要作用. 随着海水养殖业的快速发展,使得大量投加抗生素治疗养殖生物的细菌感染等疾病成为了常态,这带来了大量的抗生素残留,而鱼、虾等海产品则会从海水养殖环境中摄取这些ARGs,并进一步通过食物链威胁人类健康[101-103]. 在不同国家的多种海产品中均检出了ARGs[104-106]. 例如,在印度孟买零售市场销售的海鲜中分离出了大肠杆菌,71.58%的菌株能够产生超广谱β-内酰胺酶[107]. 在中国12个沿海地区采集的虾的内脏中也检测到了114种ARGs,其中主要为多药耐药抗性基因(21.05%),其次是四环素类抗性基因(17.54%)[108]. 可见,这些存在于海水养殖环境及水产品中ARGs将会通过食用等途径,给人类健康带来风险.
6. 总结与展望(Summarization and prospect)
抗生素耐药性问题是一个全球性的公共卫生问题,也是整个世界,尤其是发展中国家面临的一个亟待解决的重要问题. 而海洋环境作为人类活动产生的污染物的重要归宿,也是ARGs的一个天然储库. 海洋环境中存在着多种ARGs,但目前关于海洋环境中ARGs种类组成和传播途径的相关研究较少,对ARGs的归趋及其影响因素还缺乏系统的认识,对海水和沉积物中ARGs的扩散机制仍有待进一步探索.
因此,建议在以下4个方面强化研究,以深入认识海洋环境中的ARGs污染过程及防控措施:(1)开展各个海域、各种模式下海洋环境中ARGs的来源、组成和丰度的相关研究,深入解析不同人为源和自然源对海洋环境ARGs的贡献. (2)丰富海洋环境中ARGs的相关数据,建立海洋ARGs污染数据库,调查抗生素污染以及由此引发的ARGs对海洋微生物的长期和短期影响,并建立和完善海洋环境中ARGs的生态风险和人类健康风险评价指标体系,研发近海海洋环境ARGs污染基准,为制定相应环境标准、规范海水养殖和近海污水处理排放提供理论依据. (3)深入探究海洋环境中各类理化因子和污染物对ARGs的选择压力及机制,研究海洋环境中ARGs的降解机制,明确ARGs与海洋微生物群落之间的关系,细化海洋生态系统中ARGs的环境行为,从而制定相应策略,以期遏制ARGs在海洋环境中的扩散. (4)明确海洋环境中ARGs扩散和传播的分子机制,基于基因组学、大数据分析和数值模型,预测海洋环境介质中ARGs的变化趋势.
-
表 1 各国土壤生态筛选值制定考虑的关键受体和暴露途径
Table 1. Key receptors and exposure pathways for consideration of ecological soil screening values
国家1Countries 土壤直接接触途径Soil direct contact route 土壤和食物摄入途径Soil and food ingestion route 土壤-地下水途径Soil-groundwater route 美国 Eco-SSL植物 植物 — — Eco-SSL无脊椎动物 无脊椎动物 — — Eco-SSL哺乳动物 — 哺乳动物 — Eco-SSL鸟类 — 鸟类 — 英国 SSV 植物、无脊椎动物和微生物主导的生态功能 野生生物(哺乳动物和鸟类) — 荷兰 MV 植物、无脊椎动物和微生物主导的生态功能 野生生物(哺乳动物和鸟类) — IV — — 加拿大 SQG农用地 微生物(营养和能量循环)、无脊椎动物、植物/作物和牲畜/野生动物 食草动物(初级消费者)和食肉动物(次级或三级消费者)2 牲畜、作物(灌溉)和淡水生物 SQG居住用地/公园 微生物(营养和能量循环)、无脊椎动物、植物和野生动物 食草动物(初级消费者)和食肉动物(次级或三级消费者)3 淡水生物 SQG商业用地 — SQG工业用地 — 1)Eco-SSL植物、Eco-SSL无脊椎动物、Eco-SSL哺乳动物和Eco-SSL鸟类分别表示保护植物、无脊椎动物、哺乳动物和鸟类的土壤生态筛选值;SSV表示英国土壤生态筛选值;MV和IV表示荷兰最大值和干预值;SQG农用地、SQG居住用地/公园、SQG商业用地和SQG工业用地分别表示农用地、居住/公园、商业和工业用地的土壤质量指导值。 Eco-SSLplants、Eco-SSLinvertebrates、Eco-SSLmammals and Eco-SSLbirds refer to Eco-SSLs for plants, invertebrates, Mammalian and birds, respectively; SSV refers to Soil Screening Values in UK; MV and IV refer to Maximal Values and Intervention Values in The Netherlands, respectively; SQGagriculture, SQGresidential/parkland, SQGcommercial and SQGindustrial refer to Soil Quality Guidelines for agriculture, residential/parkland, commercial and industrial land use, respectively. 2)仅当土壤污染物具有潜在生物累积或生物放大特性时,加拿大农用地的土壤SQG推导才考虑食肉动物等次级或三级消费者的土壤和食物摄入途径。 In the case of substances have a strong tendency to bioaccumulate and/or biomagnify, SQGagricultural for soil and food ingestion should be developed for the protection of secondary and tertiary consumers. 3)仅当土壤污染物具有潜在生物累积或生物放大特性时,加拿大居住用地/公园的土壤SQG推导才考虑食草动物等初级消费者和食肉动物等次级或三级消费者的土壤和食物摄入途径。 In the case of substances have a strong tendency to bioaccumulate and/or biomagnify, SQGresidential/parkland for soil and food ingestion should be developed for the protection of primary, secondary and tertiary consumers. 表 2 各国土壤生态筛选值的推导方法(直接接触途径)
Table 2. Derivation methodologies of ecological soil screening values among different countries(soil direct contact route)
国家Countries 毒性数据1Ecotoxicological data1 外推方法Extrapolation methodologies 筛选值确定Determination of soil screening values 美国 Eco-SSL植物 EC20、MATC和EC10 几何均值法 Eco-SSL无脊椎动物 英国 SSV NOEC、EC10和E(L)C50 物种敏感性分布法(SSD)、评估因子法(AF) PNEC(HC5) 荷兰 MV NOEC、EC10和E(L)C50 物种敏感性分布法(SSD)、评估因子法(AF)和平衡分配法 HC5和HC50的几何均值(约HC20) IV HC50 加拿大 SQG农用地 EC25、LOEC和E(L)C50 证据权重法(EC25分布法)、最低效应浓度法和中位效应法(最小值) 25%百分位值 SQG居住用地/公园 SQG商业用地 EC25、LOEC和E(L)C50 证据权重法(EC25分布法)和最低效应浓度法(几何均值) 50%百分位值 SQG工业用地 1)各国毒性数据按照数据使用优先级排列Ecotoxicological data is listed in order of priority for each country.. 表 3 各国土壤生态筛选值的生物有效性因子
Table 3. Bioavailability factors of ecological soil screening values
国家Countries 背景含量Background concentration 土壤理化性质Soil physico-chemical properties 淋洗-老化处理Leaching/aging treatment 美国 评估毒性数据的质量和Eco-SSL的合理性 优先采用生物有效性高(基于pH和有机质含量)毒性数据 开展淋洗-老化处理的毒理试验 英国 (1)风险添加法(Zn和V)(2)总量法(其余污染物),SSV不应低于土壤背景水平 (1)通用SSV:有机物1: E(L)Csta/NOECsta=E(L)C/NOEC×3.4SOM SSVsite - specific = SSVgeneric×SOM3.4 (1)通用SSV的毒性数据不进行淋洗/老化校准(2)当条件允许,毒性数据可基于淋洗/老化因子(L/F)进行校准 荷兰 风险添加法 (1)有机物1: E(L)Csta/NOECsta=E(L)C/NOEC×3.4SOM — 加拿大 SQG不应低于土壤背景水平 (1)分为粗粒土和细粒土(2)毒性数据考虑生物有效性 — 1)E(L)Csta/NOECsta和E(L)C/NOEC分别表示标准土壤和特定土壤的毒性数据,包括EC、LC和NOEC; SOM表示特定土壤的有机质含量(%)。E(L)Csta/NOECsta and E(L)C/NOEC refer to ecotoxicological data in standard and site specific soil, including EC、LC and NOEC, respectively; SOM refer to soil organic matter (%). 2)SSVgeneric和SSVsite specific分别表示通用筛选值和特定场地的筛选值。SSVgeneric and SSVsite specific refer to generic and site specific soil screening values, respectively 表 4 土壤环境质量标准(GB15618—1995)的生态环境效应法
Table 4. Ecological effect methods of soil quality standards (GB 15618—1995)
体系Systems 土壤-植物体系(作物效应)Soil-plant system (Crop effects) 土壤-微生物体系(微生物效应)Soil-microorganism system(Microbial effects) 土壤-水体系(环境效应)Soil-water system(Environmental effects) 内容 农产品质量 作物生长 生化指标 微生物计数 地下水 地表水 目的 保证公众健康 保持良好的生产力 保持土壤生态良性循环 地下水水质符合国家标准 地表饮用水源地水质符合国家标准 依据 食品卫生标准等 农作物产量减产不大于10% 一种以上的生化指标出现的变化率小于25% 微生物数量出现的变化率小于50% 生活饮用水卫生标准 地表水环境质量标准 -
[1] 生态环境部, 国家市场监督管理总局. 中华人民共和国国家标准: 土壤环境质量 农用地土壤污染风险管控标准 GB 15618—2018[S]. 北京: 中国标准出版社, 2018. National Standard (Mandatory) of the People's Republic of China: Soil environmental quality Risk control standard for soil contamination of agricultural land. GB 15618—2018[S]. Beijing: Standards Press of China, 2018(in Chinese).
[2] 生态环境部, 国家市场监督管理总局. 中华人民共和国国家标准: 土壤环境质量 建设用地土壤污染风险管控标准 GB 36600—2018[S]. 北京: 中国标准出版社, 2018. National Standard (Mandatory) of the People's Republic of China: Soil environmental quality Risk control standard for soil contamination of development land. GB 36600—2018[S]. Beijing: Standards Press of China, 2018(in Chinese).
[3] United States Environmental Protection Agency (US EPA). Guidance for developing ecological soil screening levels[R]. Washington DC: US Environmental Protection Agency, 2005. [4] Environment Agency (EA). Derivation and use of soil screening values for assessing ecological risk (Science Report share id26)[R]. Bristol: Environment Agency, 2017. [5] SWARTJES F A, RUTGERS M, LIJZEN J P A, et al. State of the art of contaminated site management in The Netherlands: Policy framework and risk assessment tools [J]. Science of the Total Environment, 2012, 427/428: 1-10. doi: 10.1016/j.scitotenv.2012.02.078 [6] Canadian Council of Ministers of the Environment (CCME). A protocol for the derivation of environmental and human health soil quality guidelines[R]. Ottawa: Canadian Council of Ministers of the Environment, 2006. [7] PERRODIN Y, de BOILLOT C, ANGERVILLE R, et al. Ecological risk assessment of urban and industrial systems: A review [J]. Science of the Total Environment, 2011, 409(24): 5162-5176. doi: 10.1016/j.scitotenv.2011.08.053 [8] United States Environmental Protection Agency (US EPA). Framework for ecological risk assessment[R]. Washington DC: US Environmental Protection Agency, 1992. [9] United States Environmental Protection Agency (US EPA). Guidelines for ecological risk assessment[R]. Washington DC: US Environmental Protection Agency, 1998. [10] United States Environmental Protection Agency (US EPA). Ecological risk assessment guidance for superfund process for designing and conducting ecological risk assessments (Interim Final)[R]. Washington DC: US Environmental Protection Agency, 1997. [11] Environment Agency (EA). An ecological risk assessment framework for contaminants in soil (Science Report SCO70009/SR1)[R]. Bristol: Environment Agency, 2008. [12] Environment Agency (EA). Guidance on the use of soil screening values in ecological risk assessment (Science Report SC070009/SR2B)[R]. Bristol: Environment Agency, 2008. [13] Environment Agency. Soil screening values for use in UK ecological risk assessment[R]. Bristol: Environment Agency, 2008. [14] European Commission (EC). Technical guidance document in support of Commission Directive 93/67/EEC on Risk assessment for new notified substances and Commission Regulation (EC) No 1488/94 on Risk assessment for existing substances and Commission Directive (EC) 98/8 on Biocides, Part 2[R]. Luxembourg: European Commission, 2003. [15] 李勖之, 郑丽萍, 张亚, 等. 应用物种敏感分布法建立铅的生态安全土壤环境基准研究 [J]. 生态毒理学报, 2021, 16(1): 107-118. LI X Z, ZHENG L P, ZHANG Y, et al. Derivation of ecological safety based soil quality criteria for lead by species sensitivity distribution [J]. Asian Journal of Ecotoxicology, 2021, 16(1): 107-118(in Chinese).
[16] 颜增光, 谷庆宝, 周娟, 等. 构建土壤生态筛选基准的技术关键及方法学概述 [J]. 生态毒理学报, 2008, 3(5): 417-427. YAN Z G, GU Q B, ZHOU J, et al. A synoptic review of the technical tips and methodologies for the development of ecological soil screening benchmarks [J]. Asian Journal of Ecotoxicology, 2008, 3(5): 417-427(in Chinese).
[17] 周启星, 滕涌, 展思辉, 等. 土壤环境基准/标准研究需要解决的基础性问题 [J]. 农业环境科学学报, 2014, 33(1): 1-14. doi: 10.11654/jaes.2014.01.001 ZHOU Q X, TENG Y, ZHAN S H, et al. Fundamental problems to be solved in research on Soil-environmental Criteria/standards [J]. Journal of Agro-Environment Science, 2014, 33(1): 1-14(in Chinese). doi: 10.11654/jaes.2014.01.001
[18] 周启星. 环境基准研究与环境标准制定进展及展望 [J]. 生态与农村环境学报, 2010, 26(1): 1-8. doi: 10.3969/j.issn.1673-4831.2010.01.001 ZHOU Q X. Advances and prospect of research on environmental criteria/benchmarks and enactment of environmental standards [J]. Journal of Ecology and Rural Environment, 2010, 26(1): 1-8(in Chinese). doi: 10.3969/j.issn.1673-4831.2010.01.001
[19] CROMMENTUIJN T, SIJM D, de BRUIJN J, et al. Maximum permissible and negligible concentrations for metals and metalloids in the Netherlands, taking into account background concentrations [J]. Journal of Environmental Management, 2000, 60(2): 121-143. [20] 王小庆, 李菊梅, 韦东普, 等. 土壤中铜生态阈值的影响因素及其预测模型 [J]. 中国环境科学, 2014, 34(2): 445-451. WANG X Q, LI J M, WEI D P, et al. Major soil factors affecting ecological threshold for copper and the predictable models [J]. China Environmental Science, 2014, 34(2): 445-451(in Chinese).
[21] 吴燕玉, 陈涛, 张学询, 等. 污灌区环境质量评价的原则和程序 [J]. 农业环境科学学报, 1983, 2(2): 1-5. WU Y Y, CHEN T, ZHANG X X, et al. Principles and procedures for environmental quality assessment of sewage irrigation areas [J]. Journal of Agro-Environmental Science, 1983, 2(2): 1-5(in Chinese).
[22] 夏增禄. 土壤环境容量在总量控制上的应用 [J]. 环境科学, 1985, 6(1): 56-60. XIA Z L. The application of soil environmental capacity to total quantity control [J]. Environmental Science, 1985, 6(1): 56-60(in Chinese).
[23] 夏家淇. 土壤环境质量标准详解[M]. 北京: 中国环境科学出版社, 1996. XIA J Q. Detailed explanation of soil environmental quality standards [M]. Beijing: China Environment Science Press, 1996(in Chinese).
[24] 龙涛, 邓绍坡, 吴运金, 等. 生态风险评价框架进展研究 [J]. 生态与农村环境学报, 2015, 31(6): 822-830. doi: 10.11934/j.issn.1673-4831.2015.06.005 LONG T, DENG S P, WU Y J, et al. Advancement in study on development of ecological risk assessment framework [J]. Journal of Ecology and Rural Environment, 2015, 31(6): 822-830(in Chinese). doi: 10.11934/j.issn.1673-4831.2015.06.005
[25] 窦韦强, 安毅, 秦莉, 等. 农用地土壤重金属生态安全阈值确定方法的研究进展 [J]. 生态毒理学报, 2019, 14(4): 54-64. DOU W Q, AN Y, QIN L, et al. Research progress in determination methods of ecological safety thresholds for heavy metals in agricultural land [J]. Asian Journal of Ecotoxicology, 2019, 14(4): 54-64(in Chinese).
[26] 张霖琳, 金小伟, 王业耀. 土壤污染物的生态毒理效应和风险评估研究进展 [J]. 中国环境监测, 2020, 36(6): 5-13. ZHANG L L, JIN X W, WANG Y Y. Research progress on ecotoxicological effects and risk assessment of soil pollutants [J]. Environmental Monitoring in China, 2020, 36(6): 5-13(in Chinese).
[27] 吴爱明, 赵晓丽, 冯宇, 等. 美国生态毒理数据库(ECOTOX)对中国数据库构建的启示 [J]. 环境科学研究, 2017, 30(4): 636-644. WU A M, ZHAO X L, FENG Y, et al. The enlightenment of the ecotoxicolohy knowledgebase(ECOTOX) for its establishment in China [J]. Research of Environmental Sciences, 2017, 30(4): 636-644(in Chinese).
[28] 刘娜, 金小伟, 王业耀, 等. 生态毒理数据筛查与评价准则研究 [J]. 生态毒理学报, 2016, 11(3): 1-10. doi: 10.7524/AJE.1673-5897.20160503005 LIU N, JIN X W, WANG Y Y, et al. Review of criteria for screening and evaluating ecotoxicity data [J]. Asian Journal of Ecotoxicology, 2016, 11(3): 1-10(in Chinese). doi: 10.7524/AJE.1673-5897.20160503005
[29] 王小庆, 马义兵, 黄占斌. 土壤中镍生态阈值的影响因素及预测模型 [J]. 农业工程学报, 2012, 28(5): 220-225. doi: 10.3969/j.issn.1002-6819.2012.05.037 WANG X Q, MA Y B, HUANG Z B. Influence factors and prediction model for soil nickel ecological threshold [J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(5): 220-225(in Chinese). doi: 10.3969/j.issn.1002-6819.2012.05.037
[30] 李宁, 郭雪雁, 陈世宝, 等. 基于大麦根伸长测定土壤Pb毒性阈值、淋洗因子及其预测模型 [J]. 应用生态学报, 2015, 26(7): 2177-2182. LI N, GUO X Y, CHEN S B, et al. Toxicity thresholds and predicted model of Pb added to soils with various properties and its leaching factors as determined by barley root-elongation test [J]. Chinese Journal of Applied Ecology, 2015, 26(7): 2177-2182(in Chinese).
[31] 王晓南, 陈丽红, 王婉华, 等. 保定潮土铅的生态毒性及其土壤环境质量基准推导 [J]. 环境化学, 2016, 35(6): 1219-1227. doi: 10.7524/j.issn.0254-6108.2016.06.2015101402 WANG X N, CHEN L H, WANG W H, et al. Ecotoxicological effect and soil environmental quality criteria of lead in the fluvo-aquic soil of Baoding [J]. Environmental Chemistry, 2016, 35(6): 1219-1227(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.06.2015101402
-




 下载:
下载:

