-
水质生物毒性检测作为传统理化检测方法的补充,不仅能快速检测出水中是否含有毒性污染物,同时还可反映多种有毒物和污染物的综合毒性[1-2]。目前,用于水质生物毒性检测的生物传感器主要利用有毒物或污染物对不同营养级的指示生物(发光细菌、藻类、溞类、大型无脊椎动物和鱼类等)的呼吸作用、生长发育或运动能力的抑制效应来进行检测[2]。其中较高营养级的指示生物更能反映有毒物或污染物对环境质量的影响程度,但其检测成本较高、耗时也较长且需要专业的生物培养技能与装置,这导致该类群指示生物在实际应用时限制性较大;低营养级的指示生物特别是发光细菌因灵敏度高、响应快且生长周期短已被广泛用于水质生物毒性检测,但发光细菌中应用最多的费氏弧菌(Vibrio fischeri)和明亮发光杆菌(Photobacterium phosphoreum)实为海洋细菌,其生长需在含盐的溶液中,且溶液的浊度和色度会影响检测精度,这也同样限制了其在淡水生境中的广泛应用[3]。因此,寻找一种快速、灵敏、抗干扰能力强且低成本的新型生物毒性传感器成为了现实所需。
近年兴起的微生物燃料电池(microbial fuel cell, MFC)型生物毒性传感器以阳极电活性细菌(Geobacter spp.、Shewanella spp.和Pseudomonas spp.等)为指示生物,当阳极无毒性污染物存在时,电活性细菌通过催化分解有机底物产生电子,电子由胞外电子传递过程转移至阳极,再经电池外电路到达阴极形成稳定电流;当阳极有毒性污染物存在时,电活性细菌的活性或胞外电子传递受到抑制,导致MFC型生物毒性传感器产生的电流降低,通过检测有毒污染物存在时电池产电量的变化则可定量反映水质生物毒性[4-7]。该传感器具有灵敏、抗干扰能力强、无需外加能源、稳定和可自我修复等特点,已被用于检测BOD、COD、挥发性脂肪酸、重金属、氰化物、甲醛和抗生素等[4-7]。然而,目前关于MFC型生物毒性传感器用于检测农药的研究报道较少。KIM等[8]于2007年最早发现,当MFC型生物毒性传感器以1.0 mg·L−1有机磷农药(二嗪磷)为检测物时,所产生的电量降幅高达61%。2012年,王博等[9]利用MFC型生物毒性传感器构建出一套水质生物毒性预警系统,并成功预警了由强降雨导致自来水厂取水区域内农药倒灌引发的饮用水污染事件。2019年,CHOULER等[10]发现,0.3 mg·L−1三嗪类除草剂(莠去津)可使MFC型生物毒性传感器的回路电流下降12%。这些研究结果均表明,MFC型生物毒性传感器可对含农药污水产生毒性响应,但因农药种类多,来源复杂,再加上MFC型生物毒性传感器对不同农药检测的研究匮乏,进而导致MFC型生物毒性传感器检测农药的相关应用极为有限。
为探究MFC型生物毒性传感器对农药污染物的检测性能,本文研究了MFC型生物毒性传感器对溴氰菊酯(菊酯类杀虫剂)、敌百虫(有机磷杀虫剂)、百菌清(有机氯类杀菌剂)、莠去津(三嗪类除草剂)和烟嘧磺隆(磺酰脲类除草剂)5种典型农药检测的剂量-效应关系,评估了MFC型生物毒性传感器中毒后的自我修复能力,并对不同混合农药的生物毒性进行了检测与对比研究。
-
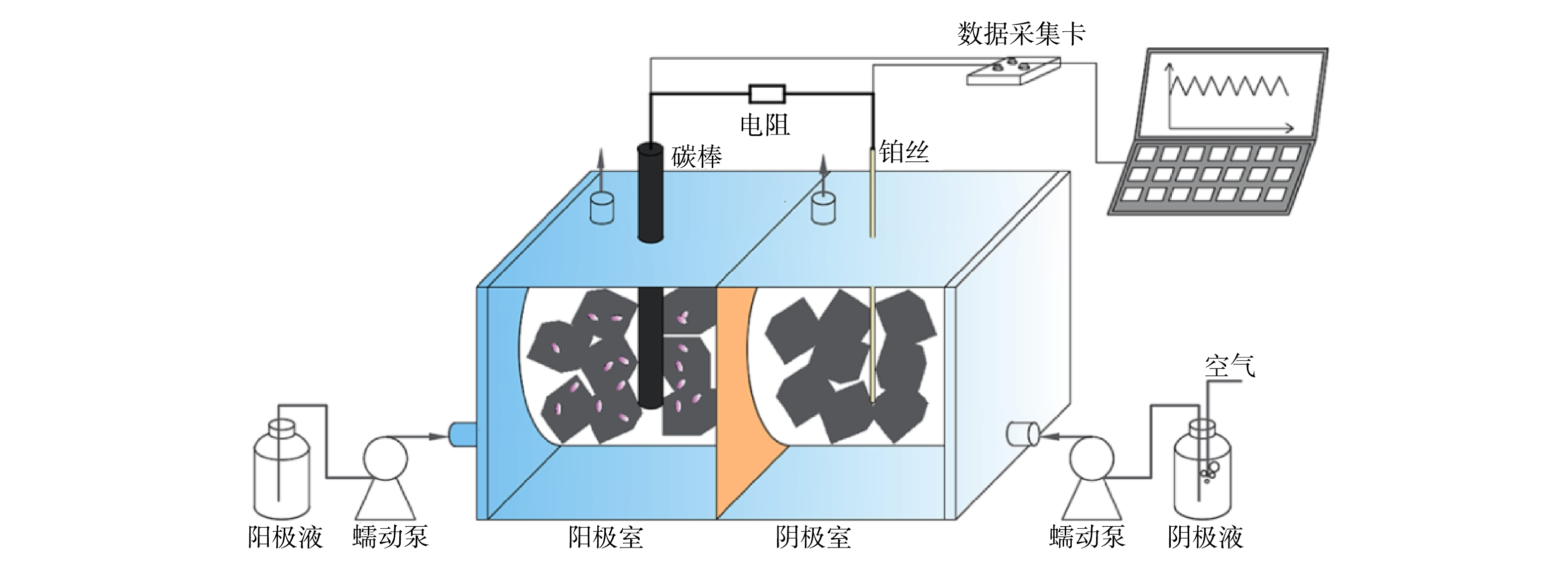
实验装置为双室圆柱立方体MFC型生物毒性传感器,材料为有机玻璃,双室中间以阳离子交换膜(CMI-7000 Membranes International,Glen Rock,NJ,USA)隔开,单室内径为3.0 cm,长为4.0 cm,阳极室和阴极室均填充满0.5 cm
⊆ 0.5 cm⊆ 0.5 cm碳毡块(三业碳素有限公司,北京),碳毡先用1.0 mol·L−1盐酸浸泡24 h,去除表面金属离子,再用1.0 mol·L−1 NaOH浸泡24 h,中和剩余盐酸,最后用去离子水冲洗并浸泡24 h。阳极液和阴极液有效体积均为12 mL。阳极为直径9 mm的碳棒,阴极为直径1.0 mm的铂丝,阴、阳电极用铜导线连接,并与1 000 Ω电阻串联(图1)。MFC型生物毒性传感器的检测单元为阳极,温度控制在(25±2) ℃,平行实验为3组。 -
MFC型生物毒性传感器启动时,以南昌市朝阳污水处理厂氧化沟末端污泥作为阳极菌源,将阳极培养基与污泥等体积混合加入阳极室。阳极培养基参照检测有机磷杀虫剂(二嗪磷)的MFC型生物毒性传感器,以0.2 g·L−1葡萄糖为碳源,其他营养物质以及磷酸缓冲液的组成和浓度参考文献[8]。阴极室为氧饱和的50 mmol·L−1磷酸缓冲液(pH=6.8)。阳极液和阴极液均由蠕动泵周期泵入,流速为6.0 mL·min−1,周期为10 min(包括进样3 min和反应7 min)。待输出电压稳定后,将阴、阳电极与100 Ω电阻串联,待输出电压再次稳定后开始实验,输出电压稳定的判定依据为当前周期的平均输出电压与前5个周期的平均输出电压的差异小于5%。
实验所用的5种典型农药分别为25 g·L−1溴氰菊酯(拜耳作物科学有限公司,浙江)、90%敌百虫(沙隆达股份有限公司,湖北)、75%百菌清(利民化工股份有限公司,浙江)、38%莠去津(长青生物科技有限公司,江苏)和40 g·L−1烟嘧磺隆(长青生物科技有限公司,江苏),所有试剂均以去离子水配制。
-
为了得到MFC型生物毒性传感器检测不同农药的剂量-效应曲线,设置溴氰菊酯的质量浓度分别为0.005、0.05、0.10、0.20、0.30 mg·L−1,敌百虫的质量浓度分别为0.05、0.10、0.20、0.30、0.40 mg·L−1,百菌清的质量浓度分别为0.01、0.05、0.10、0.20、0.30 mg·L−1,莠去津的质量浓度分别为0.003、0.005、0.01、0.03、0.05 mg·L−1,烟嘧磺隆的质量浓度分别为0.01、0.05、0.10、0.20、0.30 mg·L−1。在检测毒性时,将阳极培养基和农药混合作为阳极液,每个浓度连续测试5个周期(50 min),以5个周期内最大产电抑制率(coulombic yield inhibition ratio, Ic)作为传感器对农药生物毒性的响应值,每个样品测试3次,最后拟合Ic与农药浓度,并计算引起10% Ic所对应的农药浓度[11]。毒性检测结束后,将阳极液改为单纯的阳极培养基,以使阳极微生物恢复活性,并记录MFC型生物毒性传感器的输出电压恢复至稳定所需的时间。2次测样之间应保证传感器有24 h的恢复时间[6]。
3种混合农药的设置方法如下:混合农药A为2种杀虫剂和1种杀菌剂混合,即0.005 mg·L−1溴氰菊酯+0.05 mg·L−1敌百虫+0.01 mg·L−1百菌清;混合农药B为2种除草剂混合,即0.003 mg·L−1莠去津+0.05 mg·L−1烟嘧磺隆;混合农药C为混合农药A+混合农药B。
-
极化曲线和功率密度利用电阻为10~99 999.9 Ω的电阻箱测试,由高到低依次调整MFC型生物毒性传感器外电阻,每次调整后稳定120 min,外电阻两端的电压(输出电压)使用数据采集卡(PISO-813, 研华科技有限公司,中国台湾)连续采集,以连续稳定的3个周期的平均电压作为相应外阻条件下的输出电压,回路电流利用欧姆定律计算,电流密度利用式(1)计算,功率密度利用式(2)计算,电流密度和功率密度均相对于阳离子交换膜几何面积。
式中:I为电流,A;U为外电阻两端的电压,V;R为外电阻,Ω;S为阳离子交换膜几何面积,m2;P为功率密度,W·m−2。
产电抑制率为待测水样(含农药的阳极液)进入MFC型生物毒性传感器前后产电量的差值与待测水样进入MFC型生物毒性传感器前的产电量之比,用以表示待测水样的生物毒性,计算公式如式(3)所示[6,8]。
式中:Ic为产电抑制率;Q0为待测水样进入MFC型生物毒性传感器前5个周期的平均产电量,C;Q为待测水样进入MFC型生物毒性传感器后1个周期的产电量,C。
-
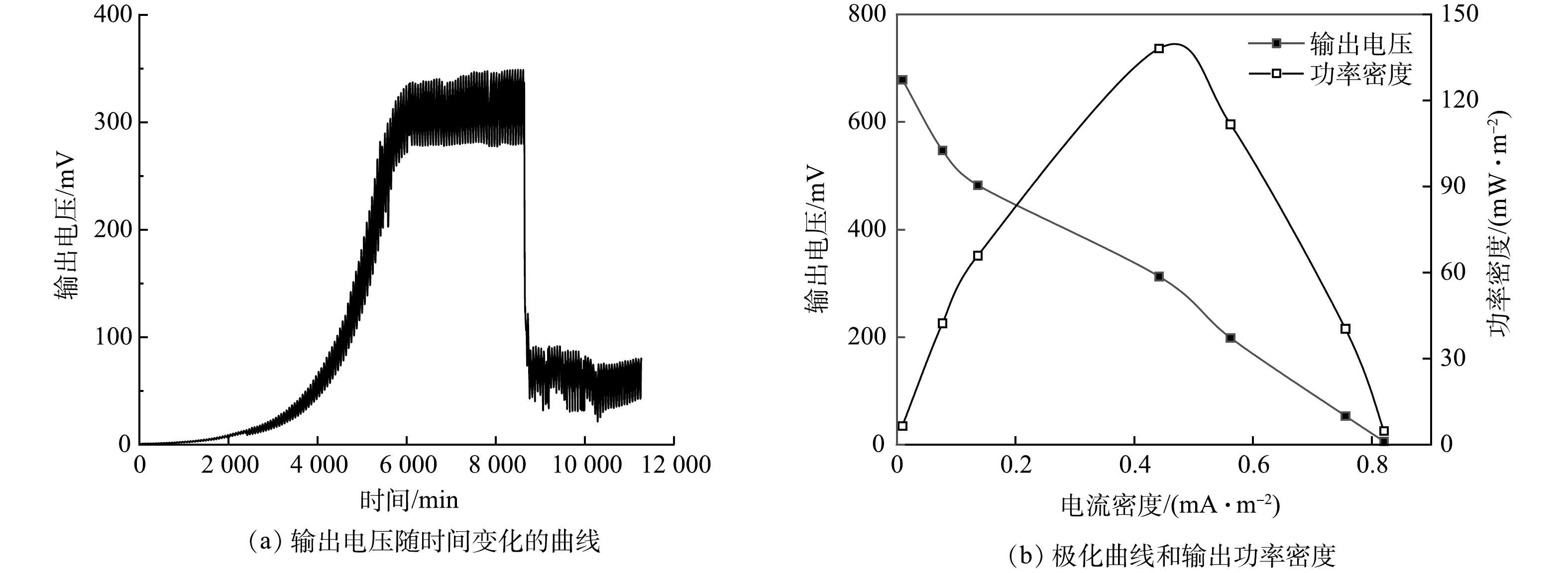
MFC型生物毒性传感器在启动时,外接电阻为1 000 Ω,在接种7 d后,输出电压稳定在(312±36) mV,回路电流为(0.31±0.04) mA(图2(a))。前期研究[12-13]已表明,外接电阻的大小可显著影响MFC型生物毒性传感器的检测性能。在外电阻为50~3 000 Ω时,MFC型生物毒性传感器对Cu(II)的毒性响应值随外电阻的降低先增后减,在外电阻约100 Ω时最大[12]。同样,在MFC型生物毒性传感器检测十二烷基硫酸钠时,在100 Ω外电阻下的毒性响应值远高于1 000 Ω外电阻[13]。因此,本研究为了获得更好的农药检测性能,以100 Ω作为实验时的电阻值。当外接电阻由1 000 Ω改变为100 Ω后,经过2 d的运行,输出电压稳定至(57±22) mV,回路电流为(0.57±0.22) mA(图2(a)),这表明MFC型生物毒性传感器已成功启动。
成功启动后,测试MFC型生物毒性传感器的极化曲线和输出功率(图2(b)),发现回路电流密度为0.44 A·m−2时,输出功率密度最大,为138 mW·m−2,远小于检测BOD的MFC型生物传感器的最大输出功率密度897 mW·m−2[5]。导致该现象的可能原因是,本研究中碳源的质量浓度(0.2 g·L−1)远低于检测BOD传感器的1.282 g·L−1,而使用MFC型生物毒性传感器在检测污染物生物毒性时,低浓度的碳源对应更高的毒性响应值[14]。
-
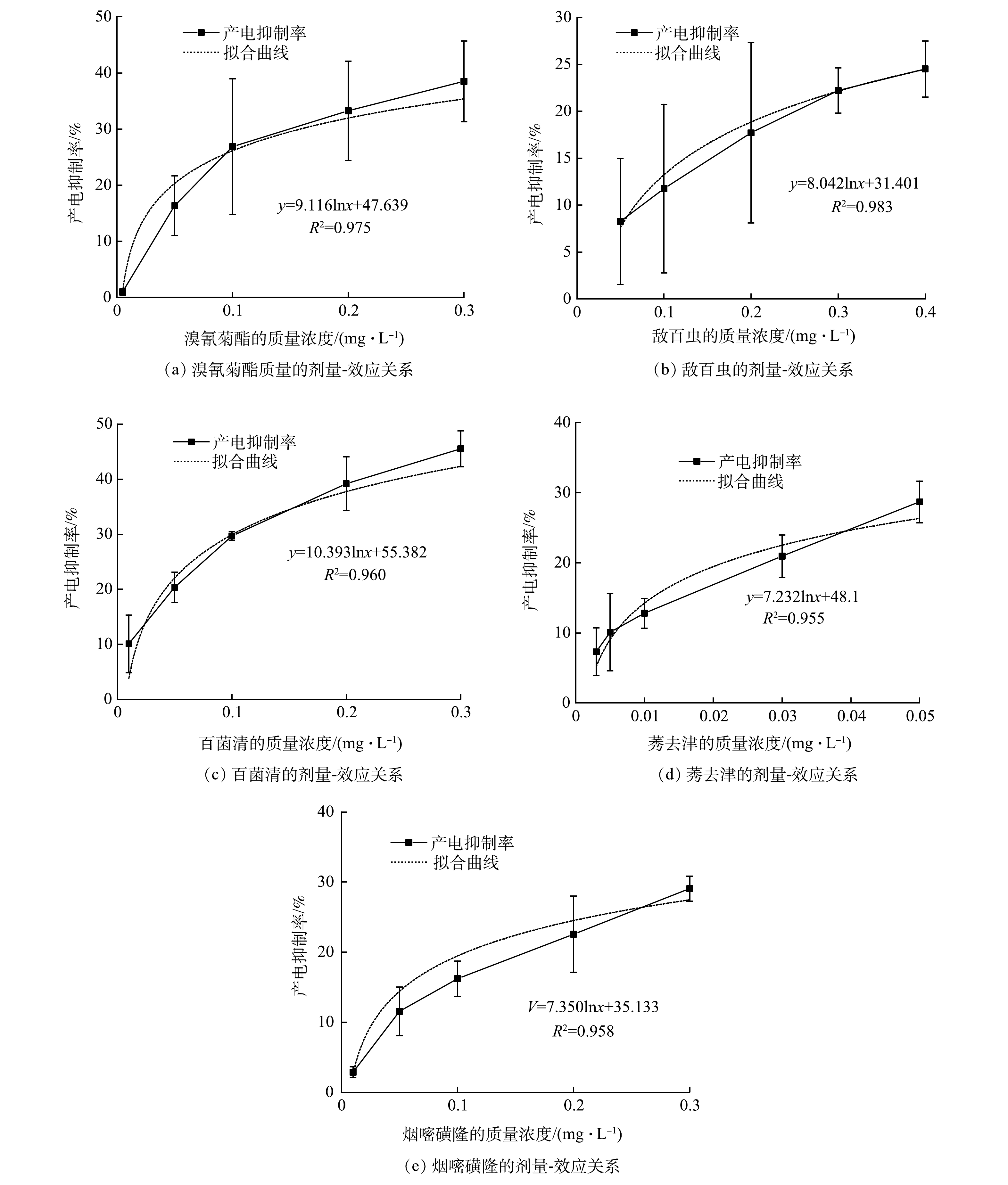
MFC型生物毒性传感器对溴氰菊酯(图3(a))、敌百虫(图3(b))、百菌清(图3(c))、莠去津(图3(d))和烟嘧磺隆(图3(e)) 5种典型农药均有明显的毒性响应(产电抑制率表示为Ic),且Ic随农药浓度增加而增加。当溴氰菊酯的质量浓度为0.005~0.3 mg·L−1时,Ic为(1.0±0.6)%~(38.5±7.2)%;当敌百虫的质量浓度为0.05~0.4 mg·L−1时,Ic为(8.3±6.7)%~(24.5±3.0)%;当百菌清的质量浓度为0.01~0.3 mg·L−1时,Ic为(10.1±5.2)%~(45.5±3.3)%;当莠去津的质量浓度为0.003~0.05 mg·L−1时,Ic为(7.3±3.4)%~(28.7±3.0)%;当烟嘧磺隆的质量浓度为0.01~0.3 mg·L−1时,Ic为(2.9±0.8)%~(29.1±1.8)%。
剂量-效应关系是毒理学的重要概念,通过剂量与效应的线性非阈值模型或阈值模型可对有毒污染物的毒性进行预测和外推。在MFC型生物毒性传感器中,Ic与污染物浓度的线性非阈值模型和阈值模型分别对应线性关系和对数关系[12]。由图3(a)~3(e)可以看出,Ic与农药浓度更符合阈值模型。为了获得10% Ic对应的农药浓度,拟合Ic与农药浓度的对数(图3(a)~3(e))。从5个拟合方程可看出,Ic与溴氰菊酯、敌百虫、百菌清、莠去津和烟嘧磺隆浓度的对数均呈良好的线性关系,可决系数(R2)分别为0.975、0.983、0.960、0.955和0.958。依据如上5个不同拟合方程,溴氰菊酯、敌百虫、百菌清、莠去津和烟嘧磺隆诱导10% Ic时的质量浓度分别为0.016、0.070、0.013、0.005、0.033 mg·L−1,这些质量浓度与GB 3838-2002地表水环境质量标准集中式生活饮用水源地中溴氰菊酯(0.02 mg·L−1)、敌百虫(0.05 mg·L−1)、百菌清(0.01 mg·L−1)、莠去津(0.003 mg·L−1)的质量浓度限值非常接近[15]。以上结果表明MFC型生物毒性传感器可用于预警水环境的低浓度农药污染。
此外,与其他不同营养级指示生物的水质生物毒性检测方法对比,发现莠去津的质量浓度达到15.2 mg·L−1才能使斑马鱼的死亡率达到10%[16],烟嘧磺隆的质量浓度超过1.17 mg·L−1才可使大型溞的急性活动抑制率达10%[17],百菌清的质量浓度达到4.3 mg·L−1时才使微藻(Skeletonema costatum)的96 h荧光抑制率达10%[18],而敌百虫的质量浓度需高达1 452 mg·L−1时才能对明亮发光杆菌(P. phosphoreum)产生10%的发光抑制率[19-20]。另外,HERNANDO等[21]以费氏弧菌(V. fischeri)为指示生物检测莠去津和溴氰菊酯时,发现莠去津的质量浓度升高至6 mg·L−1仍未观察到抑制作用,溴氰菊酯的质量浓度高达5 mg·L−1才可产生30%的发光抑制率。这些产生10%抑制效应的农药质量浓度均远高于本研究所得的结果,表明MFC型生物毒性传感器相比传统的生物毒性传感器对这5种典型农药的检出限更低。
-
为了使MFC型生物毒性传感器在实际预警水质污染时能长期稳定运行,要求阳极微生物在中毒后能快速并完全恢复活性[6,13,22]。本研究在检测每种农药后,通过向阳极连续注入新鲜无农药营养液的方式使阳极微生物快速恢复活性。在这个过程中,残留在阳极的农药被稀释和排出,部分未被排出的农药通过阳极微生物的代谢作用降解消除[10],同时,受损的微生物利用营养液修复繁殖并再生阳极微生物膜[23]。
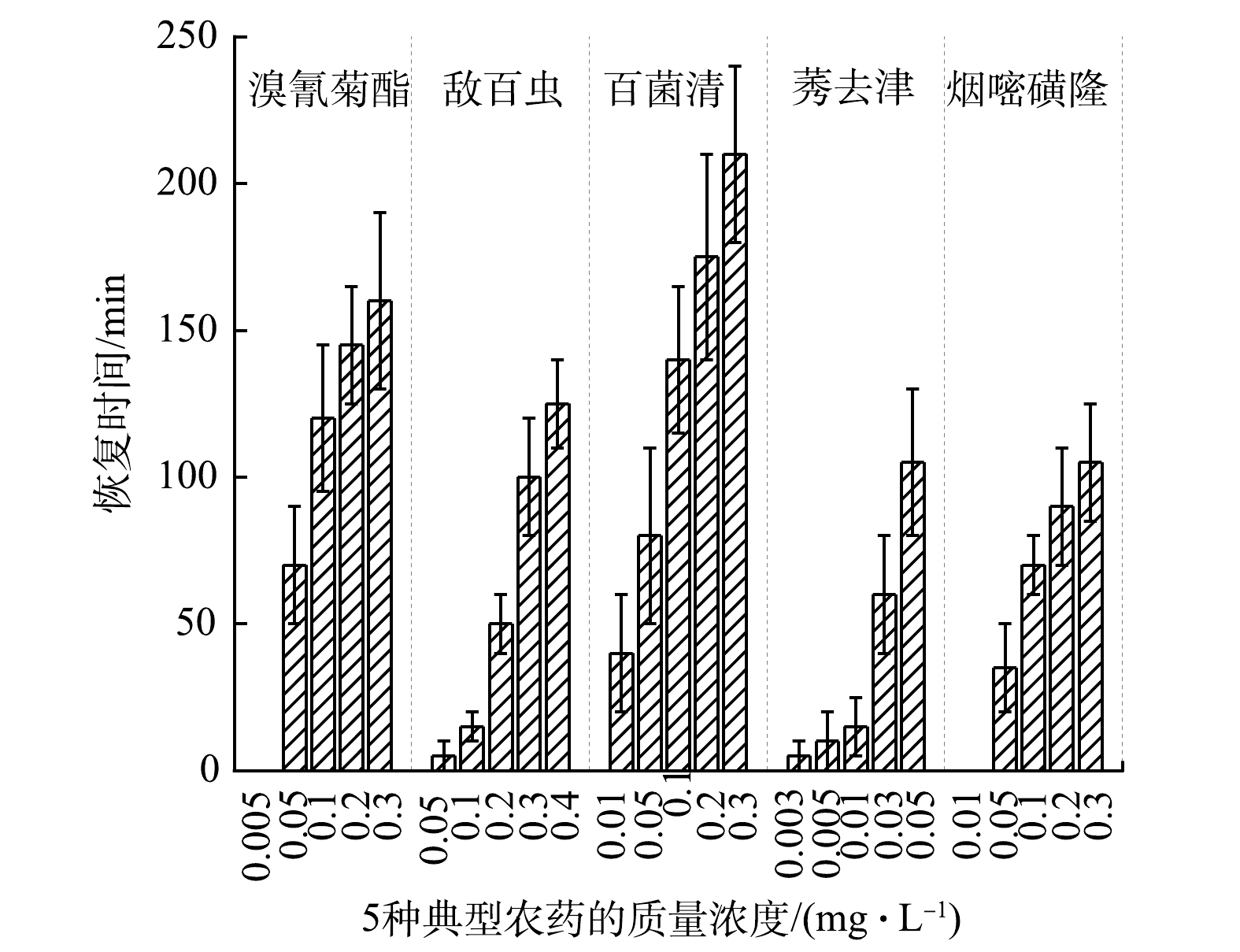
MFC型生物毒性传感器在检测这5种典型的农药后,输出电压恢复稳定的时间均随农药浓度的增加而延长(图4)。其中检测百菌清后的恢复时间明显高于其他农药。导致该现象的可能原因是:在检测百菌清时MFC型生物毒性传感器的Ic更大(图3),即电活性细菌的活性受抑制最严重,恢复所需的时间更长。这与KIM等[8]用MFC型生物毒性传感器检测高浓度有机磷杀虫剂(1 mg·L−1二嗪磷, Ic: 61%)时,恢复时间(10 h)更长的结果一致。另外,由图4可看出,MFC型生物毒性传感器检测这5种典型农药后的恢复时间均在240 min内。这表明MFC型生物毒性传感器的阳极微生物被这5种农药抑制后可快速恢复活性。
实验中还观察到,这5种典型农药在较低浓度条件下,MFC型生物毒性传感器的输出电压可恢复至未染毒前的水平,而随着农药浓度的升高,输出电压的恢复时间逐渐加长,甚至不能恢复至未染毒前的水平。这表明,当5种典型农药在较低浓度时,对MFC型生物毒性传感器阳极微生物活性的抑制是可逆的,而在高浓度时是不可逆的。这与MFC型生物毒性传感器检测十二烷基硫酸钠[13]和甲醛[24]时,输出电压在低浓度下可恢复至染毒前水平,在高浓度下不能恢复至染毒前水平的结果一致。在高浓度条件下,农药会对阳极微生物代谢过程中酯酶的磷酸化产生不可逆的影响[8],从而导致微生物活性受到不可逆的抑制。
在预警高浓度农药污染时,为了使MFC型生物毒性传感器能长期稳定在线监测,当部分阳极微生物发生不可逆失活时,可通过延长恢复时间使生物活性恢复至初始水平。如LI等[23]在利用MFC型生物毒性传感器检测0.1%甲醛时,发现阳极微生物部分失活,输出电压只能恢复到初始60%的水平,通过更换阳极液并延长恢复时间至33 h,可使阳极微生物再生,输出电压恢复至初始水平,且再次检测时获得了可重复的毒性响应;当全部阳极微生物发生不可逆失活时,可利用多个MFC型生物毒性组成的平行传感器组,及时更换失活的传感器[6]。
-
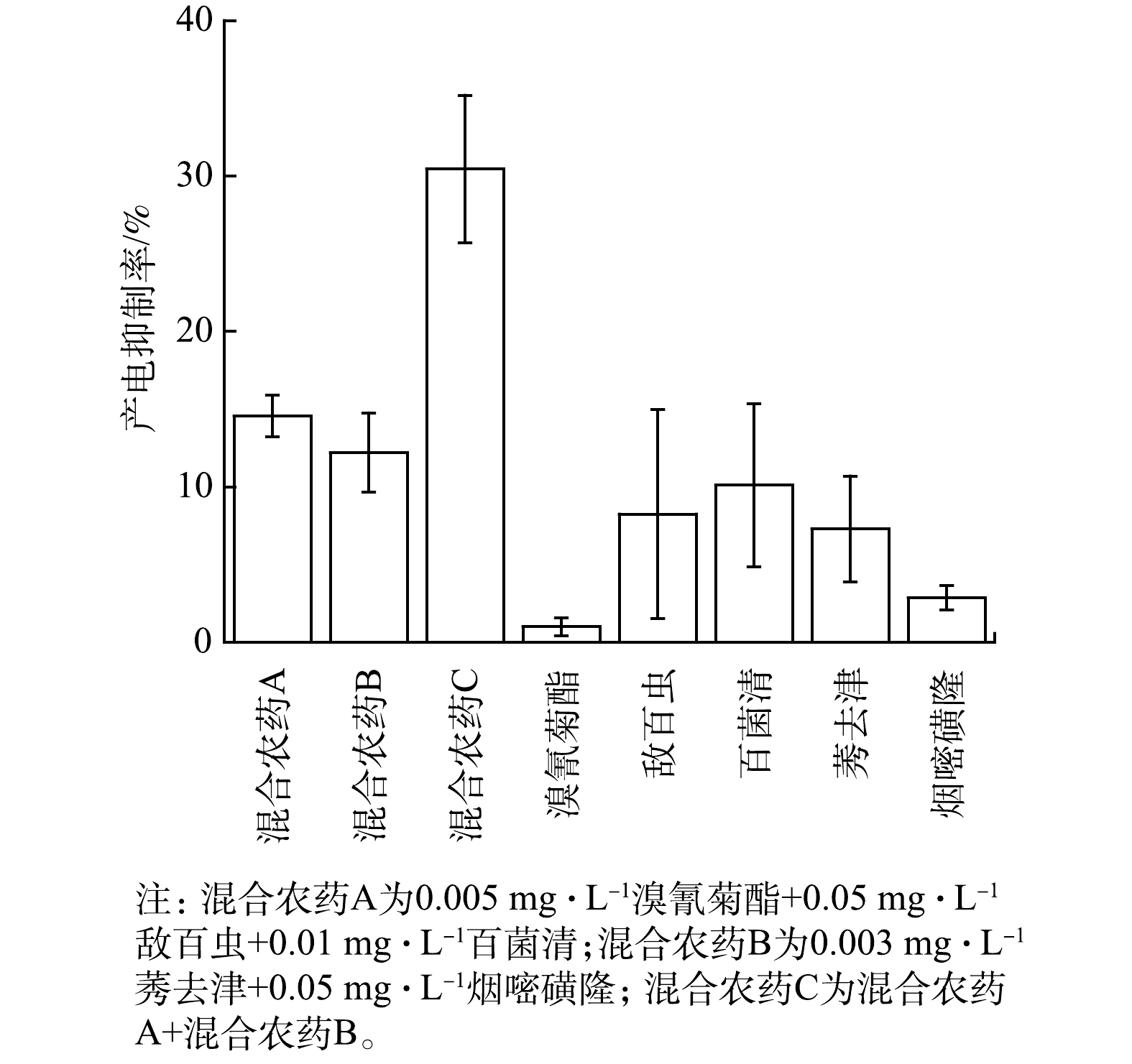
MFC型生物毒性传感器检测混合农药A和混合农药B的Ic分别为(14.6±1.3)%和(12.2±2.5)%,均高于各单一农药的毒性响应(图5),表明混合农药比单一农药具有更强的生物毒性。这与文献中报道的使用混合农药增强药效的现象类似。例如,敌百虫或溴氰菊酯与有机磷杀虫剂混合可增强杀虫作用[25-26],莠去津和烟嘧磺隆混合可提高灭藻效果[27]。进一步将混合农药A和B混合,得到含这5种典型农药的混合农药C,检测得Ic为(30.5±4.7)%(图5),该响应值高于这5种典型农药单一条件时的Ic之和,表明这5种典型农药通过协同作用强化了混合农药的联合毒性。这可能与莠去津可强化有机磷杀虫剂杀虫效果的现象类似[28]。混合农药C中的莠去津可通过增加阳极微生物细胞膜的通透性,促使更多农药进入细胞,从而导致更强的生物毒性。以上这些结果表明,在这5种典型农药浓度满足GB 3838-2002中集中式生活饮用水源地水质要求时,MFC型生物毒性传感器对以这5种典型农药所配制的不同混合农药均有明显的毒性响应。这说明该型生物毒性传感器具有检测低于集中式生活饮用水源地水质标准的混合农药生物毒性的能力,可弥补传统理化检测方法只能检测单一农药浓度不能反应混合农药综合毒性的不足,适用于预警水源地多种农药的混合污染。
MFC型生物毒性传感器在检测毒性污染物时,短期高浓度或长期低浓度染毒基本不改变阳极微生物菌群的组成,但电活性菌的相对丰度通常会降低[29-32]。XING等[29]发现,MFC型生物毒性传感器在检测高质量浓度Cu(II)(10 mg·L−1)、2,4-二氯苯酚(1 000 mg·L−1)或吡啶(1 000 mg·L−1)1次后,阳极微生物菌群组成基本无变化,电活性菌Geobacter、Azoarcus、Arcobacter和Desulfovibrio的相对丰度明显降低。长期低浓度染毒也有类似现象。例如,ZHOU等[32]用1.5 mmol·L−1呼吸链抑制剂叠氮化物使MFC阳极染毒13个月后,发现阳极微生物菌群结构未明显改变,优势菌仍为Geobacter和Ignavibacterium。长期高浓度染毒可改变阳极微生物菌群的结构。MFCs阳极经高质量浓度农药硝磺草酮(50 mg·L−1)、吡唑醚菌酯(30 mg·L−1)、乙氧氟草醚(50 mg·L−1)和异丙甲草胺(8 mg·L−1)染毒20~180 d后,阳极优势菌由电活性菌变为能够降解这些农药的微生物[33-36]。本研究中,MFC型生物毒性传感器阳极检测的农药质量浓度较低(<0.5 mg·L−1),染毒时间短(约50 min·d−1)且染毒后均在240 min内恢复。因此,可推测MFC型生物毒性传感器在检测这5种典型农药后,阳极微生物菌群的组成可能未发生变化,仅电活性菌相对丰度有所降低,经新鲜阳极液冲洗后可再生恢复。
传统生物传感器检测农药的原理归为2点:一是利用微生物的代谢作用,将农药作为底物检测;二是利用微生物的呼吸作用,将农药作为呼吸抑制剂检测[22,37]。利用MFC型生物毒性传感器检测农药时,阳极微生物的响应机制目前尚不清楚。在MFCs中,多种农药如六氯苯、涕滴伊、硝磺草酮、异丙甲草胺、吡唑醚菌酯、乙氧氟草醚和莠去津等已被证实可作为底物通过阳极微生物的共代谢作用降解[33-36,38-39]。这表明MFC型生物毒性传感器的阳极微生物可能通过代谢作用对农药产生响应。此外,农药种类多且不同农药产生生物毒性的机制不同,因此,MFC型生物毒性传感器的阳极微生物对不同农药的响应机制可能有所不同。KIM等[8]利用MFC型生物毒性传感器检测有机磷农药(二嗪磷)时,推测二嗪磷是通过抑制阳极微生物代谢过程中酯酶的磷酸化,直接引起响应。而CHOULER等[10]利用MFC型生物毒性传感器检测三嗪类除草剂(莠去津)时,推测莠去津被吸附在阳极表面,通过阻碍有机底物向阳极电活性菌的传质,间接引起响应。因此,MFC型生物毒性传感器的阳极微生物对这5种典型农药的具体响应机制有待后续进一步研究。
-
1) MFC型生物毒性传感器对5种典型农药具有明显的毒性响应且检测限较低,溴氰菊酯、百菌清、敌百虫、莠去津和烟嘧磺隆的质量浓度分别低至0.016、0.070、0.013、0.005和0.033 mg·L−1时即可使传感器的Ic达到10%。
2) MFC型生物毒性传感器检测这5种典型农药后,阳极微生物可快速恢复活性,输出电压恢复稳定的时间随农药浓度增加而延长,基本可在240 min内恢复。
3)以5种典型农药所配制的不同混合农药的生物毒性明显高于单一农药,包含这5种典型农药且浓度满足集中式生活饮用水源地水质标准的混合农药的Ic,可达(30.5±4.7)%。
微生物燃料电池型生物毒性传感器对5种典型农药的毒性检测
Detection of five typical agrichemicals using a microbial fuel cell-based biotoxicity sensor
-
摘要: 目前,微生物燃料电池(microbial fuel cell, MFC)型生物毒性传感器被广泛用于检测重金属、氰化物和抗生素等污染物,但将其应用于检测农药的研究极少。为此,探究了MFC型生物毒性传感器对溴氰菊酯、敌百虫、百菌清、莠去津和烟嘧磺隆5种典型农药的检测性能。实验结果表明:这5种典型农药的响应(产电抑制率)均与其浓度的对数呈良好的线性关系,且溴氰菊酯、敌百虫、百菌清、莠去津和烟嘧磺隆使MFC型生物毒性传感器产电抑制率达到10%的质量浓度分别低至0.016、0.070、0.013、0.005和0.033 mg·L−1;中毒后,MFC型生物毒性传感器的恢复时间随农药浓度的增加而延长,但240 min内均可快速恢复稳定;另外,这5种典型农药所配制的不同混合农药的生物毒性均高于单一农药。以上结果表明,MFC型生物毒性传感器对这5种典型农药的响应灵敏,检出限较低且中毒后恢复速度快,具有快速检测和预警水体农药污染的应用潜力。Abstract: At present, microbial fuel cell (MFC)-based biotoxicity sensors were widely attended to detect heavy metals, cyanide and antibiotics in water, while the detection of agrichemicals was rarely discussed. In this paper, five typical agrichemicals including deltamethrin, trichlorfon, chlorothalonil, atrazine, and nicosulfuron were detected using an MFC-based biotoxicity sensor. The results showed that the response (coulombic yield inhibition ratio) of each of these five agrichemicals was in a good linear relationship with the logarithm of its concentration. As low as 0.016 mg·L−1 deltamethrin, 0.070 mg·L−1 trichlorfon, 0.013 mg·L−1 chlorothrin, 0.005 mg·L−1 atrazine or 0.033 mg·L−1 nicotsulfuron could result in a coulombic yield inhibition ratio of 10% for MFC-based biotoxicity sensors. After the biotoxicity detection, the recovery time of MFC-based biotoxicity sensors increased with the increase of agrichemical concentrations, and stable voltage output could be achieved within 240 min for all tested concentrations of these five typical agrichemicals. In addition, compared with the single agrichemical, joint biotoxicities of different mixed agrichemicals prepared by the five typical agrichemicals were apparently higher. This study confirmed that MFC-based biotoxicity sensors possessed sensitive response, low detection limits to these five agrichemicals and robust recovery ability after being poisoned, thus providing an alternative and promising method for fast water quality monitoring and early warning of agrichemical pollutions in water.
-
Key words:
- microbial fuel cell /
- biosensor /
- biotoxicity /
- agrichemical /
- recovery time
-
-
[1] NÜßER L K, SKULOVICH O, HARTMANN S, et al. A sensitive biomarker for the detection of aquatic contamination based on behavioral assays using zebrafish larvae[J]. Ecotoxicology and Environmental Safety, 2016, 133: 271-280. doi: 10.1016/j.ecoenv.2016.07.033 [2] BAE M J, PARK Y S. Biological early warning system based on the responses of aquatic organisms to disturbances: A review[J]. Science of the Total Environment, 2014, 466: 635-649. [3] FARRÉ M, BRIX R, BARCELÓ D. Screening water for pollutants using biological techniques under European Union funding during the last 10 years[J]. TrAC Trends in Analytical Chemistry, 2005, 24(6): 532-545. doi: 10.1016/j.trac.2005.03.008 [4] ZHOU T, HAN H, LIU P, et al. Microbial fuels cell-based biosensor for toxicity detection: A review[J]. Sensors, 2017, 17(10): 2230. doi: 10.3390/s17102230 [5] 唐嘉丽, 凌宇祥, 于广平, 等. 空气阴极微生物燃料电池的构型优化及其快速测定BOD的性能评价[J]. 环境工程学报, 2021, 15(6): 2155-2164. [6] JIANG Y, YANG X, LIANG P, et al. Microbial fuel cell sensors for water quality early warning systems: Fundamentals, signal resolution, optimization and future challenges[J]. Renewable and Sustainable Energy Reviews, 2018, 81: 292-305. doi: 10.1016/j.rser.2017.06.099 [7] 高艳梅, 海热提, 王晓慧, 等. 双室微生物燃料电池重金属毒性传感器的研制[J]. 环境工程学报, 2017, 11(10): 5400-5408. [8] KIM M, HYUN M S, GADD G M, et al. A novel biomonitoring system using microbial fuel cells[J]. Journal of Environmental Monitoring, 2007, 9(12): 1323-1328. doi: 10.1039/b713114c [9] 王博, 王红晓. 水质生物毒性预警系统建设及在海宁市饮用水源保护中的应用[J]. 环境监控与预警, 2012, 4(5): 10-13. doi: 10.3969/j.issn.1674-6732.2012.05.003 [10] CHOULER J, DI LORENZO M. Pesticide detection by a miniature microbial fuel cell under controlled operational disturbances[J]. Water Science and Technology, 2019, 79(12): 2231-2241. doi: 10.2166/wst.2019.207 [11] GODOY A A, KUMMROW F. What do we know about the ecotoxicology of pharmaceutical and personal care product mixtures? A critical review[J]. Critical Reviews in Environmental Science and Technology, 2017, 47(16): 1453-1496. doi: 10.1080/10643389.2017.1370991 [12] JIANG Y, LIANG P, ZHANG C, et al. Enhancing the response of microbial fuel cell based toxicity sensors to Cu(II) with the applying of flow-through electrodes and controlled anode potentials[J]. Bioresource Technology, 2015, 190: 367-372. doi: 10.1016/j.biortech.2015.04.127 [13] STEIN N E, HAMELERS H V M, BUISMAN C N J. The effect of different control mechanisms on the sensitivity and recovery time of a microbial fuel cell based biosensor[J]. Sensors and Actuators B:Chemical, 2012, 171: 816-821. [14] JIANG Y, LIANG P, LIU P, et al. Enhancing signal output and avoiding BOD/toxicity combined shock interference by operating a microbial fuel cell sensor with an optimized background concentration of organic matter[J]. International Journal of Molecular Sciences, 2016, 17(9): 1392. doi: 10.3390/ijms17091392 [15] 地表水环境质量标准: GB 3838-2002[S]. 北京: 中国标准出版社, 2002. [16] 严浩, 黄岁樑. 海河悬浮颗粒物影响阿特拉津对斑马鱼的急性毒性研究[J]. 环境科学学报, 2015, 35(1): 302-310. [17] 陈亮, 沈燕, 孙如意, 等. 5%烟嘧磺隆·21%莠去津可分散油悬浮剂对2种水生生物的毒性研究[J]. 安徽农学通报, 2016, 22(17): 34-36. doi: 10.3969/j.issn.1007-7731.2016.17.014 [18] BAO V W W, LEUNG K M Y, QIU J W, et al. Acute toxicities of five commonly used antifouling booster biocides to selected subtropical and cosmopolitan marine species[J]. Marine Pollution Bulletin, 2011, 62(5): 1147-1151. doi: 10.1016/j.marpolbul.2011.02.041 [19] 张建江, 陈平, 田华, 等. 土壤中3种典型有毒污染物对发光细菌的毒性测试[J]. 环境科学与技术, 2014, 37(9): 15-18. [20] 贾玉玲, 蔡强, 彭惠民, 等. 乙酰胆碱酯酶和发光菌检测有机磷农药毒性研究[J]. 环境科学, 2011, 32(6): 1820-1824. [21] HERNANDO M D, DE VETTORI S, BUENO M J M, et al. Toxicity evaluation with Vibrio fischeri test of organic chemicals used in aquaculture[J]. Chemosphere, 2007, 68(4): 724-730. doi: 10.1016/j.chemosphere.2006.12.097 [22] PASCO N F, WELD R J, HAY J M, et al. Development and applications of whole cell biosensors for ecotoxicity testing[J]. Analytical and Bioanalytical Chemistry, 2011, 400(4): 931-945. doi: 10.1007/s00216-011-4663-6 [23] LI F, ZHENG Z, YANG B, et al. A laminar-flow based microfluidic microbial three-electrode cell for biosensing[J]. Electrochimica Acta, 2016, 199: 45-50. doi: 10.1016/j.electacta.2016.03.138 [24] DAVILA D, ESQUIVEL J P, SABATE N, et al. Silicon-based microfabricated microbial fuel cell toxicity sensor[J]. Biosensors and Bioelectronics, 2011, 26(5): 2426-2430. doi: 10.1016/j.bios.2010.10.025 [25] HASSAN S A, ALBERT R, BIGLER F, et al. Results of the third joint pesticide testing programme by the IOBC/WPRS-Working Group “Pesticides and Beneficial Organisms”[J]. Journal of Applied Entomology, 1987, 103(1/2/3/4/5): 92-107. [26] 朱蕙香, 刘瑞芹. 敌百虫与马拉硫磷、敌百虫与滴滴涕的联合毒性[J]. 农药工业, 1979(3): 53-54. [27] LEBOULANGER C, RIMET F, DE LACOTTE M H, et al. Effects of atrazine and nicosulfuron on freshwater microalgae[J]. Environment International, 2001, 26(3): 131-135. doi: 10.1016/S0160-4120(00)00100-8 [28] ANDERSON T D, LYDY M J. Increased toxicity to invertebrates associated with a mixture of atrazine and organophosphate insecticides[J]. Environmental Toxicology and Chemistry, 2002, 21(7): 1507-1514. doi: 10.1002/etc.5620210724 [29] XING F, XI H, YU Y, et al. A sensitive, wide-ranging comprehensive toxicity indicator based on microbial fuel cell[J]. Science of the Total Environment, 2020, 703: 134667. doi: 10.1016/j.scitotenv.2019.134667 [30] YI Y, XIE B, ZHAO T, et al. Effect of external resistance on the sensitivity of microbial fuel cell biosensor for detection of different types of pollutants[J]. Bioelectrochemistry, 2019, 125: 71-78. doi: 10.1016/j.bioelechem.2018.09.003 [31] WU L C, WANG G H, TSAI T H, et al. Three-stage single-chambered microbial fuel cell biosensor inoculated with exiguobacterium aestuarii YC211 for continuous chromium (VI) measurement[J]. Sensors, 2019, 19(6): 1418. doi: 10.3390/s19061418 [32] ZHOU X, QU Y, KIM B H, et al. Effects of azide on current generation and microbial community in air-cathode MFCs[J]. RSC advances, 2015, 5(19): 14235-14241. doi: 10.1039/C4RA13345E [33] ZHAO H, ZHANG Q. Performance of electro-Fenton process coupling with microbial fuel cell for simultaneous removal of herbicide mesotrione[J]. Bioresource Technology, 2021, 319: 124244. doi: 10.1016/j.biortech.2020.124244 [34] LI X, ZHANG X, ZHAO X, et al. Efficient removal of metolachlor and bacterial community of biofilm in bioelectrochemical reactors[J]. Applied Biochemistry and Biotechnology, 2019, 189(2): 384-395. doi: 10.1007/s12010-019-03014-0 [35] ZHAO H, KONG C H. Elimination of pyraclostrobin by simultaneous microbial degradation coupled with the Fenton process in microbial fuel cells and the microbial community[J]. Bioresource Technology, 2018, 258: 227-233. doi: 10.1016/j.biortech.2018.03.012 [36] ZHANG Q, ZHANG L, WANG H, et al. Simultaneous efficient removal of oxyfluorfen with electricity generation in a microbial fuel cell and its microbial community analysis[J]. Bioresource Technology, 2018, 250: 658-665. doi: 10.1016/j.biortech.2017.11.091 [37] PLEKHANOVA Y V, RESHETILOV A N. Microbial biosensors for the determination of pesticides[J]. Journal of Analytical Chemistry, 2019, 74(12): 1159-1173. doi: 10.1134/S1061934819120098 [38] BORELLO D, GAGLIARDI G, AIMOLA G, et al. Use of microbial fuel cells for soil remediation: A preliminary study on DDE[J]. International Journal of Hydrogen Energy, 2021, 46(16): 10131-10142. doi: 10.1016/j.ijhydene.2020.07.074 [39] WANG H, YI S, CAO X, et al. Reductive dechlorination of hexachlorobenzene subjected to several conditions in a bioelectrochemical system[J]. Ecotoxicology and Environmental Safety, 2017, 139: 172-178. doi: 10.1016/j.ecoenv.2017.01.039 -






 下载:
下载: