-
苯甲酸是常见的难降解工业废水组分之一,也是苯系物及木质纤维素类废弃物厌氧代谢过程中的重要中间产物。芳香族化合物需要经苯甲酸和苯甲酰辅酶A通过β氧化,形成乙酸、H2和CO2[1-3]。在厌氧产甲烷的过程中,苯甲酸降解为乙酸的反应是与产甲烷菌利用乙酸和氢气的互营产甲烷反应相结合而进行的。有学者发现,厌氧微生物互营降解苯甲酸与有机酸的产甲烷过程中存在种间直接电子传递(direct interspecies electron transfer,DIET)过程[4-5]。LOVELY等[6-7]最早发现了种间直接电子传递的机制,即厌氧沉积物中的微生物在进行有机质氧化的过程中会释放电子到胞外,以Fe(Ⅲ)为电子受体,并可产生超细粒磁铁矿。纳米Fe3O4(nanoparticles,Fe3O4 NPs)是一种性能稳定、无毒、导电性强、制备简单且生物相容性较好的磁性材料[8]。添加Fe3O4 NPs等可促进废水、废弃物产甲烷的过程[8-10]。目前,关于这类导电材料用于强化有机酸互营产甲烷菌群的DIET过程的研究较多。已确认能进行DIET的微生物主要有地杆菌(Geobacter)和希瓦氏菌(Shewanella)[10]。通常,Geobacter被认为是厌氧消化体系能发生DIET的标志微生物,但Geobacter的存在并不是发生DIET的必要条件。这是由于导电物质可富集某些具有胞外电子转移能力的微生物,实现厌氧消化体系主要电子转移方式的改变[11]。有研究表明,Desulfuromonas、Pseudomonas等电活性微生物可能也具有进行DIET的能力[12-13]。因此,需要进一步探究地杆菌以外微生物的DIET能力及作用机制,并优化导电材料强化厌氧消化产甲烷的工艺,以促进有机废水和废弃物的资源化处理。
研究苯甲酸的微生物降解过程,对于提高芳香族类污染物的降解效率有重要意义。关于铁氧化物对苯甲酸降解影响的研究表明,铁基材料可促进苯甲酸的降解。例如,ZHUANG等[14]以水稻土为接种物,发现纳米磁铁矿(1.93 g·L−1)和赤铁矿(2 g·L−1)使苯甲酸的降解率分别提高了53%和25%,促进了芽孢杆菌Bacillaceae与产甲烷菌Methanobacterium之间的直接电子传递。AROMOKEYE等[15]以海洋沉积物的富集培养物为实验对象,研究了磁铁矿和纤铁矿对苯甲酸降解的影响后发现:添加磁铁矿(6.96 g·L−1)或赤铁矿(4.8 g·L−1)可加速苯甲酸的降解和促进甲烷生成,使苯甲酸降解速率提高22.55%;而纤铁矿抑制了苯甲酸降解和甲烷生成,使苯甲酸降解速率降低45.10%~56.37%;添加磁铁矿的体系中苯甲酸厌氧降解菌Sporotomaculum作为主要微生物(占细菌的53%~62%),而添加纤铁矿的体系中主要微生物为脱硫肠状菌Desulfotomaculum(占细菌的20%~37%)。马金莲[16]以底泥沉积物为接种物,发现添加Fe3O4 NPs(1.55 g·L−1)和Fe2O3(1.6 g·L−1)可提升硫酸盐还原条件下的苯甲酸降解速率。YAN等[17]以中温苯酚与葡萄糖人工合成废水厌氧处理污泥为接种物,通过批次实验发现:纳米磁铁矿提高了苯酚的厌氧降解速度,增强了苯酚厌氧降解菌Syntrophorhabdus和苯甲酸厌氧降解菌Syntrophus的富集及互营代谢过程。
苯甲酸厌氧降解菌作为互营微生物,其生长十分缓慢,难以分离培养[18]。文献报道过的这类降解菌有8种,主要分布在厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)[18-19]。Sporotomaculum syntrophicum(后简称S. syntrophicum)是厚壁菌门的一种可产生孢子的细菌,具有苯甲酸降解速度快、耐受性强的特性,当其与产甲烷菌共培养时可将苯甲酸转化为甲烷[20]。本研究以S. syntrophicum与产甲烷菌Methanospirillum hungatei(后简称M. hungatei)的共培养体系为研究对象,研究添加纳米Fe3O4和Fe2O3对苯甲酸厌氧降解过程的影响,以期为铁基纳米材料强化苯甲酸污染物的去除提供参考。
-
实验中使用的纯菌种S. syntrophicum(DSM 14795)和M. hungatei(DSM 864)的共生培养体系由本实验室之前的研究[20]培养获得。S. syntrophicum属于厚壁菌门的厌氧苯甲酸互营降解菌,分离自对苯二甲酸产生废水的厌氧污泥。将其与氢营养产甲烷菌M. hungatei共培养后,可将苯甲酸转化为乙酸、二氧化碳和甲烷,并产生少量丁酸。
培养基采用widdel培养基[21]。以氮气和二氧化碳混合气体(体积比为4∶1)置换培养基及瓶中气体,用丁基橡胶塞和铝盖密封,高温(121℃)下蒸汽灭菌20 min。灭菌后加入半胱氨酸和硫化钠。采用5 mmol·L−1苯甲酸和0.01%酵母提取物作为底物进行S. syntrophicum和M. hungatei的共培养,于内部温度为37 ℃的黑暗培养箱中静置培养。
Fe3O4和Fe2O3纳米颗粒购买于阿拉丁化学试剂有限公司,分别表示为Fe3O4 NPs和Fe2O3 NPs。Fe3O4 NPs粒径大小为20 nm,纯度为99%,形状为球形颗粒,颜色呈黑色。Fe2O3 NPs粒径大小为30 nm,纯度为99.5%,形状为球形颗粒,颜色呈红棕色。
-
在有效体积为35 mL的厌氧管中,加入15 mL培养基。在培养基中分别加入质量浓度为10、20、50、100、200、300、400、500 mg·L−1(低浓度系列)及600、800、1 000 mg·L−1(高浓度系列)的2种铁基纳米颗粒,每个梯度设置3组平行。初始苯甲酸浓度为5 mmol·L−1。酵母提取物(0.01%)为生长因子。在培养基配制过程中添加2种纳米颗粒,然后置换培养基中的气体,用丁基橡胶塞和铝盖密封。按照体积分数为25%的比例接种S. syntrophicum与M. hungatei的共生培养系,于37℃恒温培养箱中静置培养。实验周期为30 d,每3 d取1次样,测定甲烷、苯甲酸及乙酸浓度。
-
甲烷用SP-7802型气相色谱法热导检测器(TCD)测定。取发酵液液体0.5 mL,以13 000 r·min−1的转速离心5 min,取离心后上清液,使用SP-7820气相色谱仪测定苯甲酸和乙酸浓度。色谱条件如文献[22]所述。
-
苯甲酸、甲烷及乙酸数据以(平均值±标准偏差)表示,并用SPSS.22软件对数据进行单因素方差分析,p<0.05作为分析标准。
-
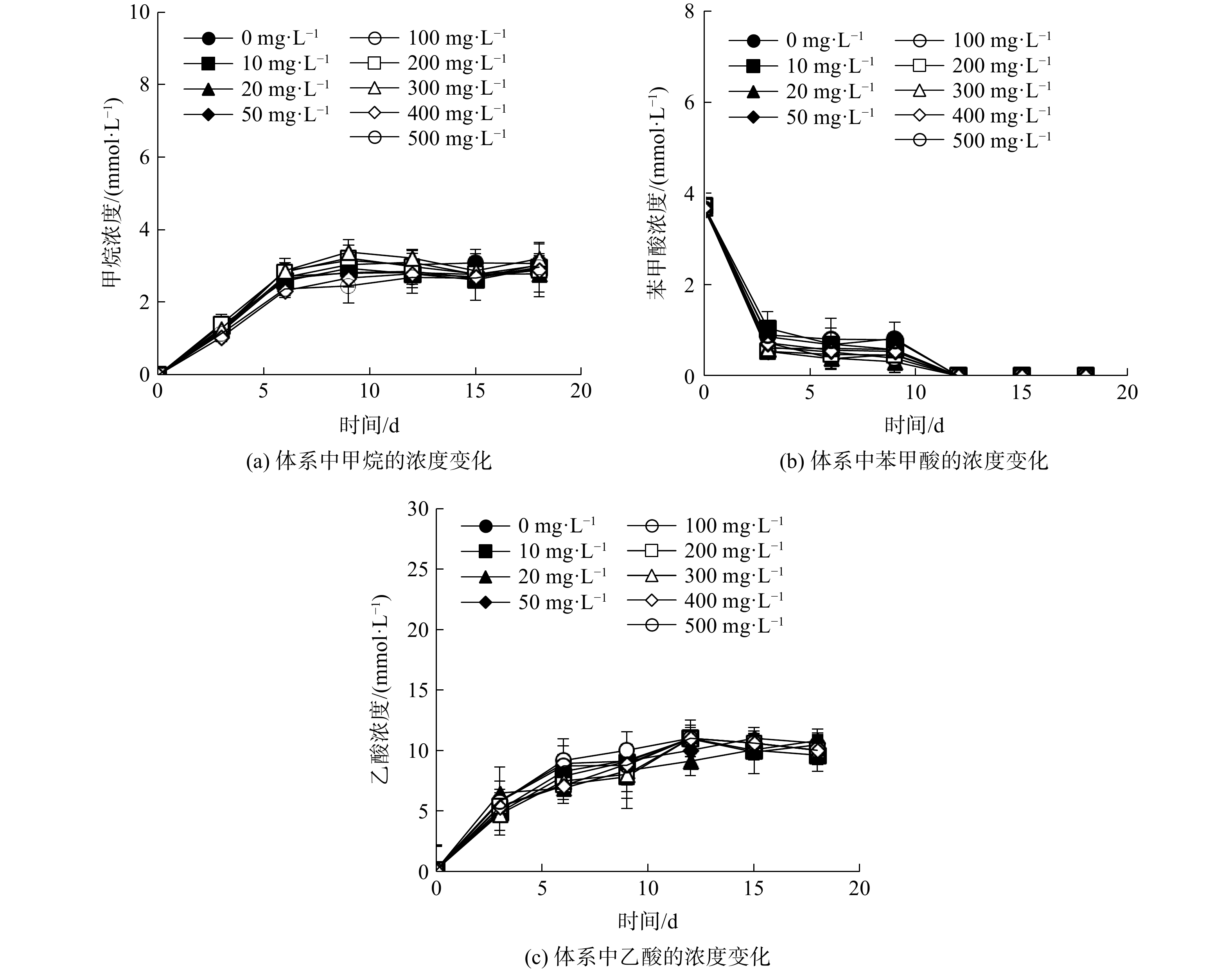
为研究Fe3O4 NPs的质量浓度对S. syntrophicum厌氧降解苯甲酸产甲烷的影响,采用批式实验进行低浓度组(其质量浓度分别为10、20、50、100、200、300、400、500 mg·L−1)的实验(结果如图1所示)。产甲烷过程中甲烷浓度变化如图1(a)所示,添加8个质量浓度梯度10~500 mg·L−1 Fe3O4 NPs对甲烷产量没有明显促进或抑制作用,累计产生甲烷浓度为2.88~3.38 mmol·L−1,与未添加空白对照组(甲烷浓度3.15 mmol·L−1)相差不大。在实验的前6 d,所有体系中甲烷浓度均呈现快速增长趋势,添加组和空白对照组的启动时间基本一致。启动后6~18 d,所有体系中甲烷浓度的变化趋势基本一致,均呈现为先增加后趋于平缓的变化趋势,说明产甲烷速率没有差别。在实验终点,所有体系中的甲烷浓度均达到理论值,约3 mmol·L−1,符合苯甲酸降解的量论关系式[20](式(1))。对照组和实验组的甲烷产量没有明显差别,不存在显著差异(p>0.05)。
苯甲酸厌氧降解过程如图1(b)所示,添加10~500 mg·L−1 Fe3O4 NPs的实验组和对照组,苯甲酸均呈现先快速降解后缓慢降解的变化趋势,最终在12 d前后实现完全降解。所有体系中苯甲酸的降解速度一样,说明添加Fe3O4 NPs对苯甲酸的厌氧降解速度没有明显影响。体系中的产乙酸过程如图1(c)所示,苯甲酸降解过程中累积的乙酸浓度达到约11 mmol·L−1,也符合苯甲酸降解的量论关系式。综上所述,10~500 mg·L−1 Fe3O4 NPs对S. syntrophicum与产甲烷菌M. hungatei的苯甲酸厌氧降解、甲烷产量和产乙酸过程均没有明显的促进或抑制作用。
-
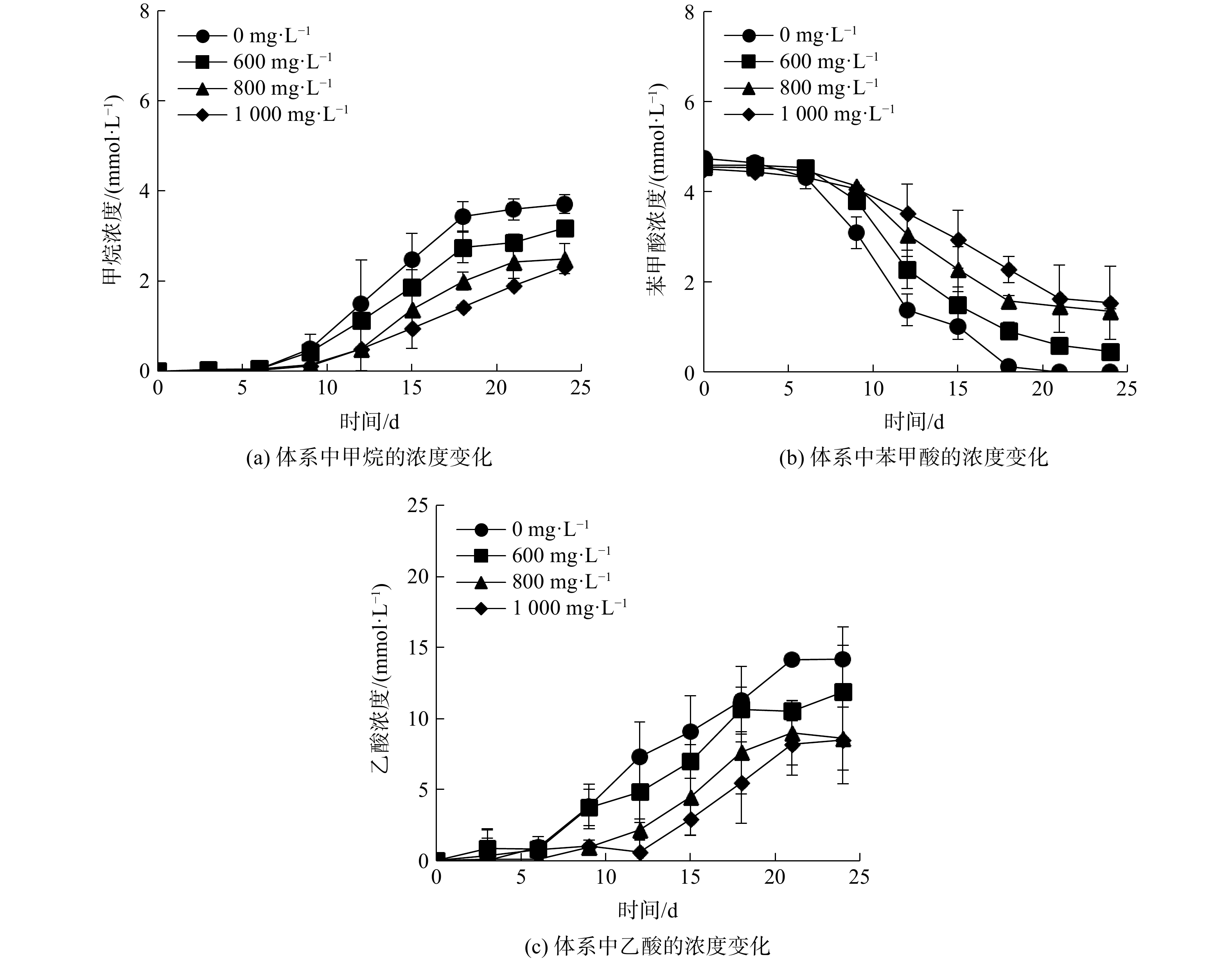
进一步研究了高浓度(600、800、1 000 mg·L−1)Fe3O4 NPs对苯甲酸厌氧降解的影响,产甲烷过程如图2(a)所示,高浓度 Fe3O4 NPs对甲烷产量有明显抑制作用。实验启动6 d后,进入快速产甲烷阶段,甲烷浓度均呈现先快速增长后趋于平缓的变化趋势。未添加Fe3O4 NPs的对照组的产甲烷速率明显高于Fe3O4 NPs添加体系。在20 d左右,最终甲烷累计产生浓度达3.78 mmol·L−1。第15天为所有体系生长最快的一天,对照组和实验组的甲烷产量差别较大,存在显著性差异(p<0.05)。此时,对照组的甲烷浓度达到2.47 mmol·L−1,而添加高浓度Fe3O4 NPs(600、800、1 000 mg·L−1)的体系中,产甲烷浓度分别减少了24.29%,44.13%和61.54%。
体系中苯甲酸的厌氧降解过程如图2(b)所示,添加高浓度Fe3O4 NPs(600、800、1 000 mg·L−1)对苯甲酸降解具有明显的抑制作用。未添加Fe3O4 NPs的对照组,启动6 d后苯甲酸呈现先快速降解后缓慢降解的变化趋势,最终在24 d左右完全降解。添加高浓度Fe3O4 NPs(600、800和1 000 mg·L−1 )的实验组,在启动0~15 d,苯甲酸降解速率分别下降了16.53%、39.11%和58.06%。体系中产乙酸的过程如图2(c)所示,添加高浓度Fe3O4 NPs(600、800、1 000 mg·L−1)对乙酸的累积具有明显抑制作用。未添加Fe3O4 NPs的对照组中累积乙酸的浓度最终达到14 mmol·L−1左右,符合苯甲酸降解的量论关系式。添加600、800和1 000 mg·L−1纳米Fe3O4的实验组,启动15 d后累积的乙酸浓度分别减少了23.15%,50.83%和67.81%。
综上所述,添加高浓度Fe3O4 NPs对S. syntrophicum与M. hungatei厌氧降解苯甲酸的产甲烷和产乙酸过程具有明显的抑制作用。抑制效果随Fe3O4 NPs浓度增大而增强,添加浓度为1 000 mg·L−1的Fe3O4 NPs时抑制作用最强,产甲烷量比对照组减少了61.54%。高浓度Fe3O4 NPs表现出的抑制作用可能是由于Fe3O4NPs具有磁性,磁铁矿的存在会使微生物表面团聚现象增强,包围在微生物周围的铁氧化物颗粒层阻碍了互营菌间的代谢,产生了不良影响[8-9]。
-
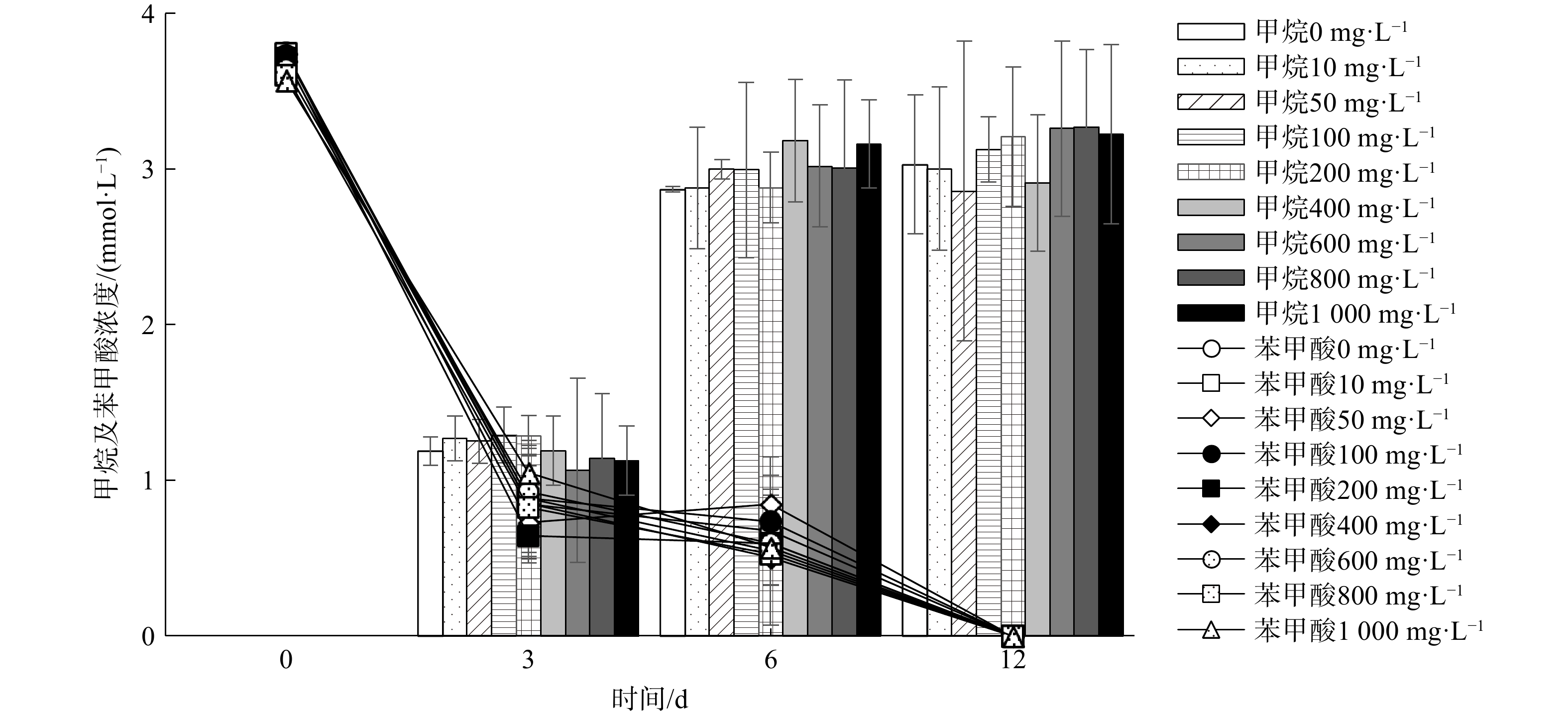
添加不同质量浓度(10~1 000 mg·L−1 )的 Fe2O3NPs对S. syntrophicum与产甲烷菌M. hungatei厌氧降解苯甲酸产甲烷的影响如图3所示。Fe2O3 NPs对甲烷产量并没有明显的促进或抑制作用。在实验的第3天,所有体系均开始产甲烷,添加组和空白对照组的启动时间基本一致。启动的前12 d,添加不同质量浓度Fe2O3 NPs累计产生的甲烷浓度为2.86~3.27 mmol·L−1,与未添加空白对照组(3.03 mmol·L−1)相差不大,所有反应体系内累积产甲烷浓度均达到理论值。在第12天,对照组和实验组的甲烷产量没有明显差别,不存在显著差异(p>0.05),苯甲酸厌氧降解的趋势基本保持一致。在未添加Fe2O3 NPs的对照组和添加Fe2O3 NPs(质量浓度为10~1 000 mg·L−1)的实验组中,苯甲酸均在第12 天被完全降解。因此,添加Fe2O3 NPs(质量浓度为10~1 000 mg·L−1)对所有S. syntrophicum与产甲烷菌M. hungatei共培养体系的甲烷产量及苯甲酸降解速率均不存在明显的促进或抑制作用。
-
有学者以水稻土[14]、海洋沉积物[15]、污泥[17]等作为接种物,采用复合菌群研究了铁基纳米材料对苯甲酸厌氧消化产甲烷过程的影响,但并未研究具体的苯甲酸厌氧降解菌。本研究以S. syntrophicum和M. hungatei的互营共培养纯菌体系为研究对象,探究了质量浓度为10~1 000 mg·L−1的Fe3O4 NPs和Fe2O3 NPs对苯甲酸厌氧降解的影响。表1反映了添加外源导电铁材料对苯酚及苯甲酸的厌氧消化产甲烷过程中DIET及主要菌群的影响。
有关文献[14-15,17]报道的研究中,其接种物主要为复合菌群,以考查导电材料苯酚和苯甲酸降解过程的影响。添加不同的导电材料使体系的某些菌群发生变化,苯甲酸厌氧互营降解菌Syntrophus和Sporotomaculum可能参与了苯甲酸互营产甲烷的DIET过程[14-15]。纳米磁铁矿提高了苯酚的厌氧降解速度,增强了苯酚厌氧降解菌Syntrophorhabdus和苯甲酸厌氧互营降解菌Syntrophus的富集,磁铁矿添加组中以苯酚厌氧互营降解菌Syntrophorhabdus为主,其丰度是对照组的2.3倍,这种增强作用涉及到DIET过程[17]。本研究同AROMOKEYE等[15]发现的主要菌群均为Sporotomaculum属,但降解效果不同。AROMOKEYE等[15]发现,添加磁铁矿能加速苯甲酸降解和甲烷生成;而本研究发现,Fe2O3 NPs及低浓度Fe3O4 NPs对苯甲酸降解并没有作用,高浓度(600~1 000 mg·L−1)Fe3O4 NPs对苯甲酸的降解具有一定抑制效果。造成这一现象的原因在于苯甲酸厌氧降解菌与产甲烷菌的种类差异。本研究采用S. syntrophicum的纯菌和M. hungatei的互营共培养体系;而AROMOKEYE等[15]则是以复合菌系为研究对象,主要微生物为Sporotomaculum和Methanosarcina近缘微生物。由于沉积物中微生物的种类繁多,高通量测序技术并不能明确鉴定功能菌种就是S. syntrophicum。
-
1)以S. syntrophicum与产甲烷菌M. hungatei构建的互营共培养体系为研究对象,分别添加质量浓度为10~500 mg·L−1 的Fe3O4 NPs和质量浓度为10~1 000 mg·L−1 的Fe2O3 NPs对苯甲酸厌氧降解均无抑制或促进作用。
2)质量浓度为600~1 000 mg·L−1 的Fe3O4 NPs对苯甲酸厌氧降解过程具有一定的抑制作用,且抑制效果随Fe3O4 NPs浓度增大而增强。高浓度Fe3O4 NPs具有磁性,会使微生物表面团聚现象增强,阻碍互营菌间的代谢,产生不良影响。
3)质量浓度为10~1 000 mg·L−1 的Fe3O4 NPs和Fe2O3 NPs均不能促进S. syntrophicum与M. hungatei共培养体系的种间电子传递过程。导电材料参与互营产甲烷的DIET过程与苯甲酸厌氧降解菌与产甲烷菌的种类有关。纯菌互营厌氧降解苯甲酸的体系与复合菌群互营的体系存在差异。
铁基纳米材料对苯甲酸降解菌Sporotomaculum syntrophicum与产甲烷菌Methanospirillum hungatei的厌氧互营体系降解苯甲酸的影响
Effect of iron -based nanomaterials on anaerobic benzoate degradation by syntrophic co-culture of Sporotomaculum syntrophicum and Methanospirillum hungatei
-
摘要: 为探究铁基纳米材料在苯甲酸厌氧互营代谢过程中的作用,以厚壁菌门的厌氧互营苯甲酸降解菌Sporotomaculum syntrophicum与产甲烷菌Methanospirillum hungatei的共培养体系为研究对象,考察投加铁基纳米颗粒四氧化三铁(Fe3O4 NPs)和三氧化二铁(Fe2O3 NPs)对苯甲酸厌氧降解转化甲烷的影响。结果表明:10~500 mg·L−1的Fe3O4纳米颗粒对苯甲酸降解速率及产甲烷量没有显著影响;而高浓度的Fe3O4纳米颗粒对苯甲酸降解及产甲烷速率产生了明显的抑制作用,当添加Fe3O4纳米颗粒的质量浓度为600、800、1 000 mg·L−1时,第15天的产甲烷量分别减少了24.29%、44.13%和61.54%。低浓度和高浓度的Fe2O3纳米颗粒对苯甲酸的降解及甲烷的产生均无影响。质量浓度为10~1 000 mg·L−1 的Fe3O4 NPs和Fe2O3 NPs均不能促进S. syntrophicum与M. hungatei共培养体系的种间电子传递过程。本研究结果可为导电材料强化厌氧纯菌降解苯甲酸,以及利用导电材料强化苯甲酸废水及木质纤维素类固体废弃物的处理提供参考。Abstract: To unveil the role of iron-based nanomaterials in syntrophic anaerobic degradation of benzoate, ferric oxide nanoparticles Fe3O4 NPs and Fe2O3 NPs were added to the syntrophic co-culture of Sporotomaculum syntrophicum (belonging to Firmicutes) and Methanospirillum hungatei and their effects were investigated. The results showed that adding Fe3O4 NPs at low concentration (10~500 mg·L-1) did not significantly impact the benzoate degradation rate and methane production. However, high dosage of Fe3O4 NPs revealed serious inhibition. At Fe3O4 NPs dosages of 600, 800 and 1 000 mg·L-1, the methane production was reduced by 24.29%, 44.13% and 61.54%, respectively on day 15. Neither low nor high dosages of Fe2O3 NPs (10~1 000 mg·L-1) influenced benzoate degradation and methane production or was able to promote the interspecies electron transfer in S. syntrophicum and M. hungatei co-culture. This study can provide a reference for enhancing anaerobic degradation of benzoate with pure culture, as well as for treating benzoate wastewater and lignocellulosic solid wastes with conductive materials.
-
表 1 导电材料对苯酚和苯甲酸厌氧降解的影响
Table 1. Effect of conductive materials on anaerobic phenol and benzoate degradation
反应体系 芳香族化合物的种类 芳香族化合物的浓度/(mmol·L−1) 互营厌氧菌 产甲烷菌 导电材料种类 导电材料的质量浓度/(g·L−1) 对底物降解率的影响 苯酚废水厌氧处理污泥[17] 苯酚 10.64 Syntrophorhabdus, Syntrophus Methanosaeta 纳米磁铁矿 5.44 提高100% 水稻土[14] 苯甲酸 8.6 Bacillaceae, Peptococcaceae Methanobacterium 赤铁矿 2 提高25% 纳米磁铁矿 1.93 提高53% 苯甲酸驯化体系[15] 苯甲酸 5 Sporotomaculum Methanobacterium 磁铁矿 6.96 提高约22.55% Desulfotomaculum Methanosarcina, Methanoculleus, Methanosaeta 纤铁矿 4.8 降低45.10%~56.37% 互营共培养体系 苯甲酸 5 S. syntrophicum Methanosarcina, Methanoculleus, Methanosaeta Fe3O4 NPs 0.01~1 0.01~0.5 g·L−1无影响;1 g·L−1,抑制61% Fe2O3 NPs 0.01~1 无影响 注:互营共培养体系指的本研究的结果。 -
[1] LEVEN L, NYBERG K, SCHNURER A. Conversion of phenols during anaerobic digestion of organic solid waste: A review of important microorganisms and impact of temperature[J]. Journal of Environmental Management, 2012, 95(1): S99-S103. [2] 张晓云, 盖忠辉, 台萃, 等. 微生物降解苯甲酸的研究进展[J]. 微生物学通报, 2012, 39(12): 1808-1816. [3] FANG H, LIU Y, KE S Z, et al. Anaerobic degradation of phenol in wastewater at ambient temperature[J]. Water Science and Technology, 2004, 49(1): 95-102. doi: 10.2166/wst.2004.0028 [4] ROTARU A E, SHRESTHA P M, LIU F, et al. A new model for electron flow during anaerobic digestion: Direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J]. Energy & Environmental Science, 2014, 7(1): 408-415. [5] LI H, CHANG J, LIU P, et al. Direct interspecies electron transfer accelerates syntrophic oxidation of butyrate in paddy soil enrichments[J]. Environmental Microbiology, 2014, 17(5): 1533-1547. [6] LOVLEY D R, PHILLIPS E J P. Availability of ferric iron for microbial reduction in bottom sediments of the freshwater tidal Potomac River[J]. Applied and Environmental Microbiology, 1986, 52(4): 751-757. doi: 10.1128/aem.52.4.751-757.1986 [7] LOVLEY D R, STOLZ J F, NORD G L, et al. Anaerobic production of magnetite by a dissimilatory iron-reducing microorganism[J]. Nature, 1987, 330(6145): 252-254. doi: 10.1038/330252a0 [8] 郭红红, 牧辉, 张晓东, 等. 纳米四氧化三铁对甲烷生物合成途径的影响[J]. 可再生能源, 2018, 36(9): 1271-1277. doi: 10.3969/j.issn.1671-5292.2018.09.002 [9] 钱风越. Fe3O4纳米颗粒对厌氧消化产甲烷过程的影响研究 [D]. 哈尔滨: 哈尔滨工业大学, 2015. [10] 张杰, 陆雅海. 互营氧化产甲烷微生物种间电子传递研究进展[J]. 微生物学通报, 2015, 42(5): 920-927. [11] 黄玲艳, 刘星, 周顺桂. 微生物直接种间电子传递: 机制及应用[J]. 土壤学报, 2018, 55(6): 1313-1324. [12] 靖宪月, 陈姗姗, 周顺桂. 吸收胞外电子的电活性微生物[J]. 微生物学报, 2018, 58(1): 19-27. [13] MARUTHUPANDY M, ANAND M, MADURAIVEERAN G, et al. Electrical conductivity measurements of bacterial nanowires from Pseudomonas aeruginosa[J]. Advances in Natural Sciences-Nanoscience and Nanotechnology, 2015, 6(4): 045007. doi: 10.1088/2043-6262/6/4/045007 [14] ZHUANG L, TANG J, WANG Y Q, et al. Conductive iron oxide minerals accelerate syntrophic cooperation in methanogenic benzoate degradation[J]. Journal of Hazardous Materials, 2015, 293: 37-45. doi: 10.1016/j.jhazmat.2015.03.039 [15] AROMOKEYE D A, ONI O E, TEBBEN J, et al. Crystalline iron oxides stimulate methanogenic benzoate degradation in marine sediment-derived enrichment cultures[J]. The ISME Journal, 2020, 15(4): 965-980. [16] 马金莲. 磁铁矿促进有机质厌氧降解过程及微生物机制初探[D]. 北京: 中国科学院研究生院, 2016. [17] YAN W, SUN F, LIU J, et al. Enhanced anaerobic phenol degradation by conductive materials via EPS and microbial community alteration[J]. Chemical Engineering Journal, 2018, 352: 1-9. doi: 10.1016/j.cej.2018.06.187 [18] 张雪, 张辉, 承磊. 获取有机物厌氧降解产甲烷过程中关键功能类群-互营细菌培养物[J]. 微生物学报, 2019, 59(2): 211-223. [19] PLUGGE C M, BALK M, STAMS A. Desulfotomaculum thermobenzoicum subsp. thermosyntrophicum subsp. nov., a thermophilic, syntrophic, propionate-oxidizing, spore-forming bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(2): 391-399. doi: 10.1099/00207713-52-2-391 [20] QIU Y L, SEKIGUCHI Y, IMACHI H, et al. Sporotomaculum syntrophicum sp. nov., a novel anaerobic, syntrophic benzoate-degrading bacterium isolated from methanogenic sludge treating wastewater from terephthalate manufacturing[J]. Archives of Microbiology, 2003, 179: 242-249. doi: 10.1007/s00203-003-0521-z [21] SEKIGUCHI Y, KAMAGATA Y, NAKAMURA K, et al. Syntrophothermus lipocalidus gen. nov., sp. nov., a novel thermophilic, syntrophic, fatty-acid-oxidizing anaerobe which utilizes isobutyrate[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50: 771-779. doi: 10.1099/00207713-50-2-771 [22] 谢彤彤, 吴凯旋, 迟明妹, 等. 酒糟厌氧消化液中丙酸互营降解菌的富集培养与群落解析[J]. 应用与环境生物学报, 2020, 26(6): 1406-1410. -






 下载:
下载: