-
有机废水具有色度高、毒性强和难处理等特点,可导致严重的环境污染问题[1-4]。在有机废水的处理技术中,高级氧化技术(AOPs)能够产生强氧化性羟基自由基∙OH(E0=2.80 V vs. SHE) [5],可有效降解和矿化各种有机污染物,因而备受青睐[6]。其中,电芬顿技术凭借其环境清洁、避免H2O2药剂投加以及易于实现自动化控制等优点,在AOPs中脱颖而出,被广泛研究[7-8]。
电芬顿过程主要包含2个阶段:H2O2的产生和活化阶段[8]。H2O2的产生主要利用O2的2电子还原反应[9](式(1));而H2O2活化则是依靠Fe2+、Fe2O3等芬顿/类芬顿催化剂,激发生成∙OH [7,10](式(2)~式(3))。在均相芬顿系统中添加适量的Fe2+离子时,由于Fe2+激发H2O2速率远大于H2O2产生速率,使得氧还原反应是电芬顿过程的限速步骤[6]。因此,提高O2的2电子还原产H2O2性能成为电芬顿降解有机污染物的关键。
在电芬顿系统中,产H2O2电极普遍用碳材料制备而成,包括炭黑、活性炭、碳纳米管和石墨烯等,这些碳材料具有成本低、导电性好和催化活性高等优点,被广泛用作氧还原反应中的催化剂[11-12]。在2电子氧还原过程中,阴极氧还原性能受限于常温常压下水中极低的饱和溶解氧(DO)浓度(8.1~8.5 mg·L−1)[13]和缓慢的氧气传质过程(2.70×10−5 m·s−1) [14]。为此,除了常规曝气外,单一浸润性阴极[11,15-16]亦被广泛研究,借助气/液/固三相界面,极大地改善了氧气传质过程,提高了电极产H2O2性能。其中,疏水性阴极普遍由碳材料和粘结剂聚四氟乙烯(PTFE)制得,当粘结剂更换成聚偏氟乙烯(PVDF)和N, N−二甲基乙酰胺(DMA)混合物时可制得亲水性阴极。
以三相界面为基础,本课题组制备了非对称湿润性的半亲半疏阴极[17],有效解决了氧气的传质限制,同时也极大地提高了氧气利用率(37.4%),远高于传统曝气式产H2O2系统(<1%)[11, 18]。而在曝气式电芬顿工艺降解有机污染物过程中,仍然存在着氧气传质限制和低效利用的问题[19],因此,我们尝试将半亲半疏阴极引入电芬顿系统,并探究该系统对有机污染物的去除效果。本研究分别制备了亲水阴极、疏水阴极和半亲半疏阴极,用于均相电芬顿系统中降解有机污染物。首先对3种电极分别进行了结构表征和电化学性能测试,进而探究了阴极浸润性对目标污染物罗丹明B去除效果的影响,并考察了阴极电势和曝气速率对半亲半疏阴极去除罗丹明B性能的影响。
-
实验材料:无水硫酸钠购于北京化工厂,N, N-二甲基乙酰胺(DMA)、罗丹明B和草酸钛钾均购于国药集团化学试剂有限公司,以上试剂均为分析级纯。炭黑(>99.9%)购于Alfa Aesar Corporation,聚四氟乙烯(PTFE)溶液(质量分数为60%)购于Sigma-Aldrich Corporation,聚偏氟乙烯(PVDF)(相对分子质量为275 000) 购于Sigma-Aldrich Corporation,石墨毡(3 mm厚)购于安徽天富环保科技材料有限公司。
实验仪器:马弗炉(SX-G07103,天津中环电炉股份有限公司),扫描电子显微镜(JSM7001,电子株式会社,日本),总有机碳分析仪(TOC-L,岛津,日本),紫外可见光分光光度计(UV-6850,Jenway,英国),溶解氧测定仪(NEOFOX-GT,海洋光学公司,美国),接触角测试仪(OCA20,dataphysics,德国),电化学工作站(VMP3,Biologic,法国)。
-
1)半亲半疏阴极的制备由2部分组成,分别为三维石墨毡基底的疏水化处理和亲水性催化剂层的涂覆。三维石墨毡基底的疏水化处理方法:先将亲水性的原始石墨毡(3 cm×3 cm)浸渍在6% PTFE溶液中,然后放入350 ℃的马弗炉中进行热处理(升温速率10 ℃·min−1,维持10 min),最后在炉中冷却至室温,得到疏水性的石墨毡。亲水性催化剂层的涂覆方法:炭黑在600°C下煅烧得到氧化炭黑。称取100 mg氧化炭黑,加入1.25 mL 8% PVDF/DMA溶液均匀混合,再均匀涂布在疏水石墨毡的一侧。将涂有催化剂的一面在水中浸泡30 min来除去DMA溶剂。然后取出电极,自然晾干过夜,即得到半亲半疏阴极。
2)亲水阴极的制备步骤。称取100 mg氧化炭黑,加入1.25 mL 8% PVDF/DMA溶液均匀混合,再均匀涂覆在原始石墨毡(3 cm×3 cm)的一面。将涂有催化剂的一面在水中浸泡30 min。取出,自然晾干过夜,即可得到亲水阴极。
3)疏水阴极的制备步骤。第一步与半亲半疏阴极制备方法相同,是三维石墨毡基底的疏水化处理。第二步是疏水性催化剂层的涂覆与疏水化处理:称取100 mg氧化炭黑,加入1.25 mL 8% PTFE溶液均匀混合,再均匀地涂覆在疏水石墨毡的一面;然后将其放入350 ℃的马弗炉中热处理(升温速率为10 ℃·min−1,维持10 min),最后在炉中冷却至室温,即可得到疏水阴极。
-
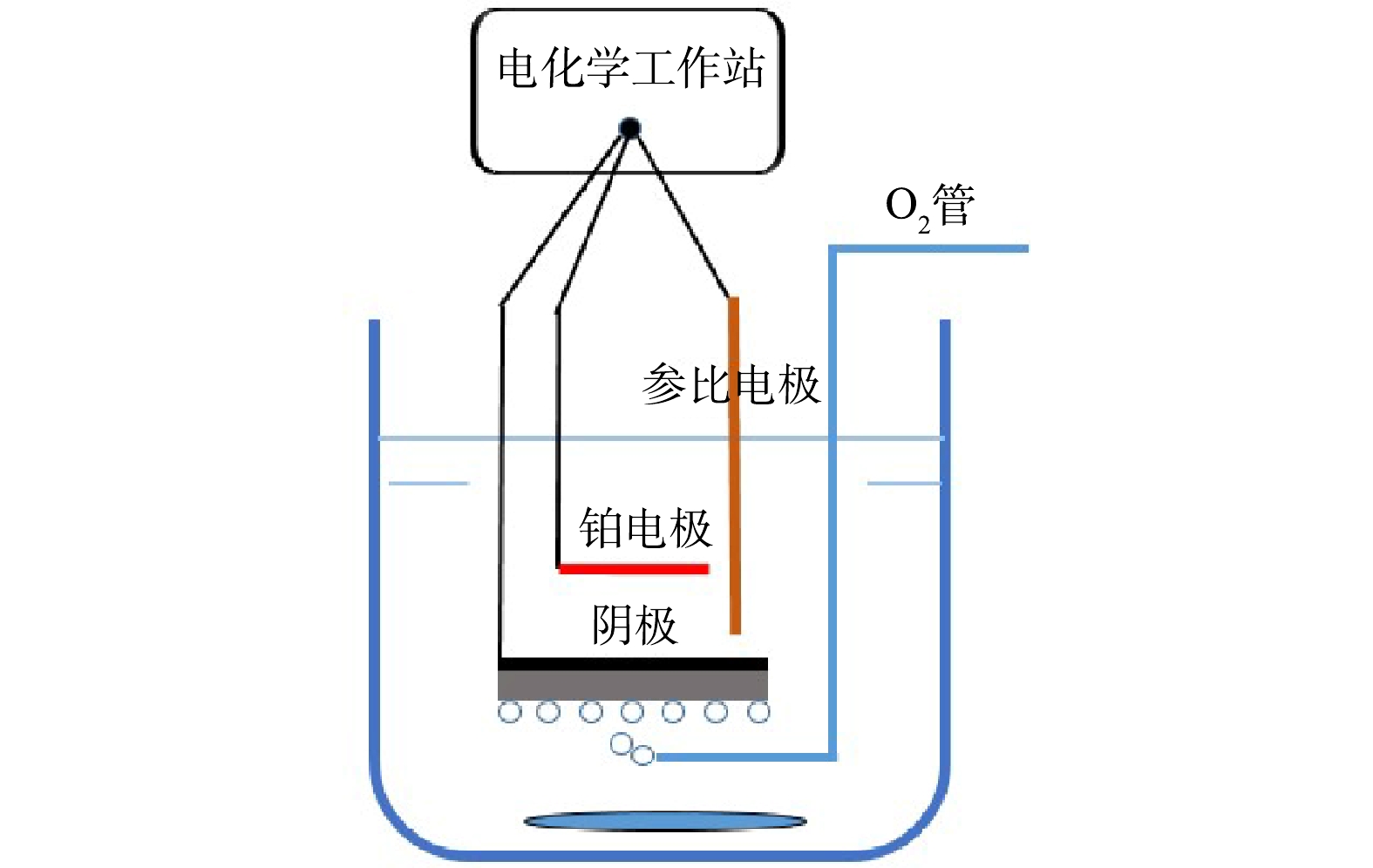
利用扫描电子显微镜(SEM)和接触角测试仪分别对阴极样品微观形貌和液体接触角进行测试。在三电极电化学测试装置中,利用线性扫描伏安法(LSV)和双电层电容(EDLC)来表征阴极的电化学性能。电解质为200 mL 的0.1 mol·L−1 Na2SO4中性溶液,不同浸润性阴极作为工作电极,铂(Pt)电极作为对电极,Ag/AgCl电极作为参比电极。阴极水平放置在Pt电极下方,催化剂层朝向Pt电极,电极间距约为2.0 cm。从阴极底部纯氧曝气,曝气速率为6 mL·min−1,搅拌转速为300 r·min−1。
-
罗丹明B去除性能测试均在含有0.1 mol·L−1 Na2SO4、1 mmol·L−1 FeSO4和10 mg·L−1罗丹明B的200 mL溶液中进行,初始pH为7.05。其他参数与上面电化学性能测试参数相同,实验装置如图1所示。利用草酸钛钾法测定H2O2的浓度,使用紫外可见分光光度计在400 nm处进行测定;根据554 nm处的吸光度计算罗丹明B浓度。
-
利用SEM对原始和疏水化处理后的石墨毡进行了表征。如图2(a)所示,原始石墨毡由众多的细小碳纤维交互错杂组成,在碳纤维之间存在着大量空间,石墨毡一旦浸入水中,亲水性使得其内部的碳纤维之间充满液体,因而不利于气体的存储。石墨毡经过疏水化处理后,如图2(b)所示,碳纤维表面被疏水的PTFE薄膜包裹,可阻止水体的浸入,同时三维空间依然充足,有利于O2储存和运输。以上结果表明,疏水性的石墨毡基底被成功制备。
由表1中接触角测试结果可见,原始石墨毡和疏水化处理后石墨毡的接触角分别为76.3°和116.4°,表明原始石墨毡是亲水性的,经过处理后变成疏水性石墨毡。而半亲半疏阴极中催化剂层的接触角为72.7°,具有较好的亲水性,有利于氧还原活性位点的充分暴露。此外,亲水催化剂层与电解质溶液充分接触,有利于电还原过程中离子的传递[20]。
-
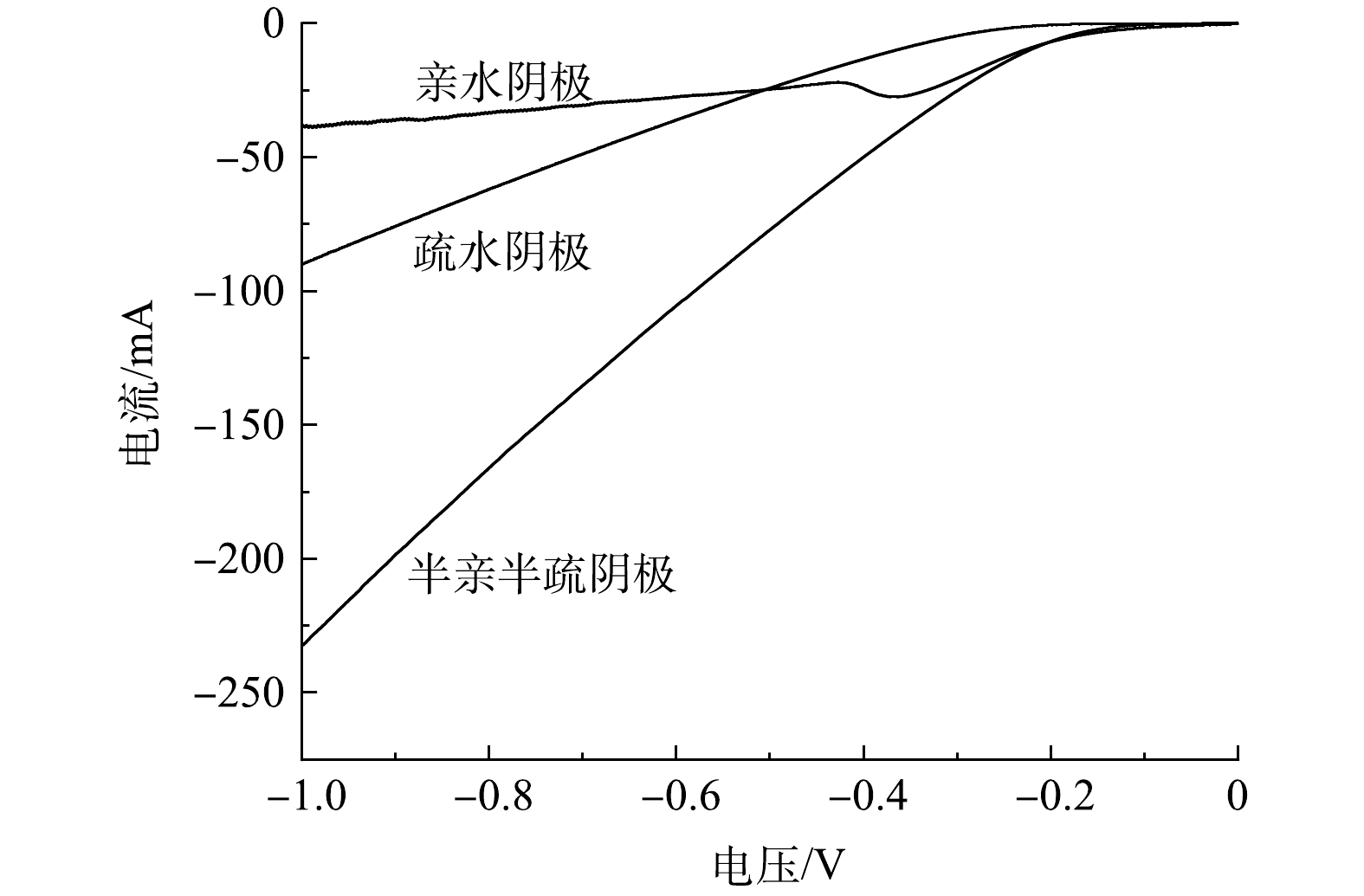
为了比较亲水阴极、疏水阴极和半亲半疏阴极的氧还原活性,进行了线性伏安法扫描测试。由图3可以看出,亲水阴极和半亲半疏阴极的起峰电位均为−0.15 V,远大于疏水阴极的−0.25 V。亲水阴极和半亲半疏阴极较正的起峰电位得益于亲水催化剂层活性位点的充分暴露。此外,亲水阴极在−0.37 V电位附近存在1个氧还原峰。在−0.2~−1.0 V内,3种阴极的电流均随还原电势的升高而增加。相比之下,半亲半疏阴极的电流增加速度最快(电流为−6.8~−232 mA),氧还原性能最佳;亲水阴极的电流增加速度最为缓慢(电流为−6.9~−38.5 mA),氧还原活性最差。导致上述结果的原因是,亲水阴极受限于溶液中低DO浓度和缓慢的氧气传质过程;而疏水气体储存层充足的O2供应,从而使得疏水阴极的电流增加速度快于亲水阴极,但疏水阴极缺少活性位点,以至于氧还原活性次于半亲半疏阴极。因此,半亲半疏阴极优秀的氧还原性能归因于亲水催化剂层大量活性位点的充分暴露以及疏水气体储存层中充足的O2供应。
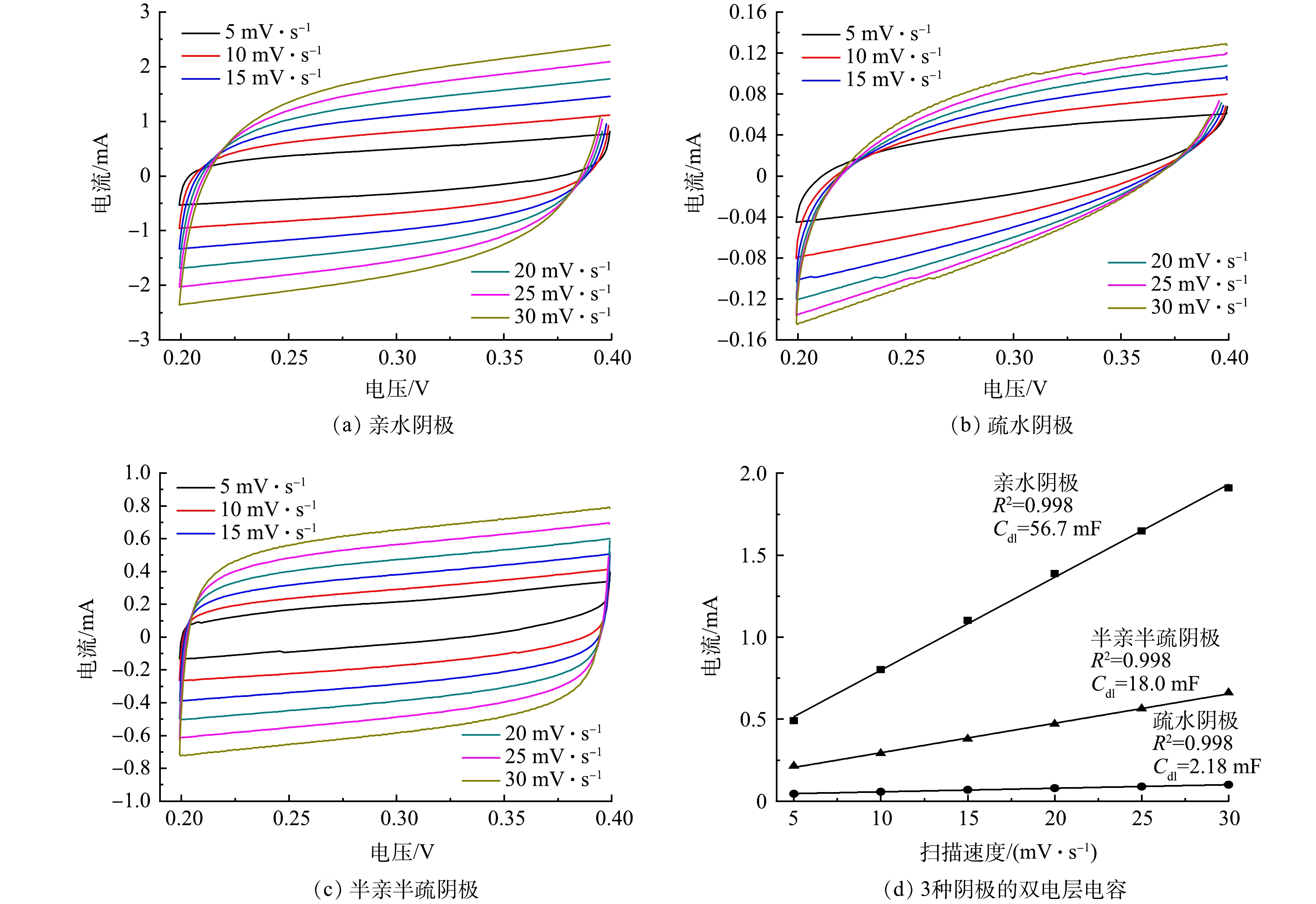
大量研究[21-22]表明,双电层电容可以用于估算电化学活性面积,因此,对3种不同浸润性阴极进行了双电层电容测试,结果如图4所示。根据循环伏安测试结果,利用0.3 V时的电流与扫描速度作图,并进行线性拟合,其斜率即为双电层电容,结果如图4(d)所示。结果表明:半亲半疏阴极的双电层电容约为18.0 mF,小于亲水阴极的56.7 mF,大于疏水阴极的2.18 mF。因此,相比于疏水阴极,亲水阴极和半亲半疏阴极拥有更大的电化学活性面积,这主要得益于电极中的亲水部分可以与电解质充分接触。催化剂的亲水性可以暴露出大量的氧还原活性位点,导致较大的电化学活性面积。
-
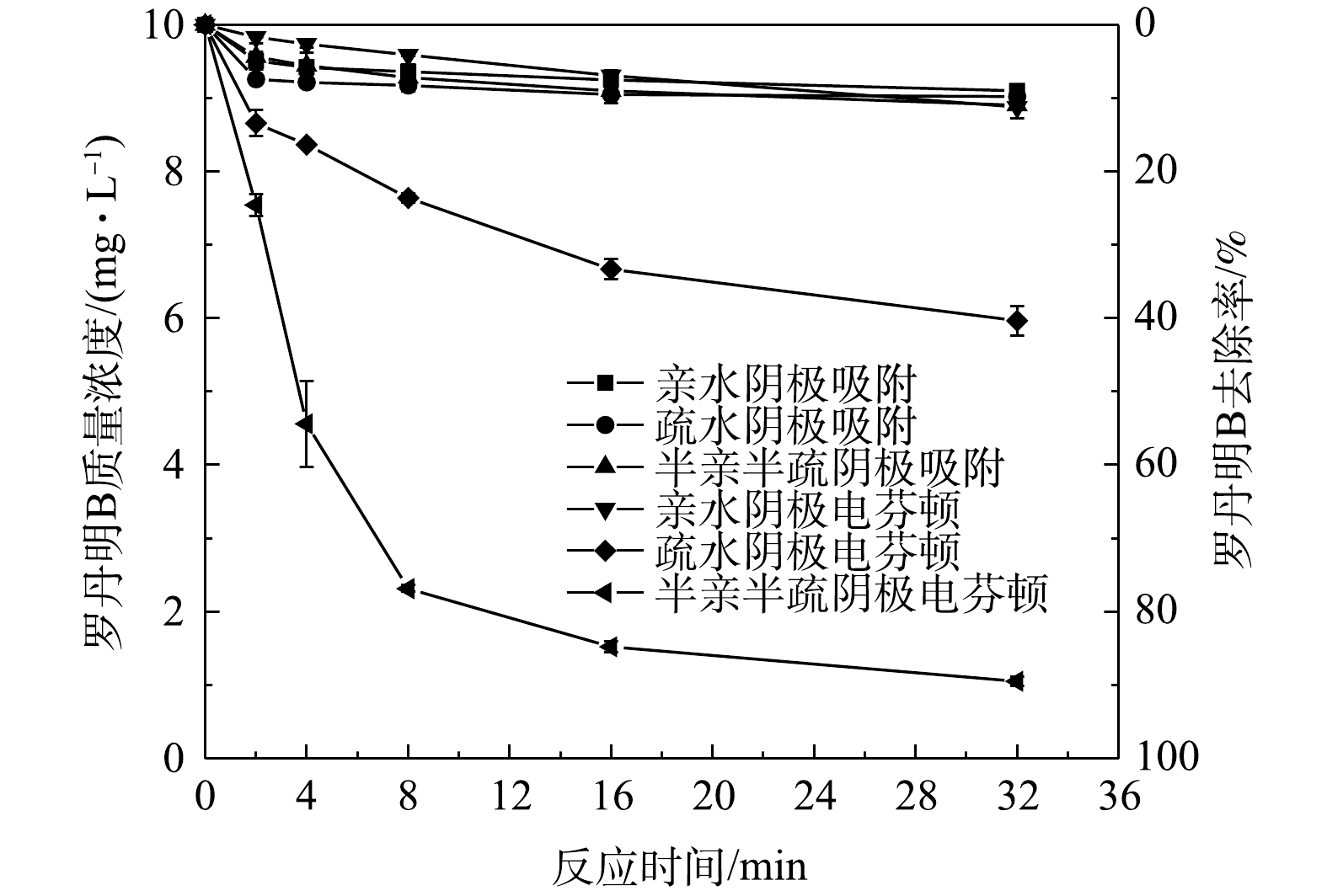
由于阴极催化剂为氧化炭黑,具有一定的吸附性能,故在不通电条件下,进行了3种阴极对罗丹明B的纯吸附研究,结果如图5所示。在反应32 min时,3种阴极对罗丹明B吸附去除效果都很差,去除率仅为10%,表明浸润性的差异对阴极吸附能力几乎无影响。因此,在本研究中,电芬顿氧化降解有机污染物效果主要受阴极自身的氧还原性能影响。
阴极浸润性对自身的氧还原能力和电化学活性面积有很大的影响,从而影响有机污染物的降解性能。故在电压为−0.4 V和曝气速率为6 mL·min‒1的条件下,对3种不同浸润性阴极去除罗丹明B的效果进行了研究。如图5所示,在32 min时,半亲半疏阴极系统中罗丹明B的剩余质量浓度最低,为(1.1±0.1) mg·L−1。因此,半亲半疏阴极拥有最佳的罗丹明B效果,去除率高达89.4%,远高于疏水阴极的40.3%和亲水阴极的11.2%。亲水阴极对罗丹明B去除率较低缘于电极只能利用溶液中的DO进行2电子还原反应,H2O2产量很低(图6),导致电芬顿反应生成的∙OH量较少。而疏水阴极凭借其良好的O2储存能力,对罗丹明B的去除效果优于亲水阴极。但疏水阴极催化剂层的疏水性导致电化学活性面积极低,使得罗丹明B去除率远低于半亲半疏阴极。因此,与亲水阴极和疏水阴极相比,半亲半疏阴极凭借疏水层充足的O2供应和亲水催化剂层较高的电化学活性面积,具有最强的污染物去除能力。
-
为优化半亲半疏阴极的有机污染物去除性能,对不同阴极电势下的罗丹明B去除率进行了研究(曝气速率为6 mL·min−1)。由图7(a)可见:罗丹明B去除率达到90%所需的时间由−0.4 V的32 min降到−0.8 V的4 min,最后降到−1.0 V的2 min。这表明随着阴极还原电势的增加,2电子还原反应速率加快,产H2O2能力增强(图8),从而提高罗丹明B的去除率。
进一步对降解过程的动力学过程进行分析拟合,如图7(b)所示,可决系数R2均大于0.9,表明罗丹明B的降解过程近似符合伪一级动力学;随着阴极还原电势的增加,罗丹明B降解的反应速率常数也在不断增加,由−0.4 V的0.187 min–1逐渐增加到−1.0 V的0.762 min−1。因此,伴随阴极还原电势的增加,半亲半疏阴极对有机污染去除速率也随之增加。
-
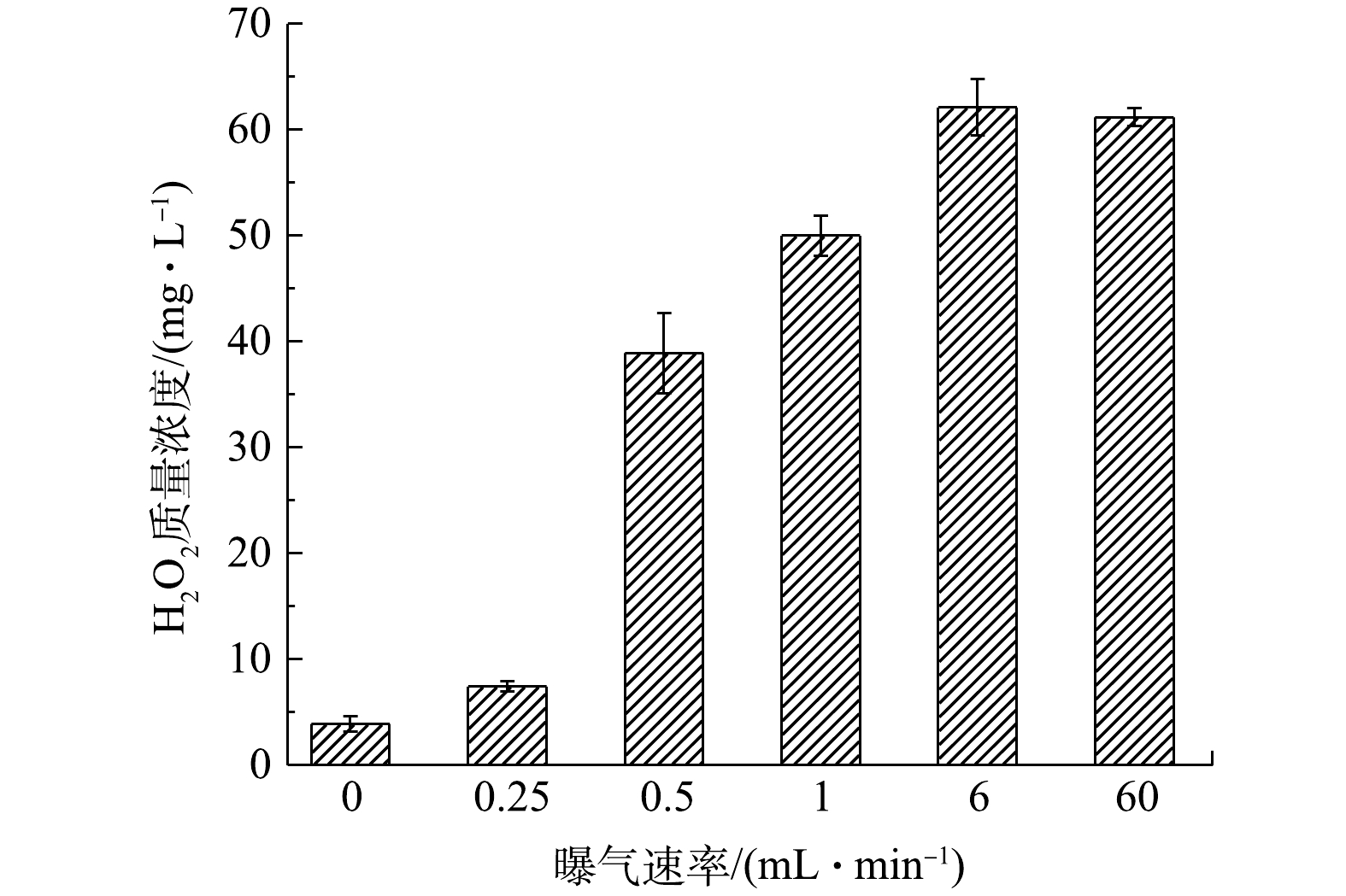
在电芬顿系统中,曝气是影响有机污染去除的重要因素之一[23]。为了研究曝气对半亲半疏阴极去除有机污染的影响,对不同曝气速率下罗丹明B的去除效果进行了测试(电压恒为−0.4 V),结果如图9所示。在反应32 min时,半亲半疏阴极在无曝气情况下对罗丹明B仍有16.2%的去除率,表明疏水石墨毡内部本身存有的空气以及水中DO被用来参与电芬顿反应;当增加曝气速率到0.25 mL·min−1时,罗丹明B的去除效果依旧很差,剩余罗丹明B的质量浓度为(7.7±0.1) mg·L−1,去除率为23.1%。导致此结果的原因是:疏水气体储存层O2在6 min左右时被耗尽,气膜消失,孔隙被电解质溶液充满,半亲半疏阴极变成亲水阴极,电极只能利用溶液中DO进行反应,导致较差的罗丹明B去除效果;继续增加曝气速率到0.5 mL·min−1时,疏水层的气膜刚好维持,罗丹明B去除率迅速升高到77.7%,剩余(2.2±0.1) mg·L−1;再继续增加曝气速率,罗丹明B去除效果也随着增强,罗丹明B去除率由1 mL·min−1的83.2%上升到6 mL·min−1的89.4%。
以上研究结果表明,当曝气速率超过6 mL·min−1后,罗丹明B去除率增加不明显;当曝气速率为60 mL·min−1时,罗丹明B去除率为90.1%,略高于6 mL·min−1下的89.4%,所以,6 mL·min−1的曝气速率为罗丹明B最佳曝气速率,再升高速率反而会浪费更多的O2。罗丹明B去除效果变化主要缘于曝气速率对半亲半疏阴极产H2O2性能的影响(图10)。在电芬顿系统中,激发H2O2速率远大于H2O2产生速率,所以O2生成H2O2的性能会影响激发H2O2生成·OH,进而影响罗丹明B的降解。因此,当曝气速率在6 mL·min−1以下时,半亲半疏阴极对罗丹明B的去除率随着曝气速率的增加而显著增加。但当曝气速率超过6 mL·min−1时,曝气速率的增加对罗丹明B的去除效果贡献很小,可以忽略。
-
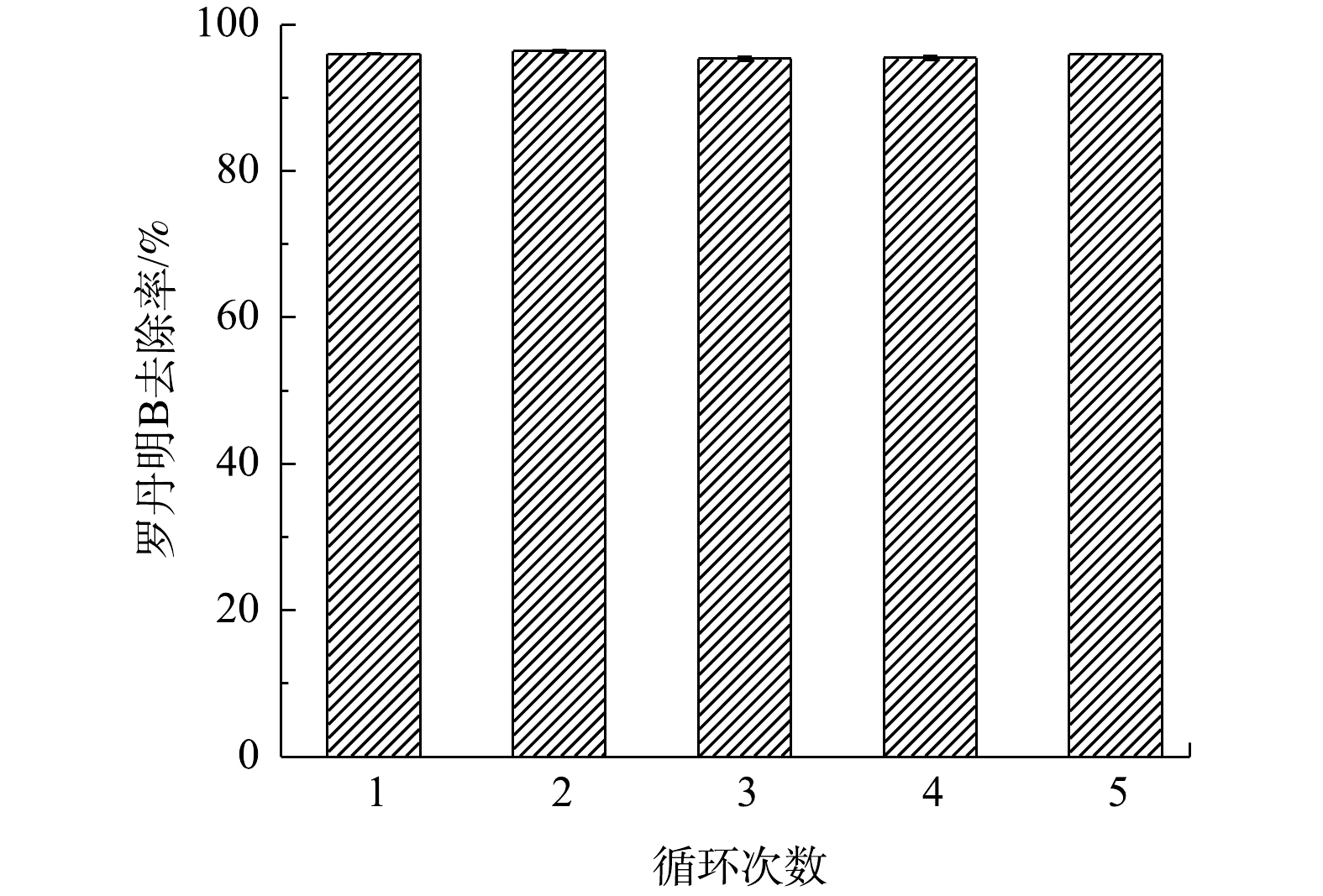
稳定性和循环利用性对电极本身实际应用非常重要。因此,在电压为−0.4 V和曝气速率为6 mL·min−1的条件下,对半亲半疏阴极进行了5次循环降解罗丹明B的测试。如图11所示,半亲半疏阴极在5次循环实验中,对罗丹明B去除率可以很好地维持在96%附近;并且在平行实验中误差小、电极稳定性高。因此,半亲半疏水阴极具有优异的稳定性和循环利用性,可以很好地应用于有机污染废水的实际处理中。
-
1)亲水阴极只能利用DO进行2电子还原,缺乏O2储存能力,传质效果差;疏水阴极催化剂层电化学活性面积低;相比之下,半亲半疏阴极凭借疏水基底的良好O2储存能力和亲水催化剂层的较大电化学活性面积,具有优良的有机污染去除效果。
2)与单一浸润性阴极相比,半亲半疏阴极对有机污染物有很强的去除能力。在电压为−0.4 V和曝气速率为6 mL·min−1的条件下,半亲半疏阴极的罗丹明B去除率为89.4%,远高于亲水阴极的11.2%和疏水阴极的40.3%。
3)当电压在−0.4 ~−1.0 V内,阴极还原电势的增加可以增强半亲半疏阴极的有机污染去除能力,并且降解罗丹明B过程为一级反应动力学。
4)曝气在电芬顿去除罗丹明B过程中发挥着重要作用:当曝气速率低于6 mL·min−1时,曝气速率的增加会显著提高罗丹明B的去除效果;但当曝气速率大于6 mL·min−1后,曝气速率的增加对罗丹明B的去除贡献较小。
半亲半疏阴极催化电芬顿工艺去除罗丹明B的性能
Performance of electro-Fenton oxidation with the Janus electrode on rhodamine B removal
-
摘要: 为解决传统曝气式电芬顿系统中氧气的传质限制和低效利用问题,利用石墨毡疏水化处理与催化剂涂覆的方法制备了一种非对称浸润性的半亲半疏阴极,且对半亲半疏阴极进行了结构表征和电化学性能测试,考察了阴极浸润性、阴极电势和曝气速率对有机污染物去除的影响。结果表明:在−0.4 V (vs. Ag/AgCl)和6 mL·min−1的曝气速率下,半亲半疏阴极在32 min内的罗丹明B去除率高达89.4%,是亲水阴极的8.0倍和疏水阴极的2.2倍,这主要得益于疏水化石墨毡基底的良好O2储存能力以及亲水催化剂层的较大电化学活性面积。Abstract: To address the problems of oxygen mass transfer limitation and low O2-utilization efficiency in conventional aeration-based electro-Fenton (EF) system, the Janus cathode with asymmetric wettability was successfully fabricated by hydrophobic treatment of graphite felt and catalyst coating. Its structure characterization and electrochemical performance test were performed, and the effects of wettability, cathode potential and aeration rate on organic pollutants removal were also investigated. The result showed that at the potential of −0.4 V and the aeration rate of 6 mL·min−1, the removal rate of rhodamine B was 89.4% in the reactor with Janus cathode, which was 8.0 times that with hydrophilic cathode and 2.2 times that with hydrophobic cathode. This good organics removal performance of Janus cathode was attributed to the excellent O2 storage ability in three-dimensional hydrophobic graphite felt substrate and large electrochemical active area in hydrophilic catalyst layer.
-
Key words:
- electro-Fenton /
- janus cathode /
- rhodamine B
-

-
表 1 不同浸润性阴极的液体接触角
Table 1. Liquid contact angle of different wettability cathodes
阴极名称 阴极组成 液体接触角/(°) 半亲半疏阴极 疏水气体储存层 116.4 亲水催化剂层 72.7 亲水阴极 原始石墨毡基底 76.3 亲水催化剂层 81.4 疏水阴极 疏水气体储存层 118.2 疏水催化剂层 136.7 -
[1] 李丽, 张国权, 邢嘉钰, 等. Fe3O4@ZIF-8/CA电极制备及其对罗丹明B废水降解研究[J]. 大连理工大学学报, 2020, 60(4): 365-373. doi: 10.7511/dllgxb202004005 [2] 陈晓燕, 何秉宇, 张雯. 印染废水处理研究进展[J]. 纺织导报, 2018(3): 60-62. doi: 10.3969/j.issn.1003-3025.2018.03.012 [3] 孙耀胜, 么强, 刘竞依, 等. 生物炭材料在水体有机污染治理中的研究进展[J]. 环境科学与技术, 2021, 44(1): 170-180. [4] 赵洪军, 张倩, 唐一, 等. ZnO-MgO/Al2O3吸附-臭氧催化氧化处理难降解有机废水[J]. 环境化学, 2021, 40(3): 818-827. [5] MOREIRA F C, BOAVENTURA R A R, BRILLAS E, et al. Electrochemical advanced oxidation processes: A review on their application to synthetic and real wastewaters[J]. Applied Catalysis B: Environmental, 2017, 202: 217-261. doi: 10.1016/j.apcatb.2016.08.037 [6] JIAO Y L, MA L, TIAN Y S, et al. A flow-through electro-Fenton process using modified activated carbon fiber cathode for orange II removal[J]. Chemosphere, 2020, 252: 126483. [7] HUANG A Q, ZHI D, TANG H M, et al. Effect of Fe2+, Mn2+ catalysts on the performance of electro-Fenton degradation of antibiotic ciprofloxacin, and expanding the utilizing of acid mine drainage[J]. Science of the Total Environment, 2020, 720: 137560. [8] JIANG J, LI G H, LI Z T, et al. An Fe-Mn binary oxide (FMBO) modified electrode for effective electrochemical advanced oxidation at neutral pH[J]. Electrochimica Acta, 2016, 194: 104-109. doi: 10.1016/j.electacta.2016.02.075 [9] CLEMATIS D, PANIZZA M. Electro-Fenton, solar photoelectro-Fenton and UVA photoelectro-Fenton: Degradation of Erythrosine B dye solution[J]. Chemosphere, 2021, 270: 129480. [10] BURY N A, MUMFORD K A, STEVENS G W. The electro-Fenton regeneration of granular activated carbons: Degradation of organic contaminants and the relationship to the carbon surface[J]. Journal of Hazardous Materials, 2021, 416: 125792. doi: 10.1016/j.jhazmat.2021.125792 [11] YU X M, ZHOU M H, REN G B, et al. A novel dual gas diffusion electrodes system for efficient hydrogen peroxide generation used in electro-Fenton[J]. Chemical Engineering Journal, 2015, 263: 92-100. doi: 10.1016/j.cej.2014.11.053 [12] DIVYAPRIYA G, NAMBI I, SENTHILNATHAN J. Ferrocene functionalized graphene based electrode for the electro-Fenton oxidation of ciprofloxacin[J]. Chemosphere, 2018, 209: 113-123. doi: 10.1016/j.chemosphere.2018.05.148 [13] TRUESDALE G A, DOWNING A L. Solubility of oxygen in water[J]. Nature, 1954, 173(4417): 1236. doi: 10.1038/1731236a0 [14] QIANGZ M, CHANGJ H, HUANG C P. Electrochemical generation of hydrogen peroxide from dissolved oxygen in acidic solutions[J]. Water Research, 2002, 36(1): 85-94. doi: 10.1016/S0043-1354(01)00235-4 [15] TAWABINI B S, PLAKAS K V, FRAIM M, et al. Assessing the efficiency of a pilot-scale GDE/BDD electrochemical system in removing phenol from high salinity waters[J]. Chemosphere, 2020, 239: 124714. [16] WANG D L, HU J P, LIU B C, et al. Degradation of refractory organics in dual-cathode electro-Fenton using air-cathode for H2O2 electrogeneration and microbial fuel cell cathode for Fe2+ regeneration[J]. Journal of Hazardous Materials, 2021, 412: 125269. [17] ZHANG H C, ZHAO Y S, LI Y J, et al. Janus electrode of asymmetric wettability for H2O2 production with highly efficient O2 utilization[J]. ACS Applied Energy Materials, 2020, 3(1): 705-714. doi: 10.1021/acsaem.9b01908 [18] ZHANG H C, WAN X Y, LI G H, et al. A three-electrode electro-Fenton system supplied by self-generated oxygen with automatic pH-regulation for groundwater remediation[J]. Electrochimica Acta, 2017, 250: 42-48. doi: 10.1016/j.electacta.2017.08.040 [19] LI D, ZHENG T, LIU Y L, et al. A cost-effective electro-Fenton process with graphite felt electrode aeration for degradation of dimethyl phthalate: Enhanced generation of H2O2 and iron recycling that simultaneously regenerates the electrode[J]. Chemical Engineering Journal, 2020, 394: 125033. [20] LI Y J, ZHANG H C, HAN N N, et al. Janus electrode with simultaneous management on gas and liquid transport for boosting oxygen reduction reaction[J]. Nano Research, 2019, 12(1): 177-182. doi: 10.1007/s12274-018-2199-1 [21] ZHANG H C, LI Y J, XU T H, et al. Amorphous Co-doped MoS2 nanosheet coated metallic CoS2 nanocubes as an excellent electrocatalyst for hydrogen evolution[J]. Journal of Materials Chemistry A, 2015, 3(29): 15020-15023. doi: 10.1039/C5TA03410H [22] ZHANG H C, LI Y J, ZHANG G X, et al. A metallic CoS2 nanopyramid array grown on 3D carbon fiber paper as an excellent electrocatalyst for hydrogen evolution[J]. Journal of Materials Chemistry A, 2015, 3(12): 6306-6310. doi: 10.1039/C5TA00707K [23] LI D, ZHENG T, LIU Y L, et al. A novel electro-Fenton process characterized by aeration from inside a graphite felt electrode with enhanced electrogeneration of H2O2 and cycle of Fe3+/Fe2+[J]. Journal of Hazardous Materials, 2020, 396: 122591. -



 下载:
下载: