-
2015年国家颁布的《水污染防治行动计划》(简称“水十条”)提出改善水环境质量,水路统筹、河海兼顾,系统推进水污染防治、水生态保护和水资源管理,对污水中污染物的排放限值提出了更高要求。作为水环境敏感区域,为改善各流域的水环境质量,北京市推行了更为严格的地方标准[1]。首都机场是“中国第一国门”,承担着对外展示国家形象、传播绿色和可持续发展理念的使命。在践行绿色机场理念的过程中,首都机场飞机区、航站楼以及公共区域的废水排放问题,显得尤为关键[2-4]。根据北京市生态环境局提高城镇污水处理厂水污染物排放标准的要求,首都机场航空净化站自2018年12月31日起须执行《城镇污水处理厂污染物排放标准》(DB11/890—2012)标准中表1B标准[5],同时要求在提标改造期间,不影响正常运行,厂区内不新增构筑物,出水稳定达标。
目前,我国城镇污水处理厂提标改造工程案例很多[6-10],新建或改造污水厂为了实现总氮和悬浮物达标,大多在二级处理系统后端增加深度处理工艺,如为了提高SS去除率,使用MBR膜或UF膜;为了去除总氮,增加反硝化深床滤池,或曝气生物滤池等构筑物,但上述工艺都涉及停产施工或增加厂区内构筑物。
为实现不停产条件下首都机场污水处理设施的提标改造,选用“利用现有生化系统调整运行方式保证脱氮,后增加磁分离工艺保证总磷达标”的方案。项目于2018年9月15日进场施工,12月21日完成调试出水达标。目前,已正常运行1年多,出水水质稳定达标。本项目的顺利实施可为不停产扩容条件下的污水厂提标改造提供参考。
-
1999年,首都机场T2航站楼扩建时,在原有污水厂的西侧天竺新村南500 m修建新的首都机场西航空净化站污水处理设施,用于处理T1、T2航站楼工作区、机场生活区以及周边商业区域的污水。净化站日处理量为2×104 t,采用“曝气沉砂池+初沉池+曝气池+二沉池”工艺,占地1.5×104 m2,于1999年11月投入运行。此后,净化站在2008年进行过一次改造,增加厌氧池及砂滤池,出水可达到《城镇污水处理厂水污染排放标准》(DB11/890-2012)表2B标准,最终排入温榆河。目前,净化站已运营约20 a,部分设备设施严重老化,性能下降严重,效率低下,已不能满足水质稳定达标排放需求,均影响后期运行效率。本次提标改造,要求在不停产、不新增构筑物的条件下将出水水质进一步提高,满足《城镇污水处理厂污染物排放标准》(DB11/ 890—2012)表1B标准。
-
2018年1月至6月污水处理设施出水水质见表1。由表1可知,出水水质达到了(DB11/ 890—2012)中表2B标准,但不能满足表1B标准要求,特别是TN、TP和SS与表1B排放限值的差距较大,因此后期工艺改造应强化脱氮除磷及悬浮物的去除。提标改造前,净化站存在的主要问题如下。
1)活性污泥系统异常。系统原有填料使用多年,已出现破碎,好氧池污泥质量浓度仅为2.3~2.8 g·L−1,污泥浓度偏低,这导致活性污泥有效微生物量不足,从而影响对BOD5和NH3-N的去除效果,其他水质指标也会产生影响。同时,系统污泥沉降性能不佳,从出水SS可知,北京市地方标准中的表1B标准对出水SS要求更严格(见表1),原工艺无法满足新的排放要求。
2)脱氮除磷能力较差。原有工艺对总氮和总磷的去除效果有限,难以达到高排放标准的处理要求。由于净化站缺氧池容积负荷偏低,且不能保证严格的缺氧环境,生化系统脱氮受到制约;生化池内微孔曝气器下放深度不一致,曝气强度没有梯变化,造成缺氧段的ORP数值偏高,反硝化能力较差。同时,厌氧池污泥释放磷效果不佳,厌氧池上清液磷含量仅为进水的1.5倍,从而影响了好氧池中聚磷菌的除磷作用,使得整个工艺对磷的去除主要依靠投加药剂;现有快速滤池静态管道混合器的运行效果欠佳,混合时间短,投加的硫酸铝没有与生化处理过的污水充分反应,因此系统除磷效果并不稳定。
-
改造前,出水水质不能满足表1B标准要求,特别是TN、TP、SS与表1B排放限值的差距较大,针对脱氮除磷及悬浮物的去除,提标改造工程设计的进、出水水质见表2。为使各指标达到设计的减排效果,制定了有针对性的工艺改造措施。
1)脱氮工艺。针对脱氮工艺的选择,考虑后接生物脱氮工艺及基于现有工艺进行强化脱氮。然而,根据厂区现有施工条件,因“不可停产新增构筑物”的要求,难以进一步在后段增加反硝化深床滤池,故将原有厌氧池改造为缺氧池,使二级生化系统专注于脱氮功能。同时,参考文献[11]报道的思路,为进一步提高污水脱氮效率并在一定程度上减少污泥产率,可采取利用污水中的碳源并强化内源反硝化脱氮等措施,投加优势菌种以保障硝化及反硝化效果。
2)脱磷及过滤工艺。原有添加铝盐除磷药剂和助凝剂的方式难以满足出水标准,因此,在三级处理中可通过磁混凝沉淀工艺实现化学除磷及悬浮物去除。据文献报道,向废水中投加絮凝剂及磁粉,使得形成的絮凝体和磁粉结合形成磁絮体,可实现高效的固液分离[12-14]。沉淀后含有磁粉的污泥一部分回流,一部分通过磁分离系统回收磁粉并循环使用,以节省运行成本。
-
基于上述设计,工程的具体改造思路分如下3个方面:1)在保留原有污水处理工艺(格栅、初沉、A2/O、二沉池及污泥处理系统)的前提下,改变污泥及混合液回流位置,将现有A2/O工艺按A/O运行,以解决原有缺氧池池容不足的问题;2)投加优势菌种(硝化菌)和碳源,以保障生化过程的硝化、反硝化效果;3)利用提升泵将二沉池出水泵入专用磁絮凝设备,通过投加磁种和混凝剂将污水中的磷从水中分离出来,其中污泥直接进入污泥处理系统,清水进入中间水池,中间水池的水部分通过过滤泵提升至新建砂滤器,以去除剩余悬浮物后排放,多余污水可溢流至现有砂滤池。砂滤器利用除磷设备出水作为反冲洗用水,反冲洗后排入缺氧池。
为满足不停产条件下净化站的提标改造,改造过程中将原有4格初沉池的其中1格改造为剩余污泥池,另1格作为中间水池放置磁絮凝设备,其余2格仍作为初沉池正常使用,不新增构筑物。因初沉池深度较大,且为半地下结构,故可增大磁絮凝反应的停留时间,以保证除磷效果,同时解决系统保温的问题。初沉池南侧空地放置新增的砂滤器,该新增设备不占用现有净化站道路,对现有净化站的运行影响最小。净化站提标改造后的工艺流程图如图1所示。
-
1)活性污泥系统的改造。原有系统中,污泥龄较短导致硝化菌生长速度缓慢;进水碳源和缺氧池池容不足,导致系统反硝化作用较差。因此,将厌氧池改造为缺氧池,加入菌剂,保证系统脱氮的稳定性。改造过程中不涉及现状池体的改造,仅在池体外部增加回流点,不影响施工期间净化站的正常运营。
2)除磷工艺的改造。除磷工艺段新增磁分离工艺,节约占地面积,运转灵活,固液分离效果较好[15]。通过高效加载絮凝设备,使磁种与污染物结合,然后通过高密度沉淀把废水中磁性悬浮物分离出来,以到达去除的目的[16]。改造项目在磁絮凝沉淀池中投加了质量密度为4.8~5.2 g·cm−3的稀土永磁材质磁种。稳定运行期间,日投加磁种4包,每包25 kg,折合补充磁种量约为5 g·m−3。
首都机场西净化站提标改造主要设计参数见表3。
-
污水处理设施改造于2018年9月完工,2018年12月21日完成调试,随后稳定运行。设施出水口安装有在线监测仪表,监测指标包括COD、氨氮、总氮和总磷。2019年1月至4月记录的月均出水水质见表4。
除在线监测外,首都机场委托第三方检测机构每月对其他出水水质指标进行了检测,结果如表5所示。
在线监测及日常检测的出水水质数据均表明,改造后污水处理设施的出水稳定达到了《城镇污水处理厂污染物排放标准》(DB11/ 890—2012)中表1B标准要求。
-
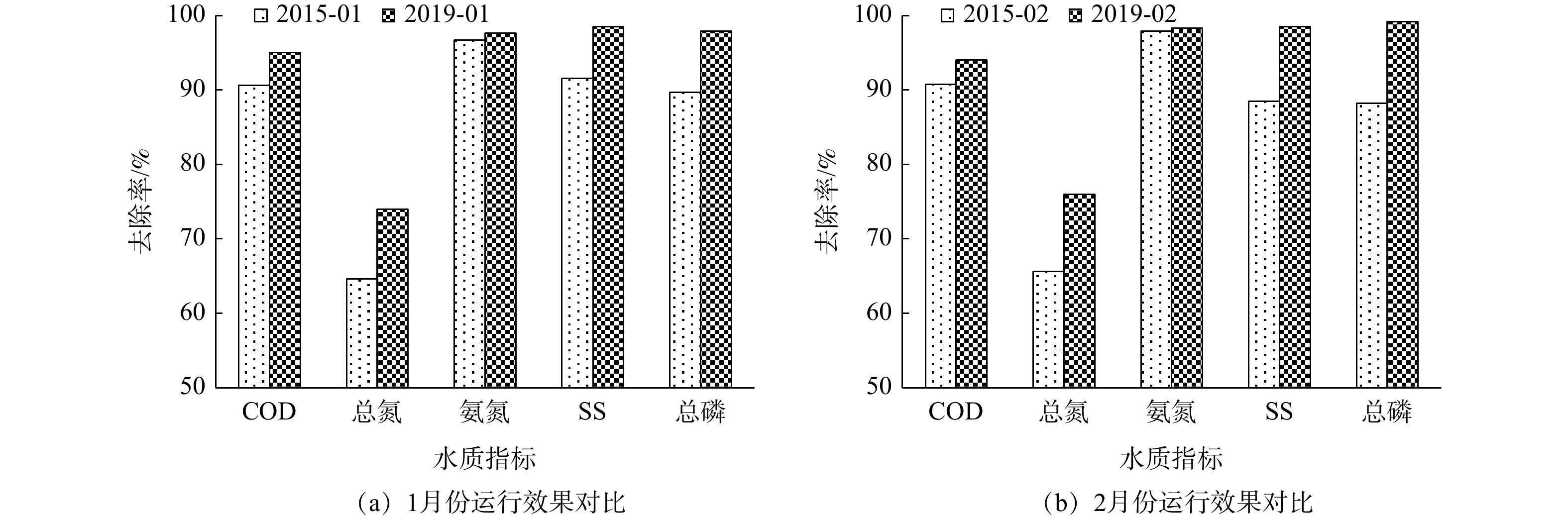
将污水处理设施改造完成后2019年1至2月的出水水质与改造前2015年对应月份的出水水质进行对比分析,结果见图2。由图2可知,改造完成后,总氮、总磷及SS去除率明显提升,比改造前提升约10%;COD去除率小幅提高,提高约4%;氨氮去除率变化不明显,总体来讲,改造后各项出水指标符合预期效果。
-
1)建设投资:1 620.18 ×104元。其中工程费用为1 444.24 ×104元,工程建设其他费用为98.79 ×104元,基本预备费为77.15 ×104元。对于新增工艺,主要改造单元磁絮凝反应池建设费用占总投资53.2%,生化工艺中沉淀池改造占总投资15.5%,其他费用主要用于全自动砂滤建设,污泥泵房改造以及自动化控制及仪表工程改造等内容。
2)运行费用:提标改造部分吨水运行费用为0.96 元·m−3,主要包括电费、水费、药剂费用(磁种、碳源、硝化菌、混凝剂和助凝剂投加)以及定员人工费用等。本项目单位水量耗电量为0.168 kW·h·m−3。运行费用与北京市现有的提标改造工程对比,如“生物强化+化学除磷+反硝化深床滤池”工艺(运行成本1.54 元·m−3)和“A2O+中空纤维膜深度处理”工艺(运行成本1.35 元·m−3),成本相对较低,节能效果较好。
-
针对实施的不停产污水处理厂改造工程,需首先明确改造工艺重点和施工技术难点,通过合理安排新建设施与改造设施的建设时序,分阶段实施,以实现不停产改造。本工程改造核心是将原有4格初沉池其中2格依次改造为磁絮凝池和剩余污泥池,施工过程中将该格水量通过管渠分散到其他并联格,不会产生污水外溢的问题。工程的顺利实施可为类似的小型污水处理工程实现不停产改造提供参考。
不停产条件下污水处理设施提标改造工程实例
An upgrade and reconstruction project of sewage treatment facilities under non-stop production conditions
-
摘要: 根据北京市顺义区水务局的相关要求,因首都机场航空净化站原有污水处理设施不能达标,需升级改造以满足新的排放要求。在不停产施工和不新增构筑物的前提下,提标改造工程的内容包括:投加优势菌种,现有生化系统按A/O方式运行,厌氧池按缺氧池运行,二沉池后增加化学除磷系统(磁絮凝+砂滤工艺)。提标改造工程完成后,出水达到《城镇污水处理厂污染物排放标准》(DB11/890—2012)标准中表1B标准。目前该工程已正常运行12个月,出水水质稳定达标。Abstract: According to the relevant requirements of the water bureau in Shunyi district, Beijing, the original sewage treatment facilities at capital airport need to be upgraded to meet the new discharge requirements. With the objective of non-stop project and non-add structures, upgrading reconstruction project includes adding superior bacteria in biochemical systems, operating the existing biochemical system in A/O mode, transforming the anaerobic tank into an anoxic tank, adding chemical phosphorus removal system (magnetic flocculation + sand filtration process) after the secondary sedimentation tank. The effluent meets the Class 1B level according to the Discharge Standard of Pollutants for Municipal Wastewater Treatment Plant (DB 11/890-2012). The project has been running for 12 months producing stable effluent quality compliant with the discharge standard.
-
随着全球气候变暖,大气中CO2体积分数持续升高,氮磷等营养物质大量输入,水体富营养化愈发严重,有害藻华频发[1-2]。致密的水华会消耗水中氧气,与水生生物竞争养分,破坏水产资源,导致水生态失衡[3-4]。此外,有些水华还会产生多种毒素或生物活性化合物,影响食品质量安全,危害人群健康[5]。水华已成为淡水湖泊面临的生态灾难,亦会对生态、环境和健康构成威胁[6]。因此,亟需寻找高效环保的方法来控制有害藻华。
在水生态环境中,藻细胞并不是独立存在的,其与微生物之间存在着物质交换与信息交流[7]。近年来,已有研究发现部分细菌及其分泌物具有强而特异的抑藻活性,这些细菌来源于藻际环境,在调节微藻的群落结构组成及生物量方面发挥着重要作用。因此,利用藻际细菌控制藻类水华成为研究者关注热点[8]。一些溶藻细菌在淡水水华爆发和消退过程中发挥了决定性作用[9],而部分溶藻细菌和相应的溶藻物质已被证实能有效控制有害藻华[10-11],且部分微生物的群体感应作用也能影响并调控菌藻的共生关系[12-13]。群体感应 (quorum sensing,QS) 是微生物化学信号传导的一种常见形式,主要通过释放一定量的胞外信号分子使个体获得有关邻近群落的细胞密度和物种组成信息,并相应地调整基因表达谱,实现个体无法进行的某些生理活动或者调节机制,如毒力因子产生、胞外聚合物合成、生物膜形成等[14-16]。在水华爆发过程中,溶藻细菌会跟随藻细胞的数量增长而增加,随水华的消亡而逐渐减少,但溶藻细菌在增殖初期并不表现出溶藻特性,只有数量达到一个阈值才能溶解藻细胞。因此,微生物的溶藻作用很可能受到QS的调控[17]。QS也参与溶藻物质代谢的调控。从太湖分离出一株气单胞菌GLY-2107,该菌能分泌3-甲基吲哚和3-苄基哌嗪-2,5-二酮两种溶藻活性物质,且证实该溶藻化合物的产生由AHL介导的QS调控,C4-HSL是溶藻功能菌溶藻活性的关键QS信号[11]。
扩散信号因子 (diffusible signaling factor,DSF) 家族群体感应是常见的群体感应系统之一,广泛存在于革兰氏阴性细菌中,可调节细菌种间与种内的多种与环境适应性相关的生物学功能[18]。DSF-QS信号的产生和响应主要由rpf基因簇完成。其中,rpfF基因负责合成DSF信号分子;rpfC/rpfG基因负责DSF信号识别与传导;rpfB基因负责降解DSF信号分子[19-20]。目前,DSF信号分子的生物化学功能调控机制基本上得以阐明,同时发现部分分泌DSF信号分子的微生物具有溶藻特性。周素等[21]用铜绿假单胞菌及其发酵液作用于铜绿微囊藻,发现用48 h的铜绿假单胞菌发酵液处理铜绿微囊藻7 d后,其溶藻率达到83.83%,对藻毒素的降解率达到71.35%。阴盼晴等[22]从赤潮中分离出一株能高效抑制锥状斯氏藻的嗜麦芽寡养单胞菌,该菌株能抑制藻细胞光合磷酸化电子传递过程,显著降低锥状斯氏藻的生物量。但这些报道中均未提及DSF-QS介导的群体感应对菌藻关系的影响机理,DSF-QS在微生物抑藻机制中的作用亦尚不清楚。
嗜根寡养单胞菌 (Stenotrophomonas rhizophila) 是一株革兰氏阴性菌,广泛存在于土壤、水体中,已有研究证实嗜根寡养单胞菌具有潜在抑藻能力[23-24],且其基因组中具有产生和响应DSF信号的rpf基因簇[19]。目前,嗜根寡养单胞菌的溶藻机制还不明晰,故S. rhizophila可作为DSF-QS调控溶藻作用和效果的模式菌株进行研究。基于此,本课题组以有害水华常见优势藻铜绿微囊藻为研究对象,以溶藻菌S. rhizophila野生型菌株 (WT) 和DSF合成酶基因-rpfF基因敲除株 (ΔrpfF) 为实验菌株,通过溶藻实验及基于光谱学手段,探讨DSF-QS存在或缺失条件下S. rhizophila 的溶藻作用及溶藻物质特性的差异,以期为DSF-QS调控的微生物溶藻机制提供科学依据,亦为微生物技术治理有害水华提供菌种资源及技术参考。
1. 材料与方法
1.1 实验材料
1) 菌种培养及无菌滤液的制备。实验所用菌株S. rhizophila WT购于美国典型微生物菌种保藏中心 (ATCC) ,保藏编号:ATCC BAA-473T。菌株S. rhizophila DSF信号合成酶基因缺陷突变体ΔrpfF是由本实验室前期敲除S. rhizophila WT中的rpfF基因得到。实验菌株均用NB液体培养基 (牛肉膏1.5 g·L−1,蛋白胨5 g·L−1,NaCl 2.5 g·L−1) 在30 ℃、150 r·min−1条件下震荡培养。在培养到特定时间段后,取OD600为1.0的菌液,于8 000 r·min−1条件下离心5 min后,收集上清液,过0.22 μm滤膜制备无菌滤液。
2) 藻种来源与培养方法。实验所用藻种铜绿微囊藻 (Microcystis aeruginosa,FACHB-905) 、凯氏拟小球藻 (Parachlorella kessleri,FACHB-729) 、斜生四链藻 (Tetradesmus obliquus,FACHB-416) 均购买自中国科学院水生生物研究所淡水藻种库 (FACHB) 。所有藻株均用BG11培养基并放于人工气候培养箱培养,培养温度为25 ℃,光照条件为2 000 Lux,光照周期为12 h/12 h (白/黑) 。藻液在培养7 d后,取OD680为0.4的藻液进行后续实验。
1.2 S. rhizophila溶藻特性实验方法
1) 溶藻方式。在实验菌株培养的第48 h取样,于8 000 r·min−1条件下离心5 min后分别收集上清液和菌体沉淀。所得上清液过0.22 μm滤膜制备无菌滤液,菌体沉淀用0.01 mol·L−1 无菌PBS洗涤3遍后加BG11培养液重悬。将所得菌液、重悬菌液、无菌滤液以体积分数10%比例添加到藻液中混匀培养,于培养第7 天取样测铜绿微囊藻叶绿素a (Chla) 质量浓度。
2) 不同培养时间对菌溶藻效果的影响。实验菌株S. rhizophila WT和ΔrpfF在1.1所述的培养条件下培养,分别在第12 h、24 h、48 h取菌液,制备无菌滤液,并以体积分数10%比例添加到藻液中混匀培养,于培养第7天取样测铜绿微囊藻Chla质量浓度。
3) 不同投加量对菌溶藻效果的影响。在实验菌株培养的第48 h取样离心,制备无菌滤液。将所得无菌滤液分别以体积分数5%、10%、15%比例添加到藻液中混匀培养,并于培养第7天取样测铜绿微囊藻Chla质量浓度。
4) 溶藻特异性。将48 h无菌滤液以体积分数10%添加到铜绿微囊藻、凯氏拟小球藻、斜生四链藻液中混匀培养,于第7天取样测铜绿微囊藻Chla质量浓度,评估S. rhizophila的溶藻特异性。
1.3 S. rhizophila溶藻物质性质实验方法
1) S. rhizophila溶藻物质热稳定性。取48 h无菌滤液于5个离心管中,分别在- 40 ℃、40 ℃、80 ℃、100 ℃水浴处理2 h,并用高压蒸汽灭菌锅121 ℃处理20 min,冷却至室温后将各处理组上清液按体积分数10%加入藻液中进行溶藻实验,并于7 d后取样测铜绿微囊藻Chla质量浓度。
2) S. rhizophila溶藻物质酸碱稳定性。取48 h无菌滤液,用2 mol·L−1 的NaOH及2 mol·L−1 的HCl溶液分别调节pH至3和12,室温处理2 h后,再回调至初始pH,以未处理的无菌上清液作为实验对照,各处理组的上清以体积分数10%的比例加入藻液中进行溶藻实验,并于培养第7天取样测铜绿微囊藻Chla质量浓度。
3) S. rhizophila溶藻物质乙醇沉淀。取48 h无菌滤液,加入3倍体积的无水乙醇,混匀震荡10 min,4 ℃静置2 h后,于8 000 r·min−1条件下离心5 min,分别收集上清和沉淀。上清用氮吹仪吹干后,用同体积的无菌水复溶残留物和沉淀,并以体积分数10%的比例加入藻液中进行溶藻实验,于培养第7天取样测铜绿微囊藻Chla质量浓度。
1.4 分析方法
1) 叶绿素a提取方法。取10 mL藻液在4 000 r·min−1条件下离心5 min,然后弃上清,加入90%丙酮,涡旋10 s,放在4 ℃黑暗环境下萃取24 h,然后于4 000 r·min−1条件下离心20 min,上清转移至10 mL比色管中,用90%丙酮固定体积至10 mL,摇匀。最后,将上清液分光光度计比色皿置于1 cm光程下,用90%丙酮调零,分别读取750、663、645和630 nm波长的吸光度。Chla质量浓度计算公式如 (1) 所示[25],并通过计算溶藻率来评估菌的溶藻效率,计算公式如 (2) 所示。
C=11.64×(A663−A750)−2.16×(A645−A750)+0.10(A630−A750) (1) 溶藻率=(C−Ct)C×100% (2) 式中:Ct为某个时间点处理组Chla质量浓度,mg·L−1;C为该时间点空白对照组Chla质量浓度,mg·L−1。
2) 无菌滤液光谱解析。紫外-可见光光谱分析:取48 h的无菌滤液,用紫外分光光度计扫描波长190~600 nm的紫外光谱图,其中以去离子水作为空白参照。三维荧光光谱分析:取48 h的无菌滤液,使用荧光光谱仪 (FluoroMax-4,美国HORIBA公司) 进行三维荧光光谱扫描。激发波长 (λex) 扫描范围为240~450 nm,发射波长 (λem) 扫描范围为290~500 nm,步长为5 nm,狭缝为1 nm。傅里叶红外光谱分析:取48 h的无菌滤液,使用真空冷冻干燥仪 (BIOBASE,山东科博生物产业有限公司) 冻干去除样品中的水分,然后研磨成细粉,用傅里叶变换显微红外光谱仪 (Nicolet iN10MX,美国赛默飞公司) 采集4 000~400 cm−1波段内样品的红外光谱信息,共扫描64次,取平均值。
1.5 数据分析
本研究采用单因素方差分析对实验结果进行统计分析。其中,以不添加菌液的作为空白对照组,以添加NB培养基的作为实验对照组,而所有添加了无菌滤液的统一作为实验处理组,每个实验组均设置3个重复。统计分析软件为SPSS statistic 20.0,p < 0.05表示实验数据有显著性差异。
2. 结果与分析
2.1 S. rhizophila的生理特性
S. rhizophila的菌体特征和生长曲线如图1所示。图1 (a) 为菌体形态。在30 ℃、150 r/min的培养条件下,WT菌体短小,两端大多呈钝圆形,菌长为1~2 μm;ΔrpfF形态呈直杆状,菌体细长,菌长2~4 μm。在培养的72 h以内,每隔一段时间用紫外分光光度计测其OD600,估计菌的生长状况。在培养初期,WT增长速率较快,而ΔrpfF具有一段延滞期;在培养至10 h后,ΔrpfF的生物量显著高于WT (p < 0.05) ,在48 h后ΔrpfF进入衰亡期,而WT依旧处于稳定期。因此,DSF-QS缺失的嗜根寡养单胞菌菌体形态与野生株不同,而敲除株在进入稳定期后会生成更多的生物量,但会更快进入衰亡期。
2.2 S. rhizophila的溶藻特征
2.2.1 溶藻方式的探究
微生物的溶藻方式主要分为2种:一种是通过微生物接触攻击藻细胞或吞噬藻细胞达到溶藻目的[26];另一种是通过营养竞争限制藻细胞必需的营养物质或者分泌具有溶藻活性的代谢产物进行间接溶藻,在现已发现的溶藻功能菌中约70%的微生物都是通过间接方式来溶藻[27]。为探究S. rhizophila对铜绿微囊藻的作用方式,分别取WT和ΔrpfF的重悬菌体和无菌滤液进行溶藻实验,结果如图2所示。在连续培养7 d后,WT重悬菌体处理组Chla质量浓度为 (6.134±0.091) mg·L−1,菌液处理组Chla质量浓度为 (3.063±0.267) mg·L−1,无菌滤液处理组Chla质量浓度仅为 (3.469±0.101) mg·L−1,菌体处理组几乎没有溶藻活性,无菌滤液的溶藻效果与菌液处理组无明显差异;而ΔrpfF重悬菌体处理组7 d后Chla质量浓度为 (6.274±0.169) mg·L−1,菌液处理组Chla质量浓度为 (1.819±0.158) mg·L−1,无菌滤液处理组Chla质量浓度仅为 (1.515±0.009) mg·L−1,ΔrpfF的重悬菌体与无菌滤液的溶藻效果呈现出与WT一样的趋势。上述结果表明,WT和ΔrpfF无菌滤液的溶藻活性并没有因为菌体的去除而降低。这说明WT和ΔrpfF主要通过分泌具有溶藻活性的代谢产物进行溶藻,属于间接溶藻方式。
2.2.2 不同生长时期对溶藻效果的影响
微生物在不同的生长阶段生物活性及代谢产物会存在差异,进而可能会影响到溶藻效果[28]。分别取12 h、24 h和48 h的无菌滤液进行溶藻实验,结果如图3所示。培养7 d后,WT的12 h、24 h和48 h无菌滤液处理组的Chla质量浓度分别为 (3.330±0.103) mg·L−1、 (3.318±0.093) mg·L−1、(3.469±0.101) mg·L−1,溶藻率分别为48%、48%、46%,WT在3个时期的无菌滤液溶藻效果相近,无明显差异;而ΔrpfF的12 h、24 h和48 h无菌滤液处理组的Chla质量浓度分别为 (3.482±0.147) mg·L−1、 (1.674±0.189) mg·L−1、 (1.515±0.009) mg·L−1,溶藻率分别为50%、76%、78%,12 h无菌滤液处理组的溶藻率显著低于24 h和48 h处理组 (p < 0.05) 。从整体上来看,WT和ΔrpfF的48 h无菌滤液溶藻效果最佳,故后续研究将选择48 h的无菌滤液进行验证。
2.2.3 不同投加量对溶藻效果的影响
不同投加量对菌溶藻效果具有较大的影响,选取合适的投加量对评估菌的溶藻特性十分重要。本实验选取3种不同的投加量 (即体积分数分别为5%、10%、15%) 进行溶藻实验,结果如图4所示。对于WT来说,处理7 d后投加量为5%、10%、15%处理组中Chla质量浓度分别为 (5.453±0.178) mg·L−1、 (3.469±0.101) mg·L−1、 (2.244±0.095) mg·L−1,溶藻率分别为15%、46%、65%,溶藻效果随投加量的增加而增大。而在ΔrpfF处理组中,到实验第7天投加量为5%、10%和15%处理组的Chla质量浓度分别为 (1.721±0.031) mg·L−1、 (1.515±0.009) mg·L−1、 (1.561±0.037) mg·L−1,溶藻率分别为75%、78%、78%,溶藻效果趋于稳定。基于上述结果及可行性分析,后续研究将选择体积分数10%的投加量进行验证。
2.2.4 S. rhizophila溶藻特异性探究
基于微藻种类多样性及生理生化结构的不同,菌的溶藻作用也可能表现出不一样的效果[29-30]。为研究S. rhizophila对不同藻株的溶藻作用,选取了水华常见藻中的凯氏拟小球藻和斜生四链藻作为对照测试藻株,结果如图5所示。WT与ΔrpfF的无菌滤液与凯氏拟小球藻共培养7 d后,Chla质量浓度分别增至(11.886±0.168) mg·L−1、(12.091±0.074) mg·L−1。S. rhizophila对小球藻并没有表现出显著的溶藻作用;WT与ΔrpfF的无菌滤液与斜生四链藻共培养7 d后,Chla质量浓度分别增至 (11.507±0.134) mg·L−1、 (11.753±0.102) mg·L−1。S. rhizophila同样对斜生四链藻没有表现出显著的溶藻作用。相反,实验菌株对铜绿微囊藻的溶藻作用显著 (p < 0.001) ,在共培养的第7天,WT处理组的Chla质量浓度降至 (2.928±0.135) mg·L−1,而ΔrpfF处理组的Chla质量浓度降至 (0.951±0.025) mg·L−1。综上所述,S. rhizophila具有针对铜绿微囊藻的溶藻特异性,而不是普适性溶藻功能菌。
2.3 S. rhizophila溶藻物质的特性
2.3.1 高温对溶藻物质活性的影响
为探究S. rhizophila溶藻物质的热稳定性,在不同温度梯度下处理了无菌滤液并进行溶藻实验。由图6 (a) 可知,WT无菌滤液未处理组的7 d溶藻率为65.65%,在低温−40 ℃处理2 h后,溶藻率为46.74%,与未处理组相比下降了28%;而在高温处理下,溶藻率保持在55%~65%。由图6 (b) 可知,ΔrpfF无菌滤液未处理组的溶藻率为88.43%,在各处理温度作用后,溶藻率仍保持约88%,几乎未受到任何影响。结果表明,ΔrpfF分泌的溶藻物质不管在低温还是高温处理后仍能保持较好的溶藻率,热稳定性较好,而WT的溶藻物质活性易受温度影响,稳定性相对ΔrpfF较差。
2.3.2 强酸强碱对溶藻物质活性的影响
部分溶藻物质在强酸强碱的条件下也容易失活变性[31]。为探究S. rhizophila溶藻物质酸碱稳定性,在强酸 (pH = 3) 强碱 (pH = 9) 条件下处理无菌滤液并进行溶藻实验,结果如图7所示。WT未经过任何处理的无菌滤液处理组7 d后Chla质量浓度为 (3.242±0.248) mg·L−1,溶藻率为56.6%;而经过强酸强碱处理过后的无菌滤液处理组Chla质量浓度分别为 (3.019±0.077) mg·L−1、 (3.237±0.225) mg·L−1,溶藻率分别为59.6%和56.7%;而ΔrpfF的未经过任何处理的无菌滤液7 d后Chla质量浓度为 (0.861±0.040) mg·L−1,溶藻率为88.5%;经过强酸强碱处理过后,无菌滤液处理组Chla质量浓度分别为 (1.066±0.027) mg·L−1、(0.997±0.025) g·L−1,溶藻率分别为85.7%和86.6%。因此,对照组与处理组之间无显著性差异,这说明S. rhizophila分泌的溶藻物质具有较好的酸碱稳定性,在强酸强碱处理后依然能保持较好的溶藻作用。
2.3.3 乙醇沉淀对溶藻物质活性影响
乙醇是渗透性很强的有机溶剂,能与氨基酸、核酸、蛋白等物质反应生成絮凝沉淀[32],故利用乙醇沉淀无菌滤液并进行溶藻实验可确认S. rhizophila分泌的溶藻成分中这些物质的存在。图8表明,WT的无菌滤液经乙醇沉淀后,沉淀部分处理组7 d后Chla质量浓度为 (5.47±0.215) mg·L−1,溶藻率仅为17%,而上清液处理组Chla质量浓度为 (3.97±0.114) mg·L−1,溶藻效率为40%;ΔrpfF的无菌滤液经乙醇沉淀后,沉淀部分处理组7 d后Chla质量浓度为 (5.18±0.326) mg·L−1,溶藻率仅为22%,而上清液处理组Chla质量浓度为 (1.34±0.048) mg·L−1,溶藻效率仍保持在约79.8%。以上结果表明,WT和ΔrpfF的的主要溶藻物质存在上清液,在乙醇作用下仍表现出较好的溶藻活性,溶藻物质的稳定性较好;但同时,乙醇沉淀部分仍具有较弱的溶藻作用,故不排除部分溶藻物质为氨基酸、蛋白、核酸等物质。
2.4 无菌滤液的光谱解析
2.4.1 三维荧光光谱分析结果
三维荧光光谱 (3D-EEMs) 是一种强有力的荧光基团分析方法,可表征产物中的荧光有机物。根据荧光区域积分,荧光光谱可表征以下几类物质:类色氨酸物质、类酪氨酸物质、类富里酸物质、类腐殖酸物质[33]。图9表明,在WT和ΔrpfF的无菌滤液中均检测到激发和发射 (λex/λem) 中心位置为360 nm/430 nm的类腐殖酸荧光峰。类腐殖酸物质是微生物对大分子有机物的代谢产物,且这类物质不能被二次代谢[34]。同时,从图谱中可看出,ΔrpfF中类腐殖酸荧光峰强度高于WT,这说明ΔrpfF的生物活性高于WT,能在相同时间里在培养液中积累更多的类腐殖酸物质。
2.4.2 紫外-可见光光谱分析结果
紫外-可见光谱是分子吸收紫外-可见光区域的电磁波而产生的吸收光谱,可反映无菌滤液在芳香族化合物和共轭体系方面的特性,并且吸光度与溶液中物质浓度成正比[35]。图10表明,WT和ΔrpfF的无菌滤液紫外可见光谱图趋势一致,在190~300 nm范围内的吸收峰密集杂乱,整个波段内最大吸收峰分别出现在297 nm和299 nm处。这说明WT和ΔrpfF的无菌滤液都含有丰富的芳香结构[36],而且在最大吸收峰处ΔrpfF的吸光度要显著高于WT。这说明ΔrpfF芳香族类化合物质量浓度显著高于WT,与三维荧光谱图的结果一致。同时A250/A365的比值一般与样品的腐殖化程度和芳香化程度呈负相关[37]。在本实验中,WT的A250/A365 (0.362) 大于ΔrpfF (0.104) 即说明后者的芳香化程度大于前者,与上述结果一致。
2.4.3 傅里叶红外光谱分析结果
利用傅里叶转换红外光谱仪对S. rhizophila的无菌滤液进行分析,可表征产物的官能团性质及相对浓度[38]。图11记录了无菌滤液在4 000~500 cm−1的红外光谱吸收曲线,对比分析发现WT和ΔrpfF的无菌滤液红外光谱图趋势一致,官能团属性相似。从特征峰的归属来看,3 200~2 900 cm−1附近出现了酚羟基或醇羟基的伸缩振动;1 629 cm−1 附近出现了芳环骨架 (C == C) 的叠加振动或羧酸类化合物 (COO—) 的伸缩振动;1 400 cm−1附近出现了脂肪烃类中甲基 (—CH3) 的弯曲振动;在1 000 cm−1附近显示的是脂类骨架 (C—C) 的伸缩振动[39-40]。这些峰主要来自无菌滤液中的碳水化合物、脂肪族烷烃、多糖类、核酸等物质[41]。同时,从谱图中还发现,与WT相比,在最大吸收峰处ΔrpfF的红外吸收强度相对较高,这与三维荧光光谱以及紫外可见光光谱的强度变化一致。
3. 讨论
本研究通过生理生化实验及光谱学手段探究DSF-QS系统对S. rhizophila溶藻作用的调控,探明了DSF-QS调控菌体表型及生长代谢情况 (图1) 。DSF-QS缺失的S. rhizophila菌体形态与野生株不同,而敲除株在进入稳定期后会生成更多生物量,但会更快地进入衰亡期。QS信号分子的识别和传导对于细菌生理代谢和适应性至关重要[42]。前期研究表明,WT和ΔrpfF之间的转录调节因子和信号传导相关基因的表达存在较大差异。在DSF-QS缺失的情况下,ΔrpfF的DNA复制相关的基因表达量下调,细胞增殖能力减弱,相对于WT而言会更快进入衰亡期;同时,与细菌趋化性相关基因的表达显著上调,ΔrpfF表现出更强的趋化性和生物膜形成能力[43]。而这些生理代谢的改变可能直接影响了S. rhizophila的溶藻作用。
WT能在较短时间内进入生长稳定期,故WT的3个生长时期的无菌滤液溶藻效果趋于稳定,无明显差异 (图3) 。而ΔrpfF具有一段延滞期,生长前期生物活性较低,细胞代谢较弱,分泌到胞外的溶藻物质质量浓度相对较低,故12 h无菌滤液处理组的溶藻作用弱;而ΔrpfF随着生长进入稳定期,ΔrpfF大量增殖,细胞代谢增强,培养液中积累了大量溶藻物质,溶菌效果随之显著提升;而在24 h和48 h这2个处理组中溶藻效果基本相持平,这说明ΔrpfF的溶藻效果已趋于稳定,细菌进入生长后期细胞代谢减弱,只能依靠前期培养液中累积的溶藻物质来溶藻[44]。此外,不同投加量的无菌滤液对S. rhizophila的溶藻效果也具有较大差异 (图4) 。对于WT来说,处理7 d后投加量为5%、10%、15%处理组的溶藻率分别依次增加,溶藻效果随着投加量的增加而加强,呈现出一定的剂量效应[45];而在ΔrpfF处理组中,投加量为5%、10%和15%处理组溶藻效果相近。ΔrpfF在稳定期的生物量显著高于WT,这可能导致WT的溶藻活性弱于ΔrpfF,需依靠较高的无菌滤液溶藻物质浓度才能发挥溶藻作用,而ΔrpfF分泌的溶藻物质活性较强,在低浓度下能达到较好的溶藻效果。
从整体上来看,WT和ΔrpfF的溶藻特性较为相似。WT和ΔrpfF都对小球藻和栅藻均未表现出溶藻作用,具有针对铜绿微囊藻的溶藻特异性 (图5) ,推测是由于小球藻和栅藻的细胞壁结构及生理代谢不同于铜绿微囊藻,对溶藻物质具有较强的抗性[46-47]。此外,WT和ΔrpfF的无菌滤液展现出与菌液一样的溶藻效果,溶藻活性并没有因为菌体的去除而降低。这说明WT和ΔrpfF主要通过分泌具有溶藻活性的物质进行溶藻,属于间接溶藻方式 (图2) 。目前,从溶藻菌中分离纯化出来的溶藻物质多为蛋白质、氨基酸、抗生素、多肽、生物碱等物质,部分物质耐高温高压、稳定性好,方便后续提取和保存[48]。本研究结果表明,WT和ΔrpfF的溶藻物质都具有热稳定性 (图6) 、耐强酸强碱 (图7) ,且经乙醇沉淀后上清依旧保持较好的溶藻活性 (图8) 。这表明WT和ΔrpfF的主要溶藻物质并非蛋白、糖类、核酸等易变性物质。此外,WT的溶藻物质受温度影响的波动较大,特别在- 40 ℃处理组中其溶藻率降低了28%,而ΔrpfF并无此现象。这说明WT和ΔrpfF的溶藻物质在种类上可能存在差异。
溶藻菌的溶藻物质在结构和作用方式上复杂多样,故进一步通过光谱学技术对WT和ΔrpfF的溶藻物质进行探究。结合三维荧光光谱 (图9) 、紫外可见光光谱 (图10) 、傅里叶变换红外光谱图 (图11) 结果分析发现,S. rhizophila WT和ΔrpfF的无菌滤液中主要以类腐殖酸物质为主,含有芳香基团,附带羧基、羟基等官能团。类腐殖酸物质是一种具有芳香基团的大分子多聚物,能与铁元素形成络合物,降低其生物利用度[49]。而铁元素参与藻类光合作用中电子传输蛋白的合成以及还原有机化合物,铁耗竭会抑制藻的生长[50],这为WT和ΔrpfF抑制铜绿微囊藻生长的机制提供了一个合理解释。然而,类腐殖酸物质是一类弱酸性大分子有机物,具有热稳定性但在碱性环境中并不稳定,这与上述酸碱稳定性结果并不符,由此说明类腐殖酸物质络合铁并不是WT和ΔrpfF主要的溶藻方式,可能存在其他溶藻物质。这也表明S. rhizophila并不是代谢某一类单一物质进行溶藻,而是通过分泌多种溶藻物质共同作用的结果[11]。此外,从荧光强度及吸光度看,ΔrpfF无菌滤液中类腐殖酸物质含量和芳香化程度均高于WT,结合WT和ΔrpfF的生长代谢差异分析表明,WT和ΔrpfF的溶藻物质在浓度上也存在差异。
综上所述,DSF-QS与S. rhizophila的溶藻作用密切相关。当DSF-QS缺失后,S. rhizophila的生物量显著增加,代谢活性增强,在相同的生长周期内能代谢出更多的溶藻物质,进而增强了S. rhizophila的溶藻能力。
4. 结论
1) S. rhizophila是一株溶藻功能菌,不同生长时期的无菌滤液和不同的投加量会对菌的溶藻效果有较大影响。其中,当采用48 h的无菌滤液且投加量为10%时,WT和ΔrpfF的溶藻效果最优,溶藻率分别为53%和78%。2) S. rhizophila WT和ΔrpfF主要通过分泌胞外溶藻物质进行溶藻,且溶藻物质稳定性较好,不易降解和失活,在高温高压及强酸强碱的处理下依然能保持较好的溶藻活性;同时,S. rhizophila产生的溶藻物质并非蛋白质、糖类、核酸等单一物质,不易被乙醇沉淀。3) S. rhizophila WT和ΔrpfF的无菌滤液主要以类腐殖酸物质为主,且该物质含有芳香基团,附带羧基、羟基等官能团,能络合铜绿微囊藻所必需的微量元素,进而限制铜绿微囊藻的生长。从荧光强度及吸光度看,ΔrpfF无菌滤液中类腐殖酸物质的质量浓度高于WT。这说明DSF-QS缺失使菌体能代谢出更多溶藻物质,进而增强了S. rhizophila的溶藻能力。DSF-QS系统对S. rhizophila溶藻作用的调控模式为溶藻菌的应用提供了新思路。
-
表 1 2018年1月至6月首都机场西航空净化站原有工艺的出水水质
Table 1. Effluent quality of the original process from January to June 2018
水质指标 质量浓度平均值/(mg·L−1) 达标率/% 执行表2B标准 执行表1B标准 COD 22.30 100 100.00 BOD5 5.50 100 93.73 SS 13.80 100 84.11 氨氮 0.77 100 92.6 总氮 14.20 100 74.32 总磷 0.76 100 69.47 表 2 提标改造工程设计进、出水水质
Table 2. Design influent and effluent quality of the upgrade and reconstruction project
项目 质量浓度/(mg·L-1) 去除率/% 进水 出水 COD 300 30 90.0 BOD5 200 6 97.0 总氮 60 15 75.0 氨氮 40 1.5 96.0 SS 200 5 97.5 总磷 7 0.3 95.7 表 3 工艺单元技术参数
Table 3. Main design parameters of the upgrade project
改造对比 除磷工艺 脱氮工艺 工艺选择 加药类型 平面尺寸/(m×m) 污泥产量/(kg·d−1) 过滤单元 滤速/(m·h−1) 工艺选择 总停留时间/h 污泥浓度/(mg·L−1) 污泥回流比/% 混合液回流比/% 改造前 混凝沉淀 铝盐除磷剂+助凝剂 4.5×4.5 1 000(含水量85%) 4 20 A2/O 8.0 2 500 100 200 改造后 磁混凝 磁种+混凝剂+助凝剂 20.0×7.0 800(含水量80%) 5 12.5 A/O 10.8 3 000 100 300 表 4 2019年1月至4月均出水水质指标
Table 4. Monthly effluent water quality from January to April in 2019
mg·L−1 月份 COD 氨氮 总氮 总磷 进水 出水 进水 出水 进水 出水 进水 出水 1月 180.18 11.34 30.05 0.68 53.42 12.86 6.06 0.10 2月 217.68 13.10 35.43 0.49 50.28 11.74 5.67 0.04 3月 217.44 12.35 31.47 0.76 48.21 11.11 5.80 0.03 4月 166.24 11.81 21.45 0.45 52.28 12.19 6.21 0.07 表 5 2019年1月至4月第三方检测机构的水质监测结果
Table 5. Daily monitoring results from January to April in 2019
日期 BOD5/ (mg·L−1) 总氮/ (mg·L−1) 色度/ 倍 SS/ (mg·L−1) 总磷/ (mg·L−1) 2019-01-03 4.5 12.10 2 <4 0.156 2019-02-12 4.6 11.30 8 <4 0.039 2019-03-05 4.9 9.57 2 <4 0.011 2019-04-08 3.8 9.06 2 4 0.018 2019-05-12 4.2 12.70 2 4 0.022 2019-06-10 3.1 9.43 2 4 0.031 排放标准 6 15 15 5 0.3 -
[1] 田颖, 梁云平, 郭婧, 等. "水十条"对北京市地表水环境质量改善分析[J]. 环境工程, 2019, 37(4): 1-6. [2] 尤洋, 张青, 李文攀, 等. 不同类型机场项目环保管理问题分析[J]. 环境监控与预警, 2017, 9(01): 59-62. doi: 10.3969/j.issn.1674-6732.2017.01.018 [3] 吴聪. 基于可持续发展的绿色机场评价体系研究[D]. 北京: 北京林业大学, 2013. [4] 张志广, 于京沦, 杨军. 北京首都机场污水处理厂自动化控制系统[J]. 环境工程, 2003, 21(4): 28-30. doi: 10.3969/j.issn.1000-8942.2003.04.009 [5] 北京市环境保护局. 城镇污水处理厂污染物排放标准: DB11/890—2012[S]. 北京: 中国环境科学出版社, 2012. [6] 瞿露, 张华伟. 重庆地区A-A2/O工艺污水处理厂提标改造工程实例[J]. 中国给水排水, 2019, 35(6): 72-75. [7] 张鹤清, 朱帅, 吴振军, 等. 城镇污水处理厂"准Ⅳ类"标准提标改造技术简析[J]. 环境工程, 2019, 37(6): 26-30. [8] SHANNON M A, BOHN Pl W, ELIMELECH M, et al. Science and technology for water purification in the coming decades[J]. Nature, 2008, 452(20): 301-310. [9] 刘亦凡, 陈涛, 李军. 中国城镇污水处理厂提标改造工艺及运行案例[J]. 中国给水排水, 2016, 32(16): 36-41. [10] 李亮, 汪德金, 杨雪, 等. 大型污水处理厂采用MBR工艺不停产扩能提标改造[J]. 中国给水排水, 2019, 35(14): 52-58. [11] 孙月鹏, 王火青, 孙广垠, 等. 不同污泥龄条件下多级AO工艺强化生物脱氮性能研究[J]. 水处理技术, 2014, 40(10): 47-52. [12] 肖波, 王吉白, 潘国强, 等. 超磁分离技术在污水厂除浊去磷中的应用研究[J]. 环境保护科学, 2015, 41(6): 63-68. doi: 10.3969/j.issn.1004-6216.2015.06.014 [13] 孙少群. 磁絮凝沉淀用于漳浦污水处理厂一级A升级改造[J]. 中国给水排水, 2019, 35(14): 95-100. [14] 王东升, 张明, 肖峰. 磁混凝在水与废水处理领域的应用[J]. 环境工程学报, 2012, 6(3): 705-713. [15] LALLEY J, HAN C, XUAN L, et al. Phosphate adsorption using modified iron oxide-based sorbents in lake water: Kinetics, equilibrium, and column tests[J]. Chemical Engineering Journal, 2016, 284: 1386-1396. doi: 10.1016/j.cej.2015.08.114 [16] VOHLA C, KOIV M, BAVOR H J, et al. Filter materials for phosphorus removal from wastewater in treatment wetlands—A review[J]. Ecological Engineering, 2011, 37: 70-89. doi: 10.1016/j.ecoleng.2009.08.003 -






 下载:
下载: