-
随着城市点源污染得到基本控制,由暴雨径流引起的非点源污染逐渐成为城市水体主要污染来源[1]。在城市分流制排水系统中,暴雨径流携带的部分颗粒物在重力作用下沉积在雨水管道底部,形成管道沉积物。这些沉积物在后续管道径流的冲刷作用下,部分又将重新进入管流并随之排入城市水体,成为水体污染重要的源和汇[2-4]。李海燕等[5-6]对北京市某区域分流制雨水管道进行了调查,结果表明,约80%以上管道存在不同程度的沉积现象,管道沉积物中TN对径流污染负荷的贡献率约为23%,TP贡献率约为30%。
管道沉积物对径流污染负荷的贡献可能与沉积物-水界面污染物交换特性有关。影响沉积物-水界面污染物交换的因素有沉积物的理化性质、环境因子和扰动(包括物理扰动和生物扰动)等[7]。近年来一些学者在管道沉积物污染分布[8-9]、冲刷沉积规律[10]、吸附解吸[11]及溶出特性[12]等方面开展了研究。陈红等[13]对合流制入河管道沉淀物中氮转化规律进行了探究,结果表明,氨氮是其主要释放形态。李明怡[14]利用北京市雨水管道沉积物进行了研究,发现上覆水体pH和流速是影响沉积物中磷和重金属释放的主要因素,并利用连续函数法计算出:当流速为1.1 m·s−1时,沉积物和水之间磷的平均交换速率为4.09 mg·(m2·min)−1。目前,有关分流制雨水管道沉积物-水界面的研究很少,关于微生物对沉积物-水界面之间污染物交换特性的影响尚未见有报道。
株洲市位于湖南省东部,湘江中下游,其中白石港是湘江在株洲最大的支流,沿河两岸雨水及溢流污水均直接排入白石港。港道水体氨氮等指标超标明显,水质较差[15]。基于此,本研究选取株洲市某分流制雨水管道沉积物作为研究对象,通过模拟实验考察了溶解氧、温度、水力扰动强度及微生物种群对污染物在沉积物-水界面之间交换的影响,剖析上覆水中污染物转化途径与规律,为雨水管道沉积物污染控制提供参考。
全文HTML
-
研究区域位于株洲市白石港流域职教城片区,汇水面积约为0.29 km2。该区域为新建城区,毗邻长株高速,以教育用地为主,下垫面主要由沥青道路、建筑屋面及绿地组成。区域内颗粒物污染来源主要为大气沉降、土壤以及道路磨损等,未见垃圾填埋场、工厂等大型污染源。研究区域排水体制为雨污分流制,雨水管道管径为1 000~1 500 mm,降雨时管道径流直接排入白石港主河道。
2020年7—9月调研期间,受强降雨条件下管道径流冲刷的影响,该区域雨水管道沉积物主要分布在拐弯及交汇处的管段末端,平均沉积厚度为10 cm。取样点处管道直径为1 200 mm,旱季无流量,沉积物呈黑色,有轻微气味。采样点位置见图1。
-
样品采集日前期的干旱天数为12 d。采样时,利用铲子铲取采样点表层沉积物,置于黑色聚乙烯袋中,采样后立即送回实验室。利用真空冷冻干燥机对部分沉积物进行干燥处理,其余沉积物去除树叶、石块等杂物后采用四分法进行均化,所有样品置于−20 ℃条件下冷冻保存。在采样结束后的雨天,采集该处降雨中期管道径流样,置于聚乙烯塑料瓶中,带回实验室于4 ℃条件下冷藏保存,以供模拟实验用。
沉积物样品主要由粒径在380~830 μm和75~150 μm内的颗粒物组成。沉积物初始pH为7.89,含水率为23.44%,有机质含量为4.22%,SCOD、氨氮、硝酸盐氮、TP质量分数分别为2 154.99、20.41、11.05、1 200.86 mg·kg−1,无机磷(IP)占总磷含量的68.9%,Fe/Al-P占IP的70.2%,可见,该区域沉积物中的磷活性较高,沉积物释磷潜力较大[16]。管道径流初始水样pH为7.6,氨氮、硝酸盐氮和亚硝酸盐氮质量浓度分别为0.467、1.283和0.106 mg·L−1,SCOD、DTP和DIP质量浓度分别为41.77、0.025和0.014 mg·L−1。
-
分别考察溶解氧、温度和扰动强度3种环境因素对污染物转化的影响。具体实验条件设置如下:为模拟管道中不同溶解氧含量的环境,采取滴加亚硫酸钠和人工曝气的方式控制上覆水溶解氧质量浓度,使其分别保持在≤1、3和5 mg·L−1,此时环境温度均为25 ℃,不进行扰动;为模拟不同季节下管道环境温度,采用恒温培养箱实现对环境温度的控制,使其分别保持在15、25和35 ℃,此时上覆水溶解氧质量浓度为3 mg·L−1,不进行扰动;为模拟管道中不同水流流速情景,通过调节搅拌器的转速实现对扰动强度的控制,分别设置转速为0、150和300 r·min−1,此时环境温度为25 ℃,实验过程中监测各组上覆水pH及DO值。
取250 g经均化处理的沉积物置于1 L烧杯底部,沿杯壁缓慢加入经0.45 μm滤膜过滤后的管道径流,稍没过底泥后进行搅拌使泥水充分混合,于25 ℃恒温培养箱中静置24 h,之后再加入剩余上覆水至水土比为1.5∶1。实验周期为7 d,装置全程避光置于恒温培养箱中,每隔12 h用注射器抽取50 mL水样,经0.45 μm滤膜过滤后,测定相关污染物质量浓度。取样后向烧杯中补充同体积的原上覆水,补充过程中尽量避免对沉积物造成扰动。在25 ℃条件下,每隔24 h取5~10 g(DO=3 mg·L−1)的沉积物,用以测定沉积物中微生物群落。实验结束后测定各组沉积物中污染物质量浓度。
-
本实验主要检测分析沉积物和上覆水中氨氮、硝酸盐氮、淋溶态化学需氧量(SCOD)、溶解态总磷(DTP)及溶解态正磷酸盐(DIP)等指标。沉积物中SCOD和无机氮含量测定采用浸提法[17];沉积物磷形态分析采用SMT磷分级分离方法[18];各步骤提取液以及上覆水中SCOD、DTP、DIP、氨氮、硝态氮、亚硝态氮的测定方法均参照国标法[19]。样品做2次平行样测定,结果取平均值,利用Excel和SPSS分析数据,Origin2018作图。
委托上海美吉生物利用细菌/古菌通用引物对(GTGYCAGCMGCCGCGGTAA/GGACTACNVGGGTWTCTAAT)进行16S rRNA基因扩增,并通过Illumina Miseq平台进行高通量测序[20],将结果与Silva数据库比对进行物种注释,得出微生物群落结构组成。
沉积物与上覆水中营养盐交换通量[21]参照式(1)进行计算。
式中:M为平均交换通量,mg∙(m2∙h)−1;V为上覆水总体积,L;
V0 为每次所取上覆水体积,L;C0 、Ct 、Cj−1 为初始时刻、t时刻和j−1时刻测得的上覆水中污染物质量浓度,mg·L−1;Ca 为补充水样中污染物质量浓度,mg·L−1;S为沉积物与水界面营养盐交换面积,m2;t为反应时间,h。当M>0时,表明污染物以从沉积物中向上覆水释放为主;当M<0时,表明上覆水中污染物以被沉积物吸附或发生降解为主。
1.1. 区域概况
1.2. 样品采集与分析
1.3. 实验设计
1.4. 分析方法
-
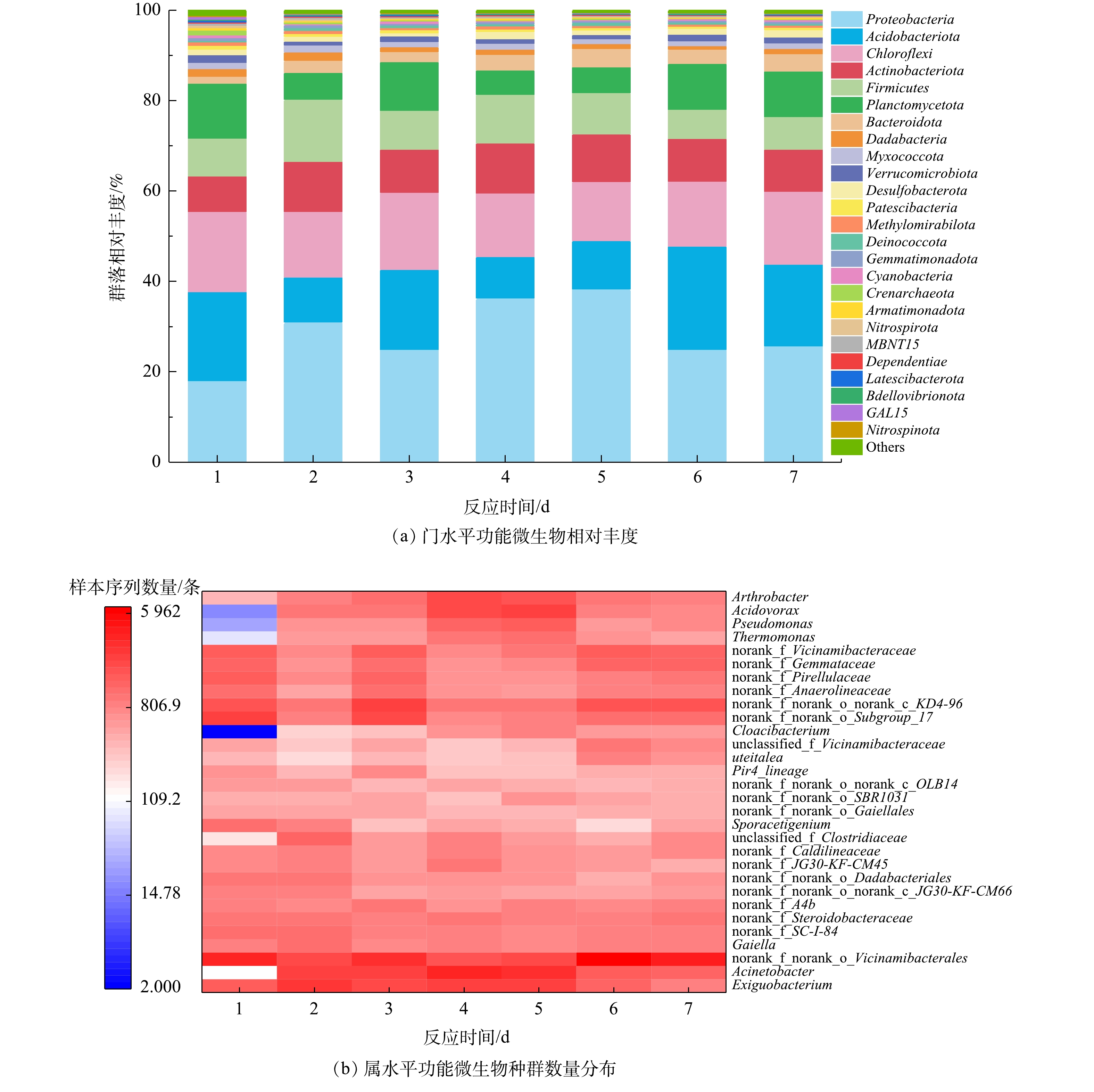
微生物种群结构如图2所示。由图2(b)可见,方格颜色代表样品中某一物种的种群数量,颜色越深表明种群数量越大。沉积物中共有25个门水平的物种丰度大于0.2%,其中与氮磷转化相关的变形菌门、绿弯菌门、厚壁菌门[22]等7个物种的总丰度达80%以上,表明在沉积物中进行着大量与氮磷转化相关的生物过程。泉古菌门是一类具有氨氧化功能的古菌,能在有氧条件下将氨氧化为亚硝酸盐,是硝化过程的关键限制反应[23],其相对丰度为0.2%~1.05%。硝化螺旋菌门和硝化刺菌门可将亚硝酸盐氧化为硝酸盐,在样品中的相对丰度为0.56%~0.58%。1个实验周期内所取的7个样品中,优势种群均为与氨化、反硝化及聚磷作用相关的菌属,主要包括变形菌门的不动杆菌属(Acinetobacter)、食酸菌属(Acidovorax)、热单胞菌属(Thermomonas)、假单胞菌属(Pseudomonas),厚壁菌门的微小杆菌属(Exiguobacterium)以及绿弯菌门的厌氧绳菌属(Anaerolinea)[22]。
-
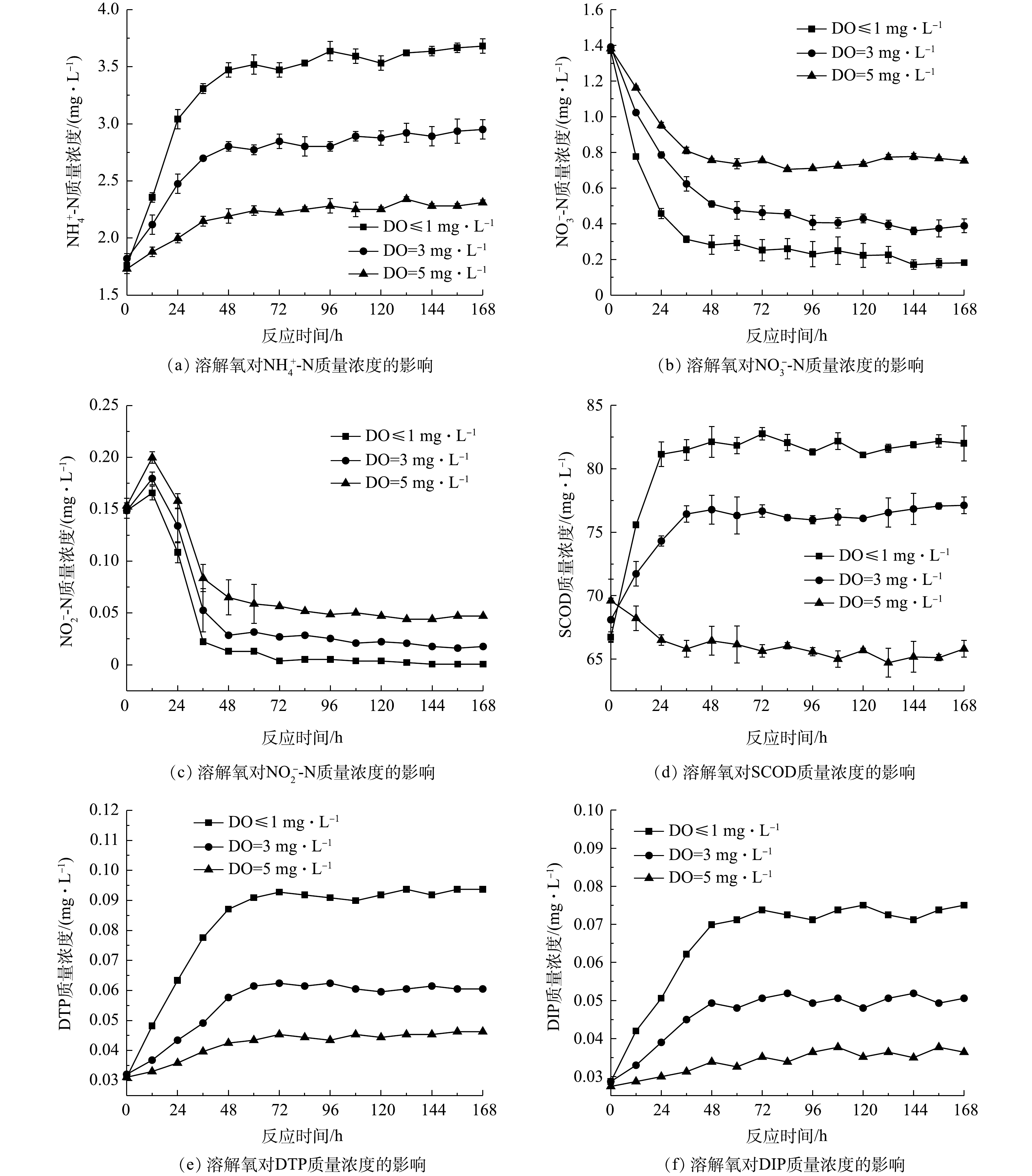
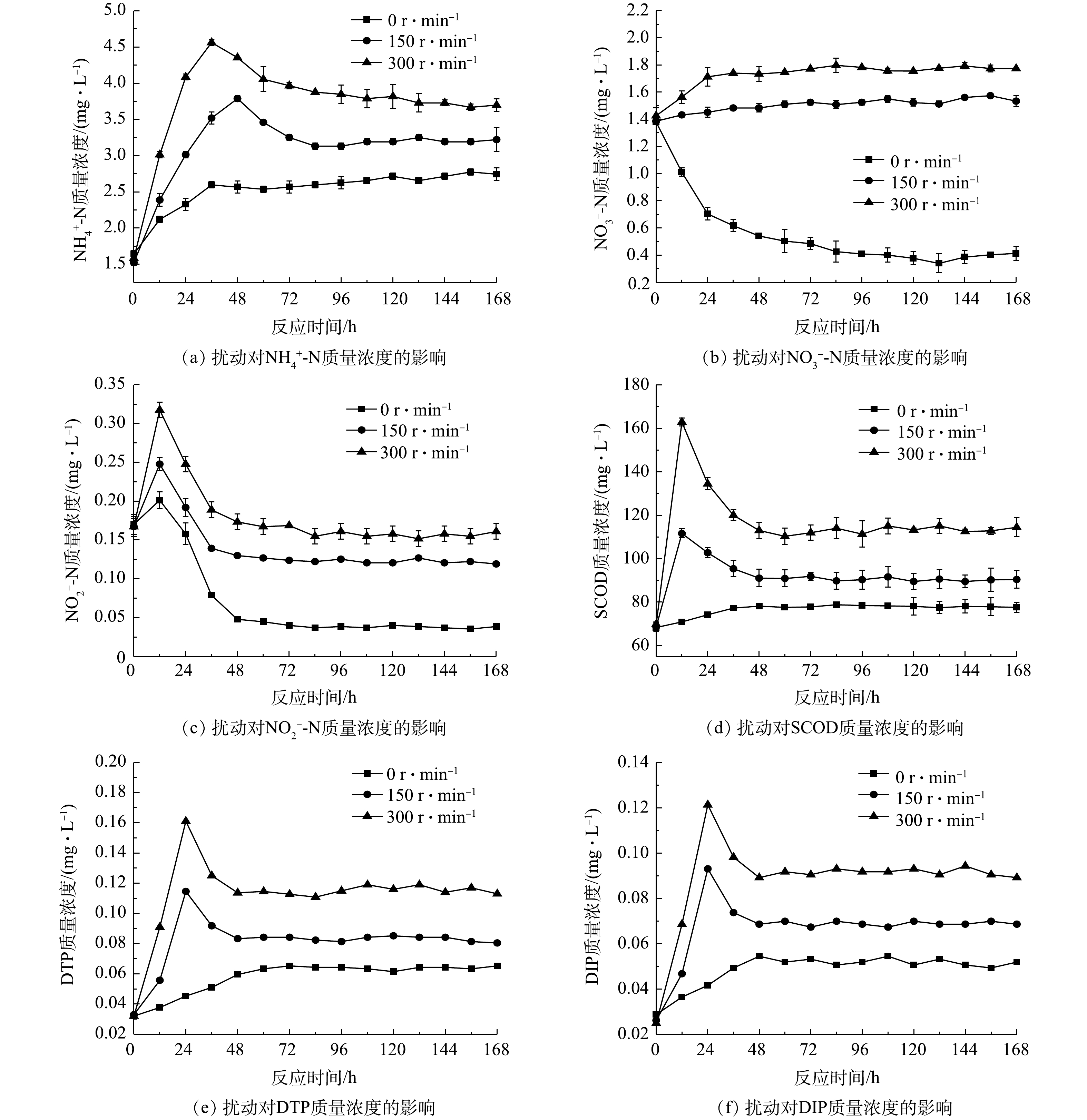
1)不同溶解氧水平下污染物交换特性。各实验组污染物平均交换通量见表1,上覆水污染物浓度随时间变化见图3。由图3(a)~(c)可知,
NH+4 -N质量浓度随反应时间逐渐升高,NO−3 -N质量浓度逐渐降低,而NO−2 -N质量浓度在实验初期经短时升高后迅速降低。这可能是由于静置状态下沉积物内部处于缺氧环境,Acinetobacter、Exiguobacterium等反硝化菌为优势菌属,氨氧化菌和亚硝酸盐氧化菌丰度较低,氮类物质的转化主要由氨化及反硝化过程主导[24]。Clostridiaceae菌在缺氧环境中具有很强的氨化能力,可将含氮有机物转化为NH4+ -N[25-26],从而促使体系中NH4+ -N质量浓度升高。体系中异化反硝化和同化反硝化具体过程[27]分别如式(2)~式(3)所示。实验初期,大量
NO−3 -N经反硝化生成NO−2 -N,导致NO−2 -N质量浓度短时升高,但随后由于NO−2 -N的反硝化速率大于生成速率,故其浓度迅速降低。由图3(d)可见,缺氧条件下SCOD质量浓度随反应时间逐渐升高,好氧条件下SCOD质量浓度逐渐降低。这可能是由于溶解氧较低时体系中还原态物质逐渐增多,并在浓度差的作用下向上覆水中释放;而好氧条件下微生物活性较强,对有机物的降解相对较快。
由图3(e)~(f)可见:磷质量浓度随反应时间逐渐升高,DTP峰值浓度为初始浓度的1.49~3.01倍,DIP峰值质量浓度为初始浓度的1.33~2.61倍。其中,上覆水DIP含量占DTP的78.2%~83.6%,说明上覆水中溶解态磷主要以无机磷为主。好氧条件下磷的释放强度低于缺氧条件,一是由于好氧环境中Pseudomonas、Arthrobacter、Anaerolinea等聚磷菌属[28]释磷过程受抑制,磷的生物释放强度减弱;二是由于此时表层沉积物中Fe2+被氧化为Fe3+,部分磷被Fe(OH)3胶体吸附发生沉积[29];三可能是由于好氧条件下,上覆水中较高浓度的
NO−3 -N作为电子受体也抑制了Fe-P的还原,从而一定程度上抑制磷的释放。这与BEUTEL等[30]的研究结果相似。由表1可见,
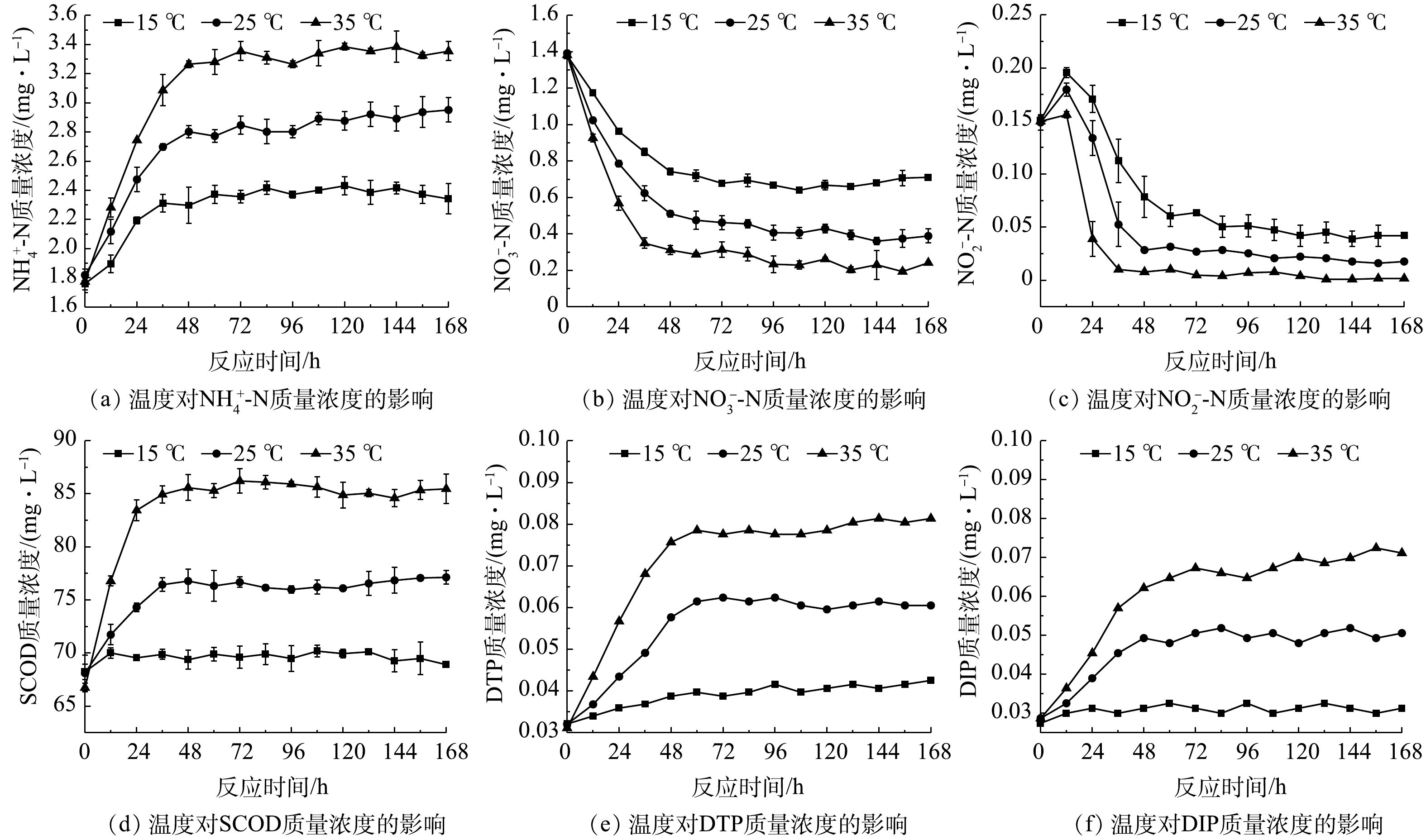
NH+4 -N平均交换通量为正值,硝态氮平均交换通量均为负值。这主要是由于体系中氨化作用较强而硝化作用较弱,NH+4 -N的生成速率总体上高于消耗速率的缘故;同时,硝态氮因反硝化作用不断被消耗,其生成速率低于消耗速率。好氧条件下SCOD质量浓度虽逐渐降低(图3(d)),但其交换通量依然为正值。这可能是由于沉积物中以兼性厌氧微生物为主,有机物降解速率较低,SCOD降解速率低于释放速率。体系中磷平均交换通量均为正值,随溶解氧的降低而升高,表明体系中磷的释放占主导地位。2)不同温度水平下污染物交换特性。各实验组上覆水污染物含量随时间变化见图4,平均交换通量见表2。由图4(a)~(c)可知,污染物质量浓度随时间的变化与溶解氧组相似。温度对氮类物质转化的影响主要体现在两方面,一是温度升高,沉积物中微生物活动随之增强,加速体系中氧的消耗,从而促使有机氮氨化及扩散过程加快[21];二是高温为反硝化过程提供了低溶解氧环境与最适温度,体系中反硝化作用增强[27]。由图4(d)可知,高温时SCOD质量浓度升高较明显。这可能是由于高温能促使沉积物中有机物释放,而沉积物中微生物以兼性厌氧型为主,温度的升高对有机物氧化速率的促进作用较弱。由图4(e)~(f)可见,上覆水磷的质量浓度随温度升高而增加。这是因为温度升高促进沉积物中Pseudomonas、Arthrobacter等聚磷菌释磷,以及Fe结合态磷的释放[31];且随着温度升高,磷酸盐的解吸作用增强[32]。
由表2可知,
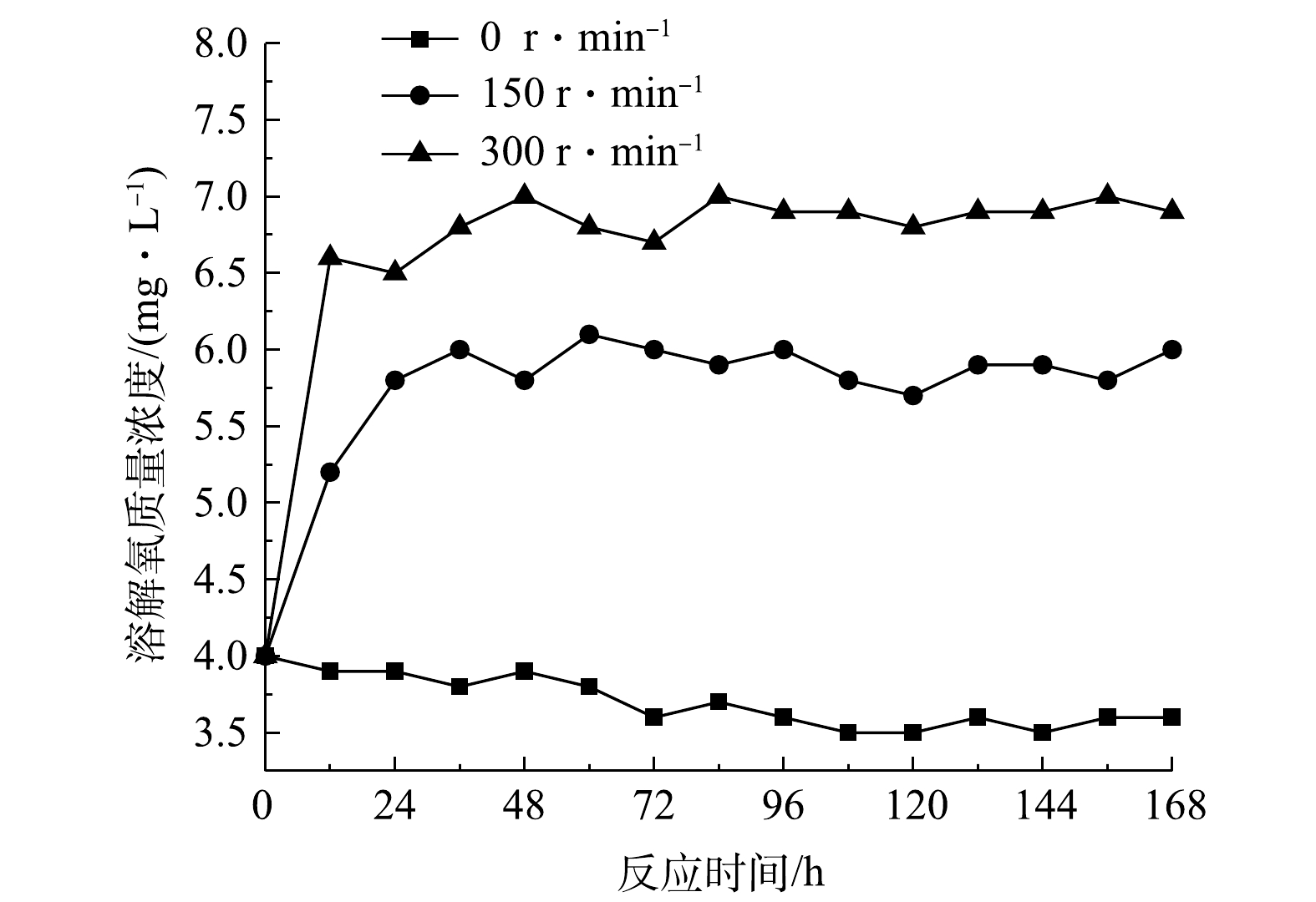
NH+4 -N、SCOD、DTP和DIP的平均交换通量均为正值,并随温度的升高而升高,而硝态氮交换通量为负值。这可能是由于此时体系中硝态氮同样因较强的反硝化作用不断被消耗,总体上其消耗速率大于生成速率的缘故。3)不同扰动强度下污染物交换特性。各实验组上覆水溶解氧质量浓度随时间变化见图5,污染物含量随时间变化见图6,平均交换通量见表3。由图5可知,静置组溶解氧质量浓度随反应时间的增加逐渐降低,而扰动组溶解氧始终保持在较高水平,持续的水力扰动增加了泥水混合体系中的氧含量。除图6(b)外,扰动组上覆水污染物质量浓度均呈先升高后降低的趋势。这可能是由于扰动促使沉积物间隙水中高浓度污染物的释放,致使上覆水污染物质量浓度在短时内显著升高[32-33],从而出现明显的初始冲刷现象。
图6(a)~(c)中,扰动组上覆水中
NH+4 -N、NO−3 -N和NO−2 -N质量浓度达到平衡时,其浓度值分别为静置组平衡状态下的1.17~1.35、3.73~4.32和3.05~4.13倍。其中,NH+4 -N和NO−2 -N质量浓度先升高后降低,而NO−3 -N质量浓度升高后未明显下降。这可能是由于此时体系中氧浓度较高,硝化反应处于主导地位,NH+4 -N和NO−2 -N不断被氧化为NO−3 -N,NO−3 -N较稳定从而出现累积。由图6(d)可知,扰动对上覆水SCOD的影响较为明显,实验开始12 h左右扰动组SCOD即达到峰值,其质量浓度达到平衡时为静置组的1.17~1.48倍。强扰动条件下SCOD质量浓度下降速率较快。其原因可能是此时微生物对有机物的降解速率较低扰动条件下更高。由图6(e)~(f)可知,扰动组中磷质量浓度均先升高后降低。这可能是由于持续的扰动使得部分磷重新被沉积物吸附[32],或被聚磷菌摄入用于生命体的合成的缘故。对比图3(c)、图4(c)和图6(c)可知,3种条件下
NO−2 -N质量浓度变化趋势虽相同,但其内在的驱动机制有所区别。对水体施加扰动后,沉积物间隙水中NO−2 -N的释放致使上覆水中NO−2 -N质量浓度短时升高,后由于NO−2 -N易被进一步氧化成NO−3 -N而降低,直至上覆水中NO−2 -N的生成与消耗达到平衡,此过程中NO−2 -N质量浓度的变化主要受硝化作用的影响,而静置条件下各实验组NO−2 -N质量浓度的变化主要受反硝化作用的影响。由表3可知,
NH+4 -N、SCOD、DTP和DIP的平均交换通量均为正值,且随扰动的增强而增加。静置组硝态氮平均交换通量为负值,而扰动组其平均交换通量为正值。这可能是由于施加扰动后,体系处于有氧环境,Acinetobacter、Exiguobacterium等反硝化菌活性受到抑制,硝态氮消耗速率降低。此时在Crenarchaeota、Nitrospirae和Nitrospinae等硝化细菌的作用下,NH+4 -N逐步被氧化为NO−3 -N[27],致使上覆水中硝态氮生成速率高于其消耗速率。扰动同样使得上覆水SS质量浓度增加,加大了颗粒物与水的接触为硝化反应提供了大量活性位点[34]。余晖等[35]的模拟实验结果表明,水体中硝化过程速率与颗粒物含量呈正相关。 -
实验结束后各组沉积物中污染物释放率见图7。由图7可知,沉积物中各污染物释放率随环境因子变化的规律相似,但相同条件下不同污染物释放率存在一定差异,其中磷的释放率最低,而硝酸盐氮释放率最高。整体来看,SCOD释放率为4.1%~26.3%;
NO−3 -N释放率最大,为91.2%~95.3%,NH+4 -N释放率为9.7%~47.2%;TP释放率为1.6%~18.8%,其中以Fe/Al-P为主。当扰动强度为300 r·min−1时,沉积物中污染物释放率均达到最大,SCOD、NH+4 -N和TP的释放率分别为静置时的1.44、3.28和2.69倍。
2.1. 沉积物微生物种群结构分析
2.2. 环境因素对污染物交换特性的影响
2.3. 沉积物中污染物释放情况
-
1)研究区域中雨水管道沉积物-水界面污染物交换通量随溶解氧质量浓度的升高而降低,而随温度的升高而升高。静置时水体中硝态氮主要表现为被消耗,其余污染物表现为从沉积物中释放;对水体施加扰动后,所有污染物均表现为向上覆水体释放,且交换通量随扰动的增强而增加。
2)研究区域中雨水管道沉积物中优势菌门主要有7种,包括与氮磷转化密切相关的变形菌门、绿弯菌门、放线菌门、厚壁菌门等,优势菌种主要为反硝化菌和聚磷菌。未施加扰动时,沉积物中氮的生物转化以氨化与反硝化过程为主。
3) 研究区域中雨水管道沉积物中磷释放率较低,在管道沉积物中易出现富集现象;有机物释放率次之;氮易于在生物化学作用下发生转化,释放率较高,其中硝酸盐氮释放率最大。沉积物中磷的释放形态以Fe/Al-P为主。










 下载:
下载: