-
近年来,基于亚硝化的新型脱氮技术,如亚硝化-厌氧氨氧化(SHARON-ANAMMOXA)、全程自养脱氮(CANON),较传统的硝化反硝化技术能够在脱氮过程中节省曝气能耗和有机碳源[1],引起了学术界的广泛关注。这些新型脱氮技术的关键是亚硝化的实现。目前。常见的实现亚硝化的策略有低DO[2-3]、高温[4]、高FA浓度[5]、高FNA[6]、高pH[7]及合适的泥龄[4]。然而,亚硝化很难实现长期稳定运行,尤其是在低浓度废水中。在低浓度废水中,氨氮浓度低,难以采用高FA及FNA抑制NOB,实现亚硝酸盐的积累。且在主流废水中,有机物、pH、温度等因素都会对亚硝化造成不利影响。
生物膜具有抗冲击负荷、污泥产量低、运行稳定、无污泥膨胀等优点。生物膜系统已被证实可以在低浓度废水中实现亚硝化的稳定运行[8]。且生物膜系统泥龄长,适合硝化细菌生长,同时底物在生物膜中的浓度梯度也可抑制了NOB的活性。在亚硝化生物膜系统中,微生物会在填料表面附着生长,生物膜的厚度使得生物膜不同深度有不同的环境,微生物分布也不同。因AOB对氧的亲和力高,所以AOB一般分布于生物膜外表面,NOB位于较内层[9]。采用限氧策略(DO/
NH+4 )能够在生物膜系统中实现亚硝化。通过控制DO/NH+4 的值,使得生物膜表面形成一层耗氧屏障,抑制亚硝酸盐氧化,达到实现亚硝化的目的[10-11]。然而,以往的研究大多基于活性污泥法研究亚硝化的实现及稳定运行,对在低氨氮浓度下亚硝化生物膜的挂膜过程、微生物的种群空间结构及其稳定运行研究较少。本研究中,接种实验室培养好的亚硝化絮体污泥,在完全混合式反应器中加入填料,用以处理低浓度废水。维持反应器内DO恒定,通过改变反应器的HRT控制反应器内剩余氨氮的浓度,研究了DO/
NH+4 策略对系统亚硝化的影响,期间,对反应器性能及填料挂膜过程进行了系统地分析,并对生物膜中细菌种群结构进行了分析,以期为进一步推进亚硝化生物膜技术的工程化应用提供参考。
全文HTML
-
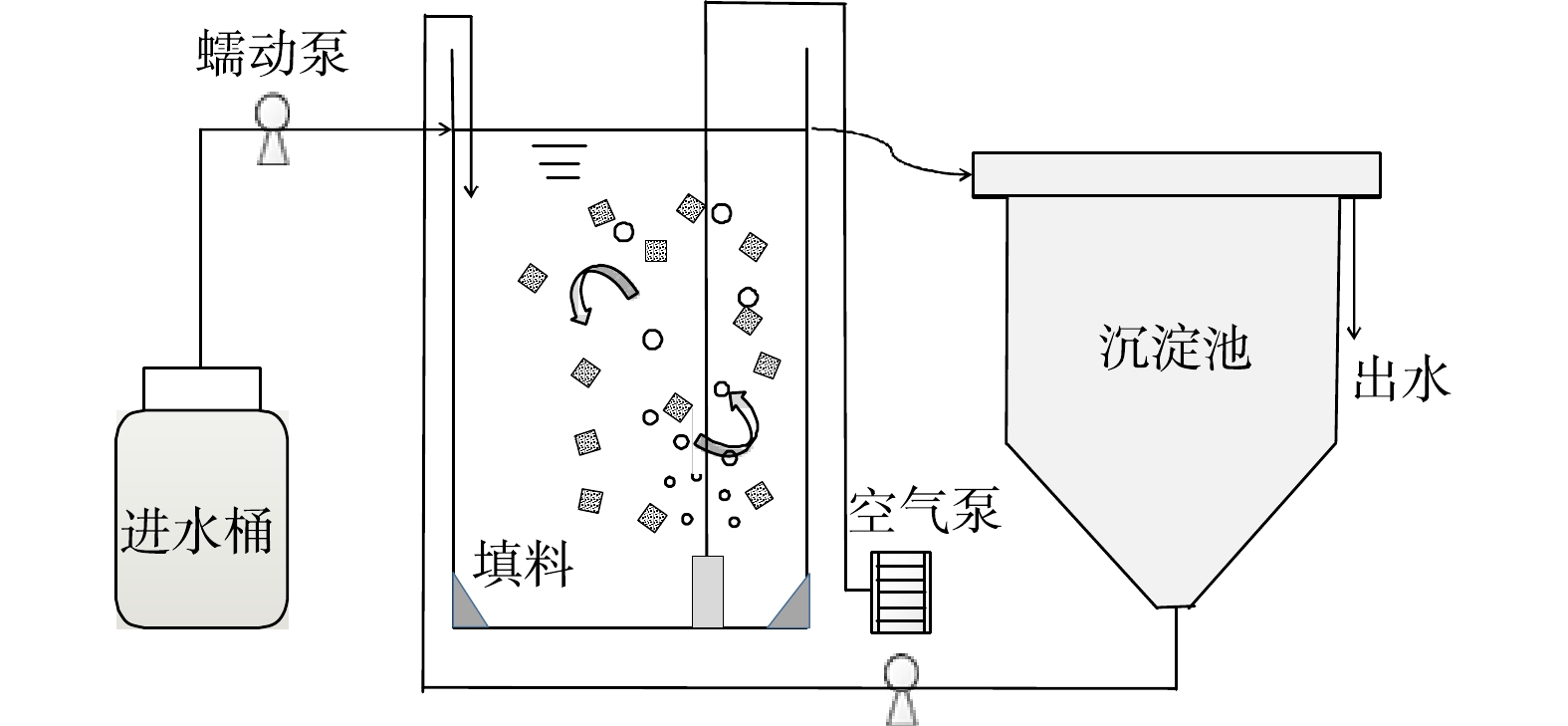
实验所用装置如图1所示,由有机玻璃制成,有效体积为3.3 L。反应器底部设有曝气装置,为反应器提供溶解氧及循环动力。实验运行1~5 d沉淀池中絮状污泥每隔2 h回流到前端反应器中,通过时间继电器控制污泥的回流。之后撤去沉淀池,絮体随出水流出反应器。将完全混合式反应器置于水浴缸中,温度控制在(30±1) ℃。反应器DO在3~4 mg·L−1,pH为7.8~8.2。反应器运行分为5个阶段,具体参数见表1。
-
实验用水采用人工配置的无机含氮废水,氨氮的质量浓度(以N计)为50 mg·L−1,用碳酸氢钠调节进水pH为8.0。配水中还包括磷酸二氢钾、氯化钙、硫酸镁及适量的微量元素[12]。接种污泥为实验室培养的亚硝化絮状污泥,亚硝积累率约为70%。
实验采用填料为多孔凝胶填料,其为高分子复合材料,比表面积≥4 000 m2·m−3,孔隙率为98%,大小为2 cm×2 cm×2 cm,将其平均分为8份投加到反应器中,投加的填料体积占反应器有效体积的10%。
-
温度、DO和pH分采用哈希便携式溶解氧测定仪(HQ30d)测定;
NH+4 -N测定采用纳式试剂光度法,NO−2 -N采用N-(1-萘基)乙二胺光度法,NO−3 -N采用紫外分光光度法。生物膜表面污泥采用扫描电镜和数码相机观察。对生物膜及接种污泥进行高通量测序(委托上海生工进行测试)。亚硝酸盐积累率(nitrite accumulation rate,NAR)的根据式(1)进行计算。式中:ηNAR指亚硝酸盐积累率;
ρNO−2 和ρNO−2 分别为亚硝酸盐及硝酸盐质量浓度,mg·L−1。 -
批次实验在原反应器中进行,将反应器中的填料及絮体污泥取出,用去离子水清洗3次后放入反应器中。批次进水为实验用水,DO保持在2 mg·L−1左右,pH保持在8左右。反应过程中采用梯度时间检测混合液的氮素含量,比氨氮氧化速率、比亚硝酸盐产生速率及比硝酸盐产生速率可根据式(2)~式(4)[13]计算。
式中:
μNH+4-N 、μNH+4-N 、μNH+4-N 分别为比氨氮氧化速率、比亚硝酸盐产生速率及比硝酸盐产生速率,mg·(L·h)−1;∆CNH+4-N 、∆CNO−2-N 、∆CNO−3-N 分别为反应器中NH−4 -N、NO−2 -N、NO−3 -N的质量浓度变化,mg·L−1;∆t为各参数值呈线性变化的时间段,h;V为反应器有效体积,L。 -
扫描电镜观察前填料的前处理过程如下:从CSTR反应器中任意取1个填料,用灭过菌的磷酸缓冲液清洗3次;加入2.5%的戊二醛5 mL,在4 ℃下固定12 h;将戊二醛弃去,用磷酸缓冲液清洗3次(每次10 min),依次用5%、10%、20%、30%、50%、70%、90%的无水乙醇进行脱水(每次10 min),再用100%的乙醇脱水3次(每次10 min),洗脱梯度不可逆;所有污泥样品均置于滤纸上自然晾干,用电解质固定在铝板上,喷金后观察。
1.1. 实验装置与运行
1.2. 实验用水、污泥来源及填料
1.3. 分析方法
1.4. 批次实验
1.5. 扫描电镜
-
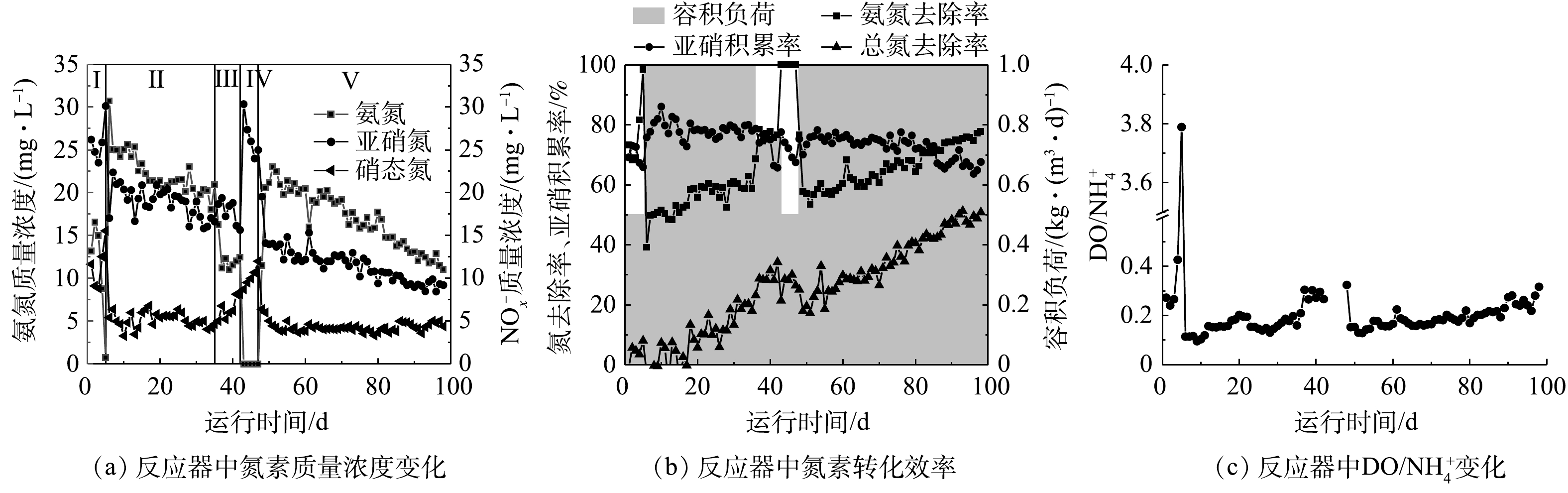
将填料加入反应器后,通过曝气实现填料在反应内的循环流动,保证微生物不断摄取水中的DO和氨氮。反应器中的进水氨氮质量浓度维持在50 mg·L−1左右,DO维持在3 mg·L−1,通过缩短HRT控制反应器中较高的剩余氨氮质量浓度,将反应器中DO/
NH+4 在较低的范围内,以保证挂膜期间反应器亚硝化效果。生物膜的生长是一个动态过程,包括初始生物量(微生物的附着)、生长、成熟[14-15],在实验中可根据填料的表观变化(图2),判断生物膜的生长情况。在反应第Ⅰ阶段(1~5 d),HRT为4 h,氨氮容积负荷控制在0.5 kg·(m3·d)−1,此阶段为微生物附着阶段,反应器运行3 d后,有部分絮体污泥被截留在填料内部(图2(b))。填料特殊的墙体结构及巨大的比表面积能吸附微生物,从而使得絮体污泥能够迅速进入并停留在填料中。除被截留在填料内部的絮体,剩余絮体随出水很快进入沉淀池,并在沉淀池与反应器中循环流动。反应器内亚硝酸盐质量浓度为23~30 mg·L−1,出水硝酸盐质量浓度为8~16 mg·L−1,亚硝酸盐积累率(NAR)保持在65%以上。但反应器氨氮去除率由72.69%快速上升至100%。为保证反应器中有剩余氨氮存在,且DO/
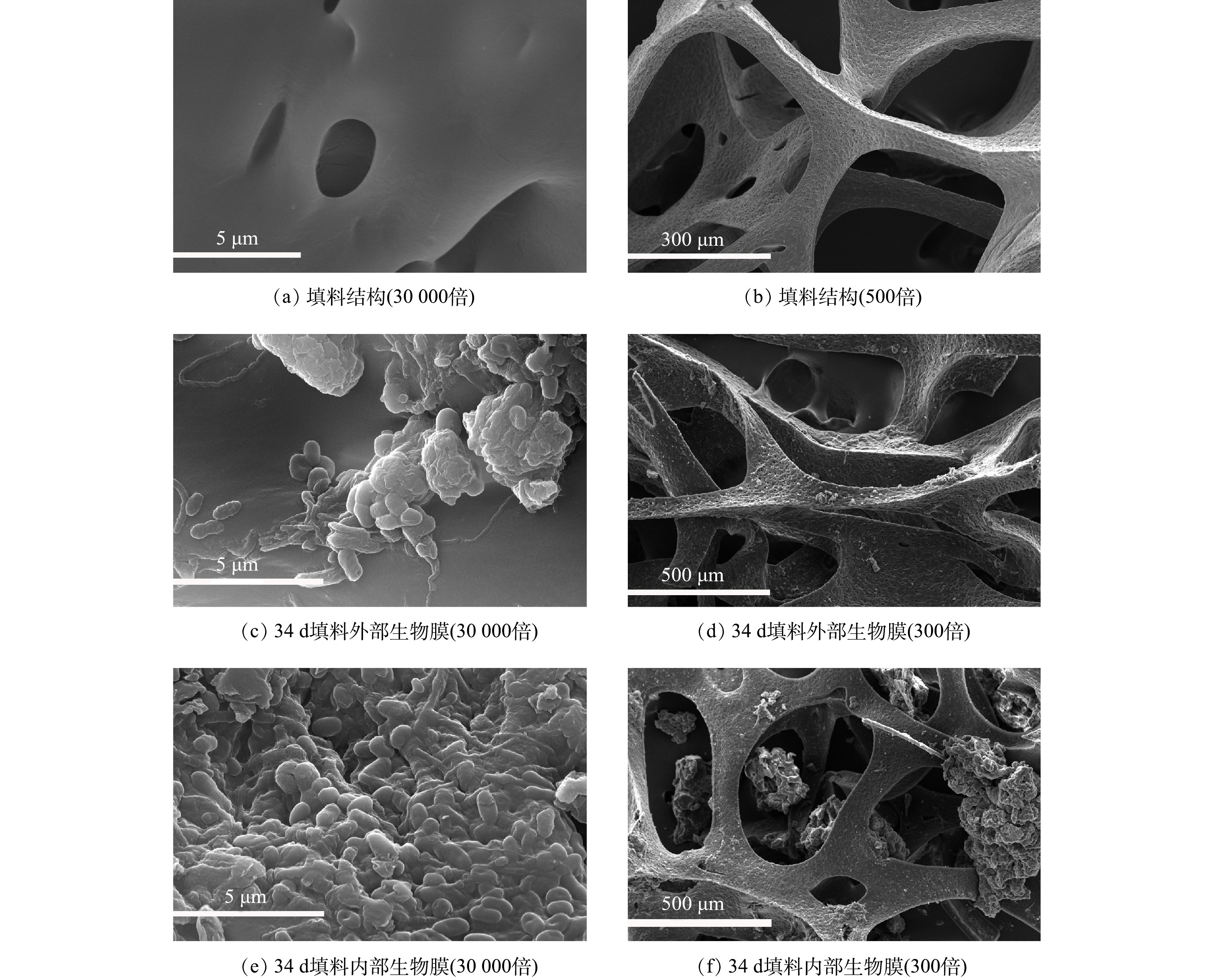
NH+4 值在较低范围内和维持反应器亚硝化效果,将反应器HRT缩短至2 h(第Ⅱ阶段)。在反应第Ⅱ阶段(6~35 d),HRT为2 h,氨氮容积负荷为1 kg·(m3·d)−1,此阶段包含生物膜的生长期和成熟期。在生长期,絮状污泥从反应器中排出后,适应环境的微生物在填料内大量繁殖,填料内部积累的生物量可以生长成小的斑片状生物膜或微菌落。填料颜色加深,微生物由填料内部逐渐生长至外部(图2(c)),之后微生物进一步发展形成连续的生物膜,最终覆盖整个载体。填料内聚集了大量微生物,随着生物量增加,填料颜色加深,变为棕红色,生物膜成熟(图2(d)),30 d时填料挂膜成功。
此阶段反应器亚硝酸盐积累率(NAR)维持在70%以上,最高达86.13%,亚硝化效果最好。反应6 d时硝酸盐质量浓度由15.56 mg·L−1快速下降达5.40 mg·L−1,这说明剩余氨氮的存在有效抑制了亚硝酸盐的氧化。反应过程中氨氮去除率逐渐升高,由39.19%逐渐上升至62.96%,这说明填料中的微生物能够适应环境不断生长。如图2(d)所示,生物膜成熟,填料内外逐渐形成好氧、缺氧、厌氧环境,亚硝化生物膜工艺启动成功。史晓林等[16]在MBBR中采用填充K2和多面空心球填料进行挂膜,于60 d时生物膜成熟。刘小锦等[17]采用低DO下启动升流式生物膜反应器,于93 d时完成挂膜。与之相比,本研究中的填料挂膜及启动速度较快。其原因有以下2点:首先,实验所采用的的填料比表面积大、孔隙率高,易于微生物附着生长,易于挂膜;其次,实验所采用的DO质量浓度高,微生物生长快速。目前的研究结果已证实,低DO策略能够实现亚硝化,但在较低的DO质量浓度下,AOB及NOB的代谢活性均会降低,且在长期运行中NOB会逐渐适应低DO环境,导致亚硝化的失败。有研究结果[18]表明,当DO质量浓度由2.5 mg·L−1降到0.5 mg·L−1时,Nitrospira丰度有所增加,由0.056%增加到3.2%,亚硝化转为完全硝化。本实验中反应器内较高的DO质量浓度,使得反应初期微生物生长繁殖迅速,加快了填料上生物膜的形成,同时较低的DO/
NH+4 比值保证了亚硝化的稳定维持。此外,由图3(a)和图3(b)可知,随反应器的运行,反应器内亚硝酸盐质量浓度及剩余氨氮质量浓度均逐渐降低,总氮(TN)去除率逐渐增加至20.40%。推测这是由于生物膜内部厌氧氨氧化菌得到富集,存在厌氧氨氧化反应,消耗了反应器中的亚硝酸盐和氨氮。为进一步观察填料挂膜情况,选取了34 d时的生物膜进行扫描电镜,填料的SEM图像(图4)显示,34 d时填料外部微生物量明显低于内部。这可能是因为填料外部受空气和水流的剪切力影响较大,微生物不易附着,生物量少。因填料特殊的多孔结构,内部所受剪切力小,易于微生物生长繁殖。填料内部微生物量丰富,多为短杆状。且内部空间出现类似于颗粒污泥的大污泥聚集体。
-
目前,采用限氧策略(DO/
NH+4 )可在生物膜系统或颗粒污泥系统中实现亚硝化[19-21]。有研究结果[22-23]表明,当反应器出水中有氨氮剩余时,亚硝酸盐开始积累;当剩余氨氮质量浓度增加时,亚硝酸盐积累率增加。通过控制反应器中氨氮容积负荷改变反应器中剩余氨氮质量浓度,使DO/NH+4 比值在不同范围内。本研究中高浓度的剩余氨氮保证了低DO/NH+4 比值,同时保证了填料外部AOB不断消耗溶解氧,内部NOB所能利用的溶解氧有限,从而有效抑制了NOB。为验证是否是低DO/NH+4 比值控制亚硝化,调节反应器HRT分别为3 h和4 h,使反应器中DO/NH+4 出现变化,即为第Ⅲ和第Ⅳ阶段。在反应第Ⅲ阶段(36~42 d),HRT为3 h,氨氮容积负荷为0.75 kg·(m3·d)−1,氨氮去除率明显增加,达到76.64%。此阶段DO/NH+4 比值增加,为0.20~0.31(图3(c)),亚硝积累率呈现下降趋势,由78%降至65%,在第41天时亚硝积累率降幅明显。反应第Ⅳ阶段(43~47 d),HRT为4 h,氨氮容积负荷为0.5 kg·(m3·d)−1,氨氮去除率为100%。剩余氨氮为0 mg·L−1,NAR由78.76%下降到65.76%。其中亚硝酸量质量浓度先增加后降低,降幅明显,硝酸盐质量浓度进一步增加。因此,亚硝化是通过控制DO/NH+4 的值以稳定维持,实验中当DO/NH+4 小于0.2时,能稳定维持亚硝化。BARTROLI等[20]在连续流颗粒污泥反应器中通过控制DO/NH+4 以实现亚硝化,与本研究所得结果相似。在第Ⅲ、Ⅳ阶段反应器中的NAR有所下降,为保证反应中的亚硝化效果,同时研究在长期运行条件下,DO/
NH+4 策略对亚硝化的控制效果,将反应器HRT调回2 h,即第Ⅴ阶段。该阶段氨氮和亚硝酸盐的质量浓度持续降低,但亚硝酸盐积累率在85 d时仍保持在70%以上,在86~98 d内保持在65%以上,这说明该策略能有效维持亚硝化效果。此外,反应器中总氮去除率逐渐增加至50.87%,厌氧氨氧化菌得到进一步富集。在本研究中,填料表观颜色加深(图2(e)),同时填料内出现产气现象,导致填料浮在水面,这说明反应器中的亚硝化生物膜逐渐向CANON生物膜转变。付昆明等[24]在好氧条件下启动CANON工艺,将填料内出现产气的现象视为CANON工艺启动成功的标志之一,这与本研究结果相似。 -
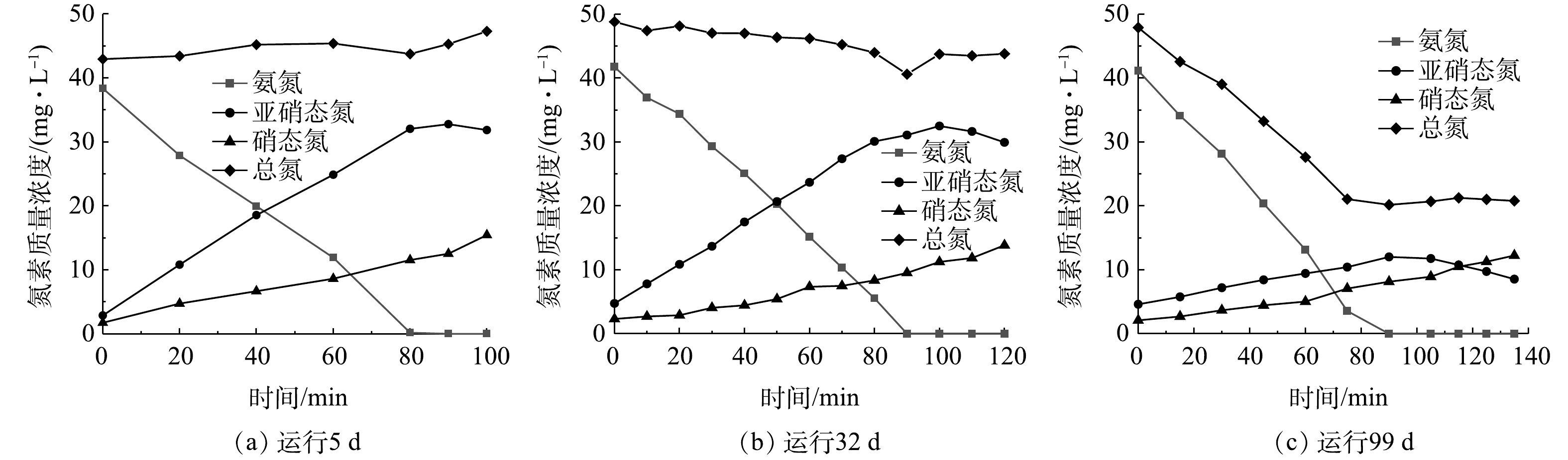
填料中硝化菌群的分层分布使得反应器中亚硝积累率维持并略有提升。通过批次实验,可以分析填料内部硝化细菌的情况。在反应进行5、32、100 d时进行实验,结果如图5所示。根据式(2)~式(4)并结合图5中的氮素质量浓度变化计算得出,氨氧化速率分别为8.68、8.23、9.12 mg·(L·h)−1,没有明显的变化。亚硝酸盐产生速率由5 d的6.6 mg·(L·h)−1降为100 d的1.4 mg·(L·h)−1,这可能是由于在实验过程中厌氧氨氧化菌消耗亚硝酸盐,致使
NO−2 质量浓度有所降低。由图5(c)可知,总氮在0~90 min下降,但当氨氮被完全消耗时,总氮不再下降,这说明厌氧氨氧化菌利用氨氮和亚硝酸盐使总氮得到去除。这与上述所推测的即厌氧氨氧化菌的存在消耗了亚硝酸盐,从而导致比亚硝酸盐产生速率降低的结果一致。氨氧化结束后比硝酸盐产生速率分别为5.31、2.37、1.66 mg·(L·h)−1,这说明随着反应进行,填料上富集的微生物增多,传递到内部的氧的量有所降低,致使填料内部的NOB受到的抑制程度更高[25],导致NOB活性下降。 -
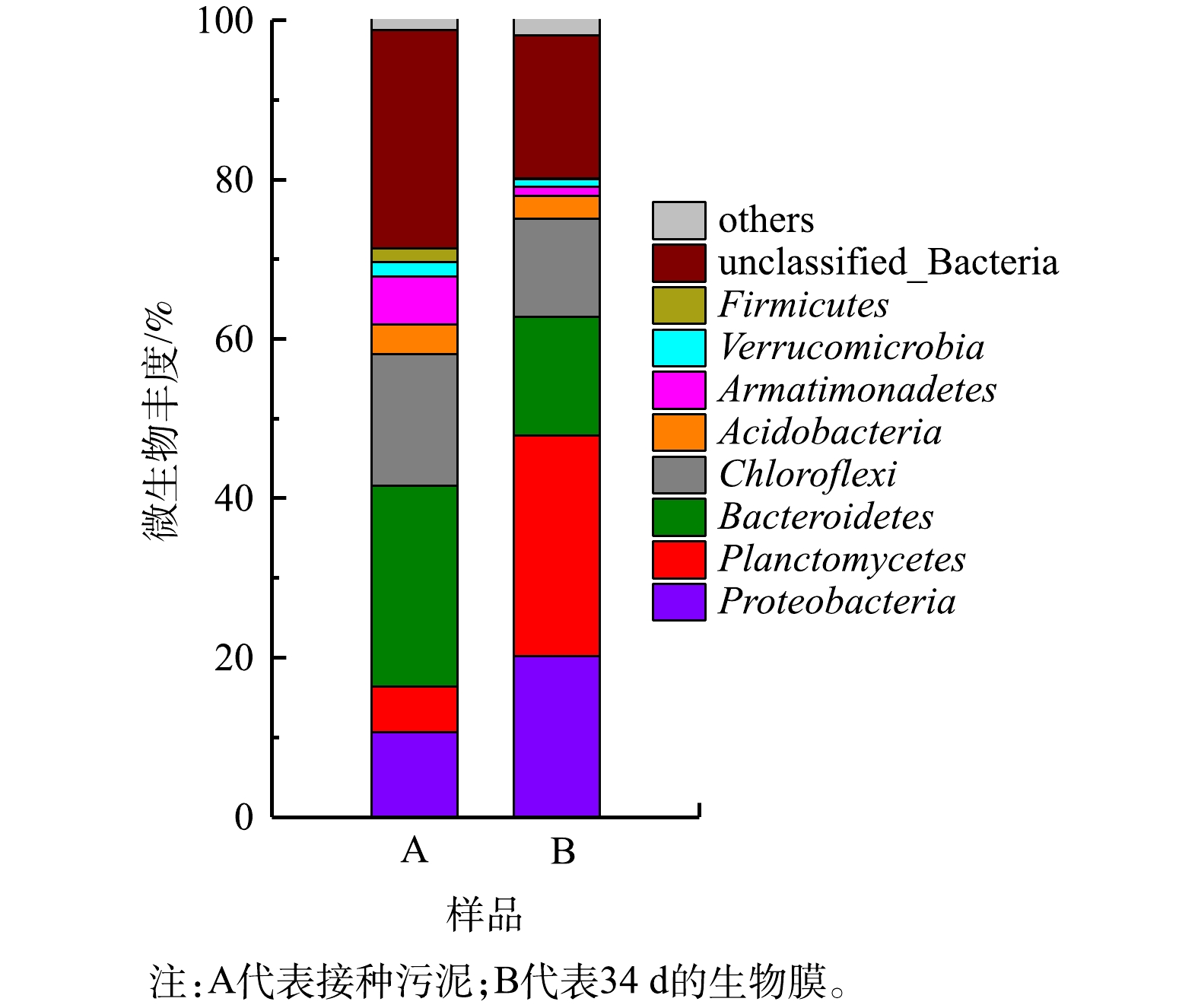
图6为微生物测序在门水平下的微生物群落多样性分析结果。主要包括变形菌门(Proteobacteria)、浮霉菌门(Planctomycets)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、酸杆菌门(acidobacteria)、装甲菌门(Armatimonadetes)、疣微菌门(verrucomicrobia)、厚壁菌门(firmicutes)。涉及到脱氮功能微生物的变形菌门丰度由10.63%增加至20.20%。厌氧氨氧化菌所在的浮霉菌门丰度则由5.70%增加至27.70%。
为进一步分析反应器中微生物种群变化,对属水平样品功能微生物及优势种群进行了分析。选取具有代表性的AOB与NOB(Nitrosomonas和Nitrospira)分析微生物种群变化[26-27]。由表2可知,生物膜中Nitrosomonas丰度为0.45%,同时,根据AOB/NOB的比值,生物膜中AOB/NOB的比值为3.03,生物膜中主要富集了AOB,而NOB较少。这说明,在长期运行中,生物膜表面形成了一层耗氧屏障,NOB因处于生物膜内层,逐渐被抑制淘汰。除了AOB和NOB之外,还存在有硝化作用的其他细菌,Acinetobacter一般被认为异养硝化菌[28-30]。在本研究中,Acinetobacter在生物膜中逐渐富集,丰度由0.14%达到了2.57%。因进水无碳源存在,可推测Acinetobacter利用老化的生物膜作为碳源进行异养硝化。
值得一提的是,反应器中厌氧氨氧化得到富集。其中Candidatus_Kuenenia丰度最高。生物膜中Candidatus_Kuenenia丰度达到25.13%。随着反应进行,填料上的微生物不断生长繁殖,生物膜厚度不断增加,填料内部形成厌氧环境,利于厌氧氨氧化菌生长富集。ZHANG等[31]的研究结果也表明,生物膜中存在厌氧氨氧化菌,对NOB的抑制促进了厌氧氨氧化反应的发生。本次实验中填料中厌氧氨氧化菌的快速及大量富集。原因可能有2个:首先接种的污泥本身存在厌氧氨氧化菌,丰度为4.05%;其次是因采用的填料(10 mm×10 mm×10 mm)尺寸较大,内部厌氧空间远大于依靠生物膜厚度形成厌氧环境的填料,适合厌氧氨氧化菌生长的空间大。有研究结果[32-33]表明,较大的载体(15 mm×15 mm×15 mm)可以为厌氧氨氧化菌在外围空间的附着提供更大的空间,可以缓解阻扰效应。AHMAD等[34]研究多孔载体尺寸(聚氨酯基)对同步硝化反硝化系统处理效果的影响时发现,总氮去除率由高到低为15 mm>10 mm>5 mm。因此,在厌氧氨氧化-MBBR体系中,应采用较大的载体,但最佳载体尺寸尚有待进一步研究。硝化细菌丰度不高的原因可能是由于填料上好氧区域较小,硝化细菌仅占据填料表面空间,数量上要远少于厌氧氨氧化菌。
2.1. 填料的快速挂膜及水质变化
2.2. 反应器运行效能
2.3. 功能微生物的活性分析
2.4. 微生物分析
-
1)多孔凝胶填料因其孔隙率高,比表面积大能截留絮体污泥,利于填料挂膜。反应第3天时填料内部出现絮状污泥,之后微生物从填料内部向外生长,逐渐覆盖整个填料,填料颜色不断加深,至第30 d时生物膜成熟。
2)在低基质浓度(50 mg·L−1
NH+4 -N)进水的反应器中,通过控制DO/NH+4 能实现亚硝化的稳定维持,当DO/NH+4 值在0.09~0.20时,亚硝化效果最好,NAR最高能达到86.13%,NOB活性下降;随着DO/NH+4 的值增加,亚硝积累率有所下降。3)填料中存在分层结构,表面为AOB,中间是NOB,内部是厌氧氨氧化菌。
4)生物膜上AOB丰度是NOB的3倍,AOB占主导地位。此外,生物膜还存在厌氧氨氧化菌,丰度由4.05%增加到25.13%。















 下载:
下载: