-
菌藻共培养系统利用菌藻之间的共生关系来低成本地进行污水处理和产油脂藻类的生产近年来受到了越来越多的关注[1-3]。能进行光合作用的微藻或蓝细菌在有光和CO2的情况下将营养物质吸收到它们的生物体中,产生O2,供异养细菌用于氧化废水中的有机物质。异养细菌产生的CO2可以被微藻和蓝细菌吸收利用。这样不仅可以减少污水处理时的能源消耗和CO2的排放,也更有利于污染物质N、P的回收。在共培养系统中,不同的接种量、操作条件、废水组成和反应器配置等因素对污染物去除和生物量的生长有一定的影响[4]。废水中污染物质组分和菌藻接种量对废水处理效果的影响已在多项研究中[5-6]得到报道。JI等[5]研究发现,当小球藻与地衣芽孢杆菌质量比为1∶3时,干细胞质量和叶绿素a累积均达到最高值,第10天时,体系分别去除了86.55%、80.28%和88.95%的溶解性COD、总磷和总氮。与单一微藻系统相比,添加细菌后的共培养体系对COD、总氮和总磷的去除效率分别提高了22.1%、20%和8.1%[6]。
然而,微藻与细菌共培养体系在生物量收获方面仍无法克服固有的障碍。收获生物质的传统技术是混凝和离心分离,这些传统技术的效率不高,但运行成本却很高。添加活性污泥可以解决微藻沉降和生物质收获的缺点,与微藻相比,活性污泥具有更好的沉降能力,对COD的去除率也比单一或单独几种细菌高[7]。因此,一些研究将微藻与活性污泥相结合,形成泥藻共培养体系[1,4,8-9]。NGUYEN等[1]认为,在3∶1(小球藻∶活性污泥)的比例下,总生物产量和COD去除率最高,微藻在生物同化脱氮过程中起主导作用,而活性污泥则是提高COD去除率的主要因素。SU等[8]发现,当泥藻接种比为1∶5时,对N和P的去除率最高(分别为91.0%和93.5%),同时藻类对COD去除率没有影响。在另一项研究中,活性污泥和小球藻的最佳比例为1∶2,此时对城市污水处理的效率最高[9]。之所以前期研究得出的最佳泥藻比各不相同,可能是因为废水组成和微藻种类的差异。NGUYEN等[1]研究中的是高负荷浓度(COD 500 mg·L−1、
NH+4 -N 200 mg·L−1和总磷45 mg·L−1)的人工合成废水和悬浮小球藻/泥系统;SU等[8]研究的是实际生活废水(COD 380 mg·L−1、总氮50 mg·L−1和PO34 8 mg·L−1)和混合微藻/泥系统,而MUJTABA等[9]研究的是低浓度的合成废水(COD 60 mg·L−1、NH+4 -N 50 mg·L−1和总磷1.3 mg·L−1)和固定化小球藻/污泥系统。因此,较少有研究利用混合藻类和活性污泥处理实际废水[2,8],也鲜有研究涉及多种微生物(菌藻)在处理实际废水的微型生态系统中的作用[2]。混合微藻(光合细菌和藻类)可直接在污水厂二沉池池壁获得,其获得成本和难度比单一微藻要低得多;活性污泥中存在的多种细菌有些可促进藻类生长,如产生藻类所需的CO2和维生素,有些却可能会抑制藻类生长[10]。有研究结果[11]表明,光合细菌营养价值高、净化水质能力强,且具有增强动物抗病力的功能。光合微生物与其他异养微生物混菌共培养是近年来的研究热点,该体系弥补了光合微生物纯培养时易染菌、不稳定等缺陷,在污水处理、土壤改善、生物降解有害物质、生产高附加值产物方面拥有广阔的应用前景[12]。但是,这些混菌聚生体的应用仍旧存在一定的困难。比如,如何发现适应生物工程应用的混菌体系是当前需要解决的问题[12]。
实际废水比人工合成废水含有更复杂的成分,因此,采用混合泥藻系统处理实际生活废水,获得的优势混菌体系可适应工程应用。基于以上原因,本研究将混合微藻和好氧池活性污泥接种至光生物反应器中共培养来处理实际生活废水,在序批式运行方式下考察了泥藻对实际生活废水中碳和营养物质的去除能力,并利用高通量测序技术分析了稳定后系统中的优势微生物组成,以及他们之间的协同作用。
全文HTML
-
本实验采用的活性污泥取自漳州市开发区生活污水处理厂好氧池,混合藻类则取自该水厂的二沉池出水堰壁。取回的活性污泥和混合藻类分别静置2 h后去掉上清液,剩下的混合液分别作为菌、藻接种物。藻接种液中主要的藻类型在显微镜下观察为丝状微藻-蓝藻门鞘丝藻属,也有一些硅藻、栅藻等微藻。
实际生活废水取自该污水处理厂的沉砂池上清液,将其作为处理对象和营养物来源。实验期间废水水质指标为:化学需氧量(chemical oxygen demand,COD)为(265±9) mg·L−1,
NH+4 -N为(27±1.6) mg·L−1,PO3−4 为(1.8±0.3) mg·L−1,总磷(total phosphorus,TP)为(4±0.5) mg·L−1,总氮(total nitrogen,TN)为(34±2.2) mg·L−1,pH为7.5±0.7,总悬浮固体(total suspended solids,TSS)为(12±1.5) mg·L−1。 -
1)接种比实验。接种比实验在室内,在由有机玻璃(深度20 cm,直径10 cm,有效容积1.5 L)制成的6组敞口光生物反应器中进行。初始接种的藻液TSS质量浓度为16.7 g·L−1。初始接种的活性污泥TSS为质量浓度9.8 g·L−1。按照SU等[8]的接种比,6个反应器分别投加600、548、479、400、260、0 mL的藻液和0、90、200、330、570、600 mL的活性污泥,得到只投加藻类、10∶1、4∶1、2∶1、0.75∶1 (w∶w)和只投加污泥的藻泥比。然后将0.35 L预处理后的实际生活废水(经过格栅、除砂、初沉处理)加入到生物反应器中,考察菌藻对碳和营养物的去除率。各组反应器投加的污泥量和藻种量见表1。利用太阳光,从上部和侧面进行照射。为了防止泥藻沉降,各反应器采用磁力搅拌,搅拌速度为100 r·min−1,每天从早上8点开始搅拌12 h,后静置12 h,取静置后的上清液待测。实验装置示意见图1。
2)序批式运行实验。根据接种比实验确定的最佳藻泥接种比,接种混合藻类和活性污泥至1.5 L有机玻璃制成的敞口光生物反应器中,在室内进行序批式运行培养,即:反应器内混合液每天通过磁力搅拌23h,搅拌转速为(225±20) r·min−1,以防止菌藻沉淀,后静置1 h,最后用实际生活污水换掉上清液。第1~30天,每天换水400 mL,混合液总有效体积为1 L,因此,水力停留时间(hydraulic retention time,HRT)为2.5 d;第30~55天,每天换水500 mL,HRT为2 d,同时利用太阳光在白天从上表面和侧面进行照射,一天中光照强度在中午13点左右达到最大值,侧面光强约65 500~25 000 lx。实验期间室内最高气温为30 ℃,最低气温为14 ℃,平均气温为22 ℃。每3 d从反应器内取出200 mL菌藻混合液测叶绿素含量和生物量,污泥龄(sludge retention time,SRT)为15 d。每天上午10:00~11:00测反应器中pH和DO值,然后取静置1 h后上清液经0.45 μm滤膜过滤后测TOC、
NH+4 -N、PO3−4 和NO−2 -N等。 -
TOC和TIC采用TOC仪进行测量(TOC-L CPH,岛津);pH采用台式酸度计(PHS-3E,雷磁);DO浓度采用便携溶氧仪(YSI 550A-12,维赛)测定;光照强度采用照度计(TES-1330A,泰仕)进行测量;TSS采用重量法测定;COD采用重铬酸钾法测定;TN采用碱性过硫酸钾氧化法测定;TP采用碱性过硫酸钾氧化法测定;
NH+4 -N采用纳氏试剂法测定;可溶性磷酸盐(PO3−4 )采用钼锑抗分光光度法测定;NO−2 -N采用N-(1-萘基)-乙二胺光度法[13]测定。 -
取反应器运行至第42天时的混合均匀后的菌藻混合液50 mL,用0.22 μm醋酸纤维滤膜过滤后,再取滤膜上样品经真空冻干后碾碎提取DNA,DNA的提取采用FastDNA®SPIN Kit for Soil (Qiagen,CA,USA)试剂盒。用338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3')引物对细菌16S rRNA V3~V4 区进行PCR扩增,扩增程序为:95 ℃ 预变性3 min,27个循环(95 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃ 延伸30 s),最后72 ℃延伸10 min。用ITS1F (5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R (5'-GCTGCGTTCTTCATCGATGC-3')引物对真菌ITS 区进行PCR扩增,扩增程序为:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。PCR仪为GeneAmp® 9700型(美国ABI公司),扩增体系为20 μL:4 μL 5×FastPfu 缓冲液,2 μL 2.5 mmol·L−1 dNTPs,0.8 μL引物(5 μmol·L−1),0.4 μL FastPfu 聚合酶;10 ng DNA模板。
-
使用2%琼脂糖凝胶回收PCR产物,利用DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA) 进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST (Promega,USA) 进行检测定量。利用Illumina公司的Miseq PE300平台进行测序。使用Uparse软件(版本号7.0.1090,http.://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类。利用RDP classifier (版本号2.11,http.://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对16S_bacteria Silva数据库(版本号132,http.://www. arb-silva.de),设置比对阈值为70%。
1.1. 菌藻来源和实际生活废水
1.2. 实验装置和实验方法
1.3. 分析方法
1.4. DNA抽提和PCR扩增
1.5. Illumina Miseq测序和数据处理
-
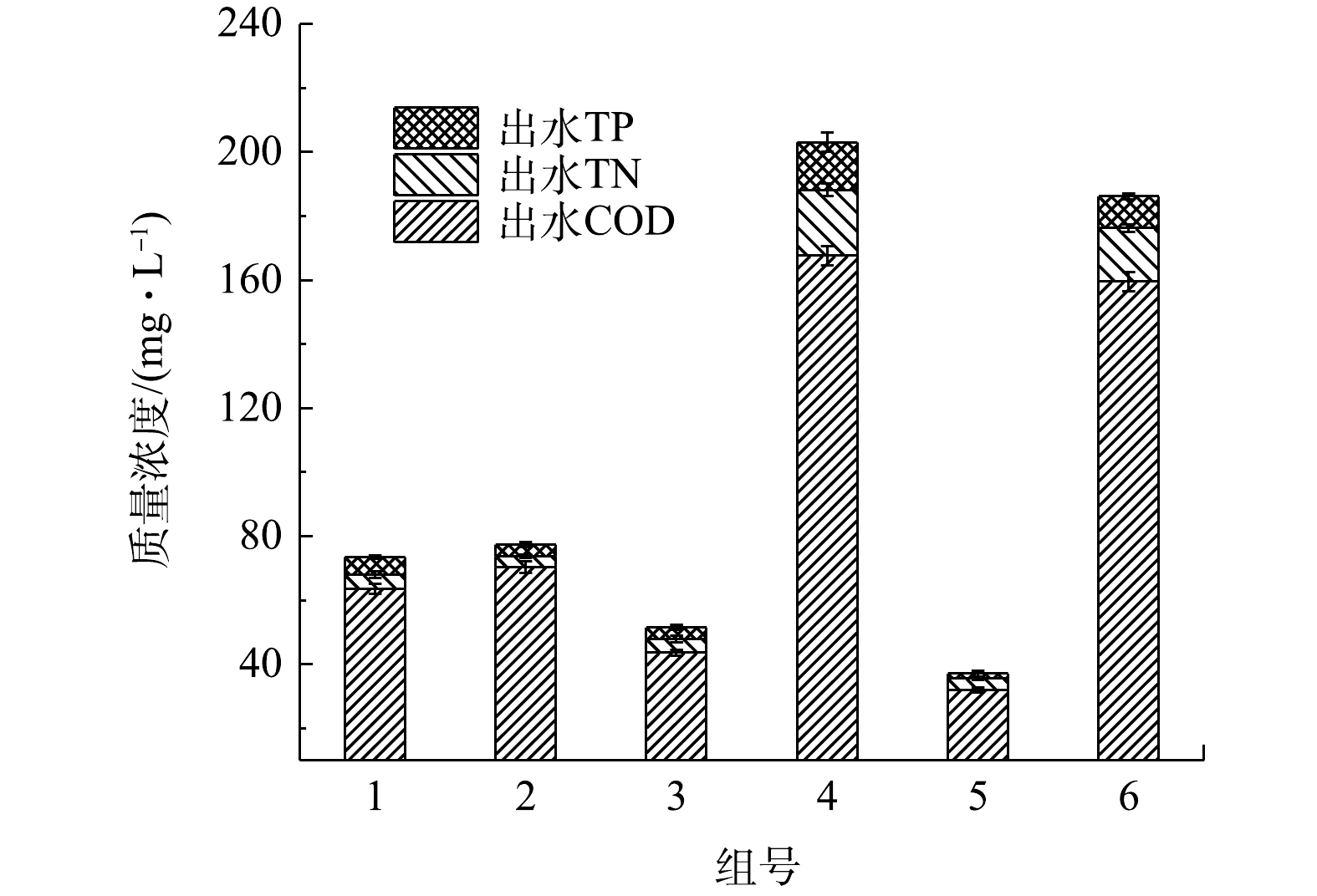
按不同接种比(表1)接种的各组的出水水质如图2所示。由图2可知,在藻泥质量比为0.75∶1的5号出水中COD、TN和TP的质量浓度最低,而只添加活性污泥的3号次之。3号的污泥质量浓度比5号高,这说明投加一定量的藻类的菌藻共生系统比纯污泥系统对污染物的处理效果要好。但添加藻类较多的1号和2号出水COD较5号高,纯污泥的3号也是如此。大部分研究表明,藻类不能去除COD。SERENA等[14]认为,小球藻接种对COD去除率没有显著影响。GARC等[15]也报道了类似的结果,他们发现微藻并不影响猪场废水中有机碳的总去除率。由于微藻不能去除有机物,因此,有机物的去除主要应该是细菌作用的结果。但添加污泥最多的3号出水COD也比5号高。这可能是因为,纯污泥系统在只搅拌的情况下,溶解氧不足,细菌对有机物的去除能力较弱。而添加一定微藻后,藻类产生的O2可促使细菌吸收降解有机物。对藻泥质量比为10∶1的4号和纯藻类的6号来说,其接种的藻类量比其他4组均要多,其出水COD、TN和TP质量浓度也均比其他组高得多,说明过高的藻质量浓度可能不利于营养物质的去除。这可能是因为,大量的藻在反应器内,遮挡减弱了太阳光强,反应器内部光照强度不足,藻类的光合作用受到抑制;同时,由于细菌数量少,产生的CO2有限,只从空气中获得的CO2供应不足,从而影响了藻类对营养物质的吸收[16]。由此可见,在菌藻反应器中,考虑污染物去除率,泥和藻的量应该有一个最佳配比。在该配比下,活性污泥中的异养细菌能够充分降解有机物,产生的CO2能供给藻类光合作用,而藻类光合作用不被限制,产生的O2能供给异养细菌,从而两者协同取得较好的有机物和营养物质去除率。在本实验中,在藻泥为0.75∶1(w∶w)的反应器(5号)中,菌藻协同作用效果较好,对COD、TN和TP的去除效率分别达到了87.5%、81.1%和39.4%。
-
按0.75∶1的接种比,接种0.48 g藻种和0.64 g污泥至1.5 L的光生物反应器中,TSS质量浓度为1.12 g·L−1,按1.2节的运行条件进行为期55 d的序批式共培养。在显微镜下进行定性观察发现,在培养开始时,污泥絮体较分散,且菌藻直接是分离状态(图3(a)),接种的微藻具有多样性(栅藻、丝状绿色蓝藻、单细胞绿藻和硅藻等)。之前研究[17]也发现,小球藻等单细胞微藻絮凝能力低,沉降能力差。因此,反应器中的不可沉淀微生物(如单细胞微藻)随出水会逐渐离开反应器,这产生了一种选择性竞争压力,有利于絮凝微藻和细菌的生长,并促进密集聚集物的形成。经过30 d的培养,反应器中形成了絮凝体(图3(b)),由图3(b)中可知,丝状的微藻是絮凝体的骨架,其中细菌、硅藻和栅藻等被诱捕。GARC等[15]也证实了在废水处理中会形成多种微藻-细菌的絮凝体。细胞外聚合物质的不断富集可能是絮凝形成的原因[14]。在培养30 d后,反应器内絮体的沉降性较好,出水TSS质量浓度较低,约为0.1~0.2 mg·L−1。
-
按0.75∶1(藻∶泥)接种的光生物反应器(TSS质量浓度为1.12 g·L−1),按1.2节运行条件运行时的进出水TOC和TIC质量浓度见图4(a),出水
NH+4 -N、PO3−4 质量浓度以及去除率见图4(b),反应器中NO−2 -N质量浓度、每天上午10:00—11:00的pH和DO质量浓度见图4(c)。在图4(a)中,第17天时,出水TIC质量浓度远远低于进水。藻类光合作用消耗TIC,说明初始阶段藻类的光合作用较强,生长较迅速,反应器内DO的质量浓度因此快速上升(白天10:00—11:00时可达到9~10 mg·L−1,图4(c))。系统在第23天后由于细菌的作用,出水TOC质量浓度低于20 mg·L−1,出水TIC质量浓度略有上升,说明细菌降解有机物的活性在增强,产生了更多的TIC。在第35天时,进水TOC质量浓度为59.06 mg·L−1,出水TOC质量浓度为19.13 mg·L−1,系统对TOC的去除率为67.6%。从整个阶段来看,出水TIC质量浓度在后期为6.5 mg·L−1,说明藻类活性一直较强。
由图4(b)可以看出,菌藻共生体系在第20天后,对
NH+4 -N的去除率可高达96%~99.7%,且出水NO−2 -N的质量浓度一直较低(0~0.2 mg·L−1,图4(c))。在反应器中,按N形态随时间的演变可分为3个阶段:启动阶段;部分硝化作用,形成亚硝酸盐的暂时积累阶段;达到稳态后的完全硝化作用阶段。藻类在光合作用下会提供硝化细菌所需的氧气(白天光照下DO质量浓度可达8~10 mg·L−1,图3(b))。在启动阶段,由于微藻的生长去除了一部分NH+4 -N,细菌硝化可能扮演一个次要角色[17],随后,细菌的硝化作用逐渐加强。由图4(b)、图4(c)可以看出,在40 d后,出水NH+4 -N和NO−2 -N的质量浓度很低,说明在反应器内实现了完全硝化。在第30天时,因加大进水量(HRT由2.5 d变成2 d),且由于季节和气候的变化(进入12月中旬),反应器的pH值有所回落,此时反应器对NH+4 -N的去除率变化不大(约90%~100%),而对PO3−4 的去除率有所下降(由70%降至50%),这说明系统中P过量。CHEVALIER等[18]的研究结果表明,菌藻共同培养时对N和P的最大摄取比例为30∶1。而本实验所用的实际生活污水的N∶P为(13~17):1,因此,在没有发生化学沉淀的情况下(pH>9时P会发生化学沉淀),N是限制性因素,而P会过量。pH下降会导致化学除磷停止,同时,降低HRT后,系统则不能及时去除过多的P。KATAM等[2]发现,在 HRT为10 d时,菌藻悬浮系统对磷去除率最高(80%)。由此可见,HRT会影响系统对磷的去除率,增加HRT能增加除磷效果,但前提是需要有充足的N量。40 d后反应器对PO3−4 的去除率逐渐上升,由50%升高到75%左右,这应该是随着菌藻生物量的增加和pH下降至8以下时,细菌和藻类对营养物质去除率增加的结果。根据胡子全[19]的研究结果,除磷菌的最适pH为7~8。同时,低pH也会促进微藻的光合作用[20]。由图4(c)可以看出,白天10:00—11:00时反应器内pH基本维持在7.5~8.9,这对维持硝化细菌的活性起到了重要作用(硝化细菌适应pH为7.5~9.0 [21])。有研究结果[22]表明,在用于废水处理的高效藻类塘(HRAP)中,由于微藻对CO2的过量吸收导致pH上升到10~11。HRAP内产生的生物质通常包括微藻(60%~80%,质量分数)、细菌(20%~30%,质量分数)和其他有机物(5%~10%,质量分数)[23]。SU等[8]的研究结果也证实,用于处理生活废水的纯藻类系统的pH很容易维持在9以上。但在本实验中pH大多情况下维持在9以下,这可能要归功于接种细菌的作用以及废水中的有机物。好氧细菌能够氧化有机物,产生CO2,使得pH缓慢下降。当藻类生长所需的CO2和细菌产生的CO2达到平衡时,系统内的pH可保持稳定在一个均有利于两者生长的值,从而维持系统的稳定性。在HRAP或光生物反应器中,一般要通入CO2来保持较低的pH。而采用废水培养菌藻的光生物反应器中,通过控制HRT和接种比,可以利用细菌降解有机物产生的CO2来维持适宜的pH。
-
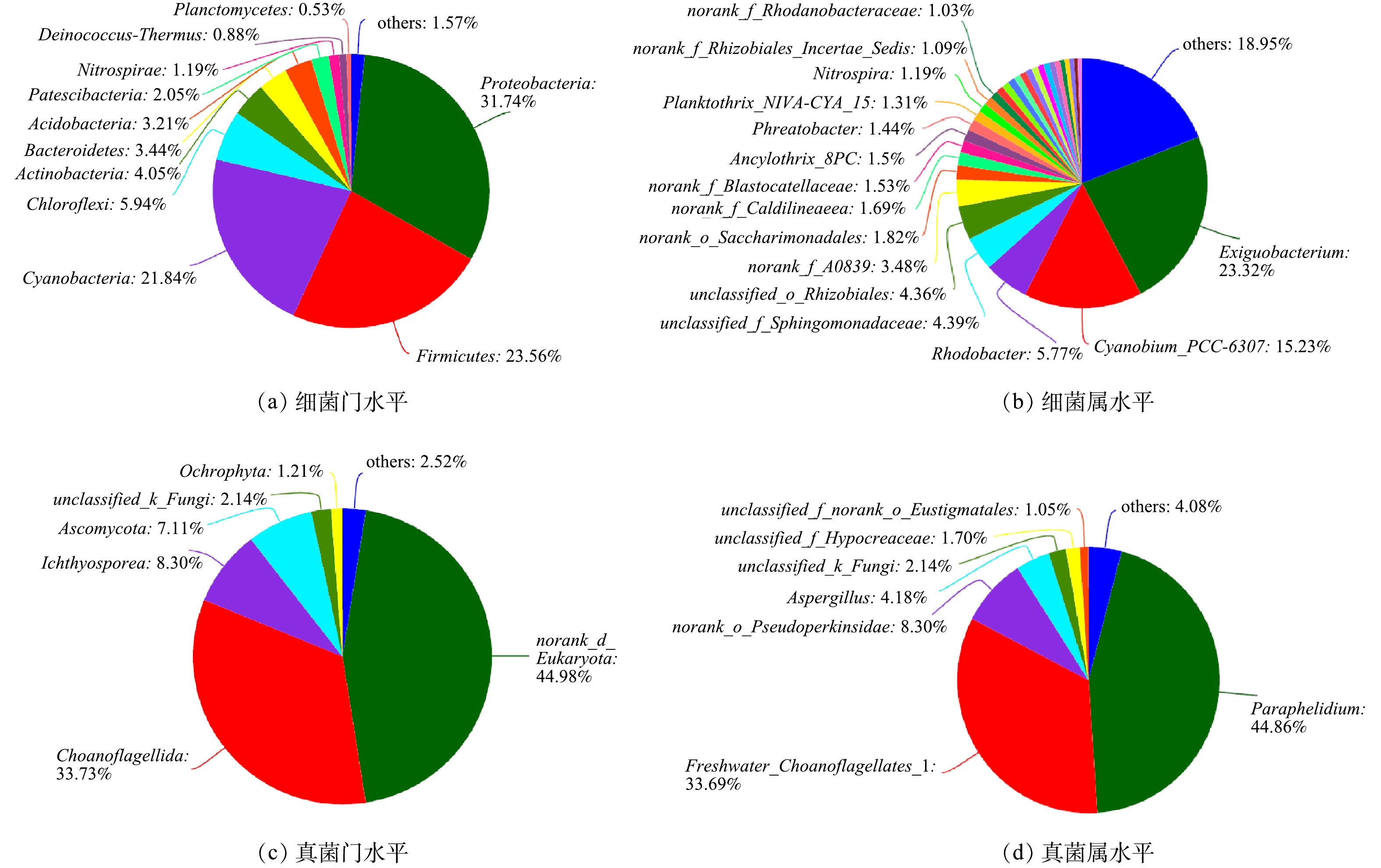
对样品OTUs代表序列进行物种注释,并将样品的有效序列划分到不同的分类水平(从门到属)。样品中相对丰度> 0.5%的细菌门和真菌门如图5(a)和图5(c)所示,相对丰度>1%的细菌属和真菌属如图5(b)和图5(d)所示。由图5(a)可知,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和蓝菌门(Cyanobacteria)为反应器内的优势细菌门,绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospira)为相对优势菌门。由系统进化树可知绿弯菌门和硝化螺旋菌门是相近的分类单元,绿弯菌门中的某些细菌在硝化过程与反硝化过程中起到重要作用,硝化螺旋菌门中的菌属是主要的亚硝酸盐氧化菌。由图5(b)可知,厚壁菌门的微小杆菌属(Exiguobacterium)是反应器内的第1大优势细菌属,蓝细菌门的蓝菌属(Cyanobium)是产氧光合细菌,为第2大优势菌属。
由图5(b)可知,好氧细菌Exiguobacterium和蓝细菌Cyanobium具有比其他菌属更明显的丰度优势,因此,它们之间很可能会相互促进、协同共生,且可能会抑制其他菌属的生长。相关研究结果[24]也表明,Exiguobacterium可通过分解有机物产生CO2和分泌次代谢产物,促进Cyanobium的生长和延长其稳定期,而Cyanobium可通过光合作用产生O2,提供给Exiguobacterium等好氧微生物。DUCAT等[25]也发现,在混菌培养条件下每毫升菌液中蓝细菌数量是单菌培养下的2~3倍,说明某些异养细菌会促进蓝细菌的生长,但有关这种促进作用的具体机理仍处于探究阶段。蓝细菌进行光合作用会产生活性氧,其在系统中大量积累会抑制蓝细菌的生长。LI等[26]在研究蓝细菌S.elongatus PCC7942和黏红酵母细菌Rhodotorula glutinis组成的人工混菌体系时发现,R.glutinis的存在可有效清除体系内的活性氧从而解除蓝细菌的生长抑制。BERNSTEIN等[27]解析了蓝细菌Thermosynechococcus elongatus BP-1与红色亚栖杆菌Meiothermus ruber A之间的相互作用关系,认为T.elongatus BP-1可以为M.ruber A提供有机碳、氧气和还原氮,并且由于异养菌的存在,蓝细菌生物量的积累增加;同时蓝细菌可通过调节关键代谢基因(光合作用、碳吸收、维生素合成和活性氧物质清除的核心基因)的表达来适应异养菌的存在。
属于α-变形菌纲的红杆菌属(Rhodobacter)为第3大优势菌属,为不产氧光合好氧异养固氮菌,在以有机物为碳源和N为氮源时生长良好,其光合能力为它们在营养物竞争时提供了优势,因此,其具有较高的丰度。硝化螺旋菌门的硝化螺旋菌属(Nitrospira)可氧化亚硝酸盐成硝酸盐,其相对丰度为1.19%,其存在避免了亚硝酸盐的积累。γ-变形菌纲的Acinetobacter菌属具有除磷功能,其相对丰度为0.58%。α-变形菌纲的好氧反硝化菌-副球菌属(Paracoccus)的相对丰度为0.35%。
由图5(d)可知,Paraphelidium是第1大优势真菌属,属于藻类的吞噬营养性寄生生物,即可以依附于藻类进行营养性寄生[28]。领鞭毛门淡水领鞭虫Freshwater_ Choanoflagellates是第2大优势真菌属,作为单细胞滤食生物,是细菌的重要捕食者[29]。除了蓝藻(蓝细菌)之外,褐藻(Ochrophyta)为第2大优势微藻(图5(c)),其中的真眼点藻目藻属(unclassified_Eustigmatales)和羽纹硅藻属 (Pinnularia)为优势藻属,二者的相对丰度之和为1.21%。
2.1. 菌藻投加比对出水水质的影响
2.2. 序批式运行实验时显微镜下的菌藻形态变化
2.3. 序批式运行实验时的污染物去除效果
2.4. 微生物群落组成分析
-
1)当HRT为2 d时,按1∶0.75(泥/藻质量比)接种培养的菌藻光生物反应器(初始TSS质量浓度为1.12 g·L−1)在太阳光照和仅搅拌的条件下,对生活污水中
NH+4 -N的去除率可达99.7%,对PO3−4 的去除率约为70%,且没有发生NO−2 的积累。2)反应器内可形成以丝状光合细菌在颗粒结构中占主导地位的沉降性能良好的絮凝体。
3)处理实际生活污水的菌藻光生物反应器内优势菌属为厚壁菌门的好氧异养微小杆菌(Exiguobacterium)、蓝细菌门的产氧光合细菌(Cyanobium)、变形菌门α-变形菌纲的不产氧光合好氧异养固氮红杆菌(Rhodobacter),其相对丰度分别为23.32%、15.23%和5.77%。












 DownLoad:
DownLoad: