-
水体富营养化是当今社会面临的主要水环境问题之一,如何有效地控制水体中的氮、磷仍是当前亟待解决的问题[1-3]。生物修复是现代原位处理富营养化水体的主要研究方向之一[4]。植物修复技术是生物修复技术的重要组成部分,因其成本较低、环境友好而受到广泛关注[5-6]。水生植物修复的机理主要包括水生植物的吸收同化、底物吸附、微生物降解和其他作用[7-8]。植物吸收同化是去除水中营养物质的重要方式,水生植物能利用其发达的根系完成对水中营养物质的富集、转化和吸收,进行生长代谢[9]。通过对植物进行合理收割可实现氮磷的空间转移[10-11]。然而,水生植物对氮磷的吸收能力和偏好有所不同[12]。ZHU等[3]探究了7种水生植物人工浮岛对富营养化水体中养分的吸收特点,发现7种植物的氮和磷积累量分别为0.51~4.48 g·m−2和0.06~0.33 g·m−2,水芹和满天星对氮磷的去除效果最好。BARYA等[13]研究发现,种植美人蕉的人工湿地对污水TN和TP的去除率分别达到60.37%和81.53%,略高于种植菖蒲的人工湿地所对应的56.33%和79.57%。QIN等[14]通过原位修复实验发现,凤眼莲凭借着发达的根系对氮有着超强的累积能力,占TN去除率的58.64%,但对TP的去除能力弱于水浮莲。
植物吸收动力学是比较不同植物养分吸收特性的有效方法。米氏(Miehaelis-Menten)学说创建于20世纪50年代初,解释了植物根系对离子吸收的原理,促进了根系养分离子吸收动力学的发展,并为植物元素吸收的研究提供了可量化的手段[15]。研究水生植物的养分吸收动力学特性,可有助于评价不同植物对水体养分状况的适应性、鉴定并筛选收高效的植物品种[16]。
当前研究多单独探究水生植物的修复机理[17-18],或只利用耗竭法探究植物在不同浓度下对营养物质的吸收特性[19-20],很少从水生植物对营养物质的吸收特性理论上分析水生植物及其组合对营养物质的同化量和去除效果的影响,并依据吸收动力学计算结果优化植物修复富营养化水体中的植物配置。本研究首先探究了苦草、凤眼莲和菖蒲对
${{\rm{H}}_2}{\rm{PO}}_4^ - $ 、${\rm{NH}}_4^ + $ 和${\rm{NO}}_3^ - $ -N的吸收动力学特征和差异;进而通过模拟实验探究了3种水生植物单独和相互组合系统对水中氮磷的去除效果,分析了植物吸收同化对氮磷去除的贡献,以期得到植物营养吸收特性与系统的去除效果之间的耦合关系,并找出净水效果最好的植物系统。本研究可为今后利用吸收特性曲线选择合适的水生植物修复不同类型的富营养化水体提供参考。
全文HTML
-
在西安市的曲江池和莲湖采集生长状况良好且性状一致的苦草、菖蒲和凤眼莲作为研究对象,放入盛有1/2 Hoagland营养液[21]的培养箱中培养待用。
1) 3种水生植物的养分吸收动力学实验。采用常规耗竭法测定3种植物对
${\rm{NH}}_4^ + $ 、${\rm{NO}}_3^ - $ -N和${{\rm{H}}_2}{\rm{PO}}_4^ - $ 的吸收特性。选取性状相同、生长状况良好的植株,放入1/8 Hoagland(pH 6.5)营养液中培养14 d,每3 d更换1次营养液。在实验开始前,用去离子水将植物冲洗干净,转入无氮磷的营养液中饥饿培养2 d,以消除自由空间中残留的氮、磷对吸收实验的影响。以无氮磷的Hoagland营养液为底液,分别使用NH4Cl、KNO3和KH2PO4配制
${\rm{NH}}_4^ + $ 、${\rm{NO}}_3^ - $ -N和${{\rm{H}}_2}{\rm{PO}}_4^ - $ 为20.0、20.0和2.0 mg·L−1的吸收液。将经饥饿处理后的植株移入装有1 L吸收液的玻璃烧杯中进行吸收实验。分别在0、0.5、1、2、3、4、6、8、10、14和24 h时取样,每次取样2 mL,用电子天平称量并记录每次取样后烧杯的质量,在下次取样时用蒸馏水补充因蒸发减少的质量。实验在相对湿度为75%、光照强度6 000 lx,温度为(25±1) ℃的光照培养箱中进行。取样完毕后立即取出植株,剪下根部,用滤纸吸干根表面附着的水分,并在70 ℃下烘干至恒重后称重。每组设置3个平行,结果取算术平均值。根据吸收液的浓度变化拟合可求得离子消耗曲线方程,通常采用一元二次多项式方程[22](式(1))表示。对式(1)求负导数可得到浓度变化速率方程,如式(2)所示。在式(2)中,使x→0,则y'=−b即为浓度最大变化速率,进一步求得最大吸收速率(式(3))。
式中:x为吸收时间,h;y为处理离子浓度,mg·L−1。
式中:Imax为最大吸收速率,mg·(g·h)−1;V为加入的吸收液体积(计算时忽略因取样减少的吸收液体积),L;M根为植物根干质量,g。
将y' =−1/2b带入式(2)中求出x,将其带入式(1)所得的y值即为米氏常数Km。令y' =0,求出吸收速率为0的时间x,回代到式(1)中即得到平衡浓度Cmin。
2) 3种水生植物及其组合净化富营养化水体实验。实验在西安建筑科技大学实验室内进行,将选择的植株放入1/8 Hoagland营养液中驯化14 d,然后清洗干净用吸水纸吸干水分,测量每组植物的鲜质量、叶长和根长,种植于36 cm×26 cm×22 cm的白色透明塑料箱中,箱内底部放入用蒸馏水清洗过的5 kg石英砂(箱内厚度约4 cm)以固定植物根系。实验用水取自西安市护城河,原水中
${\rm{NH}}_4^ + $ 浓度为0.53 mg·L−1,${\rm{NO}}_3^ - $ -N浓度为1.02 mg·L−1,TP浓度为0.22 mg·L−1,达到地表水Ⅴ类标准。在原水中添加NH4Cl、KNO3和KH2PO4试剂,使水中${\rm{NH}}_4^ + $ 浓度为4.0 mg·L−1,${\rm{NO}}_3^ - $ -N浓度为8.0 mg·L−1,TP浓度为0.8 mg·L−1。根据湖泊(水库)富营养化评价方法及分级计算,该人工配制的水体为中度富营养化[23]。每组塑料箱内加入14 L实验水体。实验共设置8组,分别为苦草组、菖蒲组、凤眼莲组、苦草+菖蒲组、苦草+凤眼莲组、菖蒲+凤眼莲组、苦草+菖蒲+凤眼莲组和空白对照组,空白组箱内只放置石英砂,每组设3个重复。苦草组、菖蒲组和凤眼莲组中的植物鲜质量分别为40、80、80 g,两两组合和3种组合时各植物鲜质量相应取单独设置时的1/2和1/3。实验期间每天光照10 h,光照强度6 000 lx。以植物移植到培养箱后的当天为第1次取样时间,以后每4 d取样1次,取样时间为12:00—13:00,每次取50 mL,实验持续时间28 d。取样前用蒸馏水补充因蒸发而减少的水量。
-
1)水样分析。水质参数的测定参考《水和废水监测分析方法(第4版)》,
${\rm{NH}}_4^ + $ 浓度的测定用纳氏试剂分光光度法,${\rm{NO}}_3^ - $ -N浓度的测定用紫外分光光度法,TN浓度的测定用碱性过硫酸钾消解紫外分光光度法,${{\rm{H}}_2}{\rm{PO}}_4^ - $ 和TP浓度的测定用钼锑抗分光光度法[24]。2)植物样本分析。实验结束后,将植株从溶液中取出,用蒸馏水冲洗残留在根部的基质。用吸水纸吸干水分后,测量植物的鲜质量、叶长和根长,结果取3组平行的平均值。然后将植物器官分离,在70 ℃下烘干至恒重,用H2SO4-H2O2消煮法测定植物器官的TN和TP含量[25],实验开始前用同样方法取样测定各植物器官的TN和TP含量。
-
在模拟实验中,通过测定水体中TN和TP的浓度、植物鲜质量和植株TN和TP含量来确定水体TN和TP的去除率η和植物同化去除率η1,分别根据式(4)和式(5)进行计算,根据式(6)来比较每组中单位鲜质量的植物对污染物同化去除的差异,弥补初始植物鲜质量不同造成的差异。
式中:η为污染物去除率;η1为植物同化去除率;c1和c2分别为初始和结束时水体污染物浓度,mg·L−1;ρ1和ρ2分别为初始和结束时植物体内TN和TP的含量,mg·g−1;m1和m2分别为初始和结束时植物鲜质量,g;V为实验水体体积,L;v为植物同化比去除率,mg·(kg·d)−1;M为植物吸收同化的TN或TP的量,mg;ω为初始和结束时的平均生物量(鲜质量),kg;Δt为实验时间,d。采用SPSS 18软件对数据进行统计分析,用Origin 8.5软件作图。
1.1. 实验材料与实验方法
1.2. 分析方法
1.3. 数据处理
-
3种水生植物吸收
${\rm{NH}}_4^ + $ 、${\rm{NO}}_3^ - $ -N和${{\rm{H}}_2}{\rm{PO}}_4^ - $ 的浓度变化情况见图1,消耗曲线方程、Imax、Km和Cmin见表1~表3。最大吸收速率Imax表示离子吸收所能达到的最大速率,与载体的数目和载体的运转效率有关,Imax越大,离子吸收的内在潜力越大。米氏常数Km是吸收速率为1/2 Imax时外界离子浓度,反映了载体活性与离子的亲和力,Km值越小,表明载体对离子的亲和力愈大,即不需要很高的离子浓度就可以很容易地达到Imax。最低平衡浓度Cmin是净吸收速率为0时外界离子的浓度,常被用作耐瘠能力的评价指标,Cmin值小,表明植物能从有效性非常低的环境介质中吸收该养分,对低养分的耐受能力强[16,22]。由图1可以看出,随时间的延长,3种水生植物对3种营养盐的吸收速率均为逐渐减慢,最后趋于稳定,这符合植物对营养盐的吸收模型。由表1可知:3种水生植物对
${\rm{NH}}_4^ + $ 的Imax的差异为凤眼莲>菖蒲>苦草,为0.402 5~0.443 5 mg·(g·h)−1,且差异不显著(P>0.05),这表明3种水生植物对${\rm{NH}}_4^ + $ 均有较强的吸收偏好;对Km的差异为凤眼莲>苦草>菖蒲,菖蒲的Km最小,对${\rm{NH}}_4^ + $ 离子的亲和力最高;对Cmin的差异为凤眼莲>菖蒲>苦草。因此,苦草耐瘠能力最强,对低${\rm{NH}}_4^ + $ 环境适应性强,菖蒲略高于苦草,而凤眼莲远大于苦草和菖蒲,适宜在高${\rm{NH}}_4^ + $ 的水体环境中生存。由表2可知,3种水生植物对
${\rm{NO}}_3^ - $ -N的Imax的差异为凤眼莲>菖蒲>苦草,凤眼莲和菖蒲均对${\rm{NO}}_3^ - $ -N表现出较强的吸收能力;对Km的差异为凤眼莲>苦草>菖蒲,说明凤眼莲对${\rm{NO}}_3^ - $ -N的亲和力最高,较容易达到Imax;对Cmin的差异为凤眼莲>苦草>菖蒲,即菖蒲对低${\rm{NO}}_3^ - $ -N浓度耐受力最强。而凤眼莲无论是在高浓度还是低浓度下都能保持较大的吸收速率。由表3可知,3种水生植物对
${{\rm{H}}_2}{\rm{PO}}_4^ - $ 的Imax差异为苦草>凤眼莲>菖蒲,苦草对${{\rm{H}}_2}{\rm{PO}}_4^ - $ 表现比凤眼莲和菖蒲更强的吸收潜力。对Km的差异为菖蒲>凤眼莲>苦草,这说明苦草对${{\rm{H}}_2}{\rm{PO}}_4^ - $ 的亲和力最高,较容易达到Imax。对Cmin的差异为凤眼莲>菖蒲>苦草,凤眼莲和菖蒲显著高于苦草,适宜于高${{\rm{H}}_2}{\rm{PO}}_4^ - $ 浓度水体。苦草则在任何浓度下均能保持对${{\rm{H}}_2}{\rm{PO}}_4^ - $ 较快的吸收速率。 -
1)植物生长情况和植株氮磷含量变化。在28 d的实验期间,各组植物均正常生长。植物的鲜质量和体内氮磷含量的变化能直接反映植物吸收同化氮磷的量。实验结束时,各组植物的鲜质量和株高均出现不同程度的增加。由表4可以看出,7个植物组中的植物鲜质量增长率为10.57%~67.57%,苦草+凤眼莲组和苦草+菖蒲+凤眼莲组的鲜质量增长率排在前2位,这表明苦草和凤眼莲组合能相互促进植株的生长。
在实验开始前,各植物器官的氮磷含量就有较大差异。凤眼莲叶的氮含量和苦草叶的磷含量最高,分别为39.30 mg·g−1和8.26 mg·g−1。在实验结束时,大部分植物的根和叶的氮磷含量高于实验前,苦草+菖蒲+凤眼莲组的凤眼莲叶和苦草+凤眼莲组的苦草叶氮和磷含量最高,分别为46.33 mg·g−1和8.76 mg·g−1。
2)各组系统水体净化结果分析。图2(a)~图2(d)分别是各组水体中
${\rm{NH}}_4^ + $ 、${\rm{NO}}_3^ - $ -N、TN和TP浓度的变化曲线。由图2(a)可知,在实验开始后,各植物组的${\rm{NH}}_4^ + $ 浓度均快速下降,在第21天时,除菖蒲组外均降到0.10 mg·L−1以下;在实验结束时,各植物组${\rm{NH}}_4^ + $ 去除率均在98.29%以上,各组之间差异不显著(P>0.05)。凤眼莲组和苦草+凤眼莲组在前4 d去除速率最快,这和凤眼莲在高${\rm{NH}}_4^ + $ 浓度条件下吸收速率大有关。由图2(b)可知,各组的
${\rm{NO}}_3^ - $ -N浓度在前8 d下降缓慢,甚至略有回升,这可能与实验过程中有一部分${\rm{NH}}_4^ + $ 经过水中和植物根际的微生物的硝化作用转化为了${\rm{NO}}_3^ - $ -N有关。除空白组和菖蒲+凤眼莲组外,其余6组的浓度在第9天时开始下降,此时${\rm{NH}}_4^ + $ 浓度较低,硝化作用减弱,依靠植物吸收和微生物反硝化等作用,水中${\rm{NO}}_3^ - $ -N浓度在实验结束前一直呈快速下降趋势,以苦草+菖蒲+凤眼莲组下降的最为明显。实验结束时,植物组中苦草+菖蒲+凤眼莲组${\rm{NO}}_3^ - $ -N浓度最低为1.62 mg·L−1,去除率为79.79%,菖蒲组浓度最高为3.89 mg·L−1,去除率为51.38%。这说明各组植物对硝氮均有显著去除效果且具有差异性。由图2(c)可知,各组的TN浓度总体呈下降趋势。前期TN去除速率快,与沉降作用和植物较强的吸收作用有关。随着实验进行,沉降作用减弱,植物吸收趋于饱和、速率减慢,TN浓度下降速率略有减缓。各植物组对TN的去除效果显著,苦草+菖蒲+凤眼莲组对TN去除率最高,为80.34%,其余各组去除率为66.42%~77.58%。
由图2(d)可知,除空白组外,各组TP浓度在前13 d呈骤降趋势,之后各组下降趋势减缓,到第21天时,除空白组和菖蒲组,其余6组的TP浓度均降到0.10 mg·L−1以下,此后浓度基本保持不变。实验结束时,苦草+菖蒲组和苦草+菖蒲+凤眼莲组的去除率最高,为97.50%,菖蒲组的TP去除率是除空白外最低的,为82.50%。上述结果表明,各组植物均能快速、高效的去除水体中的TP,去除率均显著高于空白组(P<0.05)。
2.1. 3种水生植物营养吸收动力学特征
2.2. 3种水生植物净化富营养化水体实验
-
养分吸收动力学可以比较不同植物的养分吸收效率,为了解养分的吸收机制提供依据,促进养分摄取预测模型的建立,其对选取水生植物用于修复不同营养特征的富营养化水体等方面具有理论和实践意义[26]。由于苦草、菖蒲和凤眼莲3种水生植物体内氮磷含量不同,对营养物质的吸收特征也存在差异,在不同营养物质和不同浓度条件下植物的吸收速率亦有所不同,进而会影响到植物吸收同化的过程。
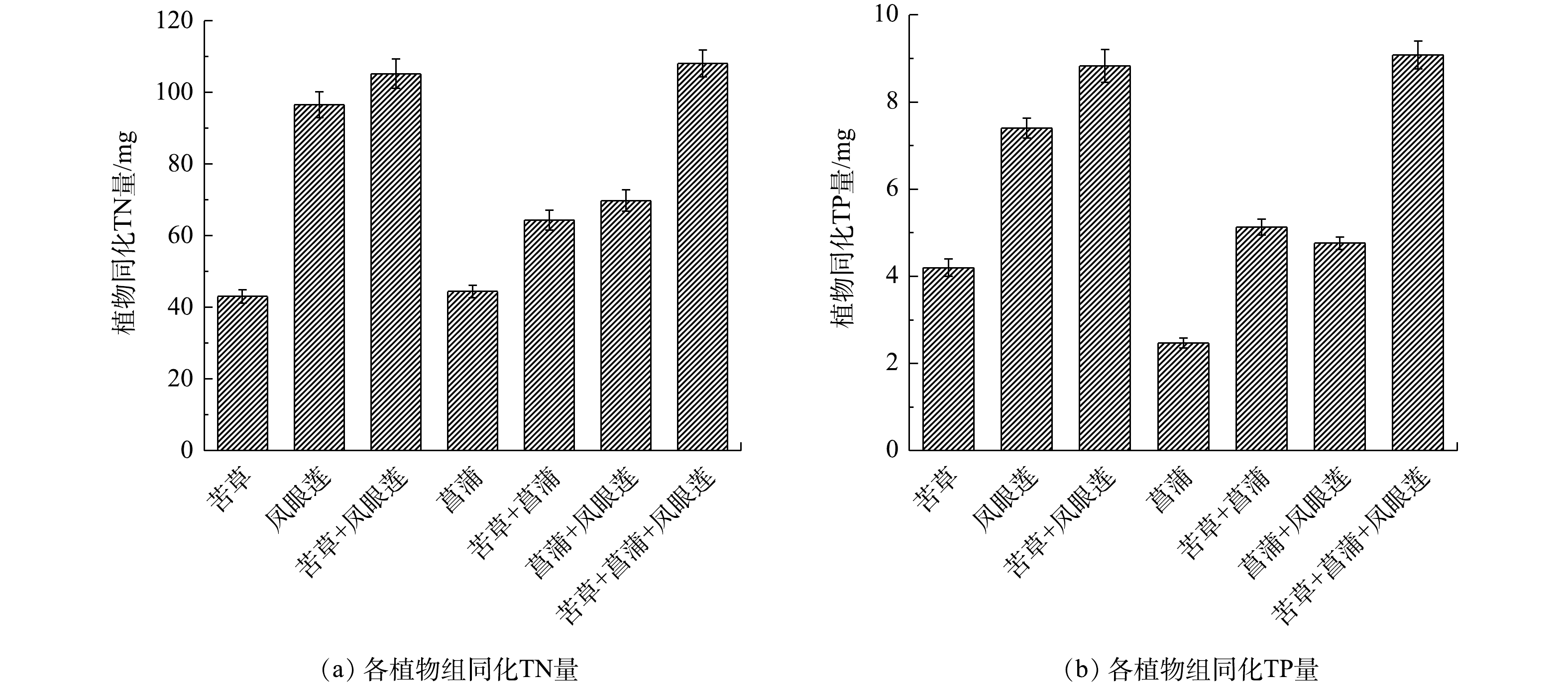
图3是模拟净化实验中各植物组同化去除TN和TP的量,表5是各植物组对TN和TP的植物同化比去除率。由图3(a)可知,各植物组同化去除TN的量在43.03~108.08 mg,苦草+菖蒲+凤眼莲组和苦草+凤眼莲组排在前两位,且显著高于其他组(P<0.05),分别占水体中TN的64.33%和59.32%,是TN去除的主要方式。各植物组的同化比去除率在12.26 ~29.53 mg·(kg·d)−1,苦草+凤眼莲组和苦草+菖蒲+凤眼莲组的同化比去除率较大,且显著高于其他组(P<0.05)。由图3(b)可知,各植物组同化去除TP的量为2.47~9.08 mg,苦草+菖蒲+凤眼莲组和苦草+凤眼莲组排前两位,且显著高于其他组(P<0.05),分别占水体中TP的81.04%和78.88%,是TP去除的主要方式。各植物组的同化比去除率为0.68~2.46 mg·(kg·d)−1。苦草+凤眼莲组和苦草+菖蒲+凤眼莲组的同化比去除率较大,且显著高于其他组(P<0.05)。
上述结果表明,植物对氮、磷物质的吸收同化是植物修复的主要去除方式,分别占到水体中TN和TP的25.61%~64.33%和22.03%~81.04%。这个比例和QIN等[14]的研究结果相似,高于金树权等[27]的研究结果。这可能与植物种植密度、生长季节和污水类型等有关。植物根系吸收的铵态氮,可直接与光合作用产物有机酸相结合,形成氨基酸,进而生成其他含氮有机物。而硝态氮被植物吸收后,要在体内被还原成铵态氮后才能被利用[28]。无机磷在植物吸收及同化作用下可转化成为ATP、DNA和RNA等有机物质、矿化的营养盐等,有利于植物的吸收并参与光合作用[29]。植物吸收的氮、磷元素,促进了植物的生长,最终变成植物体的一部分。氮磷在植物体内的积累不仅和水体的氮磷浓度有关,还和植物本身特性有关[30]。凤眼莲在高
${\rm{NH}}_4^ + $ 、${\rm{NO}}_3^ - $ -N和${{\rm{H}}_2}{\rm{PO}}_4^ - $ 浓度下均能保持较高的吸收速率,生物量增长快,植物吸收同化去除的氮磷占比高。苦草在低浓度${\rm{NH}}_4^ + $ 和任何浓度${{\rm{H}}_2}{\rm{PO}}_4^ - $ 的水体中均能保持较快的吸收速率,虽然苦草组植物同化占比较小,但比去除率并不低,这可能是初始设置苦草生物量过少,限制了后续苦草生物量的增长。而菖蒲组占比小的原因可能是由于菖蒲体内的氮磷含量较低,植物鲜质量的增长对氮磷的需求量较小,吸收作用去除有限,这也和前面菖蒲对${{\rm{H}}_2}{\rm{PO}}_4^ - $ 、${\rm{NH}}_4^ + $ 和${\rm{NO}}_3^ - $ -N吸收特性相对应。菖蒲在污染物浓度高时吸收慢,浓度低时耐受力较强,说明其适宜于在低浓度污染水体中生长。有研究[31-32]表明,不同水生植物组合对水体中营养物质去除效果要明显好于单一植物。苦草+菖蒲+凤眼莲组对氮磷去除率最高,苦草+凤眼莲组的同化比去除率最高,也表明植物组合对氮磷的吸收偏好强于单一植物,可以在不同浓度下对氮磷保持较高的吸收速率,从而提高了营养物质吸收的多样性。除此之外,丰富的水生植物种类提高了水体中微生物的多样性,进而加强了微生物对氮磷的降解作用,这也是植物组合的去除效果优于单一植物的原因之一[2,8]。在今后的生态修复工程中,可根据待修复水体中污染物种类和浓度,从吸收动力学参数的角度选择合适的修复植物,有助于提高修复效果。
-
1) 3种水生植物对
${\rm{NH}}_4^ + $ 、${\rm{NO}}_3^ - $ -N和${{\rm{H}}_2}{\rm{PO}}_4^ - $ 的吸收动力学特征存在差异。苦草适用于高${{\rm{H}}_2}{\rm{PO}}_4^ - $ 低${\rm{NH}}_4^ + $ 水体,凤眼莲适用于高${\rm{NH}}_4^ + $ 和高${\rm{NO}}_3^ - $ -N浓度的水体,菖蒲则能在低浓度养分下吸收${\rm{NO}}_3^ - $ -N,可用于维持修复后的水质。2)各植物组对水体中的氮磷营养物质去除效果显著,植物的吸收同化是植物修复去除氮磷的重要途径。苦草+凤眼莲组对TN和TP的植物同化比去除率最高,分别为29.53 mg·(kg·d)−1和2.46 mg·(kg·d)−1。苦草+菖蒲+凤眼莲组对TN、TP的去除率和吸收同化量均为最高,分别为80.34%、97.50%和108.08 mg、9.08 mg。
3)苦草+凤眼莲组和苦草+菖蒲+凤眼莲组均表现出对氮磷吸收能力的协同提高。苦草、菖蒲和凤眼莲3种水生植物相互组合,弥补了各植物间对不同营养物的吸收特征差异,显著提高了植物对水体中营养物质的同化去除率和总去除率。















 下载:
下载: