-
好氧堆肥化是利用好氧微生物代谢使有机废弃物降解稳定,不再易腐发臭,成为相容于植物生长的土壤调理剂的过程。在这一过程中,固体废物中有机氮的转化降解及存在形态是影响堆肥过程卫生环境及产品品质的重要因素。在好氧堆肥过程中,有机氮首先通过微生物的氨化作用转化为氨氮即铵态氮(
$ {\rm{NH}}_4^ + $ -N),再通过硝化作用转化为硝态氮($ {\rm{NO}}_3^ - $ -N)[1]。除存在于土壤中的少量可溶性含氮有机物如尿素、氨基酸等外,作物从土壤中吸收的氮素主要是$ {\rm{NH}}_4^ + $ -N和$ {\rm{NO}}_3^ - $ -N,被吸收到体内的$ {\rm{NH}}_4^ + $ -N可与光合作用产生的有机酸结合形成氨基酸,进而形成其他含氮有机物,而$ {\rm{NO}}_3^ - $ -N在作物体内先还原为$ {\rm{NH}}_4^ + $ -N,然后再被吸收利用。因此,堆肥过程中$ {\rm{NH}}_4^ + $ -N和$ {\rm{NO}}_3^ - $ -N的含量主要反映了堆肥的腐熟度。然而,已有研究表明,高温期催化硝化反应的微生物活性较低[2],导致$ {\rm{NH}}_4^ + $ -N无法及时转化为$ {\rm{NO}}_3^ - $ -N,堆体中$ {\rm{NH}}_4^ + $ -N含量及pH随堆肥时间的延长不断上升,最终导致累积的$ {\rm{NH}}_4^ + $ -N以氨气(NH3)的形式挥发;NH3的大量挥发不仅造成堆肥产品品质降低,而且影响好氧堆肥的卫生环境,带来大气污染。如何有效控制好氧堆肥过程中的氮素损失、减少二次污染是好氧堆肥技术的研究热点。添加外源添加剂是减少好氧堆肥过程中氮素损失的有效手段之一。常用的添加剂包括酸性添加剂[3]、吸附剂[4]、化学添加剂[5]以及生物添加剂[6]等。其中,酸性添加剂主要通过降低堆肥前期堆体pH以控制氨挥发及氮素损失。氨三乙酸(NTA)是一种含氮三元中强酸[7],为无色晶体,能溶于水,水解电离出的H+可与NH3结合形成
$ {\rm{NH}}_4^ + $ ,减少氨气挥发及氮素损失,且具有良好的生物可降解性[8],大量使用不会造成生态污染,无生态风险。另外,NTA还具有以下优点:一是在保氮的同时,还可以补充堆体的碳源和氮源;二是较于吸附剂和生物添加剂对NH3有更好的控制效果;三是添加量小,价格更经济。基于此,本研究将NTA作为外源添加剂,研究其减少好氧堆肥过程中氮素损失的实际效果;同时,通过研究NTA添加对堆体理化性质、有机质含量及堆体腐熟度的影响,进一步分析其对好氧堆肥进程及效果的影响,以期为好氧堆肥保氮工艺优化提供有益参考。
全文HTML
-
实验用脱水剩余污泥由某食品厂提供;玉米秸秆收集于江苏连云港;氨三乙酸购自山东德州,3种原料的理化性质如表1所示。
-
堆肥反应器为自制反应器,其主体为聚丙烯箱体(700 mm×330 mm×330 mm),总容积约为75 L,箱体外部包裹3 cm保温棉,曝气泵与箱体底部相连,并通过置于底端的曝气环实现均匀曝气,设置通风/关闭时间比为5 min比25 min,曝气量为0.2 L·(L·min)−1,顶部通过软管依次连接盛有硼酸溶液和NaOH溶液的锥形瓶。具体示意图如图1所示。
-
将剩余污泥与玉米秸秆按湿重比6∶4混合,使得混合物的含水率为55%~60%,碳氮比为20~25;然后,等分3份,每份重约15 kg。其中,2份分别添加2.5%和5.0%(占物料干重)的NTA,记为T1和T2,第3份不添加任何物质,记为CK,混合均匀后,开始堆肥。
在堆肥第0、3、7、14、21、28、35、42、49、56天取样,同时进行人工翻堆。分别测定样品的pH、含水率(MC)、铵态氮(
$ {\rm{NH}}_4^ + $ -N)、硝态氮($ {\rm{NO}}_3^ - $ -N)、有机氮(organic nitrogen)、总凯氏氮(TKN)、总有机碳(TOC)、C/N、电导率(EC)和种子发芽指数(GI)。 -
堆肥期间,每天上午08:00和晚上20:00对堆体进行多点测温,平均值记为当天堆体温度;含水率采用烘箱干燥法测定[9];使用2 mol·L−1的KCl溶液,按1∶10(m∶v)的比例从新鲜固体样品中提取浸提液Ⅰ[10];使用去离子水,按1∶10(m∶v)的比例从新鲜固体样品中提取浸提液Ⅱ[11]。提取浸提液时,将配制好的混合物在摇床上以150 r·min−1的转速振荡1 h,然后在4 000 r·min−1的条件下离心10 min,最后过滤取上清液。浸提液Ⅰ用于
$ {\rm{NH}}_4^ + $ -N和$ {\rm{NO}}_3^ - $ -N的测定,$ {\rm{NH}}_4^ + $ -N和$ {\rm{NO}}_3^ - $ -N分别用Berthelot法和紫外分光光度法[12]测定;浸提液Ⅱ用于pH、EC和GI的测定。pH使用DELTA-320 pH计[13]测定;EC使用电导率仪测定;取5 mL浸提液Ⅱ,将小白菜种子播种到铺有滤纸的培养皿中,每个培养皿放10粒小白菜种子。将播种完成的培养皿放入30 ℃恒温培养箱中培养72 h,测定种子的发芽率和根长。各组重复实验3次,同时用蒸馏水作为对照,计算GI值[14];TKN通过凯式定氮法[15]测定;TOC通过重铬酸钾容量法[16]测定;每天测定CO2和NH3的含量,分别采用100 mL的35%NaOH溶液和100 mL的20%硼酸溶液吸收,并用1.0或0.1 mol·L−1HCl溶液进行返滴定[17]。
1.1. 实验材料
1.2. 实验装置
1.3. 实验方法
1.4. 分析测试项目与方法
-
1)堆体温度的变化。堆体温度是反应好氧堆肥过程中有机物降解和微生物活性的重要指标之一。在好氧堆肥过程中,有机物被微生物快速降解并释放能量,致使堆体温度在堆肥初期快速升高[18]。由图2(a)可知,CK和T1堆体于3 d内到达高温期(>55 ℃),T2堆体于第4天到达高温期,高温持续时间分别为8、9和3 d,25 d后堆体温度逐渐下降。此外,3个堆体的最高温度分别达67、64和57 ℃。可见,当NTA添加量为2.5%时,堆体的高温持续时间最长,有利于堆体腐熟及无害化。
2)堆体pH的变化。在好氧堆肥过程中,高pH是引起NH3大量挥发的主要原因[19]。如图2(b)可知,NTA添加对堆体初始pH的影响较大。NTA是中强酸性有机酸,随着NTA添加量的增加,CK、T1和T2堆体的初始pH不断降低,分别为7.07、5.42和3.87。随着堆肥过程的进行,堆体中的有机酸包括NTA逐步被降解,有机氮也逐渐被微生物氨化为
$ {\rm{NH}}_4^ + $ -N,堆体pH不断升高[20];堆肥至21 d时,CK和T1堆体的pH分别升高至8.14和8.15,此后略有降低。这可能与$ {\rm{NH}}_4^ + $ -N的硝化产生H+有关[21-22],也说明随着堆体温度下降,微生物的硝化活性开始恢复。与CK和T1堆体相比,T2堆体中NTA的含量最高,随着NTA的降解,pH持续升高,第42天时pH达7.47。而后,pH开始下降,说明NTA等有机酸已消耗殆尽,堆体中
$ {\rm{NH}}_4^ + $ -N的硝化作用开始恢复。堆肥结束后,各堆体的pH相近,均稳定在7.04~7.39,符合我国有机肥料行业标准(NY 525-2012)中的pH要求。从堆体pH看,添加2.5%的NTA即可取得满意效果。3)堆体电导率的变化。堆肥电导率(EC)的大小能够反映物料的含盐量和评估堆肥产品对植物生长的抑制作用或生物毒性[23]。堆肥过程中各堆体的EC变化如图2(c)所示,随着NTA添加量增加,各堆体的初始EC分别为2.36、2.63、3.06 mS·cm−1,所有处理的EC在56 d内呈现出波动上升的趋势。其可能的原因是,在堆肥过程中随着有机物不断降解,盐分不断释放;同时,堆肥质量的损失,导致盐分浓缩,从而使堆肥的EC升高。堆肥结束后,各堆体的EC分别为3.05、3.35、3.71 mS·cm−1。通常认为,堆肥的EC小于4.00 mS·cm−1时,对植物生长无毒害作用[24]。以上结果表明,添加NTA能提高堆肥产品的EC且所有处理最终堆肥的EC均在标准范围内。
-
在堆肥过程中,氮素形态之间的相互转化是一个复杂的过程,这与不同堆肥阶段的微生物构成有关。虽然氮有很多种形态,但在堆肥过程中主要以NH3-N、
$ {\rm{NH}}_4^ + $ -N、$ {\rm{NO}}_3^ - $ -N、$ {\rm{NO}}_2^ - $ -N和有机氮的形式存在。本研究首先测定了堆体中NH3-N即NH3产生量,并获得了不同NTA添加量时的NH3挥发量;同时,为深入了解堆肥过程中氮形态及含量的变化,还分析了NTA添加对好氧堆肥过程的影响,发现了$ {\rm{NH}}_4^ + $ -N、$ {\rm{NO}}_3^ - $ -N、TKN和有机氮含量的变化情况。1)堆体NH3挥发量的变化。NH3挥发是造成好氧堆肥过程中氮素损失的主要原因,它不仅会降低堆肥产品的品质,同时会产生臭味,污染大气环境[25]。堆肥过程中各堆体NH3日挥发量的变化如图3(a)所示,在堆肥初期,随着有机物的降解,堆体温度和pH迅速升高(图2(a)和图2(b)),CK和T1堆体的NH3日挥发量分别在第4天和第9天达到最大,为843.20和453.73 mg·d−1,该结果与温度的变化一致。NTA可显著降低NH3的挥发量,减小氮素损失。此后,随着各堆体温度和微生物氨化作用逐渐减弱,硝化作用逐步增强,NH3挥发量虽有波动,但呈持续降低的变化趋势。而T2堆体的NH3挥发量始终低于73 mg·d−1,这与该堆体pH始终较低有关。这与PAN等[26]在好氧堆肥过程中利用硫粉作为添加剂的研究结果一致。
堆肥过程中各堆体NH3累计挥发量的变化如图3(b)所示,与NH3日挥发量相似,其累积挥发量在堆肥初期迅速增加,随着堆肥过程的进行,CK和T1堆体的NH3累积挥发量呈线性增加,堆至第25天时达到平稳,分别为6.62和5.12 g。这一变化趋势与JIANG等[27]在猪粪好氧堆肥过程的研究结果一致。25 d后,2个堆体的NH3累积挥发量变化不大,至堆肥结束后,分别为6.71和5.69 g。相对而言,NTA添加量为5.0%时,NH3累积挥发量最小,在第25天和堆肥结束时,分别为0.10和0.49 g。
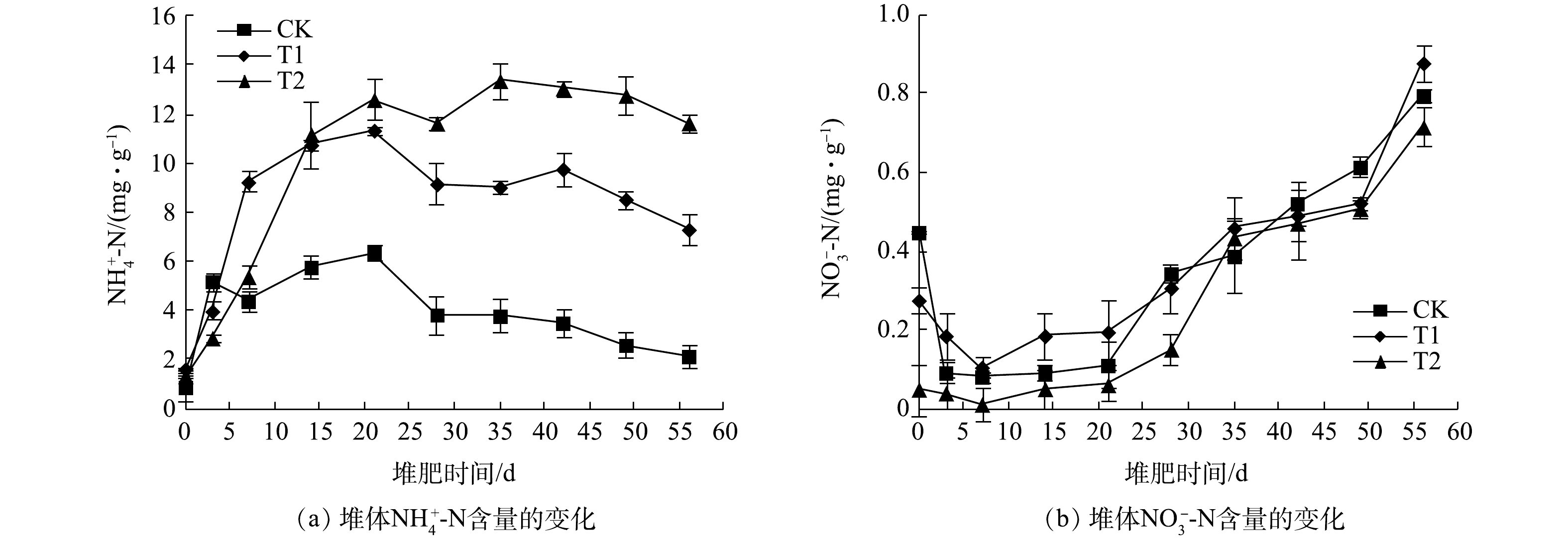
2)堆体
$ {\rm{NH}}_4^ + $ -N和$ {\rm{NO}}_3^ - $ -N含量的变化。如图4(a)所示,与NH3挥发量的变化相似,堆肥初期,微生物氨化作用较强,堆体中可溶$ {\rm{NH}}_4^ + $ -N的含量迅速增加;同时,添加NTA可显著提高堆体$ {\rm{NH}}_4^ + $ -N含量,堆肥至第21天时,CK、T1和T2堆体的$ {\rm{NH}}_4^ + $ -N含量分别为6.37、11.35和12.59 mg·g−1。NTA作为一种酸性添加剂,其水解出的H+可与NH3结合,使$ {\rm{NH}}_4^ + $ $\rightleftharpoons $ NH3平衡朝向质子化形态[28],进而将NH3以$ {\rm{NH}}_4^ + $ -N的形式固定在堆体中,从而减少NH3挥发,且其添加量越高,固定的$ {\rm{NH}}_4^ + $ -N越多,氮素损失越小。其与NH3可能的反应见式(1)~式(3)。21 d后,随着堆体温度和pH的降低及硝化活性的恢复,堆体的
$ {\rm{NH}}_4^ + $ -N含量略有降低或趋于稳定[29]。堆肥结束时,各堆体的$ {\rm{NH}}_4^ + $ -N含量分别为2.14、7.31和11.65 mg·g−1。与CK堆体相比,T1和T2堆体的$ {\rm{NH}}_4^ + $ -N含量分别提高了2.5倍和4.5倍,NTA对$ {\rm{NH}}_4^ + $ -N固定及保氮效果明显。在堆肥初期,由于堆体温度和pH逐渐升高,硝化细菌的生长受到抑制,各堆体
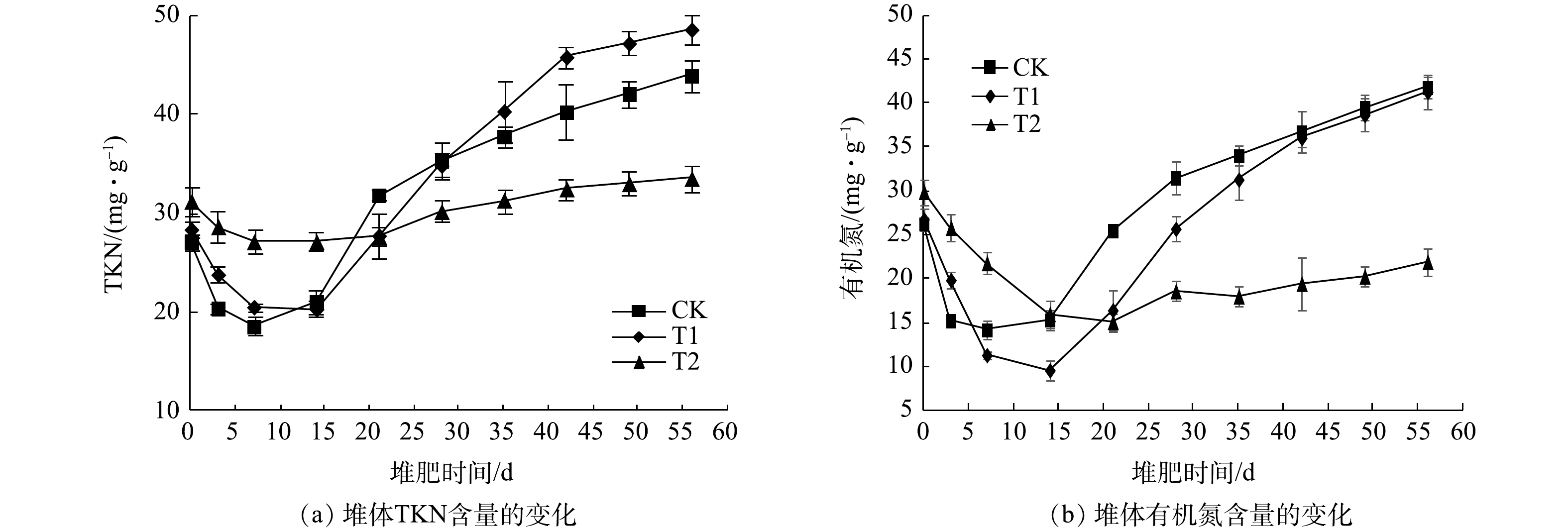
$ {\rm{NO}}_3^ - $ -N含量逐渐降低[30]。如图4(b)所示,堆肥至第7天,各堆体的$ {\rm{NO}}_3^ - $ -N含量分别降到最低,分别为0.08、0.11和0.01 mg·g−1。7 d后,硝化作用逐渐增强,$ {\rm{NO}}_3^ - $ -N含量逐渐上升。堆肥结束后,各堆体的$ {\rm{NO}}_3^ - $ -N含量分别为0.79、0.87和0.71 mg·g−1,NTA添加对堆体的$ {\rm{NO}}_3^ - $ -N含量影响不明显。经测定,堆体中$ {\rm{NO}}_2^ - $ -N的含量较低,因此未给出。3)堆体TKN和有机氮含量的变化。堆体TKN和有机氮含量的变化见图5。随着堆肥过程的进行,各堆体的TKN含量均呈先降低后增加的变化趋势(图5(a))。在堆肥初期,堆体中的有机氮逐步降解,TKN含量因此降低。堆至第7天时,随着有机物的不断降解,堆肥物料的质量不断降低,使得所有处理的TKN发生“浓缩效应”,从而致使各处理的TKN含量逐渐上升[31]。由于T1处理有机物降解效果优于CK和T2处理,堆肥结束后,各堆体的TKN含量分别为43.93、48.60和33.54 mg·g−1;堆肥结束时,各堆体TKN含量与各自初始含量相比,分别提高了61.87%、71.05%和7.43%。添加适量NTA能促进TKN合成及含量增加,且其效果明显优于苹果渣堆肥[32]。
在堆肥过程中,有机氮含量的变化趋势(图5(b))与TKN含量的变化趋势(图5(a))有很高的相似性。随着堆肥过程的进行,各堆体有机氮含量呈现出下降后上升的趋势。前期有机氮含量下降,主要是因为堆体中的有机氮被微生物分解转化为无机氮[33]。后期有机氮含量上升,一方面是因为在氨同化微生物作用下
$ {\rm{NH}}_4^ + $ -N转化为有机氮;另一方面是因为“浓缩效应”。堆肥结束后,各堆体的有机氮含量分别为41.80、41.29、21.89 mg·g−1;堆肥结束时,各堆体有机氮含量与各自初始含量相比,CK和T1处理分别提高了59.18%和54.11%,而T2降低了26.75%。 -
在堆肥过程中,碳素对微生物的新陈代谢起着关键性的作用。根据对微生物活动的平均计算结果可知,微生物合成1份氮,要利用4份碳作为能量和构成组织碳架[34]。堆体中碳素的形态包括无机碳和有机碳。无机碳在堆体内含量极少,在微生物的作用下有机碳被转化成CO2、
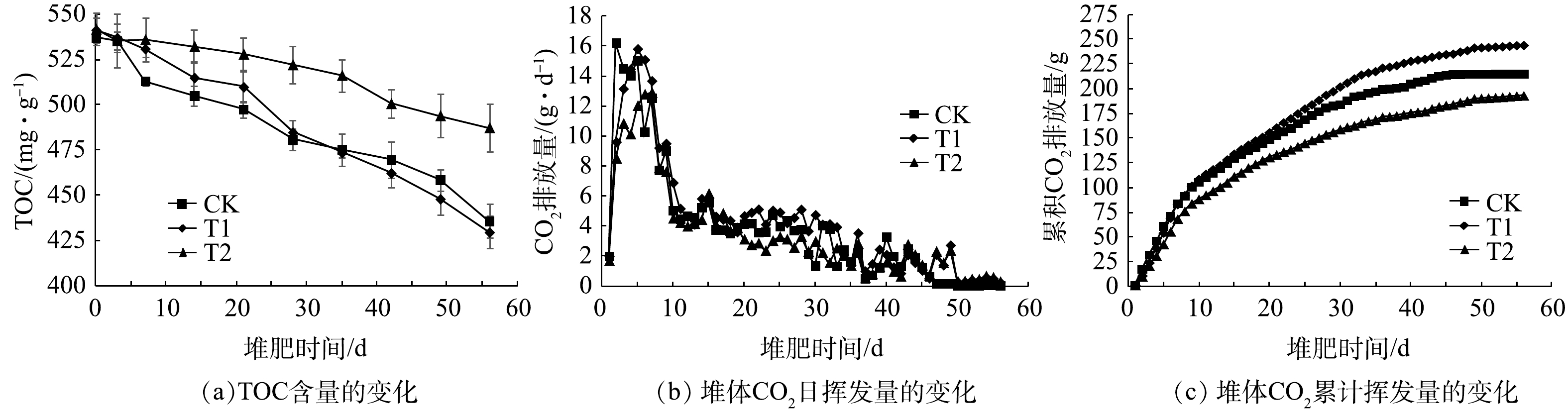
$ {\rm{HCO}}_3^ - $ 和$ {\rm{CO}}_3^ {2-} $ ,最终$ {\rm{HCO}}_3^ - $ 和$ {\rm{CO}}_3^ {2-} $ 转化成CO2而释放。在本研究中,分别探究了堆体中CO2和TOC含量的变化情况。1)堆体TOC含量的变化。在堆肥过程中,各堆体的TOC含量均呈逐渐降低的变化趋势(图6(a))。在微生物的降解作用下,各堆体的TOC含量逐渐降低,堆肥至28 d时,各堆体的TOC含量分别为480.87、484.89、522.12 mg·g−1,该变化趋势与刘媛媛等[35]在外源添加磷石膏对堆肥碳组分及腐殖质品质的影响研究中所描述一致。28 d后,T1堆体的TOC降解率超过CK;同时,T1堆体的CO2累积排放量大于CK(图6(c))。堆肥结束后,各堆体的TOC含量分别为435.75、429.72、487.40 mg·g−1,分别比起始时下降了18.89%、20.62%、10.05%。
2) CO2挥发量的变化。CO2日排放量能够反映堆肥过程中各堆体有机物的分解情况及其微生物的活性[36],各堆体的CO2日排放量如图6(b)所示,堆肥初期随着有机物快速降解,各堆体的温度迅速上升(图2(a)),各堆体的CO2日排放量也随之快速升高,并在第2天和第5天达到最大值;10 d之后,微生物活性降低,堆体温度也开始下降,CO2日排放量也随之逐渐下降到较低水平。各堆体的CO2日排放量差异体现在第1~9天,而在腐熟期基本无差异。第1~9天,各堆体的CO2平均日排放量分别为11.23、11.38、9.35 g·d−1。
堆肥过程中,各堆体的CO2累积排放量如图6(c)所示,堆肥结束时,各堆体CO2累积排放量分别为215.62、244.66、193.31 g,T1堆体的CO2累积排放量相对于CK和T2提高了13.47%和26.56%。结果表明,添加2.5%的NTA并不抑制微生物对有机物的降解,反而有促进作用。
-
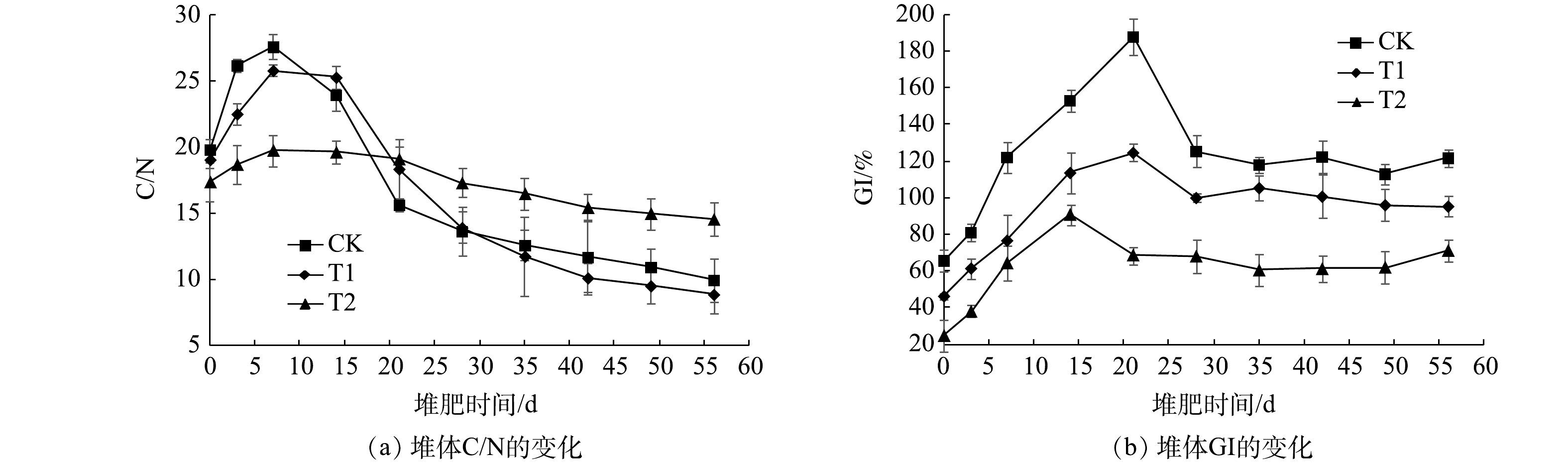
1)堆体C/N的变化。在堆肥过程中,各堆体C/N的变化如图7(a)所示。可见,各堆体的C/N变化趋势一致,由于初期NH3大量挥发(图3(a)),致使C/N在堆肥前期呈现上升趋势;在堆肥后期,由于TOC含量逐渐下降(图6(a))和TKN含量逐渐上升(图5(a)),致使C/N随着堆肥的进行逐渐下降。这一现象与姜继韶等[37]在猪粪好氧堆肥过程中利用过磷酸钙和苹果渣作为添加剂的研究一致。当C/N下降到15~20以下时,可认为已达到腐熟,小于10被认为腐熟情况较好[38]。堆肥结束时,各处理C/N分别为9.92、8.84、14.53。结果表明,添加2.5%的NTA能促进堆肥腐熟。
2)堆体GI的变化。GI是测定堆肥植物毒性的直接而有效的方法,当GI≥80%时,可认为堆肥完全腐熟,已消除对植物的毒性[39]。在堆肥过程中,各堆体的GI变化如图7(b)所示,随着NTA添加量增加,致使各堆体初始GI分别为65.81%、46.45%、24.82%。随着堆肥过程进行,堆肥植物毒性逐渐降低,GI逐渐升高,各堆体的GI分别在第3、14、14天达到80%。
$ {\rm{NH}}_4^ + $ -N含量过高会抑制植物生长[40]。堆肥第21天,各堆体$ {\rm{NH}}_4^ + $ -N含量达到最大值且保持较高水平(图4(a)),因此,GI在第21天后,开始下降并保持稳定,堆肥结束时,各堆体GI分别为121.76%、95.46%、71.30%。 -
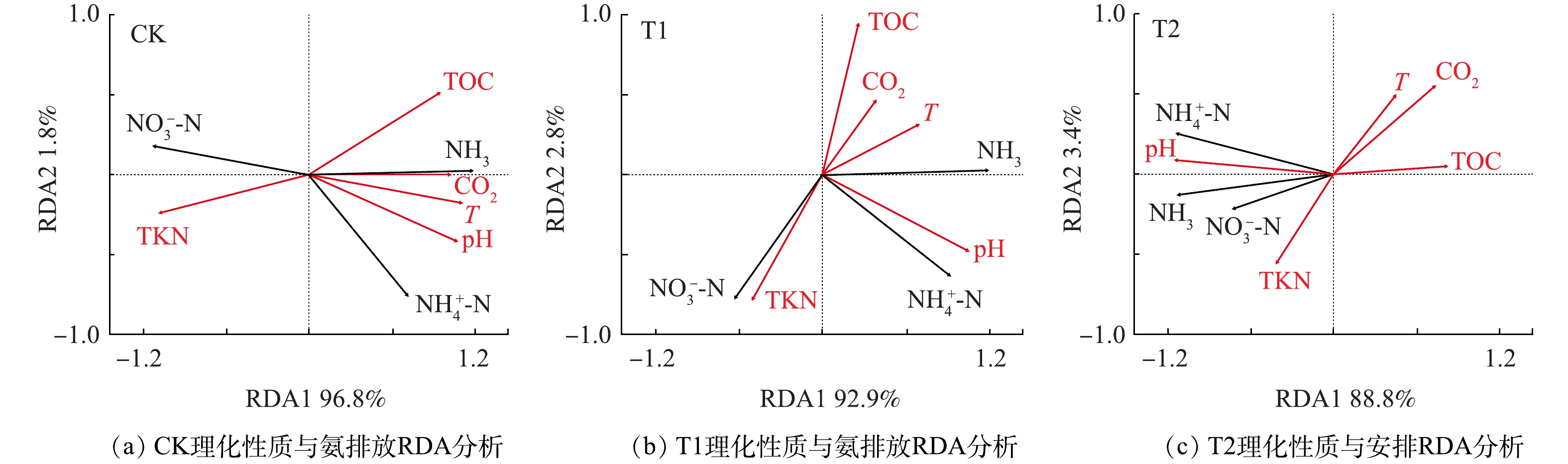
以NH3挥发、
$ {\rm{NH}}_4^ + $ -N和$ {\rm{NO}}_3^ - $ -N为响应变量,堆体的基本理化性质温度(T)、pH、TOC、TKN、CO2等作为环境解释变量,通过冗余分析阐释了NH3挥发等与堆体理化性质之间的关系,结果如图8所示。选取的环境变量对CK、T1、T2氨排放变化的解释度分别为98.9%、95.7%和92.2%,表明选取的环境变量可以有效解释氨排放的变化。在CK中,温度是氨排放变化的最主要解释变量,解释了83.8%,其次是TKN,解释了9.2%。pH和TOC是T1处理氨排放变化的主要解释变量,分别解释了68.8%和20.0%。在T2处理同T1处理一致,pH和TOC是氨排放变化的主要解释变量,分别解释了83.5%和3.5%。
2.1. 堆体理化性质的变化
2.2. 堆肥过程中氮的形态及含量变化
2.3. 堆肥过程中TOC及CO2含量变化
2.4. 堆体腐熟度的变化
2.5. 堆肥过程中堆体的理化性质与氨排放之间的冗余分析
-
1)随着堆肥过程的进行,CK和T1堆体于3 d内到达高温期,T2堆体于第4天到达高温期,高温期时间分别持续8、9和3 d。堆肥结束时,各处理pH均在7.04~7.39。相较于未添加和添加5.0%的NTA,添加2.5%的NTA有利于堆体理化性质的改善。
2)堆肥结束时,与CK相比,T1堆体的NH3累积减少了15.20%,
$ {\rm{NH}}_4^ + $ -N、$ {\rm{NO}}_3^ - $ -N和TKN含量分别提高了242%、10.54%和10.62%,CO2累积增加了13.47%,TOC含量降低了1.4%。适量的NTA添加有利于氮素保存和有机物降解,但过量NTA(5.0%)的添加不利于有机物降解。3)堆肥结束时,CK、T1和T2堆体的C/N分别为9.92、8.84和14.53;GI分别为121.76%、95.46%和71.30%。添加2.5%的NTA有利于促进堆体腐熟。




 下载:
下载: