-
近年来,电子垃圾的产生量随着电子产品的大量使用而剧增。在拆解过程中,电子垃圾被随意倾倒或填埋,这种方法会浸出有害物质和重金属,导致处理场地周边地下水和土壤的污染[1-2]。露天焚烧电子废物以收集贵金属的做法同样会导致空气污染和环境污染。家庭作坊使用酸洗方法回收重金属,随意倾倒,进一步加剧了重金属从电子废物中释出并进入土壤[3]。有研究表明,电子废物拆解场地存在多种重金属或重金属与有机污染的复合污染,其中重金属污染以铅、镉、铜、镍为主[4]。这些有毒元素会导致植物形态异常和代谢紊乱,最终导致植物减产[5]。土壤中的重金属迁移性差、持久性强、毒性高,导致了土壤很难通过自身进行修复[6]。
植物-微生物联合修复具有环境友好、资源节约的优点,从而受到了广泛关注。微生物能够在重金属胁迫条件下促进植物生长和生存。微生物通过分泌铁载体、氨基酸以及络合重金属等方式改变土壤中重金属的赋存形态来缓解重金属对植物的毒害作用[7]。微生物可在重金属存在的条件下,产生抗性机制[8]。黑麦草具有生长速度快、产量高、生长季节长、适应性广且具有耐性等特点。赵树民等[9]研究发现,巨大芽孢杆菌可以强化黑麦草对污染土壤中的铜、镉的吸收。马婵华[10]的研究表明,黑麦草吸收污染土壤中的镉。敬路淮等[11]的研究表明,黑麦草对复合重金属污染土壤中重金属均具有良好的富集能力,能大大地提高黑麦草对重金属修复的利用效率。史鼎鼎等[12]研究发现,添加细菌J6菌株可以促进黑麦草生长,提高黑麦草生物量,强化黑麦草对土壤中Pb、Cd的吸收。张永兰等[13]的研究表明,黑麦草可以对覆土下的铜尾矿进行修复。通过以上研究可知,具有功能性的微生物联合植物修复土壤重金属污染是一种有效的方法,针对多种重金属混合污染土壤值得深入研究。
本研究针对电子废物拆解场地多重重金属污染土壤,通过利用实验室筛选获得的具有重金属耐性、分泌吲哚乙酸以及解磷的烟曲霉f4,通过盆栽实验测定黑麦草地上部和地下部的生物量、黑麦草吸收和富集重金属的能力以及不同处理对根际土壤中重金属形态的影响,明确烟曲霉f4强化黑麦草对电子废物拆解场地土壤修复的能力。
全文HTML
-
植物选用南方多年生黑麦草。供试土壤采自台州市路桥区电子废物无序拆解场地表层土壤(0~10 cm),土壤经过风干后过5目筛,保存备用;取混匀后的少量土壤过100目筛,测定土壤中重金属含量。
供试土壤中的铜、锌、铬、铅、镉超过《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618-2018)[14]。土壤中Cu质量分数为5 384 mg·kg−1,超过标准约53倍;土壤中Zn质量分数为24 078 mg·kg−1,超过标准约80倍;土壤中Cr质量分数为727 mg·kg−1,超过标准约2倍;土壤中Pb质量分数为4 302 mg·kg−1,超过标准约18倍;土壤中Cd质量分数为54.2 mg·kg−1,超过标准约68倍。
实验室保藏的具有铬、铅、铜和锌抗性的烟曲霉(Aspergillus fumigatus)f4,该菌具备分泌吲哚乙酸(IAA)和溶磷的能力。
-
过氧化氢(H2O2)、氢氟酸(HF)、浓硝酸(HNO3)、高氯酸(HClO4)、冰醋酸(CH3COOH)、盐酸羟胺(NH2OH·HCl、醋酸胺(CH3COONH4)均为分析纯。
-
pH计(STARTER3100,OHAUS);精密电子天平(AL204,瑞士MEMETTLER TOLEDO公司);微波消解仪(ANTON PAAR);电感耦合等离子体光谱仪(ICAP-7200,赛默飞世尔科技中国有限公司)。
-
盆栽实验周期为60 d,每20 d对黑麦草地上部进行收割,地下部在第60天收取。将风干后的电子废物拆解场地土壤装盆,每盆装入1 kg污染土,撒入0.6 g黑麦草种子。盆栽实验分为2组:接菌处理(烟曲霉f4)和不接菌处理(ck)。取10 mL菌悬液至接菌处理盆栽中,不接菌处理加入10 mL无菌水,每个处理3次重复。每周浇透盆栽2次,不额外供给营养液。
沿着土壤表层将黑麦草地上部进行收集,将黑麦草根系取出,抖落根系周围土壤,收集紧密粘连在黑麦草根系上的土壤,用去离子水将根系清洗干净。将黑麦草在105 ℃下烘2 h,再放在60 ℃下烘干至恒重并测定其干质量[15]。
-
使用电感耦合等离子体发射光谱仪(ICP-OES)对土壤和植物中重金属含量进行测定。土壤中重金属测定过程为:称取根际土壤0.200 0 g于消解罐中,加入5 mL硝酸(HNO4)、3 mL氢氟酸(HF)、1 mL过氧化氢(H2O2)[16],置于微波消解仪内进行消解;微波消解完成后,使用3 mL高氯酸(HClO3)赶酸,定容至50 mL。植物中重金属测定过程为:称取植物样0.200 0 g于消解罐中,加入8 mL王水,置于微波消解仪内进行消解;微波消解完成后,使用3 mL高氯酸(HClO3)赶酸,定容至50 mL。
土壤中的重金属的形态分别为弱酸可提取态、可氧化态、可还原态、残渣态,采用BCR连续提取法[17]对根际土壤中重金属的形态进行分析。
-
植物富集系数(BCF)是某种元素在植物地上部或地下部的含量与植物所生长的土壤中该元素含量的比值,反映植物对某种元素的富集能力[18],计算方法见式(1)。
式中:FBCF为植物富集系数;Cplant为植物地上部或地下部的重金属含量,mg·kg−1;Csoil为土壤重金属含量,mg·kg−1。
-
植物迁移系数(TF)是植物地上部某元素的含量与地下部该元素含量的比值,反映植物对该元素的迁移能力[18],计算方法见式(2)。
式中:FTF为植物迁移系数;Cshoot为植物地上部的重金属含量,mg·kg−1;Croot为植物根部的重金属含量,mg·kg−1。当FTF>1时,植物易将地下部吸收的元素输送到地上部;当FTF<1时,植物防止重金属元素向地上部迁移,可降低重金属引起的毒性[19]。
1.1. 供试材料
1.2. 实验试剂
1.3. 实验仪器
1.4. 实验方案
1.5. 分析方法
1.6. 富集系数
1.7. 迁移系数
-
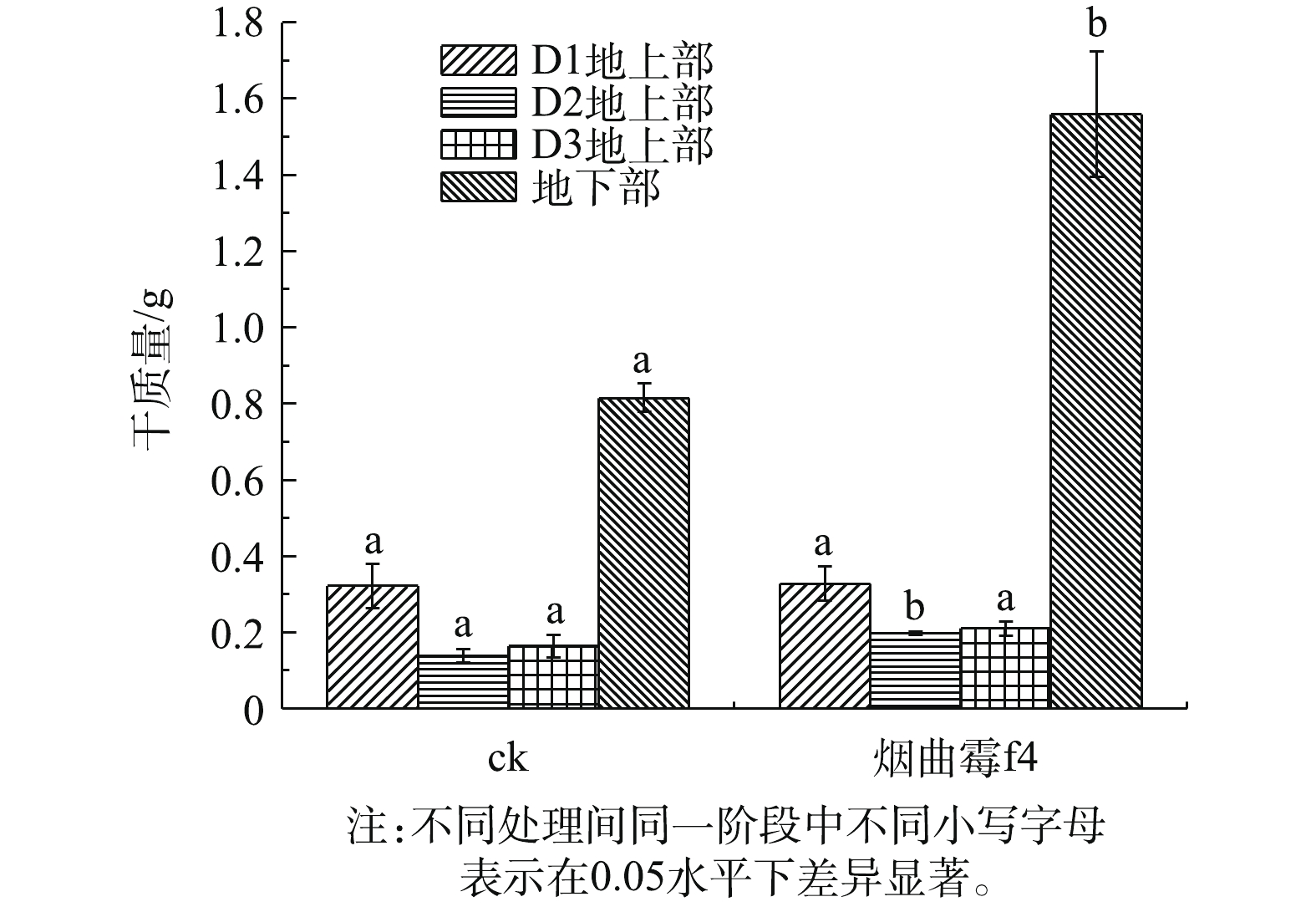
图1反映了为接菌处理与不接菌处理黑麦草地上部和地下部干质量的对比结果。可以看出,地上部分为3个阶段进行收割,1~20、21~40、41~60 d分别标记为D1、D2、D3。在D1阶段,接菌处理使黑麦草地上部生物量提高了2.16%,与不接菌处理无显著差异;D2阶段,接菌处理使黑麦草地上部生物量提高了43.56%,与不接菌处理有显著差异;D3阶段,接菌处理使黑麦草地上部生物量提高了28.64%,与不接菌处理无显著差异。接菌处理使黑麦草地下部生物量提高了91%,与不接菌处理有显著差异。在同一处理中,D1与D2、D3黑麦草地上部生物量有差异,由于地下部是第60天进行收割,随着时间的推移,地下部受到毒害作用越来越强,这可能对黑麦草地上部的生长产生了影响。严警等[20]的研究表明,筛选到的根瘤菌对于黑麦草生物量增加无显著的促进作用。本研究中的烟曲霉f4与其类似,虽无显著的促进作用,但是接菌处理对于黑麦草地上部生物量有所提高。
-
由表1可知,接种烟曲霉f4能够显著提高黑麦草对地下部重金属的积累。相较于不接菌处理,Ni、Cu、Zn、Cd、Cr、Pb的增幅分别为484%、398%、470%、355%、531%和490%。对地上部来说,接种烟曲霉f4后,地上部重金属含量相较于不接菌处理普遍降低。在烟曲霉f4的作用下,黑麦草根部吸收重金属后,通过形成带有铁载体、特殊代谢物和菌株转运体的复合物来限制重金属的生物利用度。赵会会等[21]筛选出了能活化Cd的菌株,接种在黑麦草幼苗上,能够促进黑麦草的生长。其中,接菌处理的黑麦草根系Cd相较于不接菌处理增加了57.64%。赵树民等[9]筛选出了巨大芽孢杆菌,在Cd污染、Cu污染或Cd与Cu混合污染土壤中,接种巨大芽孢杆菌后,黑麦草地下部重金属含量较不接菌处理高,巨大芽孢杆菌的施加对黑麦草地下部根系富集重金属能力提高。本研究发现接种烟曲霉f4后黑麦草地下部根系积累重金属的能力优于巨大芽孢杆菌。
-
由表2可知,不接菌处理,黑麦草地上部D3的Cu、Cd、Zn、Pb的迁移系数均大于1。这说明在D3阶段,不接菌处理的黑麦草易将地下部重金属(Cu、Cd、Zn、Pb)转移到地上部;对于D1和D2阶段,接菌处理与不接菌处理,迁移系数并无显著差异。不接菌处理对于地上部重金属的富集系数与接菌处理地上部重金属系数并无显著性差异。但是,地下部重金属的富集系数接菌与不接菌存在显著性差异。这可能是金属的移动与微生物通过分泌的络合剂与各种氧化和化学反应引发的[22]。接菌后,黑麦草对于重金属的富集显著增强。
-
表3为根际土壤中重金属的形态分布。可以看出,烟曲霉f4将可氧化态Cd转化成弱酸可提取态、可还原态和残渣态Cd;烟曲霉f4将残渣态Cr转化成弱酸可提取态、可氧化态和可还原态Cr;烟曲霉f4将可氧化态Cu转化成弱酸可提取态、可还原态和残渣态Cu;烟曲霉f4将可氧化态Zn转化成可还原态Zn;烟曲霉f4将可氧化态Pb转化成可还原态和残渣态Pb。不同重金属在作物体内的迁移能力有所不同[23],电子废物拆解场地土壤中重金属迁移能力大小依次为Cd>Zn>Cu>Pb>Cr。烟曲霉f4通过产有机酸活化了土壤中难以移动的重金属,增强了重金属的迁移性和有效性[24]。兰翔等[25]发现产黄头孢霉(CC)和头孢霉(SP)可改变土壤中重金属的形态。这可能是菌株分泌的有机物质与土壤中重金属结合,降低了土壤中重金属的活性。
由表4可知,不接菌处理黑麦草地下部Cu、Cd、Cr、Pb、Zn的弱酸可提取态含量与根际土壤中Cu、Cd、Cr、Pb、Zn含量呈负相关;接菌处理黑麦草地下部Cu、Cr、Pb、Zn的弱酸可提取态含量与根际土壤中Cu、Cr、Pb、Zn呈正相关,与Cd呈负相关。这表明接种烟曲霉f4后,根际土壤中Cu、Cr、Pb、Zn的弱酸可提取态含量越高,黑麦草地下部含量亦越高。不接菌处理黑麦草地下部Cu、Cd、Cr的可还原态含量与根际土壤中Cu、Cd、Cr含量呈正相关,与Pb、Zn呈负相关;接菌处理黑麦草地下部Cu、Zn的还原态含量与根际土壤中Cu、Zn含量呈正相关,与Cr、Pb、Cd呈负相关。这表明接种烟曲霉f4后,根际土壤中Cu、Cd、Cr的可还原态含量越高,黑麦草地下部含量亦越高。不接菌处理黑麦草地下部Cu、Cd、Cr、Pb、Zn的可氧化态含量与根际土壤中Cu、Cd、Cr、Pb、Zn含量呈负相关;接菌处理黑麦草地下部Cu、Cd、Cr、Pb、Zn的可氧化态含量与根际土壤中Cu、Cd、Cr、Pb、Zn含量呈正相关。这表明接种烟曲霉f4后,根际土壤中Cu、Cd、Cr、Pb、Zn的可氧化态含量越高,黑麦草地下部含量亦越高。
2.1. 菌株对黑麦草生长的影响
2.2. 烟曲霉对黑麦草吸收重金属的影响
2.3. 土壤-植物体系中重金属迁移特性
2.4. 菌株对土壤重金属形态的影响
-
1)通过测定接菌和不接菌处理黑麦草地上部、地下部生物量,接菌处理(烟曲霉f4)较不接菌处理3个阶段地上部生物量增幅分别为2.16%、43.56%、28.64%。地下部生物量增幅91.27%,达到差异显著水平。
2)通过对黑麦草地上部、地下部重金属含量的测定,接菌处理(烟曲霉f4)相较于不接菌处理黑麦草地下部Ni、Cu、Zn、Cd、Cr、Pb的含量增幅分别为484%、398%、470 %、355%、531%、490%。接菌后利于黑麦草地下部对重金属的富集。
3)通过BCR逐级提取法对根际土壤进行形态分析,发现接种烟曲霉f4后能够活化根际土壤中的Cd、Cu、Ni、Zn、Pb,使得弱酸可提取态占比增多。烟曲霉f4能强化黑麦草对电子废物拆解场地土壤重金属的修复。



 下载:
下载: