-
我国印染废水排放量占纺织工业废水排放量的80%,已成为污水排放量较大的行业之一[1]。大部分纺织染料具有复杂的化学结构和高化学稳定性,因此其生物可降解性比较低。多数染料(三苯甲烷类、靛蓝类、偶氮类、蒽醌类等)及其中间代谢产物具有毒性和致癌性,对水体和周边生态环境影响巨大,对人类的生命健康产生威胁和隐患[2-3]。传统的物化方法降解效率较低且成本高,易造成二次污染[4-5]。而利用微生物和酶对染料废水进行处理则具有较高的安全性,因此成为染料废水处理技术的研究热点[6]。
漆酶( Laccase, EC 1.10.3.2 )是一种多酚氧化酶。漆酶广泛存在于真菌和植物中[7],一般含4个铜离子,负责传递电子行使催化功能。漆酶一般具有较高的氧化还原能力,能氧化多种底物,如:木质素、胺类化合物、芳香化合物等[8]。漆酶的氧化反应的唯一副产物是水,因此被称为绿色催化剂[9-12]。漆酶有比较宽泛的底物谱、无有毒副产物,这些特点使其在食品、造纸、纺织、合成化学环境修复及纳米生物技术等领域均具有较好的应用前景[13-16]。研究者对多种不同来源的漆酶及其酶学特性进行了比较,并利用漆酶对不同结构的染料进行脱色实验,取得了比较好的脱色效果。COUTO等[17]用Trametes hirsuta漆酶对6种偶氮染料进行脱色实验,其中4种染料在反应4 h后的脱色率达到50%。ZHANG等[18]将Trametes versicolor来源的漆酶Lac进行聚乙烯亚胺修饰获得LacPG酶,具有高稳定性和催化性能。该酶在介体HOBT的协同作用下,对偶氮染料酸性橙7的脱色率比未经修饰的Lac高3倍。CAMARERO等[19]评估了Pycnoporus cinnabarinus来源的漆酶协同44种小分子介体对5类不同分子结构的染料的脱色能力,发现木质素降解衍生物丁香醛和乙酰丁香酮具有与合成介体相当的辅助漆酶染料脱色的能力。余昭琴等[20]采用杂色云芝菌发酵产生漆酶,并试用该漆酶对溴酚蓝染料进行脱色实验,其脱色率在反应4 h可达94.5%。谭小珊等[21]将含有漆酶的刺芹侧耳粗酶液对典型偶氮染料甲基橙进行脱色实验,28 h后的脱色率达到90%。马倩倩等[22]研究了漆酶对中性红、刚果红、碱性品红、甲基橙、孔雀石绿、次甲基蓝、茜素红7种染料进行脱色,该漆酶对其中5种染料脱色率均达到80%以上。
本研究将Moniliophthora roreri来源的漆酶Mrl2用毕赤酵母进行异源表达,检测其活性并对Mrl2的酶学性质进行了研究,考察了该漆酶-介体体系对5类11种广泛应用染料的脱色作用[23-25],以期为漆酶在染料污水处理方面的应用提供参考。
全文HTML
-
重组毕赤酵母菌株X-33/pPICZα-A-mrl2为本实验室构建并保藏。
BCA法微量蛋白质浓度测定试剂盒购自Sangon Biotech;2,2'-联氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)购自Coolaber公司;博来霉素购自广州晶欣生物科技有限公司;亮蓝R、活性黑5购自Sigma Aldrich;活性艳蓝KN-R购自天津希恩思生化科技有限公司;考马斯亮蓝R250购自Aladdin公司;结晶紫、靛蓝购自Macklin公司;溴酚蓝、刚果红、藜芦醇购自Solarbio公司;靛蓝胭脂红、对香豆酸购自上海源叶生物公司;天青I购自美仑生物公司;苯酚红购自西陇科学有限公司;N-羟基邻苯二甲酰亚胺(NOP)购自艾览化工科技有限公司;1-羟基苯并三唑(HOBT)购自Damas-beta公司。其他常规试剂均为国产分析纯。
PCR仪购自Bio-Rad 公司;VersaMax酶标仪购自美国MD公司;蛋白质层析仪AKTA Purifier 10购自Takasage公司;QuixStandTM benchtop system购自Watson Marlow;摇床购自上海知楚仪器有限公司。
-
毕赤酵母表达漆酶Mrl2,将重组毕赤酵母菌株X-33/pPICZα-A-mrl2划线于YPD固体平板(含25 µg·mL−1博来霉素),挑取单克隆接种于3 mL (含25 µg·mL−1博来霉素) YPD培养基中,在30 ℃,220 r·min−1条件下过夜培养16~20 h。转接YPD培养液至25 mL BMG培养基(250 mL三角瓶)中,调节初始OD600 为 0.2,在30 ℃ 220 r·min−1条件下过夜培养16~20 h。转接BMG培养液至50 mL BMM 培养基中(500 mL三角瓶),调节初始OD600 为 1.0,在20 ℃ 220 r·min−1条件下培养,每天添加1% 的无水甲醇诱导漆酶表达。培养5 d后,4 ℃, 4 000 r·min−1离心15 min收集上清液。接下来对漆酶Mrl2进行纯化,利用0.22 µm孔径过滤器对200 mL上清液进行过滤,并用QuixStand benchtop system将过滤后溶液浓缩为50 mL,浓缩的上清液再用0.22 µm孔径过滤器过滤后,最后利用DEAE FF阴离子交换层析柱在AKTA Purifier10仪器下对漆酶进行纯化。蛋白质处理后,用50 mmol·L−1磷酸钾缓冲液pH 6.0和200 mmol·L−1 NaCl对柱进行洗涤,用50 mmol·L−1磷酸钾缓冲液pH 6.0和250 mmol·L−1 NaCl洗脱Mrl2,洗脱出的Mrl2蛋白利用浓缩管浓缩后进行脱盐,将Mrl2保存在pH 6.0的50 mmol·L−1磷酸钾缓冲液中。以牛血清白蛋白(BSA)为标准,采用BCA蛋白定量试剂盒测定纯化后Mrl2的蛋白浓度。并将纯化后的酶进行冷冻干燥,冻干粉保存于−80 ℃,待进一步使用。
实验还进行了漆酶Mrl2酶学性质研究。在检测最适pH时,取0.08 mU纯酶,在120 µL pH 2.0的100 mmol·L−1 Britton-Robinson和pH 3.0~8.0的100 mmol·L−1 柠檬酸-磷酸盐缓冲液中,以40 µL 10 mmol·L−1 ABTS为底物,于波长420 nm处室温下测定吸光光度,以最高酶活为100%,计算其相对酶活力。在检测最适温度时,取0.08 mU纯酶,加入120 µL最适pH的柠檬酸-磷酸盐缓冲液,以40 µL 10 mmol·L−1 ABTS为底物,在20、30、40、50、60 ℃反应条件下,于420 nm波长下测定吸光度,计算其相对酶活力。在进行米氏常数Km和最大速度Vmax的测定实验时,以ABTS为底物,在pH 3.0的柠檬酸-磷酸盐缓冲液中,室温下,测定出不同底物ABTS浓度(0、0.025、0.05、0.1、0.25、0.5、1.0、2.5、5.0 mmol·L−1)时的酶活,计算酶反应的初始反应速率,作Lineweaver-Burk双倒数图,得出Km和Vmax值,并计算出Kcat和Kcat/Km值。
在进行漆酶介体系统对11种染料的脱色效果比较时,由于Mrl2属于中等氧化还原电势漆酶[1],添加氧化还原电势相对较高的小分子介体能辅助其实现对顽固性染料的脱色。本研究考察了Mrl2在4个氧化还原电势均高于0.7 V的小分子介体(NOP、HOBT、对香豆酸、藜芦醇)辅助下对11种染料(刚果红、天青I、考马斯亮蓝R250、苯酚红、结晶紫、靛蓝、亮蓝R、活性艳蓝KN-R、活性黑、溴酚蓝、靛蓝胭脂红)的脱色作用。脱色反应在96孔板中进行,反应体系为200 µL。
-
称取0.01 g Mrl2漆酶冻干粉,溶于ddH2O中,以ABTS为底物,在200 µL反应体系中,含有40 µL 10 mmol·L−1 ABTS、40 µL稀释1 000倍的漆酶酶液,120 µL pH 3.0的柠檬酸-磷酸盐缓冲液,在420 nm处测定吸光度。酶活力单位定义为:1 min催化氧化1 µmol底物的酶量为1个酶活力单位。
设定波长为300~700 nm,利用酶标仪分别对上述11种染料进行全波长扫描,确定每种染料的最大吸收峰。配置20 000 U·L−1的漆酶母液和10 mmol·L−1 的染料母液,同时精确配置50 mmol·L−1 的介体母液。使用酶标仪测定每种染料最大吸收峰处的吸光光度变化。不加介体的体系为对照,观察染料脱色情况,计算脱色率,计算方法见式(1)。
式中:R为染料脱色率;A0、A1分别为脱色反应前后溶液的吸光度值。
1.1. 实验材料
1.2. 实验方法
1.3. 酶活的测定与脱色率的计算
-
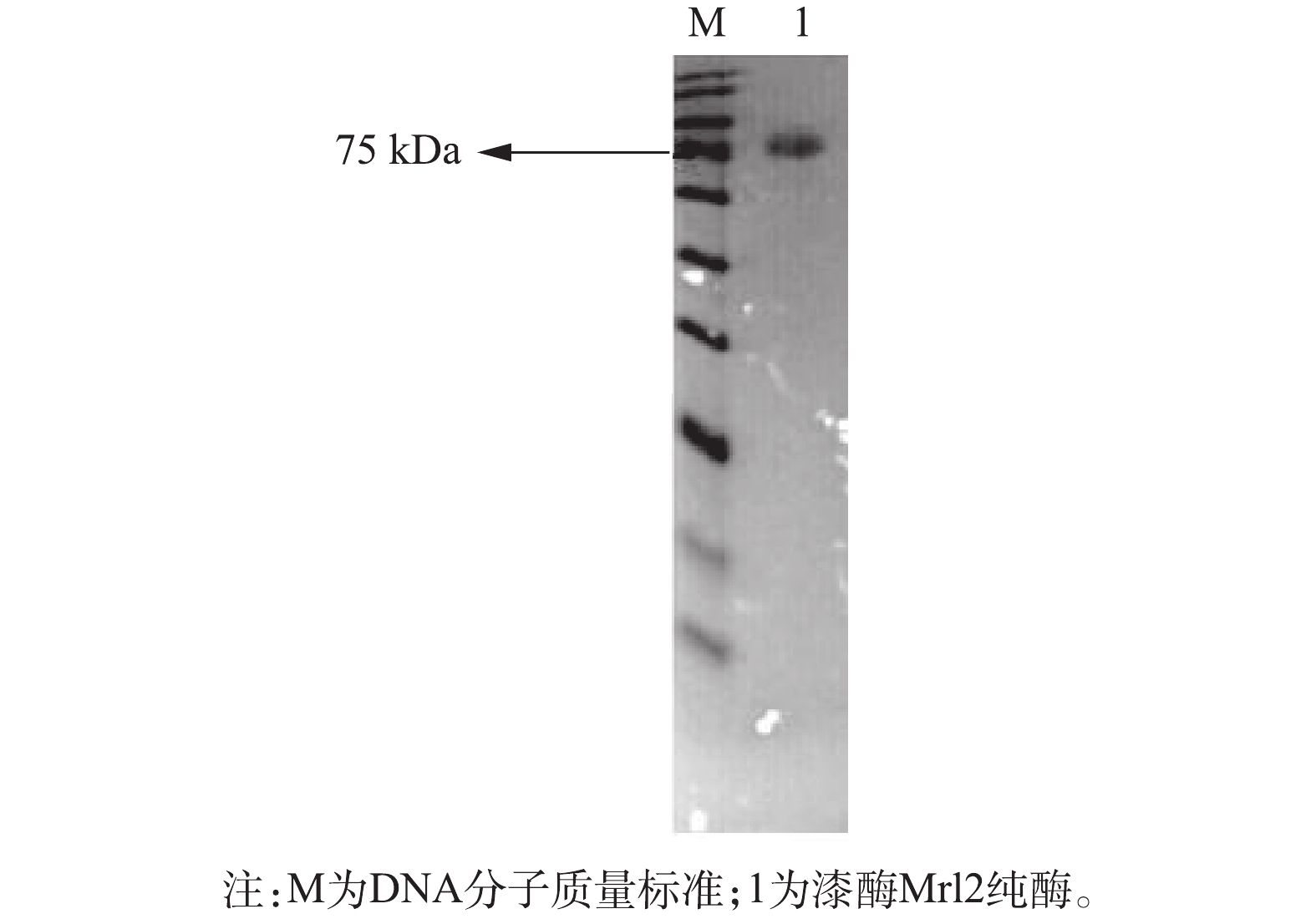
对毕赤酵母菌株X-33/pPICZα-A-mrl2进行表达培养5 d后,收集菌液,检测菌体浓度和上清液的酶活力。通过阴离子交换层析对上清液进行了纯化,经SDS-PAGE检测,纯化产物分子质量为80 kDa左右(图1),而理论分子质量应为54 kDa,可能是因为毕赤酵母中表达过程中蛋白糖基化所致。
-
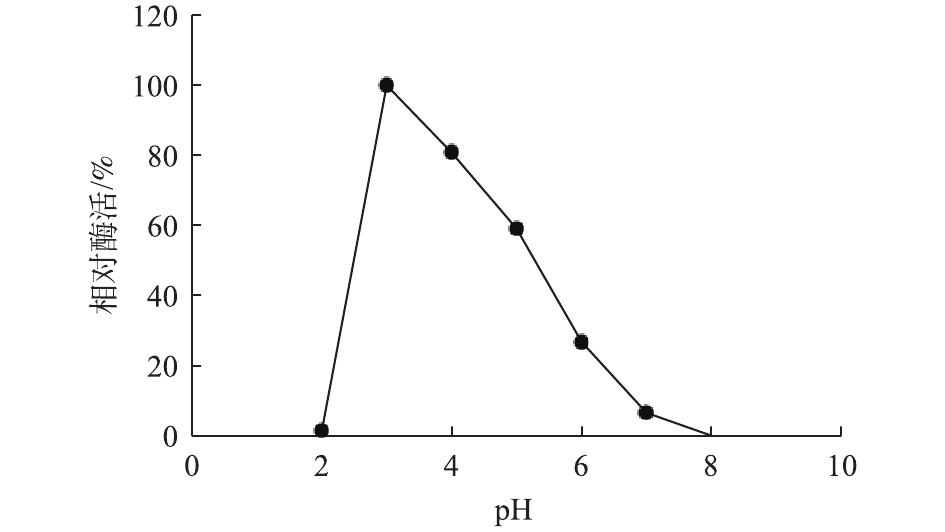
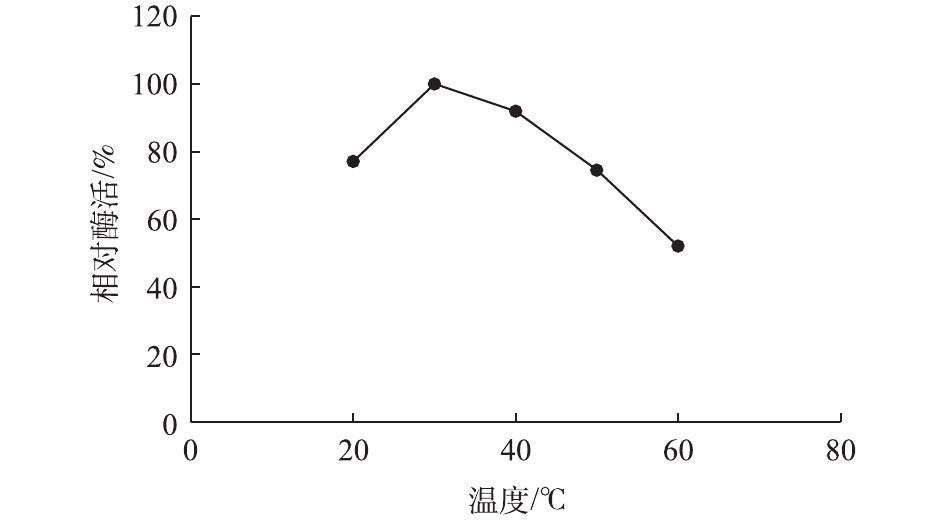
利用BCA蛋白检测试剂盒,对纯化后的漆酶进行检测,确定漆酶Mrl2的蛋白浓度为0.71 µg·mL−1。检测漆酶Mrl2 在pH 2.0~8.0时的酶活力,发现Mrl2 在pH为3.0 时活力最高(图2)。如图3所示,漆酶Mrl2最适反应温度为30 ℃,在30 ℃以下具有较好的稳定性,在40 ℃时半衰期较短,仅为1 h。根据Michaels-Menten方程式(2)的变形方程式(3),通过双倒数作图法,测得反应的Vmax值为172.8 µmol·(min·mg)−1,Km为37.61 µmol·L−1,Kcat为138.12 s−1,Kcat/Km为3.67 L· (µmol·s)−1。
式中:Cs为底物浓度;Km为米氏常数;V为反应速率;Vmax为酶被底物饱和时的反应速率。
-
根据发色基团的分子结构,染料可被分为蒽醌类、偶氮类、靛蓝类、三苯甲烷类、二苯甲烷类、吩噻嗪类、硝基亚硝基类、硫化类染料等。目前使用比较广泛的4类染料为偶氮类、三苯甲烷类、蒽醌类、靛蓝类。偶氮类和蒽醌类染料为使用最广的2类染料,每年生产的染料中,70%为偶氮类染料。20%为蒽醌类染料。三苯甲烷类染料在印染行业中应用较广泛,也是一种重要的用于痕量分析的光度显色剂,用量目前排名第3位。靛蓝类染料可用在生化药剂、着色剂、印染工业中。与上述4大类染料相比,吩噻嗪类染料具有特殊的杂环结构,因此很难脱色。为验证本研究中选择的漆酶Mrl2的广谱适用性,本研究选择了用量较多的5类染料为漆酶作用对象(表1)。
在以上5类染料中,除蒽醌类染料为漆酶底物类似物,其他几类染料均为非酶底物类染料,漆酶对其脱色率较低[1]。但是,漆酶-介体系统可明显提高其对非酶底物类染料的脱色效率,极大的扩展了漆酶的染料底物谱。由于Mrl2是中等氧化还原电势漆酶,因此选择了4个氧化还原电势[26]高于0.7 V的小分子介体(表2)来加强漆酶Mrl2的氧化作用,从而提高对各类染料的脱色效果。
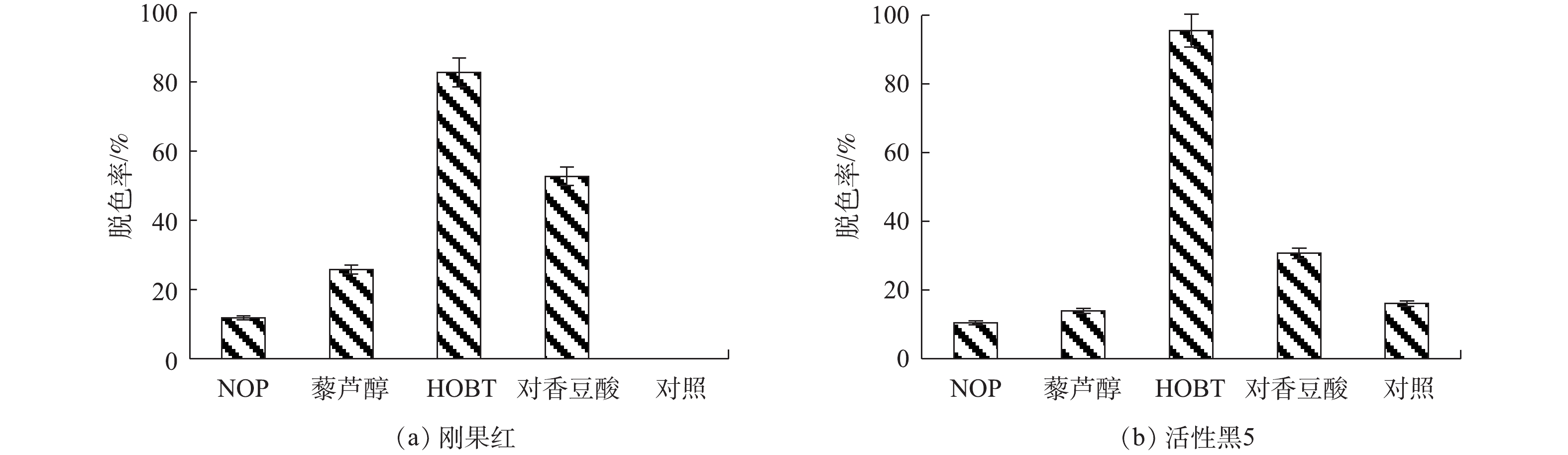
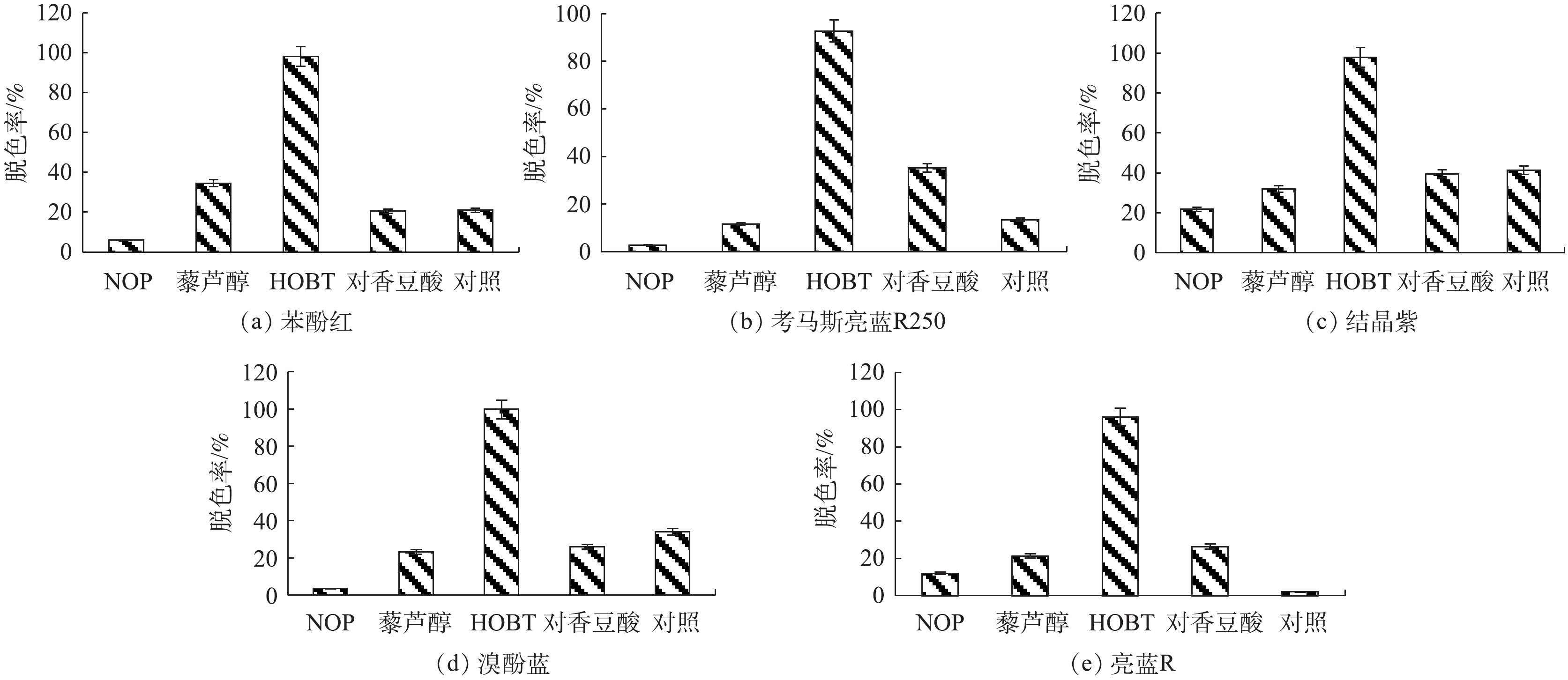
在研究漆酶-介体系统对各类染料的脱色效果时,首先利用Mrl2对第一大类染料偶氮类染料进行脱色,结果如图4所示,NOP、藜芦醇、HOBT、对香豆酸分别代表NOP、藜芦醇、HOBT、对香豆酸介体辅助下漆酶Mrl2对染料的脱色;对照为无介体参与下漆酶Mrl2对染料的脱色。结果表明:在无介体参与下,漆酶Mrl2对于偶氮类染料脱色率较低,而介体的加入强化了漆酶Mrl2对偶氮类染料的脱色能力。在HOBT辅助下,漆酶对刚果红和活性黑5 染料的脱色率明显提高,对活性黑5的脱色能力高于刚果红(脱色率分别为96%和83%),可能跟染料的分子质量、水溶性、分子结构及所带基团不同有关[27]。
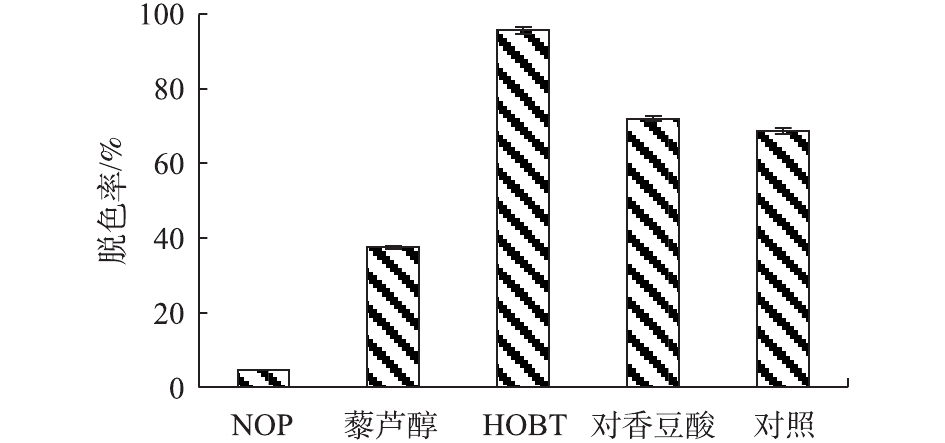
如图5所示,漆酶可直接对蒽醌类染料脱色,反应50 h后脱色率可达68.75%。这可能是因为蒽醌类染料具有蒽醌官能团,是漆酶的底物类似物,能够被漆酶直接氧化脱色,脱色程度均同漆酶的酶活力成正相关[28]。在HOBT辅助下,漆酶Mrl2对此类染料的脱色有较大促进作用,脱色率为95%以上。对香豆酸仅有较小的促进作用,而NOP、藜芦醇则显示抑制作用,这可能与染料、介体的结构有关。
虽然漆酶Mrl2可直接对三苯甲烷类染料(图6)进行脱色,但效果不显著。相比于其他4种三苯甲烷类染料,漆酶Mrl2对结晶紫的脱色效果较明显,可能是因为其分子结构较小所致。有研究者认为,三苯甲烷类染料的脱色与其分子结构有一定关系,二甲胺基的存在有助于染料分子的脱色,而磺酸基、卤素原子、酮基等的存在会使染料分子更难脱色,这与本实验的结果一致[29-31]。在HOBT辅助下,漆酶Mrl2对三苯甲烷脱色率均能达到95%以上。而Mrl2与NOP、藜芦醇或对香豆酸组成的漆酶-介体系统对三苯甲烷类染料脱色效果没有明显提高。
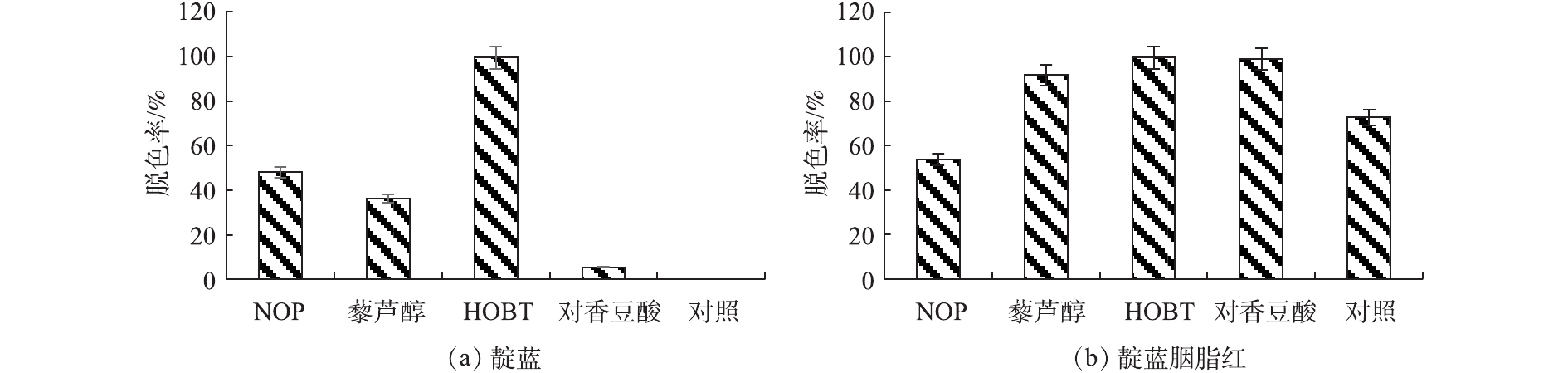
如图7所示,在无介体辅助情况下,50 h内,漆酶对靛蓝胭脂红染料脱色72.7%,但不能直接对靛蓝进行脱色。在HOBT辅助下,漆酶Mrl2对这2种染料脱色均有较大促进作用,脱色率均在95%以上。已有研究[32]发现,云芝1126漆酶不能对靛蓝“溶液”进行脱色,但漆酶-HOBT介体系统对其脱色效果显著,在最优条件下,脱色率可达90.1%。在染料降解中,像HOBT这样含有N—OH基团的N-杂环化合物是行之有效的介体[1]。藜芦醇、NOP和对香豆酸对靛蓝脱色都有促进作用。对于靛蓝胭脂红,藜芦醇和对香豆酸的参与对染料脱色有促进作用,但NOP有抑制作用。这可能与介体本身结构有关,NOP可能与真实靛蓝类染料底物存在竞争作用,从而降低了漆酶对染料的脱色效率。
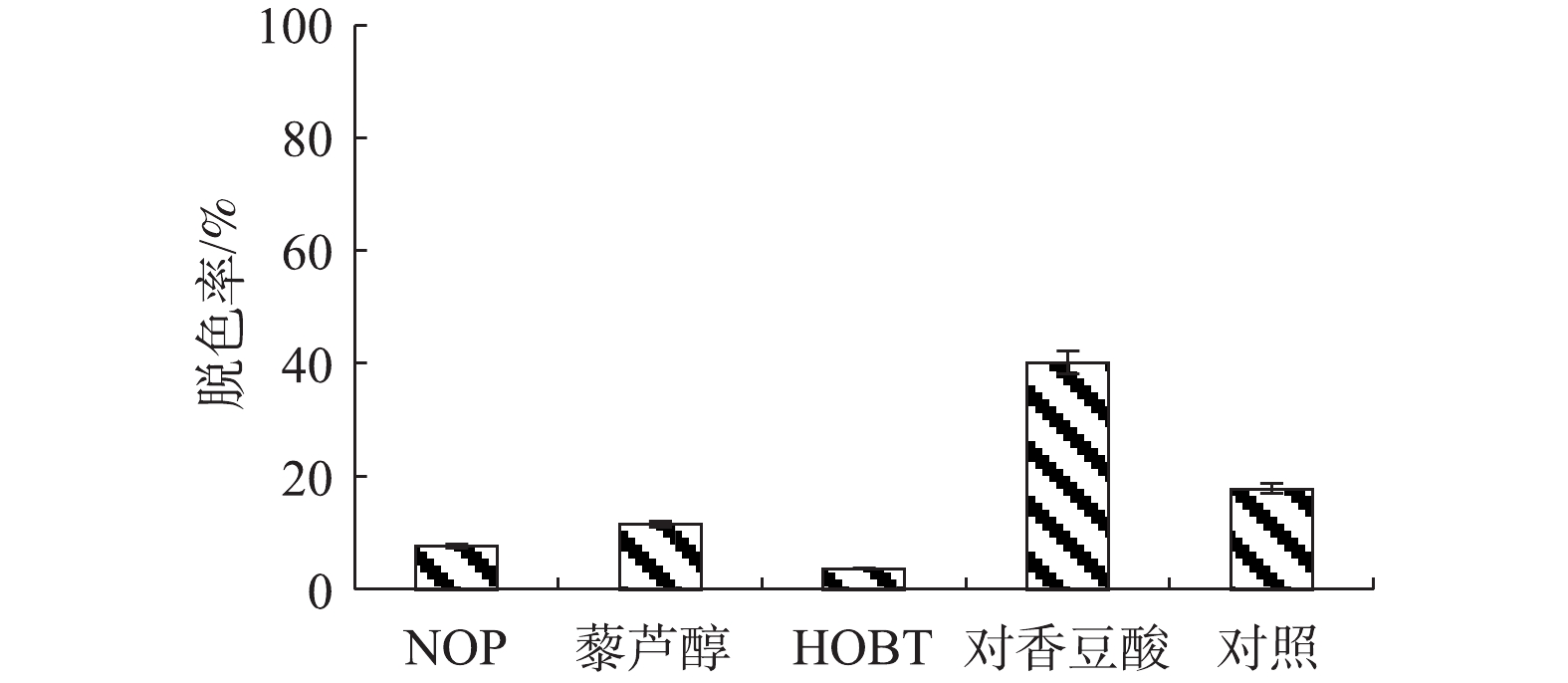
吩噻嗪类染料天青I,为难脱色染料,在未优化体系中,即使在小分子介体的辅助下漆酶Mrl2也不易对其脱色(图8)。在4个介体中,对香豆酸对天青I脱色最明显,脱色率可达40.2%。与其他几类染料相比,漆酶-介体系统对天青I染料脱色率较低,需要对脱色条件进行优化,进一步探索漆酶Mrl2对复杂杂环吩噻嗪类染料的脱色性能。
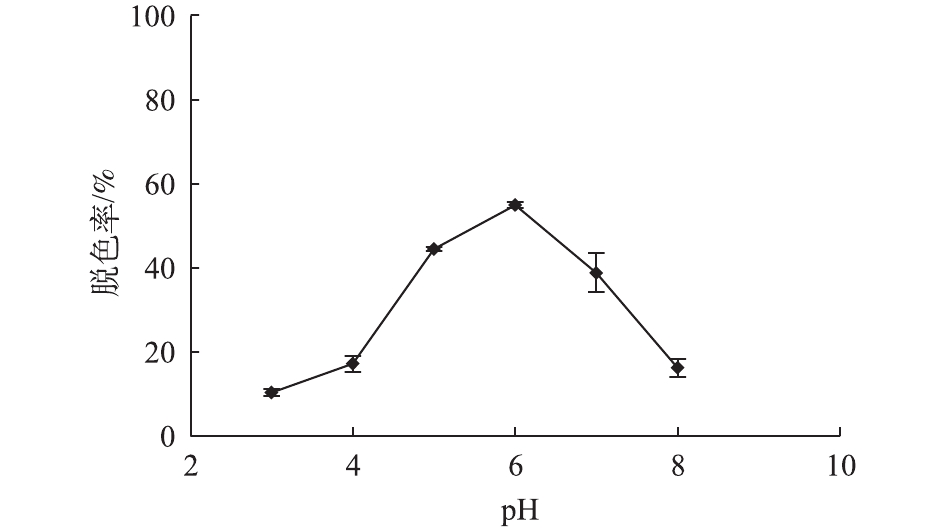
与此同时,还考察了不同因素对漆酶Mrl2氧化脱色天青I的影响。在常温下、反应1 h、天青I浓度为0.5 mmol·L−1、酶浓度为4 000 U·L−1、对香豆酸浓度为10 mmol·L−1 的条件下,考察了不同pH对天青I脱色的影响(图9)。漆酶在pH 6.0条件下对天青I的脱色率最高,达到55%。因此,确定pH 6.0为漆酶对天青I脱色的最适反应pH。运用SPSS软件对该组数据进行单因素方差分析,结果显示P<0.001, 说明差异显著。
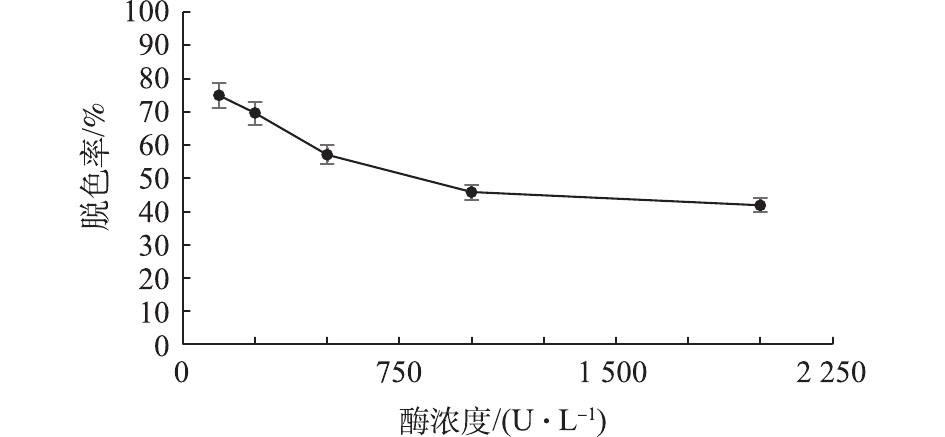
在常温、pH 6.0、对香豆酸浓度为10 mmol·L−1、天青I浓度为0.5 mmol·L−1的条件下,考察了不同酶浓度对天青I脱色的影响(图10)。在漆酶酶浓度为125 U·L−1条件下,对天青I染料的脱色率最高,13 h后,脱色率达到75%,因此,漆酶Mrl2对天青I脱色的反应体系中最适酶浓度为125 U·L−1。运用SPSS软件对该组数据进行单因素方差分析,结果显示P<0.001, 说明差异显著。
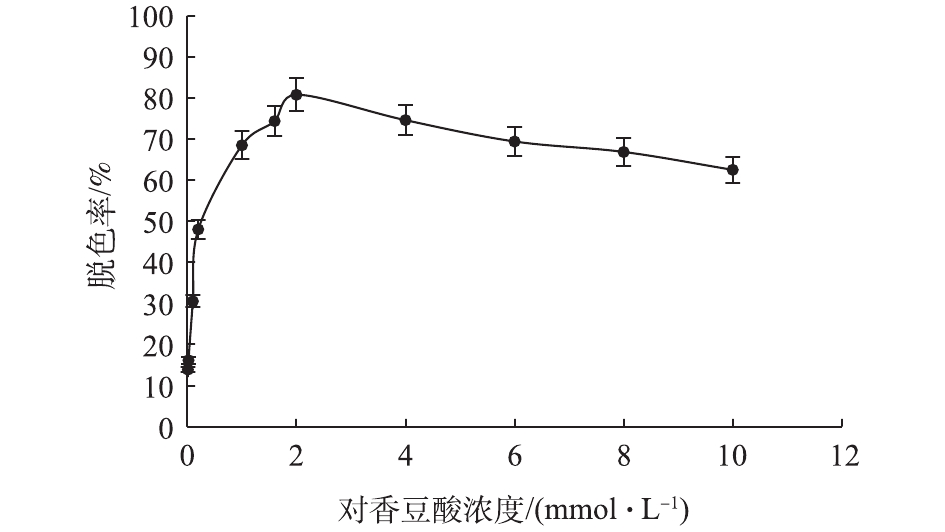
在常温、pH为6.0、天青I浓度为0.5 mmol·L−1、酶浓度为125 U·L−1的条件下,考察了不同香豆酸浓度对天青I脱色的影响(图11)。在香豆酸浓度为2 mmol·L−1条件下,20 h后,漆酶Mrl2对天青I染料的脱色率最高,达到81%。运用SPSS软件对该组数据进行单因素方差分析,结果显示P<0.01, 说明差异显著。
2.1. 漆酶Mrl2的表达纯化
2.2. 纯化后漆酶Mrl2蛋白浓度和酶学性质检测
2.3. 漆酶Mrl2对4类染料脱色研究
-
1)担子菌漆酶Mrl2与小分子组成的漆酶-介体系统对偶氮类、蒽醌类、三苯甲烷类、靛蓝类染料均具有较强的脱色能力,而文中选择的4类染料为工业染料废水的主要成分,因此,本研究选用的漆酶介体系统可处理大部分的染料废水,具有一定的广谱适用性。
2)由于蒽醌类染料具有蒽醌官能团,为漆酶底物类似物,能够被漆酶直接催化氧化;非酶底物类染料则往往难以被漆酶直接氧化脱色,需要介体辅助来提高其脱色率。
3)本研究所选用的漆酶Mrl2具有广谱高效染料废水脱色能力,能够应用于工业染料废水处理,提高脱色效率,降低处理成本,可为社会带来一定经济效益。



 下载:
下载: