-
水解酸化工艺具有处理水量大、耐冲击负荷、运行费用低等特点,在高浓度且不易生物降解的纺织印染等工业废水处理中获得了广泛的应用[1]。水解酸化工艺运行性能的评估一直是近年来的研究热点和难点[2],目前尚缺乏有效的在线评估手段和设备,常用的B/C变化以及挥发性脂肪酸含量等指标,均存在检测周期较长、反馈不及时等问题。当发生异常工况时,可能因为反馈不及时而无法进行有效地应急处理,从而对水解酸化系统运行效果以及后续生化工艺环节的处理效率和出水达标造成负面影响。因此,有必要开发新型在线评估水解酸化工艺运行性能的指标和方法,从而实现对运行工况的及时反馈。
微生物燃料电池(MFC)型传感器是一种颇具吸引力的新型电化学微生物传感器,MFC本质是一种利用微生物的催化作用,将有机物中的化学能转化为电能的电化学装置。在经典的双室MFC结构[3]中,具有胞外电子传递能力的微生物(exoelectrogenic bacteria)附着生长在阳极表面,在氧化有机生物质的同时释放电子和质子。电子通过外电路传递到阴极,同时质子透过质子交换膜或者阳离子交换膜扩散到阴极室。在阴极表面,电子、质子和氧化剂反应,最终生成稳定的还原产物,从而完成整个能量转化的电化学过程。
MFC传感器已用于各种领域,如水质监测、工艺过程在线监测、胞外产电菌筛选、腐蚀性生物膜识别和病原体检测[4-6]。近年来,研究人员又尝试开发了多种用于工艺在线诊断的MFC传感器,与传统的生物传感器相比,MFC传感器具有以下几个主要优点:待监测的水样可以为MFC提供富集阳极微生物所需的接种菌和有机底物;作为传感元件,MFC传感器中的阳极生物膜能够先天再生和自我修复,显著提高了传感器的稳定性和自我可持续性;MFC传感器不需要额外的传感器或电源,因为其可直接产生和输出电信号;在传感器操作期间,不需要额外的营养物质、底物或微生物,这简化了MFC传感器的管理和维护并降低了相关成本。
XU等[7]制作了一套潜水式MFC传感器,通过综合分析MFC电压、阳极电位和工作温度的变化,允许人们跟踪活性污泥工艺的运行状态,并提供潜在风险的早期预警,包括进水中高浓度有机物和氨氮冲击、温度异常和毒性物质冲击。结果表明,该在线监测和预警系统具有对AS体系性能变化的高度敏感,并且具有良好的稳定性和重现性。LIU等[8]研制了一种用于监测厌氧消化(AD)过程的壁喷射微生物燃料电池,发现MFC的电信号与pH变化、甲烷气体产量以及进水中的COD浓度在6个月的实验中具有良好的相关性,从而首次验证了MFC信号可以反映AD过程的动态变化。之后LIU等[9]又开发了一套集成MFC、气体流量计和pH计的新型传感器系统,重点研究该系统对厌氧发酵过程的在线诊断性能,在进水中施加不同类型冲击时,观察到MFC电信号、质子浓度和气体流速的重复瞬态响应,瞬态响应持续时间<1~6 h。而JIA等[10]则研究了一种将基于微生物燃料电池(MFC)的生物传感器和上流式厌氧污泥床(UASB)相结合的新型耦合系统,用于UASB反应器内部操作的实时在线监测,通过比较电压和pH之间的信号反馈时间点,来探索不同浓度的灵敏度。结果表明,电信号反馈比pH更敏感,并且在进水浓度为1 000~4 000 mg·L−1时,具有可接受的重现性和稳定性。
目前,基于MFC技术的生物传感器在水解酸化工艺在线监测中的应用研究鲜有报道。本研究分别模拟了水解酸化正常进水和异常进水冲击的工况,考察了MFC型传感器用于水解酸化工艺在线监测的可行性,从微观层面,探讨了不同工况下MFC阳极室内微生物群落结构特征,为扩展MFC型传感器的应用范围提供了有效依据。
全文HTML
-
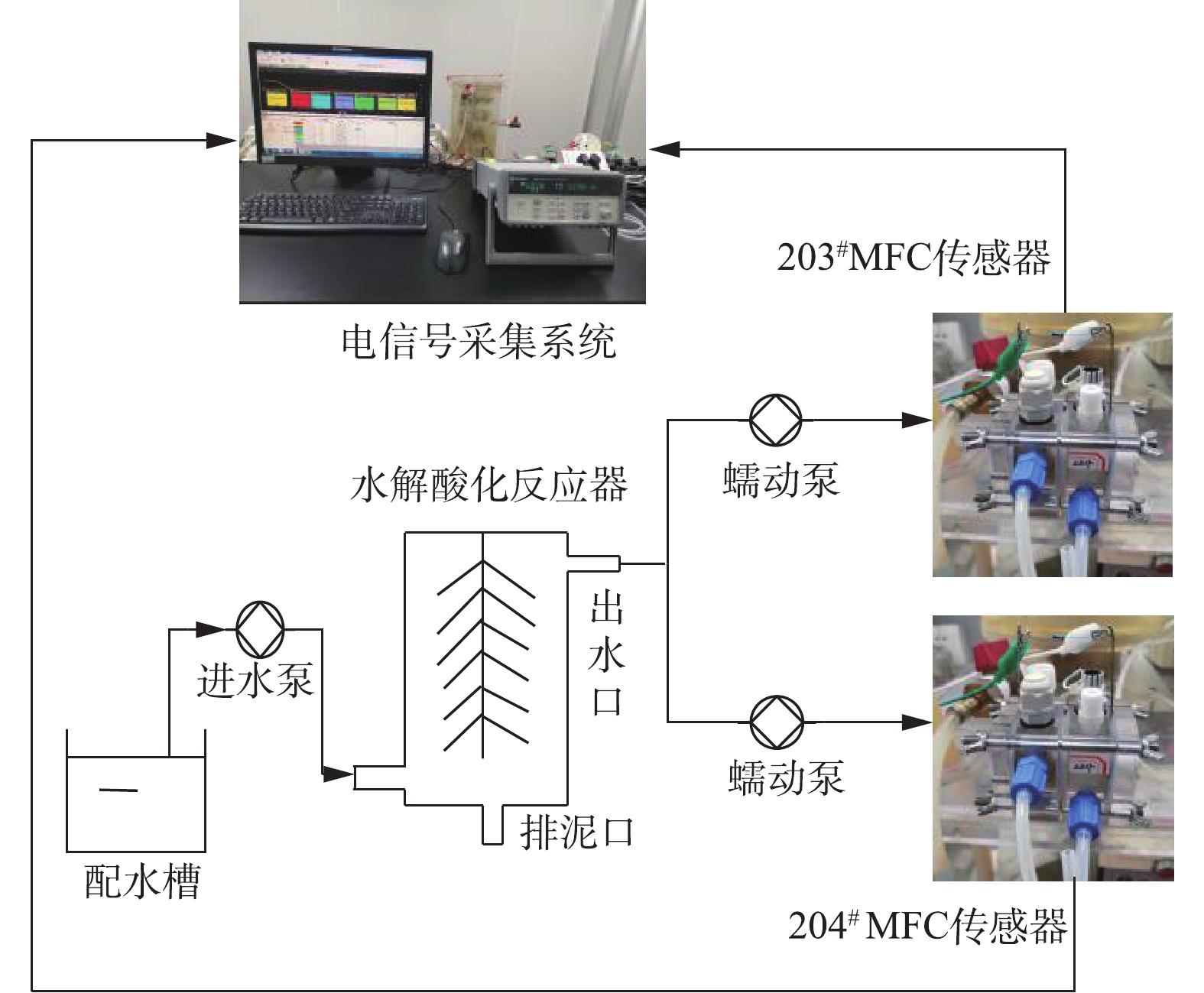
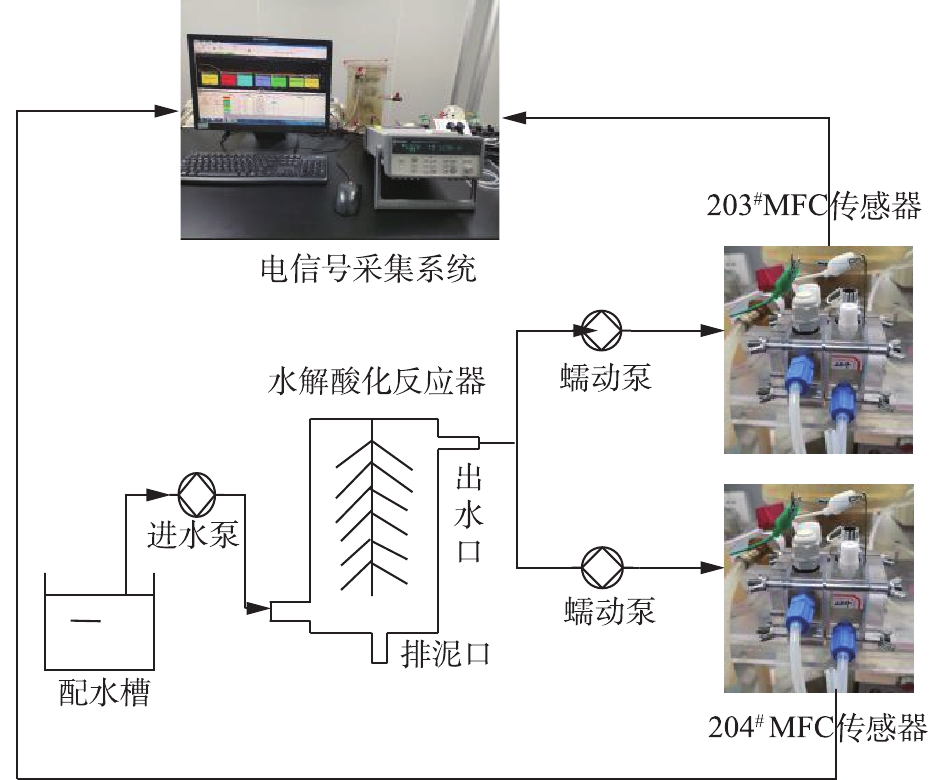
本实验装置由MFC反应器、水解酸化反应器、蓄水槽、进出水蠕动泵、数据采集系统组成,装置结构如图1所示。2套连续流式双室空气阴极MFC分别命名为203#和204#,其构型是在参考KIM等[11]的双室空气阴极MFC结构的基础上经过改造形成的,主要是在阴极室和阳极室分别增加进出水口,形成可连续运行的模式。其阳极室和阴极室直径均为3 cm,长度为2 cm,各腔室体积有效体积分别为14 cm3,阴极室和阳极室之间用Nafion117质子交换膜(美国DuPont公司)分隔开,阳极电极采用3 mm厚度的碳毡(北海碳素),空气阴极以疏水碳布(台湾碳能)为基体制备而成,其中扩散层的制备采用刮膜涂布法[12],最终涂覆4层PTFE,而催化层的制备采用史昕欣[13]的方法,所用催化剂为Pt/C,最终载Pt量为0.5 mg·cm−2。阴极和阳极均用钛丝引出,外接电阻均为1 000 Ω,并用导线与数据采集系统连接,2套MFC反应器的阳极进水口均与水解酸化体系出水口连接。
水解酸化反应器为有机玻璃材质,内径均为10 cm,高度为380 cm,有效容积为3 L,外层包裹2.5 cm厚水浴保温层,污泥载体为组合填料。水解酸化体系水力停留时间为12 h。所有实验均在30 ℃恒温房中进行。
-
实验考察了MFC反应器间歇启动和运行情况。203#MFC反应器预先进行间歇启动,接种污泥为经过厌氧培养的广州市某城市污水处理厂二沉池剩余污泥,初始底物采用葡萄糖,并将其在接种液中投加量保持为1.0 g·L−1,最终实测接种液COD为(1 050±25) mg·L−1,此外,接种液中污泥的投加量为10.0 mL·L−1,微量元素[14]溶液的投加量为12.5 mL·L−1,另外还包含0.31 g·L−1的氯化铵、0.13 g·L−1的氯化钾、3.32 g·L−1二水磷酸二氢钠、10.32 g·L−1十二水磷酸氢二钠。阳极接种液每天更换。当连续3 d最高电压变化不超过5%时,停止投加接种污泥,并将营养底物更换为1.282 g·L−1的醋酸钠,COD保持为1 000 mg·L−1,其余成分与接种期相同。当电压再次达到稳定后,继续培养70 d,以稳定阳极生物膜,之后再将203#MFC接入水解酸化体系出水口处。
204#MFC反应器则不进行预先启动(即阳极没有富集电活性生物膜),跟203#反应器同步接入水解酸化体出水口处进行对照实验。2套反应器阴极均注入50 mmol·L−1的磷酸盐缓冲溶液,其成分包括0.31 g·L−1的氯化铵、0.13 g·L−1的氯化钾、3.32 g·L−1二水磷酸二氢钠、10.32 g·L−1十二水磷酸氢二钠。阴极液隔天更换一次。
实验分析了MFC电信号对水解酸化体系启动阶段运行效果的反馈情况。水解酸化体系运行分为启动期和低碳氮比进水冲击2个阶段。第1阶段为启动期,进水由葡萄糖、淀粉、尿素、磷酸二氢钾以及微量元素配制而成,碳氮比始终保持为40∶1,COD采用梯度升高方式,从300 mg·L−1依次提高至500 mg·L−1和800 mg·L−1,最后提高至1 000 mg·L−1,每次等出水水质基本稳定3 d后,再调整进水COD。最终水解酸化体系进水主要成分包括200 mg·L−1葡萄糖、842 mg·L−1淀粉、46.7 mg·L−1尿素、27.2 mg·L−1磷酸二氢钾、5 mL·L−1微量元素,在此期间持续采集MFC电压信号。
实验分析了MFC电信号对水解酸化体系进水低碳氮比冲击的反馈情况。当水解酸化体系稳定运行后,进入第2阶段低碳氮比进水冲击实验。保持进水中COD值不变,改变氮的投加量,使进水碳氮比依次调整为0.5∶1、0.5∶1、20∶1、8∶1、4∶1、2∶1、1∶1,主要目的是考察MFC电信号对于低碳氮比冲击反馈的重现性以及MFC电信号强度与冲击浓度的相关性。每次冲击结束后,先将进水替换为正常碳氮比(40∶1),等水解酸化系统出水恢复至基本稳定运行状态后,再施加下一个浓度的冲击,在此期间持续采集MFC电压信号。
-
每天取水解酸化体系的进出水分析,COD采用分光光度法测定,总氮采用分光光度法测定。MFC电压信号采用安捷伦数字万用表(Agilent 34970A)采集,连接电脑,数据采集和记录的频率为1次·h−1。
-
分别采集以下样品:203#MFC接种污泥;203#MFC间歇启动成功后,接入水解酸化系统前的阳极生物膜;203#MFC和204#MFC接入水解酸化体系之后,稳定运行70 d,正常进水期间的阳极生物膜和阳极室悬浮物;第7批次的低碳氮比冲击实验结束后,19 d的203#MFC和204#MFC阳极生物膜和阳极室悬浮物。将以上所有样品对照进行宏基因测序[15],并鉴定各样品中的菌群组成。
1.1. 实验装置
1.2. 实验方法与流程
1.3. 数据采集及分析方法
1.4. 基于Illumina平台的16S rDNA宏基因组测序
-
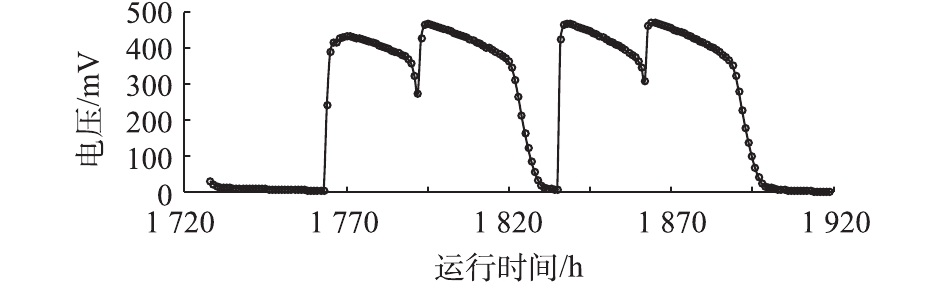
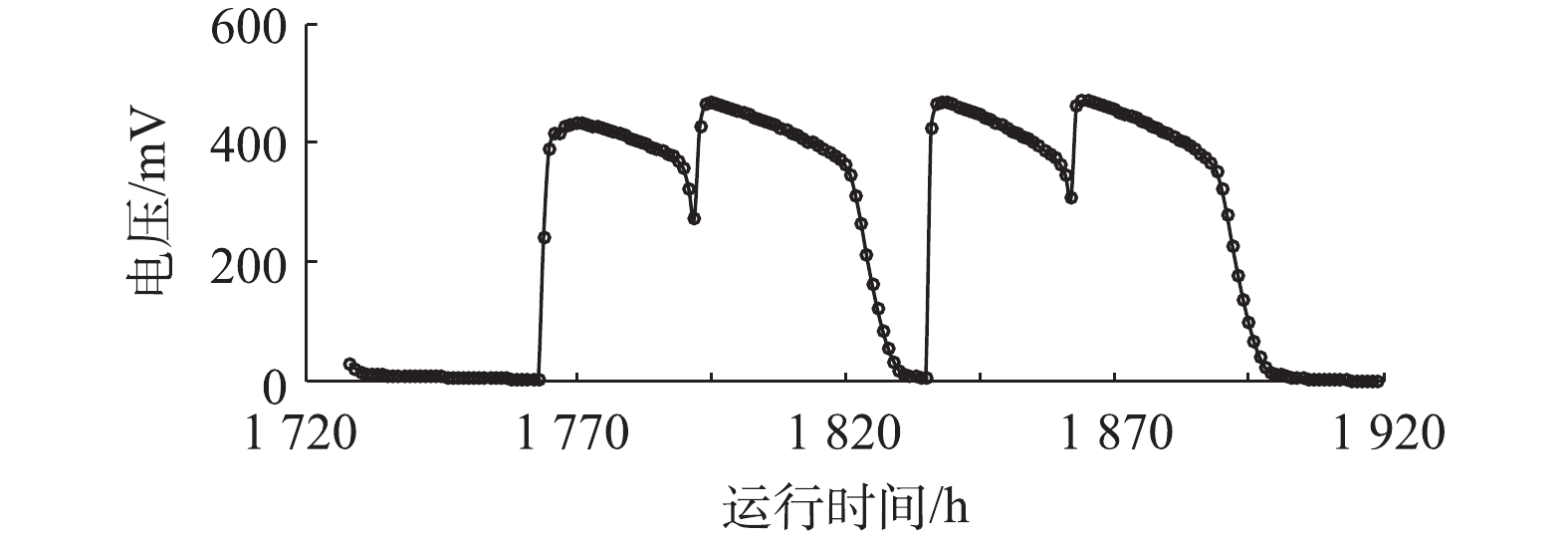
203#MFC从接种到第1次稳定产电,耗时34 d;停止投加底泥并更换阳极底物后,再次达到稳定产电状态,耗时5 d;之后为稳定生物膜,继续培养70 d。图2为自接种开始到第72~79 天(1 728~1 919 h)之间的产电曲线,可以看出,每个周期的最高电压为(450±20) mV,且每个周期产电曲线具有较好的重现性。
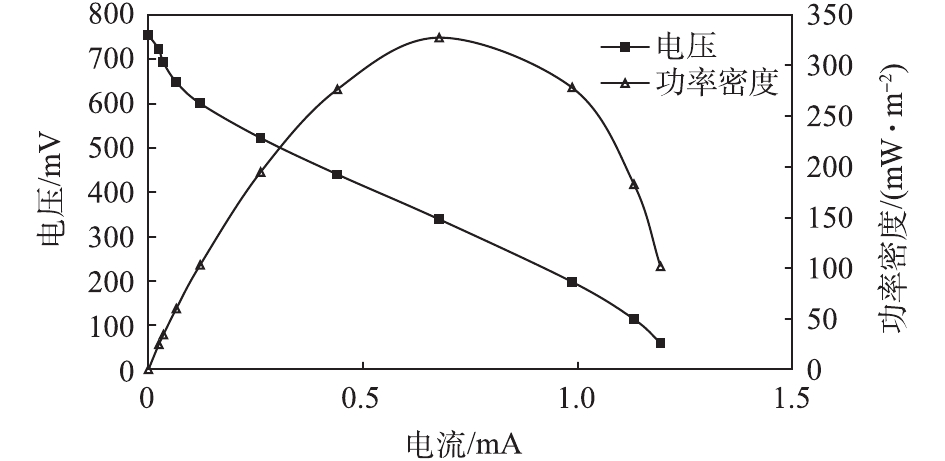
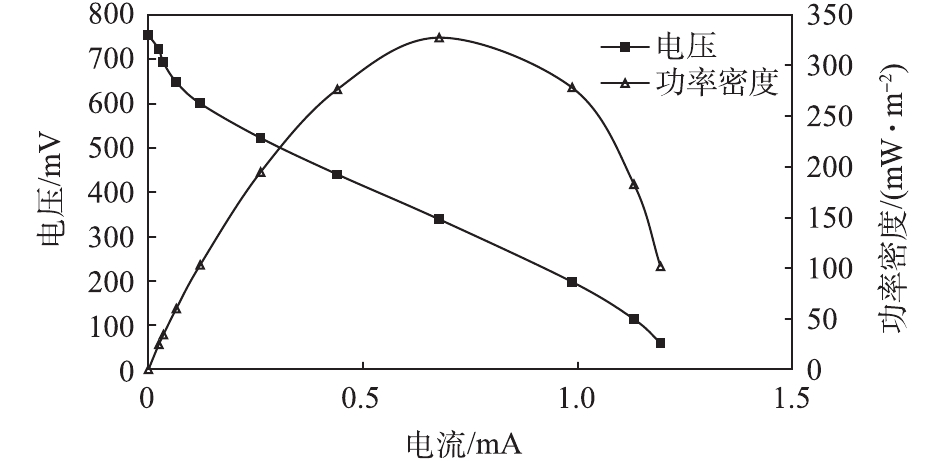
203#MFC稳定培养运行至第104天时,采用电阻箱法[16]测定了其极化曲线和功率密度,结果如图3所示。可以看出,最大功率密度为327 mW·m−2,说明阳极产电菌性能良好[17]。
-
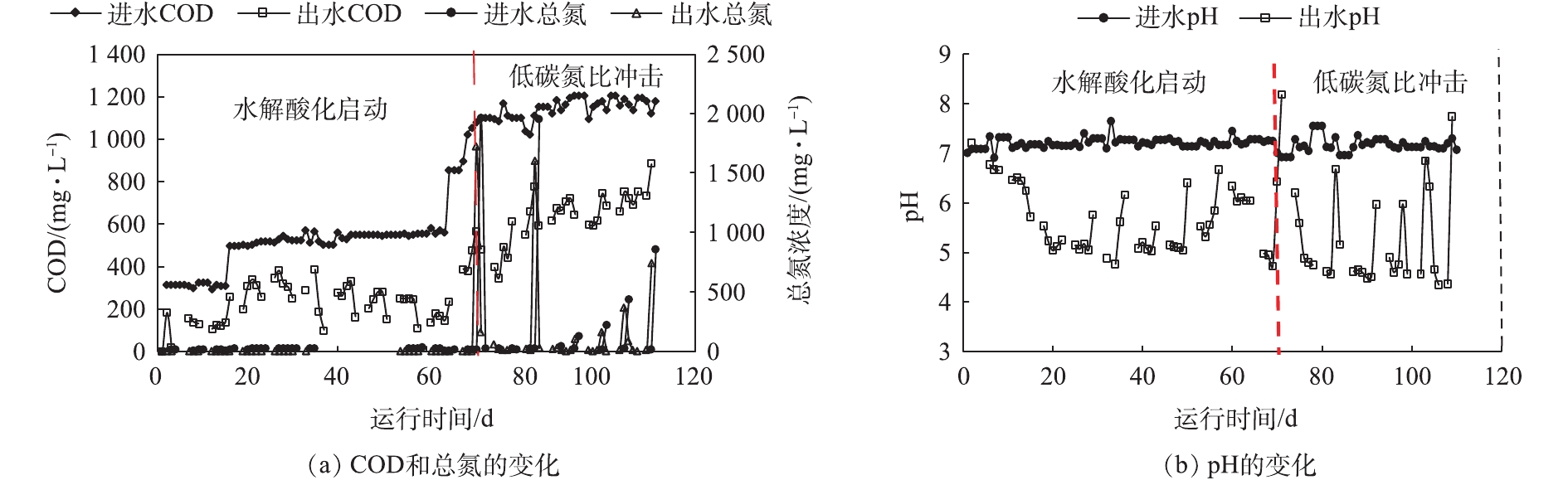
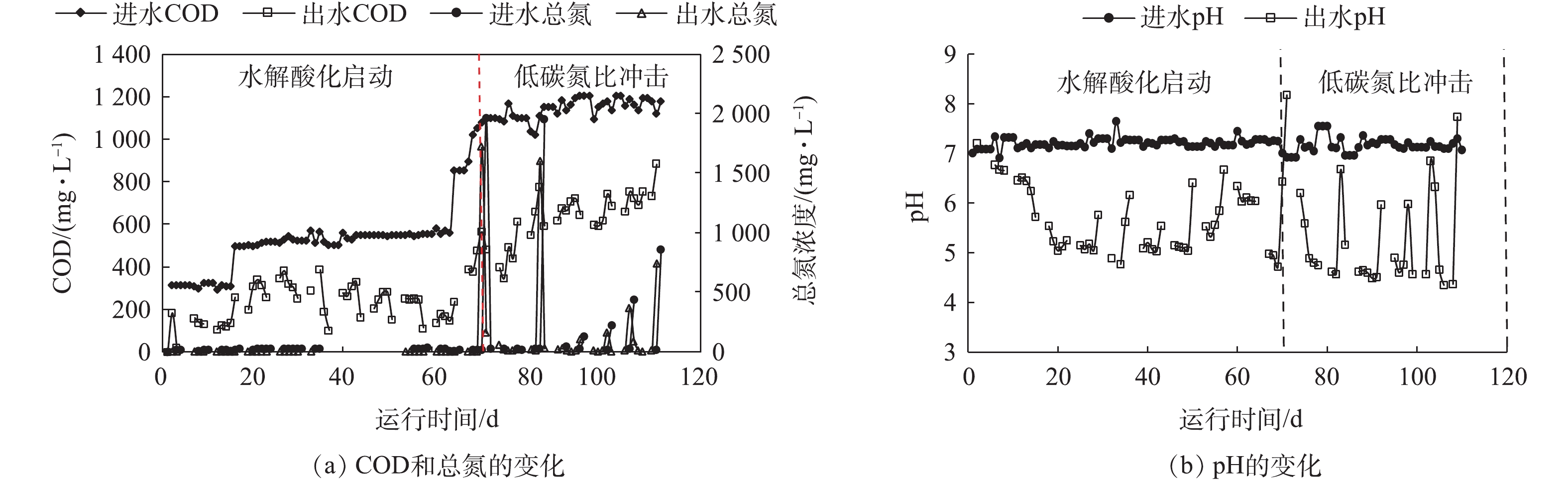
图4反映了整个实验期间水解酸化体系进出水主要水质指标的变化情况。实验总体分为2个阶段。第1阶段为启动期,分梯度提高COD浓度,当COD为300~1 000 mg·L−1时,进水碳氮比始终保持在40∶1,历时70 d。由图4(a)可以看出:第1阶段,去除效果相对稳定,其中COD平均去除率50%以上,总氮平均去除率约20%;第2阶段,在进水中保持COD浓度基本不变,间歇性施加7次低碳氮比的冲击,历时近40 d,在此期间COD去除率有明显波动,去除率下降至40%以下,尤其施加1∶1和0.5∶1的超低碳氮比冲击时,COD去除率降低至30%以下,总氮去除率则为10%~25%。
图4(b)反映了水解酸化体系进出水pH变化趋势。可以看出,进水pH在整个实验期间始终维持在7左右,而出水则在2个阶段存在不同程度的波动,其中第2阶段波动更为显著。每次在进水中施加多次低碳氮比冲击后,pH会显著升高,进水碳氮比为0.5∶1和1∶1时,pH升高的幅度更大,原因可能是进水冲击期间,高浓度的有机氮会发生氨化反应,生成大量的氨氮[15],而大量铵根离子的水解使得出水pH有所升高。
-
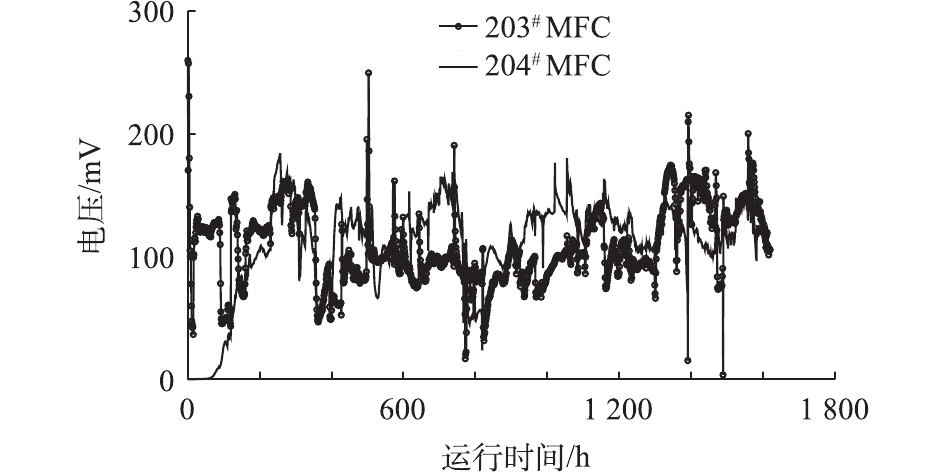
图5反映了水解酸化启动期间MFC电信号的反馈情况。可以看出,在第1阶段水解酸化进水由300 mg·L−1提高至1 000 mg·L−1的过程中,碳氮比维持在40∶1的情况下,2套MFC电信号的变化趋势与水解酸化体系对主要污染物的去除率的变化趋势较为一致,波动幅度较小,整体较为平稳。
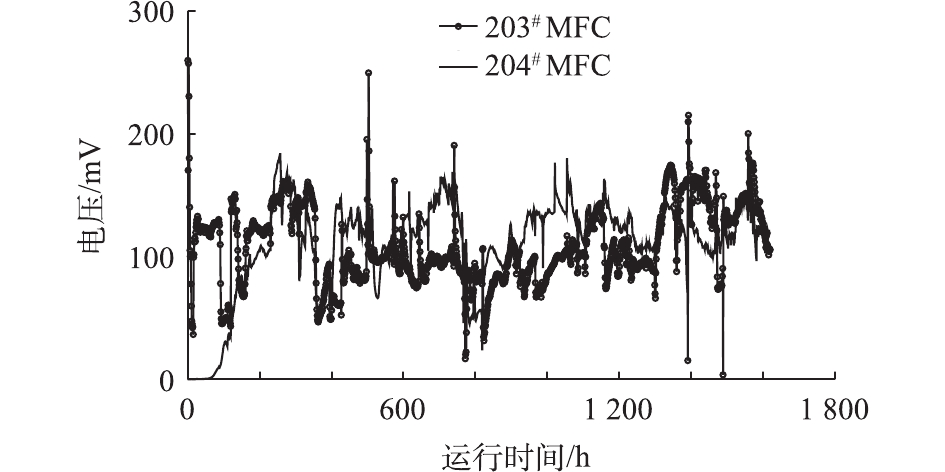
203#MFC因提前富集了阳极生物膜,接入水解酸化系统后可以持续产电,但在最初的15 h内,电信号迅速从260 mV下降至50 mV以下,之后才再次回升,且峰值明显低于刚接入时的电压值。分析其原因:203#MFC培养期间的底物为产电菌容易利用的醋酸钠,而接入水解酸化体系后,阳极底物变为葡萄糖和淀粉的水解酸化产物,此外大量水解酸化体系的微生物被带入MFC阳极室,阳极产电微生物需要重新适应;204#MFC因为阳极未提前富集产电菌,接入水解酸化系统后,水解酸化体系出水中的悬浮微生物进入204#MFC的阳极室,并逐步被驯化产电,历时约120 h后,204#MFC也开始有电信号反馈,且系统整体运行至230 h时,204#MFC电压信号已经达到与203#MFC基本相同的水平。
-
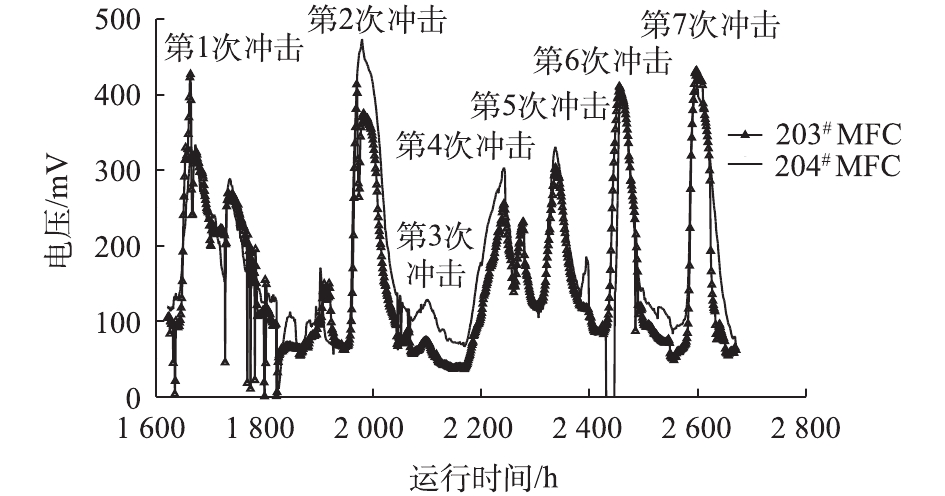
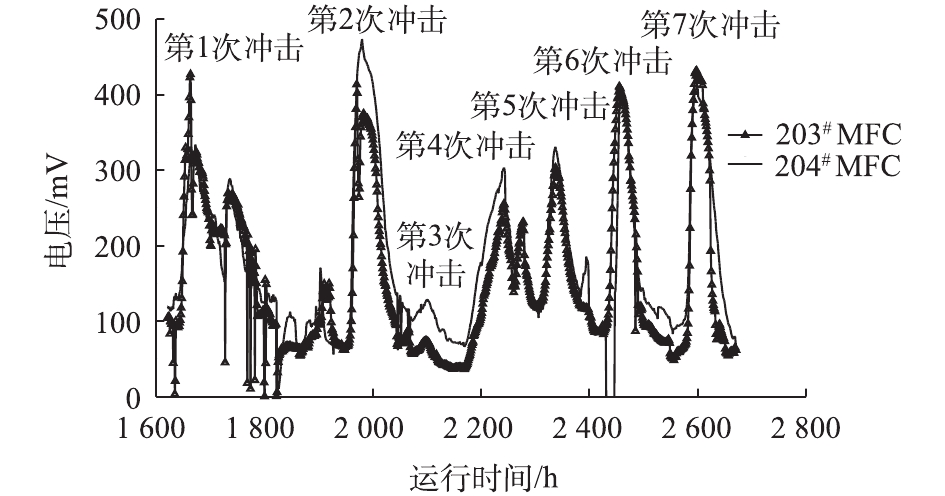
图6反映了向水解酸化体系进水间歇多次施加低碳氮比冲击后,2套MFC的电信号反馈情况。可以看出,MFC电信号对水解酸化体系进水的低碳氮比冲击有显著的增强反馈。可能原因是:实验通过保持进水COD不变,提高进水中尿素的浓度来实现低碳氮比冲击,而高浓度的尿素以及水解产物可以作为产电菌的底物,刺激产电[18-19];此外,GIL等[20]研究发现,阳极底物的pH对于MFC产电性能有明显影响,在将阳极底物从pH= 5逐步提高至pH=9的过程中,当pH为7~8时,产生的电流最大,且产电菌的活性最强,因此,低碳氮比冲击期间,水解酸化出水pH的升高也可能是促使MFC中电信号出现增强反馈的原因之一。后续还需要考察MFC对水解酸化体系遭受不同碳源以及氮源冲击时的反馈效果,以明确MFC对于水解酸化体系发生不同类型的进水冲击时反馈是否具备普遍适应性。
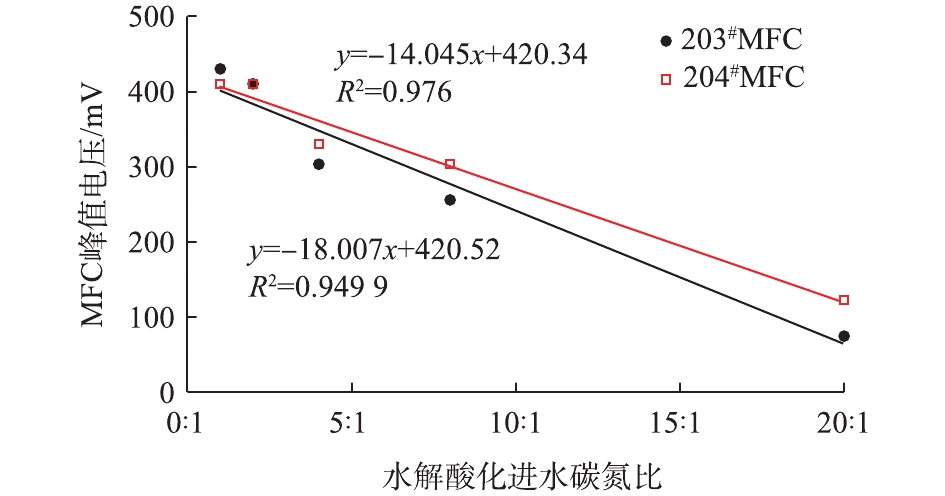
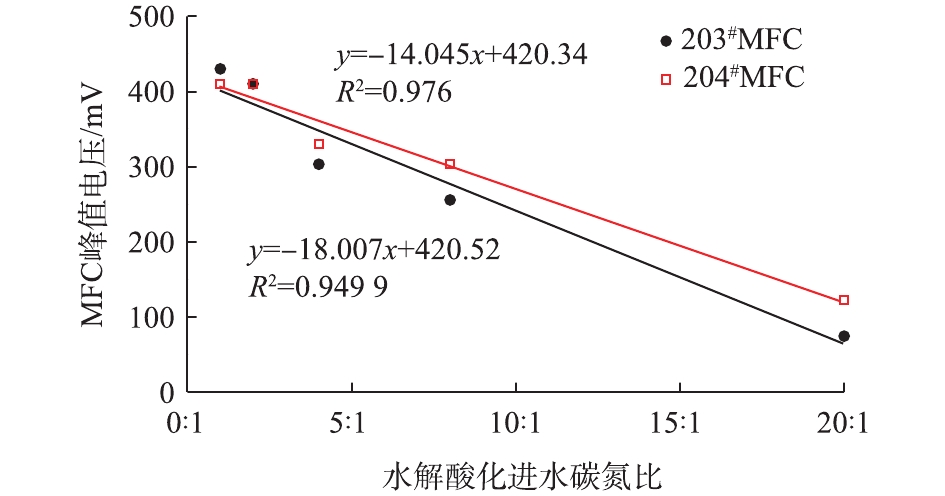
在第2次冲击发生后,2套MFC的电信号均在3 h后开始明显上升,并且相比第1次冲击,均提前到达电压峰值。203#在第17小时达到峰值,而204#MFC则于第27小时到达电压峰值,且峰值电压相比第1次冲击期间明显升高,说明MFC电信号对于低碳氮比冲击反馈具有重现性。并且经过第1次冲击后,MFC对于相同碳氮比的冲击反馈的灵敏度明显提高。此后,在5个低碳氮比(分别为20∶1,8∶1,4∶1,2∶1,1∶1)的进水冲击发生后,由图6可看出,2套MFC的电压均在5 h内开始持续上升,2套反应器在第3~7次冲击期间的峰值电压与进水碳氮比值的变化趋势如图7所示。可以看出,冲击期间的峰值电压和进水碳氮比值之间呈现较好的线性关系。
由此可以看出,MFC具备用于水解酸化工艺在线监测传感器的可行性,MFC电信号的增强可以反馈水解酸化进水的低碳氮比冲击,并且当水解酸化体系进水碳氮比为20∶1~1∶1时,可以通过MFC的最高电信号来定量判断碳氮比的比值,具体定量关系如图7所示。当水解酸化体系运行过程中观察到MFC电信号持续异常升高时,记录最高电压峰值,将其带入线性关系式中,以此初步判断进水碳氮比值是否发生异常变化。但在后续研究中,还需对MFC性能进行优化,以进一步提高MFC反馈电信号与水解酸化进水碳氮比之间的线性可决系数。
-
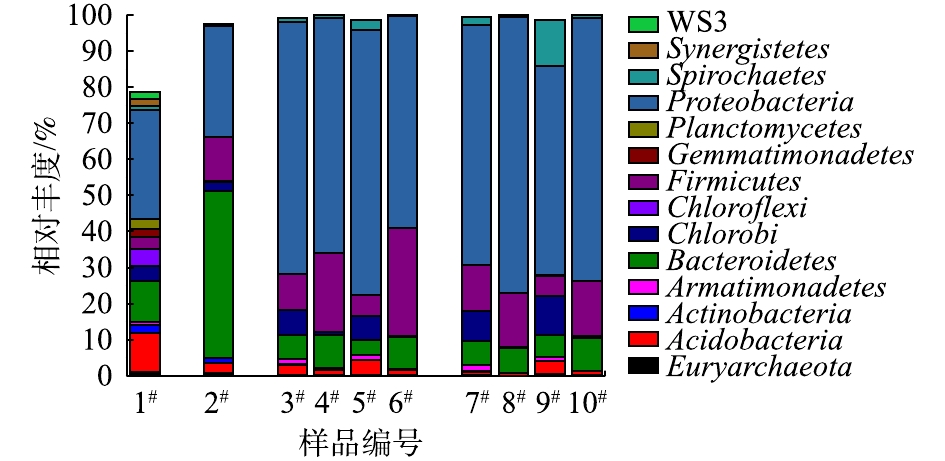
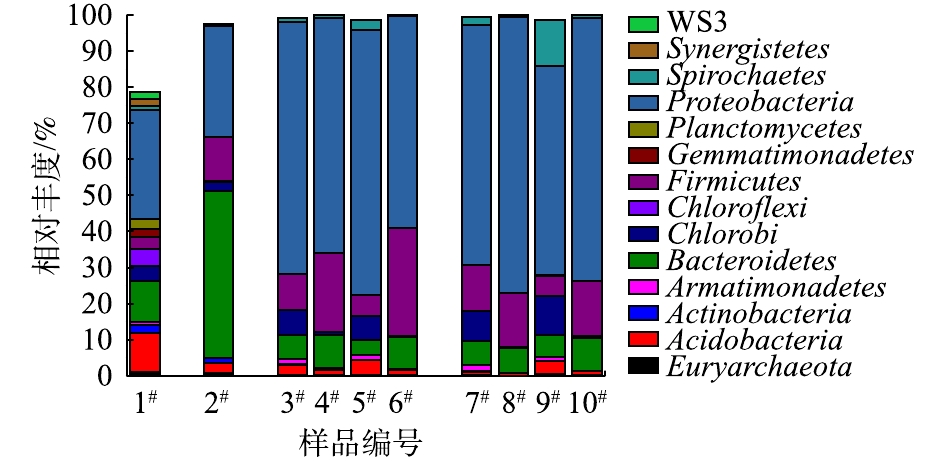
为研究MFC对水解酸化体系进水冲击产生信号反馈的深层机理,分别采集不同时期的MFC阳极室内微生物样品进行种群鉴定分析。样品编号顺序如下:1#为种泥;2#为间歇启动稳定运行的203#MFC阳极生物膜;3#为水解酸化体系正常进水期间的203#MFC阳极生物膜;4#为第7次冲击结束后的203#MFC阳极生物膜;5#为水解酸化体系正常进水期间的204#MFC阳极生物膜;6#为第7次冲击结束后的204#MFC阳极生物膜;7#为水解酸化体系正常进水期间的203#MFC阳极室悬浮物;8#为第7次冲击结束后的203#MFC阳极室悬浮物;9#为水解酸化体系正常进水期间的204#MFC阳极室悬浮物;10#为第7次冲击结束后的204#MFC阳极室悬浮物。
不同样本在门水平上的种群丰度见图8,只统计丰度大于1%的菌门(丰度低于1%的菌门对种群的组成和功能影响较小)。可以看出,203#MFC启动成功后,阳极生物膜中的微生物种群相比种泥发生了显著的变化,种泥中的优势菌门为拟杆菌门Bacteroidetes和变形菌门Proteobacteria;而经过产电驯化后,203#阳极生物膜中的优势菌门Bacteroidetes得到了极大的富集,且厚壁菌门Firmicutes的丰度也明显增加,而优势菌门Proteobacteria的总丰度相对变化不大。此外,菌纲分析结果显示,此阶段203#MFC阳极生物膜优势菌纲主要为Bacteroidia、β-Proteobacteria和Clostridia。以往研究[21-24]已证明,以上菌纲的微生物均可以参与产电。
对比3#样品与2#样品可以看出,将事先富集了阳极生物膜的MFC接入水解酸化体系一段时间后,优势菌群会发生明显改变。203#阳极生物膜优势菌门Proteobacteria的丰度显著升高,而之前的优势菌门Bacteroidetes的丰度相对则显著下降,203#MFC阳极室悬浮物中微生物组成与阳极生物膜基本一致。主要是由于进入203#MFC的底物与生物膜培养时期相比发生了明显改变。而204#MFC阳极室则从零开始成功富集产电微生物。而向水解酸化体系间歇施加7次冲击之后,2套MFC中阳极生物膜的优势菌门Proteobacteria的丰度稍有下降,绿菌门Chlorobi的丰度则在多次冲击后显著下降;Bacteroidetes和Firmicutes菌门的丰度均有不同幅度的升高;2套MFC阳极室内的悬浮微生物菌群组成和生物膜上的微生物菌群变化规律不同,优势菌门Proteobacteria丰度明显上升。
综上所述,当水解酸化体系进水发生低碳氮比的冲击时,MFC的电压信号出现明显升高反馈的原因:一是受到2.2节中讨论的pH变化的影响;另一个重要原因是水解酸化体系出水中高浓度的尿素及其水解产物进入MFC阳极室,刺激了阳极生物膜中优势菌门厚壁菌门Firmicutes、拟杆菌门Bacteroidetes和悬浮物优势菌门变形菌门Proteobacteria的富集。
2.1. MFC间歇启动效果
2.2. 水解酸化体系总体运行效果
2.3. MFC电信号对水解酸化体系启动阶段运行效果的反馈情况
2.4. MFC电信号对水解酸化体系进水低碳氮比冲击的反馈情况
2.5. MFC阳极室内微生物种群在水解酸化体系冲击前后的变化
-
1) MFC具备用于水解酸化工艺在线监测的可行性,其中水解酸化体系进水碳氮比40∶1的状态下,MFC电信号的变化趋势与主要污染物去除率变化趋势基本一致,波动幅度较小,整体较为平稳。
2)当水解酸化进水遭遇异常低碳氮比冲击时,MFC电信号会有明显的增强反馈,且阳极提前富集成熟生物膜的MFC比空白阳极直接接入水解酸化系统的MFC反馈更灵敏,并且在碳氮比为20∶1~1∶1时,MFC的峰值电压与碳氮比呈现较好的线性关系。
3) 当水解酸化体系进水发生低碳氮比的冲击时,MFC的电压信号出现明显升高反馈的原因,除了受到pH变化的影响之外,另一个重要原因是水解酸化体系出水中高浓度的尿素及其水解产物进入MFC阳极室,刺激了阳极生物膜中优势菌门厚壁菌门Firmicutes、拟杆菌门Bacteroidetes和悬浮物优势菌门变形菌门Proteobacteria的富集。
4)在后续的研究中,还需要考察MFC对水解酸化体系遭遇不同类型进水冲击的反馈效果,并且对MFC本身的构型进行优化,提高其灵敏度并缩短响应时间,使其更符合实际应用的需要。





 下载:
下载: