-
近年来,高负荷活性污泥法(high-rate activated sludge process, HRAS)在碳源捕获与回收方面展现出巨大的潜力,成为了污水厂实现碳中和、能源自给等目标的热门工艺[1-5]。在优化泥龄(SRT)、水力停留时间(HRT)、溶解氧(DO)等工艺参数和提高HRAS污水碳源捕获率等方面,已取得了阶段性成就。然而,关于HRAS的数学模型的研究较少。有机组分表征是HRAS模型建立的基础,有助于HRAS的设计、运行与优化。
活性污泥法1号模型(activated sludge model number 1, ASM1)在传统活性污泥法(conventional activated sludge process, CAS)中应用最为广泛。CAS为低负荷系统,进水可生物降解有机物(以COD计)污泥负荷为0.2~0.6 g·(g·d)−1,SRT>3 d,HRT通常可达数小时甚至几十小时。而HRAS的SRT通常小于2 d,HRT为0.5~1 h,负荷高达2~10 g·(g·d)−1。因此,HRAS与CAS的微生物和酶系组成、底物降解程度以及生物学过程等存在明显差异,ASM1无法直接应用于HRAS[6]。ASM1将可生物降解的有机物划分为易生物降解有机物(SB)、慢速生物降解有机物(XB)以及微生物(异养菌XH和自养菌XA)。HAIDER等[7]通过对AB系统进出水水质进行分析发现,SB 并不能全部在A段去除,残余的SB只能在B段去除,并认为SB应该分为2种组分。NOGAJ等[8]认为,SB可分为快速生物降解溶解性有机物(SBf)和慢速生物降解溶解性有机物(SBs),两者均可被异养菌直接吸收而不必通过水解过程,不同的是前者的利用速率高于后者。而HENZE[9]认为,溶解性可生物降解组分中存在部分快速水解型有机物(SH),这部分有机物在HRAS系统中不能被异养菌直接利用。HRAS中的异养菌为快速生长型细菌,与污水原水中的异养菌类似,但与CAS系统存在差异[6]。HRAS涉及生物絮凝和细胞贮存,因此,胞外聚合物和细胞贮存物也被划分为模型组分[8]。但是,子过程和模型组分的增加并不一定会提高模型预测的准确性,反而可能导致模型参数辨识难度增加,实用性和拓展性降低。
目前,尚未有针对HRAS有机组分表征的报道,更无标准化组分表征方法的编制。本研究使用氧利用速率(oxygen utilization rate, OUR)测试装置获取污水原水OUR曲线,采用双水解模型对HRAS进行了建模,并对OUR曲线拟合且估计了模型参数;同时,利用灵敏度和共线性分析方法[10-11],解决了模型参数识别问题,从模型组分的角度分析了提高碳源捕获量的工艺参数优化方向,还提出了提高模型参数实践识别能力的方法,为HRAS模型建立提供保障。
全文HTML
-
本研究采用的双水解模型修正自ASM1,模型矩阵如表1所示。该模型包括易生物降解有机物SB、快速水解型有机物SH、慢速水解型有机物XB及异养菌XH等4种有机组分以及溶解氧SO,共5个组分,不包括氮组分。总共涉及4个子过程:异养菌的好氧生长、快速水解型有机物的水解、慢速水解型有机物的水解和异养菌的衰减。快速水解有机物水解过程的k1大于慢速水解过程的k2。污水原水与HRAS系统中异养菌均为快速生长型细菌[2, 12],因此,对原水直接进行OUR测试并拟合OUR曲线,足以表征HRAS的有机组分。由于OUR测试时,溶解氧始终保持在3 mg·L−1以上,故异养菌的生长、水解等过程不受溶解氧的限制,因此,对应的子过程中不含溶解氧开关函数。异养菌的衰减采用内源呼吸理论,不采用死亡-再生理论。由表1可知,氧气在子过程1和4中出现,因此,理论OUR模拟值OURmod(η(θ))计算方法见式(1)。
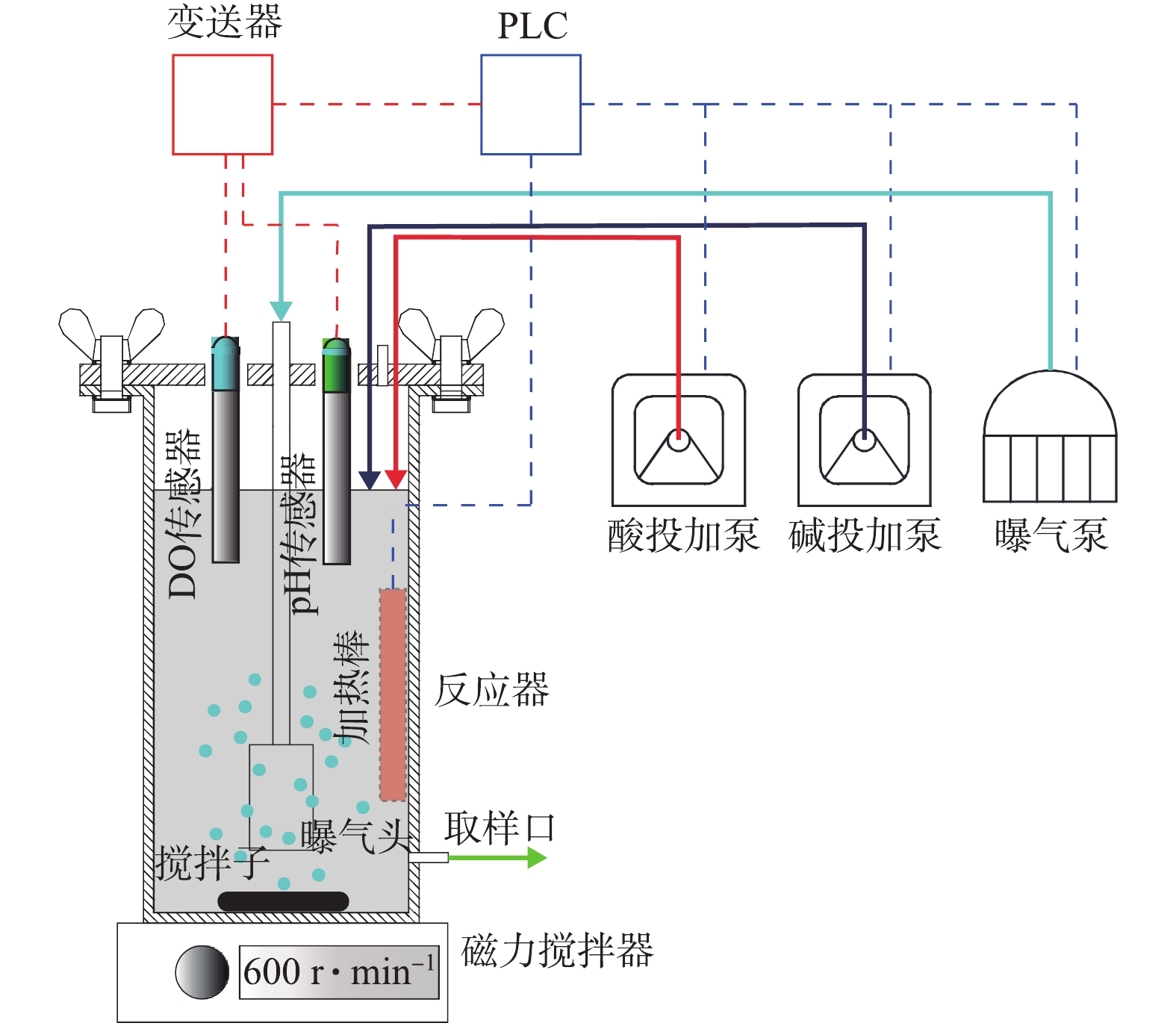
OUR的测试装置如图1所示,为典型的液相-静止气体-静止液体(liquid phase principle-static gas-static liquid,LSS)型反应器[13-14]。将一定体积的污水原水加入测试装置,同时加入20 mol·L−1烯丙基硫脲(ATU),抑制潜在的硝化作用,进行间断式曝气,利用加热棒进行加热,同一批测试期间温度保持稳定。pH通过自动投加1 mol·L−1的NaOH和1 mol·L−1的HCl进行控制。曝气由PLC进行开关量控制,当DO小于下限时,开启曝气;当DO大于上限时,停止曝气。在停止曝气时,溶解氧下降阶段的斜率为实测OURexp。
-
模型参数估计可分为3个主要步骤[15-17]:根据目标函数,拟合实际数据,估计参数值;进行不确定性分析,求得置信区间及两两参数之间的相关性;灵敏度与共线性分析,评价参数是否可以准确识别。
多次实验表明,OURmod与OURexp的误差服从正态分布,因此,以含权重余差平方和(WRSS)作为目标函数J(θ)估计参数值。目标函数如式(2)所示。
式中:Y为OUR实测值OURexp;η(θ)为OUR模拟值OURmod;θ为参数;W为对角权重矩,对角元素为实测值OURexp的倒数。
当进行不确定性参数分析时,参数估计值的协方差矩阵C(θ)如式(3)所示。
式中:N为总数据个数;p为参数个数;Qm为估计误差的协方差矩阵。
在一定的显著性水平α下,参数估计值的置信区间θ1−α如式(4)所示。
式中:t(N–p, α/2)为t分布值;diag(C(θ))表示θ协方差矩阵的对角元素。
那么,两两参数θi和θj之间的相关性矩阵R(θi, θj)如式(5)所示。
式中:σθi为θi的参数估计的标准偏差;σθj为θj参数估计的标准偏差。
当进行灵敏度和共线性分析时,相对灵敏度Sr计算方法如式(6)所示。
参数重要性排序值δmsqr如式(7)所示。
参数组合K的共线性指数γK计算方法如式(8)~式(10)所示。
式中:eigen为矩阵特征值;
˜S 为标准化欧式范数;||Sr||为相对灵敏度的欧式范数。以γK=5~20作为限值用于判断参数是否可以准确识别[15-17]。若γK<20,即可认为该参数组合可以被识别。
1.1. 双水解模型与OUR
1.2. 模型参数估计
-
污水有机组分表征结果见表2。序号1~8为原水的OUR测试结果,序号9为原水与活性污泥混合液的OUR测试结果,其原水水质与序号8相同。SB0、SH0、XB0和XH0的比例分别为13.9%、11.6%、12.6%和12.8%。
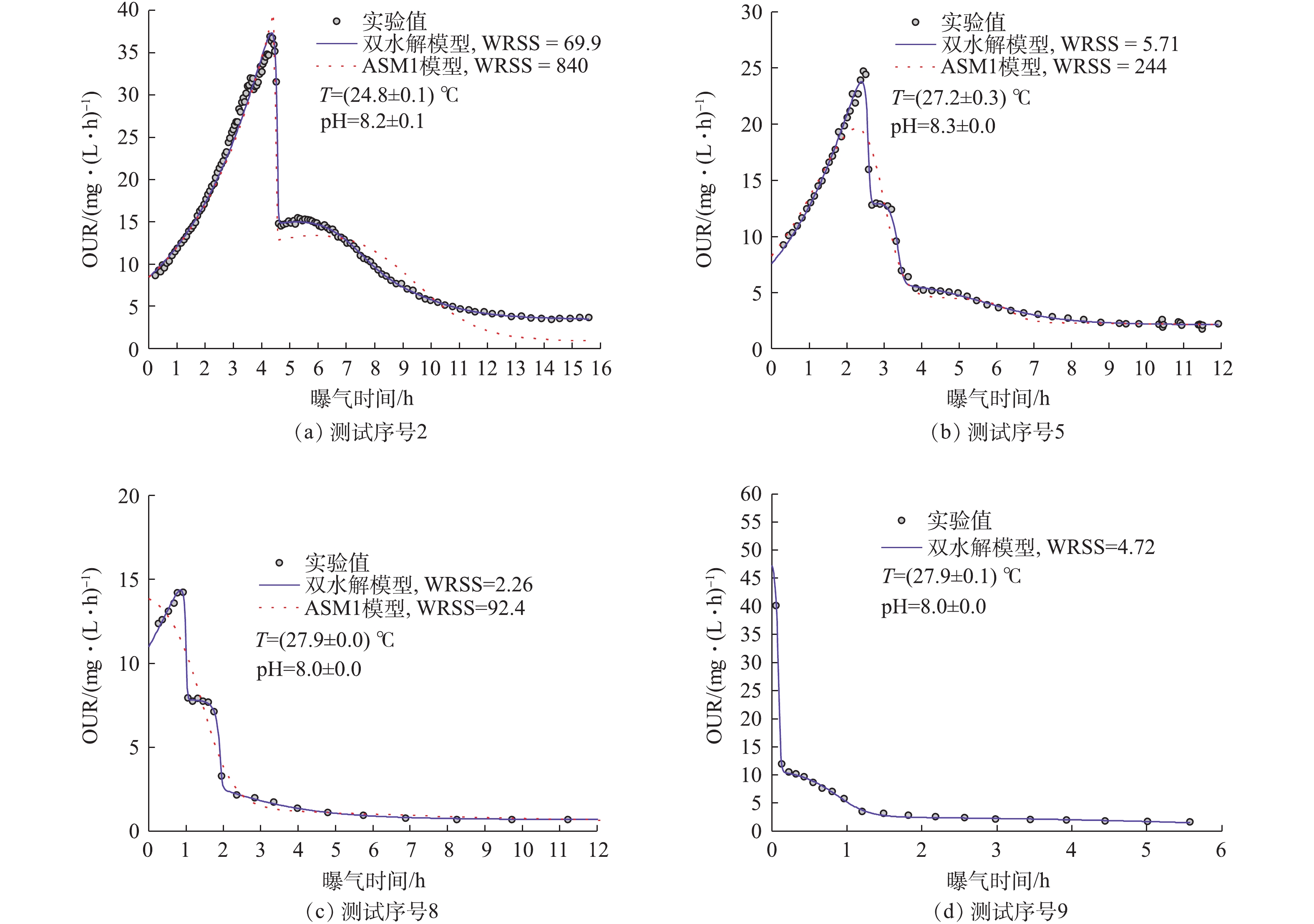
HOCAOGLU等[18]利用低负荷OUR测试方法对黑水进行了水质表征,发现SB0、SH0和XB0比例分别为14.7%、29.7%和50.7%。其与本研究中的SB0相差不大,但是他们所检测到的水解性组分分别为本研究的2.65倍和3.99倍。这是因为HOCAOGLU等[18]的研究对象是低负荷、高泥龄的常规活性污泥系统,活性污泥中的微生物和酶系种类和数量多,能够对原水土著微生物或者HRAS中微生物无法水解的有机物进行水解。HENZE[9]的研究表明,常规污水中的SB0、SH0、XB0和XH0的比例分别为15.0%、25.0%、27.5%和19.8%,除SB0外的其他组分均高于本研究的结果。SH0、XB0比例高的原因与上述相同;而XH0高的原因是,对于常规集中式污水厂,污水运输管线长,加上重力排水系统可以进行大气复氧,微生物有足够的停留时间利用污水中底物进行增殖。由于污水厂进水特性受服务范围内居民生活方式、气候(如温度、降雨)、污水厂运行状况等因素的影响大,因此,原水有机物浓度及其组成差异较大。每一个测试序号(序号9除外)组分估计精度高,在95%置信度下,置信区间长度均小于2 mg·L−1。图2(a)~图2(c)为污水原水OUR测试的拟合效果,明显地,双水解模型均能取得良好的拟合程度,而 ASM1拟合程度差。尽管双水解模型对原水与活性污泥的混和液OUR测试数据也能够获得良好的拟合效果(图2(d)),但估计精度极低,数据不可信。其可能原因有以下2点:一是实践识别的问题,F/M低,易生物降解COD在短时间内(数分钟至十几分钟)被活性污泥利用完全,而LSS型反应器采样频率低,无法对这一过程进行准确的检测[12],与SB降解过程相关的模型参数也就无法准确估计;二是结构识别的问题,在测试序号9中,使用活性污泥与污水混合,其泥龄为50~60 d,水解型COD可能无需分为SH和XB,换言之,两者降解过程的动力学参数及计量学参数相同。但第2个原因的可能性较小,因为ASM1无法对图2(d)中的数据点进行准确拟合。
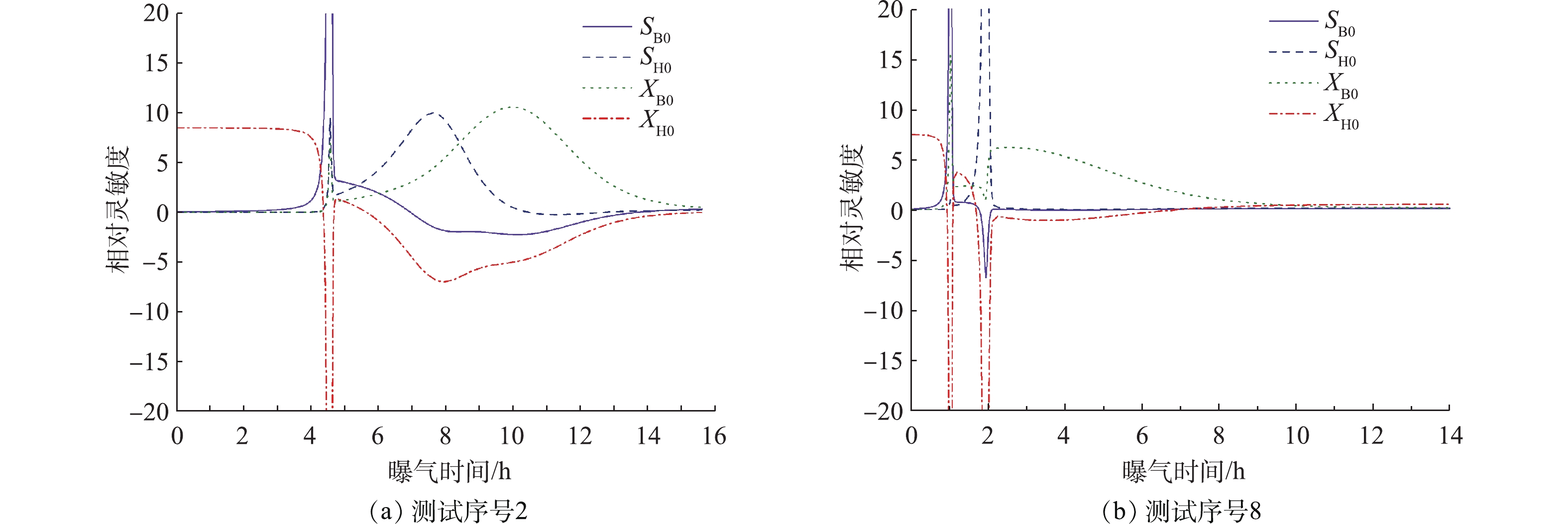
模型参数辨识绝大程度上取决于模型输出对模型参数灵敏度的分析:灵敏度绝对值越高,说明该参数对模型输出的影响越大,绝对值越低或者接近零,说明对输出的影响较小甚至无影响;当灵敏度为负值时,表明参数值增加会减少模型输出;当灵敏度为正值时,表明参数值增加会导致模型输出增加;参数之间灵敏度曲线相同或者相似,这说明参数之间可能存在相关性[13]。图3(a)和图3(b)分别为序号2和序号8模型组分初始值的灵敏度曲线。在同一测试过程中,4个组分的灵敏度曲线各具特点,相似程度较低,这说明组分之间的整体相关性低。在SB利用完全前,XH0的灵敏度保持在某一较大的正值不变,而其他组分的灵敏度几乎保持在零,这说明此阶段内OUR曲线的灵敏参数为XH0。在最大比生长速率μH和产率系数YH已知、忽略内源呼吸的前提下,可利用这一阶段估计XH0[19]。在SB利用完全时间点附近,4条灵敏度曲线均发生突变,并出现峰值(图3(b)中SH0峰值较小),而此时刻恰好为OUR曲线最高点,这与理论分析结果一致。在XH0保持不变的前提下,底物浓度初始值尤其是SB0增加,会延长OUR对数上升期,推迟OUR陡降。而XH0的增加会加速底物利用,从而导致SB0更早地被消耗,OUR陡降提前。SB利用完全后,在图3(a)中,SH0和XB0灵敏度曲线相似程度高,两者均是先上升后下降,但两者的形状有差异,SH0比XB0更早出现正的峰值。而图3(b)中,SH0和XB0灵敏度曲线形状差异很大。正是因为图3(a)和图3(b)对应的灵敏度曲线形状存在差异,两者对应的OUR曲线也不同(如图2(a)和图2(c)所示):序号8的有机物降解过程具有更加明显的阶段性,即OUR陡降后出现明显的OUR平台。
模型组分参数拟合的共线性指数γK如表2所示。γK越低,共线程度越小,估计值可信度越高。由表2可知,除序号9外,其他测试的γK均小于20,这说明直接对污水原水进行OUR测试,可准确辨识所有有机组分(其中惰性组分可用COD守恒计算出来)。γK的大小与OUR曲线形状存在相关性,OUR曲线阶段性越明显,γK越小。因此,序号3~8的γK小于序号1和序号2。
-
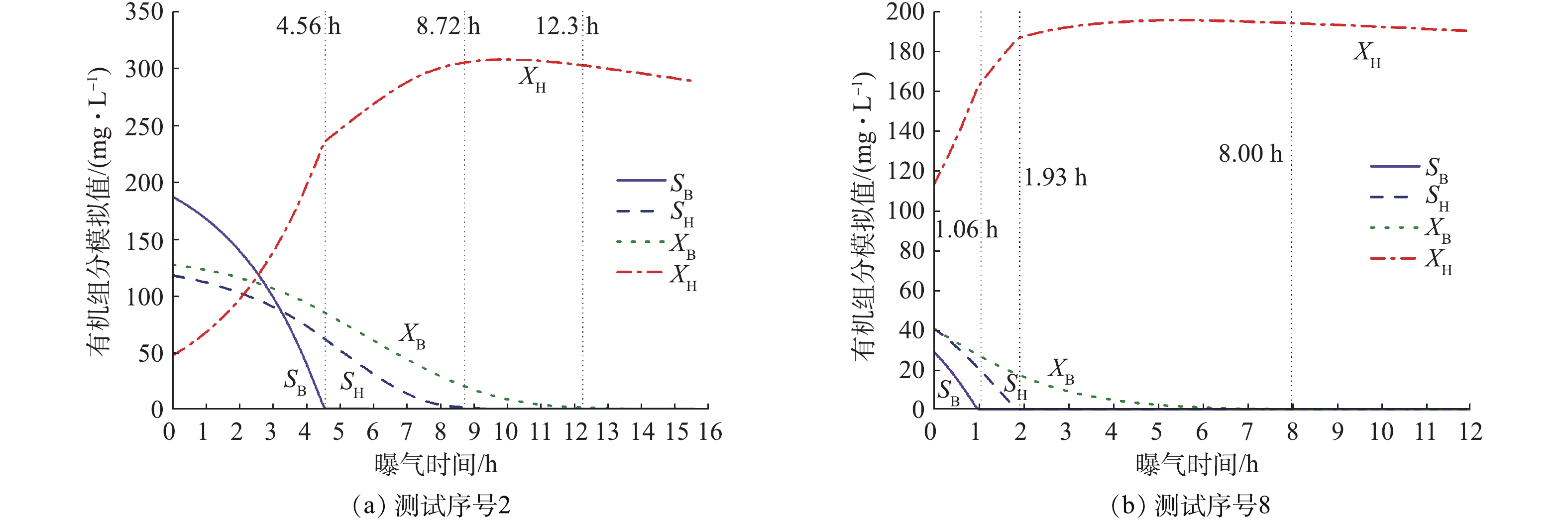
如图4所示,快速生长型微生物(即原水中的微生物)利用原水中有机物的过程大致可以分为4个阶段:阶段I(0~t1),SB利用完全;阶段II(t1~t2),SH水解完全;阶段III(t2~t3),XB水解完全;阶段IV(t3至测试结束),无底物存在。尽管纵轴并不表示细菌数的对数,但还是可以将上述阶段对应微生物的对数增长期(阶段I),稳定期(阶段II和III)和衰亡期(阶段IV)。不存在明显的延迟期是因为微生物已经适应了原水环境,无需合成新的酶系即可利用底物。序号2模型组分SB0、SH0、XB0和XH0的初始值分别为186.7、117.6、127.1和47.3 mg·L−1,而序号8对应的初始值分别为29.6、41.2、41.3和112.7 mg·L−1。序号8的SB、SH和XB等3个可生物降解组分明显低于序号2,而微生物量XH为序号2的2.4倍。序号2的SB、SH和XB利用完全的时间点分别为4.56、8.72和12.3 h,均多于序号8组分降解所需的时间:1.06、1.93和8.00 h。这是因为序号2测样时间为春季,排水管网中温度低,微生物活动弱,污水在管道中转化程度小。而序号8在炎热的夏季测样,微生物活动强,可生物降解组分管道中被降解、转化,同时微生物量增加。
-
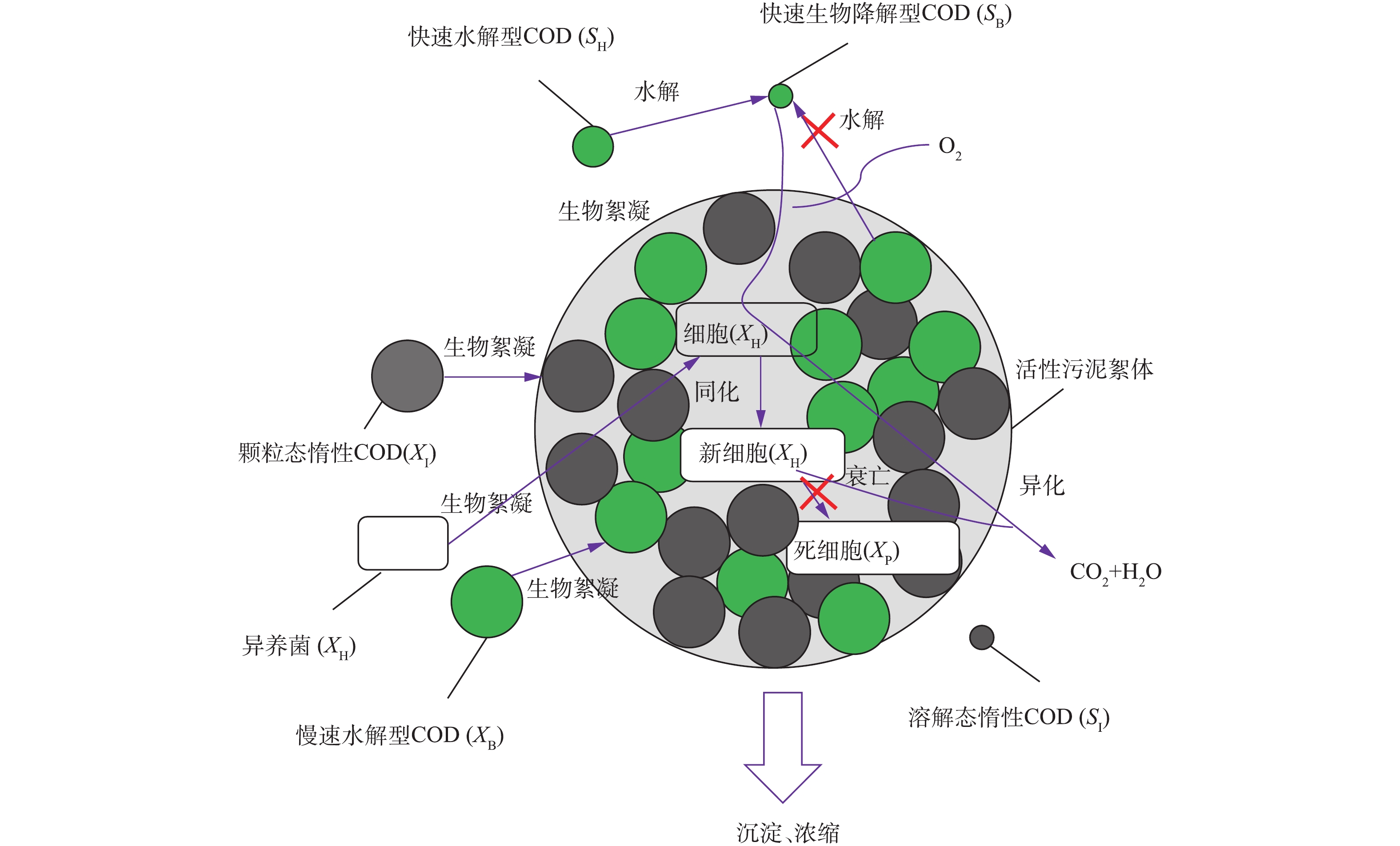
对于市政污水,碳源捕获是碳源回收的前提。HRAS能够同时对溶解态和颗粒态有机物进行捕获,是实现碳源浓缩的热点研究工艺[1, 20]。如图5所示,市政污水进入活性污泥池后,在好氧条件下,溶解态易生物降解有机物SB被活性污泥絮体中的异养菌XH所利用。其中,一部分被同化生成细胞物质或新细胞,另一部分被异化为二氧化碳和水。溶解态惰性有机物SI不可被微生物所利用,故保持在液相中。异养菌XH在生长的同时,也会发生衰亡(内源呼吸)过程,即细胞解体死亡,进而生成二氧化碳、水和内源呼吸惰性产物XP等。进水中颗粒态有机物,包括慢速水解型有机物XB、颗粒态惰性有机物XI和异养菌XH,通过生物絮凝作用被污泥絮体絮凝捕获。污泥絮体中XB和液相中的快速水解型有机物SH在胞外酶的作用下发生水解,生成易生物降解有机物SB,SB又可重新被异养菌XH同化和异化。颗粒态惰性有机物XI不可被水解,从而保留在絮体污泥中。絮体污泥在沉淀池沉淀浓缩,污水碳源至此完成捕获、浓缩过程。
由以上分析可知,絮体污泥中有机物包括4种成分:慢速水解型有机物XB、颗粒态惰性有机物XI、异养菌XH及其衰亡产物XP[21]。若以厌氧消化作为碳源回收最终手段,慢速水解型有机物XB、异养菌XH及部分颗粒态惰性有机物XI可在厌氧环境下水解发酵、产生甲烷,而衰亡产物XP不可被水解,继而不能被发酵细菌、产乙酸菌和产甲烷菌所利用。部分颗粒态惰性有机物XI之所以能在厌氧消化中被厌氧菌利用的原因是:本研究测得的XI对于HRAS或原水中微生物是惰性的,但其中一部分能在低负荷好氧系统中进一步降解,这部分XI是可厌氧消化的[22-23]。从污水组分角度来看,提高HRAS碳源捕获能力的目标是提高絮体污泥中XB、XH和XI的比例。实现此目标的方向有:方向1,反应器中的XH尽可能将SB、SH同化生成细胞物质;方向2,避免吸附絮体污泥中的XB过量水解;方向3,抑制XH衰减,减少内源呼吸产物XP的产生。关于方向1,HRAS反应器中SB在极短的水力停留时间内利用完全,且直接用于细胞生长并不考虑中间的细胞贮存过程。尽管细胞贮存可能是微生物利用碳源的一个过程,但在研究HRAS时,并未发现明显的细胞贮存现象[2]。HRAS中出水中含有高浓度溶解性COD,且主要为SH或SB,延长水力停留时间可避免这部分出水碳源损失。但方向2和方向3存在矛盾,由图4可知,SH水解过程伴随着XB的水解,延长水力停留时间,可能造成XB过量水解。因此,需要合理地设置水力停留时间,使得碳源捕获量最大化。另外,SB的利用、SH和XB的水解过程受溶解氧的影响(表1中未给出溶解氧Monod项),故溶解氧也是工艺参数优化条件之一。泥龄是方向3的决定性因素,泥龄降低,减少内源呼吸造成的氧化损失量。
-
理论上,根据溶解氧测定位置、反应液和气体(空气或氧气)的流动方式,OUR反应器可以分为8种[14]。由于技术或成本限制,目前,主要的OUR反应器类型有LSS型、GSS型、LFS型和LSF型等4种[13]。LSS和GSS型OUR反应器测试原理相对简单,但测样频率较低(数分钟甚至十几分钟一个数据),无法准确地反映有机物在短时间内被完全利用的过程,对模型参数估计不利。本研究采用了LSS型反应器,对原水进行OUR测试时,测样频率满足要求,但对原水与污泥的混合液进行测试时,无法准确追踪SB的利用过程(图2(d)),导致参数识别性极差(表2)。另外,本研究仅仅对组分进行了估计,由于实践识别问题,未估计动力学参数和计量学参数,若要建立完整的HRAS模型,必须使用高精度的OUR反应器对这些参数进行估计。LFS型和LSF型均为高精度OUR反应器。LFS型需要对氧体积传递速率kLa进行估计,要求曝气稳定,需要用精密的气体流量控制器进行准确控制。另外,在测定HRAS污泥与原水的混合液OUR时,加入的原水体积大,影响kLa的估计。LSF型反应器无需对kLa进行估计,测样频率也高(1 min内),因此,适合用于HRAS模型参数的估计。笔者将在未来的研究中,将LSS型反应器改造成LSF型反应器,从而提高OUR测试频率,为HRAS模型参数识别与估计提供技术基础。
2.1. 模型拟合结果
2.2. 有机组分降解过程
2.3. 污水组分与碳源捕获的关系
2.4. 提高模型参数实践识别性的方法
-
1)双水解模型适用于高负荷活性污泥法,而活性污泥1号模型(ASM1)不适用。根据双水解模型,进水中可生物降解有机组分可分为易生物降解COD、快速水解型COD、慢速水解型COD及普通异养菌等4种。
2) OUR测试可准确识别原水中SB、SH、XB和XH等4种有机组分。占原水总COD比例分别为13.9%、11.6%、12.6%和12.8%,共线性指数γK低于20,95%置信区间长度小于2 mg·L−1。
3)提高HRAS碳源捕获能力包括以下3个方面:反应器中的XH尽可能将SB、SH同化生成细胞物质;避免吸附在絮体污泥中的XB过量水解;抑制XH衰减,减少内源呼吸产物XP的产生。未来研究应以这3个方向为基础,进一步优化高负荷活性污泥法的工艺参数。




 下载:
下载: