-
近年来,随着人们生活水平的提高,我国餐厨垃圾产生量以每年10%的速度增长,截至2018年,餐厨垃圾产生量突破了1×108 t,占城市生活垃圾的57%左右。餐厨垃圾含有的大量有机物质容易腐烂变质并携带病原菌,不仅污染环境而且威胁人体健康。同时,餐厨垃圾又富含碳水化合物、蛋白质和油脂,营养价值高,是有机废物厌氧能源化的理想底物[1]。氢能被广泛认为是未来最具潜力的绿色可再生能源之一[2],与传统的电解水、化石燃料制氢相比,暗发酵生物制氢具有运行成本低、能耗低、操作简单等特点,可实现餐厨垃圾等高浓度复杂有机废物的能源化利用,成为最具前景的氢能制备策略之一,符合我国绿色可再生能源的战略需求。
暗发酵制氢是产氢微生物利用氢酶的催化作用将有机物降解产生氢气,同时生成挥发性脂肪酸(VFA)、乙醇等代谢产物的过程。当末端产物为乙酸时,1 mol葡萄糖的理论产氢量为4 mol,但是许多研究表明实际产氢量通常低于理论产氢量,底物的氢能转化效率不足50%[3]。有研究[4-7]表明,暗发酵制氢与[2Fe-2S]铁氧化还原蛋白和[4Fe-4S]氢酶的活性密切相关,铁氧还原蛋白可作为氢化酶的电子载体参与氢分子的产生过程,其中,铁是其重要组成部分,能够影响微生物的产氢潜力[8]。此外,铁离子的种类和含量也会影响微生物的产氢功能基因表达,进而影响复杂底物的产氢性能[9]。因此,如何克服高浓度有机废物暗发酵制氢过程的代谢障碍,提高复杂底物的利用效率和产氢潜力是制约暗发酵生物制氢技术的瓶颈问题。
有研究[10-12]发现,投加纳米零价铁(NZVI)和零价铁(ZVI)可以提高暗发酵制氢过程中的微生物活性,进而提高暗发酵制氢潜力和底物的利用效率。ZVI以其低成本成为氢发酵中最具吸引力的添加剂,能够降低发酵系统中的氧化还原电位(Eh),可以为发酵菌提供更有利的环境[13]。ZHANG等[14]研究了ZVI对葡萄糖发酵产氢量的影响,当ZVI浓度为400 mg·L−1时,1 mol葡萄糖的最大产氢量为1.22 mol,比对照组高出了37.1%。ZHU等[15]发现,ZVI的浓度为16 g·L−1时,1 mol葡萄糖的产氢量从3.8 mol 提高到8.7 mol。NZVI具有较高的催化活性和较大的表面积,从而提高了暗发酵制氢过程的效率[16]。有研究[17]采用NZVI强化葡萄糖间歇暗发酵产氢,发现当NZVI为100 mg·L−1时,1 mol葡萄糖的最大产氢量可达到1.9 mol,比未加NZVI的对照组高出1倍。ZADA等[18]发现,在加入250 mg·L−1 NZVI条件下,水葫芦的产氢量从31.7 mL·g−1增加到57 mL·g−1。可见,投加NZVI和ZVI添加剂均可提高产氢性能,且具有操作简单、能耗低的优点。目前,研究主要集中在:通过投加NZVI与ZVI添加剂,探讨其对葡萄糖、蔗糖等单一底物暗发酵制氢性能的影响。而以餐厨垃圾等复杂有机废物为底物,深入研究暗发酵制氢过程中铁离子转化规律和产氢酶活性的影响还鲜有报道。本研究通过投加不同浓度的NZVI和ZVI,研究了其对餐厨垃圾在(55±1) ℃高温条件下的暗发酵制氢潜力、末端代谢产物变化规律的影响,通过分析暗发酵制氢前后铁离子组成及浓度变化、氢化酶和脱氢酶活性表达,探究了NZVI与ZVI强化餐厨垃圾暗发酵制氢的作用机制,为餐厨垃圾等复杂有机废物的绿色能源化提供参考。
-
本实验所用的餐厨垃圾取自北京市某大学食堂,分拣出餐厨垃圾中骨头、塑料袋等杂质后破碎至5 mm,经90 ℃水热预处理30 min,离心去油(去油可提高餐厨垃圾的水解效果,利于提高产气潜力[19]),置于4 ℃冰箱备用[20]。接种污泥取自北京某生活垃圾综合处理厂的干式厌氧发酵剩余污泥。实验材料的基本理化指标如表1所示。
-
将11.65 g经水热去油预处理的餐厨垃圾与50 g接种污泥混合放入500 mL广口瓶中,接种比为0.63∶1,分别加入不同浓度(0、100、200和300 mg·L−1)的NZVI和ZVI,实验组编号记为NZVI-0、NZVI-1、NZVI-3和ZVI-0、ZVI-1、ZVI-2、ZVI-3。加去离子水定容至200 mL,有机负荷为6 g·(L·d)−1(以VS计),采用1 mol·L−1 HCl与1 mol·L−1 NaOH调节初始pH为6,通氮气10 min排除反应装置内空气。在(55±1) ℃的高温条件下进行暗发酵制氢,搅拌速度为120 r·min−1,采用排水法收集产生的气体。实验编号如表2所示。
-
铁离子浓度采用GB/T 12496.19-2015邻菲啰啉分光光度计法测定;氢化酶、脱氢酶活性采用辛红梅[21]的方法测定。VFA和乙醇浓度测定采用9790II气相色谱仪分析测定,色谱条件为:色谱柱采用CP-Wax(FFAP)25 m×0.32 mm×0.2 μm毛细管柱,FID氢火焰离子检测器,进样量1 μL,柱温箱初始温度为80 ℃,保持5 min,以10 ℃·min−1速率升温至190 ℃;进样口和检测器温度为250 ℃;高纯氮气为载气,流速为1.5 mL·min−1。采用上海天美公司GC7900气相色谱仪分析发酵气相产物和含量,色谱条件为:色谱柱采用填充柱,TCD热导检测器,分析柱1为2 m hayesep Q,分析柱2为5A分子筛3 m;柱温箱120 ℃,进样口和检测器温度为150 ℃,电流为30 mV,载气为高纯氩气,进样量为1 mL。以峰面积定量,校正归一法计算气体含量。
-
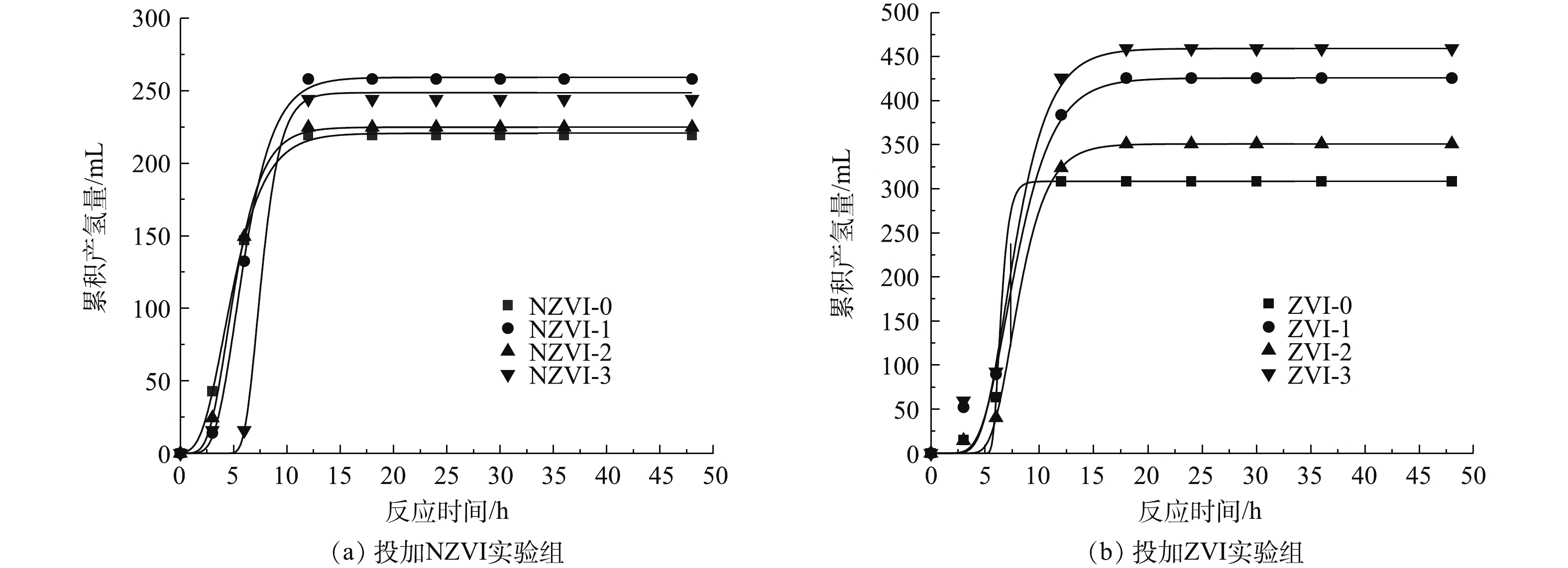
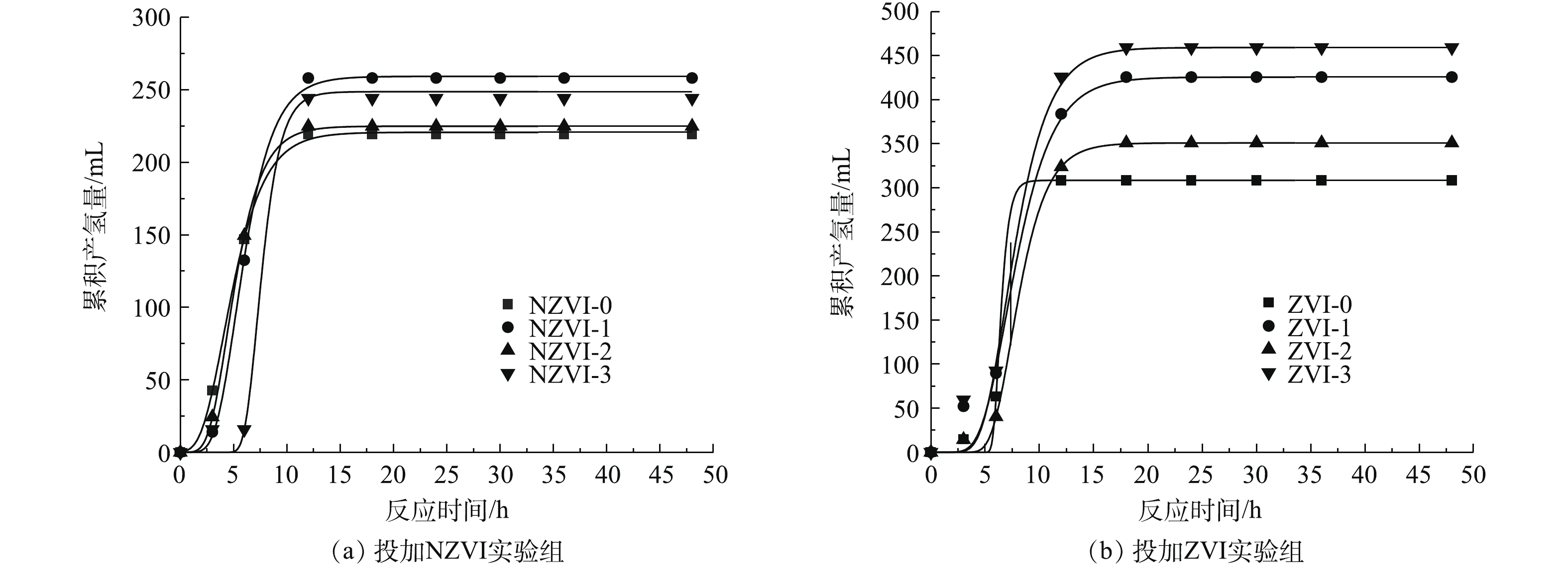
图1为不同浓度NZVI和ZVI对餐厨垃圾高温暗发酵累积产气量和氢气百分含量的影响结果。可以看出,所有实验组在暗发酵前18 h累积产气量显著提高,之后累积产气量增加趋势变缓直至趋于稳定。在暗发酵产氢的过程中,氢气百分含量呈现先升高后降低的趋势。在投加NZVI添加剂时,浓度为100 mg·L−1的NZVI-1组的暗发酵制氢性能最好,累积产气量和氢气百分含量在12 h和30 h达到最大值,分别为676 mL(单位VS产气量为281.68 mL)和83.76%,是未投加NZVI实验组的1.08倍和1.1倍。其次为NZVI-0实验组,累积产气量和氢气百分含量分别为625 mL(单位VS产气量为260.43 mL)和79.16%。由此可见,与未投加NZVI相比,NZVI-1组最多可提高产气量51 mL(单位VS产气量为21.25 mL),提高氢气百分含量8.53%。在投加ZVI添加剂时,暗发酵产氢性能较好的实验组为投加浓度300 mg·L−1的ZVI-3组和浓度100 mg·L−1的ZVI-1组,获得累积产气量分别为798 mL和732 mL(单位VS产气量分别为332.51 mL和305.01 mL),最大氢气百分含量分别为72.79%和81.95%,从节省添加剂的角度考虑,暗发酵产氢性能最好的是添加ZVI浓度为100 mg·L−1的ZVI-1组。由此可见,与未投加ZVI相比,投加100 mg·L−1 ZVI最多可提高产气量90 mL(单位VS产气量为37.50 mL),提高氢气百分含量2.74%。
在分析累积产气量和氢气百分含量基础上,利用修正过的Gompertz模型对暗发酵产氢过程的累积产氢量进行动力学拟合,产氢动力学分析结果如图2和表2所示。由图2可知,除NZVI-3实验组外,投加NZVI实验组的启动时间均比投加ZVI实验组短,但ZVI组的最大产氢潜力和最大产氢速率均比NZVI组高。在投加NZVI实验组中,NZVI-0实验组启动时间最短,为1.95 h,但最大产氢潜力和最大产氢速率均为最低,分别为220.72 mL和38.41 mL·h−1。浓度为100 mg·L−1的NZVI-1组最大产氢潜力最高为259.25 mL,浓度为300 mg·L−1的NZVI-3实验组的最大产氢速率最高,为76.48 mL·h−1。虽然NZVI-3实验组的最大产氢速率值最高,但其启动时间(6.02 h)是NZVI-1实验组(3.27 h)的1.84倍。NZVI-3实验组的最大产氢潜力(248.70 mL)也小于NZVI-1实验组(259.25 mL)。由此可见,投加NZVI可以提高最大产氢速率和最大产氢潜力,且投加浓度为100 mg·L−1时效果最好。
投加ZVI的实验组的产氢潜力均高于未投加ZVI的ZVI-0实验组(308.51 mL)。ZVI-3实验组的最大产氢潜力最高,为459.24 mL,ZVI-1实验组次之,为425.72 mg·L−1。此外,ZVI-1实验组的启动时间最短,为4.59 h。当ZVI投加量为100 mg·L−1时,餐厨垃圾最大产氢潜力是投加NZVI实验组的1.64倍。可见投加ZVI可有效提高产氢微生物对底物的利用效率和产氢潜力。
-
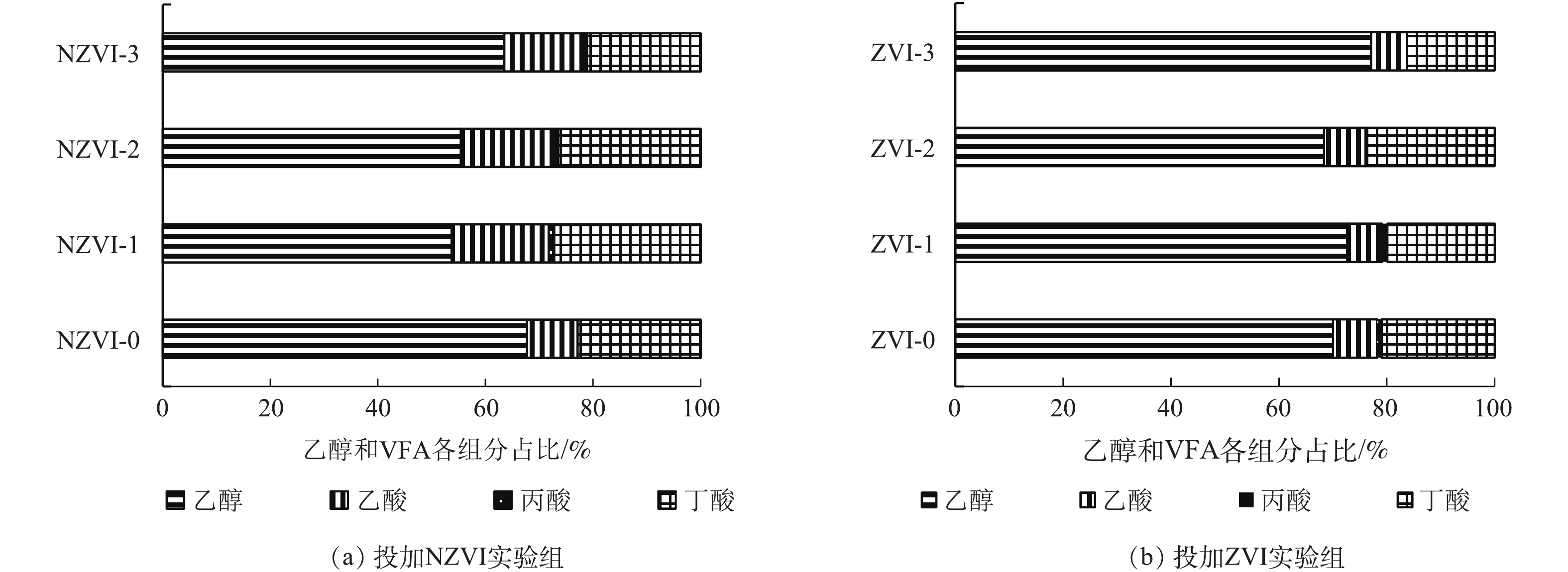
乙醇和VFAs是暗发酵制氢的重要末端代谢产物,根据其浓度和组成可将暗发酵制氢的代谢类型分为乙醇型发酵、丁酸型发酵、丙酸型发酵和混合酸发酵[22]。投加不同浓度的NZVI和ZVI后,餐厨垃圾暗发酵制氢末端乙醇和VFAs各组分占比如图3所示。可以看出,末端代谢产物中以乙醇、乙酸和丁酸为主,其中乙醇占比最高,为53.71%~77.09%,发酵类型是以乙醇型发酵为主的混合型发酵。与未投加ZVI的实验组相比,投加浓度为300 mg·L−1的ZVI-3实验组中的乙醇浓度提高了7.04%。
在投加NZVI的实验组中,乙酸在NZVI-1、NZVI-2、NZVI-3组中末端代谢产物中的占比分别为18.04%、16.89%、14.22%,均高于NZVI-0对照组(9.42%)。而对于投加ZVI的实验组,ZVI-1、ZVI-2、ZVI-3实验组中乙酸在末端代谢产物中的占比分别为6.44%、7.70%、6.62%,均低于ZVI-0对照组(8.18%)。由此可见,与投加ZVI相比,投加NZVI更有利于乙酸的转化,但产氢潜力和速率有所较低。可能由于发酵过程中产生的乙酸使体系pH降低,产生过剩的NADH+H+,未能被氧化为NAD+,影响微生物酶活或酶合成,进而抑制NADH/NAD+平衡产氢[23]。
投加NZVI的实验组相比未投加NZVI的实验组(67.7%),其中乙醇的占比均有所降低。对应投加NZVI的实验组,随着NZVI投加量的增加,乙醇占比由53.71%逐渐升高至63.50%,同时累积产气量和氢气百分含量有所下降,这说明NZVI在一定程度上改变了产氢细菌的代谢产氢途径,产生了更多的乙醇副产物和更少的乙酸副产物,投加低浓度的NZVI有利于产氢,浓度过高可能对微生物活性产生了抑制作用。投加ZVI的实验组相比未投加ZVI的实验组(70.05%),乙醇的占比略有提高。随着ZVI投加量的增加,乙醇占比由72.65%升高至77.09%,同时在ZVI-3实验组中的累积产气量大于ZVI-1实验组。发酵过程中所产生的乙醇可以氧化过多的NADH+H+,有利于产氢潜力的提高[23]。对于投加NZVI和ZVI的实验组,暗发酵末端代谢产物中乙醇的占比均有所升高,但累积产气量的变化趋势却相反,这可能是由于2种添加剂对与产氢相关的关键酶影响有所不同。
-
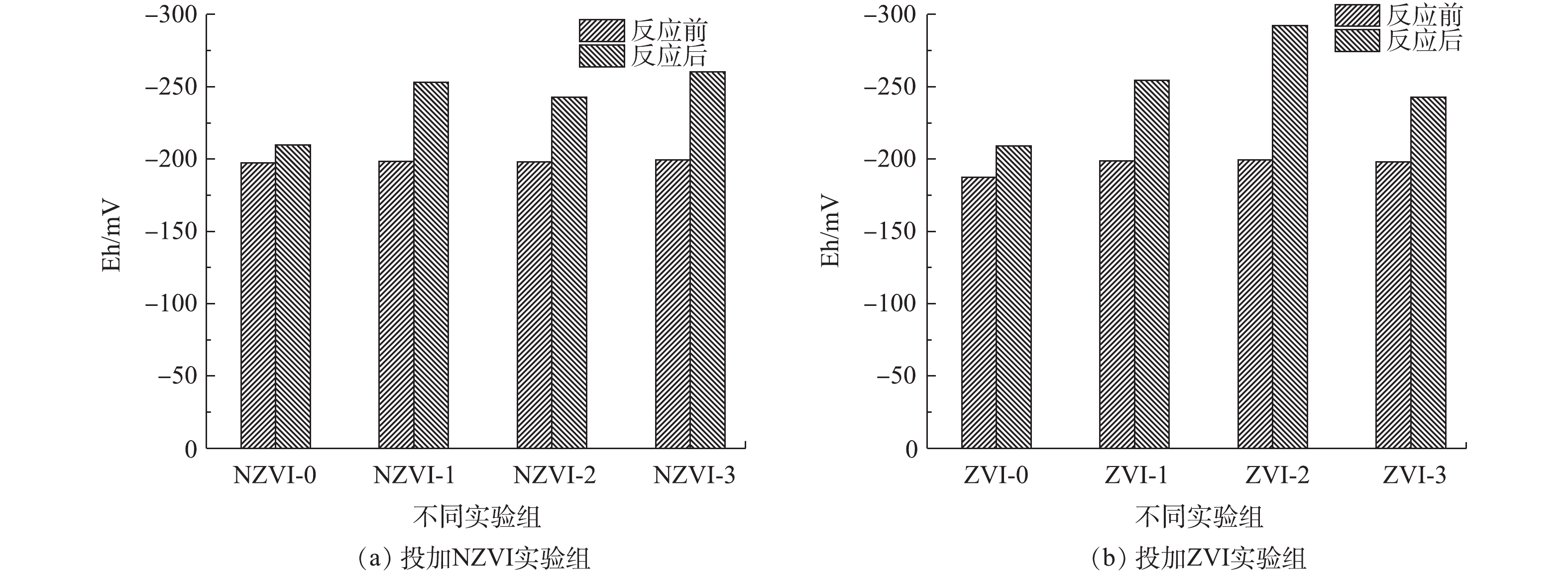
在发酵过程中,Eh是控制微生物代谢和增殖的重要参数之一[24-25]。其可以通过还原/氧化NAD(NADH/NAD+)来改变细胞内外的Eh,从而调控微生物代谢。一般认为,厌氧微生物所需Eh的最适范围为−180~−260 mV[26]。
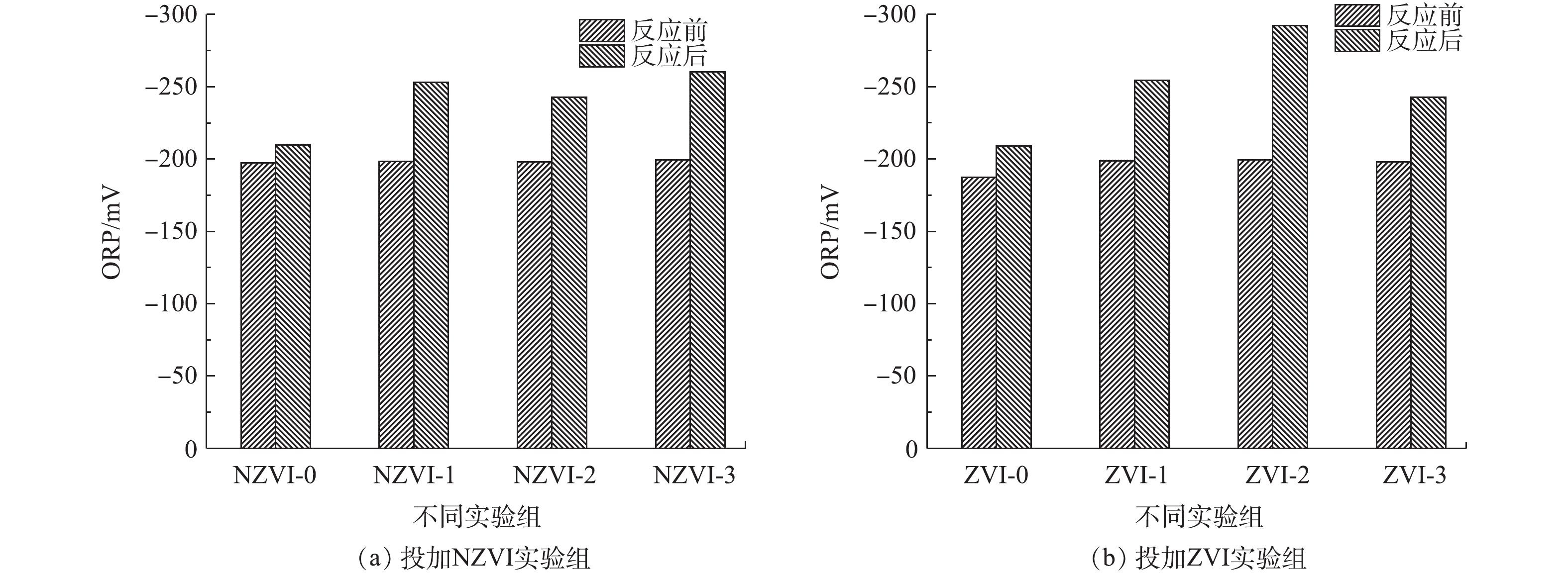
暗发酵产氢前后体系中的Eh变化结果如图4所示。结果表明,投加与未投加NZVI和ZVI的实验组在反应结束后Eh均有所下降,其中投加NZVI与ZVI的实验组中Eh下降更为显著。投加NZVI的实验组,NZVI-3实验组Eh下降最大,由反应前的−199.6 mV下降至−260.1 mV,是未投加NZVI实验组的1.24倍。其次是NZVI-1实验组,由反应前的−198.5 mV下降至−253 mV,是未投加NZVI实验组的1.20倍。对于投加ZVI的实验组,ZVI-2实验组的ORP下降最大,由反应前的−199.4 mV下降至−292.2 mV,是未投加ZVI实验组的1.39倍。其次是ZVI-1实验组,由反应前的−198.8 mV下降至−254.3 mV,是未投加ZVI实验组的1.21倍。
结合产氢潜力结果分析可知,产氢效果好的NZVI-1实验组(−253 mV)与ZVI-1实验组(−254.3 mV)Eh值相近,均在厌氧微生物最适Eh的范围内,从而有利于产氢性能的提高。分析原因可能是:反应器内的Eh迅速降低,说明分子氧等氧化剂被消耗掉,这可能由于投加的NZVI和ZVI被用作电子供体,铁可作为底物诱导因子,作用于细菌代谢途径中,既能参与细菌的生物氧化过程,又能使反应器内的Eh迅速降低,使Eh维持在产氢的最适范围内,从而提供更好的还原条件[27-29];另一方面,氢化酶活性和NAD+/NADH平衡产氢均需要较低的Eh[30]。
-
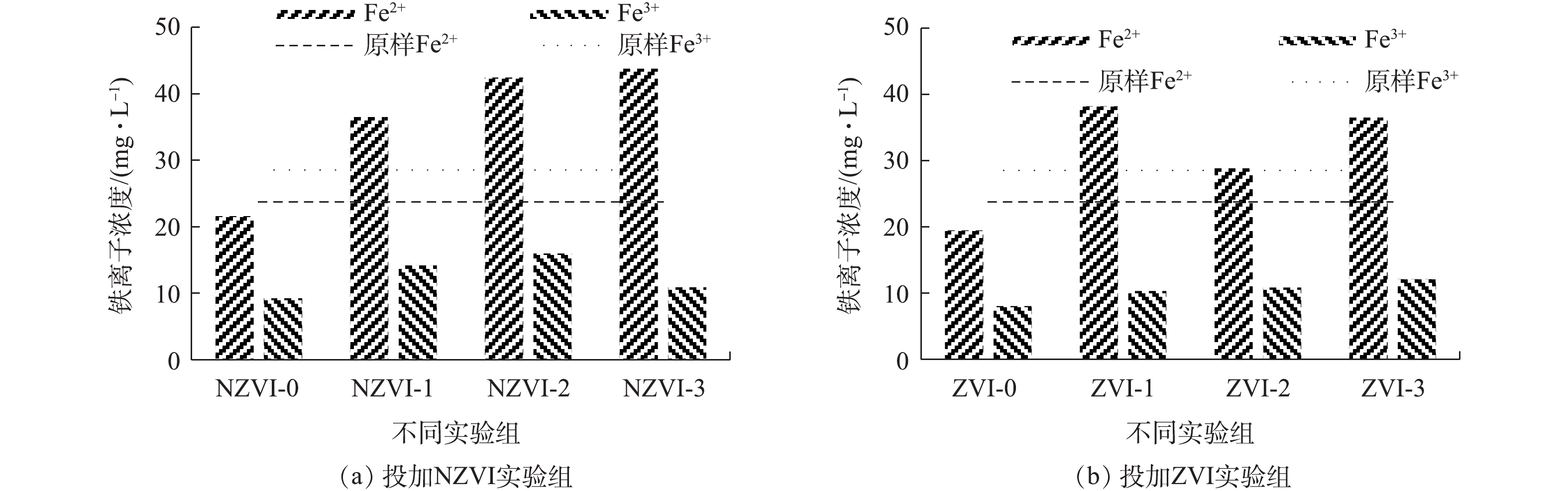
图5表示投加NZVI和ZVI进行暗发酵制氢前后,各实验组发酵液中Fe2+和Fe3+浓度的变化情况。由图5可知,在餐厨垃圾暗发酵制氢前,体系中Fe2+和Fe3+的浓度较低,分别为23.74 mg·L−1和28.52 mg·L−1。反应结束后,未投加NZVI与ZVI的实验组中Fe2+和Fe3+的浓度有所下降,投加NZVI与ZVI的实验组中Fe2+浓度显著上升,而Fe3+浓度略有提升,这证明了NZVI和ZVI是作为电子供体而存在的。铁在产氢细菌的代谢机制中起着至关重要的作用,是形成氢化酶和铁氧化还原蛋白的重要成分[31]。Fe2+可以促进生物量的增长和功能基因的表达,从而促进氢气的产生。对于投加NZVI的实验组,NZVI-3实验组中的Fe2+浓度最高,为43.78 mg·L−1,是未投加NZVI实验组的2倍,NZVI-2的Fe2+浓度次之,为42.47 mg·L−1,是未投加NZVI实验组的1.96倍。在投加ZVI的实验组,ZVI-1实验组的Fe2+浓度最高,为38.21 mg·L−1,是未投加ZVI实验组的1.96倍,ZVI-3的Fe2+浓度次高,为36.51 mg·L−1,是未投加ZVI实验组的1.87倍。
厌氧微生物可以将Fe3+还原为生物利用性更高的Fe2+。在投加NZVI的实验组中,NZVI-2实验组的Fe3+浓度最高,为15.99 mg·L−1,是未投加NZVI实验组的1.72倍,NZVI-1的Fe3+浓度次之,为14.21 mg·L−1, 是未投加NZVI实验组的1.53倍。在投加ZVI的实验组中,ZVI-3实验组的Fe3+浓度最高,为12.12 mg·L−1,是未投加ZVI实验组的1.30倍,ZVI-1的Fe3+浓度次之,为10.34 mg·L−1,是未投加ZVI实验组的1.28倍。
综上所述,在暗发酵制氢体系中投加NZVI和ZVI,可使Fe2+浓度升高,Fe3+浓度略有升高。一方面,这是由于投加的NZVI和ZVI有部分转化为Fe2+;另一方面是由于微生物对Fe3+的利用,将Fe3+还原成Fe2+。但投加NZVI与ZVI浓度过高,铁离子会与蛋白质结合生成难以被生物降解的螯合物,故使产氢潜力下降[32]。
-
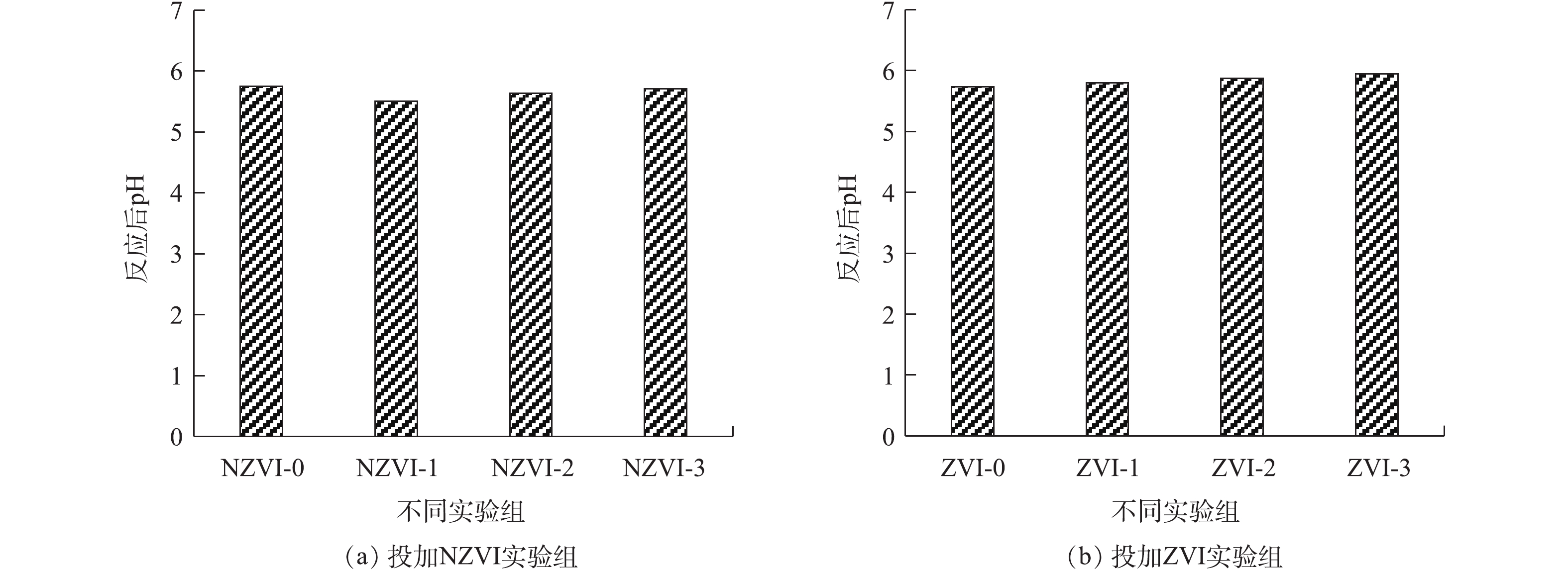
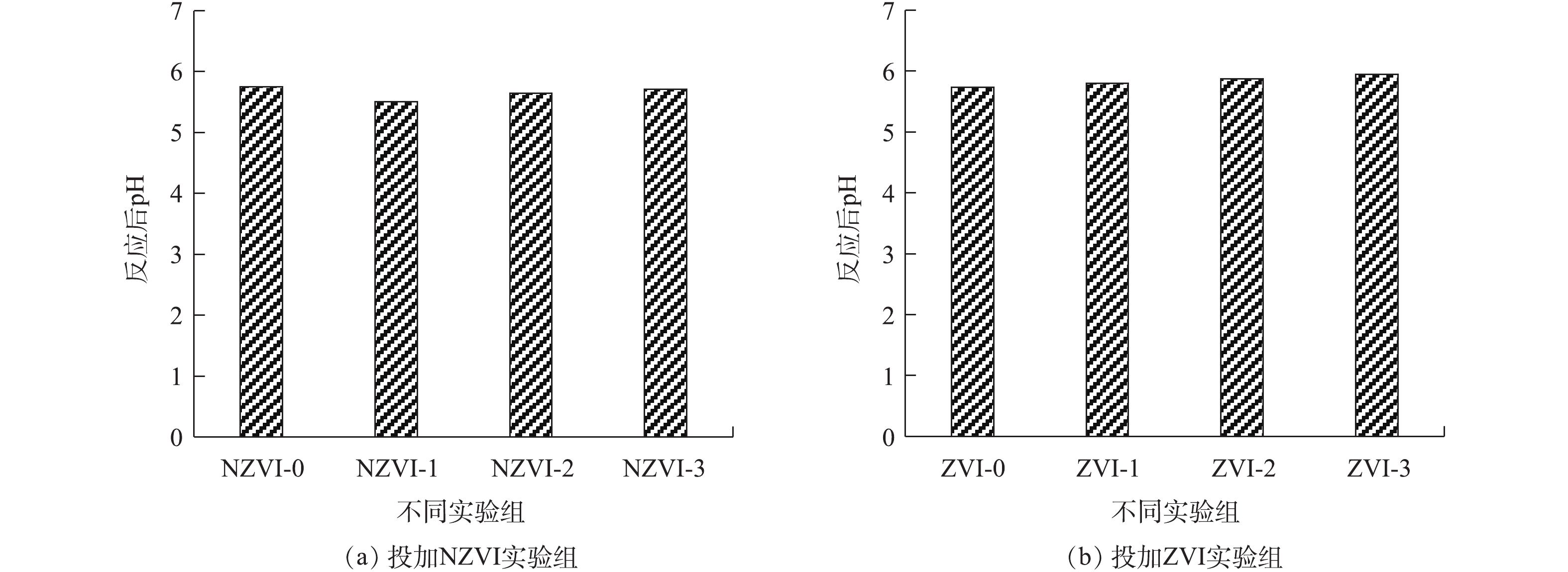
反应结束时pH的变化情况如图6所示。由图6可知,NZVI和ZVI对反应器的pH的影响作用并不明显。在暗发酵制氢反应结束时,投加NZVI和ZVI的实验组的pH均在5.5~6.0。在投加NZVI实验组中,pH最高的实验组为NZVI-3实验组(5.71),最低的为NZVI-1实验组(5.51)。投加ZVI的实验组中,pH最高的为ZVI-3实验组(5.94),最低的为ZVI-1实验组(5.8)。随着投加NZVI和ZVI浓度的增加,pH也随之升高。这可能是由于投加的NZVI和ZVI作为诱导因子作用于细菌代谢途径中,参与了产氢细菌的生物氧化过程,发酵类型为以乙醇型发酵为主的混合型发酵[33]。末端代谢产物中乙醇的占比随着NZVI和ZVI投加量的增加而增大,从而导致了pH的升高。投加NZVI的实验组在反应结束时pH低于未投加NZVI的实验组(5.75),投加ZVI的实验组在反应结束时pH高于未投加ZVI实验组,这说明与投加ZVI相比,投加NZVI更有利于乙酸的转化,产生的乙酸可使体系pH降低。
-
有机物的暗发酵制氢过程是在一系列酶和辅酶以及中间传递体的作用下完成的一种生物氧化过程。其中,氢化酶是一类能够高效可逆地催化产生氢气的酶,含有双核铁原子的铁氢化酶具有很高的催化活性。脱氢酶中的电子载体铁氧还蛋白是暗发酵生物氧化过程产生氢分子的重要功能蛋白。可见,铁是决定餐厨垃圾暗发酵制氢过程氢化酶和脱氢酶活性的重要物质,对产氢微生物的生长代谢有着重要的影响。
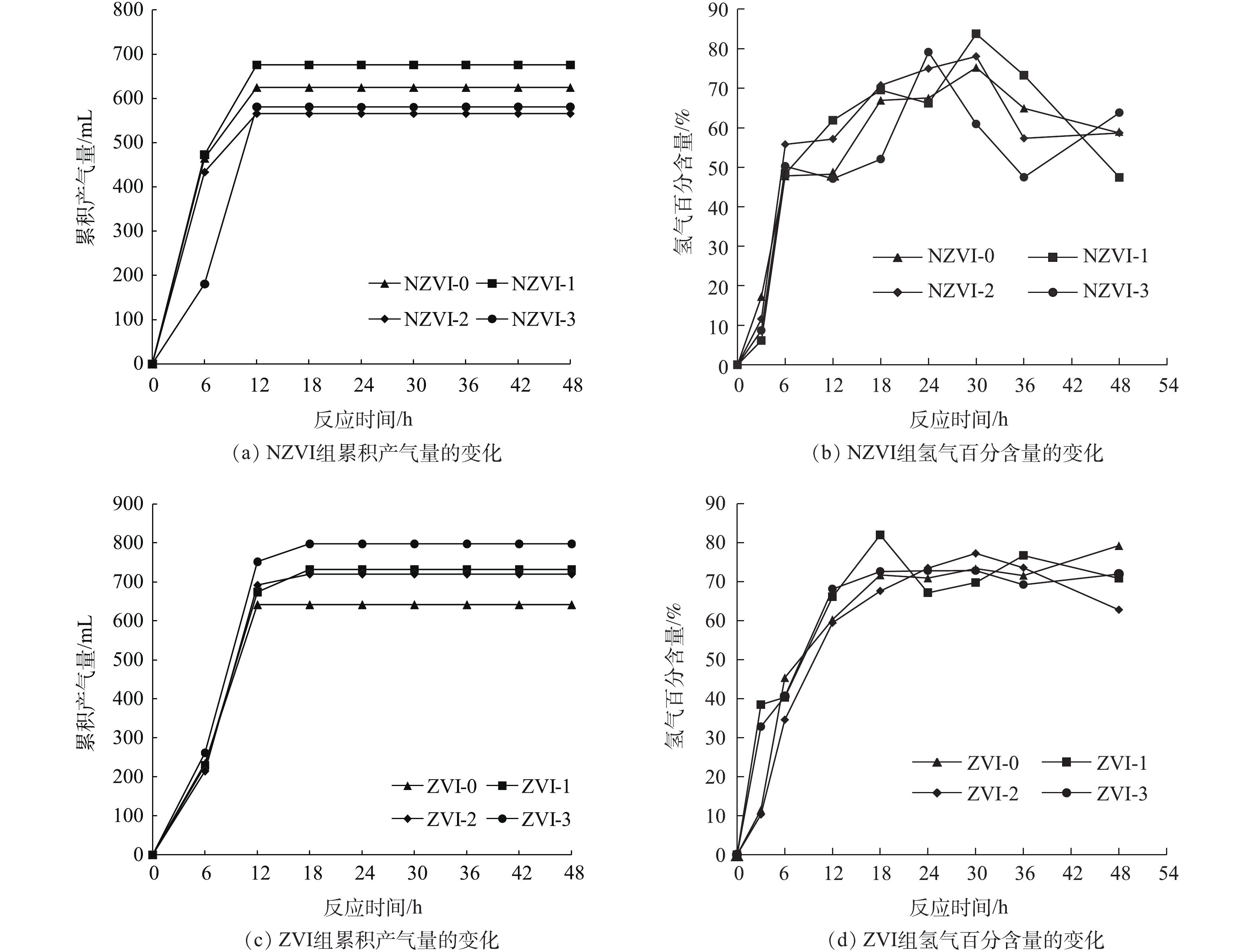
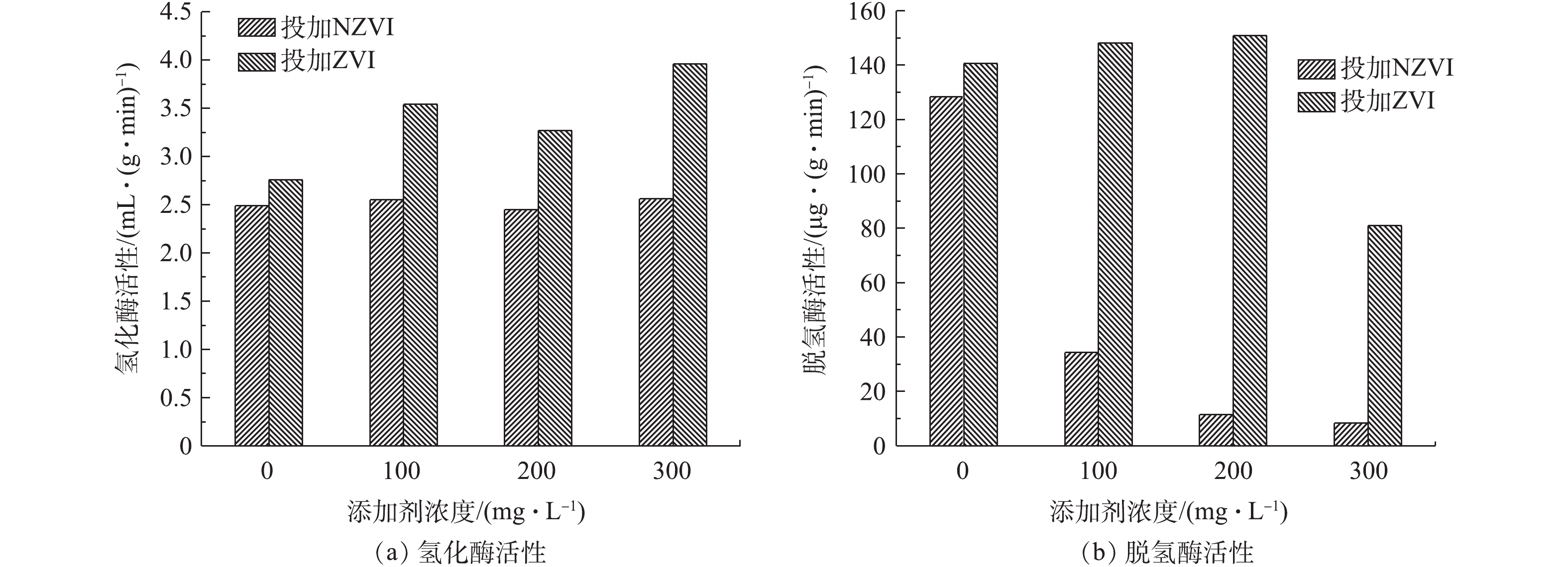
投加不同浓度的NZVI和ZVI对氢化酶和脱氢酶活性的影响结果如图7所示。可以看出,对于未投加NZVI与ZVI的实验组,氢化酶活性分别为2.49 mL·(g·min)−1和2.76 mL·(g·min)−1(以VSS计)。在投加NZVI后,氢化酶活性有所提高,其中,NZVI-3组的氢化酶活性最高,为2.56 mL·(g·min)−1,是未投加NZVI实验组的1.02倍,NZVI-1实验组氢化酶活性次高,为2.55 mL·(g·min)−1。在投加ZVI后,氢化酶活性有显著提高。ZVI-3实验组氢化酶活性(3.96 mL·(g·min)−1)最高,是ZVI-0实验组的1.43倍。ZVI-1实验组次之,为3.54 mL·(g·min)−1。有研究[5]表明,NZVI可以降低培养基中溶解氧的水平,从而提高氢化酶的活性。李永峰等[33]提出金属元素在微生物生命活动中具有重要作用,其对酶的作用主要有2个方面:一是作为酶的辅助因子,在酶促反应中运输转移电子、原子或某些功能基团参与氧化还原或运载酰基团作用;二是作为激活剂来提高酶的活性。铁作为铁氧还蛋白及氢化酶重要的组成成分,投加NZVI和ZVI可以提高铁氧还蛋白和氢化酶的活性,促进电子的转移,进而提高产氢效能。
对于NZVI-0和ZVI-0实验组,脱氢酶活性分别为128.32 μg·(g·min)−1和140.53 μg·(g·min)−1(以VSS计)。然而,投加NZVI的实验组脱氢酶活性出现了显著下降,由NZVI-0实验组的128.32 μg·(g·min)−1下降到NZVI-1实验组的34.37 μg·(g·min)−1,下降了73.2%。且随着投加NZVI浓度增加,脱氢酶活性继续下降,NZVI-3实验组中脱氢酶活性下降到最低,为8.40 μg·(g·min)−1。在投加ZVI的实验组中,脱氢酶活性有显著的提高。脱氢酶活性在ZVI浓度小于300 mg·L−1时,随着投加ZVI浓度的增加,其由140.53 μg·(g·min)−1提高到150.84 μg·(g·min)−1,提高了7.3%;但当ZVI浓度为300 mg·L−1时,脱氢酶活性下降到80.96 μg·(g·min)−1。这说明过高的ZVI浓度抑制了脱氢酶的活性。其原因可能是因为铁的投加量过高超出了体系中产氢微生物的所需,而过剩的铁形成了铁盐或亚铁盐,从而使系统的渗透压升高,导致脱氢酶活性的降低[21]。
有研究[34]表明,当金属元素浓度维持在较低水平时,对微生物可以起到激活作用,但当浓度过高时,便会对微生物的酶活性产生抑制作用。由此可见,投加ZVI的同时提高了氢化酶和脱氢酶的活性。结合铁离子浓度变化趋势可知,投加的NZVI和ZVI会向系统环境中释放铁离子,为微生物提供生长代谢过程中所需的铁元素并提高氢化酶活性。但投加NZVI时,虽然提高了氢化酶活性,脱氢酶活性却受到了抑制,这可能缘于纳米材料中活性氧的生成和氧化应激反应引起的生物毒性损害了微生物细胞结构,导致细胞死亡,进而影响微生物产氢能力[35]。
由此可见,投加100 mg·L−1 NZVI和ZVI均可有效提高氢化酶活性,投加ZVI还可提高脱氢酶活性,有利于产氢微生物的暗发酵制氢。
-
1)投加NZVI和ZVI均可显著提高餐厨垃圾暗发酵制氢性能,投加100 mg·L−1 ZVI效果最佳,最大产氢潜力和最大产氢速率分别为425.72 mL和66.32 mL·h−1,是投加NZVI实验组的1.64倍和1.34倍。投加NZVI与ZVI后,末端代谢产物以乙醇、乙酸和丁酸为主,其中乙醇占比最高(53.71%~77.09%),发酵类型是以乙醇型发酵为主的混合型发酵。
2)投加NZVI和ZVI可使反应体系中ORP显著下降,有利于暗发酵制氢的进行。反应结束后,未投加NZVI与ZVI的实验组中Fe2+和Fe3+的浓度较反应前均有所下降,投加NZVI与ZVI的实验组Fe2+浓度有显著上升,Fe3+浓度略有提升。在投加的NZVI和ZVI浓度为300 mg·L−1时,Fe2+浓度分别是未投加NZVI和ZVI实验组的2倍和1.87倍。
3)投加NZVI和ZVI均可有效提高氢化酶活性,投加100 mg·L−1 ZVI-1实验组氢化酶活性最佳,为3.54 mL·(g·min)−1,是NZVI-1实验组的1.38倍。投加ZVI可同时提高氢化酶和脱氢酶活性,有利于产氢微生物的暗发酵制氢。
纳米零价铁和零价铁对餐厨垃圾暗发酵制氢过程铁离子和酶活性的影响
Effect of nano zero valent iron and zero valent iron on the iron ion composition and enzyme activity during dark fermentation of food waste for hydrogen production
-
摘要: 通过投加不同浓度的纳米零价铁(NZVI)和零价铁(ZVI),考察了暗发酵制氢过程中铁离子组成和浓度变化、氢化酶和脱氢酶活性,研究了2种添加剂强化餐厨垃圾高温((55±1) ℃)暗发酵制氢的作用机制。结果表明:投加NZVI和ZVI均可提高餐厨垃圾暗发酵制氢性能;当投加100 mg·L−1 ZVI时,产氢效果最佳,最大产氢潜力和最大产氢速率分别为425.72 mL和66.32 mL·h−1,是投加NZVI实验组的1.64倍和1.34倍,代谢途径是以乙醇型发酵为主的混合型发酵;在投加NZVI和ZVI后,暗发酵制氢末端产物的Fe2+和Fe3+浓度升高,投加300 mg·L−1 NZVI和100 mg·L−1 ZVI实验组Fe2+浓度最大,是未投加实验组的2倍和1.87倍;与反应前相比,Fe2+显著升高,Fe3+由于微生物利用与转化浓度降低,同时可有效提高氢化酶活性。投加100 mg·L−1 ZVI不仅可提高氢化酶活性,还可提高脱氢酶活性。以上结果可为提高餐厨垃圾等复杂有机废物的高效能源化提供参考。Abstract: The composition and concentration changes of iron ion, hydrogenase and dehydrogenase activity in the process of dark fermentation were analyzed by adding different concentrations of nano zero valent iron (NZVI) and zero valent iron (ZVI). The mechanism of dark fermentation hydrogen production of food waste at (55±1) ℃ strengthened by both additives was investigated. The results showed that the NZVI or ZVI addition could improve the hydrogen production performance of food waste dark fermentation. When the concentration of ZVI was 100 mg·L−1, the hydrogen production effect was the best. The maximum hydrogen production potential and hydrogen production rate were 425.72 mL and 66.32 mL·h−1, respectively, which were 1.64 times and 1.34 times as much as those of the NZVI group. The metabolic pathway was identified as a type of mixed fermentation mainly based on ethanol fermentation. After the addition of NZVI and ZVI, the concentration of Fe2+ and Fe3+ in the end product of dark fermentation increased. The concentration of Fe2+ reached the highest for the test group with 300 mg·L−1 NZVI or 100 mg·L−1 ZVI addition, respectively, which was 2 times or 1.87 times as high as that of the test group without addition. Compared with that before the reaction, the concentration of Fe2+ increased significantly and the concentration of Fe3+ decreased due to the microorganisms utilization and conversion. Meanwhile, the hydrogenase activity increased effectively. Of which 100 mg·L−1 ZVI addition not only improved hydrogenase activity, but also improved the dehydrogenase activity. The above results can provide scientific basis for further improving the high effective energy conversion of complex organic wastes such as food waste.
-
近年来,随着人们生活水平的提高,我国餐厨垃圾产生量以每年10%的速度增长,截至2018年,餐厨垃圾产生量突破了1×108 t,占城市生活垃圾的57%左右。餐厨垃圾含有的大量有机物质容易腐烂变质并携带病原菌,不仅污染环境而且威胁人体健康。同时,餐厨垃圾又富含碳水化合物、蛋白质和油脂,营养价值高,是有机废物厌氧能源化的理想底物[1]。氢能被广泛认为是未来最具潜力的绿色可再生能源之一[2],与传统的电解水、化石燃料制氢相比,暗发酵生物制氢具有运行成本低、能耗低、操作简单等特点,可实现餐厨垃圾等高浓度复杂有机废物的能源化利用,成为最具前景的氢能制备策略之一,符合我国绿色可再生能源的战略需求。
暗发酵制氢是产氢微生物利用氢酶的催化作用将有机物降解产生氢气,同时生成挥发性脂肪酸(VFA)、乙醇等代谢产物的过程。当末端产物为乙酸时,葡萄糖的理论产氢量为4 mol·mol−1,但实际产氢量不足2 mol·mol−1,底物的氢能转化效率不足50%[3]。有研究[4-7]表明,暗发酵制氢与[2Fe-2S]铁氧化还原蛋白和[4Fe-4S]氢酶的活性密切相关,铁氧还原蛋白可作为氢化酶的电子载体参与氢分子的产生过程,其中,铁是其重要组成部分,能够影响微生物的产氢潜力[8]。此外,铁离子的种类和含量也会影响微生物的产氢功能基因表达,进而影响复杂底物的产氢性能[9]。因此,如何克服高浓度有机废物暗发酵制氢过程的代谢障碍,提高复杂底物的利用效率和产氢潜力是制约暗发酵生物制氢技术的瓶颈问题。
有研究[10-12]发现,投加纳米零价铁(NZVI)和零价铁(ZVI)可以提高暗发酵制氢过程中的微生物活性,进而提高暗发酵制氢潜力和底物的利用效率。ZVI以其低成本成为氢发酵中最具吸引力的添加剂,能够降低发酵系统中的氧化还原电位(ORP),可以为发酵菌提供更有利的环境[13]。ZHANG等[14]研究了ZVI对葡萄糖发酵产氢量的影响,当ZVI浓度为400 mg·L−1时,最大产氢量为1.22 mol·mol−1,比对照组高出了37.1%。ZHU等[15]发现,ZVI的浓度为16 g·L−1时,产氢量从3.8 mol·mol−1提高到8.7 mol·mol−1。NZVI具有较高的催化活性和较大的表面积,从而提高了暗发酵制氢过程的效率[16]。NATH等[17]采用NZVI强化葡萄糖间歇暗发酵产氢,发现当NZVI为100 mg·L−1时,最大产氢量可达到1.9 mol·mol−1,比未加NZVI的对照组高出1倍。ZADA等[18]发现,在加入250 mg·L−1 NZVI条件下,水葫芦的产氢量从31.7 mL·g−1增加到57 mL·g−1。可见,投加NZVI和ZVI添加剂均可提高产氢性能,且具有操作简单、能耗低的优点。目前,研究主要集中在投加NZVI与ZVI对以葡萄糖、蔗糖等单一底物暗发酵制氢性能的影响,而以餐厨垃圾等复杂有机废物为底物,深入研究暗发酵制氢过程中铁离子转化规律和产氢酶活性的影响还鲜有报道。本研究通过投加不同浓度的NZVI和ZVI,研究了其对餐厨垃圾在(55±1) ℃高温条件下的暗发酵制氢潜力、末端代谢产物变化规律的影响,通过分析发酵前后铁离子组成及浓度变化、氢化酶和脱氢酶活性表达,探究了NZVI与ZVI强化餐厨垃圾暗发酵制氢的作用机制,以期为餐厨垃圾等复杂有机废物的绿色能源化提供科学依据。
1. 材料与方法
1.1 实验原料
本实验所用的餐厨垃圾取自北京市某大学食堂,分拣出餐厨垃圾中骨头、塑料袋等杂质后破碎至5 mm,经90 ℃水热预处理30 min,离心去油(去油可提高餐厨垃圾的水解效果,利于提高产气潜力[19]),置于4 ℃冰箱备用[20]。接种污泥取自北京某生活垃圾综合处理厂的干式厌氧发酵剩余污泥。实验材料的基本理化指标如表1所示。
表 1 实验材料基本理化指标Table 1. Basic physical and chemical indexes of experimental materials分析项目 TS/% VS/% VS/TS/% 含水率/% pH COD/(mg·L−1) C/% N/% 餐厨垃圾(水热后) 22.55 20.59 91.31 77.45 6.07 107 100 53.10 3.94 接种污泥 15.13 7.59 50.15 84.87 7.20 7 600 22.13 2.27 1.2 实验设计
将11.65 g经水热去油预处理的餐厨垃圾与50 g接种污泥混合放入500 mL广口瓶中,接种比为0.63∶1(VS∶VS),分别加入不同浓度(0、100、200和300 mg·L−1)的NZVI和ZVI,实验反应器情况记为:NZVI-0、NZVI-1、NZVI-3和ZVI-0、ZVI-1、ZVI-2、ZVI-3。加去离子水定容至200 mL,有机负荷为6 g·(L·d)−1(以VS计),采用1 mol·L−1 HCl与1 mol·L−1 NaOH调节初始pH为6,通氮气10 min排除反应装置内空气。在(55±1) ℃的高温条件下进行暗发酵制氢,搅拌速度为120 r·min−1,采用排水法收集产生的气体。实验编号如表2所示。
表 2 暗发酵产氢动力学分析Table 2. Dynamic analysis of dark fermentation hydrogen production实验组 Pmax/mL Rmax/(mL·h−1) λ/h R2 NZVI-0 220.72 38.41 1.95 0.999 55 NZVI-1 259.25 49.43 3.27 0.999 35 NZVI-2 224.87 47.04 2.66 0.999 85 NZVI-3 248.70 76.48 6.02 0.996 37 ZVI-0 308.51 216.07 5.72 0.998 48 ZVI-1 425.72 66.32 4.59 0.998 44 ZVI-2 350.91 70.96 5.58 0.998 90 ZVI-3 459.24 77.67 4.72 0.989 22 注:Pmax代表最大产氢量潜力,Rmax代表最大产氢速率,λ表示反应启动时间。 1.3 分析方法
铁离子浓度采用GB/T 12496.19-2015邻菲啰啉分光光度计法测定;氢化酶、脱氢酶活性采用辛红梅等[21]方法测定。VFA和乙醇浓度测定采用9790II气相色谱仪分析测定,色谱条件为:色谱柱采用CP-Wax(FFAP)25 m×0.32 mm×0.2 μm毛细管柱,FID氢火焰离子检测器,进样量1 μL,柱温箱初始温度为80 ℃,保持5 min,以10 ℃·min−1速率升温至190 ℃;进样口和检测器温度为250 ℃;高纯氮气为载气,流速为1.5 mL·min−1。气体成分测定采用上海天美公司GC7900气相色谱仪分析发酵气相产物和含量,色谱条件为:色谱柱采用填充柱,TCD热导检测器,分析柱1为2 m hayesep Q,分析柱2为5 A分子筛3 m;柱温箱120 ℃,进样口和检测器温度为150 ℃,电流为30 mV,载气为高纯氩气,进样量为1 mL。以峰面积定量,校正归一法计算气体含量。
2. 结果与讨论
2.1 NZVI和ZVI对餐厨垃圾暗发酵制氢性能的影响
1) NZVI和ZVI对暗发酵制氢性能的影响。图1为不同浓度NZVI和ZVI对餐厨垃圾高温暗发酵累积产气量和氢气百分含量的影响结果。结果表明,所有实验组在暗发酵前18 h累积产气量显著提高,之后累积产气量增加趋势变缓直至趋于稳定。在暗发酵产氢的过程中,氢气百分含量呈现先升高后降低的趋势。在投加NZVI添加剂时,浓度为100 mg·L−1的NZVI-1组的暗发酵制氢性能最好,累积产气量和氢气百分含量在12 h和30 h达到最大值,分别为676 mL(单位VS产气量为281.68 mL)和83.76%,是未投加NZVI实验组的1.08倍和1.1倍。其次为NZVI-0实验组,累积产气量和氢气百分含量分别为625 mL(单位VS产气量为260.43 mL)和79.16%。由此可见,与未投加NZVI相比,NZVI-1组最多可提高产气量51 mL(单位VS产气量为21.25 mL),提高氢气百分含量8.53%。
在投加ZVI添加剂时,暗发酵产氢性能较好的实验组为投加浓度300 mg·L−1的ZVI-3组和浓度100 mg·L−1的ZVI-1组,获得累积产气量分别为798 mL和732 mL(单位VS产气量分别为332.51 mL和305.01 mL),最大氢气百分含量分别为72.79%和81.95%,从节省添加剂的角度考虑,暗发酵产氢性能最好的是添加ZVI浓度为100 mg·L−1的ZVI-1组。由此可见,与未投加ZVI相比,投加100 mg·L−1 ZVI最多可提高产气量90 mL(单位VS产气量为37.50 mL),提高氢气百分含量2.74%。
2)NZVI和ZVI产氢动力学分析。在累积产气量和氢气百分含量分析基础上,利用修正过的Gompertz模型对暗发酵产氢过程的累积产氢量进行动力学拟合,产氢动力学分析结果如图2和表2所示。由图2可知,除NZVI-3实验组外,投加NZVI实验组的启动时间均比投加ZVI实验组短,但ZVI组的最大产氢潜力和最大产氢速率均比NZVI组高。在投加NZVI实验组中,NZVI-0实验组启动时间最短,为1.95 h,但最大产氢潜力和最大产氢速率均为最低,分别为220.72 mL和38.41 mL·h−1。浓度为100 mg·L−1的NZVI-1组最大产氢潜力最高为259.25 mL,浓度为300 mg·L−1的NZVI-3实验组的最大产氢速率最高,为76.48 mL·h−1。虽然NZVI-3实验组的最大产氢速率值最高,但其启动时间(6.02 h)是NZVI-1实验组(3.27 h)的1.84倍。NZVI-3实验组的最大产氢潜力(248.70 mL)也小于NZVI-1实验组(259.25 mL)。由此可见,投加NZVI可以提高最大产氢速率和最大产氢潜力,且投加浓度为100 mg·L−1时达到的效果最好。
投加ZVI的实验组的产氢潜力均高于未投加ZVI的ZVI-0实验组(308.51 mL)。其中,ZVI-3实验组的最大产氢潜力最高,为459.24 mL,ZVI-1实验组次之,为425.72 mg·L−1。此外,ZVI-1实验组的启动时间最短,为4.59 h。当ZVI投加量为100 mg·L−1时,餐厨垃圾最大产氢潜力是投加NZVI实验组的1.64倍。可见投加ZVI可有效提高产氢微生物对底物的利用效率和产氢潜力。
2.2 NZVI和ZVI对餐厨垃圾暗发酵制氢发酵途径的影响
乙醇和VFAs是暗发酵制氢的重要末端代谢产物,根据其浓度和组成可将暗发酵制氢的代谢类型分为乙醇型发酵、丁酸型发酵、丙酸型发酵和混合酸发酵[22]。投加不同浓度的NZVI和ZVI后,餐厨垃圾暗发酵制氢末端乙醇和VFAs各组分占比如图3所示。结果表明,末端代谢产物中以乙醇、乙酸和丁酸为主,其中乙醇占比最高(53.71%~77.09%),发酵类型是以乙醇型发酵为主的混合型发酵。与未投加ZVI的实验组相比,投加浓度为300 mg·L−1的ZVI-3实验组中的乙醇浓度提高了7.04%。
在投加NZVI的实验组中,乙酸在NZVI-1、NZVI-2、NZVI-3组中末端代谢产物中的占比分别为18.04%、16.89%、14.22%,均高于NZVI-0对照组(9.42%)。而对于投加ZVI的实验组,ZVI-1、ZVI-2、ZVI-3实验组中乙酸在末端代谢产物中的占比分别为6.44%、7.70%、6.62%,均低于ZVI-0对照组(8.18%)。由此可见,与投加ZVI相比,投加NZVI更有利于乙酸的转化,但产氢潜力和速率有所较低。可能由于发酵过程中产生的乙酸使体系pH降低,产生过剩的NADH+H+,未能被氧化为NAD+,影响微生物酶活或酶合成,进而抑制NADH/NAD+平衡产氢[23]。
投加NZVI的实验组相比未投加NZVI的实验组(67.7%),其中乙醇的占比均有所降低。对应投加NZVI的实验组,随着NZVI投加量的增加,乙醇占比由53.71%逐渐升高至63.50%,同时累积产气量和氢气百分含量有所下降,这说明NZVI在一定程度上改变了产氢细菌的代谢产氢途径,产生了更多的乙醇副产物和更少的乙酸副产物,投加低浓度的NZVI有利于产氢,浓度过高可能对微生物活性产生了抑制作用。投加ZVI的实验组相比未投加ZVI的实验组(70.05%),其中乙醇的占比略有提高。随着ZVI投加量的增加,乙醇占比由72.65%升高至77.09%,同时在ZVI-3实验组中的累积产气量大于ZVI-1实验组。发酵过程中所产生的乙醇可以氧化过多的NADH+H+,有利于产氢潜力的提高[23]。对于投加NZVI和ZVI的实验组,暗发酵末端代谢产物中乙醇的占比均有所升高,但累积产气量的变化趋势却相反,这可能是由于2种添加剂对与产氢相关的关键酶影响有所不同。
2.3 NZVI和ZVI对餐厨垃圾暗发酵制氢ORP的影响
在发酵过程中,ORP是控制微生物代谢和增殖的重要参数之一[24-25]。其可以通过还原/氧化NAD(NADH/NAD+)来改变细胞内外的ORP,从而调控微生物代谢。一般认为,厌氧微生物所需ORP的最适范围为-180~-260 mV[26]。
暗发酵产氢前后体系中的ORP变化结果如图4所示。结果表明,投加与未投加NZVI和ZVI的实验组在反应结束后ORP均有所下降,其中投加NZVI与ZVI的实验组中ORP下降更为显著。投加NZVI的实验组,NZVI-3实验组ORP下降最大,由反应前的−199.6 mV下降至−260.1 mV,是未投加NZVI实验组的1.24倍。其次是NZVI-1实验组,由反应前的−198.5 mV下降至−253 mV,是未投加NZVI实验组的1.20倍。对于投加ZVI的实验组,ZVI-2实验组的ORP下降最大,由反应前的−199.4 mV下降至−292.2 mV,是未投加ZVI实验组的1.39倍。其次是ZVI-1实验组,由反应前的−198.8 mV下降至−254.3 mV,是未投加ZVI实验组的1.21倍。
结合产氢潜力结果分析可知,产氢效果好的NZVI-1实验组(−253 mV)与ZVI-1实验组(−254.3 mV)ORP值相近,均在厌氧微生物最适ORP的范围内,从而有利于产氢性能的提高。分析原因可能是:反应器内的ORP迅速降低,说明分子氧等氧化剂被消耗掉,这可能由于投加的NZVI和ZVI被用作电子供体,铁可作为底物诱导因子,作用于细菌代谢途径中,既能参与细菌的生物氧化过程,又能使反应器内的ORP迅速降低,使ORP维持在产氢的最适范围内,从而提供更好的还原条件[27-29];另一方面,氢化酶活性和NAD+/NADH平衡产氢均需要较低的ORP[30]。
2.4 NZVI和ZVI对餐厨垃圾暗发酵制氢过程中铁离子浓度的影响
图5表示投加NZVI和ZVI进行暗发酵制氢前后,各实验组发酵液中Fe2+和Fe3+浓度的变化情况。由图5可知,在餐厨垃圾暗发酵制氢前,体系中Fe2+和Fe3+的浓度较低,分别为23.74 mg·L−1和28.52 mg·L−1。反应结束后,未投加NZVI与ZVI的实验组中Fe2+和Fe3+的浓度有所下降,投加NZVI与ZVI的实验组中Fe2+浓度显著上升,而Fe3+浓度略有提升,这证明了NZVI和ZVI是作为电子供体而存在的。铁在产氢细菌的代谢机制中起着至关重要的作用,是形成氢化酶和铁氧还蛋白的重要成分[31]。Fe2+可以促进了生物量的增长和功能基因的表达,从而促进氢气的产生。对于投加NZVI的实验组,NZVI-3实验组中的Fe2+浓度最高,为43.78 mg·L−1,是未投加NZVI实验组的2倍,NZVI-2的Fe2+浓度次之,为42.47 mg·L−1,是未投加NZVI实验组的1.96倍。在投加ZVI的实验组,ZVI-1实验组的Fe2+浓度最高,为38.21 mg·L−1,是未投加ZVI实验组的1.96倍,ZVI-3的Fe2+浓度次高,为36.51 mg·L−1,是未投加ZVI实验组的1.87倍。
厌氧微生物可以将Fe3+还原为生物利用性更高的Fe2+。在投加NZVI的实验组中,NZVI-2实验组的Fe3+浓度最高,为15.99 mg·L−1,是未投加NZVI实验组的1.72倍,NZVI-1的Fe3+浓度次之,为14.21 mg·L−1, 是未投加NZVI实验组的1.53倍。在投加ZVI的实验组中,ZVI-3实验组的Fe3+浓度最高,为12.12 mg·L−1,是未投加ZVI实验组的1.30倍,ZVI-1的Fe3+浓度次之,为10.34 mg·L−1,是未投加ZVI实验组的1.28倍。
综上所述,在暗发酵制氢体系中投加NZVI和ZVI,可使Fe2+浓度升高,Fe3+浓度略有升高。一方面,这是由于投加的NZVI和ZVI有部分转化为了Fe2+;另一方面是由于微生物对Fe3+的利用将Fe3+还原成Fe2+。但投加NZVI与ZVI浓度过高,铁离子会与蛋白质结合生成难以被生物降解的螯合物,故使产氢潜力下降[32]。
2.5 NZVI和ZVI对餐厨垃圾暗发酵制氢过程pH的影响
反应结束时pH的变化情况如图6所示。由图6可知,NZVI和ZVI对反应器的pH的影响作用并不明显。在暗发酵制氢反应结束时,投加NZVI和ZVI的实验组的pH均在5.5~6.0。在投加NZVI实验组中,pH最高的实验组为NZVI-3实验组(5.71),最低的为NZVI-1实验组(5.51)。投加ZVI的实验组中,pH最高的为ZVI-3实验组(5.94),最低的为ZVI-1实验组(5.8)。随着投加NZVI和ZVI浓度的增加,pH也随升高。这可能是由于投加的NZVI和ZVI作为诱导因子作用于细菌代谢途径中,参与了产氢细菌的生物氧化过程,发酵类型为以乙醇型发酵为主的混合型发酵[33]。末端代谢产物中乙醇的占比随着NZVI和ZVI投加量的增加而增大,从而导致了pH的升高。投加NZVI的实验组在反应结束时pH低于未投加NZVI的实验组(5.75),投加ZVI的实验组在反应结束时pH高于未投加ZVI实验组,这说明与投加ZVI相比,投加NZVI更有利于乙酸的转化,产生的乙酸可使体系pH降低。
2.6 NZVI和ZVI对餐厨垃圾暗发酵制氢过程中酶活性的影响
有机物的暗发酵制氢过程是在一系列酶和辅酶以及中间传递体的作用下完成的一种生物氧化过程。其中,氢化酶是一类能够高效可逆地催化产生氢气的酶,含有双核铁原子的铁氢化酶具有很高的催化活性。脱氢酶中的电子载体铁氧还蛋白是暗发酵生物氧化过程产生氢分子的重要功能蛋白。可见,铁是决定餐厨垃圾暗发酵制氢过程氢化酶和脱氢酶活性的重要物质,对产氢微生物的生长代谢有着重要的影响。
投加不同浓度的NZVI和ZVI对氢化酶和脱氢酶活性的影响结果如图7所示。结果表明,对于未投加NZVI与ZVI的实验组,氢化酶活性分别为2.49 mL·(g·min)−1和2.76 mL·(g·min)−1(以VSS计)。在投加NZVI后,氢化酶活性有所提高,其中,NZVI-3组的氢化酶活性最高,为2.56 mL·(g·min)−1,是未投加NZVI实验组的1.02倍,NZVI-1实验组氢化酶活性次高,为2.55 mL·(g·min)−1。在投加ZVI后,氢化酶活性有显著提高。ZVI-3实验组氢化酶活性(3.96 mL·(g·min)−1)最高,是ZVI-0实验组的1.43倍。ZVI-1实验组次之,为3.54 mL·(g·min)−1。有研究[5]表明,NZVI可以降低培养基中溶解氧的水平,从而提高氢化酶的活性。李永峰等[33]提出金属元素在微生物生命活动中具有重要作用,其对酶的作用主要有2方面:一是作为酶的辅助因子,在酶促反应中运输转移电子、原子或某些功能基团参与氧化还原或运载酰基团作用;二是作为激活剂来提高酶的活性。铁作为铁氧还蛋白及氢化酶重要的组成成分,投加NZVI和ZVI可以提高铁氧还蛋白和氢化酶的活性,促进电子的转移,进而提高产氢效能。
对于NZVI-0和ZVI-0实验组,脱氢酶活性分别为128.32 μg·(g·min)−1和140.53 μg·(g·min)−1(以VSS计)。然而,投加NZVI的实验组脱氢酶活性出现了显著下降,由NZVI-0实验组的128.32 μg·(g·min)−1下降到NZVI-1实验组的34.37 μg·(g·min)−1,下降了73.2%。且随着投加NZVI浓度增加,脱氢酶活性继续下降,NZVI-3实验组中脱氢酶活性下降到最低,为8.40 μg·(g·min)−1。在投加ZVI的实验组中,脱氢酶活性有显著的提高。脱氢酶活性在ZVI浓度小于300 mg·L−1时,随着投加ZVI浓度的增加,其由140.53 μg·(g·min)−1提高到150.84 μg·(g·min)−1,提高了7.3%,但当ZVI浓度为300 mg·L−1时,脱氢酶活性下降到80.96 μg·(g·min)−1。这说明过高的ZVI浓度抑制了脱氢酶的活性。结合相关文献,其原因可能是因为铁的投加量过高超出了体系中产氢微生物的所需,而过剩的铁形成了铁盐或亚铁盐,从而使系统的渗透压升高,导致脱氢酶活性的降低[21]。
有研究[34]表明,当金属元素浓度维持在较低水平时,对微生物可以起到激活作用,但当浓度过高时,便会对微生物的酶活性产生抑制作用。由此可见,投加ZVI的同时提高了氢化酶和脱氢酶的活性。结合铁离子浓度变化趋势可知,投加的NZVI和ZVI会向系统环境中释放铁离子,为微生物提供生长代谢过程中所需的铁元素并提高氢化酶活性。但投加NZVI时虽然提高了氢化酶活性,脱氢酶活性却受到了抑制,这可能缘于纳米材料中活性氧的生成和氧化应激反应引起的生物毒性损害了微生物细胞结构,导致细胞死亡,进而影响微生物产氢能力[35]。
由此可见,投加100 mg·L−1 NZVI和ZVI均可有效提高氢化酶活性,投加ZVI还可提高脱氢酶活性,有利于产氢微生物的暗发酵制氢。
3. 结论
1)投加NZVI和ZVI均可显著提高餐厨垃圾暗发酵制氢性能,投加100 mg·L−1 ZVI效果最佳,最大产氢潜力和最大产氢速率分别为425.72 mL和66.32 mL·h−1,是投加NZVI实验组的1.64倍和1.34倍。投加NZVI与ZVI后,末端代谢产物以乙醇、乙酸和丁酸为主,其中乙醇占比最高(53.71%~77.09%),发酵类型是以乙醇型发酵为主的混合型发酵。
2)投加NZVI和ZVI可使反应体系中ORP显著下降,有利于暗发酵制氢的进行。反应结束后,未投加NZVI与ZVI的实验组中Fe2+和Fe3+的浓度较反应前均有所下降,投加NZVI与ZVI的实验组Fe2+浓度有显著上升,Fe3+浓度略有提升。在投加的NZVI和ZVI浓度为300 mg·L−1时,Fe2+浓度分别是未投加NZVI和ZVI实验组的2倍和1.87倍。
3)投加NZVI和ZVI均可有效提高氢化酶活性,投加100 mg·L−1 ZVI-1实验组氢化酶活性最佳,为3.54 mL·(g·min)−1,是NZVI-1实验组的1.38倍。投加ZVI可同时提高氢化酶和脱氢酶活性,有利于产氢微生物的暗发酵制氢。
-
表 1 实验材料基本理化指标
Table 1. Basic physical and chemical indexes of experimental materials
实验材料 TS质量分数/% VS质量分数/% (VS/TS)/% 含水率/% pH COD/(mg·L−1) C质量分数/% N质量分数/% 餐厨垃圾(水热后) 22.55 20.59 91.31 77.45 6.07 107 100 53.10 3.94 接种污泥 15.13 7.59 50.15 84.87 7.20 7 600 22.13 2.27 表 2 暗发酵产氢动力学分析
Table 2. Dynamic analysis of dark fermentation hydrogen production
实验组 最大产氢潜力/mL 最大产氢速率/(mL·h−1) 反应启动时间/h R2 NZVI-0 220.72 38.41 1.95 0.999 55 NZVI-1 259.25 49.43 3.27 0.999 35 NZVI-2 224.87 47.04 2.66 0.999 85 NZVI-3 248.70 76.48 6.02 0.996 37 ZVI-0 308.51 216.07 5.72 0.998 48 ZVI-1 425.72 66.32 4.59 0.998 44 ZVI-2 350.91 70.96 5.58 0.998 90 ZVI-3 459.24 77.67 4.72 0.989 22 -
[1] 王勇, 任连海, 赵冰, 等. 初始pH和温度对餐厨垃圾厌氧发酵制氢的影响[J]. 环境工程学报, 2017, 11(12): 6470-6476. doi: 10.12030/j.cjee.201702160 [2] BARCA C, SORIC A, RANAVA D, et al. Anaerobic biofilm reactors for dark fermentative hydrogen production from wastewater: A review[J]. Bioresource Technology, 2015, 185: 386-398. doi: 10.1016/j.biortech.2015.02.063 [3] CAI G, JIN B, MONIS P, et al. Metabolic flux network and analysis of fermentative hydrogen production[J]. Biotechnology Advances, 2011, 29(4): 375-387. doi: 10.1016/j.biotechadv.2011.02.001 [4] 丁杰, 任南琪, 刘敏, 等. Fe和Fe2+对混合细菌产氢发酵的影响[J]. 环境科学, 2004, 25(4): 48-53. doi: 10.3321/j.issn:0250-3301.2004.04.010 [5] GOPALAKRISHNAN K, THANGAVEL M, ELDON R R, et al. Application of nanotechnology in dark fermentation for enhanced biohydrogen production using inorganic nanoparticles[J]. International Journal of Hydrogen Energy, 2019, 44: 13106-13113. doi: 10.1016/j.ijhydene.2019.03.131 [6] 王勇, 任南琪, 孙寓姣. Fe对产氢发酵细菌发酵途径及产氢能力影响[J]. 太阳能学报, 2003, 24(2): 222-226. doi: 10.3321/j.issn:0254-0096.2003.02.017 [7] BUI E T N, JOHNSON P J. Identification and characterization of [Fe]-hydrogenases in the hydrogenosome of Trichomonas vaginalis[J]. Molecular & Biochemical Parasitology, 1996, 76(1/2): 305-310. [8] 任南琪, 王宝贞. 厌氧活性污泥工艺生物发酵产氢能力研究[J]. 中国环境科学, 1995, 15(6): 401-406. doi: 10.3321/j.issn:1000-6923.1995.06.003 [9] WANG J L, WAN W. Effect of concentration on fermentative hydrogen production by mixed cultures[J]. International Journal of Hydrogen Energy, 2008, 33(4): 1215-1220. doi: 10.1016/j.ijhydene.2007.12.044 [10] TAHERDANAK M, ZILOUEI H, KARIMI K. The effects of Fe0 and Ni0 nanoparticles versus Fe2+ and Ni2+ ions on dark hydrogen fermentation[J]. International Journal of Hydrogen Energy, 2016, 41: 167-173. doi: 10.1016/j.ijhydene.2015.11.110 [11] YANG G, WANG J L. Various additives for improving dark fermentative hydrogen production: A review[J]. Renewable and Sustainable Energy Reviews, 2018, 95: 130-146. doi: 10.1016/j.rser.2018.07.029 [12] ZHANG J S, FAN C F, ZANG L H. Improvement of hydrogen production from glucose by ferrous iron and biochar[J]. Bioresource Technology, 2017, 245: 98-105. doi: 10.1016/j.biortech.2017.08.198 [13] FENG Y, ZHANG Y, QUAN X, et al. Enhanced anaerobic digestion of waste activated sludge digestion by the addition of zero valent iron[J]. Water Research, 2014, 52: 242-250. doi: 10.1016/j.watres.2013.10.072 [14] ZHANG L, ZHANG L X, LI D P. Enhanced dark fermentative hydrogen production by zero-valent iron activated carbon micro-electrolysis[J]. International Journal of Hydrogen Energy, 2015, 40(36): 12201-12208. doi: 10.1016/j.ijhydene.2015.07.106 [15] ZHU H, SETO P, PARKER W J. Enhanced dark fermentative hydrogen production under the effect of zero-valent iron shavings[J]. International Journal of Hydrogen Energy, 2014, 39(33): 19331-19336. doi: 10.1016/j.ijhydene.2014.06.055 [16] MULLAI P, YOGESWARI M K, SRIDEVI K. Optimisation and enhancement of biohydrogen production using nickel nanoparticles: A novel approach[J]. Bioresource Technology, 2013, 141(7): 212-219. [17] DHRUBAJYOTI N, AJAY K M, KULDEEP G, et al. Phytosynthesized iron nanoparticles: Effects on fermentative hydrogen production by Enterobacter cloacae DH-89[J]. Bulletin of Materials Science, 2015, 38(6): 1533-1538. doi: 10.1007/s12034-015-0974-0 [18] ZADA B, MAHMOOD T, MALIK S A. Effect of iron nanoparticles on hyacinth's fermentation[J]. International Journal of Applied Mechanics, 2013, 2: 106-121. [19] 施军营. 高温蒸煮除油对餐厨垃圾厌氧消化的影响[J]. 安徽农业科学, 2014, 42(7): 2101-2103. doi: 10.3969/j.issn.0517-6611.2014.07.074 [20] JIA X, XI B D, LI M X, et al. Metaproteomic analysis of the relationship between microbial community phylogeny, function and metabolic activity during biohydrogen-methane coproduction under short-term hydrothermal pretreatment from food waste[J]. Bioresource Technology, 2017, 245: 1030-1039. doi: 10.1016/j.biortech.2017.08.180 [21] 辛红梅. Fe3O4纳米颗粒对废水厌氧发酵产氢的影响研究[D]. 哈尔滨: 哈尔滨工业大学, 2016. [22] 高常卉, 黄振兴, 赵明星, 等. 餐厨垃圾厌氧干发酵产氢特性及其调控[J]. 环境工程学报, 2018, 12(6): 285-294. [23] VAN G S, LOGAN B E. Inhibition of biohydrogen production by undissociated acetic and butyric acids[J]. Environmental Science & Technology, 2005, 39(23): 9351-9356. [24] DABROCK B, BAHL H, GOTTSCHALK G. Parameters affecting solvent production by clostridium pasteurianum[J]. Applied and Environmental Microbiology, 1992, 58(4): 1233-1239. [25] CARNAHAN J E, MORTENSON L E, MOWER H F, et al. Nitrogen fixation in cell-free extracts of Clostridium pasteurianum[J]. Biochimica Et Biophysica Acta, 1960, 44(1): 520-535. [26] 李永峰, 任南琪, 史英. 有机废水生物制氢的连续流发酵工艺[J]. 能源工程, 2004(6): 24-27. doi: 10.3969/j.issn.1004-3950.2004.06.006 [27] VALDEZ-VAZQUEZ I, POGGI-VARALDO H M. Hydrogen production by fermentative consortia[J]. Renewable & Sustainable Energy Reviews, 2009, 13(5): 1000-1013. [28] LAURINAVICHENE T V, CHANAL A, WU L F, et al. Effect of O2, H2 and redox potential on the activity and synthesis of hydrogenase 2 in Escherichia coli[J]. Research in Microbiology, 2001, 152(9): 793-798. doi: 10.1016/S0923-2508(01)01262-1 [29] REN Y L, XING X H, ZHANG C, et al. A simplified method for assay of hydrogenase activities of H2 evolution and uptake in Enterobacter aerogenes[J]. Biotechnology Letters, 2005, 27: 1029-1033. doi: 10.1007/s10529-005-8106-3 [30] WANG C Q, YE L, JUN J, et al. Magnetite nanoparticles enhance the performance of a combined bioelectrode-UASB reactor for reductive transformation of 2,4-dichloronitrobenzene[J]. Scientific Reports, 2017, 7(1): 1-10. doi: 10.1038/s41598-016-0028-x [31] BAO M D, SU H J, TAN T W. Dark fermentative bio-hydrogen production: Effects of substrate pre-treatment and addition of metal ions or L-cysteine[J]. Fuel, 2013, 112: 38-44. doi: 10.1016/j.fuel.2013.04.063 [32] DAI X H, XU Y, LU Y Q, et al. Recognition of the key chemical constituents of sewage sludge for biogas production[J]. RSC Advances, 2017, 7(4): 2033-2037. doi: 10.1039/C6RA26180A [33] 李永峰, 陈红, 韩伟, 等. 零价铁和二价铁离子对发酵产氢效能的影响[J]. 太阳能学报, 2009, 30(4): 551-557. doi: 10.3321/j.issn:0254-0096.2009.04.028 [34] 唐金花, 许国仁, 萧静, 等. Fe2(SO4)3对活性污泥微生物活性的影响[J]. 哈尔滨工业大学学报, 2012, 44(6): 1-5. doi: 10.11918/j.issn.0367-6234.2012.06.001 [35] ZHAO X, LIU W, CAI Z Q, et al. An overview of preparation and applications of stabilized zero-valent iron nanoparticles for soil and groundwater remediation[J]. Water Research, 2016, 100: 245-266. doi: 10.1016/j.watres.2016.05.019 -




 DownLoad:
DownLoad: