-
近年来,人工湿地作为一种绿色环保型生态系统而备受关注。通过基质、土壤、植物和微生物的物理、化学、生物三重协同作用,人工湿地可用于城市污水、生活污水以及农业排放污水等的净化处理[1-2]。
氮是引起水体富营养化的主要因子[3]。研究氮在人工湿地中的时空分布特征、迁移转化规律、去除机制及影响因素对于湿地系统的水质管控具有重要意义[4-6]。人工湿地水体中氮污染物的去除和转化与微生物硝化、反硝化作用和植物吸收有关,很大程度上受各种理化性质的影响[7]。如水体酸碱度(pH)对氮的去除影响较大,pH升高,会增加作为生化反应基质底物的游离氨浓度,抑制氨氧化菌的活性和硝化反应的进行[8-9],水体碱性过高时,植物吸收作用也会减弱,可降低氮的去除率[10]。水体电导率(EC)与离子有关,高盐度会导致微生物细胞在高渗透压下脱水而不利于其存活,同时也会使代谢酶活性受阻,影响氮的去除[11-12]。氧化还原电位(Eh)可较好地反映好氧与厌氧环境,从而调控硝化和反硝化反应过程[13]。溶解氧(DO)对氮的去除也有一定影响,研究认为,高浓度的DO有利于硝化反应,反之,低浓度的DO则更有利于反硝化过程。但也有研究表明,在好氧条件下,硝化和反硝化反应可交互影响氮的转化过程[14-15]。此外,温度(T)通过影响微生物活性,也可影响氮的去除,有报告显示,水体温度升高有利于提升微生物活性,从而提高水体氮的去除率[16]。
人工湿地水体中不同形态氮的去除受多种因素的共同影响[17]。然而,目前关于基于污水处理厂处理尾水的人工湿地系统中氮分布特征的研究还十分有限。研究组合人工湿地水体多种理化因子与氮形态的分布之间的关系,对于探究湿地氮污染迁移转化规律、优化组合人工湿地系统构建模式具有重要的意义。本研究利用GIS中克里格插值法,研究了天津临港人工湿地水体中DO、Eh、pH、EC、T和不同形态氮的分布特征,分析了pH、EC、Eh和DO对不同形态氮分布间的影响,采用单因子指数法对湿地水体污染状况进行了评价,为改善该湿地系统的水质、优化湿地系统的结构和功能提供参考。
全文HTML
-
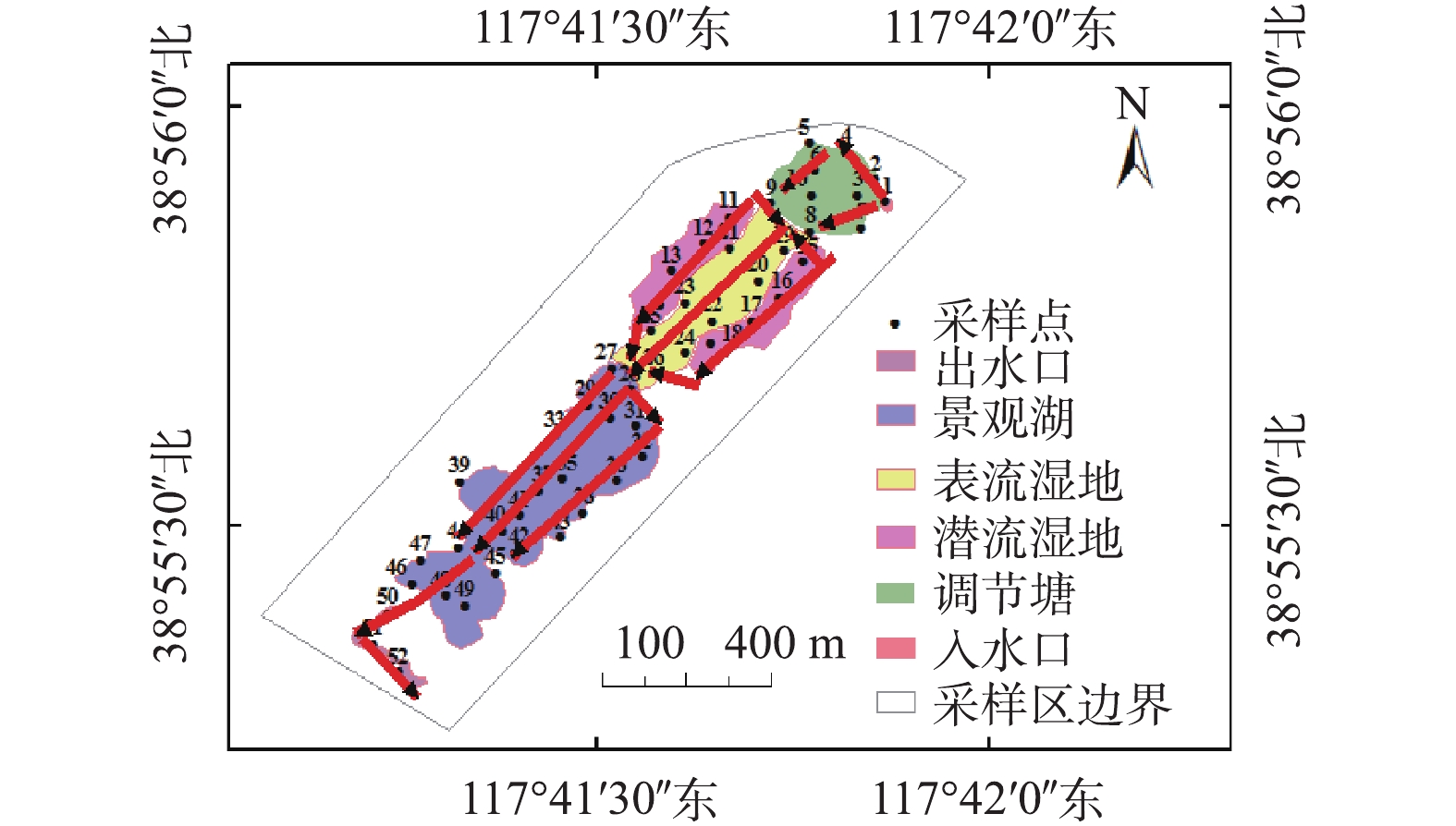
天津临港经济区湿地公园位于东经117°41′58″,北纬38°55′58″,是由一片退海成陆的盐碱地改造而成的国内首个以水处理为主的生态公园。全园大致分为调节塘预处理区、潜/表流湿地集中处理区、景观湖混合区3大功能区,地势总体由东北向西南倾斜。园区的总占地面积约0.63 km2,水体所占面积约0.17 km2。其中,调节塘、潜流湿地的水面分别约为0.01 km2和0.05 km2,表流湿地和景观湖区水面约为0.11 km2。该区域的补充水源主要来自于其东北方向污水厂的处理尾水,水源补给量约4 000 m3·d−1。全园水生植物类型以芦苇为主,主要集中于潜/表流湿地集中处理区,潜流湿地区域底层铺设有大量基质,对水质净化起到关键作用。
-
本次采样采用网格布点法[18],布设位置如图1所示。采样区域由东北部入水口往西南部出口处依次覆盖调节塘、潜流/表流湿地、景观湖、出水口,网格规格为100 m × 100 m。去除其中的无效网格(如整个网格为小岛或无水淹没区),并在每个网格中心取点。2#、4#、7#、10#、20#、22#、24#、27#、29#、31#、33#、35#、40#、42#和46#采样点的网格被小岛分割,所以未在网格的中心进行取样,据其地形环境条件以及水流状况,于每个网格间增加1 ~ 2个采样点,最后采样点共计52个。于2018年12月1—3日进行采样,采集样品装入聚乙烯瓶,迅速带回并置于冰箱中,在4 ℃的条件下进行冷藏保存。
-
本研究采用ArcGIS 10.2中的克里格插值法对各采样点污染物浓度值进行氮分布分析,以颜色的深浅代表浓度的高低。
采用单因子污染指数法,评价TN、
NH+4 -N、NO−3 -N以及NO−2 -N各项水质指标相对于水体功能类别的达标或超标情况[19]。其计算方法如式(1)所示。式中:Pi为单因子评价污染指数;i表示湿地水体污染因子(TN、
NH+4 -N、NO−3 -N、NO−2 -N);Ci为污染因子的实测值,mg·L−1;Si为污染因子的标准值,mg·L−1。根据《地表水环境质量标准》(GB 3838-2002)Ⅳ类水质标准,Pi ≤ 1,表明水体未受污染;Pi>1,表明水体受到污染,且Pi越大,水体受污染越严重。 -
本研究所涉及的检测指标包括水体理化因子DO、Eh、pH、EC、T及污染因子总氮(TN)、氨氮(
NH+4 -N)、硝态氮(NO−3 -N)和亚硝态氮(NO−2 -N)。TN的测定采用碱性过硫酸钾消解-紫外分光光度法(GB 3838-2002)[20],NH+4 -N的测定采用纳氏试剂分光光度法(GB 3838-2002),NO−3 -N的测定采用紫外可见光分光光度法(GB 3838-1988),NO−2 -N的测定采用分子吸收分光光度法(GB 3838-1988)。而DO、Eh、pH、EC和T则主要用便携式的多参数测量仪(Multi3630 IDS,德国WTW公司)于采样现场测定。不同形态氮的含量采用紫外-可见智能型多参数水质测定仪(LH-3BA,兰州连华科技公司)进行测定。所取水样均进行3次平行测试,取平均值作为最终结果,相对偏差控制在5%以内。
1.1. 研究区域
1.2. 样品采集
1.3. 数据处理
1.4. 实验仪器与方法
-
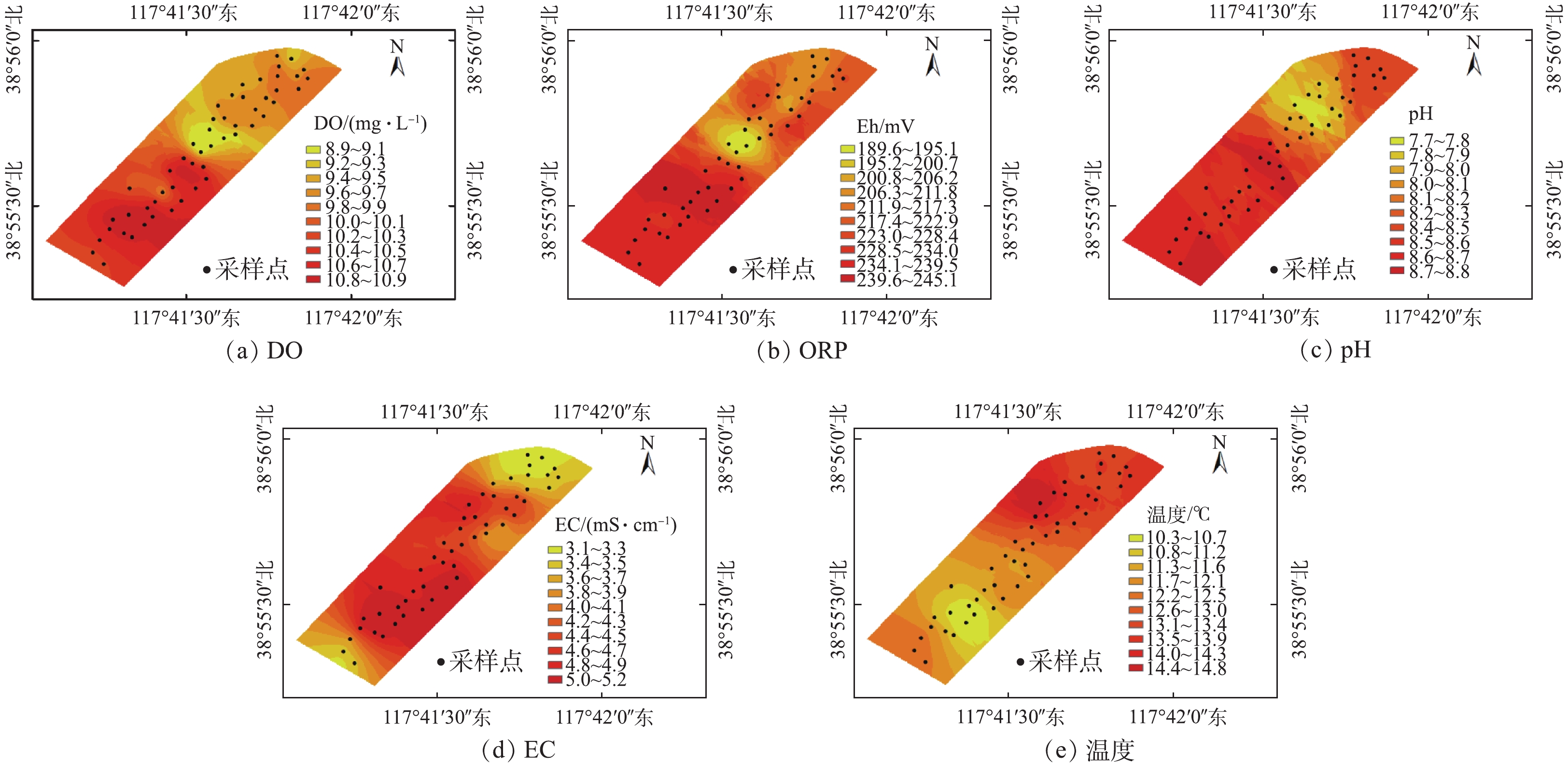
天津临港湿地水体中理化性质的分布如图2所示。由图2可知,水体中DO的含量为8.9~10.9 mg·L−1。邱昭政等[21]研究了DO对氨氧化过程的影响,认为DO在5.0~7.0 mg·L−1的条件下,即形成了水体微生物的好氧环境。对比可知,本研究湿地水体DO整体较高,故有利于微生物的好氧氨氧化作用。整体上,自调节塘向表流湿地方向,DO的含量呈下降趋势,至景观湖又趋于升高。DO下降可能因有机物好氧降解消耗大量DO所致,而景观湖出现DO升高,这可能与景观湖DO的T较低有关[22]。
Eh与水体氮污染物转化行为紧密相关[23],有研究[24]认为,Eh大于100.0 mV的水体处于好氧环境。本研究人工湿地水体Eh为189.6~245.1 mV,这表明水体整体溶氧条件良好。由图2(b)可知,Eh在调节塘和潜流湿地浓度略高,在表流湿地下游与景观湖交汇处较低,而至出水口呈逐渐增加的趋势。
由图2(c)可知,湿地水体的pH为7.7~8.8,呈弱碱性。细菌适宜生长的pH为6~9,但不同细菌之间存在差异[25]。本研究湿地中调节塘、景观湖及出水口的pH相差不大。在潜流湿地pH相对较低,这可能与潜流湿地处硝化反应产生H+积聚有关[26]。
天津临港湿地水体的EC为3.1~5.2 mS·cm−1。整体上,EC从调节塘至景观湖呈递增趋势,EC的变化规律可能与水中离子组成及盐分有关[11]。
因采样时间为冬季,故湿地水体温度总体较低,为10.3~14.8 ℃。已有研究[27-28]表明,生物进行硝化反应相对适宜的温度为15.0~35.0 ℃,当其低于15 ℃时,硝化与反硝化过程虽能够发生,但均会受到一定的抑制。
-
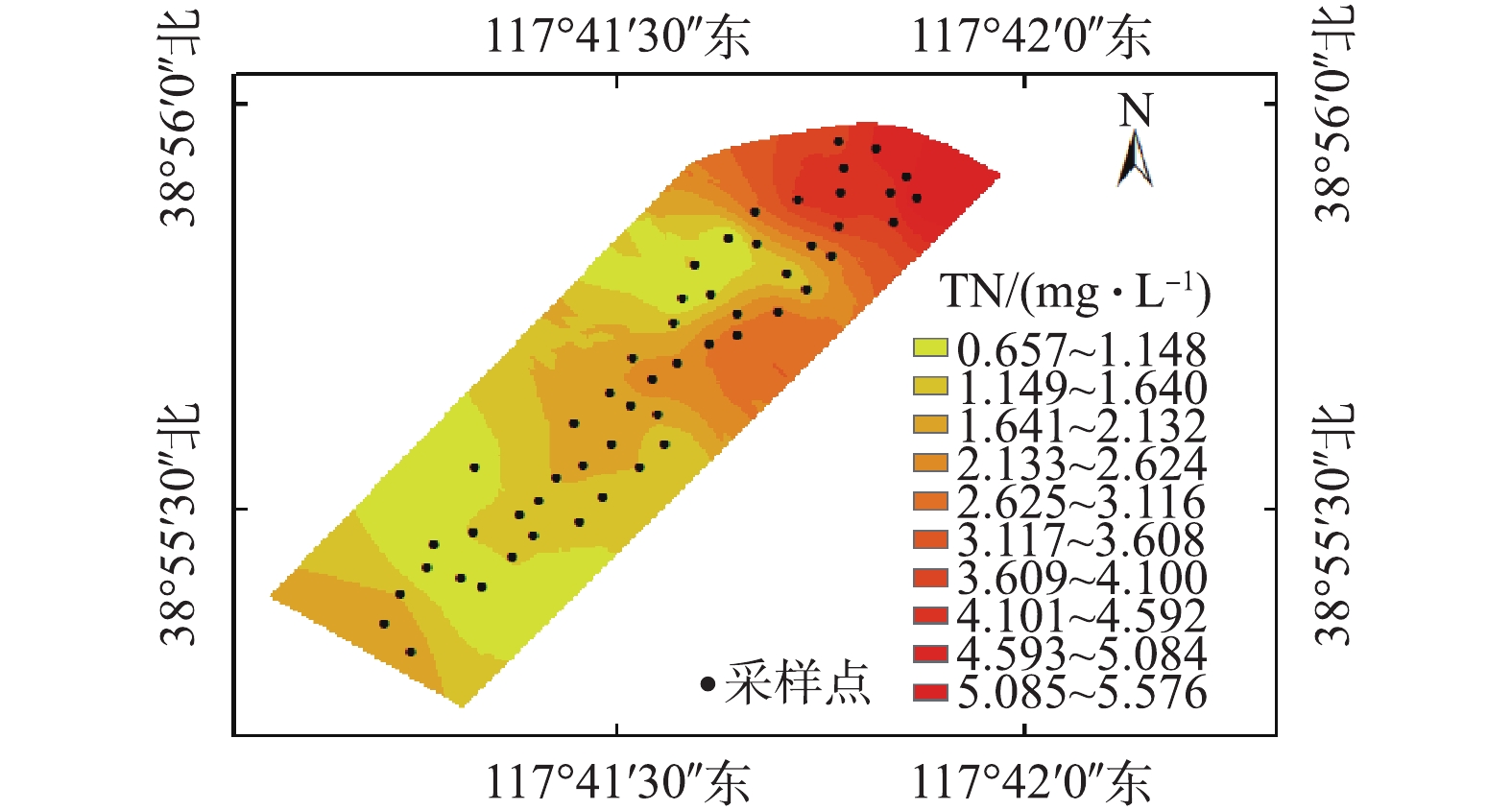
TN、
NH+4 -N、NO−3 -N、NO−2 -N浓度的统计值如表1所示。TN、NH+4 -N、NO−3 -N、NO−2 -N的浓度分别为0.657~5.576、0.054~0.885、0.095~3.920、0.001~0.054 mg·L−1。由表1可知,NH+4 -N、NO−3 -N、NO−2 -N的浓度之和低于TN浓度,这表明湿地中除无机氮之外仍可能存在一定量的有机氮。NH+4 -N和NO−3 -N含量较高,分别占TN的17.6%和49.2%,NO−2 -N含量较低,仅为TN的0.44%。变异系数为标准差和平均数的比值,其可反映变量在平面上分布的不均匀性,当变异系数低于10%时,表示该变量为弱变异性;当变异系数为10%~100%时,为中等变异性;当变异系数超过100%时,则为强变异性[29-30]。由表1可知,NO−3 -N与NO−2 -N的变异系数大于TN和NH+4 -N,分别为中等强度变异和强变异,这表明湿地中的NO−3 -N与NO−2 -N在水流方向分布上浓度差异较大,而NO−2 -N的分布最不均匀。天津临港湿地水体TN分布如图3所示。水体TN浓度从入水口到景观湖总体呈现逐渐下降趋势,在出水口略有回升,于调节塘处浓度较高。由于湿地位于临港经济区工业园西南侧,水体来源为污水处理厂出水,湿地的调节塘、潜流湿地和景观湖据地势高低,由北向南依次分布。当水体首先流经调节塘时,仍含有大量含氮污染物,水质相对较差,故TN浓度也相对较高。水体流入潜流湿地后,TN浓度呈下降趋势。一方面,潜流湿地砂石基质的过滤作用有助于TN去除;另一方面,潜流湿地种植有芦苇、美人蕉等水生植物,其根系仍可吸附去除水中部分含氮污染物;而根际微生物,在好氧环境下,可通过硝化作用将
NH+4 -N转化为NO−2 -N和NO−3 -N[31]。经过表流湿地处理,水体进入景观湖后,TN总体浓度保持较低,至出水口的TN浓度微升,这可能与出水口污染物沉积有关。湿地水体中
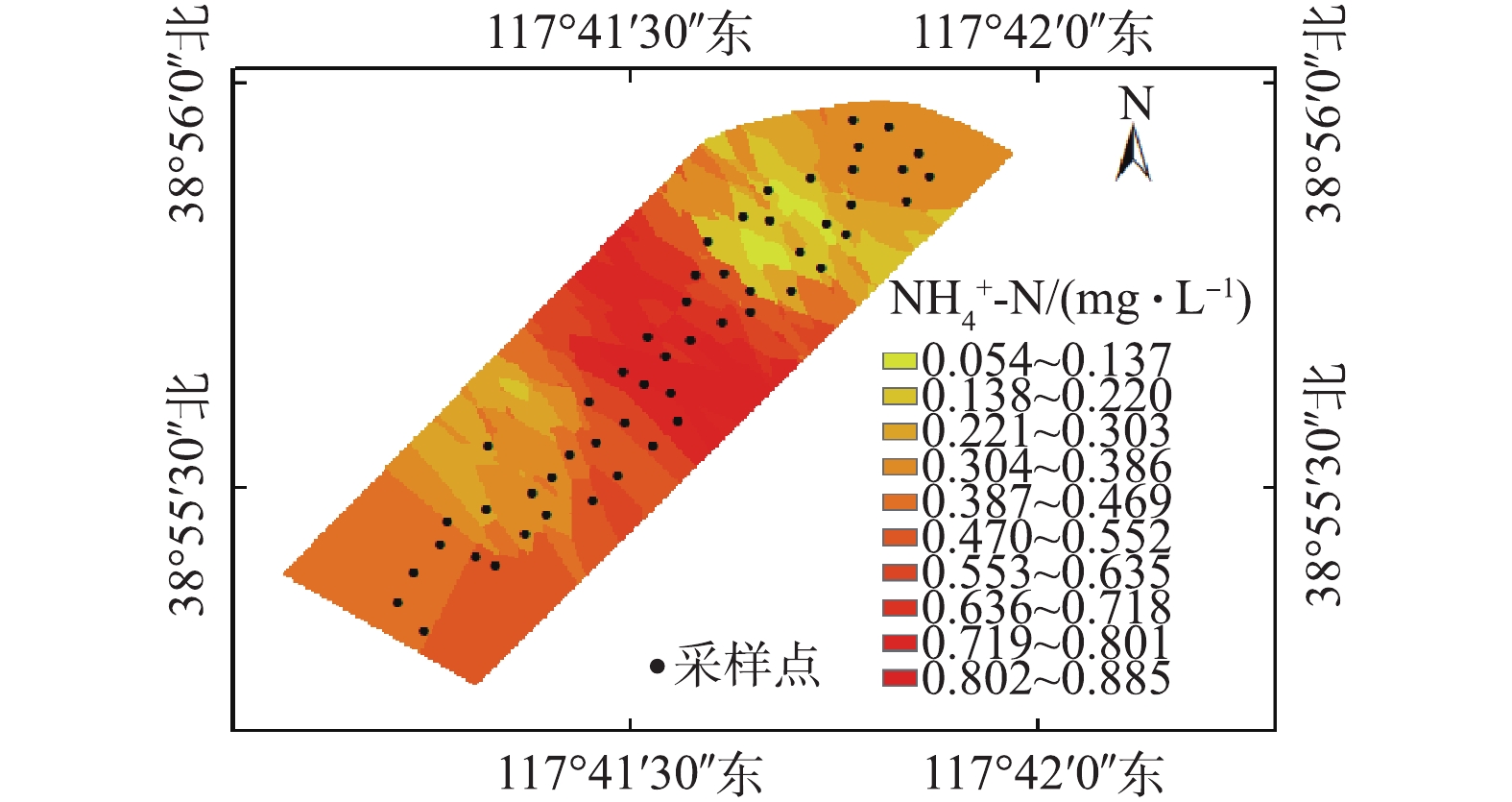
NH+4 -N分布如图4所示。整体上看,潜流湿地和表流湿地中部及东北部区域水体NH+4 -N浓度相对较低,而在2个区域的下游与景观湖交汇处及景观湖上游区域,其浓度出现最高值。潜流湿地和表流湿地区域的NH+4 -N浓度较低,可归因于硝化作用、基质作用、植物根系影响等多因素作用的结果。由图2(c)可知,潜流和表流湿地中NH+4 -N较低部分的pH为7.7~7.9,该区域的pH有利于氨氧化菌的生长繁殖[32],可通过硝化反应,促进NH+4 -N的转化。此外,芦苇等植物的根系和填料基质也可为微生物提供依附界面,增加微生物数量,从而有利于NH+4 -N的去除[33]。潜流和表流湿地下游与景观湖交汇区域的NH+4 -N浓度相对较高,这可能主要与此处较低的pH和相对较低的Eh有关。由图2(b)可知,Eh由206.5 mV降至189.6 mV,较低的Eh也对硝化反应起到抑制,从而导致该区域NH+4 -N浓度水平相对较高。由图2(c)可知,潜流和表流湿地下游与景观湖交汇区域pH相对较低,而水体中较低的pH有利于NH+4 -N的存在[32]。湿地水体
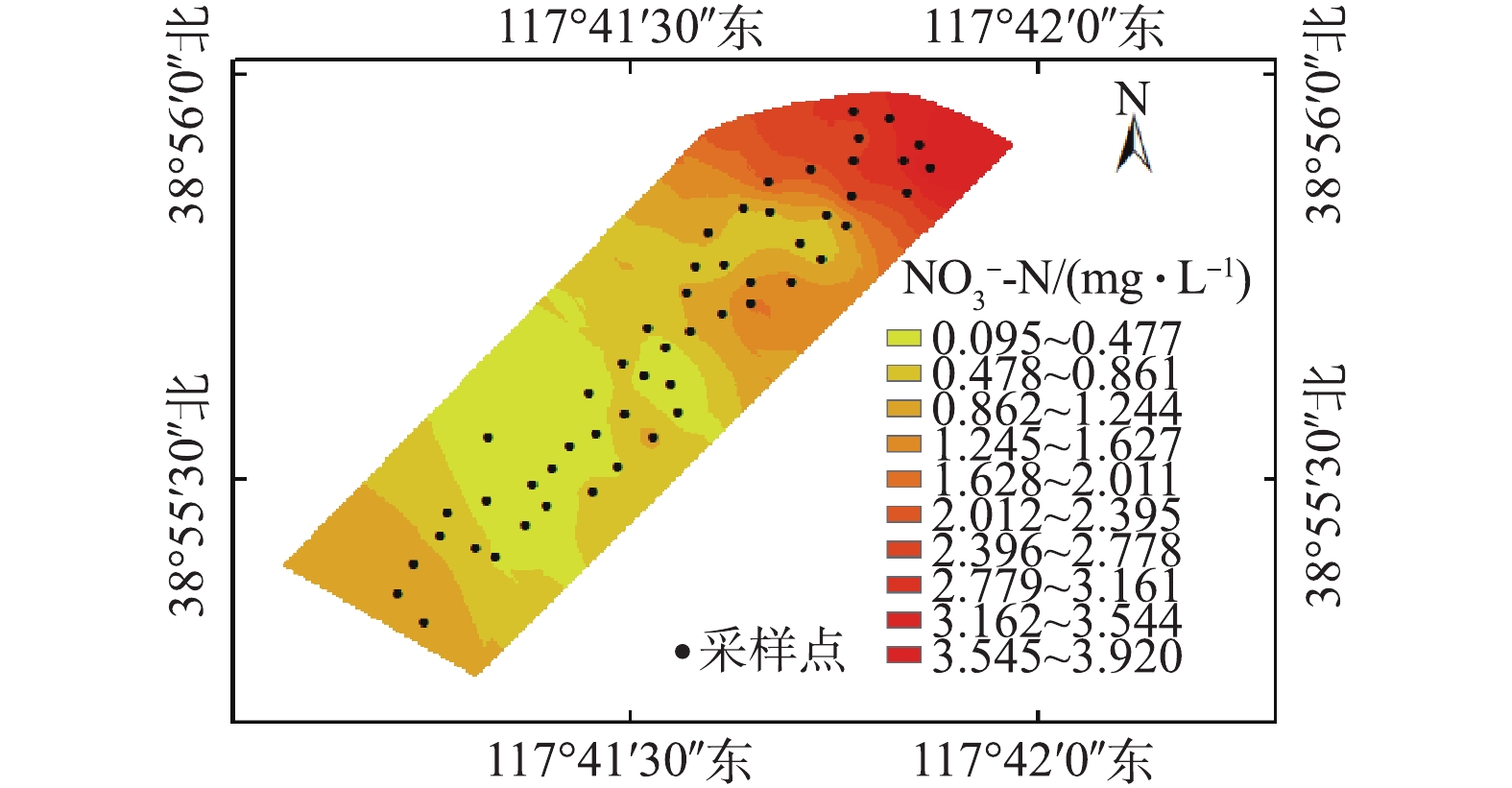
NO−3 -N分布特征如图5所示。NO−3 -N分布趋势与TN总体一致,其浓度在入水口处最高,为3.920 mg·L−1,所占比例为70.3%,这可能是由于入水口处的水样为污水处理厂处理尾水,并未有其他因素影响。从入水口到景观湖总体呈下降趋势,在景观湖中部区域最低,于出口处略回升。在景观湖中部区域,NO−3 -N浓度最低,可能与该区域EC较高有关。由图2(d)可知,NO−3 -N浓度最低的区域,EC相对较高,约为5.0~5.2 mS·cm−1,表明该区域盐度相对较高。已有研究[12, 34]表明,水体盐度升高,会影响微生物对渗透压的调节作用,进而降低微生物的存活率。EC较高水体的反硝化菌可能成为优势菌种,在反硝化菌作用下,导致NO−3 -N浓度水平趋于降低。湿地水体
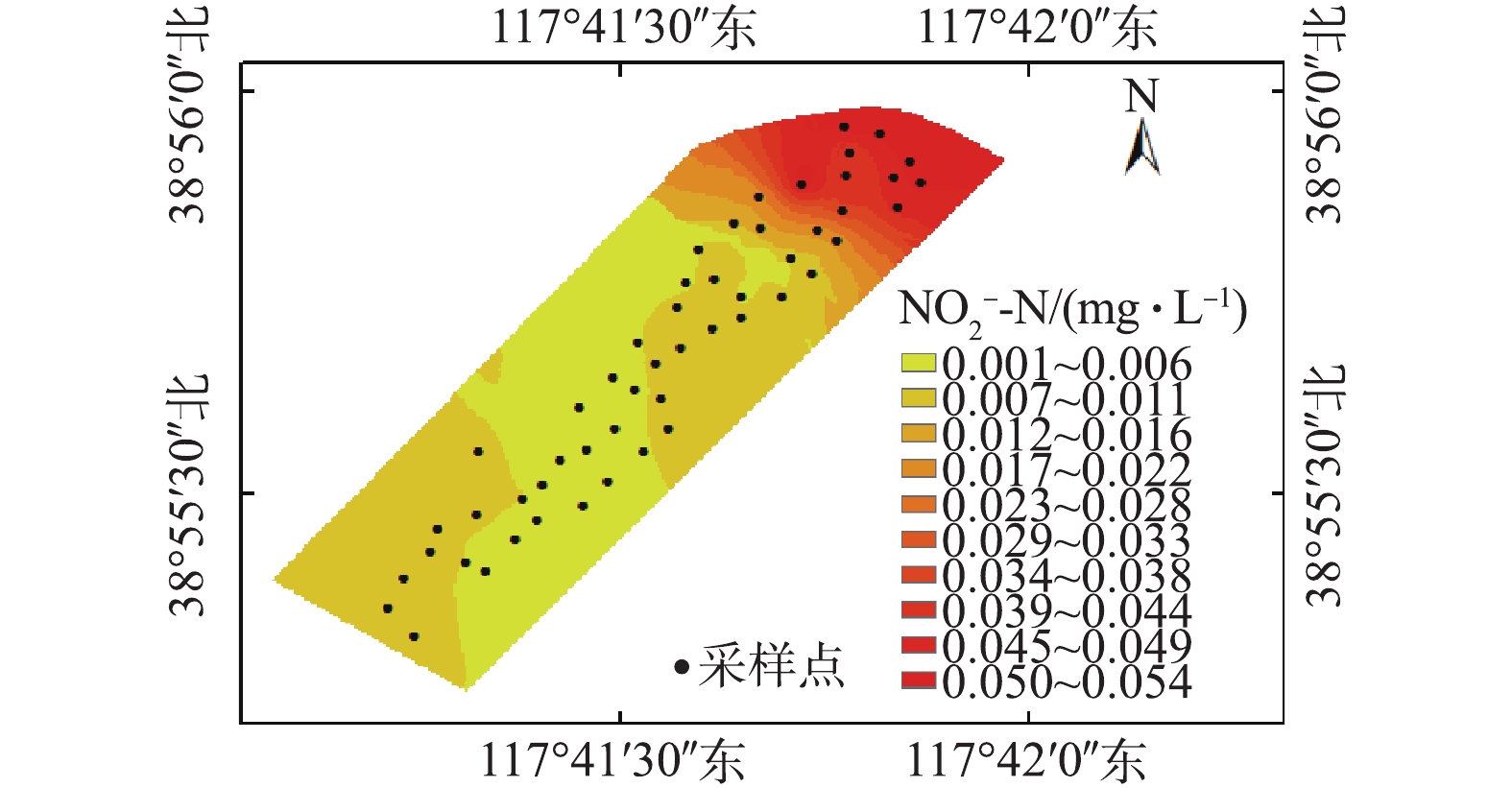
NO−2 -N的分布特征如图6所示。结果表明,调节塘的NO−2 -N浓度要显著高于其他区域。由图2(a)可知,与湿地其他区域相比,调节塘DO含量相对较低,但其仍维持在较高水平,为9.6~9.9 mg·L−1,这表明调节塘水体仍处于好氧环境[25]。较高的DO浓度有利于该区域的硝化反应发生,促进NH+4 -N向NO−2 -N和NO−3 -N转化。据图4和图5可知,调节塘NH+4 -N浓度较低,而NO−3 -N浓度较高,二者分别为0.260~0.376 mg·L−1和2.057~2.866 mg·L−1,也印证了上述所得的结论。 -
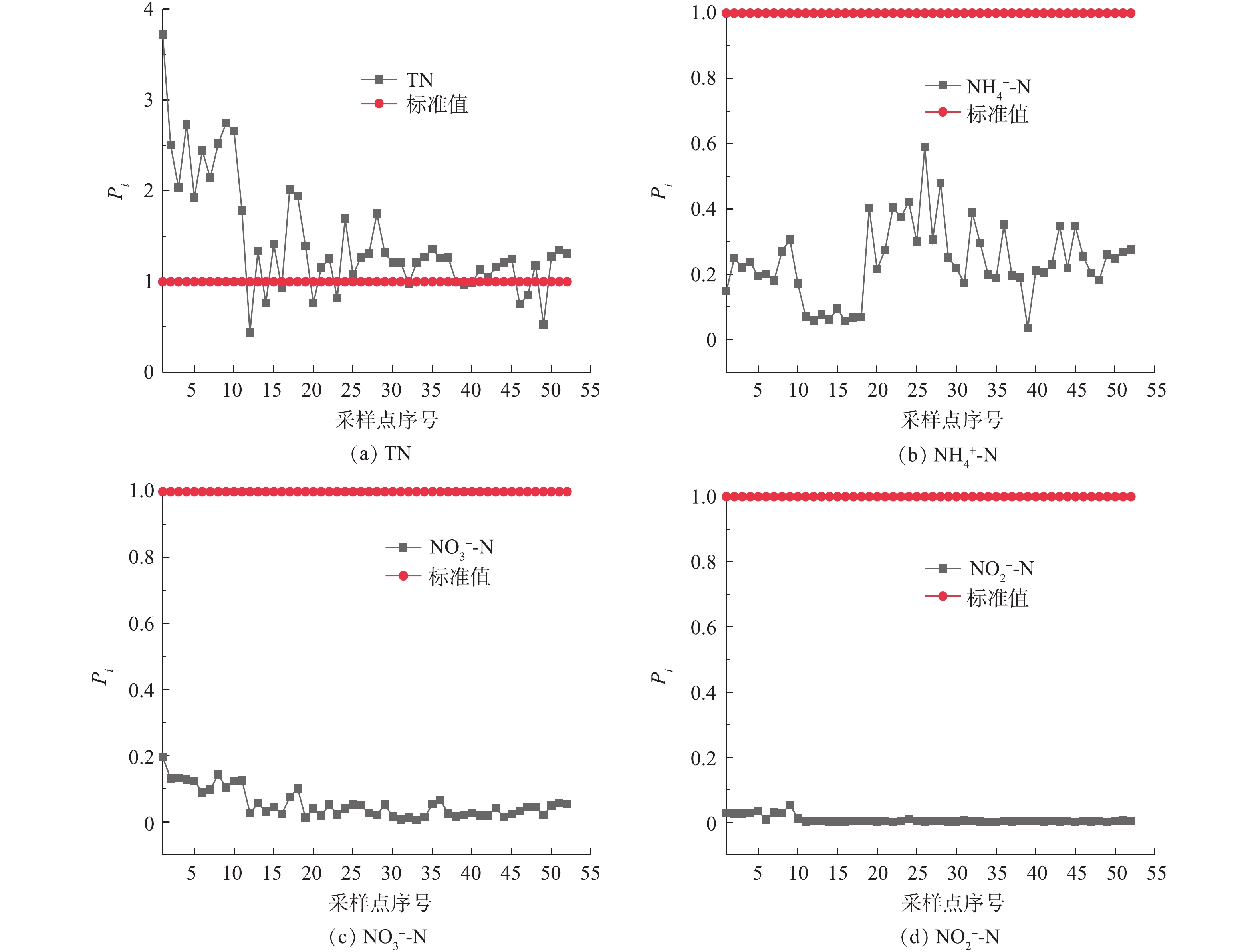
湿地水体不同形态氮的单因子污染指数分布如图7所示。由图7(a)可知,污水厂尾水中TN的浓度超过地表水环境质量标准,进入湿地后,TN整体呈现下降趋势。由图7(b)~图7(d)可知,尾水和湿地中
NH+4 -N、NO−3 -N与NO−2 -N等形态氮均未超标。TN在40个采样点存在不同程度的超标,大部分区域TN的Pi均高于1,在调节塘区域,TN的污染相对最为严重,因此,应考虑以调节塘作为TN的优控区。
2.1. 湿地水体的理化性质及分布特征
2.2. 湿地水体不同形态氮的分布特征分析
2.3. 湿地水质污染评价
-
1) TN和不同形态氮的浓度及其分布沿水流方向存在显著差异。天津临港人工湿地水体中TN、
NH+4 -N、NO−3 -N和NO−2 -N的浓度分别为0.657~5.576、0.054~0.885、0.095~3.920、0.001~0.054 mg·L−1。污水厂尾水中TN的浓度超过地表水环境质量标准,进入湿地系统后,TN、NO−3 -N、NO−2 -N的分布趋势基本一致,沿水流方向,从入水口至景观湖呈逐渐降低趋势,而NH+4 -N的变化相对复杂。其中,NO−2 -N表现为强变异、分布最不均匀。2)湿地水体理化性质可影响不同形态氮污染物浓度的分布,其影响程度因具体区域不同存在一定差异。研究区水体DO和Eh分别为8.9~10.9 mg·L−1和189.6~245.1 mV,整体溶氧条件良好,水体整体呈弱碱性(pH=7.7~8.8),pH降低可导致
NH+4 -N浓度增加,EC增大可引起NO−3 -N浓度的降低。3)尾水和湿地系统水体中
NH+4 -N、NO−3 -N与NO−2 -N等形态氮均未超标(Pi<1)。总体上,TN在湿地各功能区存在不同程度的超标现象(Pi>1),且在调节塘TN污染最为严重,为加强对人工湿地氮污染物的有效管控,调节塘应列为TN的优控区。



















 DownLoad:
DownLoad:
 百度学术
百度学术
















