-
在我国城市河流中,长期的外源污染输入和水生生物残渣的沉积,导致河流水质恶化并产生黑臭现象。水体黑臭是一种生物化学现象,水体中有机污染物含量过高时,有机物在好氧条件下进行生物分解时耗氧较大,远远超出水体复氧量,造成水体缺氧,致使有机物降解不完全、速度减缓。厌氧生物降解过程生成氨、硫化氢、有机胺、硫醇和有机酸等发臭物质,同时形成FeS、MnS等黑色物质,使水体发生黑臭。在形成城市黑臭水体的许多因素中,有机物污染是直接原因[1]。微生物原位修复技术作为一种低成本、实地操作性强、生态节能的方法,被广泛应用于各个领域[2-3]。目前,微生物原位修复技术主要包括曝气、投加菌剂、生物促生剂等[4-6]。近年来,利用微生物法净化黑臭水体在我国部分地区的实际应用中已取得了一定的效果,但对有机物净化效果尚不理想,这是因为有机物的去除效果往往只是采用传统的表观有机物指标如COD、BOD等进行评价,这些指标很难反映微生物法处理黑臭水过程中各类溶解有机物(DOM)组成和含量的变化特征。
由于DOM中存在发色团和荧光团,光谱技术可以揭示其特征和结构组成。三维荧光激发发射光谱矩阵(EEM)已被证明是表征DOM的有用技术[7-9]。其具有快速、灵敏和不使用化学试剂等优点,有利于识别各种水系统中DOM的位置、强度和区域比例。CHEN等[10]根据模型化合物、DOM组分和海水或淡水的荧光特征,将EEMs划分为5个区域:类富里酸物质、类腐殖酸物质、类色氨酸物质、类酪氨酸物质和微生物腐殖质类物质。近年来,三维荧光光谱与平行因子分析(PARAFAC)相结合的方法得到广泛应用,它通过整合每个区域的体积,对DOM的荧光响应部分进行定量分析[11]。EEM-FRI技术已被广泛用于不同的领域,包括对河流和废水样品[11]、废水污泥样品[12]等的检测,通过该方法鉴定光谱组分,可以进一步了解不同废水处理过程中有机物的动态。因此,利用三维荧光技术对不同微生物法处理废水过程中的溶解性有机物检测对水污染控制具有重要意义。
本研究以重度黑臭水(劣V类水)为研究对象,分别对曝气、菌剂+曝气、生物促生剂+曝气和菌剂+生物促生剂+曝气4种微生物处理方式进出水中的DOM特征和来源进行了探讨,采用三维荧光光谱法对各处理方式中DOM的荧光特性进行了测定和分析,结合平行因子(PARAFAC)分析方法,提取有效的荧光光谱特征,分析了黑臭水体DOM的主要组成成分、来源以及不同处理方式下水体中DOM的降解过程,阐明不同生物处理方式对黑臭水体中DOM特征变化的影响,为进一步高效治理黑臭水体提供参考。
-
实验上覆水和底泥取自云南省昆明市晋宁县晋城护城河,采集水样100 L,底泥20 L。水样和底泥采集及保存均按照《水和废水监测分析方法(第4版)》中的方法。由于污染较为严重,属劣V类水质,黑臭水体背景值和地表V类水标准(GB 3838-2002)如表1所示。
-
在前期研究中,首先通过正交实验分别研究了目标黑臭水体中的光合菌(3.9×108 CFU·mL−1)、酵母菌(5.0×108 CFU·mL−1)、硝化菌(4.3×107 CFU·mL−1)和放线菌(4.7×108 CFU·mL−1)的定向富集培养液(富集培养至对数期)对黑臭水中NH3-N、TP和COD去除效率的影响,从而确定各菌群最佳投加比例,以这4种菌的定向富集培养液作为微生物菌剂(4.5×108 CFU·mL−1)的组成成分。研究结果表明:各菌群富集培养物投加最佳体积比例为3∶3∶4∶3。其次,在前期实验中,采用3因素3水平正交实验研究了菌剂、生物促生剂(购于上海普罗生物技术有限公司,Bio Energizer)投加量和pH的最优条件。菌剂投加量水平设置为10、30、50 mL·L−1,生物促生剂投加量水平设置为10、30、50 mL·m−3,pH水平设置为6.5、7.5、8.5。测定1个周期内(6 d)NH3-N、TP和COD的去除率,每个实验做3次平行。由于NH3-N去除率是评价黑臭水体净化效果的主要指标,因此,在正交实验中,选取NH3-N去除率为主要考察指标。实验结果显示,pH为7.5、菌剂投加量为50 mL·L−1、生物促生剂投加量为30 mL·m−3是最优组合。
在本研究中,选取15 L的方形聚乙烯桶5只,将黑臭水体搅拌均匀后,每只桶装入10 L水和1 L底泥,连接充气泵和纳米曝气管进行曝气,一般规定水体中的溶解氧至少在4 mg·L−1以上。因此,本研究将曝气、菌剂+曝气、生物促生剂+曝气、菌剂+生物促生剂+曝气4个处理组的溶解氧控制为4 mg·L−1左右。菌剂和生物促生剂均按照上述正交实验结果最佳投加量投加,空白对照组为实验周期中相同体积、温度等条件的静置黑臭水,未作任何处理。实验分组编号如表2所示。
本研究进行了5组实验,实验周期为6 d,即氨氮、TP、COD降解趋于平缓,各实验组每天定时取样,经0.45 μm微孔滤膜抽滤后,将样品避光保存于4 ℃冰箱,用于水质常规指标,进水(投加试剂后)和实验周期结束后的出水用于三维荧光光谱的测定。
-
NH3-N采用纳氏试剂光度法[13]测定,COD采用重铬酸钾法[13]测定,TP采用分光光度法[13]测定,硝态氮采用麝香草酚分光光度法[14]测定,亚硝态氮采用格里斯(Griess)比色法[15]测定,pH采用pH计(瑞士的Mettle Toledo Delta 320)测定。采用数字便携式DO测量仪(JPB-607A,中国,杭州)监测DO水平。
采用F-7000型荧光分光光度计(日本日立)对DOM荧光组分进行分析。激发和发射的狭缝宽5 nm,扫描速度为30 000 nm·min−1,PMT电压为600 V,激发波长(Ex)为220~450 nm,发射波长(Em)为240~600 nm。用1 cm的石英比色皿进行测量,用超纯水作空白对照,进行散射校正。由于黑臭水体污染严重,荧光强度较大,为了降低荧光测量的内滤效应,需要对水样进行稀释。在三维荧光光谱解析之前,要对荧光光谱进行预处理,消除瑞利和拉曼散射的影响,提高光谱解析效率。将瑞利散射上方光谱数据设置为0,以消除瑞利散射的影响;减去超纯水空白的三维荧光光谱数据,以消除拉曼散射的影响[16]。基于DOM组分分级和13C核磁共振分析,CHEN等[10]将废水荧光光谱中不同激发-发射波长区域分为5类主要荧光基团(见表3)。
-
采用SPSS 16.0软件进行方差分析(ANOVA),确定实验因素的影响[17],当P<0.05时,视为存在显著性差异,采用k值和R值进行正交实验分析。通过对不同处理下水体中的荧光组分和物理化学参数进行主成分分析(PCA),发现潜在因素,揭示各荧光组分与水质之间的关系。利用SPSS 16.0对数据集进行PCA分析,使用双因素方差分析测定相关性[18]。三维荧光光谱和平行因子(PARAFAC)模型的模拟均在Matlab16.0中进行分析处理。
-
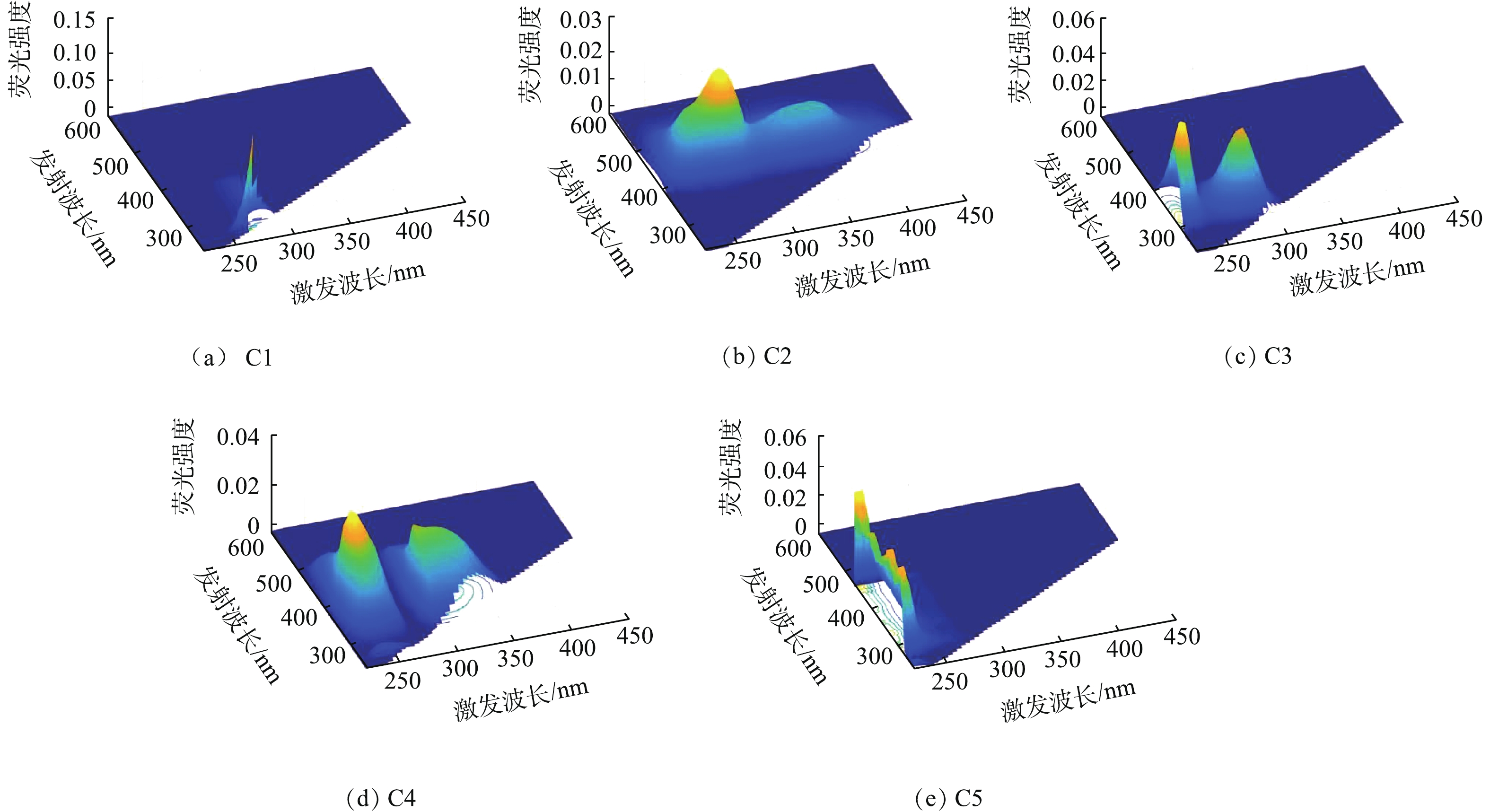
通过PARAFAC分析,本研究共解析出5个荧光尖峰和5个肩峰(图1)。其中,C1为溶解性微生物代谢物(Ex/Em(250~360) nm/(280~380) nm);C2为腐殖酸类腐殖质(Ex/Em (250~420) nm/(380~520) nm),C2肩峰与C4肩峰为腐殖酸类腐殖质(Ex/Em(250~420) nm/(380~520) nm);C3为酪氨酸类蛋白质(Ex/Em(220~250) nm/(280~330) nm),C3肩峰为溶解性微生物代谢物(Ex/Em(250~360) nm/(280~380) nm);C4为色氨酸类蛋白质(Ex/Em(220~250) nm/(330~380)nm);C5为富里酸类腐殖质 (Ex/Em(220~250) nm/(380~480) nm),C5肩峰分别为酪氨酸类蛋白质和色氨酸类蛋白质 (Ex/Em(220~250) nm/(280~330) nm;Ex/Em(220~250) nm/(330~380) nm)。
-
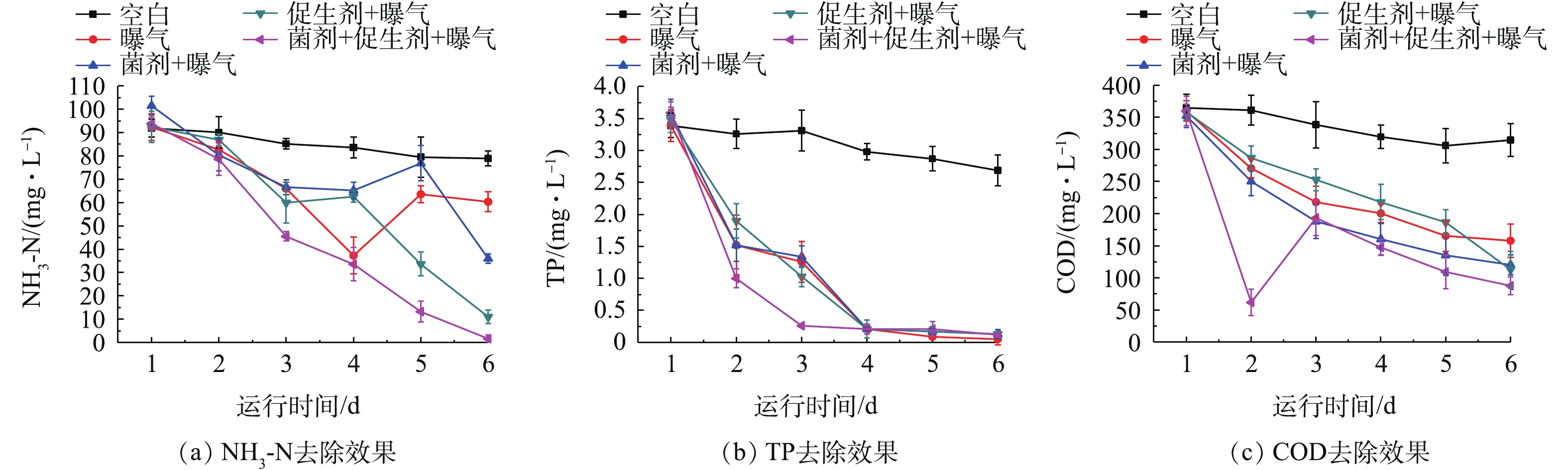
不同处理方式下黑臭水体水质状况如图2所示。在1个周期内,空白组、曝气组、菌剂+曝气组、生物促生剂+曝气组和菌剂+生物促生剂+曝气组中NH3-N去除率分别为14.1%、34.63%、63.29%、88.08%和98.21%(图2(a));TP去除率分别为20.65%、98.53%、96.37%、96.26%和96.66%(图2(b));COD去除率分别为13.74%、56.08%、65.83%、68.52%和75.60%(图2(c))。其中,菌剂+生物促生剂+曝气组NH3-N浓度在实验结束时降至1.68 mg·L−1,达到地表水质V类水标准;在曝气条件及曝气辅助条件下,各处理组TP浓度在实验结束时均降至0.2 mg·L−1以下,达到地表水质Ⅲ类水标准。
-
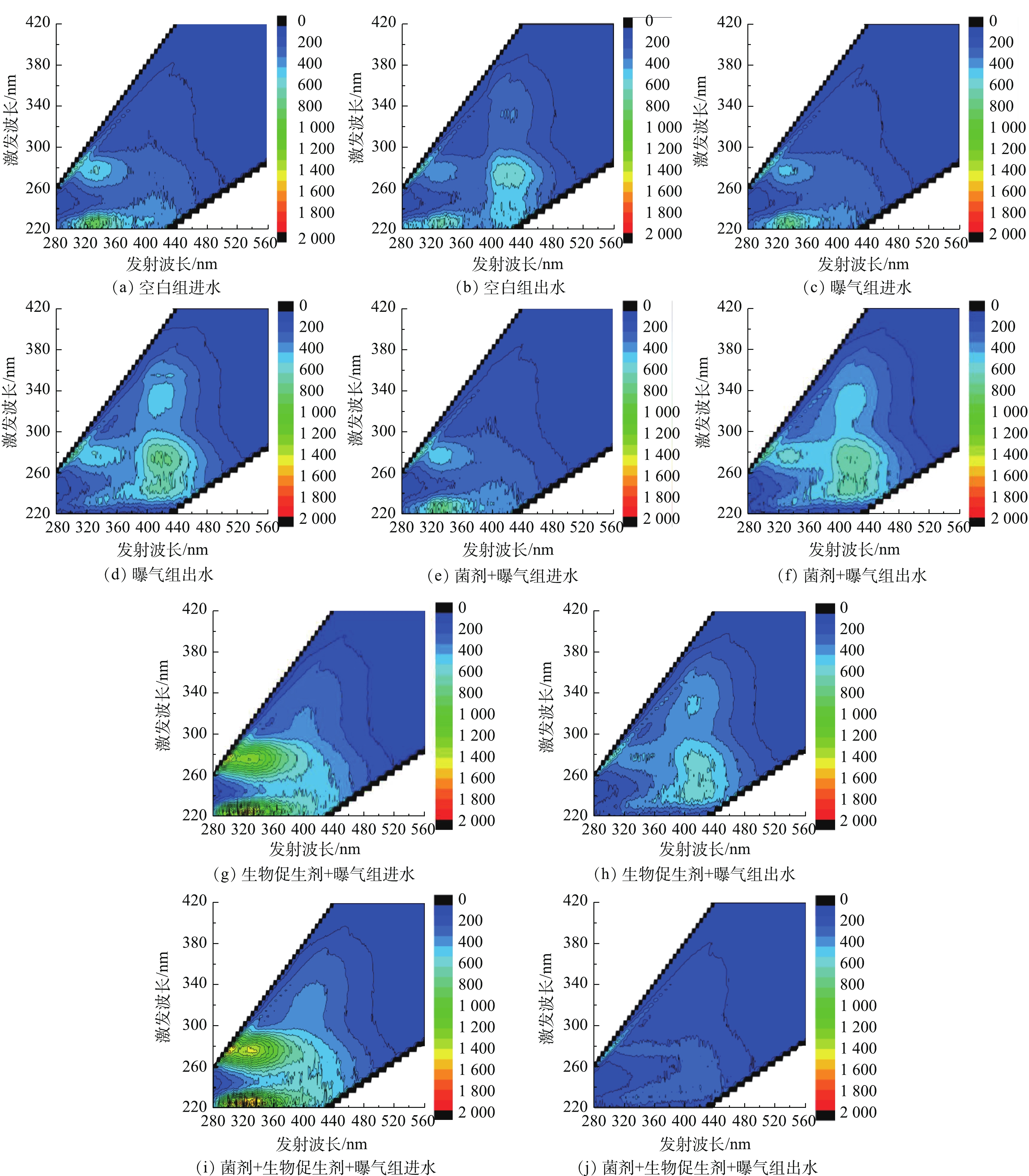
DOM不同组分荧光峰强度在不同处理方式下进出水变化情况如图3所示。不同处理方式下水样DOM的各组分变化存在较明显的差异,与空白组相比,曝气和投加菌剂对进水中DOM的各组分影响较小,投加促生剂后,5种组分均明显增加,这是因为生物促生剂中含有机碳源、有机酸、生物酶和复合维生素等有机营养物。
在1个实验周期内(6 d),与空白组进水样相比,曝气组、菌剂+曝气组和生物促生剂+曝气组出水中溶解性微生物代谢物(C1组分)、腐殖酸类腐殖质(C2组分)和富里酸类腐殖质(C5组分)显著增加,溶解性微生物代谢物增加可能是因为,经过上述3种处理方式后,水样中含有丰富的微生物,而微生物在生长过程中通过代谢以及由于环境中的基质匮乏饥饿刺激或底物刺激等会产生较多的溶解性微生物代谢物;腐殖酸类腐殖质增加可能与底泥中有机质在微生物作用下形成并释放到上覆水体中有关[19];富里酸类腐殖质增加主要是因为腐殖质分解后的更小单位的物质,且其相对稳定不易进行生物降解。上述3种处理方式出水中酪氨酸蛋白质(C3组分)和色氨酸类蛋白质(C4组分)明显降低,可能是由于黑臭水体在3种处理方式过程中,微生物活性增强,对色氨酸类蛋白质和酪氨酸类蛋白质具有转化作用,将其稳定化为类腐殖质物质。而菌剂+生物促生剂+曝气组处理后的出水DOM中的5种组分均明显降低。C1、C2、C3、C4和C5组分分别削减了3.77%、17.15%、85.73%、2.77%和62.81%。
与曝气组出水相比,菌剂+曝气组C1和C4组分分别增加了10.91%和13.44%,C2、C3和C5组分分别削减了2.38%、7.03%和34.73%;促生剂+曝气组C1、C4和C5组分分别增加了0.76%、6.26%和135.47%,C2和C3组分分别削减了20.90%和62.62%;菌剂+促生剂+曝气组C5组分增加了206.07%,C1、C2、C3和C4组分分别削减了36.88%、68.02%、77.85%和13.53%。与菌剂+曝气组出水样相比,菌剂+促生剂+曝气组C5组分增加了368.95%, C1、C2、C3和C4组分分别削减了43.77%、67.25%、76.18%和50.22%。与促生剂+曝气组相比,菌剂+促生剂+曝气组C5组分增加了29.98%,C1、C2、C3和C4组分分别削减了37.35%、59.58%、40.76%和46.86%。由此可见,与其他处理组相比,菌剂+促生剂+曝气组对有机物的去除效果最好,这与本研究中不同处理方式对COD去除率的分析结果相一致。
综上所述,曝气、投加菌剂和生物促生剂均对水溶性有机物结构的转化具有重要意义,可以显著提高黑臭水体中溶解性有机物的稳定性。就有机物而言,有明显的向腐殖化转化的倾向,而腐殖化有机物化学性质相对稳定,比简单有机物较难降解。而经过菌剂和生物促生剂联合处理之后,对类腐殖质等难降解物质又有进一步削减。
-
三维荧光光谱参数主要包括荧光指数FI、腐殖化指数HIX和生物源指数BIX。荧光指数FI可以表征水体溶解性有机质来源,其定义为激发波长为370 nm时,发射波长在450与500 nm处的比值。其中,陆源和生物源DOM的荧光指数分别约为1.4和1.9[20];腐殖化指数HIX是评价DOM腐殖化程度的重要指标,其定义为在激发波长254 nm处,发射波长在435~480 nm与300~345 nm波段内的荧光强度积分值的比率,HIX指数越高,表明DOM腐殖化程度越高[21];生物源指数BIX可以衡量DOM的生物来源的贡献,表征微生物代谢产生的有机质与外源有机质的比例,其定义为激发波长为310 nm时,发射波长在380 nm与430 nm处的比值[22]。不同处理方式下进出水DOM三维荧光光谱参数的变化规律如表4所示。
由表4可知,在不同处理方式下,进水和出水的FI (f450/500)值均大于1.9,表明各处理方式进出水的腐殖质主要为生物源。在出水中,曝气组、菌剂+曝气组和生物促生剂+曝气组的f450/500值明显高于进水的f450/500值,表明经过上述几种处理方式后,微生物群落较进水更加丰富,在代谢过程中,可能会生成部分新的自生生物源类腐殖质,这与2.3节中分析的C1组分增多的现象相对应。菌剂+生物促生剂+曝气组出水的f450/500值最小,低于进水的f450/500值。表明经过菌剂和生物促生剂联合处理后,水体中的有机物被降解生成了大量的腐殖酸,这也从侧面佐证了菌剂+生物促生剂+曝气组COD去除率较其他处理组更好的原因。此外,f450/500与富里酸芳香性之间呈负相关性[23],实验中各处理组f450/500值均较高,说明腐殖酸类物质芳香性较弱,苯环等芳香性基团较少。
在HUGUET等[22]提出的地球化学领域HIX指标溯源体系中,HIX被分为4个等级:1)当HIX<4时,生物内源占主导地位;2)当4<HIX<6时,为较弱的陆地外源和较强的生物内源;3)当6<HIX<10时,为较弱的生物内源和较强的陆地外源;4)当HIX>16时,陆地外源占主导地位。由表5可知,各处理组水样的进水和出水HIX均小于4,但出水相对于进水均有一定程度的增大,较低的HIX说明了水样中的DOM荧光特征主要以生物内源为主导。表明DOM结构特征在不同处理后发生了不同程度的变化,说明不同方式处理有使生物源类腐殖质转变为陆源类腐殖质和生物源类腐殖质共存的倾向,这和FI值变化规律相同。
据报道,BIX值越高,表明水样中的DOM中新近自生源组分占主导地位,BIX值越低,表明水样中的DOM主要来自陆源输入,当BIX>1.0时,水样中的DOM主要是由微生物活动产生的[22]。在本研究中,各处理组进水BIX均大于1.0,说明水样中的DOM主要是由微生物活动产生。空白组出水BIX为0.6~0.7,表明水样中的DOM具有较少的自生源成分;曝气组出水BIX为0.7~0.8,表明水样中的DOM具有中度新近自生源特征;菌剂+曝气组出水BIX为0.8~1.0,表明水样中的DOM具有较强自生源特征;生物促生剂+曝气组和菌剂+生物促生剂+曝气组BIX均大于1.0,表明水样中的DOM是由微生物活动产生的。
综上所述,FI指数、HIX指数和BIX指数都能够较好地反映水体中DOM特征和来源的变化规律,FI表明各处理组水样中的DOM生物来源作用大于陆源作用;HIX表明,各处理组水样中DOM主要由生物活动产生,腐殖化程度较弱[24];BIX表明,除空白组和曝气组外,其余处理组水样中的DOM整体处于较强的自生源特征。但HIX指数变化程度更为显著,其指示作用更敏感。
-
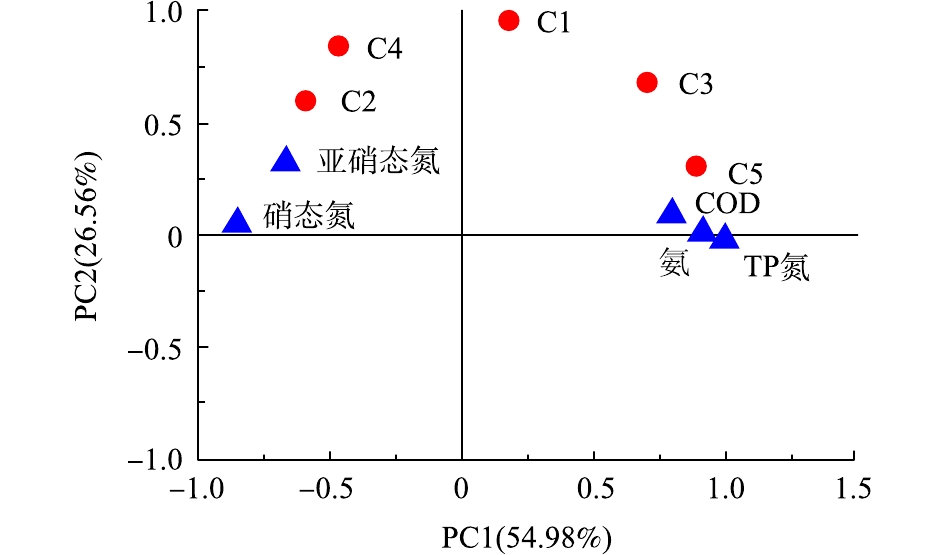
利用SPSS软件,对空白组、曝气组、菌剂+曝气组、生物促生剂+曝气组和菌剂+生物促生剂+曝气组5个处理方式中进出水水质参数(氨氮、TP、COD、亚硝态氮和硝态氮)和5个荧光组分的荧光强度值进行主成分分析。结果显示,主成分分析共提取了2个成分,其累计方差贡献率大于81.5%。主成分分析DOM和水体指标的载荷如图4所示。
主成分分析结果表明:在第1主成分中,C3(酪氨酸类蛋白质)、C5(富里酸类腐殖质)与氨氮、TP、COD具有较好的正相关关系,R2分别为0.589、0.673、0.614和0.742、0.884、0.569,提取因子均大于66.7%,说明C3、C5与氨氮、TP、COD具有同源性。由于C5(富里酸类腐殖质)又是典型的陆源性腐殖质[25],因此,第1主成分表现为陆源类腐殖质和生物源类腐殖质共存的现象;C3与硝态氮呈负相关性(R2=−0.547),C5与亚硝态氮和硝态氮呈负相关性(R2为−0.559和−0.712)。C2(腐殖酸类腐殖质)与TP呈负相关性(R2=−0.549);C4(色氨酸类蛋白质)与亚硝态氮和硝态氮呈正相关性(R2为0.502和0.513),这说明在好氧生物处理过程中,微生物新陈代谢功能增强,含氮有机物分解速率加快,生成较多的硝酸盐和亚硝酸盐。其中,第1主成分对黑臭水体中的DOM的贡献率为54.98%。
在第2主成分中,C1(溶解性微生物代谢物)与C3(酪氨酸类蛋白质)和C4(色氨酸类蛋白质)表现出正相关性(R2分别为0.810和0.688),C1、C3和C4在第2主成分的提取因子分别为95.90%、68.20%和83.74%,说明C1与C3和C4具有同源性,BAKER等[26]在研究微生物活动与类蛋白质荧光关系的同时,提出类蛋白质荧光强度可以作为反映水生生物活动与污染程度的主要指标。其中,C3主要来源于水生生物的死亡降解向水体中释放了大量的类酪氨酸荧光物质,C4主要来源于藻类和微生物新陈代谢产生的氨基酸类物质[25]。此外,C2(腐殖酸类腐殖质)与C4(色氨酸类蛋白质),C3(酪氨酸类蛋白质)与C5(富里酸类腐殖质)表现出较强的正相关性,R2分别为0.785和0.869,说明C2与C4具有同源性,C3与C5具有同源性。第2主成分反映了以微生物代谢过程为代表的内源污染,其对黑臭水体中DOM的贡献率为26.5%。C1和C4在第2主成分中提取因子均大于83%,显示出很强的内源性。
-
1)通过PARAFAC分析,本研究在空白组、曝气组、菌剂+曝气组、生物促生剂+曝气组和菌剂+生物促生剂+曝气组5个不同处理方式进出水中共解析出5种不同组分。分别为溶解性微生物代谢物C1、腐殖酸类腐殖质C2、酪氨酸类蛋白质C3、色氨酸类蛋白质C4、富里酸类腐殖质C5。
2)不同处理方式下进出水DOM的不同组分荧光峰强度变化存在较明显的差异。曝气、投加菌剂和生物促生剂均对水溶性有机物结构的转化具有重要意义,可以显著提高黑臭水体中溶解性有机物的稳定性,而经过菌剂和生物促生剂联合处理之后,对类腐殖质等难降解物质又有进一步的削减,与其他处理组相比,其对有机物的去除效果最好,这与本研究对COD去除率的分析结果一致。
3)FI指数、HIX指数和BIX指数表明各处理组水样中的DOM整体处于较强的自生源特征。但HIX指数变化程度更为显著,其指示作用更加敏感。主成分分析结果表明:第1主成分表现为陆源类腐殖质和生物源类腐殖质共存的现象,其对黑臭水体中的DOM的贡献率为54.98%。第2主成分反映了以微生物代谢过程为代表的内源污染,对水体中DOM的贡献率为26.56%。
基于三维荧光光谱技术解析不同微生物法净化黑臭水体的效果
Effect of different microbial methods on purifying black-odor water based on three-dimensional fluorescence spectroscopy
-
摘要: 应用曝气、菌剂+曝气、生物促生剂+曝气、菌剂+生物促生剂+曝气4种微生物技术净化黑臭水体,分别考察了进水中溶解性有机物(DOM)的特征和来源及出水中DOM的特征和效果,采用三维荧光(EEM)光谱技术与平行因子(PARAFAC)模型相结合的方式对进出水DOM进行了分析。结果表明,不同处理方式下进出水DOM的不同组分荧光峰强度变化存在较明显的差异,经过菌剂和生物促生剂联合处理之后,对类腐殖质等难降解物质削减效果最好。FI、HIX和BIX指数分析表明各处理水样中的DOM整体处于较强的自生源特征。利用主成分分析法(PCA)对影响黑臭水体DOM的主要因素及其贡献量研究发现:第1主成分表现为陆源类腐殖质和生物源类腐殖质共存的现象,对水体中DOM的贡献率为54.98%;第2主成分反映了以微生物代谢过程为代表的内源污染,对水体中DOM的贡献率为26.56%。因此,利用三维荧光分析能够较好的反映水中DOM的去除情况,易于实时在线监测,对黑臭水治理具有重要意义。Abstract: Excitation-emission matrix (EEM) fluorescence spectroscopy combined with parallel factor analysis (PARAFAC) were employed to analyze the characteristics and source of dissolved organic matter (DOM) in influent and the characteristics and effect of DOM in effluent when four microbial technologies: aeration, microbial inoculum+aeration, biostimulant+aeration, microbial inoculum+biostimulant+aeration, were used to purifying black-odor water. The results showed that the fluorescence peak intensity of different components of DOM was significantly different under different treatments. The combined treatment with microbial inoculum and biostimulant had the best reduction effect on non-biodegradable substances such as humus. The FI, HIX and BIX index analysis showed that the DOM in effluent was in a strong autogenous source. Principal component analysis (PCA) was used to study the main factors affecting the DOM of black-odor water and their contributions. The results indicated that the first principal component was characterized by the coexistence of terrestrial humus and biogenic humus, contributing 54.98% to the DOM in water. The second principal component reflected the endogenous pollution represented by microbial metabolism, accounting for 26.56% of the DOM in water. Therefore, the use of three-dimensional fluorescence analysis can better reflect the removal of DOM in water, and is easy to realize real-time on-line monitoring, which is of great significance for black-odor water treatment.
-

-
表 1 黑臭水体背景值
Table 1. Black-odor water background values
mg·L−1 标准和背景值 TN TP COD NH3-N 溶解氧 地表V类水标准 2 0.4 40 2 2 黑臭水体背景值 590.47 3.45 370 94.88 0.35 表 2 实验分组情况
Table 2. Experimental group numbers
序号 曝气 促生剂 菌剂 处理组 1 × × × 空白对照组 2 √ × × 曝气组 3 √ × √ 菌剂+曝气组 4 √ √ × 生物促生剂+曝气组 5 √ √ √ 菌剂+生物促生剂+曝气组 注:√表示添加,×表示不添加。 表 3 荧光光谱分区及其对应物质
Table 3. Fluorescence spectral partition and its corresponding substances
区域 激发波长/nm 发射波长/nm 物质类型 I 220~250 280~330 酪氨酸类蛋白质 II 220~250 330~380 色氨酸类蛋白质 III 220~250 380~480 富里酸类腐殖质 IV 250~360 280~380 含苯环蛋白质、溶解性
微生物代谢物V 250~420 380~520 腐殖酸类腐殖质 表 4 不同处理方式下进出水DOM三维荧光光谱参数
Table 4. Three-dimensional fluorescence spectral parameters of DOM in influent and effluent under different treatment modes
实验组 FI HIX BIX 进水 出水 进水 出水 进水 出水 空白组 2.37 2.79 1.13 1.85 1.07 0.60 曝气组 2.07 2.81 1.21 1.88 1.12 0.77 菌剂+曝气组 2.22 2.51 1.16 1.95 1.05 0.90 生物促生剂+曝气组 2.38 2.60 0.74 2.15 1.11 1.08 菌剂+生物促生剂+曝气组 2.35 2.08 0.75 1.85 1.09 1.08 -
[1] 徐敏, 姚瑞华, 宋玲玲, 等. 我国城市水体黑臭治理的基本思路研究[J]. 中国环境管理, 2015(2): 74-78. doi: 10.3969/j.issn.1674-6252.2015.02.016 [2] SHENG Y, QU Y, DING C, et al. A combined application of different engineering and biological techniques to remediate a heavily polluted river[J]. Ecological Engineering, 2013, 57: 1-7. [3] PUPOV D, MIROPOLSKAYA N, SEVOSTYANOVA A, et al. Current bioremediation practice and perspective[J]. Journal of Bioscience and Bioengineering, 2001, 92(1): 1-8. doi: 10.1016/S1389-1723(01)80190-0 [4] 杨兆华, 何连生, 姜登岭, 等. 黑臭水体曝气净化技术研究进展[J]. 水处理技术, 2017, 43(10): 54-58. [5] 张宗阳, 李捍东, 马兴华, 等. 优势复合菌剂处理黑臭河水的实验研究[J]. 环境科学与技术, 2010, 33(12): 58-61. [6] 胡湛波, 刘成, 周权能, 等. 曝气对生物促生剂修复城市黑臭河道水体的影响[J]. 环境工程学报, 2012, 6(12): 29-36. [7] BORISOVER M, LAOR Y, SAADI I, et al. Tracing organic footprints from industrial effluent discharge in recalcitrant riverine chromophoric dissolved organic matter[J]. Water, Air & Soil Pollution, 2011, 222(1): 255-269. [8] PELEATO N M, LEGGE R L, ANDREWS R C. Investigation of fluorescence methods for rapid detection of municipal wastewater impact on drinking water sources[J]. Spectrochimica Acta (Part A Molecular and Biomolecular Spectroscopy), 2017, 171: 104-111. doi: 10.1016/j.saa.2016.07.031 [9] SGROI M, ROCCARO P, KORSHIN G V, et al. Use of fluorescence EEM to monitor the removal of emerging contaminants in full scale wastewater treatment plants[J]. Journal of Hazardous Materials, 2016, 323: 367-376. [10] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science and Technology, 2015, 37(24): 5701-5710. [11] WANG Y, HU Y, YANG C, et al. Variations of DOM quantity and compositions along WWTPs-river-lake continuum: Implications for watershed environmental management[J]. Chemosphere, 2018, 218: 468-476. [12] GUO L, LU M, LI Q, et al. Three-dimensional fluorescence excitation-emission matrix (EEM) spectroscopy with regional integration analysis for assessing waste sludge hydrolysis treated with multi-enzyme and thermophilic bacteria[J]. Bioresource Technology, 2014, 171: 22-28. doi: 10.1016/j.biortech.2014.08.025 [13] ZHENG B, ZHANG Q, ZHANG Y, et al. Heterogeneous chemistry: A mechanism missing in current models to explain secondary inorganic aerosol formation during the January 2013 haze episode in north China[J]. Atmospheric Chemistry and Physics, 2015, 14(15): 2031-2049. [14] 纪晓娜, 刘晶, 左妍, 等. RP-HPLC和麝香草酚法检测硝酸盐氮的比较[J]. 长春工程学院学报(自然科学版), 2014, 15(1): 1-4. doi: 10.3969/j.issn.1009-8984.2014.01.001 [15] 柳玲, 高晓庆, 苗振华, 等. 离子色谱法与分光光度法测定水中亚硝酸盐含量的对比[J]. 中国给水排水, 2016, 32(2): 93-96. [16] HE X S, XI B D, WEI Z M, et al. Fluorescence excitation-emission matrix spectroscopy with regional integration analysis for characterizing composition and transformation of dissolved organic matter in landfill leachates[J]. Journal of Hazardous Materials, 2011, 190(1): 293-299. [17] XUAN W, LEUNG D Y C. Optimization of biodiesel production from camelina oil using orthogonal experiment[J]. Applied Energy, 2011, 88(11): 3615-3624. doi: 10.1016/j.apenergy.2011.04.041 [18] OU H S, WEI C H, DENG Y, et al. Principal component analysis to assess the composition and fate of impurities in a large river-embedded reservoir: Qingcaosha reservoir[J]. Environmental Science Processes and Impacts, 2013, 15(8): 1613-1621. doi: 10.1039/c3em00154g [19] 李晓洁, 高红杰, 郭冀峰, 等. 三维荧光与平行因子研究黑臭河流DOM[J]. 中国环境科学, 2018, 38(1): 311-319. doi: 10.3969/j.issn.1000-6923.2018.01.035 [20] MCKNIGHT D M, BOYER E W, WESTERHOFF P K, et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 2001, 46(1): 38-48. doi: 10.4319/lo.2001.46.1.0038 [21] OHNO T, FERNANDEZ I J, HIRADATE S, et al. Effects of soil acidification and forest type on water soluble soil organic matter properties[J]. Geoderma, 2007, 140(1): 176-187. [22] HUGUET A, VACHER L, RELEXANS S, et al. Properties of fluorescent dissolved organic matter in the gironde estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719. doi: 10.1016/j.orggeochem.2009.03.002 [23] WOLFE A P, KAUSHAL S S, FULTON J R, et al. Spectrofluorescence of sediment humic substances and historical changes of lacustrine organic matter provenance in response to atmospheric nutrient enrichment[J]. Environmental Science and Technology, 2002, 36(15): 3217-3223. doi: 10.1021/es011215r [24] ZSOLNAY A, BAIGAR E, JIMENEZ M, et al. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying[J]. Chemosphere, 1999, 38(1): 45-50. doi: 10.1016/S0045-6535(98)00166-0 [25] 黄廷林, 方开凯, 张春华, 等. 荧光光谱结合平行因子分析研究夏季周村水库溶解性有机物的分布与来源[J]. 环境科学, 2016, 37(9): 3394-3401. [26] BAKER A, CURRY M. Fluorescence of leachates from three contrasting landfills[J]. Water Research, 2004, 38(10): 2605-2613. doi: 10.1016/j.watres.2004.02.027 -



 下载:
下载: