-
随着排放法规的加严,后处理系统的系统集成是满足国六排放标准的必然要求,柴油车后处理主流技术路线为DOC(氧化型催化转化器)+DPF(柴油颗粒捕集器)+SCR(选择性催化还原转化器)+ASC(氨逃逸催化器)。其中,SCR技术是控制柴油机尾气中NOx排放最有效的技术之一,现已商业化用于移动污染源排放控制[1],催化剂是SCR技术的核心。CHA型小孔分子筛(SSZ-13、和SAPO-34)催化剂具备良好的NH3-SCR催化活性和抗水热老化能力,是满足国六阶段柴油车排放标准的必然选择[2-5],缺点是成本偏高,制备工艺复杂。ZSM-5分子筛价格低廉、制备工艺成熟、NH3-SCR效率较高,具有对CHA型分子筛催化剂进行低成本取代的潜力,一直是国内外研究的热点[6-8]。在NH3-SCR反应中,Cu/ZSM-5分子筛催化剂具有良好的NOx转化率和N2选择性,但其在700 ℃以上的高温水热条件下极易劣化[9-11]。在国六阶段,DPF在运行过程中须周期性地反复再生,再生过程中排气温度可达到700 ℃以上,加之尿素水解引入的大量水蒸气,严重制约了铜基ZSM-5分子筛催化剂的实际应用。
许多研究者[12-14]对ZSM-5分子筛的水热老化性能进行了研究。SHI等[15]发现,Fe-H-ZSM-5在新鲜时和在750 ℃、5%H2O水热老化后的NH3-SCR活性高于Fe-Na-ZSM-5,是由于Fe-H-ZSM-5和Fe-Na-ZSM-5的Fe种类分布和酸度不同。宋守强等[16]研究了磷改性的ZSM-5分子筛在甲醇制丙烯(MTP)反应中的水热稳定性,发现高硅铝比会明显加剧磷氧化物的迁移、缩合及与骨架铝的配位成键作用,提高其水热稳定性。DING等[17]合成了多级孔ZSM-5分子筛,发现通过引入介孔和磷改性均可提高ZSM-5的稳定性。
解决Cu/ZSM-5催化剂水热老化问题的关键在于探明催化剂在水热老化条件下的NH3-SCR失活机理。目前,对其失活机理尚无明确的认识,普遍被接受的水热老化失活机理主要包括Cu/ZSM-5催化剂的Brønsted酸位减少和活性中心数目损失机理[18]。尽管已有对ZSM-5水热老化后Brønsted酸减少和活性中心损失机理的研究,但仍无法系统解释不同水热条件下Cu/ZSM-5催化剂的失活现象。本研究针对水热老化过程中不同温度、H2O(g)含量处理后的Cu/ZSM-5催化剂,通过对老化前后的催化剂物理化学结构表征,对催化剂失活的构效关系进行了研究。
-
通过浸渍法制备Cu/ZSM-5催化剂,CuO的质量分数为3%。利用硝酸铜(Cu(NO3)2)制备前驱体溶液,将商业ZSM-5分子筛(Si/Al为25)加入前驱体溶液中,在110 ℃下水浴搅拌至蒸干,然后将样品120 ℃干燥10 h,550 ℃焙烧5 h,得到粉末样催化剂。将催化剂粉末压片并用40~60目筛网过筛,得到催化剂样品,标记为CZ5。
快速水热老化是评估催化剂高温水热稳定性的手段之一,老化条件:H2O(g)浓度为5%~15%,以N2作为H2O(g)载气,空气作为平衡气,老化温度为600~800 ℃,老化时间为12 h,将老化后的催化剂样品标记为CZ5-X-Y,其中X代表温度,Y代表H2O(g)含量。
-
样品的NH3-SCR催化活性和N2选择性评价在立式固定床石英反应器中进行。模拟反应气体组成如下:φ(NO)=0.05%、φ(NH3)=0.05%、φ(O2)=5%、N2作为平衡气、总流量为1 000 mL·min−1、空速30 000 h−1。通过FT-IR光谱仪(Thermo IS10,美国)分析NO、NO2、N2O和NH3的浓度。催化剂NO转化率和N2选择性[19-20]按式(1)和式(2)计算。
式中:RNO为NO转化率;φ(M)in为M气体的进口浓度;φ(N)out为N气体的出口浓度;S为N2选择性。
-
采用比表面积分析仪(Autosorb AS-1,美国)测定老化前后催化剂的比表面积和孔结构;采用X射线衍射仪(D/MAX-RB,日本)测试催化剂的晶体结构;采用化学吸附仪(ChemiSorb 2720,美国)评价催化剂的氧化还原性;采用扫描电子显微镜(XL-30-ESEM,瑞士)测试新鲜和水热老化催化剂的粒度和形貌;采用X射线光电子能谱分析(ESCALab 220i-XL,美国)测试催化剂表面元素价态。
-
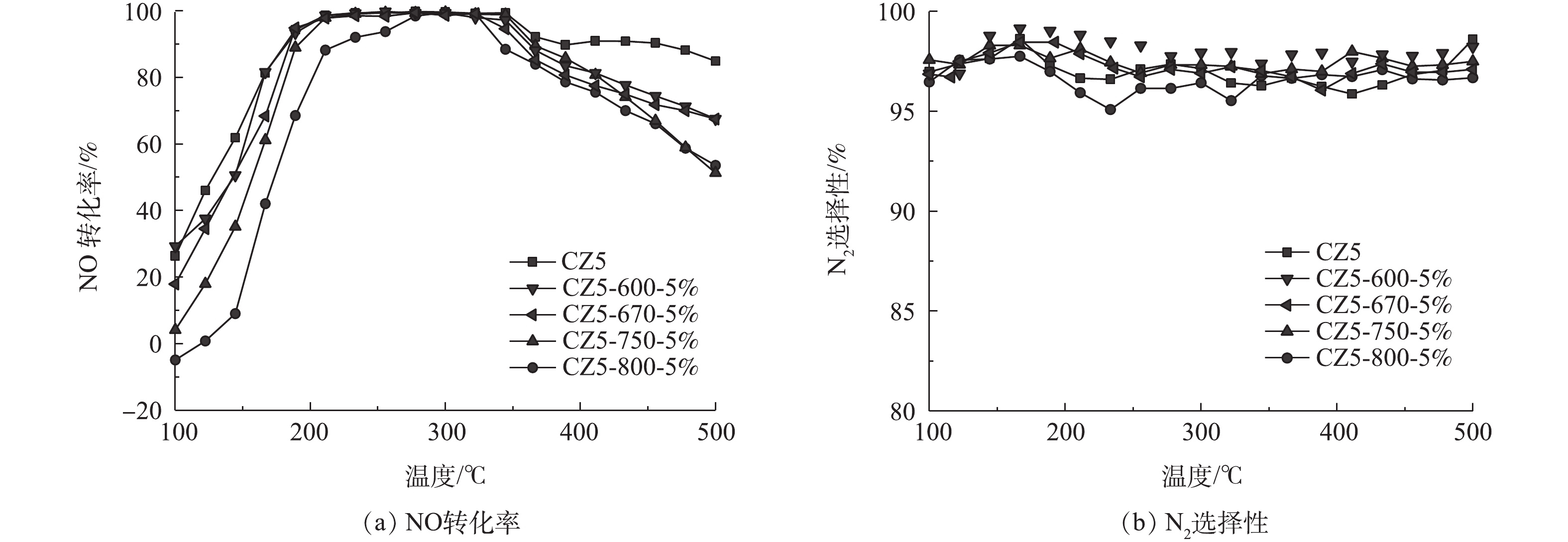
图1(a)为不同温度老化条件下,各Cu/ZSM-5催化剂的NO转化率和N2选择性,老化条件如表1所示。从图1(a)中可以看出,不同温度(5%H2O)水热处理后,CZ5催化剂的NO转化率均有所降低,低温条件下(T<250 ℃),催化剂NO转化率显著降低;在高于400 ℃时,催化剂的NO转化率也略有下降。在CZ5-600-5%催化剂上NO起燃温度(NO转化率为50%)为151 ℃,温度窗口(NO转化率大于80%)为175~429 ℃。当老化温度提高至800 ℃,CZ5-800-5%催化剂上NO起燃温度为187 ℃,温度窗口为226~375 ℃。随着水热处理温度的升高,Cu/ZSM-5的NO转化率明显降低。不同老化条件的催化剂的N2选择性如图1(b)所示,不同温度(5%H2O)水热处理后的各CZ5催化剂表现出相近的变化规律,但随着老化温度的提高,N2选择性未表现出良好的规律性,且选择性均在95%以上,变化幅度较小。
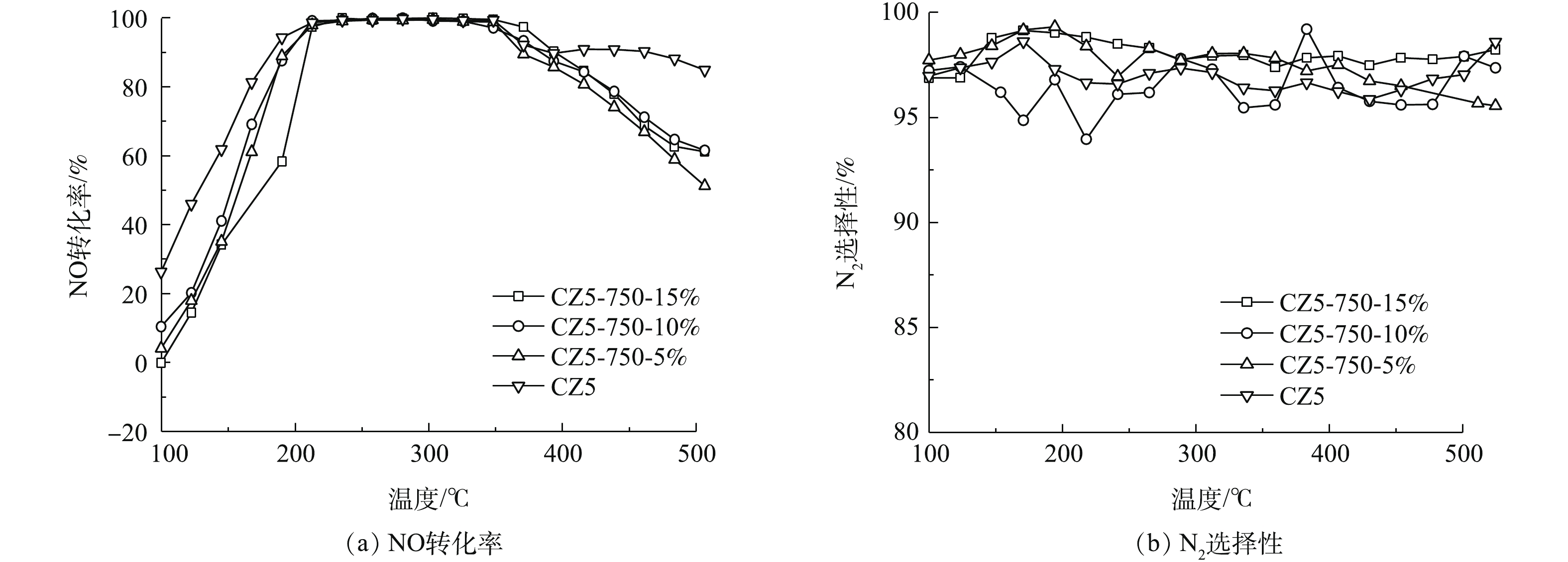
图2(a)为不同H2O(g)含量(750 ℃)条件下,各Cu/ZSM-5催化剂上NO转化率和N2选择性,老化条件如表1所示。从图2(a)中可以看出,经过750 ℃,不同浓度H2O(g)条件老化后的各催化剂上NO起燃温度均向高温方向移动。CZ5-750-5%、CZ5-750-10%和CZ5-750-15%催化剂上NO起燃温度分别为160、167和181 ℃,窗口温度分别为195~450、190~450和230~461 ℃,与新鲜催化剂相比,催化剂性能均出现不同程度的劣化。随着H2O(g)浓度的增加,各Cu/ZSM-5催化剂上NO转化率表现出不同规律,在H2O(g)含量分别为5%和10%时,催化剂性能差异不大,与CZ5-750-5%相比,CZ5-750-10%样品上NO起燃温度提高幅度仅为5 ℃,温度窗口几乎没有变化;当水含量为15%时,CZ5-750-15%催化剂性能出现明显劣化,NO起燃温度提高至181 ℃,温度窗口明显向高温方向移动。N2选择性如图2(b)所示,不同催化剂的N2选择性同样未表现出良好的规律性。
催化剂水热老化的主要变量是温度和H2O(g)含量。提高H2O(g)含量对催化剂SCR活性的影响小于提高老化温度对催化剂NH3-SCR活性的影响。
-
1)水热老化对Cu/ZSM-5催化剂孔结构的影响。不同温度和不同H2O(g)含量老化后各催化剂的BET结果如表1所示。从表1中可以看出,老化后样品的比表面积整体呈现下降趋势。CZ5-600-5%、CZ5-670-5%和CZ5-750-5%催化剂的比表面积(SBET)分别为298、286和285 m2·g−1,催化剂比表面积没有表现出明显变化。当水热老化温度达到800 ℃时,CZ5-800-5%催化剂的SBET大幅减小为256 m2·g−1,与600 ℃老化样品相比,下降幅度达14%。而H2O(g)含量的提高对比表面积的影响不大,比表面积呈略下降趋势。老化温度的提高和H2O(g)含量的增加都会导致催化剂的比表面积下降,但温度的升高(特别是800 ℃以上的高温)对催化剂比表面积的影响更大,这是由于高温会导致催化剂活性组分聚集或载体结构坍塌,导致比表面积急剧下降,温度可能是影响催化剂比表面积变化的主要原因。
CZ5催化剂的孔容为0.095 1 cm3·g−1,随着水热老化温度的提高孔容逐渐增加,当水热处理温度达到750 ℃和800 ℃时,孔容分别为0.211 4 cm3·g−1和0.476 5 cm3·g−1,水热老化温度越高,催化剂孔容增加越快。因此,随着水热老化温度的升高,Cu/ZSM-5催化剂的结构逐渐被破坏,孔容变大,孔径提高,特别是在老化温度高于750 ℃后,ZSM-5孔道坍塌,这和催化剂比表面积减少结果相一致。但水热处理过程中H2O(g)浓度的增加对催化剂孔容孔径的影响很小。
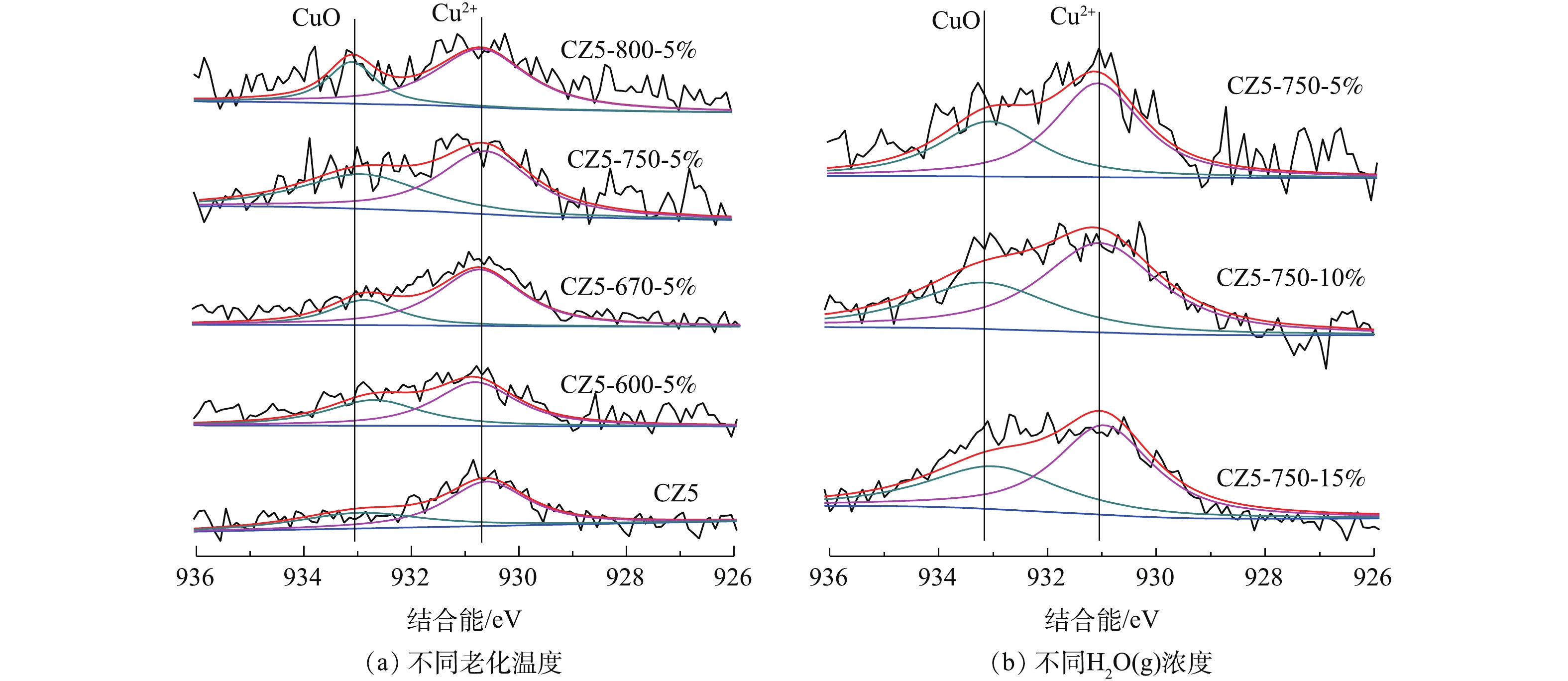
2)水热老化对Cu/ZSM-5晶体结构的影响。新鲜和水热老化后的Cu/ZSM-5催化剂的XRD图谱如图3所示,从图3(a)和图3(c)中可以看出,水热老化前后各Cu/ZSM-5催化剂样品均具有典型的MFI结构衍射峰,且衍射峰尖锐,具有良好的结晶度[15],这表明水热老化后各催化剂保持了完整的ZSM-5晶相结构。随着水热老化温度的升高,特征峰的强度降低,这表明ZSM-5的结晶度降低。同时,在所有XRD图谱中均未显示CuO的衍射峰,这表明活性组分CuO在催化剂表面得到了良好的分散。
将衍射峰放大后,如图3(b)所示,随着老化温度的升高,衍射峰均不同程度地向高衍射角移动。与新鲜催化剂相比,CZ5-750-5%、CZ5-750-10%和CZ5-750-15%催化剂的衍射峰由于晶粒高温聚集向高衍射角移动,而在图3(d)中H2O(g)含量的增加不会改变衍射峰位置。由布拉格方程(见式(3))可以看出,当n和λ不变时,晶面间距d会变小,θ增加。高温会导致催化剂晶体团聚,晶面间距d减小,衍射峰向高衍射角移动。综上所述,水热老化温度对ZSM-5结构的影响大于水蒸汽浓度变化的影响。
式中:d为晶面间距;θ为入射光线、反射线和反射晶面之间的角度;λ为波长,n为反射次数。
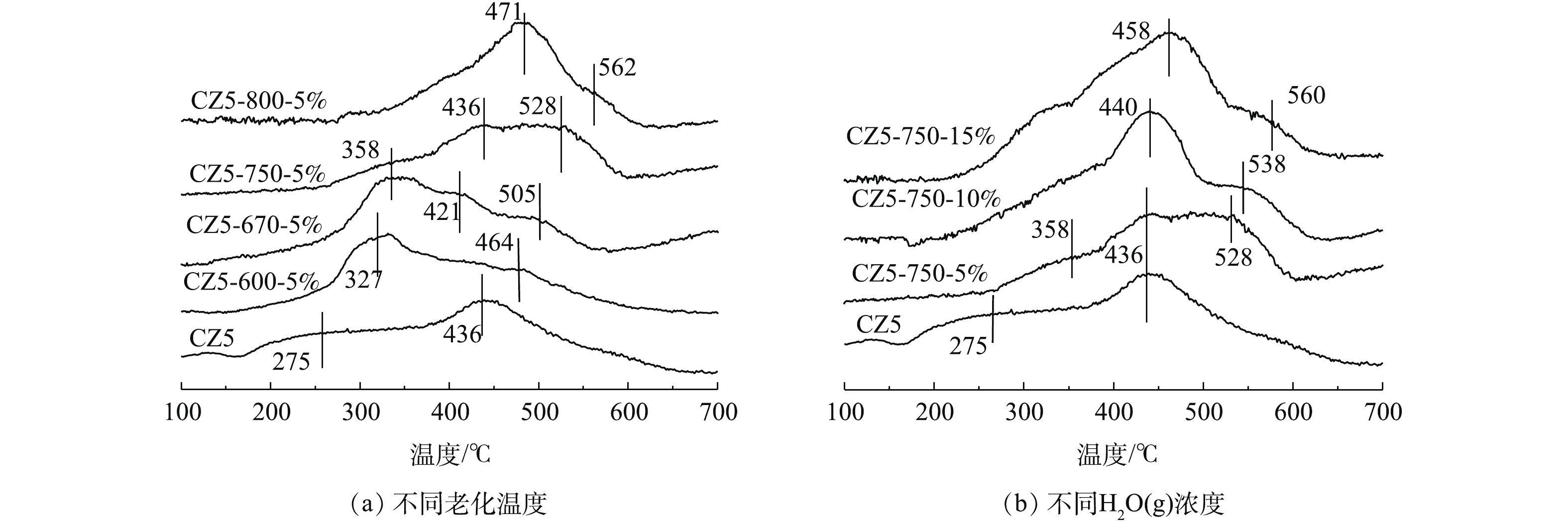
3)水热老化对Cu/ZSM-5催化剂氧化还原性的影响。H2消耗信号与催化剂表面的铜活性物种的氧化还原现象有关,新鲜和水热老化各Cu/ZSM-5催化剂上H2-TPR如图4(a)和图4(b)所示。结果表明,各Cu/ZSM-5催化剂样品均能检测到至少2个还原峰。低温峰(200~400 ℃)归因于Cu2+还原为Cu+[21-24],而高温峰(430~570 ℃)归因于氧化铜还原[25-27],而Cu+还原的峰一般出现在600 ℃以后。CZ5-670和CZ5-750在400~450 ℃的肩峰归因于氧化铜微晶的还原[28]。
CZ5催化剂在275 ℃和436 ℃分别出现2个还原峰。对比发现,随着老化温度的提高,上述2个还原峰均向高温方向移动,这说明催化剂的还原性降低,这也是水热老化后各Cu/ZSM-5催化剂活性降低的原因之一。CZ5-670-5%和CZ5-750-5%催化剂在温度400~450 ℃出现的肩峰归属于氧化铜微晶的还原峰[29]。对比各催化剂发现,CZ5-670-5%样品中421 ℃和505 ℃的2个还原峰随着老化温度的提高还原峰温度逐渐向高温方向移动,进而CZ5-800-5%样品中在471 ℃形成一个典型的还原峰。上述结果表明,随着老化温度的升高,ZSM-5分子筛笼中的活性铜离子逐渐转变成铜微晶并最终变成铜氧化物,这可能也是催化剂氧化还原性降低的原因,随之催化剂活性出现明显下降。
750 ℃不同H2O(g)含量条件下,水热老化各Cu/ZSM-5催化剂的H2-TPR结果如图4(b)所示。与CZ5-750-5%对比,随着H2O(g)含量的增加,低温峰(<350 ℃)位置基本不变,且强度很低,随着H2O(g)的增加,436 ℃位置的峰面积逐渐增大。结果表明,随着H2O(g)含量的增加,部分Cu2+和水结合,形成更多的氧化铜微晶。总之,水热老化增加水蒸汽含量对催化剂的还原性能影响要小于老化温度的影响。这和两者对催化剂活性的影响规律保持一致。
4)水热老化对Cu/ZSM-5催化剂表面形貌的影响。不同温度水热老化前后各Cu/ZSM-5催化剂形貌如图5所示。在800 ℃水热老化后,CZ5-800-5%催化剂可以观察到颗粒团聚,而随着H2O(g)的增加,未能观察到明显的团聚现象。新鲜催化剂具有尖锐的边缘,经600 ℃水热老化后,CZ5-600-5%催化剂颗粒略微破碎成小块,直径约为1~10 μm。随着老化温度的进一步升高,这种现象变得更为明显。在750 ℃和800 ℃水热老化后,CZ5-750-5%和CZ5-800-5%催化剂颗粒的小块重新团聚成大颗粒,这与BET结果中比表面积大幅降低相一致。水热老化过程中随着H2O(g)含量的增加未观察到明显的团聚现象发生。水热老化过程中温度的提高对催化剂表面形貌的影响较为显著。
5)水热老化对Cu/ZSM-5催化剂表面元素价态的影响。水热老化前后各Cu/ZSM-5催化剂XPS能谱如图6(a)和图6(b)所示。Cu2p3/2的峰位于930~934 eV,位于933.1 eV附近的峰归属于Cu2+[30-31],图6中并没有观察到Cu+的信号峰,这可能是由于催化剂表面Cu+含量较低或XPS灵敏度较低[32]。Cu2p3/2信号可以拟合为2个峰,峰I (930~931 eV)和峰II (932~934 eV)分别为不同的Cu2+化学态。其中,前者归属于CuO活性物种信号峰;后者归属于与分子筛的表面氧原子配位的Cu2+离子[33]信号峰。水热老化前后各Cu/ZSM-5催化剂均可观察到峰I和峰II,不同温度下,5%H2O水热老化催化剂对应的峰I强度基本保持不变,随着水热老化温度的升高,峰II的强度明显下降,这表明与分子筛的表面氧原子配位的Cu2+转化为CuO微晶或者CuO物质,这与H2-TPR结果一致。另一方面,750 ℃不同H2O(g)含量水热处理各催化剂XPS结果变化不大,峰II强度略有升高,这说明水热老化过程中,H2O(g)含量的变化不是影响Cu2+变化的主因,H2O(g)含量小于老化温度对催化剂中Cu2+变化的影响。
-
1)随着水热老化温度的升高,Cu/ZSM-5催化剂的NH3-SCR活性显著下降,比表面积减小,孔容增大,催化剂发生团聚现象,催化剂的表面氧原子配位的Cu2+转化为CuO微晶或者CuO物质,活性Cu2+离子减少,导致催化剂低温活性下降。水热老化温度是影响催化剂NH3-SCR性能变化的主因。
2)随着水热老化H2O(g)含量的升高,Cu/ZSM-5催化剂上NH3-SCR性能无明显劣化,当H2O(g)含量增加至15%时,催化剂低温活性显著下降,H2O(g)含量的增加对Cu/ZSM-5催化剂结构没有显著的影响;水热老化后SCR的低温性能(<300 ℃)的下降主要是由于老化温度提高所致。
3)对Cu/ZSM-5催化剂,优化催化剂的抗高温能力是提高其水热稳定性的最直接有效的方式。提高ZSM-5分子筛结构稳定性或减少催化剂活性Cu2+迁移可能是优化Cu/ZSM-5的抗水热能力的有效途径。
水热老化条件对Cu/ZSM-5催化剂NH3-SCR反应的影响
Effect of hydrothermal aging conditions on NH3-SCR reaction of Cu/ZSM-5 catalysts
-
摘要: 针对Cu/ZSM-5高温水热失活的问题,通过浸渍法合成了Cu/ZSM-5催化剂,并对该催化剂进行了不同温度和不同H2O(g)含量的水热老化。采用比表面积分析、SEM观察、X射线衍射分析、H2-程序升温还原、X射线光电子能谱分析对Cu/ZSM-5催化剂的理化性能进行了表征。分别研究了不同水热老化条件下Cu/ZSM-5催化剂的NH3-SCR性能和水热失活机理。结果表明,经水热处理后,各Cu/ZSM-5催化剂的NH3-SCR性能均有所降低。随着老化温度的提高,催化剂的分子筛载体出现结构坍塌,比表面积减小,孔容积增大,但仍保持MFI结构,老化温度的提高同样使催化剂活性Cu2+减少并一部分转化为CuO微晶,而H2O(g)含量的变化对催化剂的物理化学结构的影响较小。在高温水热老化过程中,温度对催化性能劣化的影响大于水蒸汽含量,是催化剂失活的主要原因。Abstract: Aiming at the hydrothermal deactivation of Cu/ZSM-5 catalysts under high temperature, they were synthesized by impregnation method and then the hydrothermal aging treatment of these catalysts were carried out under different temperatures and water vapor contents. The physicochemical properties of the catalysts were characterized by BET, SEM, XRD, H2-TPR and XPS. The NH3-SCR performance and hydrothermal deactivation mechanism of the Cu/ZSM-5 catalysts under different hydrothermal aging conditions were studied. The results showed that the NH3-SCR performance of each Cu/ZSM-5 catalyst was reduced after hydrothermal treatment. With the increase of temperature of hydrothermal aging, the zeolite supports of Cu/ZSM-5 collapsed, the specific surface area decreased and the pore volume increased while the MFI structure of Cu/ZSM-5 remained unchanged, even the isolated active Cu2+ in it decreased and partly transformed to CuO microcrystal. However, the change in water vapor content had slight effect on the physicochemical structure of the catalyst. High temperature hydrothermal deactivation study found that the effect of temperature on catalytic performance degradation was greater than that of water vapor contents. High temperature was the main reason for catalyst deactivation.
-
Key words:
- molecular sieve ofzeolites /
- NH3-SCR /
- ZSM-5 /
- hydrothermal stability
-
在废水生物处理系统中,微生物是污染物降解的主体。一般而言,活性污泥处理系统中微生物生长繁殖需要的营养物质含量具有一个经验比例,即化学需氧量∶氮∶磷(COD∶N∶P)为100∶5∶1。当处理废水中营养物质含量达不到该比例时,如耗氧有机污染物(以COD计)浓度过低,或者氮、磷浓度比例过低,则该废水被称为贫营养废水。在贫营养水质条件下,系统营养物质比例失调,生物系统中活性污泥微生物由于缺乏某类营养物质而活性降低,甚至大量死亡,导致处理系统失效。WANG等[1]发现,在脱氮除磷系统中,当有机物浓度过低时,微生物细胞内合成和贮存的PHA不足,系统的脱氮除磷效率将大幅降低。PENG等[2]的研究表明,进水底物中缺乏氮或磷会刺激活性污泥中丝状菌的增殖,从而发生丝状污泥膨胀而使系统处理性能降低。为解决贫营养废水处理效率低的难题,目前大多数污水处理厂通常采用投加有机物或氮磷等营养物质的方式调整系统进水营养比例,以满足活性污泥微生物生长需求,保证系统稳定运行。
近年来,随着微生物测序技术的飞速发展,基于16SrRNA高通量测序技术的微生物检测被广泛应用于污水处理厂活性污泥微生物群落结构的分析中,大大提高了人们对污泥微生物群落及其功能的了解。目前,对污水处理系统内主要微生物群落的研究已有大量报道。JIN等[3]的研究表明,在门水平上,活性污泥中的细菌主要集中在变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)4种。ZHANG等[4]对滁州市污水处理系统5个活性污泥微生物群落结构的研究中发现,在所有活性污泥样品中,除了上述4种菌门,绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)也是优势菌。在这些优势菌门中,变形菌门(Proteobacteria)是活性污泥系统中最常见的原生门类,也是传统废水生物处理过程中的关键细菌群[5]。有研究[6]表明,该菌门与污水生物处理过程中的有机物降解和脱氮除磷密切相关,而隶属于该门的Zoogloea属是构成活性污泥菌胶团的重要组成菌属,在多种有机物的降解过程中发挥着重要作用[7]。拟杆菌门(Bacteroidetes)是异养微生物的另一类重要门类,能参与有机碳和蛋白类物质的循环[8]。该门同时也是厌氧消化过程中常见的产酸菌[9],其部分菌属能降解长链脂肪酸,并可水解发酵多糖类有机化合物[10-11]。有研究[12-13]表明,拟杆菌门中的拟杆菌属(Bacteroidales)能够利用纤维素和多糖,并可将纤维素、二糖、葡萄糖和甘露糖等有机物降解为醋酸酯或琥珀酸。绿弯菌门(Chloroflexi)作为污水处理厂常见的菌群,具有较高的有机负荷承受能力[14],并且对糖类有较好的降解能力,可产生乙酸[15]。厚壁菌门(Firmicutes)广泛分布在厌氧环境中,包含梭菌纲(Clostridium)、芽孢杆菌纲(Bacillibacteria)等多种功能菌纲,其对有机物的水解和酸化有重要作用[16]。此外,酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)也是污水处理厂厌氧过程中重要的功能菌群,是厌氧消化过程中的主要产酸菌,起水解酸化作用[17-18]。以上这些污水处理厂常见主要菌群的研究结论,大多是基于普通的污水生物处理过程,即微生物生长所需营养物质能够得到满足的条件下得到的结果。然而,当污水处理系统中氮、磷等营养受限时,微生物群落的结构变化和种群分布规律还有待进一步研究。
云南省昆明市某制药厂废水处理系统中,进水耗氧有机污染物(以COD计)和悬浮物浓度高,而氮磷浓度极低,进水营养物质含量比例达不到常规微生物生长需求,COD∶N∶P仅为100∶0.4∶0.07。然而系统长期运行状况表明,在氮磷营养贫乏的条件下,该系统运行稳定,污水处理效果良好,出水水质均达到了国家《污水综合排放标准》(GB 8978-1996)的一级标准。为此,本研究对该贫营养废水处理系统中关键环节的污染物降解情况进行了监测,并对其活性污泥中微生物进行了高通量测序分析。本研究旨在从系统运行及污泥微生物的角度解释该制药厂贫营养废水处理系统长期稳定运行的原因,为营养不均衡的高浓度有机废水的处理及系统维护提供有益指导。
1. 工艺系统概况
1.1 水质水量概况
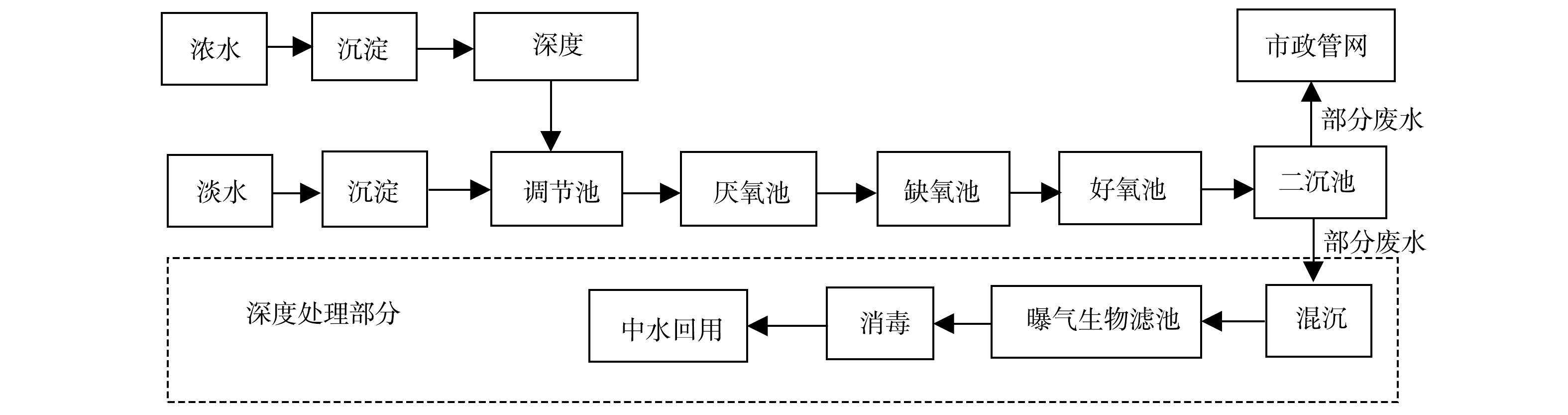
云南省昆明市某制药厂污水处理站总处理水量约为1 000 m3·d−1,进水分别来源于生产废水和生活污水。生产废水主要来自车间洗泡蒸煮药材、冲洗、制剂等生产过程,该废水的特点为:废水COD值高、波动范围较大,耗氧有机污染物(以COD计)质量浓度通常在1 000~2 000 mg·L−1波动;废水中氮磷等营养元素含量较低(TN<9 mg·L−1、TP<1 mg·L−1),加大了生物处理的难度。工艺好氧段曝气池MLSS为3 000~4 000 mg·L−1,MLVSS为1 500~2 000 mg·L−1,SVI为100~150 mL·g−1。废水经污水处理站处理后,部分废水排入市政管网,部分经过深度处理后作为该厂中水进行回用。
1.2 工艺流程
系统处理工艺为A2O工艺,厌氧过程采用IC工艺,好氧过程采用活性污泥完全混合处理工艺。为了适应不同的进水水质,在生化处理工艺的前端分别设置了2组预处理工艺。污染物浓度较高的生产废水(浓废水),首先经过沉淀作用去除水中部分悬浮物,再进入浓废厌氧池进行部分有机污染物的降解,而后流入调节池调节水质水量。经过这样预处理后,浓废水才能进入后续的主体生化系统进行处理;污染物浓度较低的生活污水(淡废水),经沉淀后直接流入调节池进行后续的生化处理。混合后的调节池出水从厌氧污泥池底部进入,与堆积在池子底部的污泥混合接触,经污泥中微生物对废水中的有机物进行充分降解后,出水自厌氧池上部出水口流入缺氧池进行反硝化脱氮。缺氧池出水继而流入好氧池,在大量好氧异养菌的作用下,有效地去除剩余有机污染物。好氧池出水经过二沉池泥水分离后,部分出水排入市政管网,剩下的部分废水经过混凝沉淀、曝气生物滤池、消毒等深度处理工艺处理后作为中水回用。系统详细工艺流程图如图1所示。
2. 实验与分析方法
2.1 分析项目及方法
分别取调节池和生化处理单元各反应池末端的出水进行水质检测。采用标准方法[19]对COD、氨氮、硝态氮、TN、TP、SS、SVI、MLSS、MLVSS等指标进行测定;DO、pH、水温等用雷磁多参数水质分析仪测定。
2.2 微生物群落结构及特征分析
在工艺系统运行过程中,分别收集厌氧池、曝气池的污泥微生物样品。采用CTAB或SDS方法对污泥样品的基因组DNA进行提取,提取样品总DNA后,根据全长引物序列合成带有Barcode的特异引物,进行PCR扩增并对其产物进行纯化、定量和均一化,形成测序文库(SMRT Bell),建好的文库先进行文库质检,质检合格的文库用PacBio Sequel进行上机测序。使用USEARCH(10.0版)在相似性97%(默认)的水平上对有效的标签序列进行聚类,默认以测序所有序列数的0.005%作为阈值过滤OTUs。以silva为参考数据库,使用朴素贝叶斯分类器对OTUs代表序列进行分类学注释,得到物种分类学信息,进而统计各个样品在门、纲、目、科、属和种水平上的群落组成。利用QIIME软件计算各样品在97%相似度水平下的ACE、Chao、Shannon及Simpson指数。将数据批量导入QIIME软件,对OTUs表进行组间差异性分析,生成不同分类水平上的物种丰度表,再利用R语言工具绘制成样品各分类学水平下的群落结构图。
3. 结果与讨论
3.1 系统长期运行状况分析
系统在近10年的运行过程中,处理效果稳定,出水有机污染物及氮、磷浓度低,达到国家《污水综合排放标准》(GB 8978-1996)和《污水排入城市下水道水质标准》(CJ 3082-1999)。其中,COD和BOD的去除率均高达90%以上;氮磷去除率也达到70%左右。表1显示了近期系统出水指标的具体监测结果。
表 1 中药废水处理系统出水指标监测结果Table 1. Status of the effluent from the Chinese medicine wastewater treatment system检测单元 pH 其他水质参数浓度/(mg·L−1) 溶解氧 SS COD BOD5 氨氮 TN TP 阴离子表面活性剂 调节池 9.05 1.01 47.00 1296.67 931.33 4.05 8.05 0.38 0.95 二沉池出水 7.46 3.67 13.00 81.33 12.67 0.47 2.33 0.12 0.03 去除率/% — — 72 94 99 88 71 68 97 3.2 系统各阶段处理状况分析
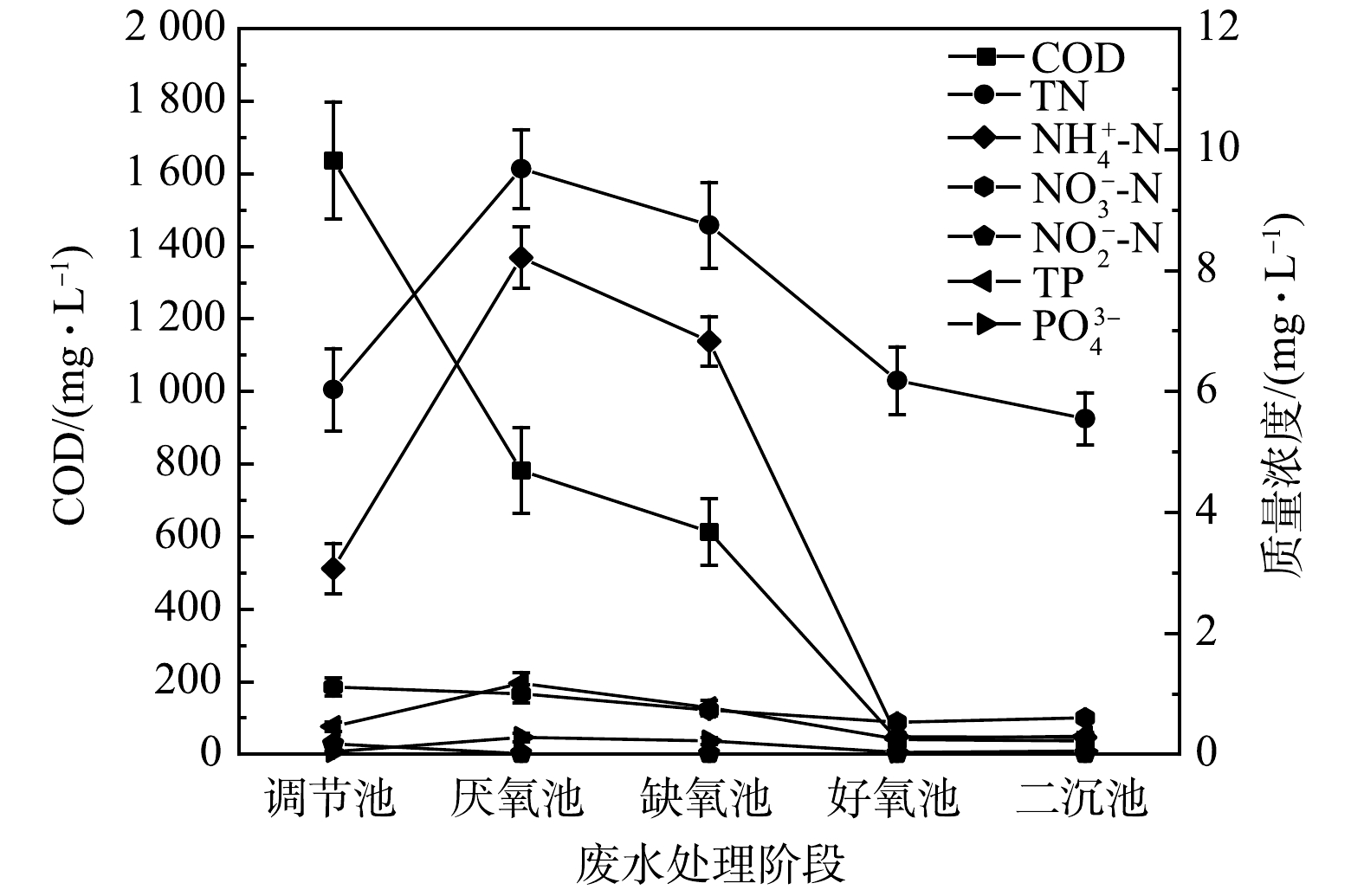
为探查系统在贫营养条件下各阶段的处理性能,本实验对系统进水及各反应器末端出水水质进行了取样检测。系统中各处理构筑物末端出水污染物平均浓度变化如图2所示。水质检测结果表明,贫营养水质并未对系统各处理阶段的处理性能产生明显影响;有机物在系统厌氧、缺氧和好氧过程中都得到了很好的降解,氮、磷在厌氧过程中略有积累,而在缺氧和好氧过程中得到很好的降解。厌氧池的COD去除率为52%左右,好氧池的COD去除率为93%,系统COD总去除率高达98%,这表明系统具有良好的有机物降解效果。TN和氨氮的降解主要在缺氧段和好氧段,缺氧段的去除率为9.61%和16.81%,好氧段为29.37%和95.75%。厌氧过程中氮磷浓度略有上升,这可能与其过长的SRT有关。有研究表明,厌氧条件下氮磷的释放受SRT影响[20],过长的SRT会导致氮磷的释放量增加[21]。本系统中厌氧池污泥长时间停留在反应器内,其SRT长达78 d左右,有可能导致其氮磷浓度增加。此外,有研究[22]表明,当活性污泥系统同时缺乏氮磷时,部分污泥将发生解体。因此,本研究中由于氮磷缺乏而导致的部分微生物死亡解体,从而释放氮磷,也可能是造成厌氧池氮磷浓度升高的原因。
3.3 贫营养条件下系统微生物群落分析
在污水生物处理系统中,微生物是污染物去除的主要执行者,系统中微生物的种类、数量及分布等状况,从根本上决定着系统处理性能及效果。为揭示贫营养水质条件对系统优势菌群的影响,本研究对该污水处理系统中的厌氧池和好氧曝气池的污泥样品进行了高通量测序,考察两生化反应池与正常营养水平废水处理系统中微生物群落的差异。
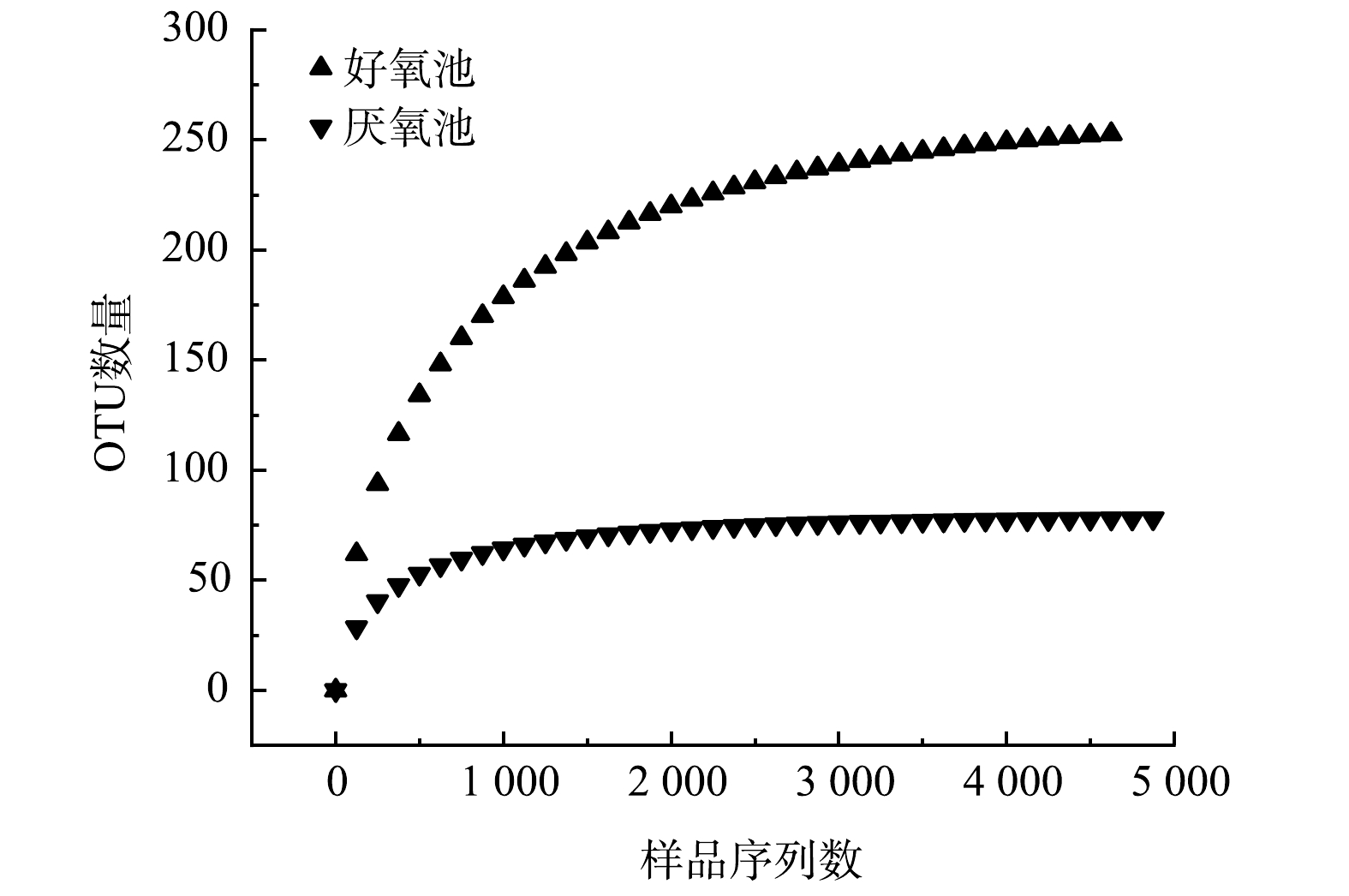
1)高通量测序数据结果表明,该系统中好氧池和厌氧池的有效序列数分别为4 625和4 875;在97%的相似度水平上对有效序列归类OTUs,好氧池和厌氧池的OUTs数量分别为253和78。好氧池的OUT数量较高,表明好氧池具有较多的微生物种类。好氧池的细菌群落具有19门、24纲、55目、62科、70属;厌氧池细菌群落具有18门、27纲、35目、44科、51属。
OUTs稀释曲线能够验证测序数据量是否足以反映样品中的物种多样性,并间接反映样品中物种的丰富程度。图3所示的OUTs稀释曲线反映了在持续抽样下系统新物种出现的速率。结果表明,在97%的相似度水平上,当好氧池、厌氧池的样品序列数分别在0~1 500和0~1 000时,曲线表现为急剧上升的趋势,表明群落中有大量物种被发现;而当样品序列数分别大于4 500和3 625后,曲线趋于平缓,表明此环境中的物种并不会随测序数量的增加而显著增多,基本达到饱和。该曲线说明该测序结果能够反映2生化池微生物群落的多样性。
Alpha多样性(Alpha diversity)反映的是单个样品的物种丰度及物种多样性,一般有多种衡量指标,如Chao、ACE、Shannon和Simpson。Chao和ACE指数用于衡量物种丰度即物种数量的多少;Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度(community evenness)的影响。在相同物种丰度的情况下,群落中各物种均匀度越大,群落多样性越高;Shannon和Simpson指数值越大,样品的物种多样性越高。厌氧池、好氧池所取污泥微生物样品的Alpha多样性分析结果如表2所示。
表 2 好氧池、厌氧池的微生物群落丰富度和多样性指数Table 2. Richness and diversity indexes of microbial community in the aerobic tank and anaerobic tank检测单元 OTUs Chao ACE Shannon Simpson 覆盖率/% 好氧池 253 259.2432 262.2059 6.4124 0.9751 99.53 厌氧池 78 78.3333 78.5846 3.9206 0.8622 99.96 由表2可知,好氧池的OTUs、Chao指数和ACE指数明显高于厌氧池,说明好氧池的细菌群落更加丰富。同时,好氧池的Shannon指数和Simpson指数也略高于厌氧池,表明好氧池比厌氧池具有更高的群落多样性。测序实验还统计了样品覆盖率(coverage指数),以鉴定测试结果是否代表样品微生物的真实情况。该指数越高,则样本中物种被测出的概率越高。2个反应池的样品覆盖率均大于0.99,说明测序结果能够反映样品微生物的真实情况。
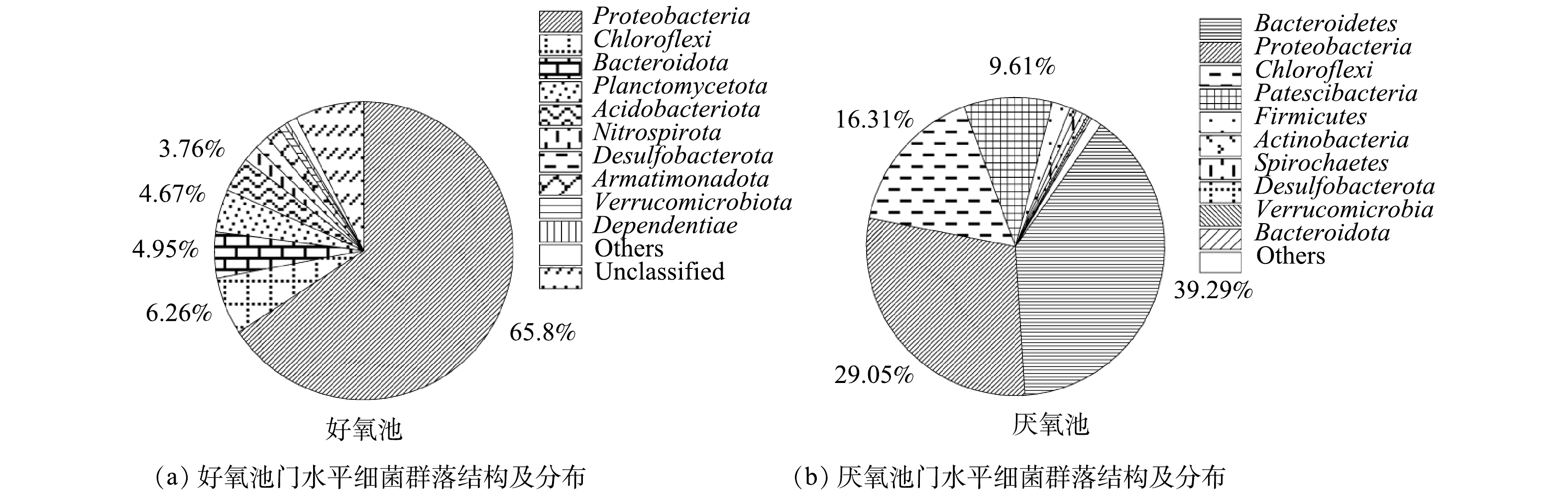
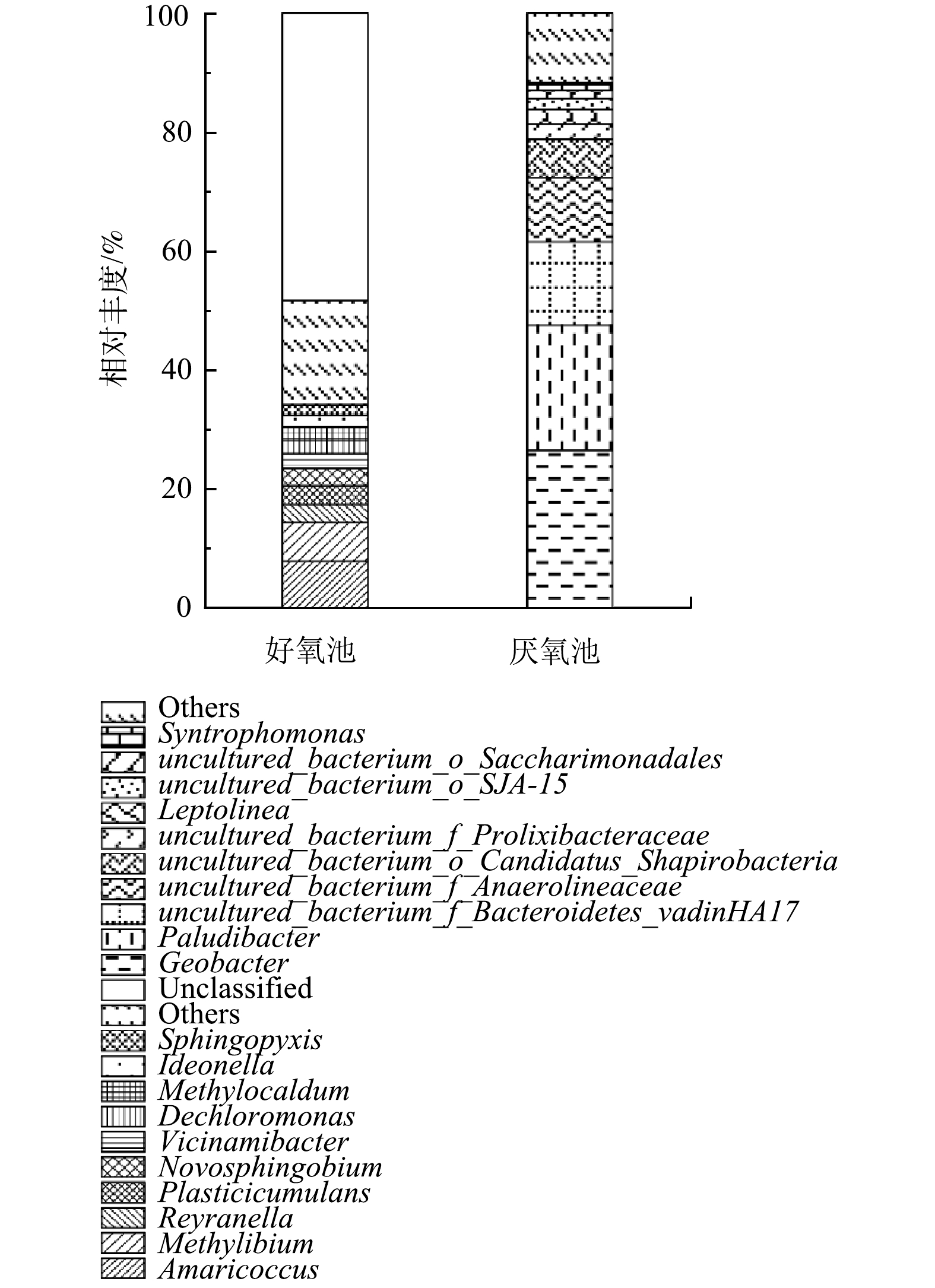
2)好氧池、厌氧池在门水平上的细菌群落分布如图4所示。从门水平上的差异可看出,好氧池的优势菌群为变形菌门(Proteobacteria,65.8%)、绿弯菌门(Chloroflexi,6.26%)、拟杆菌门(Bacteroidota,4.95%)、浮霉菌门(Planctomycetota,4.67%)以及酸杆菌门(Acidobacteriota,3.76%)。这些检测结果与WANG等[23]对中国14个污水处理系统细菌多样性的焦磷酸测序分析结果基本一致。在好氧池还检测到了硝化螺旋菌门(Nitrospirota),相对丰度占1.76%,表明好氧池具有良好的硝化作用。此外,脱硫杆菌门(Desulfobacterota)和Armatimonadota门分别占1.61%和1.57%。ANTUNES等[24]的研究表明,Armatimonadota门与废水中耗氧有机物(以COD计)、TOC、TDS和SS浓度呈显著的正相关。因此,系统中的高有机浓度有助于Armatimonadota门的生长。此外,在其他研究[3]中常发现占优势的厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),在本研究中的数量却较少,存在这一差异的原因有待进一步探究。
相比之下,厌氧池丰度最高的优势菌门是污水处理系统中常见的拟杆菌门(Bacteroidetes),占总群落的39.29%,其次是变形菌门(Proteobacteria,29.05%)和绿弯菌门(Chloroflexi,16.31%)。拟杆菌门在厌氧池中占主导地位,说明厌氧池中发生了良好的水解和酸化作用。另外,Patescibacteria门在厌氧池中占9.61%,厚壁菌门(Firmicutes)占1.98%。除Patescibacteria外,以上几种优势菌门与AHRING[25]所报道的厌氧系统中常见菌门一致。在以往的研究中,关于厌氧系统中Patescibacteria的研究报道还比较少。Patescibacteria门是新定义的超级门,其普遍存在于含水层环境中,如营养物质较少、DO浓度较低的地下水中[26]。由于这一门具有超小的细胞体积,使其具有较高的表容比,能最大限度地利用营养物质[27-28]。由此可推测,该门在本系统厌氧池中的分布与贫营养水体环境的选择作用存在一定的关联。
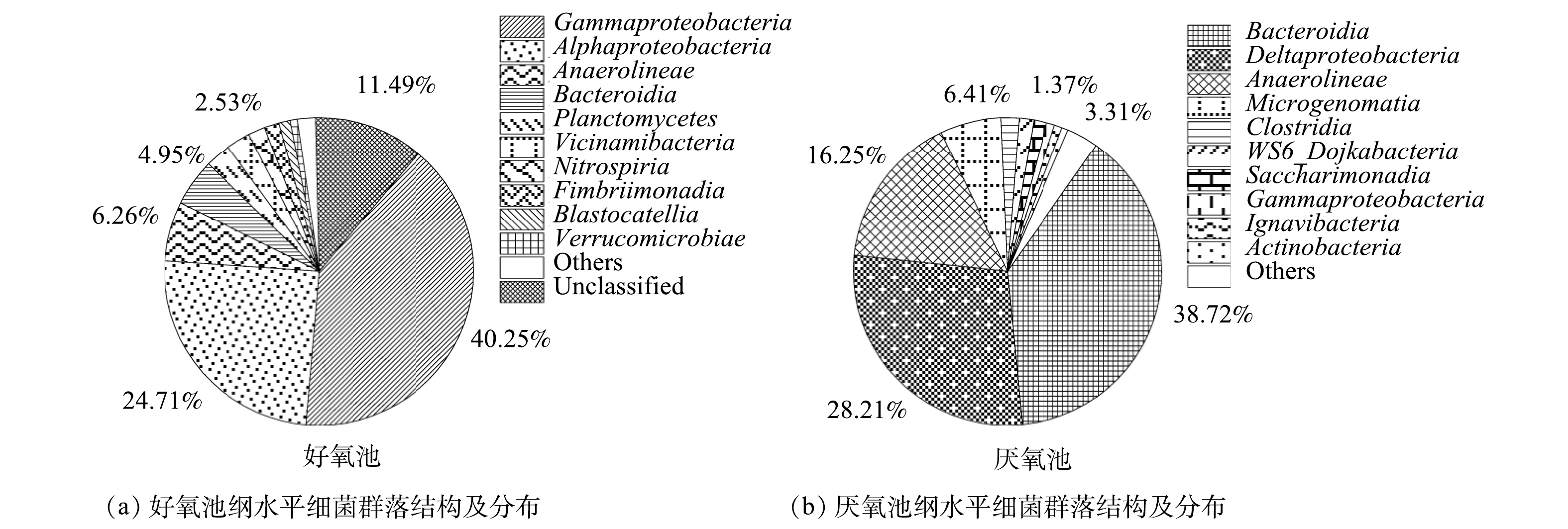
3)从2生化池细菌群落在纲水平上的分布来看(图5),好氧池的优势菌纲主要包括γ-变形菌纲(Gammaproteobacteria,40.25%)、α-变形菌纲(Alphaproteobacteria,24.71%)、厌氧绳菌纲(Anaerolineae,6.26%)、拟杆菌纲(Bacteroidia,4.95%)、浮霉菌纲(Planctomycetes,2.68%)以及Vicinamibacteria菌纲(2.53%)。此外,还发现了硝化螺旋菌纲(Nitrospiria,1.76%)以及不常见的Fimbriimonadia菌纲(1.55%)和Blastocatellia菌纲(1.19%)。与通常的研究结果不同[4],好氧池的优势菌纲中出现了厌氧绳菌纲(Anaerolineae),该菌纲是发酵分解糖类的厌氧细菌纲[29]。其能够在好氧池中富集的原因可能是Anaerolineae纲的一些菌种是半共营养型微生物[30],可与氢营养型产甲烷菌等细菌协同降解糖类[31]。另外,隶属于酸杆菌门(Acidobacteriota,3.76%)的Vicinamibacteria菌纲和Blastocatellia菌纲相对丰度之和为3.72%,表明二者是酸杆菌门的主要贡献者。Vicinamibacteria为好氧有机异养菌,能耐受广泛的pH范围,对不同的糖类、复杂的蛋白质化合物具有良好的代谢效果[32];而Blastocatellia菌纲的细菌偏好缺乏营养的生长条件[33],能够在干旱和营养限制的条件下生存[34]。Fimbriimonadia是一类严格需氧的非运动性杆状细菌,这类细菌大多生长在低营养介质中,绝大部分有机底物都不能作为碳源而被其利用[35]。
厌氧池的优势菌纲则主要为拟杆菌纲(Bacteroidia)、δ-变形菌纲(Deltaproteobacteria)以及厌氧绳菌纲(Anaerolineae),相对丰度分别为38.72%、28.21%和16.25%。其次,Microgenomatia菌纲占比为6.41%、梭状芽孢杆菌纲(Clostridia)为1.90%,最后是WS6_Dojkabacteria菌纲和Saccharimonadia菌纲,相对丰度分别为1.53%和1.37%。大多数厌氧绳菌纲(Anaerolineae)的物种都能进行发酵代谢,有助于在厌氧条件下糖类和蛋白质的降解,是厌氧系统中一个重要的发酵种群[15]。与AHRING[25]的研究结果不同,本系统的厌氧池中出现了2种不常见的菌群,即Microgenomatia和Saccharimonadia。Microgenomatia和Saccharimonadia均属于Patescibacteria门,他们不仅能够在厌氧条件下进行广泛的有机底物代谢,而且能够在营养物质匮乏的贫营养水体中生长[36]。Microgenomatia菌纲能水解发酵纤维素,Saccharimonadia菌纲中的一些菌属被发现有助于降解烃类物质[37-38]。
4)图6所示的百分比柱状堆积图反映了好氧池和厌氧池的微生物群落分别在属水平上的分布情况。微生物群落作为生物反应器的主体,决定了生物反应器的性能,而在一个污水生物处理过程中,微生物群落的形成又受当地气候条件、工艺类型和被处理废水的性质等因素的影响。本研究中,高有机物浓度、低氮磷的贫营养条件无疑是一个最重要的影响因素,此条件极有可能为系统中微生物的生长施加选择压。实际结果也表明,本系统的好氧池微生物菌属与常规的好氧活性污泥系统菌属有很大差别。在一般的生活污水处理厂中,活性污泥优势菌属主要为动胶菌属(Zoogloea)、不动杆菌属(Acinetobacter)、丛毛单胞菌属(Comamonas)和黄杆菌属(Flavobacterium)以及硝化螺旋菌属(Nitrospira)等[39];而在本研究中,好氧池的优势菌属包括Amaricoccus(8.03%)、Methylibium(6.50%)、Reyranella(3.1%)、Plasticicumulans(3.06%)、新鞘氨醇杆菌属(Novosphingobium,2.91%)、Vicinamibacter(2.46%)、脱氯单胞菌属(Dechloromonas,2.31%)、甲基暖菌属(Methylocaldum,2.17%)、Ideonella(1.97%)和Sphingopyxis(1.78%)。其中,丰度最高的属Amaricoccus是一种贫营养(氮、磷营养不足)增殖的好氧细菌,属于变形菌门(Proteobacteria),α-变形菌纲(Alphaproteobacteria),革兰氏阴性,能以多糖为底物降解多糖[40]。在氮、磷等营养元素受限制的情况下,他们能大量地储存胞内PHB,并合成胞外荚膜物质[41],因此,能在N、P受限制的条件下增殖[42]。Plasticicumulans属是专性好氧异养菌,能够利用多种有机化合物作为碳源和能源,如醋酸盐、乙醇和乳酸盐等[43]。该属能在超过85%的细胞干重中积累92%的PHB,并利用氨、硝酸盐和复合有机氮作为氮源[44]。通常认为,PHB是微生物在营养不均衡的条件下,如碳源过剩、而其他如氮、磷、硫等营养限制,积累在体内作为其营养和能量储存物质,并参与细胞代谢的天然产物[45]。Plasticicumulans积累PHB的性质使其得以在该系统的贫营养环境中生长。以上这些菌属在好氧池中占主导地位,表明在好氧池中出现了适应贫营养条件的优势菌属,这些菌属能够有效地降解含有大量生物难降解有机物并缺乏氮磷营养物质的中药废水,达到良好的去除效果,以此来保证系统稳定运行。
厌氧池的优势菌属主要集中在地杆菌属(Geobacter,26.62%)、帕卢迪杆菌属(Paludibacter,20.98%)、uncultured_bacterium_f_Bacteroidetes_vadinHA17(14%)、未培养的厌氧菌属(uncultured_bacterium_f_Anaerolineaceae,10.82%)等4种。此外,还发现了uncultured_bacterium_o_Candidatus_Shapirobacteria(6.41%)、uncultured_bacterium_f_Prolixibacteraceae(2.51%)和纤绳菌属(Leptolinea,2.49%)。最后是uncultured_bacterium_o_Saccharimonadales和互营单胞菌属(Syntrophomonas),相对丰度分别占1.37%和1.31%。
地杆菌属(Geobacter)在厌氧池丰度最高,占26.62%。地杆菌属(Geobacter)为变形菌门、δ-变形菌纲;革兰氏阴性、杆状、严格厌氧[46]。这类菌群显著的代谢特征是能将有机物的氧化与Fe(Ⅲ)的还原结合起来,在厌氧条件下以乙酸盐、芳香烃、有机氯化物等多种有机污染物作为电子供体和碳源,还原可溶性或不溶性的Fe(Ⅲ)[47-48]。地杆菌属(Geobacter)对生长环境的适应能力比较强,因而在被石油污染的含水层、被垃圾渗滤液污染的地下水、生活污水和各种废水等环境中均能发现其存在[49]。据以往的研究,地杆菌属(Geobacter)在参与厌氧消化方面有很大的潜力,可以广泛地利用有机物作为底物,如挥发性脂肪酸(VFAs)、醇、酚和苯等[50]。不仅如此,地杆菌属(Geobacter)还可以与其他物种(如产甲烷菌等)建立直接电子连接,即直接种间电子转移,例如,金属还原地杆菌(Geobacter metallireducens)可与甲烷丝菌属(Methanosaeta)或甲烷八叠球菌属(Methanosarcina)等产甲烷菌共培养[51-52]。地杆菌属(Geobacter)在本废水处理系统厌氧池占主导地位,说明厌氧池发生了良好的水解酸化作用,同时也有利于厌氧消化中的产甲烷过程。同时,其它的优势菌属,如帕卢迪杆菌属(Paludibacter)是β-拟杆菌纲(Betabacteroidetes)、紫单胞菌科(Porphyromonadaceae)下的一种严格厌氧菌,该菌能发酵多种单糖和二糖产生乙酸、丙酸和少量丁酸,是一种产酸菌[53-54]。
纤绳菌属(Leptolinea)在厌氧条件下能将多糖等有机物降解转化为有机酸和脂肪酸[55],有利于糖类等有机物的水解酸化。值得注意的是,纤绳菌属(Leptolinea)属于营养匮乏的绿弯菌亚门I(Chloroflexi subphylum I)中的厌氧菌纲,需要与其他微生物结合才能有效生长[30]。uncultured_bacterium_o_Saccharimonadales(1.37%)系超级门Patescibacteria门,具有非常小的基因组和细胞大小,通常与其他微生物共存、依赖共代谢生长[56];一些该细菌被证明能够吸收油酸并具有脂肪酶和其他外酶活性[57];可在发酵途径中将丙酮酸转化为乳酸。互营单胞菌属(Syntrophomonas)是厌氧发酵中常见的微生物,可以降解丁酸,是厌氧活性污泥的功能菌属之一[58]。Syntrophomonas可与氢化产甲烷菌共同消耗长链和短链脂肪酸,是厌氧消化中重要的共营养细菌,具有产生氢或甲酸作为甲烷菌电子载体的功能[59]。Syntrophomonas属在厌氧反应池中的富集,可能也有助于提高COD去除率和产甲烷量。
由上述分析可知,贫营养进水条件下,厌氧池中出现了适应该环境条件并能降解各种复杂有机物的优势菌属Gobacter和Paludibacter,Gobacter主要参与厌氧过程的水解发酵,Paludibacter参与产酸过程。其次,氮磷营养元素的限制为起水解酸化作用的贫营养菌属Leptolinea的生长提供了有利条件。以Leptolinea和Syntrophomonas为代表的优势菌属与其他功能菌属的共代谢生长有利于厌氧消化过程的顺利进行。其中,Syntrophomonas与产甲烷菌的共营养生长不仅促进了产氢产乙酸过程,还有利于厌氧产甲烷。总之,以上这些优势菌属在厌氧池的稳定生长及分工合作是厌氧池能够长期稳定运行的有力保障。
4. 结论
1)该贫营养系统运行状况表明,系统能在TN、TP分别低至约10 mg·L−1和1 mg·L−1的条件下长期稳定运行,且系统处理效果良好。
2)中药废水的特殊性质(高COD、低N、P营养)对微生物群落的生长施加了选择压,即大量有机物的存在为具有高有机物降解能力的异养菌提供了微生物选择。其中,厌氧池中表现为Geobacter(26.62%),好氧池中表现为Amaricoccus(8.03%)。
3)贫营养环境和工艺运行条件促进了贫营养需求菌的优势增长,如厌氧池中的纤绳菌属(Leptolinea)、好氧池中的Amaricoccus属和Plasticicumulans属,这些优势菌本身具有很强的有机物降解能力,并在处理统系统中各个阶段分工合作,使系统能够长期稳定运行,达到良好的处理效果。
4)一些优势菌与其他菌种的共营养生存,使系统在污染物降解的各个阶段能够有序地进行,保障了该系统在长期处理过程中的稳定运行。其中厌氧绳菌纲(Anaerolineae)、地杆菌属(Geobacter)、纤绳菌属(Leptolinea)及互营单胞菌属(Syntrophomonas)是典型的代表。
-
表 1 不同催化剂的质构参数
Table 1. Structure parameters of different catalysts
催化剂 BET比表面积/(m2·g−1) 单点总孔容/(10−2cm3·g−1) 吸附平均孔径/nm CZ5 316 9.51 28.94 CZ5-600-5% 298 14.82 29.17 CZ5-670-5% 286 15.59 30.99 CZ5-750-5% 285 21.14 31.18 CZ5-800-5% 256 47.65 44.64 CZ5-750-10% 276 26.53 34.55 CZ5-750-15% 270 26.59 34.63 -
[1] FAHAMI A R, NOVA I, TRONCONI E. A kinetic modeling study of NO oxidation over a commercial Cu-CHA SCR catalyst for diesel exhaust aftertreatment[J]. Catalysis Today, 2017, 297(15): 10-16. [2] KARAMITROS D, KOLTSAKIS G. Model-based optimization of catalyst zoning on SCR-coated particulate filters[J]. Chemical Engineering Science, 2017, 173(14): 514-524. [3] FICKEL D W, D′ADDIO E, LAUTERBACH J A, et al. The ammonia selective catalytic reduction activity of copper-exchanged small-pore zeolites[J]. Applied Catalysis B: Environmental, 2011, 102(3/4): 441-448. [4] KWAK J H, TONKYN R G, KIM D H, et al. Excellent activity and selectivity of Cu-SSZ-13 in the selective catalytic reduction of NOx with NH3[J]. Journal of Catalysis, 2010, 275(2): 187-190. doi: 10.1016/j.jcat.2010.07.031 [5] FICKEL D W, FEDEYKO J M, LOBO R F. Copper coordination in Cu-SSZ-13 and Cu-SSZ-16 investigated by variable-temperature XRD[J]. Journal of Physical Chemistry C, 2010, 114(3): 1633-1640. doi: 10.1021/jp9105025 [6] WILKEN N, KAMASAMUDRAM K, CURRIER N W. Heat of adsorption for NH3, NO2 and NO on Cu-Beta zeolite using microcalorimeter for NH3 SCR applications[J]. Catalysis Today, 2010, 151(3/4): 237-243. [7] 张惠, 王喜芹, 栾志强, 等. 铜-胺改性ZSM-5吸附剂的制备及其对NOx的净化机理[J]. 环境工程学报, 2013, 7(12): 4887-4890. [8] 李富霞, 任晓光, 李鹏, 等. 焙烧条件对CuO/ZSM-5催化剂脱硫脱硝性能的影响[J]. 环境工程学报, 2013, 7(8): 3117-3122. [9] 石晓燕, 刘福东, 单文坡, 等. 水热老化对不同方法制备的Fe-ZSM-5用于NH3选择性催化还原NOx的影响[J]. 催化学报, 2012, 33(3): 454-464. [10] GOMEZ S A, CAMPERO A, MARTINEZ-HERNANDEZ A. Changes in Cu2+ environment upon wet deactivation of Cu-ZSM-5 deNOx catalysts[J]. Applied Catalysis A: General, 2000, 197(1): 157-164. doi: 10.1016/S0926-860X(99)00546-3 [11] PARK J H, PARK H J, BAIK J H. Hydrothermal stability of Cu-ZSM-5 catalyst in reducing NO by NH3 for the urea selective catalytic reduction process[J]. Journal of Catalysis, 2006, 240(1): 47-57. doi: 10.1016/j.jcat.2006.03.001 [12] 任爱玲, 刘卉, 张硕, 等. Ce-Mn/ZSM-5催化剂的制备及其低温脱硝性能分析[J]. 现代化工, 2018, 38(6): 73-77. [13] 杨晓初, 肖海平, 万震天, 等. 煅烧温度影响MNOx/ZSM-5催化NO氧化性能研究[J]. 热能动力工程, 2018, 33(4): 56-62. [14] 杜蒙蒙, 温正城, 康普滋, 等. ZSM-5负载Ce-Co催化氧化NO的机理研究[J]. 热能动力工程, 2018, 33(3): 93-99. [15] SHI X Y, HE H, XIE L J. The effect of Fe species distribution and acidity of Fe-ZSM-5 on the hydrothermal stability and SO2 and hydrocarbons durability in NH3-SCR reaction[J]. Chinese Journal of Catalysis, 2015, 36(4): 649-656. doi: 10.1016/S1872-2067(14)60268-0 [16] 宋守强, 李明罡, 李黎声, 等. 磷改性ZSM-5分子筛的水热稳定性[J]. 石油学报(石油加工), 2014, 30(2): 194-203. doi: 10.3969/j.issn.1001-8719.2014.02.002 [17] DING J, XUE T, WU H H, et al. One-step post-synthesis treatment for preparing hydrothermally stable hierarchically porous ZSM-5[J]. Chinese Journal of Catalysis, 2017, 38(1): 48-57. doi: 10.1016/S1872-2067(16)62549-4 [18] IWASAKI M, YAMAZAKI K, BANNO K, et al. Characterization of Fe/ZSM-5 DeNOx catalysts prepared by different methods: Relationships between active Fe sites and NH3-SCR performance[J]. Journal of Catalysis, 2008, 260(2): 205-216. doi: 10.1016/j.jcat.2008.10.009 [19] 李振国, 马杰, 刘双喜, 等. 黏结剂对柴油车用V2O5-WO3/TiO2催化剂选择性催化还原性能的影响[J]. 工业催化, 2011, 19(11): 60-63. doi: 10.3969/j.issn.1008-1143.2011.11.011 [20] 李振国, 马杰, 王务林, 等. 制备条件对柴油车用V2O5-WO3/TiO2催化剂催化性能的影响[J]. 工业催化, 2011, 19(5): 30-33. doi: 10.3969/j.issn.1008-1143.2011.05.006 [21] BEUTEL T, SARKANY J, LEI G D, et al. Redox chemistry of Cu/ZSM-5[J]. Journal of Physical Chemistry, 1996, 100(2): 845-851. doi: 10.1021/jp952455u [22] PRALIAUD H, MIKHAILENKO S, CHAJAR Z, et al. Surface and bulk properties of Cu-ZSM-5 and Cu/Al2O3 solids during redox treatments. Correlation with the selective reduction of nitric oxide by hydrocarbons[J]. Applied Catalysis B: Environmental, 1998, 16(4): 359-374. doi: 10.1016/S0926-3373(97)00093-3 [23] RICHTER M, FAIT M J G, ECKELT R, et al. Oxidative gas phase carbonylation of methanol to dimethyl carbonate over chloride-free Cu-impregnated zeolite Y catalysts at elevated pressure[J]. Applied Catalysis B: Environmental, 2006, 73(3/4): 269-281. [24] SULTANA A, NANBA T, HANEDA M, et al. Influence of co-cations on the formation of Cu+ species in Cu/ZSM-5 and its effect on selective catalytic reduction of NOx with NH3[J]. Applied Catalysis B: Environmental, 2010, 101(1/2): 61-67. [25] NANBA T, MASUKAWA S, OGATA A, et al. Active sites of Cu-ZSM-5 for the decomposition of acrylonitrile[J]. Applied Catalysis B: Environmental, 2005, 61(3/4): 288-296. [26] RICHTER M, FAIT M J G, ECKELT R, et al. Gas-phase carbonylation of methanol to dimethyl carbonate on chloride-free Cu-precipitated zeolite Y at normal pressure[J]. Journal of Catalysis, 2007, 245(1): 11-24. doi: 10.1016/j.jcat.2006.09.009 [27] KEFIROV R, PENKOVA A, HADJIIVANOV K, et al. Stabilization of Cu+ ions in BEA zeolite: Study by FTIR spectroscopy of adsorbed CO and TPR[J]. Microporous and Mesoporous Materials, 2008, 116(1/2/3): 180-187. [28] RUTKOWSKA M, PACIA I, BASĄG S, et al. Catalytic performance of commercial Cu-ZSM-5 zeolite modified by desilication in NH3-SCR and NH3-SCO processes[J]. Microporous and Mesoporous Materials, 2017, 246: 193-206. doi: 10.1016/j.micromeso.2017.03.017 [29] 吕刚, 范啸天, 宋崇林, 等. Cu/ZSM-5催化剂制备及SCR催化性能研究[J]. 工程热物理学报, 2015, 36(10): 2276-2281. [30] LI Z G, CHEN X Y, LI J H, et al. Synthesis and evaluation of mesopore structured ZSM-5 and a CuZSM-5 catalyst for NH3-SCR reaction: Studies of simulated exhaust and engine bench testing[J]. RSC Advances, 2016, 6: 102570-102581. doi: 10.1039/C6RA20237C [31] SARMA D D, RAO C N R. XPES studies of oxides of second- and third-row transition metals including rare earths[J]. Journal of Electron Spectroscopy and Related Phenomena, 1980, 20(1): 25-45. doi: 10.1016/0368-2048(80)85003-1 [32] WANG L, GAUDET J R, LI W, et al. Migration of Cu species in Cu/SAPO-34 during hydrothermal aging[J]. Journal of Catalysis, 2013, 306: 68-77. doi: 10.1016/j.jcat.2013.06.010 [33] 郑昌坤, 韩帅, 叶青. 铜源对Cu/ZSM-5催化剂氨选择性催化还原NO的影响[J]. 化学工程, 2018, 46(9): 23-27. doi: 10.3969/j.issn.1005-9954.2018.09.005 期刊类型引用(2)
1. 陈栋栋,彭丽娟,高慎勇,李云华,孙晓宇. 基于OBD监测的国六柴油机NO_x排放方法研究. 内燃机与动力装置. 2022(04): 48-53 .  百度学术
百度学术
2. 朱自如,黄鹏,王素梅,吕立群,葛蕴珊. 柴油车SCR装置实际使用过程劣化机理研究. 重庆理工大学学报(自然科学). 2022(12): 216-222 .  百度学术
百度学术
其他类型引用(4)
-






 下载:
下载: