-
屠宰废水是中国最大的有机污染源之一,主要来源于屠宰加工过程的高温废水、机房冷却水及办公生活污水。含有大量污血、动物内脏和粪便,具有很高的可生化性[1]。一般不含有毒有害的重金属和化学物质[2],氨氮含量有时高达120 mg·L−1。由于物理化学法对屠宰废水的处理效率普遍较低,而生物法表现出良好的处理效果,因此,对其多采用生物法进行处理。序批式生物膜反应器(SBBR)作为生物法中较常应用的一种方法,它在相同操作条件下的同一反应器中实现了同步硝化反硝化(SND)[3]和去碳[4]。有研究[5]表明,该处理系统对处理屠宰废水是非常有效的。
铁作为微生物生长繁殖的必需元素,工业废水排放标准对它的排放浓度没有明确限制。研究表明,低温条件下,铁增强活性污泥对于氨氮的去除率明显高于对照系统[6],但对硝酸盐氮和亚硝酸氮的影响却未见更多研究,而硝化菌和亚硝化菌的活性会受Fe相关产物积聚到污泥中的影响[7]。研究发现,一价阳离子不利于生物絮凝,易使絮凝性质恶化。二价阳离子则可以改善絮凝性,提高处理效率[8]。三价阳离子同样具有絮凝性,研究却相对较少。有研究[9-10]表明,加入三价铁离子的活性污泥的沉降性能得到改善,但微量金属元素的过量添加会导致二次污染,所以控制好投加浓度至关重要。由于只针对屠宰废水的高氨氮进行去除,为避免其他因素影响,故采用模拟废水进行研究。通过向SBBR中添加Fe3+离子,探究不同浓度Fe3+对氨氮、COD、硝态氮、亚硝态氮及同步硝化反硝化速率(ESND)的影响,确定Fe3+的最佳投加浓度,并观察生物膜上的微生物群落结构特征及分布情况,为屠宰废水生物脱氮的实际应用提供参考。
-
SBBR由圆柱形有机玻璃制成,高30 cm,内直径10 cm,有效体积2 L。采用瞬时进水方式,曝气泵连接曝气砂头进行曝气,曝气量通过转子流量计控制。活性污泥取自大连某污水处理厂二沉池,MLSS为2 500 mg·L−1。
-
COD为2 000~3 000 mg·L−1、氨氮为80~100 mg·L−1、pH为6~9,补充适量磷源和微量元素以保证微生物正常生长繁殖。
-
污泥取回后,闷曝1周,待恢复活性即进行驯化及挂膜,运行1个月后,填料上附着有1~2 mm厚的生物膜,COD及氨氮去除率稳定。实验过程温度不设限制,以室温为主,进水10 min,曝气720 min,闲置80 min,排水10 min。反应器分为生物铁SBBR和普通SBBR。实验设置的7个Fe3+浓度分别为0、5、10、20、30、40和50 mg·L−1。在生物膜中实现SND须同时考虑硝化反应对溶解氧的需求和溶解氧对反硝化反应的抑制干扰,因此,外界溶解氧浓度需要严格控制在一定水平以内[4],操作条件相关参数如表1所示。
-
氨氮采用纳氏试剂法测定,硝酸盐氮采用紫外分光光度法测定,亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法测定,COD采用COD快速测定仪(5B-3C(V8),连华科技,北京)测定,pH采用pH计(pH1500,Eutech Instruments Pte Ltd,新加坡)测定,溶解氧及温度采用便携式溶氧仪(ST400D,奥豪斯仪器有限公司,常州)测定,吸光度采用紫外可见分光光度计(756 PC,上海光谱仪器公司,上海)测定,微生物相采用光学显微镜测定,SEM采用钨灯丝扫描电镜(QUANTA 450,FEI公司,美国)测定,Nano Measurer 1.2软件分析细菌粒径大小,FT-IR采用傅里叶红外光谱仪(EQUINOX55,德国布鲁克公司,德国)测定。
-
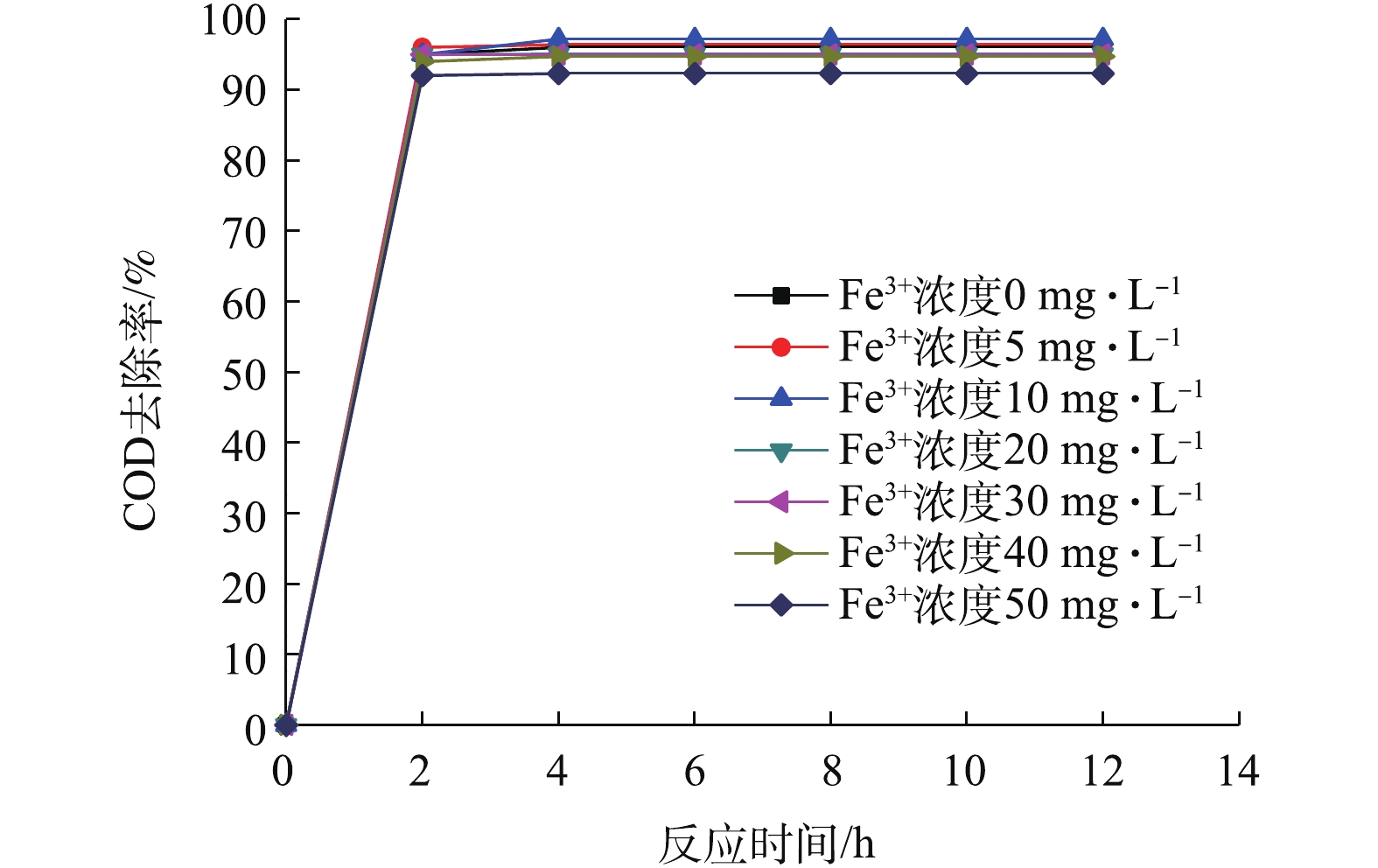
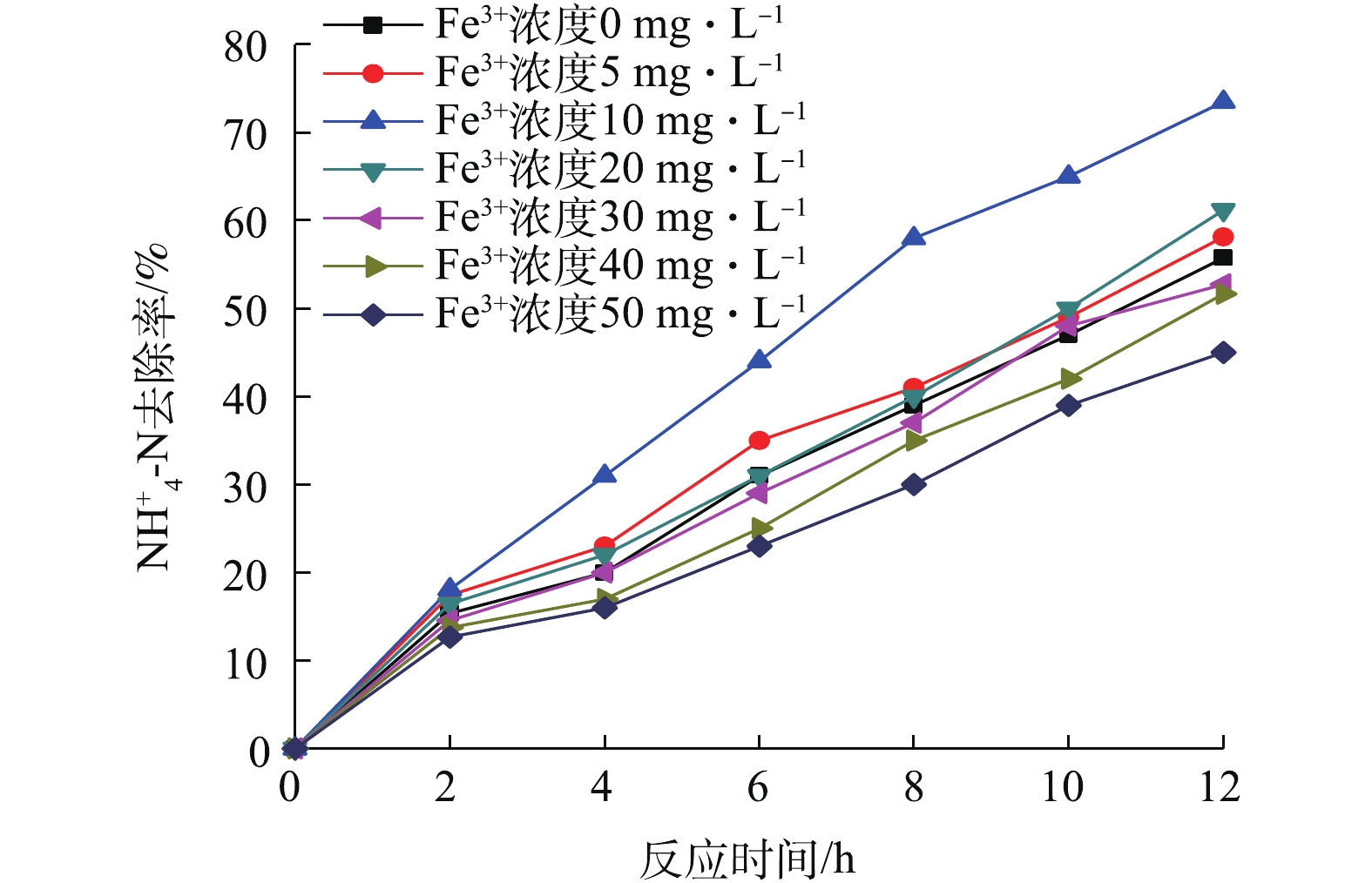
在室温18 ℃左右,不同浓度Fe3+对氨氮和COD去除的影响如图1和图2所示。由图1可以看出,在0~10 mg·L−1,随着浓度的升高,氨氮去除率持续升高。Fe3+为10 mg·L−1时,NH4+-N去除率为73.5%,明显高于其他浓度下的去除率,TN去除率达到59.94%。随着浓度继续增加,促进作用逐渐减弱。Fe3+浓度超过30 mg·L−1时,氨氮去除受到抑制。Fe3+浓度达到50 mg·L−1时,对氨氮降解没有任何促进作用,反而抑制了氨氮去除。推测和反应器内氢氧化铁絮体的增多有关,由于形成的氢氧化铁量越多,污泥浓度和污泥颗粒势必会增大,这就影响了溶解氧和基质从反应器混合液向污泥絮体内部扩散,抑制脱氮。由图2看出,COD去除率在2 h左右基本达到平衡,随着时间的延长,始终维持在90%以上。Fe3+浓度为10 mg·L−1时的COD去除率为97%,比对照组高2%。7个浓度下的COD去除率均较高,可见足够长的曝气时间均能使COD得到有效去除。
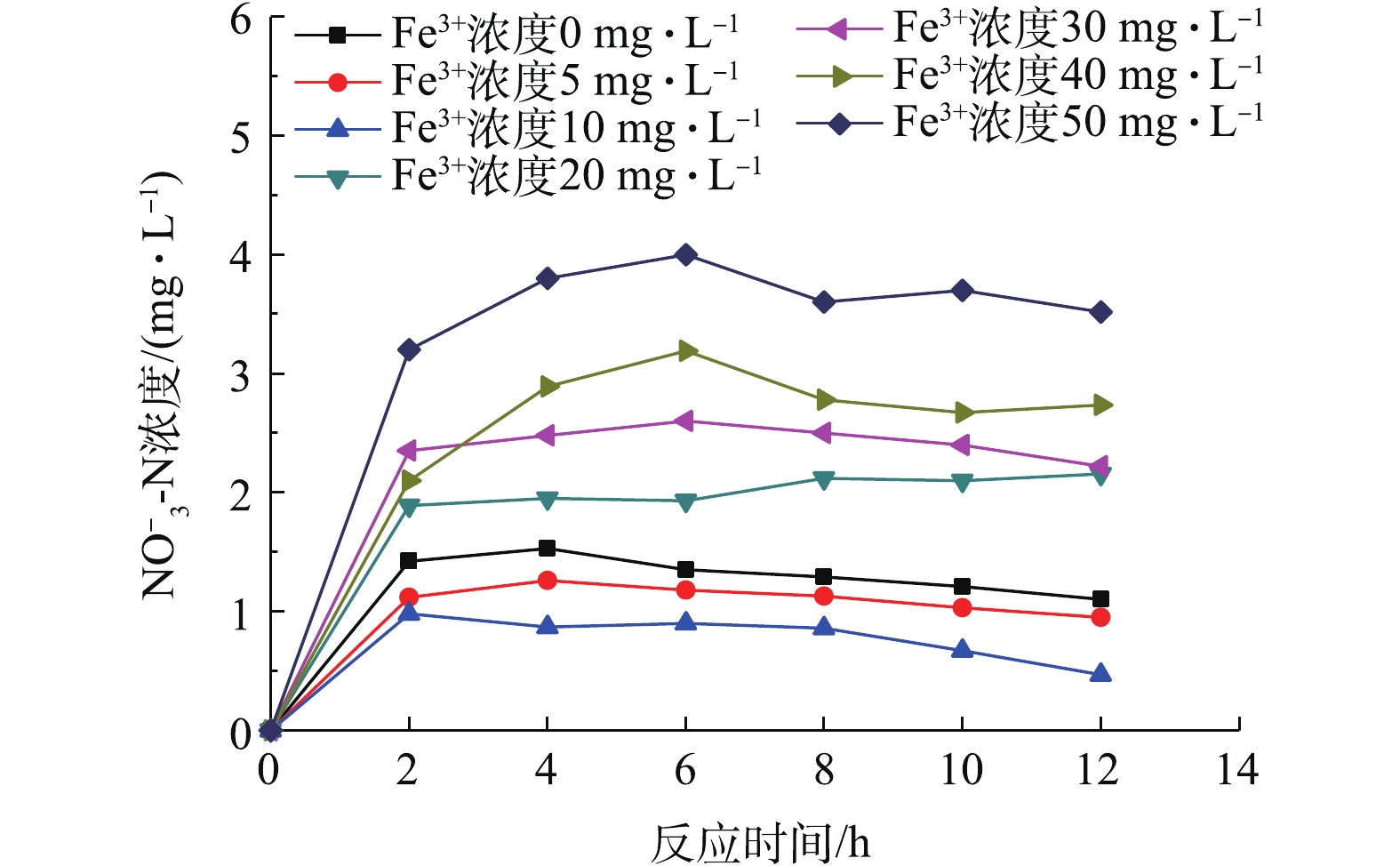
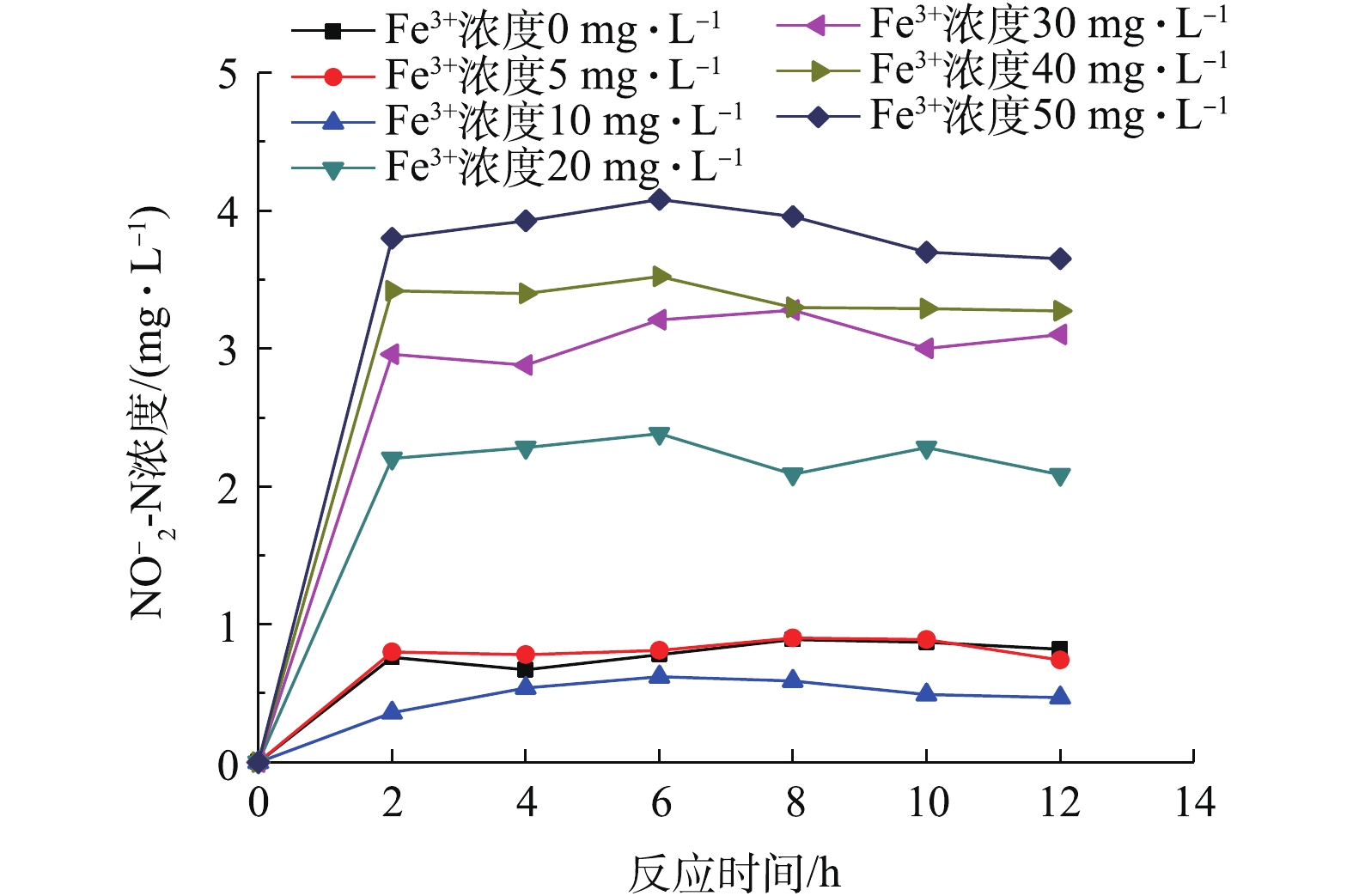
由图3和图4可以看出,Fe3+浓度在0~10 mg·L−1时,
${\rm NO}_2^- $ -N及${\rm NO}_3^- $ -N含量都较低,${\rm NO}_2^- $ -N含量小于1 mg·L−1,${\rm NO}_3^- $ -N含量小于2 mg·L−1。Fe3+浓度为10 mg·L−1的${\rm NO}_2^- $ -N及${\rm NO}_3^- $ -N含量最低,分别为0.47 mg·L−1和0.46 mg·L−1。铁的存在有利于微生物对氧的吸收,提高了微生物的活性[11],低浓度的三价铁能促进反硝化速率[12],减少硝酸盐氮及亚硝酸盐氮的积累。而Fe3+浓度在20~50 mg·L−1时,${\rm NO}_2^- $ -N及NO3−-N含量均不同程度上升,促进作用减弱。当Fe3+浓度超过20 mg·L−1时,NO2−-N及${\rm NO}_3^- $ -N含量与对照组相比,开始明显上升,${\rm NO}_2^- $ -N浓度上升较快,推测原因可能是Fe3+浓度的增大,抑制了硝化菌和反硝化菌的活性。研究表明,铁超过一定浓度就变成可减弱、抑制甚至破坏酶作用的抑制剂[13]。当Fe3+浓度达到50 mg·L−1时,${\rm NO}_2^- $ -N及${\rm NO}_3^- $ -N含量已接近4 mg·L−1。综上所述,为得到理想的处理效果,将10 mg·L−1作为Fe3+最佳投加浓度。 -
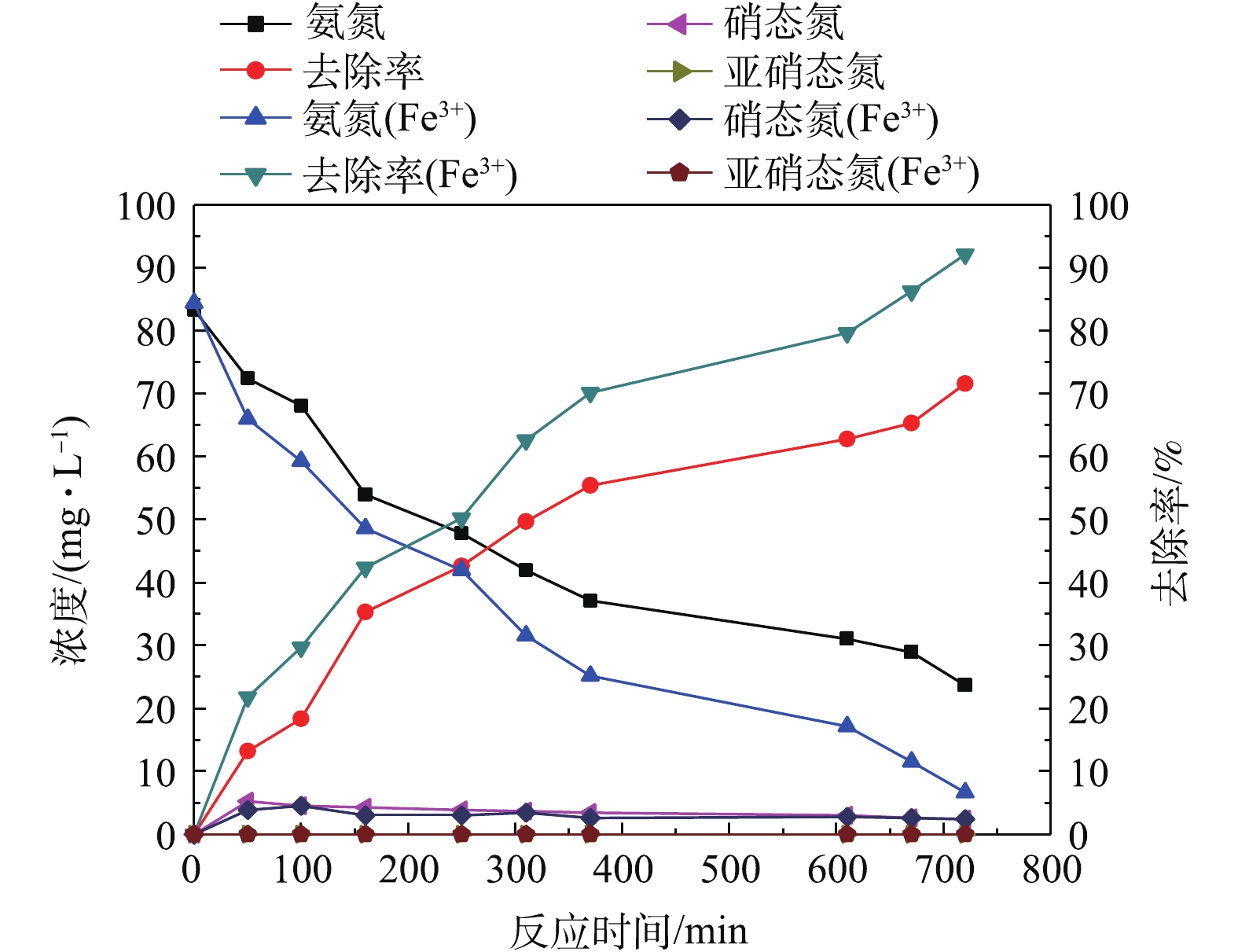
室温26 ℃左右,在三价铁最佳浓度下测定1个周期内的污染物降解情况,如图5、图6所示。由图5可看出,
${\rm NH}_4^+ $ -N初始浓度为85 mg·L−1,由于温度的升高,含铁组反应12 h时${\rm NH}_4^+ $ -N浓度已降低至6.65 mg·L−1,去除率达92.12%,TN去除率为89.28%,${\rm NH}_4^+ $ -N出水浓度符合国家《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级B标准。对照组${\rm NH}_4^+ $ -N浓度为23.67 mg·L−1,去除率仅为71.59%,TN去除率为68.71%。含铁组的${\rm NH}_4^+ $ -N及TN去除率比对照组分别高21%和20.56%。温度升高后,硝化菌和反硝化菌的活性随之提高,${\rm NO}_3^- $ -N及${\rm NO}_2^- $ -N含量维持在较低水平,${\rm NO}_3^- $ -N含量小于5 mg·L−1,${\rm NO}_2^- $ -N含量接近0 mg·L−1。含铁组${\rm NO}_3^- $ -N含量低于对照组,铁元素作为微生物代谢过程中电子链传递的重要影响因素,Fe3+可以进一步増强硝化菌和反硝化菌活性,促进脱氮,减少${\rm NO}_3^- $ -N积累。缺少铁将影响酶的合成,有机物释放的电子不能顺利地传递给最终电子受体O2,而影响微生物的生长代谢过程[14]。由图6可看出,进水COD接近3 000 mg·L−1,含铁组COD降解较快,在100 min时,含铁组和对照组去除率分别达到91.79%和89.82%。继续延长反应时间,COD去除率均达到97%以上。对比图5和图6可看出,由于曝气初期负荷较高,COD降解占主导,待有机负荷降低后硝化反应开始进行,氨氮降解加快。 -
为了进一步分析Fe3+对同步硝化反硝化速率的影响,分别计算了不同温度下,加铁前后的同步硝化反硝化速率(ESND)。根据杨帅等[15]的研究中提到的SND效率计算方法,忽略微生物同化作用和细胞衰亡的影响,具体计算方法如式(1)~式(3)所示。
式中:C硝态氮剩为剩余的
${\rm NO}_3^- $ -N和${\rm NO}_2^- $ -N总含量,mg·L−1;C氨氮去为去除的${\rm NH}_4^+ $ -N含量,mg·L−1;C亚硝酸盐氮出为出水${\rm NO}_2^- $ -N含量,mg·L−1;C硝酸盐氮出为出水${\rm NO}_3^- $ -N含量,mg·L−1;C氨氮进为进水${\rm NH}_4^+ $ -N含量,mg·L−1;C氨氮出为出水${\rm NH}_4^+ $ -N含量,mg·L−1。在室温条件下,水温为14~32 ℃,不同温度条件下的同步硝化反硝化速率计算结果如表2所示。可以看出,温度升高,ESND值增大。在WANG等[16]的研究中,碳氮比越高,SND效率也越高。屠宰废水的C/N比可达20,甚至更高,SND效率整体处于较高水平。在低温条件下(14 ℃),加铁后ESND为87.08%,对照组ESND为78.65%,加铁后SND速率比对照组高8.43%,可见温度较低时,硝化菌和反硝化菌的活性受到抑制。王琳等[17]的研究中提到硝化细菌和反硝化细菌的适宜温度分别为20~30 ℃和20~40 ℃,低于15 ℃硝化反应和反硝化反应速率均下降。由此推测,三价铁能改善微生物的抗低温冲击性,即使温度不在硝化菌和反硝化菌生存繁殖的最佳温度范围,反应器中的三价铁也能在一定程度上提高硝化菌和反硝化菌活性。
温度由14 ℃升高到20 ℃时,加铁组和对照组的ESND分别提高了5.10%和7.86%,对照组的提高幅度较显著。不加铁的反应器内微生物对于温度变化更敏感,铁的存在降低了温度变化对微生物的冲击,因此,加铁组的提高幅度较小。在高温条件下(32 ℃),加铁后的ESND为99.94%,对照组ESND为97.54%,二者相差2.4%。温度升高后,硝化菌和反硝化菌活性得到提高,SND速率增大,加速了硝化和反硝化速率。对照组ESND平均值为88.67%,加铁组ESND平均值为93.91%,二者均值相差5.24%。SND效率越高,反应器硝化反应与反硝化反应越平衡,同步脱氮的效果越好[18]。所以,为了保持较高的微生物活性,提高氧气利用率,获得较好的出水水质,保持反应器中适量的铁离子浓度是必需的。
-
分别从反应器内和生物膜上取适量污泥进行SEM分析,如图7所示。在放大3 000倍和1 000倍的条件下,观察反应器内和生物膜上的微生物形貌特征。在含铁(图7(a))和不含铁(图7(b))的反应器内,球形硝化菌的数量都较为丰富,尤其是含铁反应器(图7(a))内,硝化菌分布更密集,颗粒形态更清晰可见,推测与其中添加的铁离子有关。由于Fe(Ⅲ)具有较高化合价,每一个Fe(Ⅲ)能够与更多带负电的基团结合,使得絮体变得更小、更密实[19]。Nano Measurer 1.2粒径分析软件分析结果显示,含铁反应器硝化菌粒径平均值为1.08 μm,不含铁反应器硝化菌粒径平均值为1.51 μm。研究表明,与由较多硝化细菌组成的较大絮凝物相比,小型絮凝物在低氧水平下提高了硝化速率[20],这也解释了含铁体系氨氮下降较快的原因。对比反应器内部的生物膜(图7(a))可以看出,填料内部的生物膜(图7(c))不易受到曝气扰动。同时,对比图7(c)和图7(d),铁离子的絮凝作用使污泥团聚更明显,有利于生物膜缺氧微环境的构建,帮助实现反硝化过程。Fe3+的存在使更多有机和无机分子吸附在含Fe3+的颗粒表面上[21],生物质冲洗过程减少,更多的生物量保留在反应器中,处理效率得到提升。镜检发现,含铁体系污泥团中含有铁细菌、线虫、轮虫、变形虫、表壳虫等细菌、真菌、原生动物及微型后生动物,微生物种类比不含铁体系更为丰富。
-
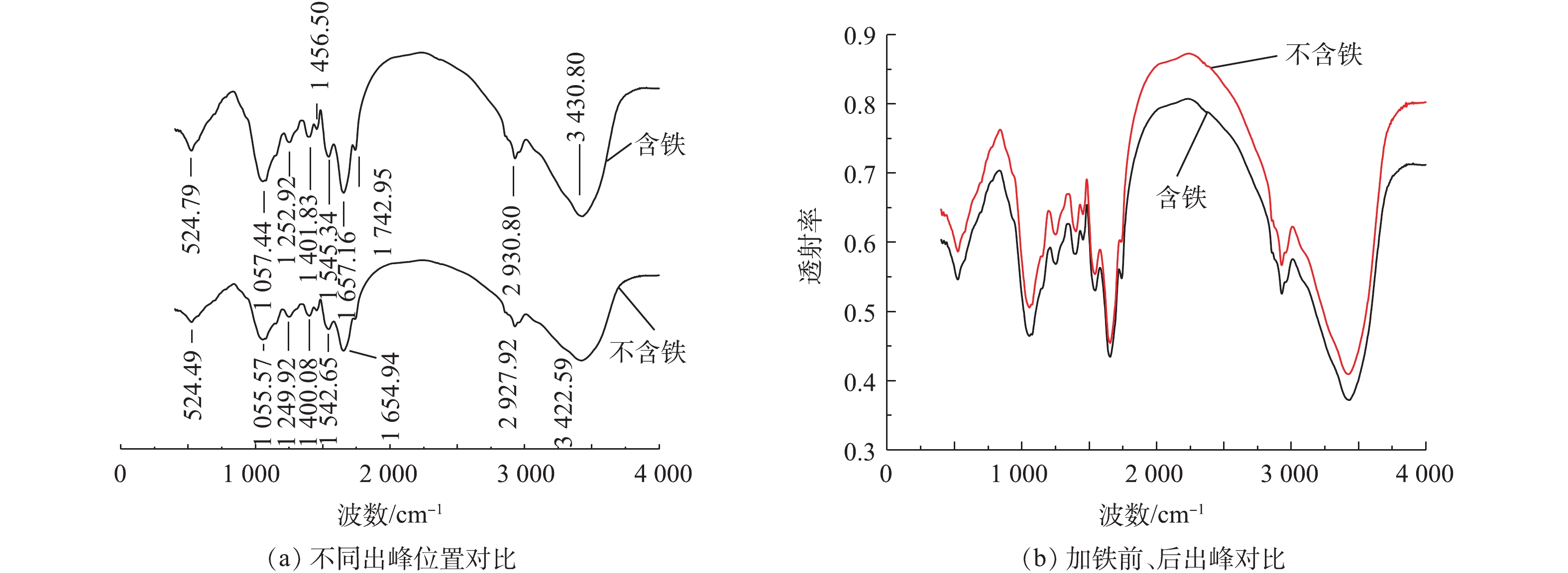
采用傅里叶红外变换光谱来表征加铁前后特征官能团的变化情况,测定结果见图8。由图8(a)看出,吸收峰主要集中在500~1 800 cm−1和2 900~3 500 cm−1 2个区域内。由图8(b)看出,加入Fe3+离子后,吸收峰强度变大,总吸收峰数量增多。524.78 cm−1处稍弱吸收峰来自于多糖官能团的弯曲振动。由图8(a)看出,1 000~1 500 cm−1的吸收峰相对较弱,加铁的吸收峰更多,多糖含量更丰富,其中1 055.57~1 252.92 cm−1出现的特征峰为糖原分子中C—OH的吸收峰[22]。1 400 cm−1附近的2个峰为饱和C—H变形振动吸收峰,其中1 456.50 cm−1为—CH3的变形振动峰,1 542 cm−1和1 545 cm−1处为—NH和C—N耦合产生的酰胺Ⅱ带特征峰,1 657.16 cm−1处为酰胺Ⅰ带特征峰,表明了蛋白质的存在。1 742.95 cm−1为CHO—中的C=O伸缩振动峰,主要来源于脂类及脂肪酸。2 930 cm−1附近的2个峰为—CH2不对称伸缩振动峰,来源于脂类和碳水化合物。3 422.59 cm−1和3 430.80 cm−1处出现的宽峰是N—H和O—H伸缩振动的吸收峰,来源于多糖及蛋白质[23-24]。综上分析,三价铁的添加增加了蛋白质及多糖类物质的含量,提高了体系处理效率。
-
1)Fe3+离子浓度对微生物活性影响显著,10 mg·L−1的Fe3+有效提高了模拟屠宰废水的同步硝化反硝化速率,最高为99.94%。
2)Fe3+离子对硝酸盐及亚硝酸盐积累量影响明显,Fe3+离子为10 mg·L−1时,
${\rm NO}_2^- $ -N及${\rm NO}_3^- $ -N含量最低,分别为0.47 mg·L−1和0.46 mg·L−1。3)三价铁的添加对官能团特征峰的吸收强度也有影响,Fe3+离子为10 mg·L−1的污泥中蛋白质及多糖的特征峰强度显著增加。
Fe3+对生物膜反应器去除模拟屠宰废水高氨氮的影响
Effect of Fe3+ on ammonia nitrogen removal from simulated slaughter wastewater by biofilm reactor
-
摘要: 为解决屠宰废水的高氨氮问题,在2 L SBBR中添加Fe3+对模拟屠宰废水进行脱氮处理。在室温条件下,研究了不同浓度Fe3+对
${{\rm NH}_4^+} $ -N、${{\rm NO}_2^-} $ -N、${{\rm NO}_3^-} $ -N、COD、同步硝化反硝化速率(ESND)、微生物群落分布的影响。结果表明,曝气量为0.6 L·min−1,HRT为12 h,Fe3+质量浓度为10 mg·L−1时,${{\rm NH}_4^+} $ -N、COD和TN去除率分别为94%、97%和89.28%。${{\rm NO}_3^- }$ -N含量小于5 mg·L−1,NO2−-N含量接近0 mg·L−1,ESND平均值可达93.91%,比对照组高5.24%。Fe3+提高了微生物抗低温冲击性,加快了同步硝化反硝化速率。高浓度的Fe3+(30~50 mg·L−1)会产生生物毒性,抑制生物脱氮。SEM及显微镜观察发现,含有10 mg·L−1 Fe3+的体系减少了生物质流失,微生物种类丰富,体系脱氮性能得到有效提升。Abstract: In order to solve the problem of high ammonia nitrogen in slaughter wastewater, Fe3+ was added to a 2 L SBBR reactor for nitrogen removal from the simulated slaughter wastewater. The effects of Fe3+ con ons on${\rm NH}_4^+ $ -N,${\rm NO}_2^- $ -N,${\rm NO}_3^- $ -N, COD, simultaneous nitrification and denitrification rate (ESND) and microbial community distribution were studied at ambient temperature. The results showed that the removal rates of${\rm NH}_4^+$ -N, COD and TN were 94%, 97% and 89.28%, respectively when the aeration rate was 0.6 L·min−1, the HRT was 12 h and the Fe3+ mass concentration was 10 mg·L−1. The corresponding contents of${{\rm NO}_3^- }$ -N,${{\rm NO}_2^-} $ -N were less than 5 mg·L−1 and close to 0 mg·L−1, respectively, and the average ESND could reach 93.91%, which was 5.24% higher than that of the control group. Fe3+ addition improved the resistance of microorganisms to low temperature impact and accelerated the rate of simultaneous nitrification and denitrification. Higher concentration of Fe3+ (30~50 mg·L−1) caused biological toxicity and inhibited biological nitrogen removal. SEM and microscope observation showed that the system containing 10 mg·L−1 Fe3+ reduced the loss of biomass and enriched microbial species, and its nitrogen removal performance was effectively improved. -

-
表 1 序批式生物膜反应器操作条件
Table 1. Operating conditions of sequencing batch biofilm reactor
反应器 反应温度/
℃曝气量/
(L·min−1)反应器
体积/LHRT/h 生物铁
SBBR14~32 0.6 2 12 普通SBBR 14~32 0.6 2 12 表 2 不同温度条件ESND值
Table 2. ESND values under different temperature conditions
温度/℃ 不加铁ESND/% 加铁ESND/% 14 78.65 87.08 16 81.40 89.56 18 84.27 91.67 20 86.51 92.18 22 88.04 93.17 24 89.21 93.45 26 91.71 95.31 28 93.87 97.86 30 95.51 98.87 32 97.54 99.94 平均 88.67 93.91 -
[1] 谢小兵. 两级兼氧+好氧处理技术在屠宰废水处理中的应用研究[D]. 南昌: 南昌大学, 2013. [2] 郑凡君, 刘锐, 刘思来, 等. 屠宰废水生态处理系统工程实践研究[J]. 上海畜牧兽医通讯, 2014(5): 36-37. doi: 10.3969/j.issn.1000-7725.2014.05.013 [3] CHEN R, WANG X, ZHANG Y, et al. Simultaneous nitrification and denitrification by aerobic granular sludge membrane bioreactor for high concentration ammonium nitrogen wastewater[J]. Chinese Journal of Geochemistry, 2006, 25(1): 130-131. [4] 曹文娟, 徐祖信, 王晟. 生物膜中同步硝化反硝化的研究进展[J]. 水处理技术, 2012, 38(1): 1-5. doi: 10.3969/j.issn.1000-3770.2012.01.001 [5] 曹昉, 王增长. SBBR工艺发展与应用综述[J]. 科技情报开发与经济, 2006(1): 147-148. doi: 10.3969/j.issn.1005-6033.2006.01.081 [6] LI H C, XUE J B, CHANG Q L, et al. Effect of temperature on the sewage treatment by iron-enhanced activated sludge[C]//Wuhan University. 2010 4th International Conference on Bioinformatics and Biomedical Engineering, 2010: 1-4. [7] IONNIS O, BURROWS L J, CYNTHIA M C. Mode of action of ferric and ferrous iron salts in activated sludge[J]. Journal of Chemical Technology & Biotechnology, 2010, 85(8): 1067-1076. [8] DAVIA C S, MATTHEW J H. Examination of three theories for mechanisms of cation-induced bioflocculation[J]. Water Research, 2002, 36(3): 527-538. doi: 10.1016/S0043-1354(01)00254-8 [9] 高颖, 袁林江, 吕景花. 铁盐化学除磷对活性污泥生物除磷系统的影响[J]. 环境工程学报, 2016, 10(10): 5366-5372. doi: 10.12030/j.cjee.201602125 [10] 张瑜, 石先阳. Fe3+对厌氧产甲烷体系的影响及生物有效性研究[J]. 水处理技术, 2018, 44(8): 76-80. [11] 孙天华, 林少宁, 余智梅, 等. 生物铁法处理高浓度难降解印染废水的研究[J]. 中国环境科学, 1991, 11(2): 138-142. [12] 李浩. Fe3+对同步硝化反硝化过程氮元素迁移转换的影响及其微生物机理研究[D]. 济南: 山东大学, 2015. [13] 冀世锋. 膜生物反应器中铁含量对活性污泥性能的影响[J]. 工业水处理, 2010, 30(10): 48-51. doi: 10.11894/1005-829x.2010.30(10).48 [14] 曹敬华, 明欲晓. 铁离子对生物膜微生物活性的影响[J]. 环境工程, 1996, 14(4): 50-51. [15] 杨帅, 杨凤林, 付志敏. 移动床膜生物反应器同步硝化反硝化特性[J]. 环境科学, 2009, 30(3): 803-808. doi: 10.3321/j.issn:0250-3301.2009.03.030 [16] WANG B, HE S, WANG L, et al. Simultaneous nitrification and de-nitrification in MBR[J]. Water Science and Technology, 2005, 52(10/11): 435-442. [17] 王琳, 田璐. 曝气生物滤池脱氮研究进展[J]. 水处理技术, 2018, 44(7): 1-5. [18] 邱鑫. 生物活性炭填料反应器同步硝化反硝化脱氮研究[D]. 新乡: 河南师范大学, 2016. [19] 李久义, 吴晓清, 陈福泰, 等. Fe(Ⅲ)对活性污泥絮体结构和生物絮凝作用的影响[J]. 环境科学学报, 2003, 23(5): 582-587. doi: 10.3321/j.issn:0253-2468.2003.05.004 [20] ZHOU X, HAN Y P, GUO X S. Identification and evaluation of SND in a full-scale multi-channel oxidation ditch system under different aeration modes[J]. Chemical Engineering Journal, 2015, 259: 715-723. doi: 10.1016/j.cej.2014.07.133 [21] BEATA K, JAGNA K, KORMELIUSZ M. Influence of calcium, magnesium, and iron ions on aerobic granulation[J]. Applied Biochemistry and Biotechnology, 2014, 174(8): 2910-2918. doi: 10.1007/s12010-014-1236-0 [22] TAYLOR S E, CHEUNG K T, PATEL I I, et al. Infrared spectroscopy with multivariate analysis to interrogate endometrial tissue: A novel and objective diagnostic approach[J]. British Journal of Cancer, 2011, 104(5): 790-797. doi: 10.1038/sj.bjc.6606094 [23] 李卫华, 严国兵, 申慧彦, 等. 强化生物除磷过程中污泥胞内糖原的红外光谱分析[J]. 环境科学学报, 2015, 35(3): 705-712. [24] 李瑞. 活性污泥法除磷过程中胞内储存物质的红外光谱解析与应用[D]. 合肥: 安徽建筑工业学院, 2012. -














 下载:
下载: