-
磷是一种生命必不可少的非金属元素,目前天然的磷矿正在不断枯竭,故磷的有效回收显得尤为重要[1]。由于城市生活污水中的磷酸盐含量较低,无法直接用磷酸铵镁结晶法(MAP)进行回收,因此,获取高浓度的磷酸盐浓缩液是高效回收磷的关键[2]。而在获取高浓度磷酸盐的过程中,聚磷微生物的生长环境从长期处于低浓度磷酸盐中转变为好氧低浓度磷酸盐与厌氧高浓度磷酸盐不断交替的状态,同时快速获取高浓度的磷酸盐浓缩液要求聚磷菌具有高效的释磷能力,因此,研究同步去除与富集磷酸盐工艺中聚磷微生物的种群结构变化显得十分必要。
SLATER等[3]研究发现,在相同条件下,运行的4个SBR中的Accumulibacter结构存在差别。而TIAN等[4]发现,在厌氧/好氧交替式生物滤池中随着磷吸收与磷富集的进行,占主导地位的菌群由β-变形菌纲转变为γ-变形菌纲(98%),且γ-变形菌纲中的假单胞菌为优势菌。孟璇等[5]发现,在厌氧/好氧交替式同步去除并富集磷酸盐尼龙生物膜反应器中,红环菌科(Rhodocyclaceae)含量最高,为58.32%。这些研究显示,在不同运行条件下,反应器中可能存在不同种类的聚磷菌。
目前,大部分研究把重点放在提高反应器的除磷效率上,而对于富集高浓度的磷酸盐以及在此过程中聚磷菌变化的研究较少。本研究以悬浮填料为载体,采用厌氧/好氧交替式运行的反应器,针对未来城市污水厂从污水中同时去除并回收利用磷的需求进行了实验;采用以人工配水模拟城市生活污水并结合扫描电子显微镜(SEM)和高通量测序技术,探讨了不同浓度的磷酸盐生长环境对同步去除与富集磷酸盐的悬浮填料生物膜工艺吸释磷性能的影响及其微生物群落的变化情况。
-
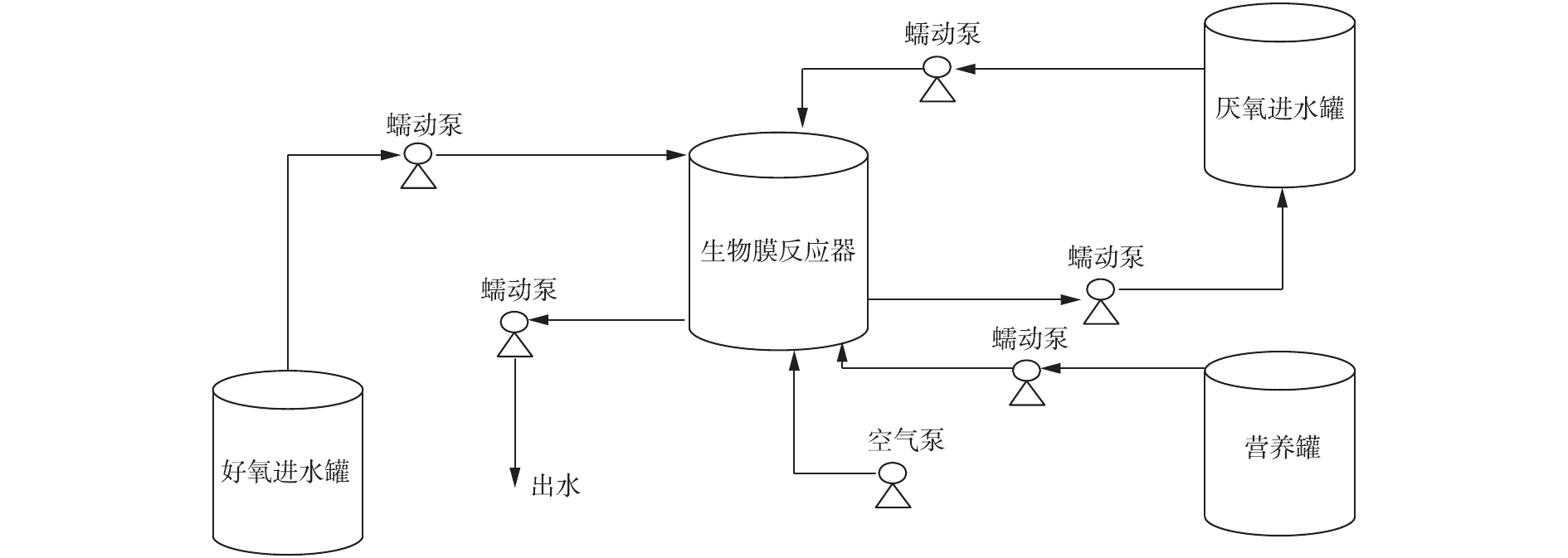
实验采用内径14 cm,高19 cm,有效容积为1.6 L的生物膜反应器。反应装置见图1。所用填料为k2型填料,材料为优质共聚材料,产品直径为15 mm。孔隙率高达95%以上,有效比表面积>500 m2·m−3。
实验用水采用人工配水来模拟城市生活污水水质,以乙酸钠作为厌氧碳源。好氧进水水质为5 mg·L−1
PO3−4 -P,40 mg·L−1NH+4 -N,少量微量元素[6],不添加碳源,加入适量NaHCO3,调节pH至7。控制厌氧进水水质为200 mg·L−1 COD,40 mg·L−1NH+4 -N,少量微量元素,不添加磷元素,pH为7。在第2阶段,使用投加浓缩液的方式在每个厌氧周期内补充200 mg·L−1 COD,40 mg·L−1NH+4 -N和少量微量元素[6]。 -
接种污泥来自苏州市某污水厂氧化沟。以人工配水模拟城市生活污水,采用厌氧/好氧交替式的运行模式在室温(20~25 ℃)下运行(好氧6 h,厌氧6 h),好氧阶段溶解氧控制在3 mg·L−1左右,蠕动泵的进出水流量约160 mL·min−1,进出水时间10 min,分2个阶段运行。
第1阶段(0~45 d),处于低浓度磷酸盐的生长环境(以下简称为低磷环境)。在好氧阶段,好氧进水通过蠕动泵进入生物膜反应器,曝气6 h,将溶液排出;在厌氧阶段,厌氧进水通过蠕动泵进入反应器,6 h后将溶液排出。
第2阶段(46~95 d),处于好氧低浓度磷酸盐与厌氧高浓度磷酸盐不断交替的生长环境(以下简称为低磷高磷交替环境)。在好氧阶段,好氧进水通过蠕动泵进入反应器,曝气6 h,之后将溶液排出;在厌氧阶段,厌氧进水通过蠕动泵进入反应器,同时营养罐中的碳源和氮源通过蠕动泵进入反应器,反应完成后,溶液回到厌氧进水罐中。以15 d为1个周期更新厌氧进水罐中的溶液。
-
COD采用重铬酸钾法[7]测定;
PO3−4 -P采用钼锑抗分光光度法[7]测定。采用扫描电子显微镜(SEM)观察第0、45和95天的微生物形态[4];采用高通量测序分析第0、45和95天反应器内的微生物群落组成[5]。 -
在同步去除与富集磷酸盐的工艺中,好氧进水COD为0 mg·L−1、
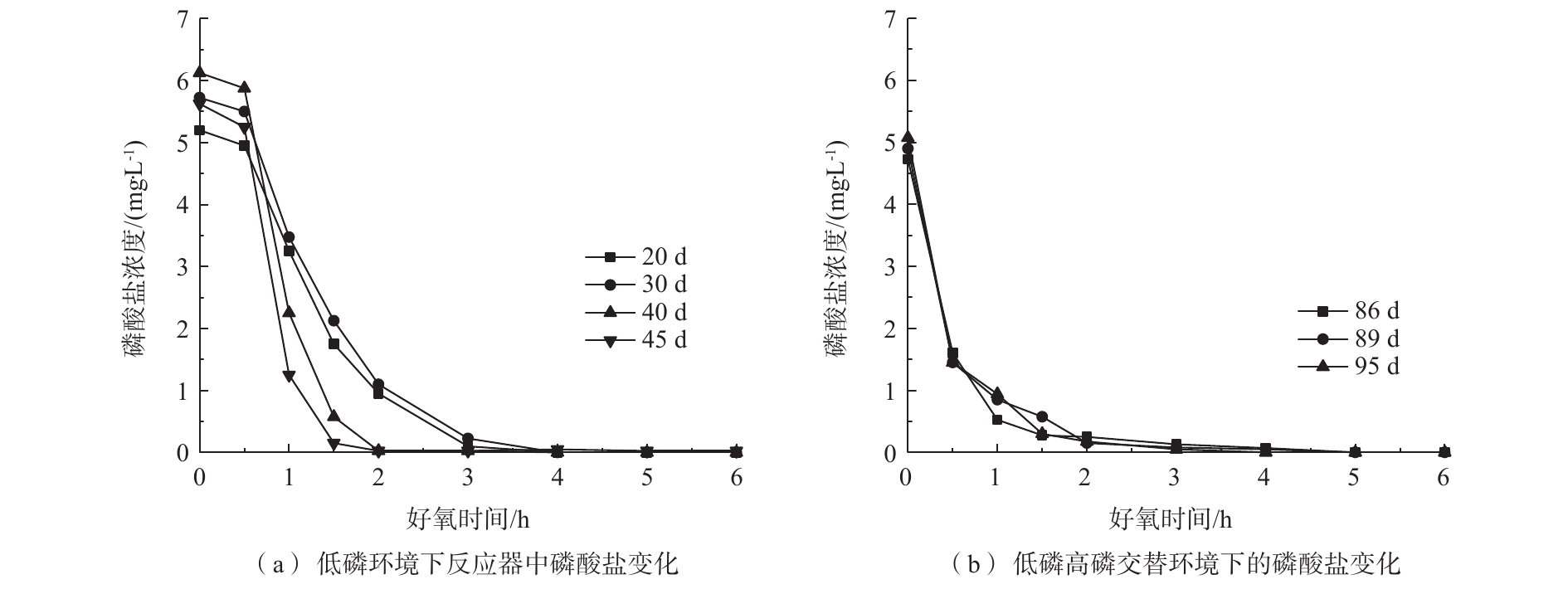
PO3−4 -P为5 mg·L−1。由图2(a)可知,在低磷环境下,随着反应器的运行,好氧阶段生物膜的吸磷速率逐渐变快,第45天时悬浮填料聚磷生物膜仅需1.5 h便可将磷酸盐浓度降低至0.15 mg·L−1;从图2(b)可以发现,低磷高磷交替环境下的悬浮填料聚磷生物膜也可在2 h内快速吸磷并使出水达标排放,具有良好的磷酸盐去除能力。在图3(a)中,在低磷环境下,运行稳定后,好氧出水磷酸盐浓度稳定在0.5 mg·L−1以下;由图3(b)可以看出,低磷高磷交替环境下的一个典型周期(以第81~95天为例)内,好氧出水磷酸盐浓度基本稳定在0.5 mg·L−1以下。图3的厌氧进水水质为200 mg·L−1 COD、0 mg·L−1
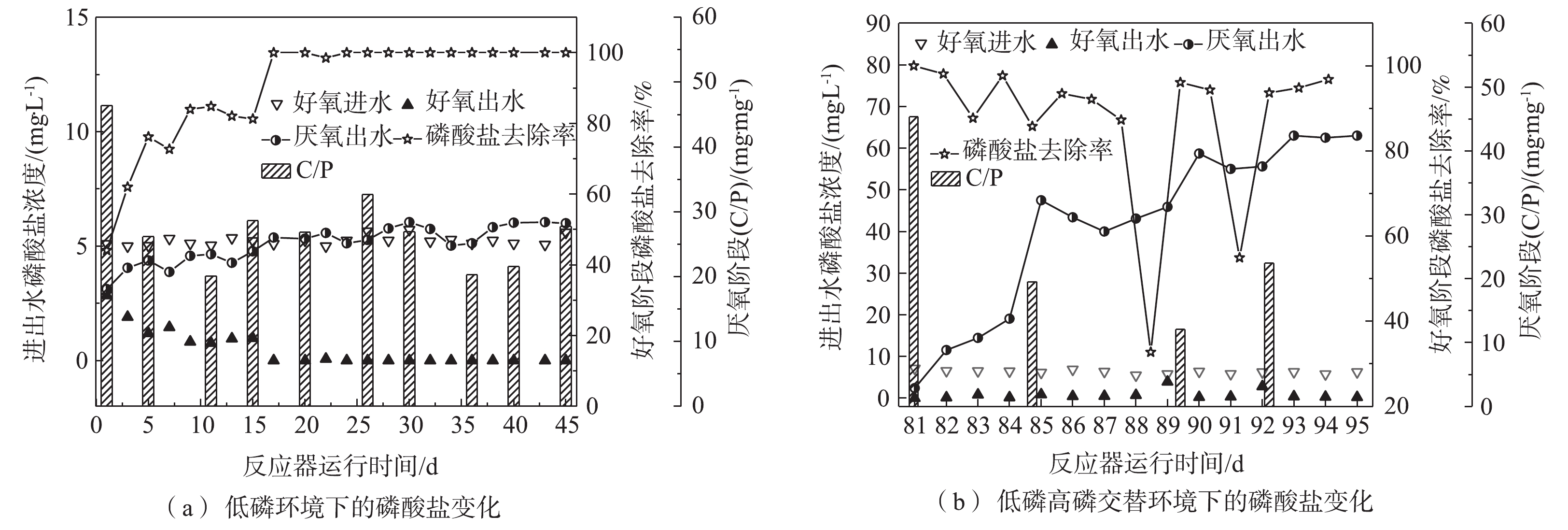
PO3−4 -P。由图3可知,低磷环境下厌氧阶段的释磷能力不断加强,最大释磷量为6.05 mg·L−1,在此期间,厌氧阶段C/P(消耗的COD量/释放的磷酸盐量)平均为24.84 mg·mg−1;低磷高磷交替环境下,厌氧进水在15 d内被重复利用(后简称富磷溶液),富磷溶液的磷酸盐浓度在15 d内逐渐增大,达到63 mg·L−1后趋于稳定,在此期间,C/P平均为27.74 mg·mg−1。在低磷环境中,同步去除与富集磷酸盐工艺的磷酸盐去除率基本稳定在98%以上,且其释磷能力不断加强;而在低磷高磷交替环境下,该工艺的磷酸盐去除能力受到了富磷溶液浓度的影响,该工艺前期对磷酸盐的去除率达到85%以上,厌氧阶段磷酸盐不断得到释放,富磷溶液达到了47 mg·L−1,之后富磷溶液的浓度出现了短期内变化幅度较小的现象。与此同时,好氧阶段磷酸盐的去除率下降至32%~54%。由此可见,聚磷生物膜的释磷能力与细胞外界的磷酸盐浓度密切相关。当富磷溶液中的磷酸盐浓度较高时,释磷能力会受到细胞内外磷酸盐浓度差太小的影响,导致富磷溶液磷酸盐浓度难以上升。有研究[8]表明,聚磷菌能够在好氧阶段吸收多于自己生长所需的磷,并以多聚磷酸盐颗粒的形式储存于体内。当聚磷生物膜进入蓄磷阶段,并且生物膜体内的磷酸盐量积累到一定程度时,聚磷菌细胞内外的磷酸盐浓度差增大,聚磷生物膜再次释磷,从而导致富磷溶液的磷酸盐浓度再次上升。
-
第0、45和95天的污泥扫描电子显微镜(SEM)表征结果如图4所示。在第0天的污泥中,可以观察到存在大量的胞外聚合物(EPS),通过相互作用与细胞结合在一起,此时有多种形态的微生物并存。第45天,聚磷生物膜的生长环境为低磷环境,此时反应器具有良好的除磷能力,好氧出水在0.5 mg·L−1以下,符合国家磷酸盐排放标准[9],污泥中存在较多的短杆菌和少量的球菌,污泥形态上逐渐均一化,此时杆菌正处于生长阶段,且优势菌种得到富集。第95天,生长环境为低磷高磷交替环境,在满足好氧出水达标排放的同时,富磷溶液的磷酸盐浓度为63 mg·L−1,污泥中长杆菌数量明显增加,仅存在少量的球菌,轮廓较为清晰,低磷高磷交替的生长环境对聚磷菌存在一定的筛选作用。CAO等[10]也指出聚磷菌主要为杆状和球状,与本研究结果一致。
-
1)聚磷生物膜的微生物多样性和丰富度。采用16S rDNA的测序方法,对聚磷生物膜运行过程中的微生物多样性和丰富度进行了评价。如表1所示,第0、45和95天的有效序列数分别为59 711、73 249和126 462。各样品的OTU数分别为52 736、64 715和92 618。第0、45和95天的覆盖率在0.995 0与0.996 4之间,所获得的结果可以说明样品中的微生物多样性。Shannon多样性指数可以说明样品中的物种丰富度,可见接种污泥中的物种丰富度最高(Shannon=7.781 0),第95天的物种丰富度最小(Shannon=5.630 7)。ACE、Chao和Simpson指数同样说明第95天的物种分布最为简单。第0、45和95天的种群变化表明,不同的磷酸盐生长环境会影响反应器中的微生物丰富度和多样性。
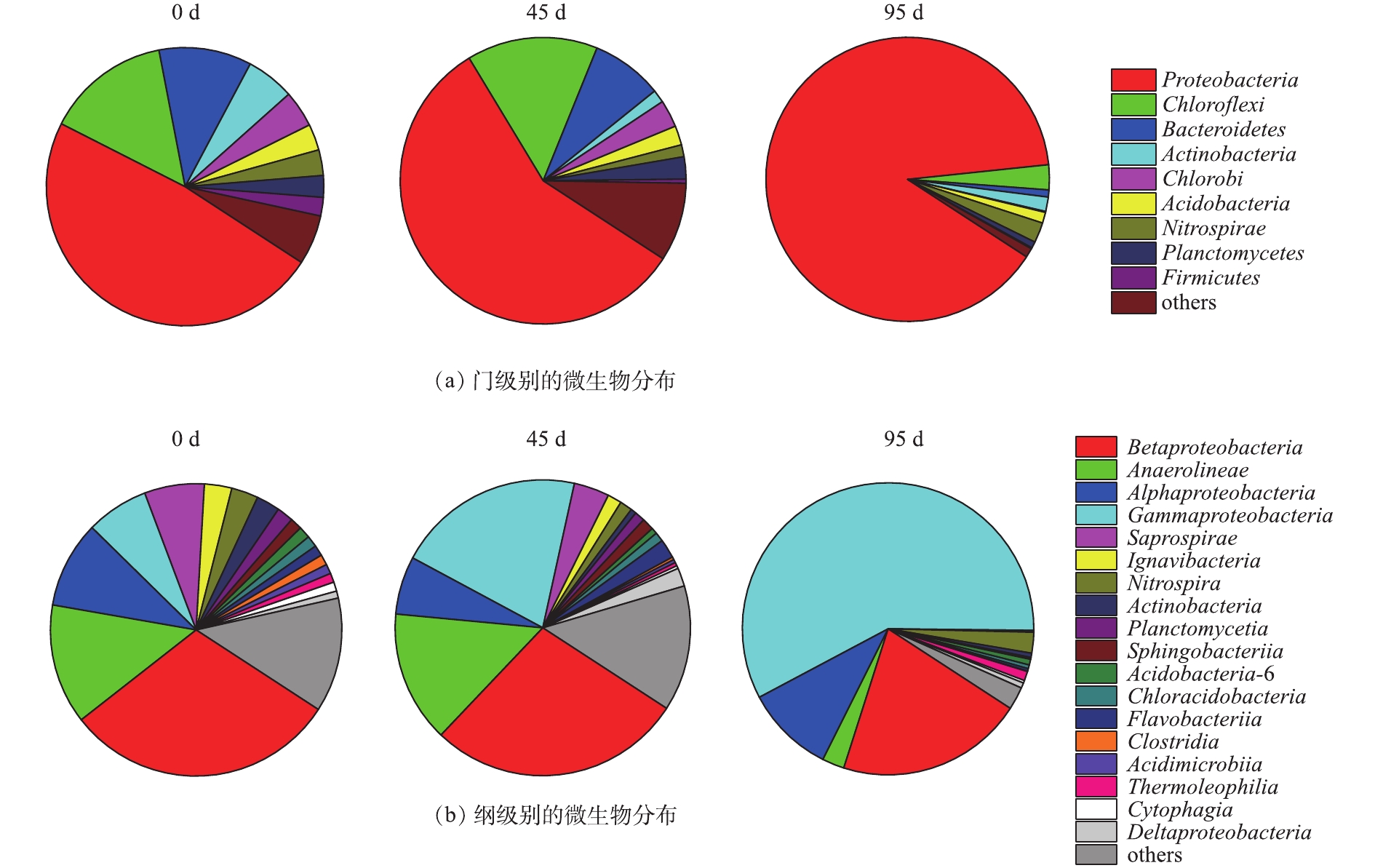
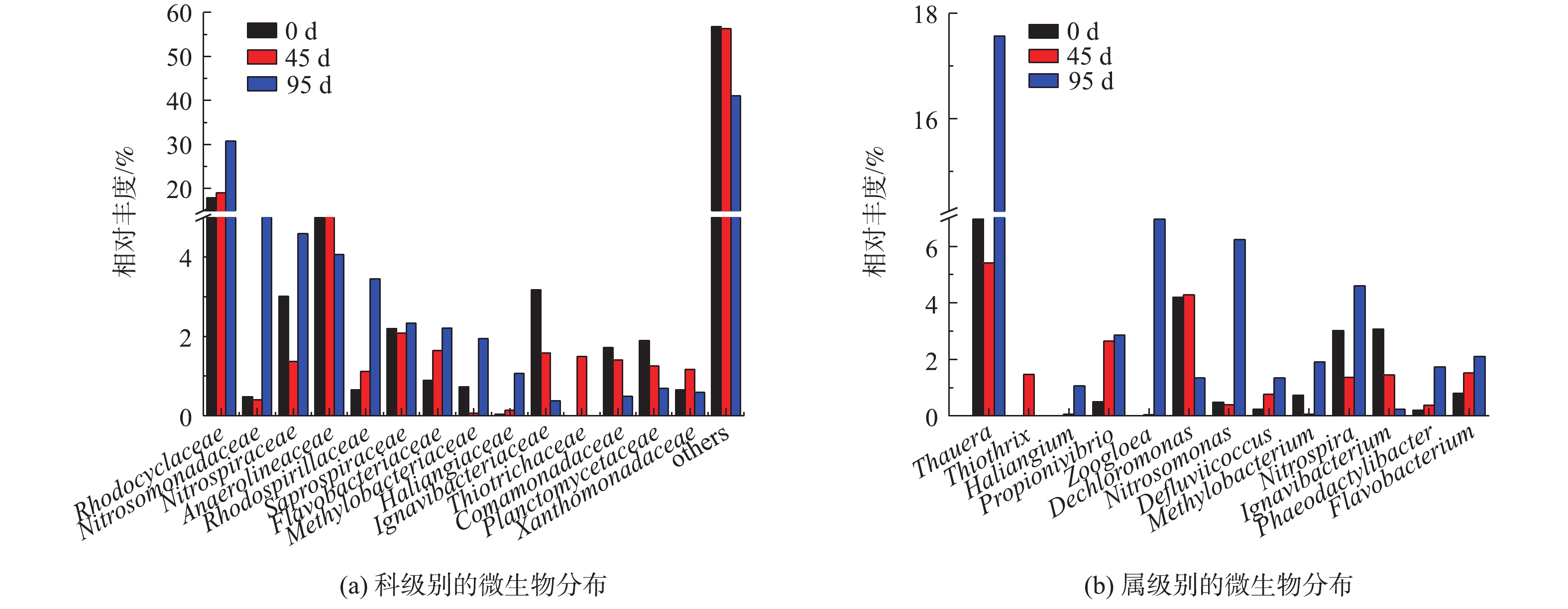
2)细菌种群特性分析。测序结果显示,在不同的生长环境下,聚磷生物膜中共同存在着一些微生物。第0、45和95天的样品在门级共有的OTUs主要有变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)和厚壁菌门(Firmicutes)。
从门、纲2个水平对生物膜上的微生物群落进行分析,结果如图5所示。这3个污泥样品中相对丰度大于3%的门为变形菌门(48.3%、57.1%、89.1%)、绿弯菌门(14.5%、14.8%、2.8%)、拟杆菌门(10.8%、8.1%、0.8%)、绿菌门(4.2%、3.1%、0.1%),其中,变形菌门是3个污泥样品中最丰富的门。夏雪等[11]研究发现,使用不同碳源驯化得到的除磷污泥中变形菌门是最丰富的门。NGUYEN等[12]研究发现,变形菌门内的部分细菌具有在降解有机物的同时完成脱氮除磷的功能。在同步去除与富集磷酸盐的悬浮填料生物膜工艺中,变形菌门可能为潜在的聚磷菌。
在纲的水平上,第0、45和95天的γ-变形菌纲(Gammaproteobacteria)的相对丰度从6.9%上升至20.6%和57.9%,β-变形菌纲(Betaproteobacteria)的相对丰度从30.2%下降至27.9%和20.7%。在同步去除与富集磷酸盐的悬浮填料生物膜工艺中,主要的微生物属于γ-变形菌纲,这与强化生物除磷系统中主要微生物属于β-变形菌纲不同,可见生物膜系统与活性污泥系统中,存在不同种类的聚磷菌。
如图6所示,在科的水平上,相对丰度大于3%的有红环菌科(Rhodocyclaceae)、厌氧绳菌科(Anaerolineaceae)、亚硝化单胞菌科(Nitrosomonadaceae)、硝化螺旋菌科(Nitrospiraceae)、红螺菌科(Rhodospirillaceae)。红环菌科(Rhodocyclaceae)在运行过程中相对丰度逐渐增大(分别为18.1%、19.0%和30.8%),成为了反应器中相对丰度最大的科。据报道,目前被认可的聚磷菌大多属于红环菌科(Rhodocyclaceae)[13]。ZILLES等[14]的研究也发现,红环菌科(Rhodocyclaceae)是生物强化除磷系统中的优势聚磷菌,具有良好的除磷效果。测序结果证明,红环菌科(Rhodocyclaceae)是同步去除与富集磷酸盐的悬浮填料生物膜工艺中的优势菌群。
在属的水平上,反应器中的主要属类为陶厄氏菌属(Thauera)。在运行过程中,陶厄氏菌属(Thauera)、亚硝酸菌属(Nitrosomonas)、硝化螺旋菌属(Nitrospira)的相对丰度有所增加,这可能是由于微生物的生长导致生物膜逐渐变厚。在好氧阶段,氧气通过扩散作用能够进入到悬浮填料生物膜的一定深度处,生物膜外层处于好氧环境,亚硝酸菌属(Nitrosomonas)[15]、硝化螺旋菌属(Nitrospira)[16]等发生硝化作用产生硝酸盐,此时生物膜内层处于缺氧环境,陶厄氏菌属(Thauera)[17]等反硝化细菌吸收硝酸盐进行反硝化作用[18]。测序结果显示,动胶菌属(Zoogloea)是同步去除与富集磷酸盐的悬浮填料生物膜工艺中的主要功能菌。动胶菌属(Zoogloea)属于假单胞科(Pseudomonadaceae),是革兰氏阴性杆菌,属于兼性好氧细菌,能够将吸收的磷以多聚偏磷酸盐的形式贮存在细胞中[19]。动胶菌属(Zoogloea)也是活性污泥法强化除磷系统中的主要功能菌。在同步去除与富集磷酸盐的生物膜工艺中,动胶菌属的相对丰度不断增加,可见低磷高磷交替的生长环境比低磷的生长环境更适合聚磷菌的富集。
-
1)在低磷环境下,反应器好氧出水磷酸盐浓度稳定在0.5 mg·L−1以下,具有良好的磷酸盐去除能力,厌氧阶段的最大释磷量为6.05 mg·L−1,具有良好的磷酸盐释放能力;在低磷高磷交替的生长环境中,好氧出水磷酸盐浓度基本在0.5 mg·L−1以下,厌氧富磷溶液浓度最高可达63 mg·L−1,能够做到同步去除与富集磷酸盐。
2)杆菌是同步去除与富集磷酸盐的悬浮填料生物膜工艺中的优势菌群。反应器中的主要功能菌是动胶菌属(Zoogloea)。变形菌门是同步去除与富集磷酸盐的悬浮填料生物膜工艺中相对丰度最大的门,高达89.1%。γ-变形菌纲的相对丰度为57.9%,同步去除与富集磷酸盐的悬浮填料生物膜工艺中的优势菌种是红环菌科(Rhodocyclaceae),相对丰度为30.8%。
3)在悬浮填料生物膜工艺中,低磷高磷交替的生长环境下培养的聚磷生物膜能够使好氧出水磷酸盐达到国家排放标准,并在厌氧阶段得到高浓度的磷酸盐富集溶液,且这种生长环境更适合聚磷微生物的生长。
2种磷酸盐生长环境对同步去除与富集磷酸盐工艺的影响
Effects of two phosphate growth environments on simultaneous removal and enrichment of phosphate
-
摘要: 针对同步去除与富集磷酸盐溶液的问题,研究了在低磷环境和低磷高磷交替环境下悬浮填料生物膜反应器的除磷能力和释磷能力,采用扫描电子显微镜(SEM)和高通量测序对第0、45和95天的污泥进行了表征。结果表明:低磷环境下好氧出水磷酸盐浓度稳定在0.5 mg·L−1以下,厌氧阶段的最大释磷量为6.05 mg·L−1;在低磷高磷交替环境中,好氧出水磷酸盐浓度基本在0.5 mg·L−1以下,富磷溶液浓度最高可达63 mg·L−1。SEM结果表明,同步去除与富集磷酸盐的悬浮填料生物膜反应器中的主要微生物是杆状菌。高通量测序结果表明:第0、45和95天的变形菌门(Proteobacteria)的相对丰度分别为48.3%、57.1%和89.1%,占主导地位;而红环菌科(Rhodocyclaceae)的相对丰度分别为18.1%、19.0%和30.8%,是反应器中的优势菌科;动胶菌属(Zoogloea)是同步去除与富集磷酸盐的悬浮填料生物膜工艺中的主要功能菌。在悬浮填料生物膜工艺中,低磷高磷交替的生长环境下培养的聚磷生物膜能够使好氧出水的磷酸盐浓度达到国家排放标准,并在厌氧阶段得到高浓度的磷酸盐富集溶液,且这种生长环境更适合聚磷微生物的生长。
-
关键词:
- 同步去除与富集磷酸盐 /
- 微生物生长环境 /
- 生物膜 /
- 高通量测序
Abstract: The aim of this study was to simultaneously remove and enrich phosphate solutions. The phosphorus removal and release capacity of suspended packed biofilm reactor in low concentration phosphate environment or continuous alternation environment of aerobic low concentration phosphate and anaerobic high concentration phosphate were studied. Sludge samples taken from 0, 45 and 95 d were characterized by SEM and high-throughput sequencing. The results showed that the phosphate concentration of aerobic effluent was below 0.5 mg·L−1 and the maximum phosphorus release was 6.05 mg·L−1 in the low phosphorus environment. In the low phosphorus concentration and high phosphorus concentration alternating environment, most of the phosphate concentration of aerobic effluent was below 0.5 mg·L−1, and the concentration of anaerobic phosphate concentrate was up to 63 mg·L−1. The SEM images showed that the main microorganisms in the suspended packed biofilm reactor for simultaneous removal and enrichment of phosphoric acid were bacilli. The result of high-throughput sequencing showed that the relative abundance of Proteobacteria on 0, 45 and 95 d were 48.3%, 57.1% and 89.1%, respectively, and it was dominant bacteria phylum. The relative abundances of Rhodocyclaceae were 18.1%, 19.0% and 30.8%, respectively, which was the dominant bacteria family in the reactor. Zoogloea was the main functional bacterium. In the suspended packing biofilm process, phosphorus accumulating bacteria cultured in alternate growth environment of low phosphorus and high phosphorus could lead to phosphate content in aerobic effluent which meets the national discharge standard, and could obtain high concentration phosphate enrichment solution in anaerobic phase. This growth environment was more suitable for the growth of phosphorus-accumulating microorganisms. -
我国幅员辽阔,湖泊众多,全国1 km2以上的湖泊有2 759个,总面积达91 019 km2,占国土面积的0.95%[1]。近年来,随着社会发展和人们生活水平的不断提高,城市建设越来越强调生态元素及理念,因此建设了大量的水体景观工程,即人工湖[2]。城市小型湖泊及人工湖能够影响城市微气候,促进物质和能量循环并参与生物修复过程,还具重要的美学和娱乐价值[2-3],以及重要的生态意义[4-5]。然而,这类湖泊通常水域面积较小、水深较浅、流速小、污染源受纳量较高且自净能力有限,容易出现水体富营养化[6-9]。近5年来,我国城市湖泊富营养化日趋严重,浮游藻类大量繁殖会破坏湖泊原有的自然景观,限制城市旅游业的发展,也降低了人民群众的幸福感[5]。
富营养化城市湖泊的治理已成为国内外学者广泛关注的焦点。自20世纪80年代初开始,国内外学者就开展了湖泊生态治理的实践研究。经过近40年的发展,底泥疏浚、人工曝气、水生植物种植等[10-13]生态治理技术得到广泛应用,且均取得了一定成效。但在实际应用中还需要依据每个湖泊的特点,因地制宜地选择相应的某种或者多种生态治理技术对湖泊进行治理。
温州大学明心湖是一个小型人工湖,占地面积约20 000 m2,平均水深0.50 m,因在湖中养有黑天鹅等水禽,又称“天鹅湖”。近年来,明心湖水体富营养化问题日趋严重,湖水透明度低且TN、TP、COD等多项指标高于地表Ⅴ类标准,浮游植物大量繁殖聚集而形成水华。为提升明心湖景观、改善水质,学校于2020年4~5月实施了疏浚、曝气以及水生植物种植等多项生态治理措施。为探究此次生态治理工程的治理效果,本研究分别对工程治理前后的水质及浮游生物群落结构变化进行了为期6个月的连续监测,对明心湖的主要水源温瑞塘河河道进行了同步监测并以此作为对照进行对比分析;在对生态治理工程治理前后明心湖水质及浮游生物群落结构变化的监测分析的基础上,评估生态治理工程对小型富营养化湖泊的治理效果,旨在为此类小型人工湖的日常维护与生态治理治理提供参考样本和数据支持。
1. 研究区域与生态治理措施
1.1 研究区域
温瑞塘河位于瓯江以南、飞云江以北的温瑞平原,是温州市境内十分重要的河道水系。水源主要来自瞿溪、雄溪、郭溪以及大罗山和集云山的山涧溪流,整个流域面积740 km2,水面面积22 km2,灌溉面积3 213 km2。温瑞塘河水质满足Ⅳ类水要求的河段长度仅占15.0%,Ⅴ类及劣于Ⅴ类河段占85.0%,河床平均淤积层达0.8 m,最深达2.2 m,有大量的内源污染[14]。
明心湖位于浙江省温州市温州大学校园内,主要靠从旁边的温瑞塘河支流抽取河水进行补水。为了全面监治理前后明心湖水体理化指标及浮游生物群落的变化,在明心湖内设置了4个采样位点 ,分别为位点1# (27°55′02″N, 120°41′48″E)、位点2# (27°55′03″N, 120°41′46″E)、位点3# (27°55′03″N, 120°41′45″E)、位点4# (27°55′05″N, 120°41′44″E)。此外,由于明心湖补水主要从旁边的温瑞塘河抽取,所以在温瑞塘河河道内也设置了4个采样位点作为对照,分别为位点5# (27°55′12″N, 120°41′41″E)、位点6# (27°55′09″N, 120°41′46″E)、位点7#(27°55′05″N, 120°41′52″E)、位点8# (27°55′01″N, 120°41′57″E)。
1.2 明心湖生态治理措施
理治措施主要包括3方面: 将湖中水体排空,对湖底进行冲洗并清淤,厚度约0.20 m,清除明心湖底表层沉积物,防止沉积物中营养盐再次向上覆水体释放; 从温瑞塘河支流中抽取河水,经砂砾过滤后注入湖中,水深达到0.50 m左右,在湖底种植莲属植物(荷花、睡莲)、苦草和轮叶黑藻等水生植物,种植面积约占湖底面积的80%,以改善景观并利用水生植物吸收水体中的营养盐与污染物,净化水质并恢复水体生态功能; 禁养黑天鹅等水禽并采用喷泉曝气机进行曝气,以减少有机污染源并增加水体溶解氧含量,从而提高有机污染物的氧化降解速率。采用以上生态治理措施对明心湖治理后,温州大学明心湖的景观改善显著,水生植物生长状况良好、水生动物丰富度增加、生态系统质量优良。
2. 样品的采集与分析方法
2.1 样品的采集与处理
参照《水质采样方案设计技术规定:HJ 495—2009》和《水质采样技术指导:HJ 494—2009》的相关要求,依据《水质样品的保存和管理技术规定:HJ 493—2009》相关规范,采用便携式多参数水质分析仪 (HACHHQ40d,哈希,美国) 现场测定水温、pH、DO;采用便携式电导率仪 (DDBJ-350F,上海雷磁,中国) 现场测定电导率;采用塞氏黑白盘测定SD;采用丙酮法测定Chl-a质量浓度;采用重铬酸盐法测定COD;采用碱性过硫酸钾消解紫外分光光度法测定TN质量浓度;采用过硫酸钾消解钼酸铵分光光度法测定TP质量浓度;采用分光光度法测定NO3-N质量浓度;采用纳氏试剂分光光度法测定NH4+-N质量浓度;采用钼酸铵分光光度法测定PO43-P质量浓度。
2.2 浮游植物样品
浮游植物样品采集方法参照章宗涉等[15]的研究。在采集样品过程中,使用伸缩杆控制网孔直径为0.064 mm的25号浮游生物网,在水面以“∞”状拖动浮游生物网,重复多次。采集的水样装入50 mL聚乙烯样品瓶,加入样品体积2%~4%的甲醛溶液固定保存样品,用于浮游植物的定性检测。用采水器采集水样1 L,注入聚乙烯样品瓶中并加入15 mL鲁哥氏液 (Lugol’s solution) 及样品体积2%~4%的甲醛溶液混匀,用于浮游植物样品的固定保存与定量检测。浮游植物定量检测时,充分摇匀后,吸取0.1 mL水样置于0.1 mL浮游生物计数框内 (面积为20 mm×20 mm),在10×40倍光学显微镜下进行计数。浮游植物丰度的计算,见式 (1):
stringUtils.convertMath(!{formula.content}) (1) 式中:N为1 L水样中浮游植物个体数,个/mL(浮游动、植物细胞以“个”计数) ;V为水样体积 ,mL;Vs为浓缩样体积,mL;Va为计数体积,mL;n为计数所获得的个体数。浮游植物生物量浓度采用各种浮游植物的平均质量乘以丰度来计算,平均质量的计算参照《湖泊生态调查观测与分析》中的方法。
2.3 不同类群浮游植物相对丰度的确定
本研究采用Phyto-PAM浮游植物分析仪 (Heinz Walz GmbH,Effeltrich,Germany) 测定水样的Chl-a浓度,并将水样中的浮游植物按照蓝藻、绿藻、褐藻 (硅藻+甲藻) 种群进行群落类型的区分[16-18]。
2.4 浮游动物样品
使用伸缩杆控制25号浮游生物网做“∞”字形运动,缓慢拖动3~5 min,将样品用100 mL聚乙烯样品瓶收集,并立即加入样品体积3%~5%的甲醛溶液,用于浮游动物的定性检测。定量样品用2 L采水器采集,采集水样总计20 L。所有水样经25 号浮游生物网过滤后,用1 L聚乙烯样品瓶收集,之后加入甲醛溶液固定。带回实验室静置24 h,浓缩至100 mL后,倒置显微镜下鉴定并计数。浮游动物丰度的计算方法与浮游植物丰度的计算方法相同。浮游动物生物量浓度采用各类群浮游动物的平均质量乘以丰度来计算。平均质量参照《淡水浮游动物的定量方法》中的方法。
2.5 数据统计与分析
采用 SPSS 22.0软件对水质参数进行单因素方差分析 (One-way ANOVA),以检验各采样点之间水环境因子是否存在显著差异。采用OriginPro 2020进行浮游植物与水质相关性分并绘图。采用优势度 Y 来表征浮游动、植物种类结构特征,计算方法,见式 (2) :
stringUtils.convertMath(!{formula.content}) (2) 式中:N为样品中所有种的细胞总数;Ni为样品中第i种的细胞数;fi为第i种在各采样点出现的频率。取浮游生物优势度 Y ≥ 0.02为优势种[19]。
3. 结果与讨论
3.1 生态治理前后明心湖水质的变化
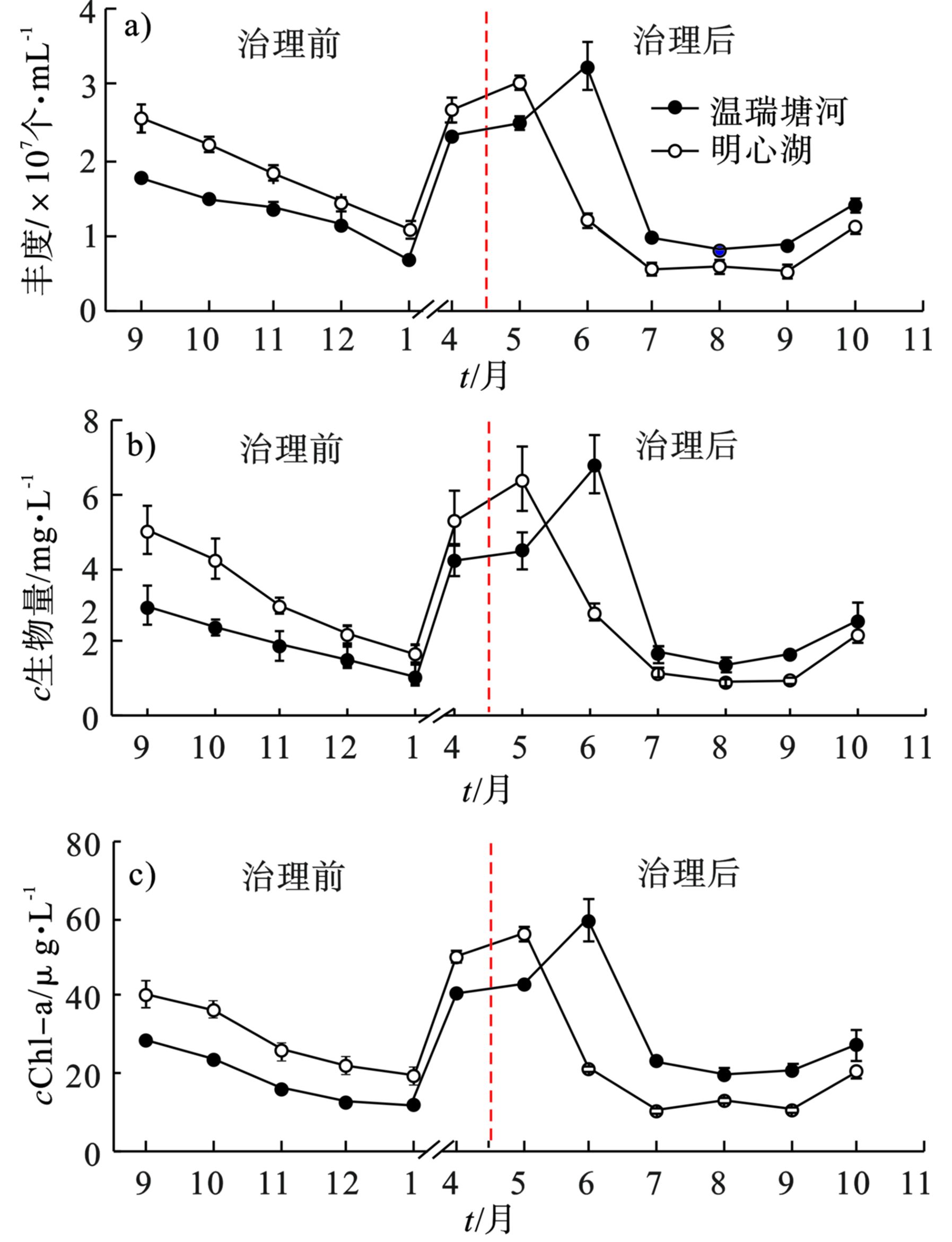
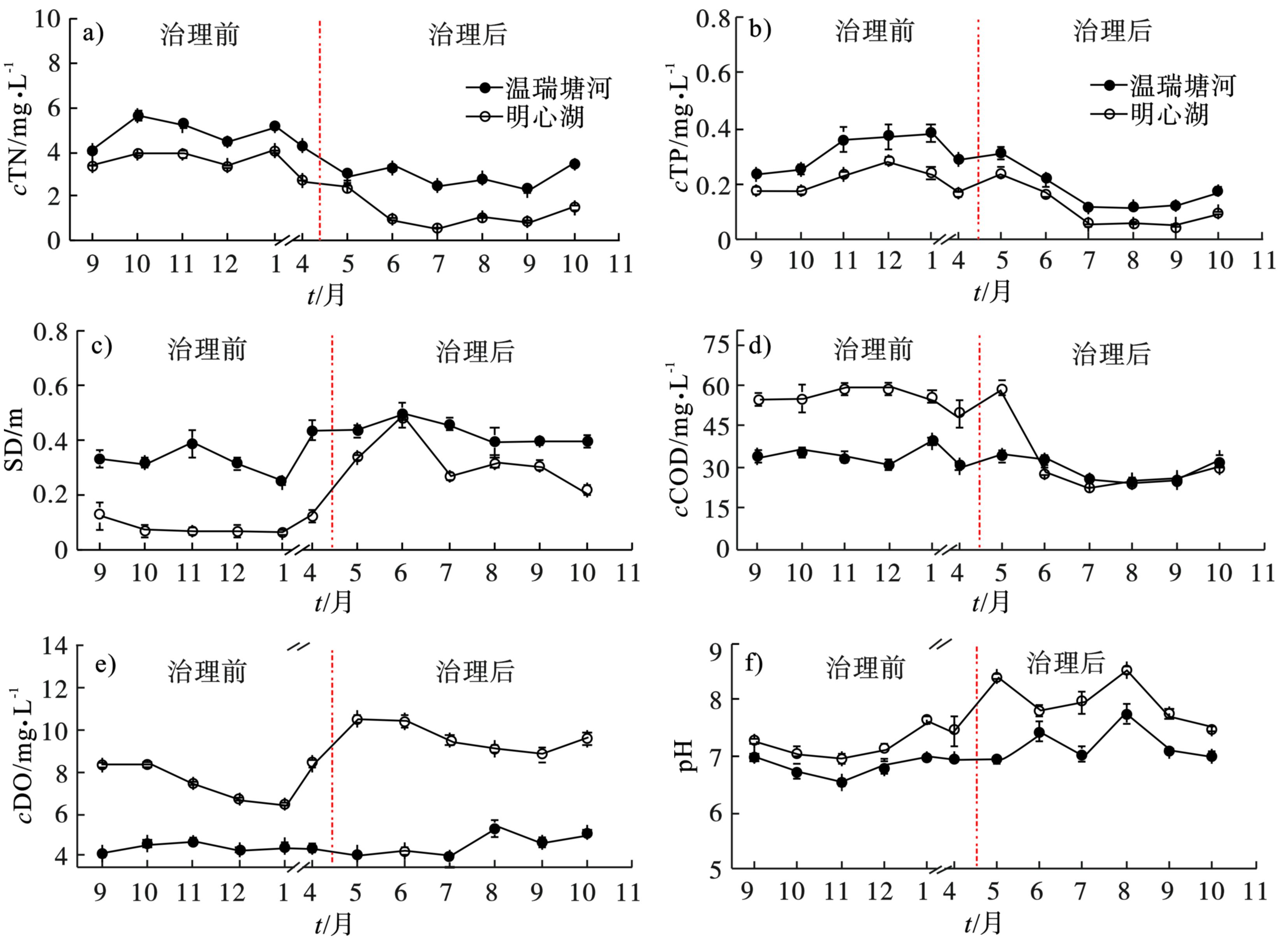
检测结果表明,生态治理后,明心湖水体透明度显著升高,有机污染物含量显著下降,水质明显改善。明心湖和温瑞塘河治理前水质的变化,见图1。
图1 可知,治理后,明心湖表层水体的COD、TN、TP显著 (P<0.05) 下降。根据《地表水环境质量标准:GB 3838—2002》,治理后明心湖水体的TN平均质量浓度由Ⅴ类水水平 (>2.00 mg/L) 降至Ⅱ类水水平 (0.50~1.00 mg/L);TP平均质量浓度由Ⅴ类水水平 (0.20 mg/L)降至Ⅲ类水水平 (0.05 mg/L);平均COD由Ⅴ类水水平 (>40.00 mg/L)降至Ⅲ类水水平(20.00~30.00 mg/L),显示出了较好的治理效果。已有研究[20]表明,水生植物种植等生态治理措施能有效去除水体中的重金属、营养盐、有机与无机污染物,从而使湖泊的水质得到改善。
此外,SD平均值由治理前的0.14 m上升至0.31 m以上,DO平均质量浓度由治理前的7.06 mg/L上升至10.53 mg/L,而pH平均值由7.28上升至8.10。SD的显著 (P<0.05) 提升可能与底泥疏浚与水生植物种植有关[21]。水生植物可以通过吸附和过滤作用,降低生物性和非生物性悬浮物,增加透明度,净化水质[22];此外,其还可通过与浮游植物竞争营养物质和生长空间,形成遮光效应并分泌克藻物质,可以很好地抑制浮游藻类的过量繁殖,减少水华的暴发,维持较高的生物多样性和健康的水环境[23]。生态治理后,明心湖水体的DO显著 (P<0.05) 升高,这可能与曝气及禁养水禽后水体中有机污染物含量降低有关。
3.2 生态治理前后明心湖浮游植物群落结构的变化
治理措施对明心湖浮游植物群落结构起到了改善作用。治理前后明心湖和温瑞塘河浮游植物的变化,见图2。
图2可知,治理前,明心湖中的浮游植物丰度、生物量和Chl-a质量浓度均显著 (P<0.05) 高于温瑞塘河,且变化趋势相似。治理前明心湖中的浮游植物的平均丰度为1.40×107 个/mL,平均生物量为3.14 mg/L,平均Chl-a质量浓度为28.34 µg/L;温瑞塘河中的平均浮游植物丰度为1.20×107 个/mL,平均生物量为3.37 mg/L,平均Chl-a质量浓度为18.25 µg/L。治理后,除5月份外,明心湖中的浮游植物丰度、生物量和Chl-a质量浓度均低于温瑞塘河,分别降低了17%、14%、18%。通常情况下,清洁水体中浮游植物的种类较多,而生物量较小[24-25]。治理后,明心湖中的浮游植物丰度、生物量及Chl-a质量浓度均显著 (P<0.05) 降低。已有研究[18, 26-27]表明,浮游植物丰度与水温、TN、TP、COD之间呈显著相关。
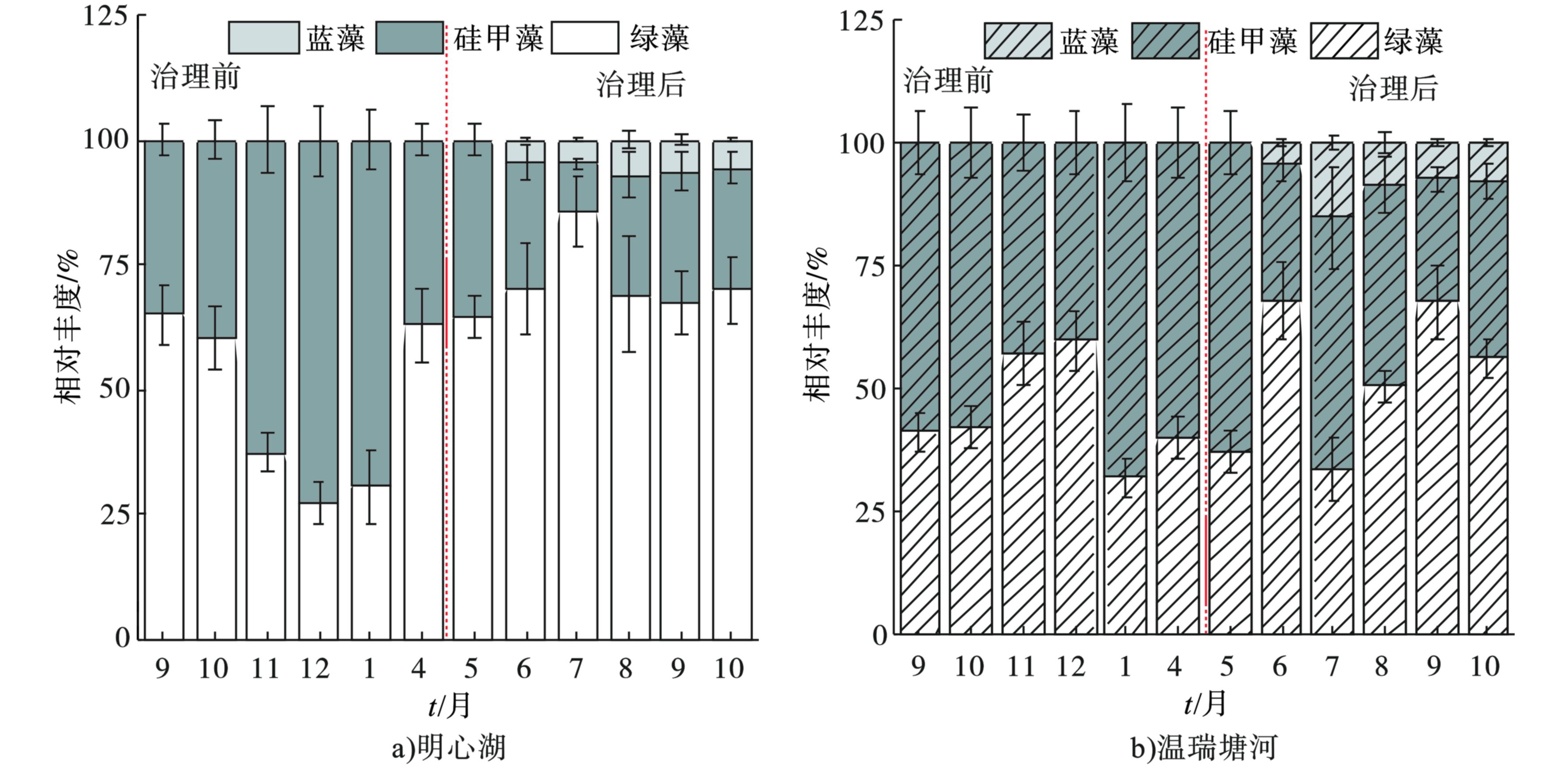
以不同类群浮游藻类即蓝藻、绿藻、硅藻的Chl-a含量与水体中总Chl-a含量的比值随时间的变化表示各种群相对丰度在一年中的消长状况,结果表明,明心湖和温瑞塘河的浮游植物全年以绿藻和硅藻为主,蓝藻主要在夏秋季出现,并且占比很小 。治理前后明心湖和温瑞塘河表层水体中浮游植物种群相对丰度的变化,见图3。
图3可知,治理前,明心湖和温瑞塘河的绿藻平均相对丰度分别为50%和45%,硅藻的平均相对丰度分别为50%和55%,未出现蓝藻。治理后,明心湖和温瑞塘河绿藻的平均相对丰度分别为69%和51%,硅藻的平均相对丰度分别为27%和42%,蓝藻的平均相对丰度分别为4%和7%。这表明生态治理后明心湖的水体更适宜绿藻生长。此外,明心湖和温瑞塘河全年的浮游植物群落类型为绿藻-硅藻型。
治理后,明心湖中绿藻种群的相对丰度显著增加 。监测结果表明,治理后绿藻单角盘星藻和空球藻的丰度和优势度显著 (P<0.05) 增加 ,见表2。文献[28-30]表明,曝气引起的浮游植物在垂直方向上的重新分布有利于浮游植物获取光和营养,能够显著提升绿藻和硅藻种群的生长。一般来说,硅藻的最佳生长温度为5~20 ℃ ,绿藻为15~30 ℃,而蓝藻在温度30 ℃以上也可以较好地生长[31-32]。因此,在春夏季节交替时,随着水温的升高,绿藻丰度会增加[33-34],相对丰度也会相应提高。治理前后,明心湖浮游植物种类数变化微小,且与温瑞塘河一致性较强。这可能是由于明心湖经常抽取温瑞塘河的河水进行补水所致。有研究[35-36]表明,引水水源与湖泊水质和浮游生物有显著相关性。而明心湖和温瑞塘河均在夏秋季节出现少量蓝藻,这也与已有的研究结果[18]一致。
表 2 治理前后明心湖和温瑞塘河浮游动物优势种及其优势度的变化门类 优势种 治理前 治理后 明心湖 温瑞塘河 明心湖 温瑞塘河 轮虫 矩形龟甲轮 Keratella quadrata 0.05 0.06 0.04 0.20 针簇多肢轮 Polyarthra trigla 0.12 0.20 0.13 0.05 壶状臂尾轮 Brachionus urceus 0.20 - 0.02 0.03 晶囊轮 Asplanchna 0.06 0.08 0.06 0.11 真翅多肢 Polyarthra euryptera - 0.08 0.03 0.06 截头皱甲轮 Ploesoma truncatum - 0.04 0.02 0.11 长三肢轮 Filinia longiseta - - 0.04 0.05 脾状四肢轮 Tetramastix opoliensis - - 0.11 0.04 圆筒异尾轮 Trichcerca cylindrica - - 0.05 - 萼花臂尾轮 Brachionus calyciflorus 0.02 0.04 0.03 0.11 独角聚花轮 Conochilus unicornis - - - 0.06 枝角类 长肢秀体 Diaphanosoma leuchtenbergianum 0.08 0.07 0.03 0.04 微型裸腹 Moina micrura - 0.04 0.17 - 多刺裸腹 Moina macrocopa 0.03 0.03 0.04 0.03 长额象鼻 Bosmina longirostris 0.02 0.09 0.06 0.08 平突船卵 Scapholeberis kingi 0.21 - - - 桡足类 近邻剑水 Cyclops vicinus 0.02 0.03 0.03 0.03 广布中剑水 Mesocyclops leuckarti 0.02 0.06 0.03 0.06 注:“-”表示优势度未达到0.02。 治理前后,明心湖与温瑞塘河的浮游植物优势种均为硅藻和绿藻。治理前后明心湖和温瑞塘河浮游植物优势种及其优势度的变化,见表1。
表 1 治理前后明心湖和温瑞塘河浮游植物优势种及其优势度的变化门类 优势种 治理前 治理后 明心湖 温瑞塘河 明心湖 温瑞塘河 硅藻门 脆杆 Fragilaria sp. 0.04 0.07 0.02 0.09 针杆 Synedra sp. 0.03 0.06 0.02 0.04 桥弯 Cyclotella sp. 0.02 0.03 - - 异极 Gomphonema sp. 0.03 0.02 0.02 - 变异直链 Aulacoseira varians 0.04 0.06 0.03 0.03 小环 Cyclotella sp. 0.04 0.06 0.04 0.03 舟形 Navicula sp. 0.04 - - 0.02 颗粒直链 Aulacoseira granulate 0.09 0.09 0.09 0.09 绿藻门 衣 Chlamydomonas sp. 0.02 0.04 0.03 0.03 空球 Eudorina sp. 0.03 - 0.09 - 弓形 Schroederia sp. 0.02 - 0.02 - 小球 Chlorella sp. - 0.03 0.02 0.02 针形纤维 Ankistrodesmus acicularis 0.03 0.03 0.02 - 单角盘星 Pediastrum simplex 0.06 - 0.09 0.05 二形栅 Scenedesmusdimorphus 0.02 0.04 0.02 - 二尾栅 Scenedesmus bicauda 0.02 0.03 - - 四尾栅 Scenedesmus quadricauda 0.04 0.05 0.03 0.03 四足十字 Crucigenia tetrapedia 0.03 - - - 新月 Closterium sp. 0.03 0.03 0.02 - 纺锤 Elakatothrix sp. - - - 0.02 鼓 Cosmarium sp. 0.04 0.03 0.02 0.02 隐藻门 隐 Cryptomonas sp. 0.05 0.05 0.03 - 裸藻门 裸 Euglena sp. - 0.07 - 0.03 梭形裸 Euglena acus - 0.06 - 0.08 裸囊 Trachelomonas sp. 0.02 0.04 - 0.04 蓝藻门 隐球 Aphanocapsa sp. - 0.05 - 0.04 注:“-”表示优势度未达到0.02。 表1可知,治理前,明心湖中优势度最大的浮游植物是颗粒直链藻 (Aulacoseira granulate) 和单角盘星藻 (Pediastrum simplex)、空球藻 (Eudorina sp.);温瑞塘河中优势度最大的浮游植物是脆杆藻 (Fragilaria sp.)和颗粒直链藻。治理后,明心湖与温瑞塘河浮游植物优势种仍有很多是相同的,包括脆杆藻、针杆藻 (Synedra sp.)、桥弯藻 (Cyclotella sp.)、变异直链藻 (Aulacoseira varians)、小环藻 (Cyclotella sp.)、衣藻 (Chlamydomonas sp.)、四尾栅藻 (Scenedesmus quadricauda)和鼓藻 (Cosmarium sp.) 等。但是优势度有较大差别,其中明心湖中脆杆藻和针杆藻的优势度显著 (P<0.05) 低于温瑞塘河。治理后,明心湖裸藻的优势度显著 (P<0.05) 降低,而单角盘星藻和空球藻优势度显著 (P<0.05) 增加。
3.3 生态治理前后明心湖浮游动物群落结构的变化
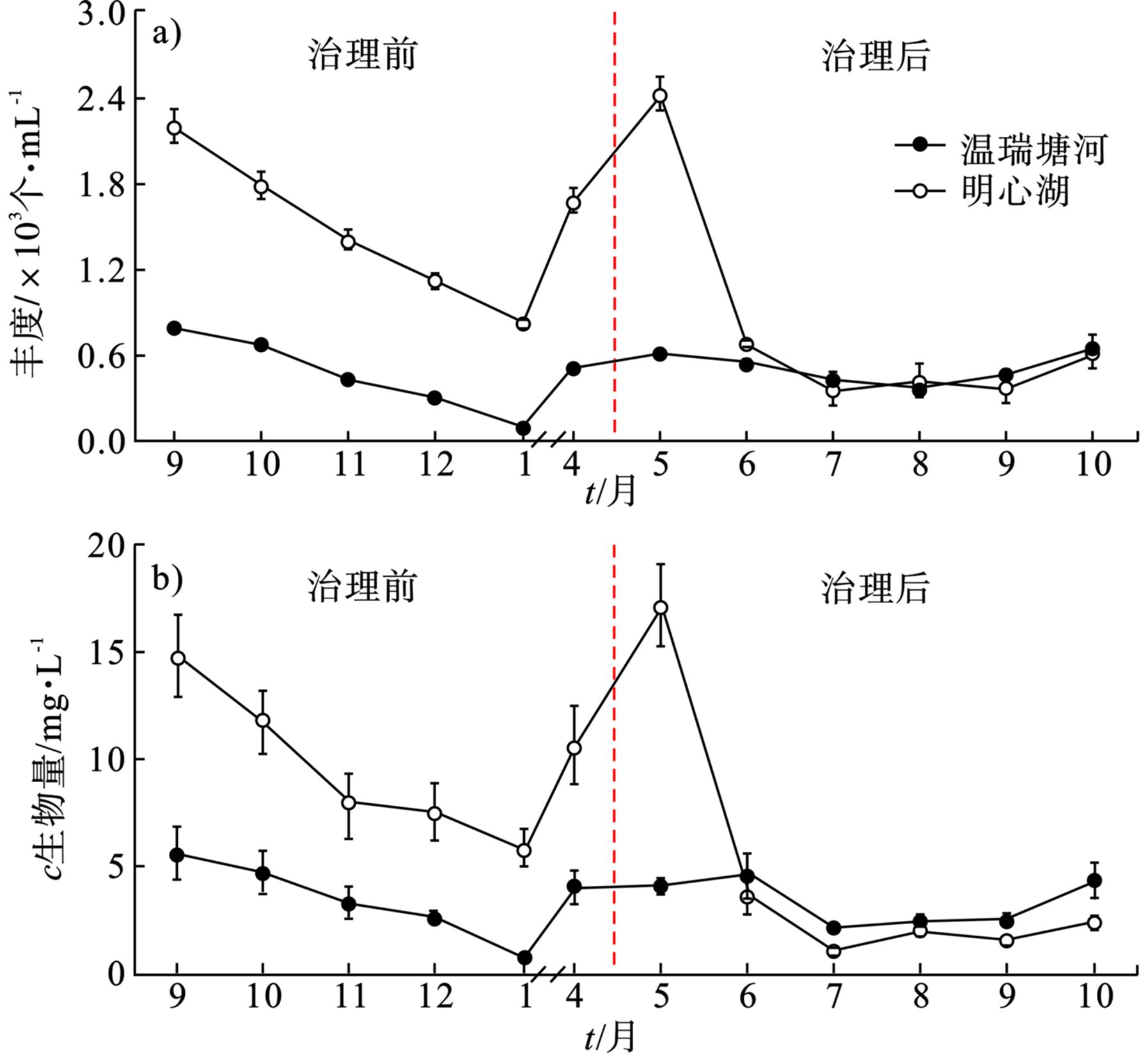
治理后明心湖浮游动物的丰度与生物量显著 (P<0.05) 降低 ,并且与水体中浮游植物丰度的变化趋势一致。治理前后明心湖和温瑞塘河中浮游动物丰度和浓度的变化,见图4。
治理前,明心湖中的浮游动物丰度 (图4a) 和生物量 (图4b) 均显著 (P<0.05) 高于温瑞塘河,其平均丰度分别为1 508.00和486.00个/L,平均生物量分别为9.60和3.47 mg/L。治理后,除了在5月份明心湖的浮游动物丰度和生物量显著 (P<0.05) 高于温瑞塘河外,其他月份均略低于温瑞塘河。治理后,明心湖和温瑞塘河中浮游动物的平均丰度分别为825.00和514.00个/L,平均生物量分别为4.63和3.25 mg/L。这可能与浮游动物种群丰度的变化主要受饵料供应调控有关[29, 37]。浮游动物是水体中较为敏感的环境指示生物[38],同时水体中其他环境因素 (如水温、溶解氧等,以及鱼类等) 对浮游动物的摄食压力都会对其群落结构产生重要影响[39-40]。
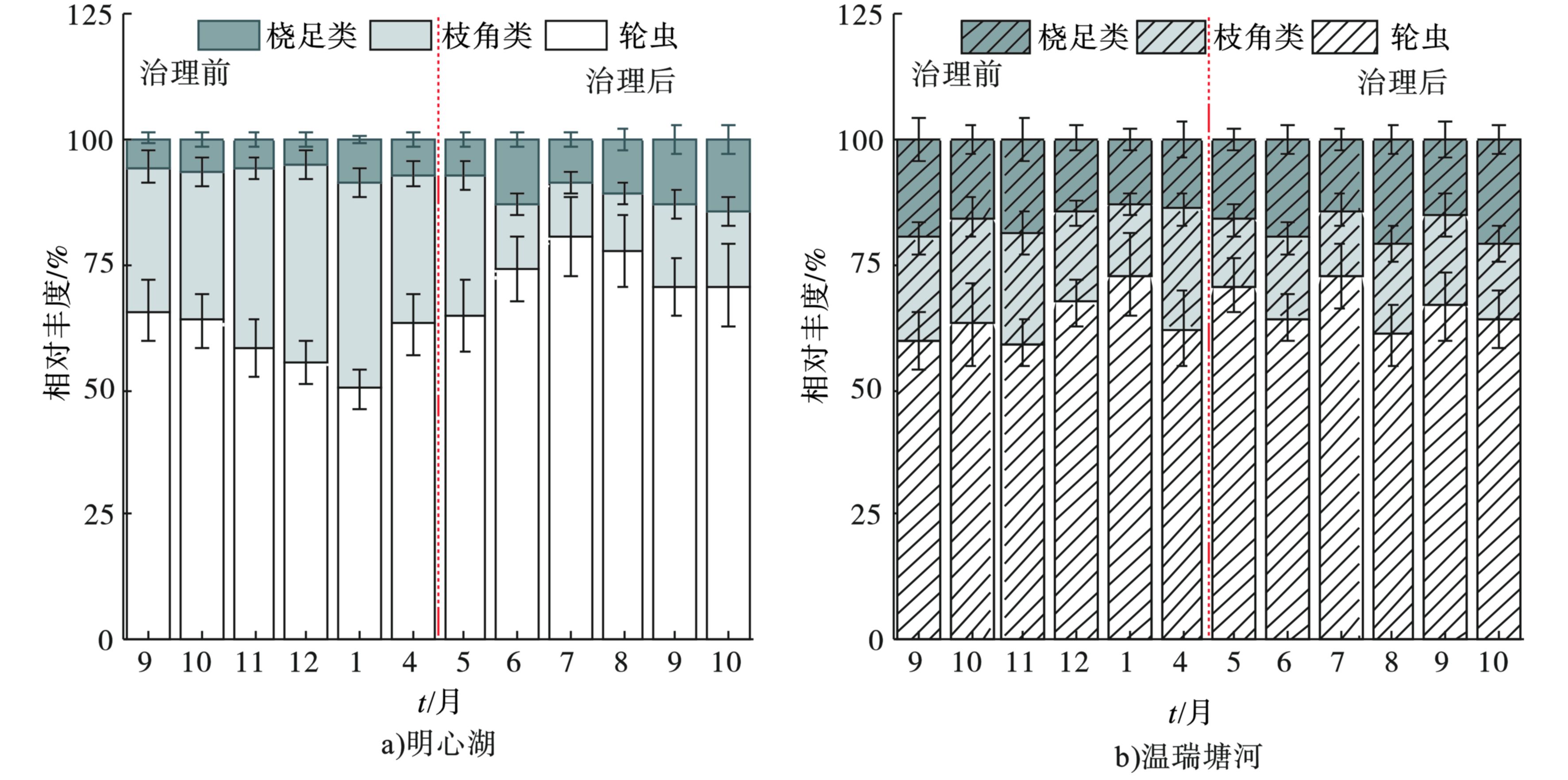
与温瑞塘河相比,治理后明心湖中的桡足类中近邻剑水蚤优势度显著增加。治理前后明心湖和温瑞塘河表层水体中浮游动物种群相对丰度的变化,见图5。
治理前,明心湖 (图5a) 与温瑞塘河 (图5b) 浮游动物相对丰度的变化均不显著 (P>0.05) ,且轮虫占比均较大。治理后,明心湖中桡足类占比有所增加,枝角类占比则有所降低,轮虫仍占绝对优势。治理前明心湖中桡足类、枝角类和轮虫类的平均相对丰度为7%、36%和57%,而治理后三者的平均相对丰度为11%、14%和75%。与之相对应,治理前,同一时段温瑞塘河中桡足类、枝角类和轮虫类的平均相对丰度为17%、22%和61%,而治理后同一时段三者的平均相对丰度为20%、15%和65%。
治理后,明心湖与温瑞塘河中浮游动物优势种的多样性有所增加。治理前后明心湖和温瑞塘河浮游动物优势种及其优势度的变化,见表2。
表2可知,治理前后,明心湖与温瑞塘河中浮游动物优势种均为轮虫和枝角类 ,且治理前后明心湖中优势度最大的浮游动物分别是平突船卵溞 (Scapholeberis kingi) 和螺形龟甲轮虫 (Keratella cochlearis);温瑞塘河中优势度最大的浮游动物分别是针簇多肢轮虫 (Polyarthra trigla) 和矩形龟甲轮虫 (Keratella quadrata)。治理前后,明心湖与温瑞塘河中相同的浮游动物优势种包括裂足臂尾轮虫 (Brachionus diversicornis)、裂痕龟纹轮虫 (Brachionus fissa)、螺形龟甲轮 、矩形龟甲轮虫、针簇多肢轮虫、萼花臂尾轮虫 (Brachionus calyciflorus)、长肢秀体溞 (Diaphanosoma leuchtenbergianum)、近邻剑水蚤 (Cyclops vicinus)和广布中剑水蚤 (Mesocyclops leuckarti)等。治理后,明心湖中枝角类平突船卵溞和长肢秀体溞的优势度显著 (P<0.05) 降低,而长额象鼻溞 (Bosmina longirostris) 和多刺裸腹溞 (Moina macrocopa) 的优势度有所增加。治理后,明心湖与温瑞塘河中浮游动物优势种的多样性有所增加,这可能与水质改善有关。水体富营养化会降低浮游动物的物种多样性,抑制非耐污种的生长[41-42]。治理前后,轮虫的相对丰度在温瑞塘河与明心湖中均占比较高 ,见图5,壶状臂尾轮虫 (Brachionus urceus) 优势度显著 (P<0.05) 降低。耐污的枝角类平突船卵溞、长肢秀体溞以及壶状臂尾轮虫丰度的优势度的降低(图5 b, 表3) 可能也与水质改善有关。枝角类作为浮游甲壳动物的一种,广泛分布在淡水中,经常在在富营养化的水体中大量暴发,当水体富营养化程度降低时,暴发情况会减弱[5, 43]。如耐污种微型裸腹溞,一定程度上可以作为判别水体富营养化程度的指示生物[44]。在对江苏省宜兴市的临溪河进行生态治理后,该水体中的轮虫优势种由治理前的壶状臂尾轮虫等耐污种转变为了针簇多肢轮虫等寡污种[45]。
4. 结论
(1)生态治理治理后,温州大学明心湖的水质得到了明显改善,COD、TN 、生物量和TP质量浓度显著降低,DO、SD和pH显著上升,表明生态治理对该类型湖泊的水质改善效果较好。
(2)治理后,浮游植物种类及优势种变化不显著,但浮游植物丰度、浓度和Chl-a质量浓度显著降低。同时,绿藻的相对丰度显著增加,单角盘星藻和空球藻等绿藻的优势度显著上升,表明治理后水质改善有利于绿藻的生长。
(3)治理后,浮游动物的丰度和生物量均显著降低,枝角类的相对优势度显著下降。而桡足类和轮虫类的相对丰度显著增加。这表明水质改善及浮游植物丰度的变化对浮游动物种群具有调控作用。
-
表 1 微生物种群丰度和多样性分析
Table 1. Species abundance and diversity ofmicrobial communities
时间 序列数 OTU数 ACE Chao Shannon Simpson 覆盖率 第0天 59 711 52 736 1 454.53 1 457.3 7.781 0 0.984 0.996 4 第45天 73 249 64 715 1 556.34 1 561.2 7.490 1 0.983 0.995 7 第95天 126 462 92 681 1 171.48 1 183.0 5.630 7 0.952 0.995 0 -
[1] HUTNIK N, KOZIK A, MAZIENCZUK A, et al. Phosphates (V) recovery from phosphorus mineral fertilizers industry wastewater by continuous struvite reaction crystallization process[J]. Water Research, 2013, 47(11): 3635-3643. doi: 10.1016/j.watres.2013.04.026 [2] 黄常青. MAP沉淀法回收化工废水中氮磷的研究[D]. 哈尔滨: 哈尔滨工程大学, 2017. [3] SLATER F R, JOHNSON C R, BLACKALL L L, et al. Monitoring associations between clade-level variation, overall community structure and ecosystem function in enhanced biological phosphorus removal (EBPR) systems using terminal-restriction fragment length polymorphism (T-RFLP)[J]. Water Research, 2010, 44(17): 4908-4923. doi: 10.1016/j.watres.2010.07.028 [4] TIAN Q, ONG S K, XIE X, et al. Enhanced phosphorus recovery and biofilm microbial community changes in an alternating anaerobic/aerobic biofilter[J]. Chemosphere, 2016, 144: 1797-1806. doi: 10.1016/j.chemosphere.2015.10.072 [5] 孟璇, 潘杨, 章豪, 等. 同步去除并富集磷酸盐生物膜驯化过程中微生物种群分析[J]. 环境科学, 2018, 39(6): 2802-2809. [6] KODERA H, HATAMOTO M, ABE K, et al. Phosphate recovery as concentrated solution from treated wastewater by a PAO-enriched biofilm reactor[J]. Water Research, 2013, 47(6): 2025-2032. doi: 10.1016/j.watres.2013.01.027 [7] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2016. [8] SEVIOUR R J, MINO T, ONUKI M. The microbiology of biological phosphorus removal in activated sludge systems[J]. FEMS Microbiology Reviews, 2003, 27(1): 99-127. doi: 10.1016/S0168-6445(03)00021-4 [9] 国家环境保护总局, 国家质量监督检验检疫总局.城镇污水处理厂污染物排放标准: GB 18918-2002[S]. 北京: 中国环境科学出版社, 2002. [10] CAO Y S, ALAERTS G J. Influence of reactor type and shear stress on aerobic biofilm morphology, population and kinetics[J]. Water Research, 1995, 29(1): 107-118. doi: 10.1016/0043-1354(94)00136-U [11] 夏雪, 邵明非, 吕小梅, 等. 不同碳源驯化除磷污泥的除磷效果及菌群结构分析[J]. 环境科学研究, 2014, 27(8): 936-942. [12] NGUYEN H T, LE V Q, HANSEN A A, et al. High diversity and abundance of putative polyphosphate-accumulating Tetrasphaera-related bacteria in activated sludge systems[J]. FEMS Microbiology Ecology, 2011, 76(2): 256-267. doi: 10.1111/fem.2011.76.issue-2 [13] OEHMEN A, SAUNDERS A M, VIVES M T, et al. Competition between polyphosphate and glycogen accumulating organisms in enhanced biological phosphorus removal systems with acetate and propionate as carbon source[J]. Journal of Biotechnology, 2005, 123(1): 22-32. [14] ZILLES J L, HUNG C H, NOGUERA D R. Presence of Rhodocyclus in a full-scale wastewater treatment plant and their participation in enhanced biological phosphorus removal[J]. Water Science & Technology, 2002, 46(1/2): 123-128. [15] PURKHOLD U, POMMERENINGRÖSER A, JURETSCHKO S, et al. Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amoA sequence analysis: Implications for molecular diversity surveys[J]. Applied and Environmental Microbiology, 2000, 66(12): 5368-5382. doi: 10.1128/AEM.66.12.5368-5382.2000 [16] WOLGAST I, BARTOSCH S. Identification of nitrite-oxidizing bacteria with monoclonal antibodies recognizing the nitrite[J]. Applied & Environmental Microbiology, 1999, 65(9): 4126-4133. [17] YANG N, ZhAN G, WU T, et al. Effect of air-exposed biocathode on the performance of a Thauera-dominated membraneless single-chamber microbial fuel cell (SCMFC)[J]. Journal of Environmental Sciences, 2018, 66(4): 216-224. [18] 王健, 陈文兵, 黄传伟, 等. 序批式生物膜法除磷技术研究现状[J]. 水科学与工程技术, 2008, 32(S2): 22-24. [19] 安卫星, 高娜, 夏明, 等. 动胶菌属系统分类、生理特征及其在活性污泥中的作用[J]. 应用与环境生物学报, 2016, 22(6): 1167-1174. -






 下载:
下载: