-
抗生素是一类能够抵抗微生物活性的天然、半合成或人工合成的化合物,具有干扰细胞发育的功能,被广泛用于人和动物感染性疾病的治疗与预防[1-2]。抗生素生产过程中会产生大量的废水,主要来源于抗生素生产工艺的结晶液、废母液、洗涤废水和冷却水[3],制药废水排放是抗生素进入水环境的主要途径之一[4]。由于废水中常含有大量有机物、硫酸盐和残留抗生素,且废水中部分抗生素异构体和降解中间产物具有较强的抑菌效应[5],导致废水具有很强的生物毒性,且可生物降解性差、处理难度大[6]。将高级氧化技术与生物处理技术组合用于处理难降解工业废水,不但可有效去除废水中难降解污染物,还可以降低工艺运行成本,因而在难降解制药废水处理中有广阔应用前景[7]。
臭氧催化氧化技术是在传统臭氧氧化基础上发展而来的一种新型的高级氧化技术,可将废水中难降解有机物转变为易生物降解的小分子物质,从而有效改善废水的可生化性 [8-9]。臭氧催化氧化预处理后的废水仍含有一定浓度的可生化降解有机物,须进行进一步生化处理。曝气生物滤池(BAF)作为一种广泛应用的污水深度处理技术,与传统活性污泥法相比具有自动化程度高、占地面积小、产泥量低、出水水质好[10]等优点,常被用于废水的深度处理。将臭氧催化氧化技术与BAF组合用于处理抗生素制药废水,不仅能发挥物化和生化处理工艺各自的优势,还能提高废水的处理效率,降低废水的处理成本[11-12]。
本研究采用臭氧催化氧化-BAF组合工艺深度处理抗生素制药尾水,考察了臭氧预处理单元和BAF生化处理单元对废水污染物的去除效果,分析了影响组合工艺运行的主要因素,优化了组合工艺的运行条件,以期为抗生素废水的处理提供技术参考。
-
实验用水取某制药园区污水处理厂生化处理单元出水,水质如下:COD为203~262 mg·L−1,BOD为23~43 mg·L−1,TOC为79~101 mg·L−1,
NH+4 -N为9~14 mg·L−1,pH为6.5~7.5,DO为5~6 mg·L−1,B/C为0.04~0.15。天然沸石取自某沸石矿,纯度大于93%,粒度200目,其主要组分如下:O 52.8%,Si 31.9%,Al 7.5%,K 4.3%,Ca 1.8%,Fe 0.9%,Mg 0.7%。 -
实验构建的臭氧催化氧化-BAF组合工艺流程图如图1所示。组合工艺分为臭氧预处理单元和BAF生化处理单元2部分。臭氧预处理的对象为抗生素制药废水二级生化处理出水,臭氧反应柱为内径10 cm、高65 cm的玻璃柱,废水经蠕动泵进入臭氧预处理单元,同时向反应柱内添加Ce/NZ催化剂,臭氧发生器(LCF-G/A-5型,北京山美水美环保科技有限公司)以氧气为气源,通过调节流量计以600 mL·min−1的流速进入反应柱内。反应时电动搅拌器连续搅拌保证废水、臭氧和催化剂均匀混合,反应器顶端排出的尾气进入臭氧破坏器(LR-RH22型,北京山美水美环保科技有限公司)。生化处理单元主要反应装置为BAF,反应器采用内径6 cm、高70 cm的透明有机玻璃柱制成,内置火山岩填料,粒径3~5 mm,高度50 cm。反应器在设计流量为0.35 L·h−1的条件下经蠕动泵完成连续进水,水力停留时间(HRT)为4 h。接种污泥取自北京某污水处理厂MBR池好氧污泥,经过驯化成熟后的活性污泥浓度约为5 000 mg·L−1。
-
COD、NH4+-N、TN、SS均采用标准方法[13]测定;BOD5采用5日培养法测定;TOC采用TOC仪(Analytik Jena Multi N/C 2100,德国)测定;溶液pH采用pH计(OHAUS Starter 3C,美国奥豪斯)测定;DO采用Thermo便携式溶氧仪测定;臭氧发生器的产量是用臭氧浓度检测仪(淄博爱迪尔公司的IDEAL 2000)在线测定,水中和尾气中的臭氧浓度采用碘量法(CJ/T 3028-1994)测定;DOM采用三维荧光分析仪(HITACHI F-7000型,日本)和Matlab软件分析。
-
单独运行臭氧反应器,分别对臭氧进气浓度和臭氧反应时间等条件进行优化,并研究稳定运行状态下各污染物指标的变化特征。
1)臭氧进气浓度对处理效果的影响。在进水COD为262 mg·L−1,催化剂用量为1 g·L−1,臭氧进气量600 mL·min−1,反应时间120 min的条件下,控制进气臭氧质量浓度分别为10、20、30、40、50和60 mg·L−1,考察不同臭氧进气浓度对污染物的去除效果,结果如图2所示。在臭氧进气浓度为10 mg·L−1时,废水COD去除率仅为8.4%;随着臭氧浓度的增加,COD去除率逐渐升高。当臭氧浓度升至50 mg·L−1时,COD去除率达到43%;继续增加臭氧浓度,去除率不但未出现提升,反而呈现降低趋势。这是因为反应体系中臭氧浓度较低时,臭氧直接氧化废水中的有机物,此时有机物与臭氧分子的反应活性较低,无法将有机物完全氧化,产生大量中间产物,导致COD去除率较低。随着臭氧浓度的提高,臭氧间传质驱动力增强并产生臭氧衍生的活性自由基(如·OH),对有机污染物的氧化能力增强,从而促使COD去除率不断提高;继续增加臭氧浓度,反应体系中产生大量·OH,由于羟基自由基性质活泼,相互之间可发生淬灭作用,导致反应体系内·OH浓度降低,COD去除效率降低[14]。根据上述结果,本研究臭氧催化氧化单元臭氧进气浓度优选为50 mg·L−1。
2)催化剂用量对处理效果的影响。在进水COD为262 mg·L−1,臭氧进气浓度为50 mg·L−1,反应时间120 min的条件下,分别控制催化剂用量为0、0.5、1、1.5、2 g·L−1,考察不同催化剂用量对废水处理效果的影响,结果如图3所示。在催化剂用量为0.5 g·L−1时,废水COD去除率仅为28%;随着催化剂用量的增加,COD去除率逐渐升高。当催化剂用量为1 g·L−1时,废水COD去除率为43%;继续增加催化剂用量,去除效率不但未出现提升,反而呈现降低趋势。这是因为随着催化剂用量的增加,催化剂的活性位点增多,产生大量强氧化性的活性物种(如·OH),使得臭氧、有机物和催化剂的接触反应效率得到提升,从而提升了COD的去除率[15]。但是,随着催化剂用量的增多,反应体系中·OH的浓度不断提高,过多的·OH本身会发生相互反应,如式(1)~式(4)所示,使臭氧分解为·OH的链终止反应[16]。根据上述结果,本实验臭氧催化氧化单元催化剂用量优选为1 g·L−1。
3)臭氧反应时间对处理效果的影响。在进水平均COD为220 mg·L−1,臭氧进气浓度为50 mg·L−1,催化剂用量为1 g·L−1,调节反应时间为30 min(Ⅰ阶段)、60 min(Ⅱ阶段)、120 min(Ⅲ阶段)和150 min(Ⅳ阶段)4种工况条件进行实验,考察不同臭氧反应时间对废水处理效果的影响,结果见图4。由图4可以看出,随着反应时间的增加,COD去除率也相应提高;30 min时平均COD为178 mg·L−1,平均去除率为25%,120 min后平均COD降低到125 mg·L−1,平均去除率为43%;继续增加反应时间,COD去除率逐渐降低,且反应时间越长臭氧投加量就越高,运行成本提高。上述结果表明,在实验进水浓度范围内,臭氧反应时间控制在120 min,可使有机物反应更彻底,有利于后续BAF单元的生物降解[17]。测定各阶段出水的B/C,结果显示:随着反应时间的增加,B/C也相应增加;120 min后出水B/C为0.28,这是因为随着臭氧反应时间的增加,产生更多的·OH,废水中部分难降解的大分子有机物被氧化降解为可生物降解性较好的小分子有机物,臭氧预处理可以有效的改善废水的可生物降解性,使废水可生化性提高[18]。根据上述结果,本实验臭氧催化氧化单元反应时间为120 min较为合适。
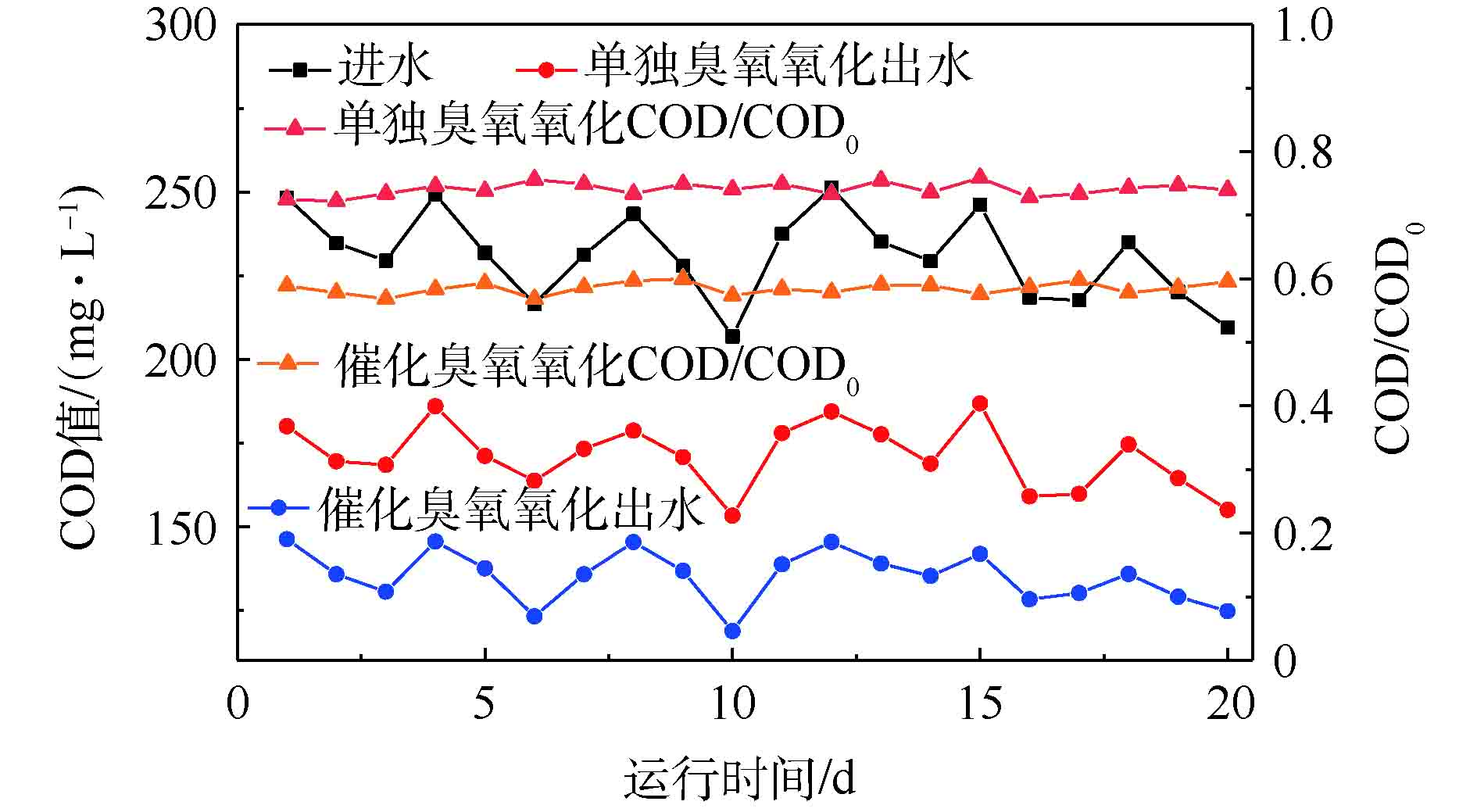
4)不同反应体系对处理效果的影响。在进水平均COD为220 mg·L−1,臭氧进气浓度为50 mg·L−1,催化剂用量为1 g·L−1,反应时间为120 min的条件下,考察单独臭氧氧化和臭氧催化氧化对废水处理效果的影响,结果见图5。由图5可以看出,臭氧催化氧化的平均去除率为43%,相比于单独臭氧氧化,臭氧催化氧化使COD平均去除率提高了17%。这是因为,单独臭氧氧化反应以臭氧直接氧化为主,而臭氧催化氧化反应中Ce作为催化剂的活性组分,引发臭氧分解的链反应,产生大量·OH,此时臭氧单元以间接氧化为主,·OH为主要氧化剂[19];由于·OH氧化能力比臭氧强,故废水COD平均去除率得以提高。
-
臭氧预处理后的出水进入BAF进行进一步的生化处理,考察BAF对废水COD、
NH+4 -N的去除效果,以分析臭氧催化氧化-BAF组合工艺处理制药废水的效果。1) HRT对BAF处理效果的影响。废水经过臭氧催化氧化后进入BAF,在进水平均COD为125 mg·L−1,平均
NH+4 -N为12 mg·L−1,气水比3∶1的条件下,考察不同水力停留时间HRT对BAF处理效果的影响,实验设定HRT分别为2.0 h(Ⅰ阶段)、3.0 h(Ⅱ阶段)、4.0 h(Ⅲ阶段)和5.0 h(Ⅳ阶段)4种工况条件,每种条件下分别运行15 d,实验结果如图6所示。由图6可以看出,随着HRT的增加,COD和NH+4 -N的去除率也随之增加。当HRT从2.0 h增加到4.0 h,COD平均去除率从32%增加到62%,NH+4 -N平均去除率从11%增加到64%。继续增加HRT,废水COD和NH+4 -N的去除效果均继续提升,但增幅不明显。当HRT太短时,BAF系统生物膜中的微生物没有充分吸收和降解废水中的污染物,COD去除效果较差;随着HRT的延长,污染物得到充分降解,从而COD去除效果得到改善[20]。由于HRT在4.0 h时出水COD已达到制药行业废水排放标准,且增加HRT会增加废水处理设备投资和运行成本,故本实验BAF运行的HRT优选为4.0 h。2)气水比对BAF处理效果的影响。设定BAF的HRT为4.0 h,选取气水比为2∶1(Ⅰ阶段)、3∶1(Ⅱ阶段)、4∶1(Ⅲ阶段)和5∶1(Ⅳ阶段)4种工况条件进行实验,每个条件运行15 d,考察气水比对废水COD、
NH+4 -N去除效果的影响,结果如图7所示。由图7可以看出,随着气水比的增大,BAF对COD、NH+4 -N的去除率逐渐提高。当气水比从2∶1增加到4∶1时,COD平均去除率从26%增加到62%,NH+4 -N平均去除率从13%增加到64%。继续增大气水比,废水COD和NH+4 -N的去除效果均继续提升,但增幅不明显。这是因为随着气水比的增加,废水中溶解氧(DO)浓度升高,通过氧在生物膜内部的传质,生物膜内的DO浓度也提高了,从而加速了生物氧化,改善了COD降解效果。当气水比过高时,曝气对填料上生物膜的冲刷加剧,不利于污染物的截留和微生物的生长繁殖,亦不利于COD和NH+4 -N的去除[21]。根据上述实验结果,BAF单元最佳气水比为4∶1。 -
根据前期实验确定的最佳条件,在进水平均COD为232 mg·L−1,平均
NH+4 -N为12 mg·L−1,催化剂用量为1 g·L−1,进气臭氧浓度为50 mg·L−1,水力停留时间(HRT)为4.0 h,气水比为4∶1的条件下,选取单独BAF工艺(Ⅰ阶段)、臭氧反应时间为30 min(Ⅱ阶段)、60 min(Ⅲ阶段)和120 min (Ⅳ阶段) 4种工况条件进行实验,每个条件运行20 d,考察单独BAF工艺和臭氧催化氧化-BAF组合工艺对制药废水的去除效果。结果如图8所示。由图8可以看出,单独BAF出水平均COD为204 mg·L−1、出水平均NH+4 -N为5.9 mg·L−1。组合工艺出水平均COD为46 mg·L−1、出水平均NH+4 -N为4.1 mg·L−1。组合工艺使COD的平均去除率提高了66%,NH+4 -N的平均去除率提高了15%,明显优于单独BAF出水的处理效果。采用GC-MS对组合工艺进水和出水中有机污染物进行分析,结果显示,进水中含有头孢沙定、苯唑嘧啶、青霉素G等β-内酰胺酶类抗生素及其衍生物,经组合工艺处理后,这些污染物均被彻底降解去除,出水中均未检出,出水水质也可稳定达到《发酵类制药工业水污染物排放标准》(GB 21903-2008)。 -
采用臭氧催化氧化-BAF组合工艺处理抗生素制药废水,其运行成本主要来自臭氧预处理单元的催化剂使用、臭氧能耗和生化处理单元的能耗2个方面。臭氧投加量50 mg·L−1,每克臭氧耗电量20 W,每吨水处理的耗电量为1 kW,电费按0.55元·(kWh)−1计,臭氧单元吨水电费为0.55元·t−1;BAF单元处理能耗按0.3元·t−1计[22],组合工艺运行成本约为0.85元。催化剂制备方面,200目的天然沸石价格为400元·t−1,工业级Ce(NO3)3价格约为9 600元·t−1,Ce/NZ催化剂的材料成本约为1.19元·kg−1。由于制备的Ce/NZ催化剂经分离回收后可重复使用,可有效降低臭氧催化氧化处理单元的运行成本,具有较好的经济性。
-
1)以Ce/NZ作催化剂,采用臭氧催化氧化法对废水进行预处理。废水平均COD为220 mg·L−1,在臭氧浓度50 mg·L−1、臭氧进气量600 mL·min−1,催化剂用量1 g·L−1和反应时间120 min的条件下,臭氧催化氧化预处理可实现制药废水中COD去除率达到43%,B/C由0.12上升至0.28,废水的可生化性得到显著提高。
2)采用BAF对臭氧催化氧化单元出水进行处理,在HRT 4.0 h和气水比4∶1的条件下,出水平均COD达到46 mg·L−1,出水平均NH4+-N达到4.1 mg·L−1,出水水质稳定达到《发酵类制药工业水污染物排放标准》(GB 21903-2008)。
3)与单独BAF相比,臭氧催化氧化-BAF组合工艺处理抗生素制药废水,出水COD和NH4+-N的平均去除率分别提高了66%和15%,出水水质优于单独BAF出水。组合工艺可以有效去除抗生素制药废水中难降解有机物,在制药废水处理方面具有广阔的应用前景。
臭氧催化氧化-BAF组合工艺深度处理抗生素制药废水
Advanced treatment of antibiotic pharmaceutical wastewater by catalytic ozonation combined with BAF process
-
摘要: 针对抗生素制药废水组分复杂、毒性强、难生物降解的特点,以Ce负载天然沸石作为催化剂(Ce/NZ),采用臭氧催化氧化-曝气生物滤池(BAF)组合工艺对抗生素制药废水二级生化处理出水进行深度处理。结果表明,Ce/NZ催化剂可显著改善臭氧预处理单元的处理效率,在臭氧进气浓度为50 mg·L−1、臭氧进气量为600 mL·min−1、催化剂用量为1 g·L−1、臭氧反应时间为120 min的条件下,臭氧催化氧化预处理对抗生素制药废水的COD去除率达到43%,平均COD由220 mg·L−1降至125 mg·L−1,BOD5/COD由0.12升至0.28,废水的可生化性得到显著提高。臭氧预处理单元出水采用BAF进行生化处理,在进水平均COD为125 mg·L−1、平均NH4+-N为12 mg·L−1、水力停留时间为4 h、气水比为4∶1的条件下,COD和NH4+-N的平均去除率分别为62%和64%。组合工艺处理后出水平均COD和NH4+-N分别为46 mg·L−1和4.1 mg·L−1,出水水质可以稳定达到《发酵类制药工业水污染物排放标准》(GB 21903-2008)。相较于单独BAF工艺,组合工艺出水COD和NH4+-N平均去除率分别提高了66%和15%,出水水质明显优于单独BAF工艺出水。Abstract: In view of the complex, toxic and difficult biodegradation of antibiotic pharmaceutical wastewater, the Ce-loaded natural zeolite was used as a catalyst (Ce/NZ), and the ozone-catalyzed biological aerated filter (BAF) combination process was applied to advanced treatment of the secondary biochemical treatment effluent of antibiotic pharmaceutical wastewater. The results showed that the Ce/NZ catalyst could significantly improve the treatment efficiency of the ozone pretreatment unit. With the ozone inlet concentration of 50 mg·L−1, the ozone intake of 600 mL·min−1, the catalyst dosage of 1 g·L−1 and the ozone reaction time of 120 min, the COD removal rate of antibiotic pharmaceutical wastewater reached 43%, the average COD value was reduced from 220 mg·L−1 to 125 mg·L−1, and the BOD5/COD increased from 0.12 to 0.28, during which the biodegradability of wastewater was significantly improved. The effluent of the ozone pretreatment unit was biochemically treated by BAF. At average influent COD value of 125 mg·L−1, the average influent
NH+4 -N concentration of 12 mg·L−1, the hydraulic retention time of 4 h, and the gas to water ratio of 4∶1, the average removal rates of COD andNH+4 -N were 62% and 64%, respectively. After the combined process treatment, the average concentrations of COD andNH+4 -N in the effluent were 46 mg·L−1 and 4.1 mg·L−1, respectively, and the effluent water quality could stably meet the Discharge Standards of Water pollutants for Pharmaceutical Industry Fermentation Products Category (GB 21903-2008). Compared with the BAF process alone, the average removal rates of COD andNH+4 -N in the effluent of combined process increased by 66% and 15%, respectively, and the effluent quality was significantly better than that of the BAF process alone.-
Key words:
- pharmaceutical wastewater /
- catalysis /
- ozonation /
- biological aerated filter /
- advanced treatment
-
-
[1] 刘昔, 王智, 王学雷, 等. 我国典型区域地表水环境中抗生素污染现状及其生态风险评价[J]. 环境科学, 2018, 30(12): 1-13. doi: 10.3969/j.issn.1673-1212.2018.12.001 [2] CHEN J, LIU Y S, ZHANG J N, et al. Removal of antibiotics from piggery wastewater by biological aerated filter system: Treatment efficiency and biodegradation kinetics[J]. Bioresource Technology, 2017, 238: 70-77. doi: 10.1016/j.biortech.2017.04.023 [3] 阮林高, 徐亚同, 丁浩. 抗生素制药废水处理研究进展[J]. 上海化工, 2007, 32(4): 1-4. doi: 10.3969/j.issn.1004-017X.2007.04.001 [4] AUBERTHEAU E, STALDER T, MONDAMERT L, et al. Impact of wastewater treatment plant discharge on the contamination of river biofilms by pharmaceuticals and antibiotic resistance[J]. Science of the Total Environment, 2017, 579: 1387-1398. doi: 10.1016/j.scitotenv.2016.11.136 [5] 张昱, 唐妹, 田哲, 等. 制药废水中抗生素的去除技术研究进展[J]. 环境工程学报, 2018, 12(1): 1-14. [6] MA K, QIN Z, ZHAO Z Q, et al. Toxicity evaluation of wastewater collected at different treatment stages from a pharmaceutical industrial park wastewater treatment plant[J]. Chemosphere, 2016, 158: 163-170. doi: 10.1016/j.chemosphere.2016.05.052 [7] 王驭龙, 刘刚, 谌建宇, 等. 臭氧-BAF组合工艺处理电镀RO浓水[J]. 环境工程学报, 2016, 10(8): 4055-4060. [8] 周洪正, 刘平, 张静, 等. 微气泡臭氧催化氧化-生化耦合处理难降解含氮杂环芳烃[J]. 中国环境科学, 2017, 37(8): 2978-2985. doi: 10.3969/j.issn.1000-6923.2017.08.021 [9] HU EN L, WU X B, SHANG S M, et al. Catalytic ozonation of simulated textile dyeing wastewater using mesoporous carbon aerogel supported copper oxide catalyst[J]. Journal of Cleaner Production, 2016, 112: 4710-4718. doi: 10.1016/j.jclepro.2015.06.127 [10] BAO T, CHEN T H, TAN J, et al. Synthesis and performance of iron oxide-based porous ceramsite in a biological aerated filter for the simultaneous removal of nitrogen and phosphorus from domestic wastewater[J]. Separation and Purification Technology, 2016, 167: 154-162. doi: 10.1016/j.seppur.2016.05.011 [11] WU C Y, ZHOU Y X, WANG Y, et al. Innovative combination of Fe2+-BAF and ozonation for enhancing phosphorus and organic micropollutants removal treating petrochemical secondary effluent[J]. Journal of Hazardous Materials, 2017, 323: 654-662. doi: 10.1016/j.jhazmat.2016.10.029 [12] LI X, CHEN W, TANG Y, et al. Relationship between the structure of Fe-MCM-48 and its activity in catalytic ozonation for diclofenac mineralization[J]. Chemosphere, 2018, 206: 615-621. doi: 10.1016/j.chemosphere.2018.05.066 [13] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [14] 余斌, 刘锐, 程家迪, 等. 臭氧-曝气生物滤池深度处理印染制革园区废水[J]. 环境工程学报, 2013, 7(12): 4799-4804. [15] 赵雷, 孙志中, 马军. 蜂窝陶瓷催化臭氧化降解水中草酸的研究[J]. 环境科学, 2007, 28(11): 2533-2538. doi: 10.3321/j.issn:0250-3301.2007.11.022 [16] 马骕骦, 潘兆琪, 陈伟锐, 等. 铈负载SBA-15分子筛催化臭氧氧化水中环丙沙星[J]. 环境化学, 2016, 35(5): 910-916. [17] 刘旭, 崔康平, 王翠萍, 等. 高级氧化-生化深度处理工业园区生化尾水[J]. 环境工程学报, 2016, 10(8): 3993-3998. [18] GOLDMAN J H, ROUNDS S A, NEEDOBA J A. Applications of fluorescence spectroscopy for predicting percent wastewater in an urban stream[J]. Environmental Science & Technology, 2012, 46(8): 4374-4381. [19] LI C H, JIANG F, SUN D Z, et al. Catalytic ozonation for advanced treatment of incineration leachate using (MnO2-Co3O4)/AC as a catalyst[J]. Chemical Engineering Journal, 2017, 325: 624-631. doi: 10.1016/j.cej.2017.05.124 [20] 孙会玲, 陈庆国, 刘梅, 等. 水力停留时间对水解酸化-改性贻贝壳填料曝气生物滤池处理模拟生活污水的影响[J]. 安全与环境学报, 2016, 16(2): 309-313. [21] 韩庭苇, 王政, 薛侨, 等. 曝气生物滤池在水处理中的应用研究进展[J]. 煤炭与化工, 2017, 40(5): 22-26. [22] 宋鑫, 任立人, 田哲, 等. 生化-臭氧-曝气生物滤池组合工艺处理制药园区综合废水[J]. 环境工程学报, 2013, 7(11): 4201-4206. -









 下载:
下载: