-
目前,我国大气复合污染形势依然严峻,挥发性有机物(VOCs)排放量仍呈增长趋势[1-2],重点地区年排放量超过1×107 t[3-4]。2018年,我国打赢蓝天保卫战3年行动计划和“十三五”挥发性有机物污染防治工作方案要求实施VOCs专项整治活动,明确提出从源头控制VOCs的排放,大力发展水性涂料行业,推广水性涂料使用。但水性涂料使用过程会产生乙二醇乙醚有机废气[5],而乙二醇醚类废气具有血液毒性、生殖毒性、肝肾毒性、发育毒性和致畸毒性等[6],因此,研究水性涂料喷涂有机废气治理具有十分重要的现实意义。
生物法具有无二次污染、运行费用低等优点,近年来已逐步被应用于有机废气处理,而新型膜生物反应器[7](membrane biofilm reactor, MBfR)将膜分离技术与生物降解作用相结合,既充分利用纤维膜材料较大的比表面积作为气液吸收的传质界面和微生物附着,又可增强有机污染物的降解效果[8],在处理VOCs方面备受青睐。聚偏氟乙烯中空纤维膜生物反应器能有效处理二甲苯、乙酸乙酯单一废气以及双组分有机废气[9-10],乙酸乙酯废气[11]最大去除能力达225 g·(m3·h)−1;复合型平板膜生物反应器净化甲苯废气[12],可增强甲苯的生物降解[13];利用Pseudomonas putida为菌种挂膜的中空纤维膜生物反应器处理甲苯,通过中空纤维膜提高了氧的传质能力,能承受更高的负荷[14]。
膜生物反应器广泛应用于处理疏水性单一废气以及双组分有机废气方面,但用此技术处理水性涂料喷涂过程中产生的乙二醇乙醚有机废气鲜有报道。本研究采用膜生物反应器处理乙二醇乙醚有机废气,研究各种因素对去除效率的影响;通过16S rRNA和宏基因组测序技术研究反应器内微生物群落结构与功能,以期为膜生物反应器处理乙二醇乙醚废气的实际应用提供参考。
全文HTML
-
气相色谱(GC-1690,杭州捷岛科学仪器有限公司);玻璃转子流量计(LZB-3WB,余姚市舜寰流量仪表有限公司),pH计(pHB-3型,上海三信仪表厂)。
磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、硫酸镁(MgSO4)、蛋白胨、氯化钠(NaCl);超纯氮气(N2,99.999 9%);实验室所用污泥取自广东省某生活污水处理厂的厌氧池和好氧池,接种的微生物类型有芽孢杆菌、陶厄氏菌属、噬氢菌属、蛭弧菌属等。
-
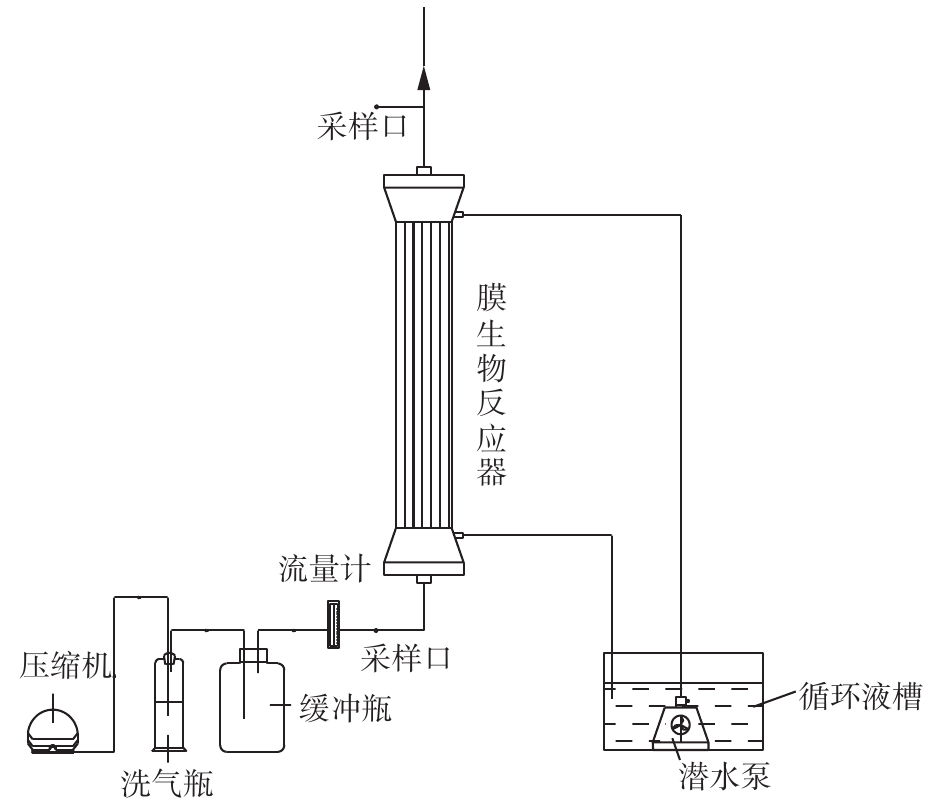
膜生物反应器处理乙二醇乙醚有机废气的实验装置流程如图1所示。膜生物反应器内膜组件为聚丙烯(PP)中空纤维膜,纤维内径为0.38 mm,外径为0.50 mm,纤维膜数量为2 400根,有效长度为300 mm,反应器有效体积为90 mL,废气处理量为0.1~0.6 L·min−1。乙二醇乙醚气体采用动态法配制,乙二醇乙醚经孟氏洗瓶后和压缩空气进入到缓冲瓶混合,混合后的气体从膜生物反应器底部进入,由膜内扩散传质至膜外的生物膜表面,与湿润生物膜接触被微生物降解,净化后的气体从反应器顶部排出;循环液体从顶部向下喷淋,在中空纤维膜外流动,由底部排出至循环液储槽。
-
在膜生物反应器180 d的运行期间,每天采用气相色谱仪测定进出气中乙二醇乙醚浓度。在研究喷淋量和pH影响因素时,每次调整运行参数运行3 d后,监测进出气中乙二醇乙醚浓度;在研究气体停留时间和进气浓度影响因素时,每次调整运行参数运行1 d后,监测进出气中乙二醇乙醚浓度。定期向循环液槽中投加氮磷营养液。
-
采用气相色谱测定乙二醇乙醚浓度,具体分析方法为:采用5%苯基-1%乙烯基聚甲基硅氧烷交联毛细管柱,初始柱温为100 ℃,升温速率为10 ℃·min−1,保持5 min;进样口温度为270 ℃,检测器温度为240 ℃,采用氢火焰离子化检测器检测;采用pHB-3型pH计测定循环液pH;采用16S rRNA技术分析第30、90、145天反应器内微生物群落结构;采用宏基因组测序技术分析反应器内微生物的功能基因。
1.1. 实验原料
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
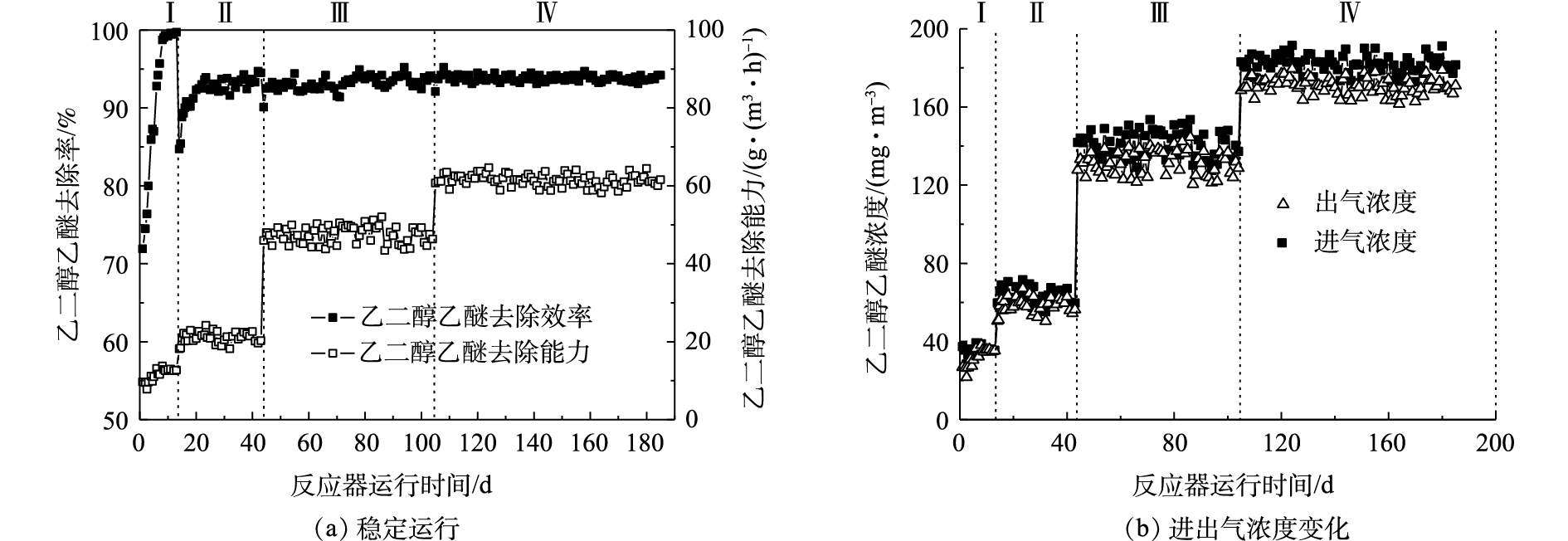
在气体停留时间为10 s、乙二醇乙醚进气浓度为35.0~200.0 mg·m−3、循环液pH为6.00~8.50、喷淋量为0.2~1.8 m3·(m2·h)−1的条件下,膜生物反应器处理乙二醇乙醚的运行稳定性如图2(a)所示,进出气浓度随时间变化如图2(b)所示。在膜生物反应器系统运行初期(1~13 d),进行低浓度(40.0±5.0) mg·m−3驯化。由于聚丙烯中空纤维膜高效分离和膜基水吸收乙二醇乙醚的作用,第1天乙二醇乙醚的去除率可达71.9%,随着纤维膜表面附着的微生物逐渐形成生物膜,第13天上升至99.0%。在驯化适应期(14~43 d),将进气浓度提高到(60.0±10.0) mg·m−3,乙二醇乙醚去除率先下降,再由84.7%升至94.0%,平均去除负荷为20.9 g·(m3·h)−1。为提高反应器抗冲击负荷能力,第44天将进气浓度增加到(140.0±10.0) mg·m−3,乙二醇乙醚去除率由92.2%下降至90.1%,然后升至93.8%,60 d的平均去除负荷达49.1 g·(m3·h)−1。这表明膜生物反应器具有抗冲击负荷的能力。为考察高负荷承受能力,第105天将乙二醇乙醚浓度提高到(180.0±10.0) mg·m−3,乙二醇乙醚去除率由93.8%下降至92.1%,第106天迅速恢复到93.7%,以后79 d维持稳定在94.0%左右。这表明膜生物反应器具有较强的抗冲击负荷能力和良好的稳定性。
-
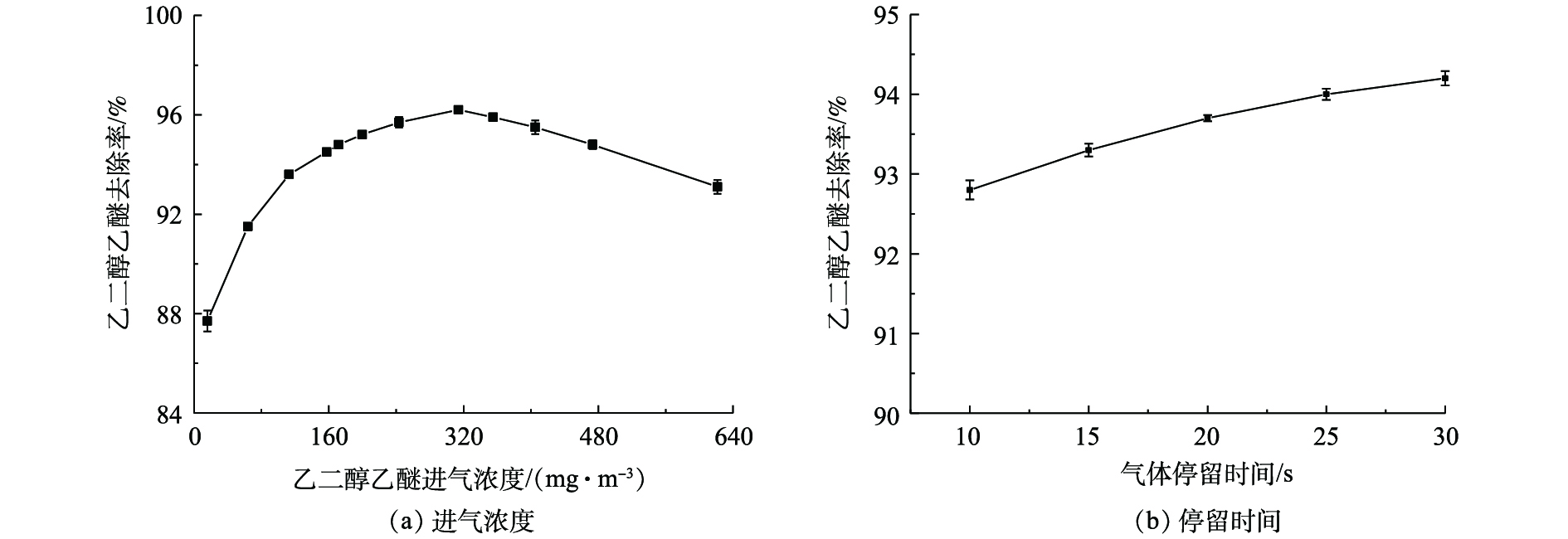
由图3(a)可知,在气体停留时间为10 s、循环液pH为7.65、喷淋量为1.3 m3·(m2·h)−1的条件下,随着进气浓度增加,乙二醇乙醚的去除率先升高后下降,由87.7%升至96.2%,再下降至93.1%;进气浓度为314.1 mg·m−3时,去除率最高,为96.2%。这可能是由于乙二醇乙醚从纤维膜内扩散到膜外的传质速率和微生物的活性随着进气浓度升高而增加,提高了微生物捕获降解能力[15-16],导致去除率逐渐升高;当进气浓度超过314.1 mg·m−3时,生物膜中有限的生物量在单位时间内无法通过代谢降解过量的乙二醇乙醚,导致去除率逐渐下降[17-18]。由图3(b)可知,在进气浓度为140.0 mg·m−3,循环液pH为7.50、喷淋量为1.3 m3·(m2·h)−1的条件下,随着气体停留时间由10 s延长至30 s,乙二醇乙醚的去除率由92.8%升至94.2%。延长停留时间有利于提高乙二醇乙醚的去除率,但增幅较小,同时会显著增加反应器体积,故选取适宜的气体停留时间为10 s。
-
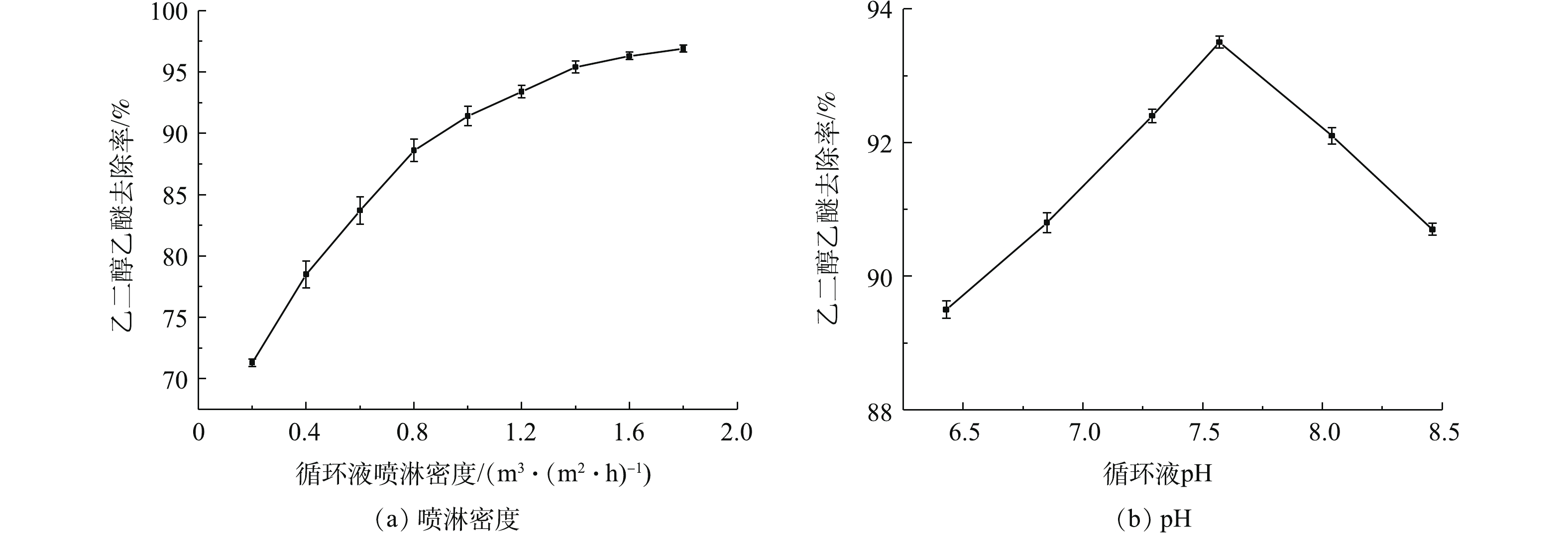
循环液喷淋量和pH对乙二醇乙醚去除率影响如图4所示。在气体停留时间为10 s,乙二醇乙醚进气浓度为140.0 mg·m−3,循环液pH稳定在7.52,设置不同喷淋密度,每个密度下反应器运行3 d。由图4(a)可知,当喷淋密度由0.2 m3·(m2·h)−1增大至1.8 m3·(m2·h)−1,乙二醇乙醚去除率由71.3%升至96.9%。这是由于乙二醇乙醚易溶于水,喷淋液能吸收乙二醇乙醚,增大喷淋量能增大循环液吸收乙二醇乙醚,循环液中有乙二醇乙醚的富集,进而增加液相中乙二醇乙醚与生物膜的接触,中空纤维膜表面的生物膜和循环液中的微生物共同降解乙二醇乙醚。当循环液喷淋量高于1.2 m3·(m2·h)−1时,乙二醇乙醚去除率增幅很小,同时会使运行成本增加,故选取适宜的循环液喷淋量为1.2 m3·(m2·h)−1。在气体停留时间为10 s,乙二醇乙醚进气浓度为140.0 mg·m−3,喷淋量为1.3 m3·(m2·h)−1的条件下,由图4(b)可知,乙二醇乙醚去除率随pH的升高呈现先升高后下降的趋势;当pH为7.57时,去除率最大为93.5%。这是因为体系pH过高或者过低都会影响微生物的活性,不利于其生长繁殖[19-20],进而影响乙二醇乙醚降解速率。因此,本实验循环液以磷酸氢二钾、磷酸二氢钾为缓冲物质,调节pH,适宜pH为7.60。
-
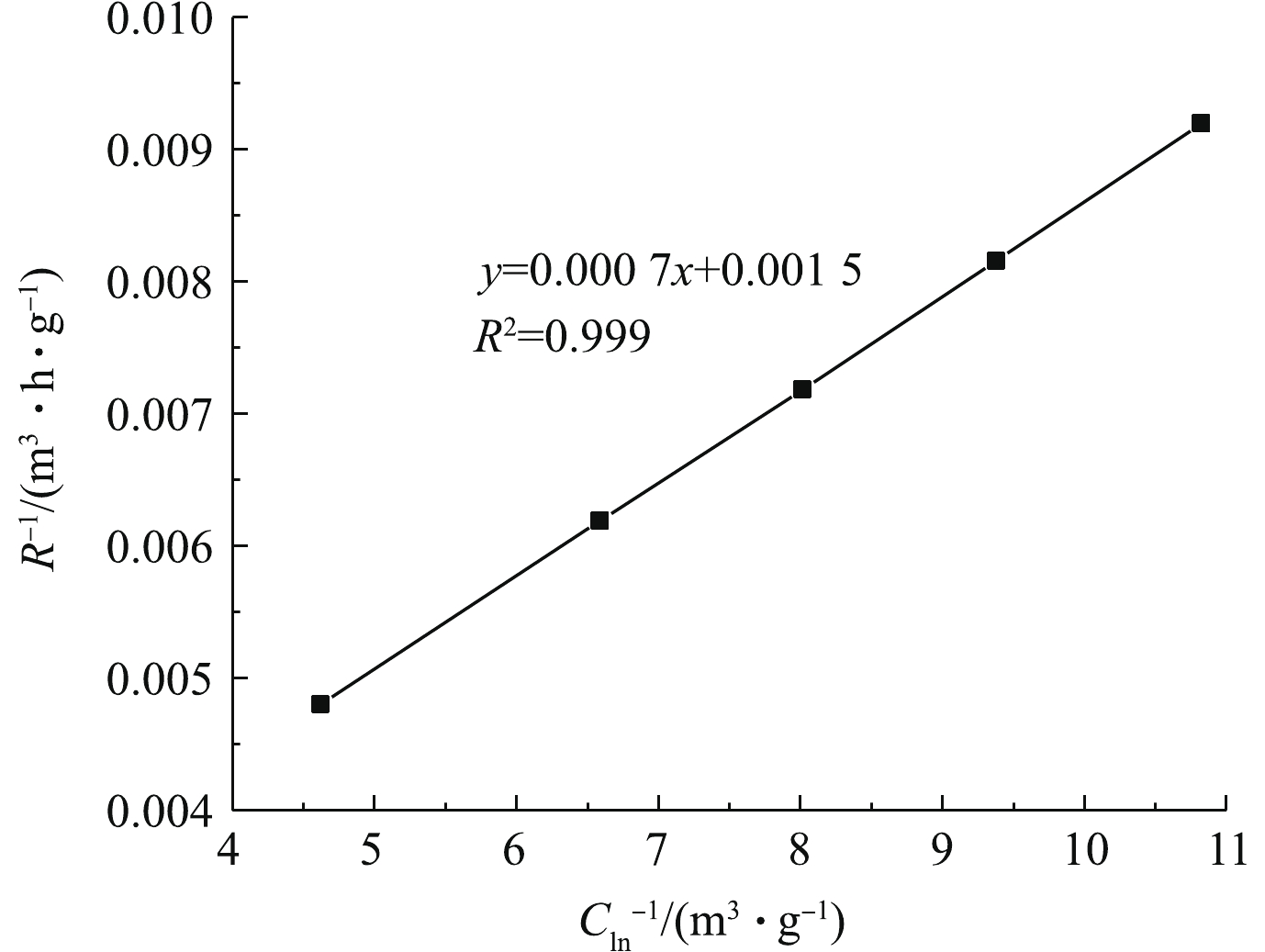
膜生物反应器处理乙二醇乙醚的本质是酶促反应,是利用体系中微生物产生的酶来降解乙二醇乙醚。Michaelis-Menten方程被广泛运用于研究酶催化反应动力学,因此,采用米门方程[21]式(1)拟合,得出生化降解乙二醇乙醚的最大反应速率和半饱和常数。
式中:R为表观去除率;Cln为进出气浓度的对数平均值;Vm为最大反应速率;Ks为半饱和常数。
将实验数据带入方程,结果如图5所示。拟合所得方程为y=0.000 7x+0.001 5,因此,本实验酶促反应的最大反应速率为666.67 g·(m3·h)−1,半饱和常数为0.47 g·m−3。
-
采用16S rRNA技术分析膜生物反应器运行第30、90、145天的微生物群落结构变化,结果如图6所示。由图6(a)可知,在门分类水平上,反应器中的微生物在第30、90、145天的优势菌门均为Proteobacteria(54.4%,78.8%,34.2%)和Bacteroidetes(26.5%,7.9%,50.2%)。膜生物反应器在30~145 d,经过2次进气负荷的提高,微生物优势菌属、微生物群落结构发生了变化。在属分类水平上,膜生物反应器中的微生物群落结构变化如图6(b)所示,相对丰度在前10的优势菌属由第30天的OC32、Denitromonas、Methyloversatilis、OLB12、Chryseolinea、Bacillus、Thauera、Lewinella、Limnohabitans、Hydrogenophaga,第90天的Azospirillum、C39、Desulfovibrio、Blvii28, wastewater-sludge group、Sphaerochaeta、Desulfomicrobium、Lentimicrobium、Pseudomonas、SM1A02、Oceanimonas,变为第145天的Flavobacterium、Thauera、Blvii28, wastewater-sludge group、Oceanimonas、Azoarcus、Pseudomonas、Azospirillum、Desulfuromonas、Acinetobacter、Methyloversatilis。第30天微生物菌属相对丰度较大的OC32、Lewinella和Limnohabitans在装置运行到第90天后消失,Flavobacterium、Oceanimonas和Azoarcus等菌属在运行至第145天时,相对丰度有明显上升,分别为31.5%、5.5%和4.2%。Bacillus、Pseudomonas能够降解多种醚类物质[22];Pseudomonas和Hydrogenophag具有降解多种有机物的能力[23],包括酯类、醚氧化物等[24-25];Flavobacterium在降解2-乙基乙酸丁酯有机物中发挥重要作用,能够降解含氧有机物[26];Azoarcus和Thauera能共同参与酚类、吲哚等有机物的降解[27]。
膜生物反应器内乙二醇乙醚代谢主要功能基因如图7所示。乙二醇乙醚降解的功能基因分为加氧酶、醇脱氢、醛脱氢、乙酸氧化、乙醇酸氧化、乙二醇脱氢等6类。其中,NAD+、adhE、aldH能够将醛类物质氧化为羧酸类有机物[28],glcD能够代谢乙醇酸[29],adh能够将乙醇降解为乙醛,乙醛被aldB继续氧化为乙酸和水[30],dmpB、xyl属于加氧酶,能够在有机物的碳原子上加入氧键,与醚键的断裂相关[31]。宏基因组测序结果显示,微生物菌属Methyloversatilis含有功能基因aldB、xylQ、glcD、mdh2 mxaI、exaA、ACSS acs;Pseudomonas含有功能基因adh、aldH、glcD、catA;Azoarcus含有功能基因adhP、exaA、glcD;Thauera含有功能基因exaA、aldB、ACSS acs、frmB ESD fghA、pct;Hydrogenophaga含有功能基因puuC aldH、ACSS acs、glcD。这些菌属能将乙二醇乙醚降解为二氧化碳和水。
2.1. 膜生物反应器运行稳定性
2.2. 进气浓度和停留时间的影响
2.3. 循环液喷淋量和pH的影响
2.4. 乙二醇乙醚的生物降解动力学
2.5. 微生物群落结构与功能
-
1)膜生物反应器处理乙二醇乙醚废气的最佳运行条件为:气体停留时间为10 s,循环液pH为7.60,循环液喷淋量为1.2 m3·(m2·h)−1。
2)采用米门方程和双倒数方程拟合得出生化降解乙二醇乙醚的最大反应速率为666.67 g·(m·h)−1,半饱和常数为0.47 g·m−3。
3)采用16S rRNA研究膜生物反应器内的微生物群落结构变化,经过2次进气负荷的提高,降解乙二醇乙醚的主要功能菌属由第30天的Methyloversatilis变为第90天的Methyloversatilis、Pseudomonas,最终变为第145天的Thauera和Flavobacterium。
4)宏基因组测序技术结果表明,adh、yiaY、adhP、gbsB、mah1,mxaf等是乙二醇乙醚代谢功能基因。
5)膜生物反应器能高效降解乙二醇乙醚废气,去除率可达99.6%。本研究结果为降解水性涂料生产使用过程中产生的有机废气提供了数据支持。




 下载:
下载: