-
印制电路板行业在生产印制电路板(PCB)过程中涉及大量有机溶剂、醚类有机物以及表面活性剂等,产生的废液中包含的有机污染物组成复杂、浓度高、毒性大且难以降解[1-2]。目前,企业针对高浓度难降解PCB有机废液的处理方法主要是Fenton氧化法,但该方法存在有机物降解不彻底、Fenton试剂不能循环利用且处理费用高等问题。因此,急需寻找高效、安全且低成本的处理技术来对该类废液进行治理。
高级氧化工艺(AOP)主要包括Fenton/photo-Fenton[3-4]、湿法氧化[5-6]、光催化氧化[7-8]以及臭氧氧化[9-10]等技术。其中,催化臭氧氧化技术克服了臭氧氧化法中存在的不足,能在常温常压下高效降解大部分有机污染物且无二次污染[11-14],从而备受关注。大部分研究[15-17]表明,催化剂的加入会促进活性自由基的产生。其中,羟基自由基( · OH)是催化臭氧氧化过程的主要活性自由基,对有机物的降解起关键性作用。目前,使用较为广泛的是非均相催化剂,主要包括金属和金属氧化物负载、金属氧化物,活性炭以及其他多孔材料等[18-19]。金属氧化物催化剂(如MnO2[20-21]、MgO[22-24]、ZnO[25-26]、TiO2[27-28]、Al2O3[29-30]和CeO2[31]等)、金属氧化物载体的材料(如Al2O3[32]、TiO2[33]等)、多孔材料载体(如石墨烯[34]、碳纳米管[35]等)都已经用于催化臭氧氧化过程,并且已经被证明具有良好的催化活性。然而,很多催化剂在制备及应用时存在一些缺点,如制备工艺复杂、成本较高、重复利用率低等,这些因素限制了催化臭氧氧化技术在实际高浓度难降解工业废液的应用。在催化臭氧化过程中,氧化钙(CaO)很少用于催化臭氧化过程;但初步实验表明,CaO结合臭氧氧化法,在处理实际工业废液中有机污染物时具有很大的优势,并且CaO具有活性高、成本低、毒性低、pH稳定性好和环境友好的特点,因此,将其应用于催化臭氧氧化过程有良好的发展前景[36]。
本研究探讨了PCB废液降解过程中的催化降解机理以及有机物降解途径,考察了催化剂的循环稳定性并分析催化剂失活的可能原因;通过单纯形优化实验考察了CaO在PCB废液的臭氧氧化过程中的催化性能,包括CaO质量、pH、臭氧浓度、降解时间和废液深度对废液中有机物降解率的影响;最后,将CaO催化臭氧过程应用于实际高浓度难降解废水并探讨其应用潜能,为实际工业废水的处理提供参考。
-
氧化钙(CaO)、氢氧化钠(NaOH)、硫酸(H2SO4)、异丙醇(C3H8O)、正己烷(C6H14)、乙二醇单丁醚(C6H14O2)、吐温-80、碘化钾(KI)、硫代硫酸钠(Na2S2O3)、叔丁醇(C4H10O)和水杨酸(C7H6O3)购于中国成都科隆化学试剂厂。二乙二醇单乙醚(C6H14O3),2,3-二羟基苯甲酸(C6H14O4)和2,5-二羟基苯甲酸(C6H14O4)购于梯希爱(上海)化成工业发展有限公司。所有试剂均为分析级,无须进一步处理,所有溶液均是由超纯水净化机(ATSro)获得的去离子水制备。
PCB废液来源于某工厂制造PCB过程,PCB废液为黄色,略带刺激性气味,pH为10.10,COD高达20 246.4 mg·L−1,属于碱性高浓度有机废液,主要成分为异丙醇、正己烷、二乙二醇单乙醚、乙二醇单丁醚和吐温-80等。
-
通过UV光谱(Shimadzu,Japan)检测水杨酸及其与 · OH的反应产物,波长扫描范围为260~400 nm。通过LC-MS(LCMS-8060)对水杨酸羟基化产物进行定量分析。PCB废液中的降解过程中的中间产物通过GC/MS(Agilent 7890A)检测。采用扫描电子显微镜(SEM)检测催化剂使用前后的形貌。通过X射线衍射分析仪(Empryean PANalytical B.V.)检测催化剂使用前后的组成,测定X射线为Cu靶Kα射线(λ=0.154 18 nm,加速电压为40 kV,发射电流为40 mA,扫描角度为10°~85°。用重铬酸钾法测量废液处理前后的COD。通过pH计(SevenEasyS20,Mettler Toledo)测定废液pH。
-
催化臭氧化过程在半连续反应器(内径可调,总高度25 cm)中进行,该反应器盛有250 mL PCB废液和一定量的CaO用作催化剂,在常温常压条件下进行反应。臭氧由臭氧发生器产生,并通过曝气石将O3分散到废液中,并且通过磁力搅拌使废液与O3接触更充分。在实验过程中,气体流速为4 L·min−1,臭氧浓度通过靛蓝法检测,残余臭氧用20%KI溶液吸收。
在催化臭氧化过程中,以异丙醇(IPA)、正己烷(nHA)、二乙二醇单乙醚(DGDE)、乙二醇单丁醚(EB)和吐温-80(Tween-80)为原料,模拟PCB实际废液。将3.0 g CaO加入到含有250 mL模拟废液的反应器中,然后通入一定浓度的臭氧以降解废液中的有机污染物。在此过程中,以一定的时间间隔从反应器中取出10 mL的降解液样品,加入Na2S2O3钠溶液淬灭样品中残余臭氧。将获得的样品通过0.22 μm微孔膜过滤,并将过滤的样品用于GC/MS检测分析。叔丁醇(TBA)用作 · OH淬灭剂,水杨酸(SA)用作 · OH捕获剂,添加到催化臭氧化过程中以研究催化臭氧氧化过程的主要活性自由基。使用过后的催化剂经过过滤、洗涤、50 ℃干燥后,用于催化剂的稳定性实验。
-
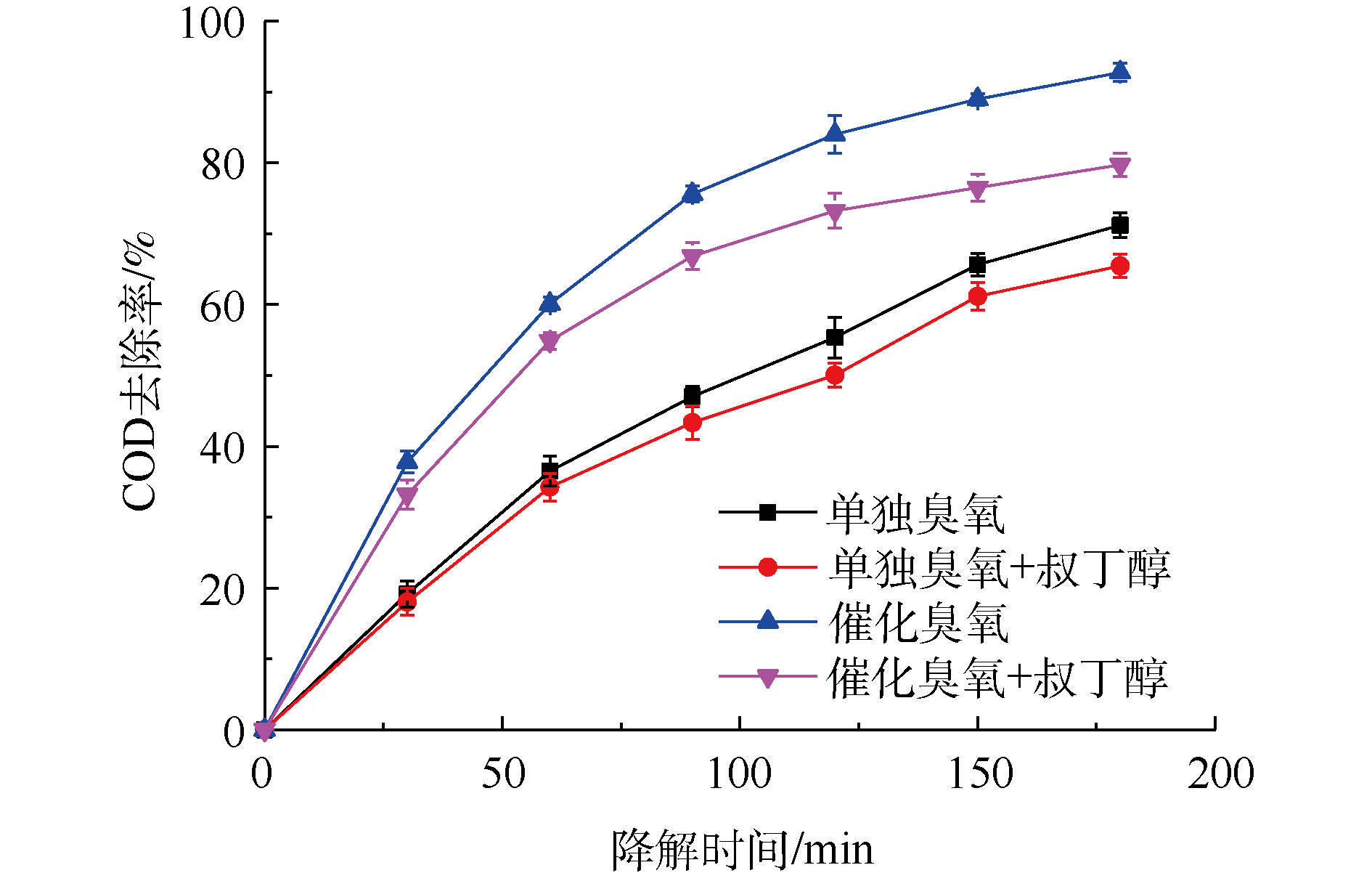
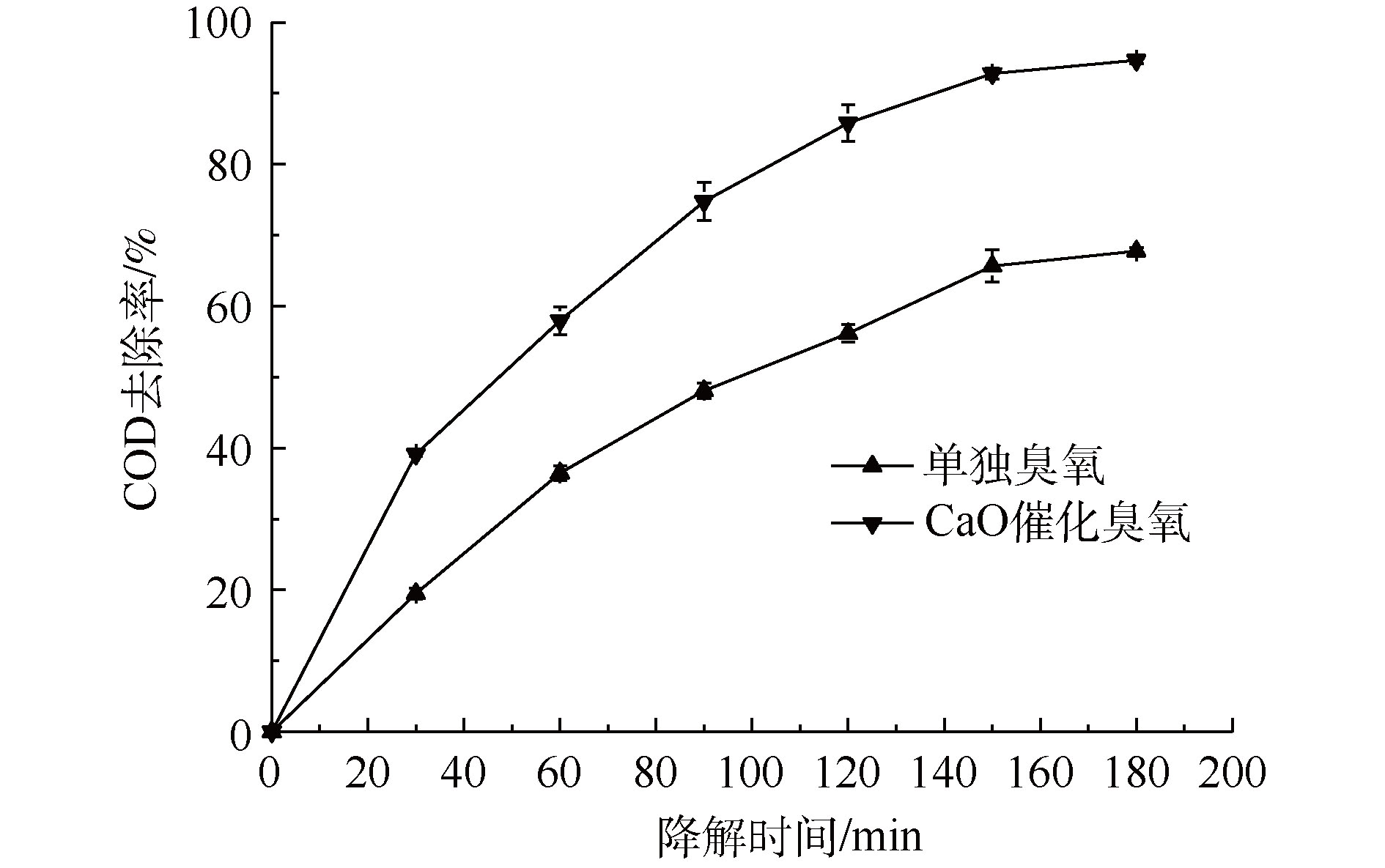
臭氧与有机物的反应主要有2种途径,即直接反应和间接反应。直接反应是指O3直接氧化有机物,间接反应主要是通过O3分解产生的活性自由基对有机物进行氧化[37-38]。通过研究 · OH淬灭剂的影响进行对比实验,研究 · OH对有机物的降解作用。TBA是一种常见的 · OH淬灭剂,它与臭氧分子基本不反应,反应速率仅3×10-3 L·(mol·s)−1,而其与 · OH的反应速率高达6×108 L·(mol·s)−1。因此,可以通过加入TBA到臭氧或催化臭氧过程,间接检测体系中是否有 · OH的产生[39]。图1为单独臭氧氧化过程以及催化臭氧氧化过程加入TBA前后废液的COD去除率对比图。由此可知,CaO催化臭氧氧化过程和单独臭氧氧化过程加入TBA后,处理180 min后,COD去除率分别降低13.04%和5.71%,表明TBA的加入对2个过程降解率均造成负面影响,从而间接证明单独臭氧氧化过程与催化臭氧氧化过程都有 · OH产生。此外,从TBA对2个过程的影响程度上可以看出,CaO可以促进O3产生更多的 · OH,表明CaO催化臭氧氧化过程遵循羟基自由基机理。
-
水杨酸(SA)羟基化实验是另外一种间接检测羟基自由基的方法[40]。羟基自由基具有存在时间短、不稳定的特点,但SA可以作为 · OH的捕捉剂,SA与 · OH反应后会生成较为稳定的2,3-二羟基苯甲酸(2,3-DHBA)和2,3-二羟基苯甲酸(2,5-DHBA)。本研究结合紫外-可见分光光度计跟踪SA与 · OH反应后产物,再结合液相色谱-质谱联用仪对2,3-DHBA和2,5-DHBA进行定量分析。
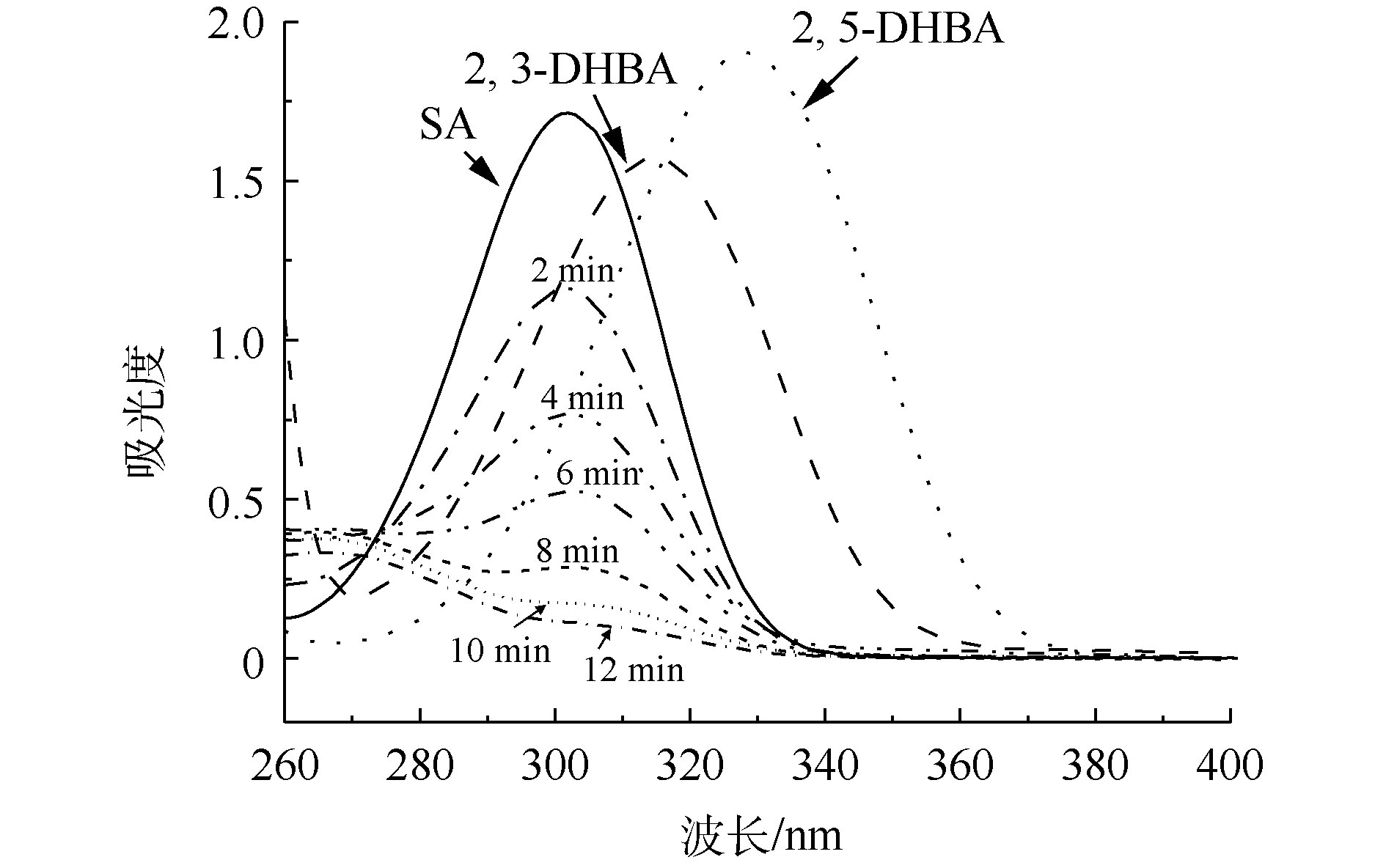
图2为SA、2,3-DHBA和2,5-BHBA的紫外-可见吸收光谱图以及CaO催化臭氧氧化处理后的紫外-可见吸收光谱。可以看出,SA在302 nm处有最大吸收峰,而2,3-DHBA和2,5-DHBA分别在315 nm和330 nm处出现最大吸收峰,SA经过催化臭氧氧化处理后最大吸收峰波长向右移动,在2,3-DHBA和2,5-DHBA的大吸收峰处有一定的吸收,证明在该过程中有 · OH产生。
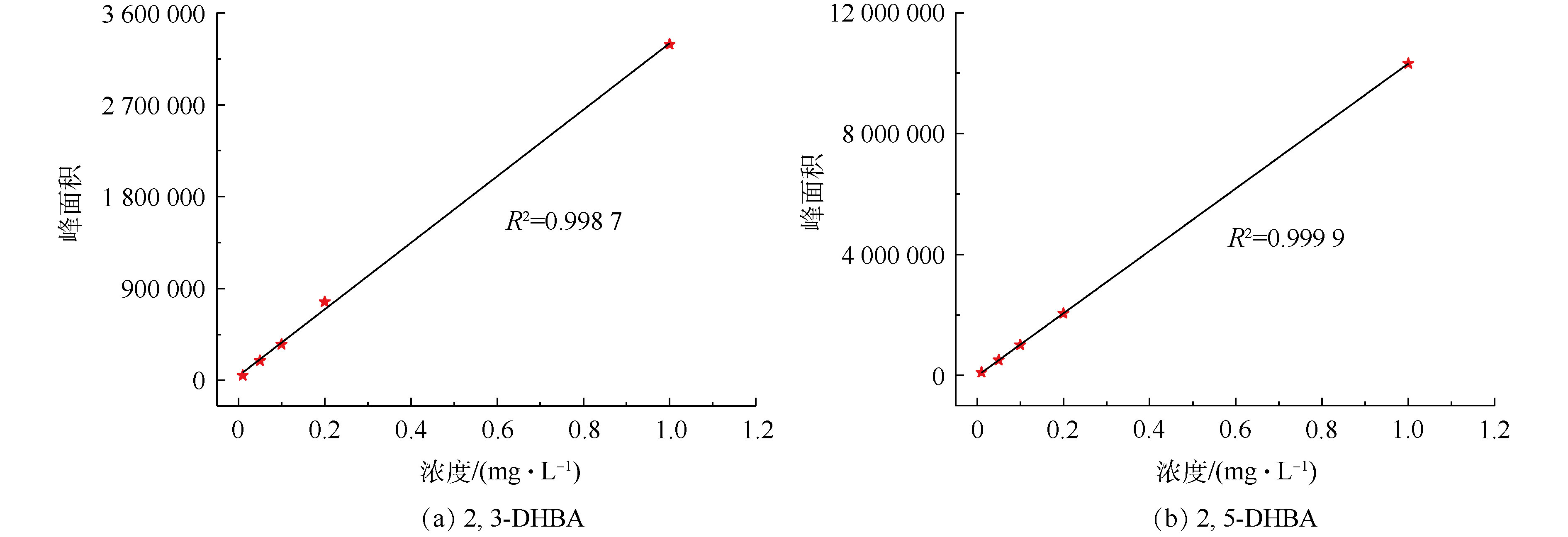
从图2中可以观察到2,3-DHBA和2,5-DHBA的存在,接下来使用LC-MS联用仪对2,3-DHBA和2,5-DHBA的含量进行定量分析。图3(a)和图3(b)分别表示2,3-DHBA和2,5-DHBA的液相色谱标准曲线,根据该标准曲线求得CaO催化臭氧处理不同时间溶液中2,3-DHBA和2,5-DHBA的含量,结果如表1所示。从表1中可以看出,CaO催化臭氧处理4、8和12 min后,溶液中2,3-DHBA的含量分别为0.037 3、0.022 1和0.020 mg·L−1,2,5-DHBA的含量分别为0.015 5、0.014 4和0.013 7 mg·L−1。可以看出,随着时间的增加,2,3-DHBA和2,5-DHBA的含量都不断减少,表明催化臭氧过程中SA与羟基自由基结合的同时,羟基化产物2,3-DHBA和2,5-DHBA也被氧化降解。
-
为了研究废液的降解路径,以废液主要成分异丙醇和乙二醇单丁醚为例进行探讨,对2种物质进行降解并对降解产物用GC/MS进行检测。
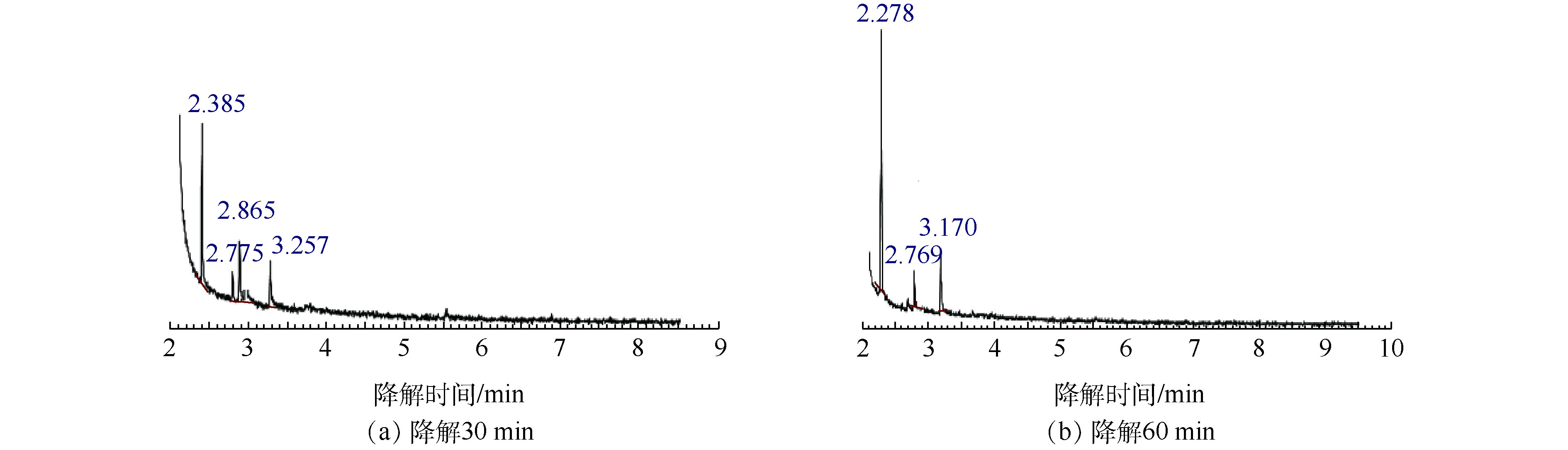
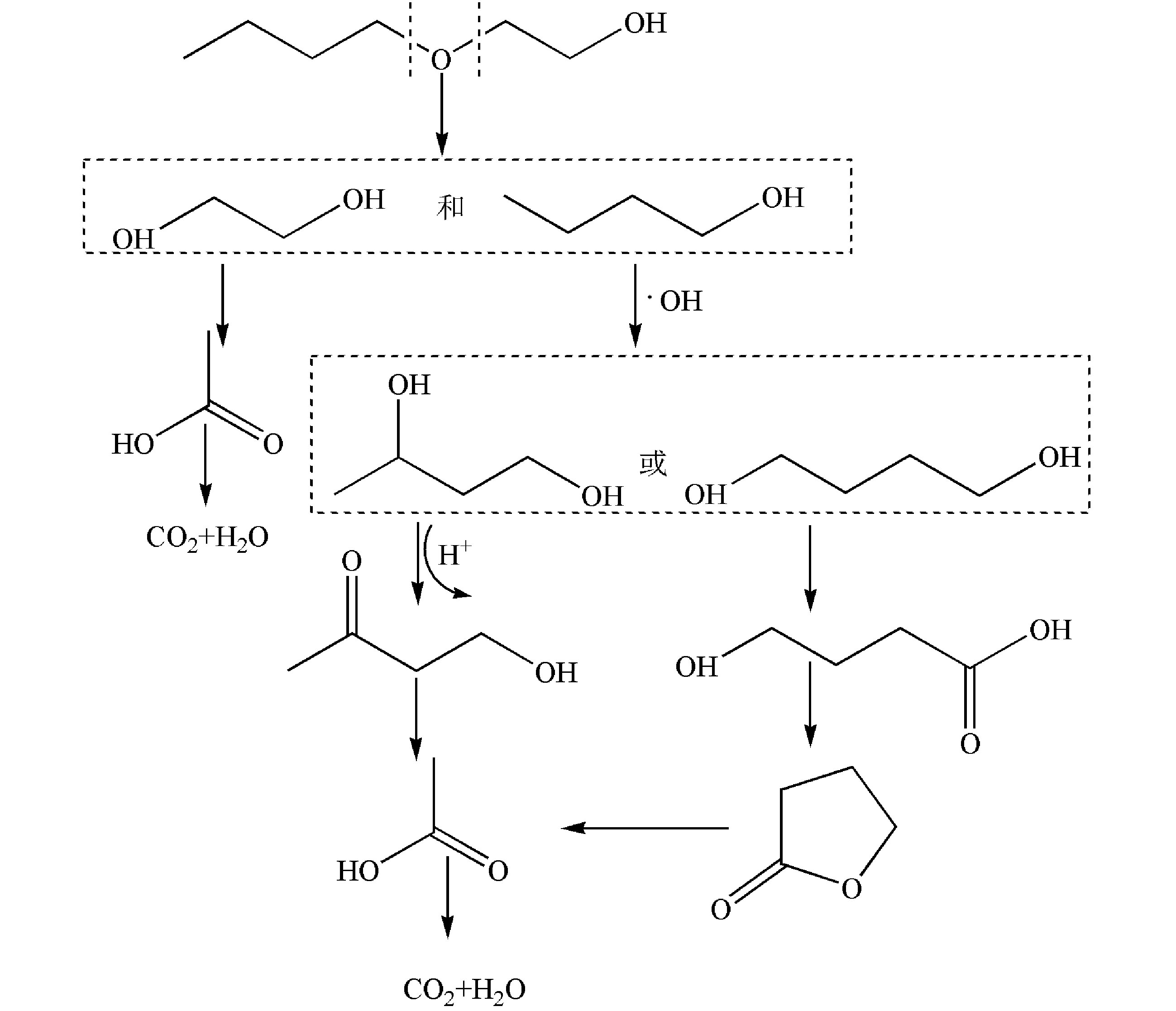
异丙醇降解30 min和60 min的GC/MS结果如图4所示,对应的中间产物信息如表2所示。异丙醇溶液经催化臭氧氧化降解30~60 min后,检测到的中间产物有羟基丙酮、1,2-羟基丙二醇以及乙酸,由此推测出异丙醇的可能降解路径为:异丙醇与 · OH结合形成了1,2-羟基丙二醇,1,2-羟基丙二醇再被氧化为羟基丙酮,然后再进一步被氧化为小分子酸乙酸,结果如图5所示。
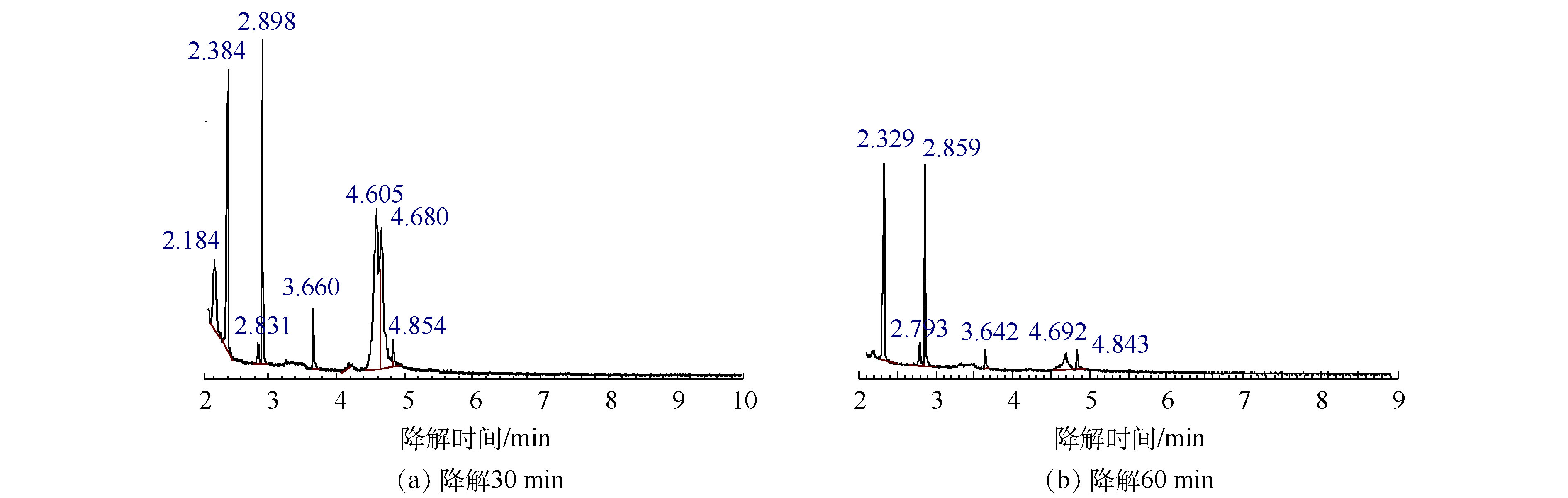
乙二醇单丁醚降解30 min和60 min后的总离子流色谱图如图6所示,对应的中间产物信息如表3所示。乙二醇单丁醚的降解中间产物主要有1-丁醇、乙二醇、4-羟基-2-丁酮、丁内酯和乙酸。由此可以推测乙二醇单丁醚的可能降解路径如图7所示,乙二醇单丁醚的降解一部分是被氧化断链形成乙二醇,然后再接着被氧化为乙酸。另外有一部分乙二醇单丁醚被氧化断链形成1-丁醇,1-丁醇与 · OH结合,结合产物再被氧化形成酮或酸,最后再被氧化形成小分子酸乙酸,最后形成CO2和H2O。
-
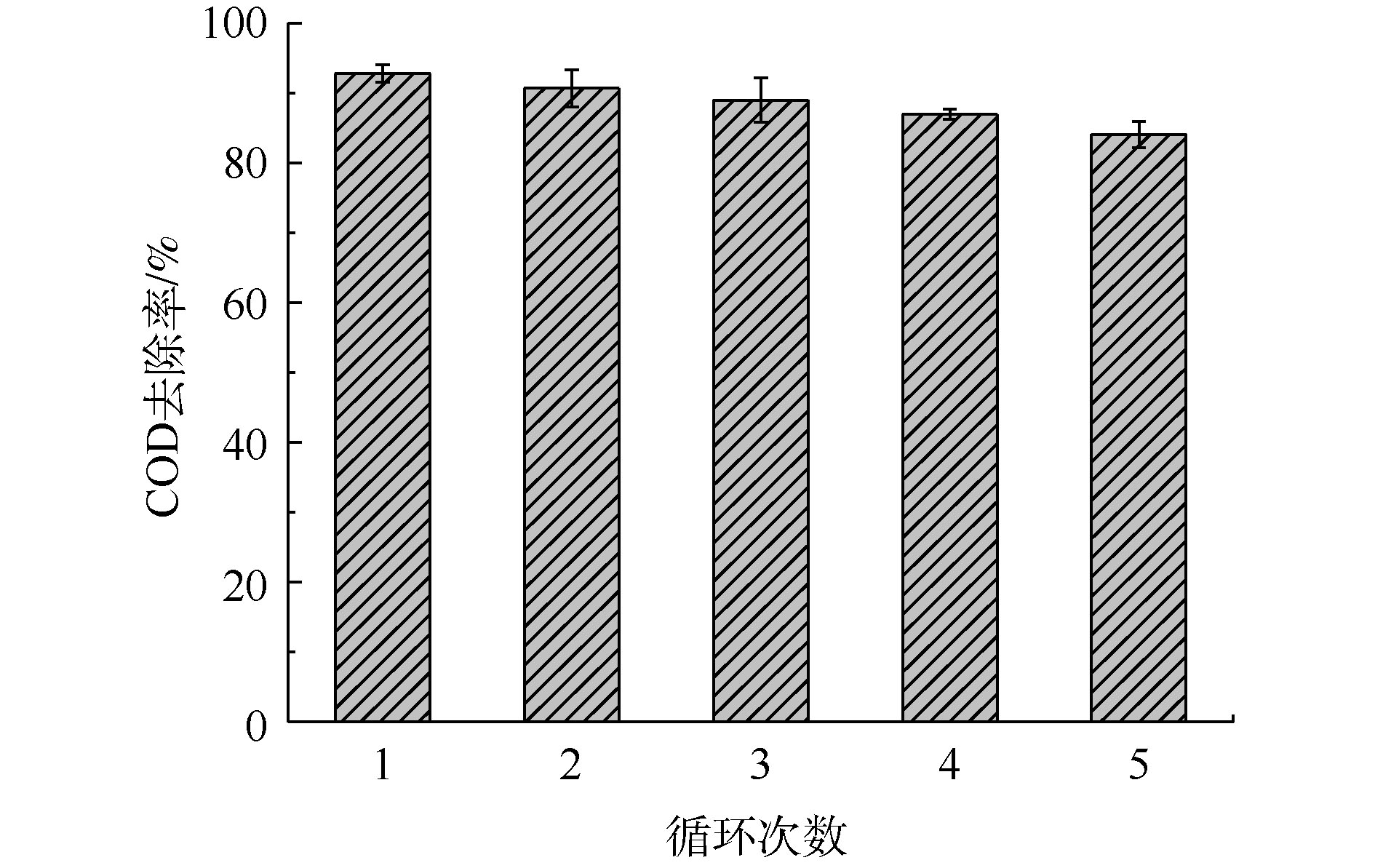
在实际应用中,催化剂的稳定性十分重要。催化剂的多次循环使用可以节约催化剂成本,并且减少固废。本实验对催化剂进行了5次循环,每次使用后对催化剂进行过滤、洗涤、干燥后进行循环使用。如图8所示,催化剂在每一次使用时的催化效率分别是92.78%、90.67%、88.98%、86.94%和84.04%。经过多次循环,催化剂活性下降,但每次循环均没有显著下降,表明该催化剂具有良好的循环性能。
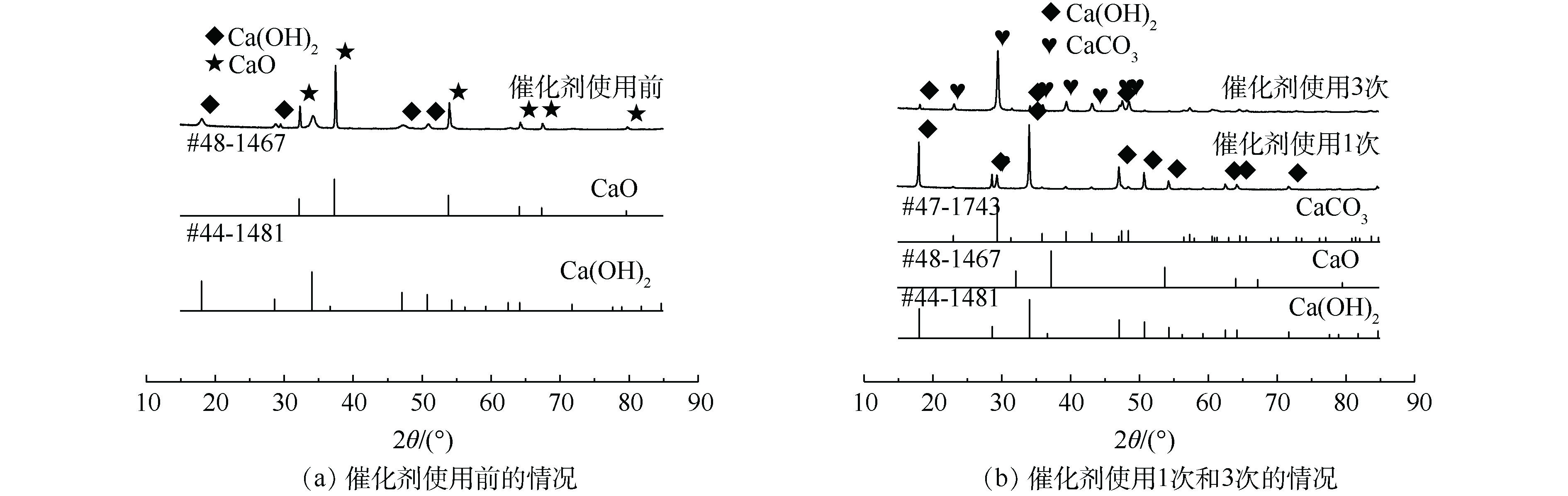
为了探讨催化剂失活原因以及催化剂活化的方式,对使用前后的催化剂进行了表征,研究催化剂使用前后的形貌、组成以及比表面积变化。图9(a)显示的是催化剂使用前的形貌,图9(b)和图9(c)表示催化剂使用1次和3次后的形貌。可以看出,使用后的催化剂较使用前的催化剂不易分散,产生的团聚现象更为严重,从而导致催化剂的性能降低。
图10显示的是催化剂使用前后的XRD谱图。图10(a)得到的XRD谱图与标准JCPDS对照可知,2θ为32.3°、37.4°、53.9°对应的是CaO的特征吸收峰,2θ为18°、28.7°、34.1°、47.1°和50.9°对应的是Ca(OH)2的特征峰,表明在使用前的催化剂中Ca(OH)2的特征峰也有一定的吸收强度。使用前的催化剂中CaO的特征峰十分清晰且强度较大,表明其主要成分是CaO,但也含有少量的Ca(OH)2,说明催化剂在存放过程中或者样品测试时受到空气中水分的影响。
图10(b)为催化剂使用1次和使用3次后的XRD图。催化剂使用1次后的XRD谱图在2θ为18°、28.7°、34.1°、47.1°和50.9°处存在较强的峰,这些峰与Ca(OH)2的特征峰一致,表明其主要成分是Ca(OH)2。而使用3次的催化剂测出的2θ为23°、29.4°、39.4°、43.2°和47.1°对应的峰是CaCO3的特征峰,说明催化剂的失活过程主要是:经过多次循环后的催化剂与水结合变成了Ca(OH)2,形成的Ca(OH)2与矿化产物CO2结合从而变为CaCO3,最终由于多次反应后CaCO3含量不断增加从而导致催化剂催化效率逐渐降低。
-
有研究[41-42]表明,pH变化对催化效率有很大影响,这可能会影响催化剂的表面性质和活性自由基的产生。废液深度的变化会影响O3分子与废液的接触时间,从而影响废液的降解率。O3在催化臭氧氧化过程起氧化作用。臭氧用量的增加,可以促进活性自由基的产生并且可以增加臭氧与废液的接触面积,从而促进废液中有机物的降解[43]。因此,废液pH、CaO质量(m)、废液深度(h)、降解时间(t)、臭氧用量等工艺条件的优化就显得尤为重要。考虑到CaO会造成固废以及时间成本,因此,综合考虑了CaO质量、降解时间和COD去除率(η)三者的关系,以0.7η+0.1/t+0.2/m为考察指标进行单纯形优化实验。表4显示各因素的初点和步长,即各个因素的初始值以及变化值。表5为根据均匀设计表U6(65)得到的初始实验条件,经过优化之后得到的优化结果如表6所示。可以看出,pH为12.6~13.2,降解时间为150~180 min以及臭氧量为120 ~200 mg·min−1时会取得较好的催化降解率。综合考虑固废以及时间成本,pH为12.97、CaO质量为1.0 g、废液深度为11 cm、降解时间为150 min、臭氧用量为120 mg·min−1时,COD去除率可达到90.045%,并且0.7η+0.1/t+0.2/m综合效率为0.870 3,能够满足在较短时间、较少催化剂用量下取得较高的降解率,可以应用于高浓度难降解有机废水的处理。
-
图11显示了CaO催化臭氧氧化处理工厂的实际PCB清槽剂废液的处理效果,其工艺条件如下:pH为13.0、CaO质量为2.0 g、废液深度为11 cm、降解时间为180 min、臭氧用量为180 mg·min−1。可以看出,处理180 min后,废液COD去除率达到了94.67%,比单独臭氧氧化过程COD去除率高26.92%,CaO作为催化剂加入到臭氧氧化过程大幅度提高了有机物的降解率。上述结果表明CaO催化臭氧氧化处理实际高浓度难降解废液具有可行性,并且对有机物的降解效果显著,具有广阔的应用前景。
-
1)自由基淬灭实验和水杨酸羟基化实验结果表明,CaO催化臭氧氧化体系中存在 · OH,主要是遵循羟基自由基机理。
2)通过GCMS检测,废液降解后检测出了中间体,如羟基丙酮、乙二醇、正丁醇、乙酸等。因此,有机物可能降解途径是:有机物主要是先与 · OH结合,再进一步被氧化形成酮,然后被氧化为乙酸,最后形成CO2和H2O。
3)催化剂稳定性测试表明,CaO具有优良的循环稳定性,经过5次循环后,催化剂的催化效率可以达到84.04%。SEM、XRD测试结果表明,使用后的催化剂团聚现象明显增大,其主要成分由CaO变为了Ca(OH)2和CaCO3,从而导致催化效率降低。
4)单纯形优化实验表明,在优化条件下可以满足在较短时间,使用较少催化剂情况下,催化效率达到90.04%。最后,将CaO催化臭氧氧化技术应用到实际PCB废液中,废液COD去除率可以达到94.67%,表明CaO催化臭氧氧化技术可应用于实际高浓度难降解废液。
催化臭氧氧化降解PCB有机废液及其机理
Performance and mechanism of PCB organic effluents degradation by catalytic ozonation
-
摘要: 为了高效、快速治理高浓度难降解PCB(printed circuit board)有机废液,研究了氧化钙非均相催化臭氧氧化降解PCB废液的催化机理和催化性能。采用叔丁醇淬灭自由基实验和水杨酸羟基化实验探究催化机理;通过GC/MS研究了PCB废液中有机物可能降解途径;通过单纯形优化法对实验因素进行优化,并通过XRD和BET探究催化剂的循环稳定性。结果表明:氧化钙非均相催化臭氧氧化过程遵循羟基自由基机理;在pH为12.97、CaO质量为1.0 g、废液深度为11 cm、降解时间为150 min、臭氧用量为120 mg·min−1时,COD去除率可达到90.045%;氧化钙经过5次循环后,废液的COD去除率没有显著降低,从92.78%降低至84.04%。CaO应用于催化臭氧氧化过程处理高浓度且难降解的PCB废液,能维持良好的催化性能和循环稳定性,具有良好的应用前景。Abstract: In order to high efficiently and rapidly treat refractory organic effluent generated during manufacturing printed circuit boards (PCB) with high concentration, the performance and mechanism of PCB organic effluents degradation by heterogeneously catalytic ozonation with CaO were studied. The catalytic mechanism was investigated by radical quenching test with tert-butanol and hydroxylation test of salicylic acid. The possible degradation pathway of organic matter was studied by GC/MS. The experimental factors were optimized by simplex optimization method, and the cycle stability of the catalyst was explored by XRD and BET. The results showed that the catalytic ozonation process in the presence of calcium oxide followed hydroxyl radicals mechanism. The COD removal efficiency could reach 90.045% at the pH of 12.97, CaO mass of 1.0 g, the solution height of 11 cm, the degradation time of 150 min, and the ozone dosage of 120 mg·min−1. After five cycles, the COD removal ratio of organic matter decreases insignificantly, which changes from 92.78% to 84.04%. CaO can maintain a good catalytic performance and recycle stability during treating refractory organic industrial wastewater with high concentration, which confirms its good prospect in this field.
-
Key words:
- catalytic ozonation /
- calcium oxide /
- PCB effluents /
- hydroxyl radicals
-
近年来,提高大中型城镇污水处理厂废水处理过程能源利用率,降低污水处理厂碳排放量成为研究热点[1]。城镇污水处理厂消耗能源有电能、药剂和燃料等,电能占总能耗的60%~90%,曝气池消耗电能占总运行电耗的51.81%[2],其中,部分电耗被用于难降解有机物的去除,造成了资源的浪费。因此,有必要更新污水处理工艺,改变污水处理厂运行思路,以减少能源消耗和提高能源回收率,提高污水处理厂效益。
生物絮凝工艺具有微生物浓度高、污泥龄短、有机负荷高等特点,可有效利用微生物分泌的胞外聚合物(EPS)截留进水所含颗粒态和胶体态有机物、悬浮态无机物、重金属等物质[3-4]。活性污泥絮体中EPS作为微生物主要成分之一[5],除具有形成和保护活性污泥絮体结构功能外,还有良好的絮凝功能[6]。但是由于EPS提取工艺不成熟、组成成分不尽相同、各组分功能尚不明确等原因使其无法被广泛应用[7-8]。生物絮凝系统不仅可以发挥EPS絮凝颗粒态和难降解有机物的能力,还可减少化学药剂使用量,进而降低污水处理成本,减轻污水处理厂对环境的负面影响。
生物絮凝系统通过截留难降解有机物,可降低二级处理过程中的电能消耗,从而减少温室气体的间接排放。此外,生物絮凝系统内微生物与有机物絮凝后产生有机质含量较高的剩余污泥,可用于厌氧发酵产酸,相应挥发性脂肪酸平均浓度可达7.93 g·L−1[9]。因此,有机酸可作为优质碳源,投加至厌氧池或缺氧池内,以强化污水处理厂脱氮除磷效果,减少除磷药剂和外加碳源的使用量,从而进一步降低污水处理厂污水处理成本与温室气体排放量。
本研究以城镇污水为对象,在中试规模下研究了生物絮凝系统对实际污水中污染物的去除效果与污泥产量变化影响,考察了不同水力停留时间下生物絮凝系统内EPS合成规律,并核算了生物絮凝系统温室气体排放量,为污水处理厂节能降耗与资源回收利用提供参考。
1. 材料与方法
1.1 进水水质
生物絮凝中试系统所用污水为天津市某污水处理厂沉砂池出水。该厂采用特有除臭工艺将除臭污泥回流至进水泵房,致使沉砂池出水SS较高,沉砂池出水COD、TN、TP等指标随SS发生相似变化。此外,该污水处理厂上游有日处理量800 t的大型污泥处理厂,该厂所排废液含聚合氯化铝、聚合氯化铁等调理药剂污泥直接进入污水处理厂。中试系统进水水质具体参数见表1。
表 1 中试系统进水水质Table 1. Influent quality of pilot-scale systemmg·L−1 浓度与平均值 COD TN  -N
-NTP SS Al Fe 浓度 245~852 34.46~54.99 26.95~41.31 6~32 400~2 400 2~10 2~8 平均值 417.50±177.89 44.17±6.20 33.48±4.03 14.04±6.96 1 362.50±740.54 5±0.12 3±0.15 1.2 中试装置及运行参数
生物絮凝中试系统结构和现场如图1所示,该系统中试装置构筑物包括生物絮凝池、一沉池,有效容积分别为1 m3和2.10 m3。生物絮凝系统进水、污泥回流量、曝气量采用变频控制器控制,采用电磁流量计监测实时流量。
生物絮凝中试系统设计处理量50 m3·d−1。生物絮凝系统污泥回流比为100%,溶解氧(DO)维持在0.30 mg·L−1左右。为控制该系统内污泥浓度,每日排泥量根据一沉池泥位确定,每日排泥4~8次,生物絮凝系统污泥龄(SRT)为0.2~2 d。按照进水悬浮固体浓度(SS)变化,生物絮凝中试系统的运行可分为进水高SS与进水低SS阶段,其中,进水高SS阶段按照水力停留时间(HRT)变化可分为3个阶段(见表2)。
表 2 生物絮凝系统运行参数Table 2. Operational parameters of bioflocculation system运行阶段 时间/d 流量/(m3·h−1) HRT/h SS/(mg·L−1) 1 1~11 1.25 0.80 1 500~2 400 2 12~22 2.10 0.50 1 500~2 400 3 23~33 3.30 0.30 1 500~2 400 4 34~53 2.10 0.50 400~700 1.3 实验方法
COD、TN、STN、
NH+4 -N、NO−3 -N、TP、STP与PO3−4 -P、MLSS和MLVSS采用标准方法[10]测定。EPS的提取采用NaOH法。首先将10 mL待测样品置于50 mL离心管中超声解体后,分别在2 000、5 000和10 000 r·min−1的转速下离心15 min,并分别收集离心后的上清液,即为含溶解型胞外聚合物(Sol-EPS)、附着型胞外聚合物(LB-EPS)和紧密结合型胞外聚合物(TB-EPS)。用考马斯亮蓝法和蒽酮-硫酸比色法[11]对每层EPS中的蛋白质(PN)和多糖(PS)含量进行测定。
1.4 污水处理过程温室气体排放量核算
污水处理过程中温室气体排放方式分为直接排放与间接排放,所排放温室气体主要有CO2、CH4和N2O[12-13]。此外,因微生物自身呼吸作用产生的CO2不纳入系统温室气体排放量计算范围[14]。2018年,中试系统所在污水处理厂电耗及污染物去除量等数据来自住房和城乡建设部《全国城镇污水处理信息管理系统》平台,生物絮凝系统电耗则来自数字电表。
污水处理厂CH4和N2O排放量根据IPCC方法[15]计算,其中CH4和N2O的温室效应是CO2的25倍和298倍,计算方法如式(1)所示。
E1=TF−R (1) 式中:E1为处理污水过程中CH4的排放量,kg;T为计算年份污水中有机物含量,kg;F为排放因子;R为计算年份回收CH4量,kg;其中F的计算方法如式(2)所示。
F=B0M (2) 式中:B0为CH4的最大生成值,即单位质量有机物转化为CH4的比例,缺省值可取0.2;M为CH4修正因子,依据IPCC推荐值。
E2=44NF/28 (3) 式中:E2为清单年份的N2O排放量,kg·a−1;N为排放至水生环境的污水中的氮含量,kg·a−1。
污水处理厂CO2的间接排放主要发生在电能的消耗过程。CO2的间接排放量通过中国区域电网基准线排放因子和污水处理消耗电能来计算。华北区域电网的2017年电量边际排放因子为1.11 t·(mW·h)−1。
2. 结果与讨论
2.1 生物絮凝系统污染物去除特性
生物絮凝系统进水所含化学除磷药剂可与生物絮凝系统内微生物分泌的EPS发生协同作用,该协同作用可称为生物-化学絮凝作用[16]。EPS可与颗粒态或胶体态等具有不可溶有机物、TN和TP等污染物发生絮凝作用,并沉淀于沉淀池中,随剩余污泥排出生物絮凝系统。混凝剂则通过网捕、吸附架桥和压缩双电子层的方式强化EPS的絮凝作用,并去除进水中的STP。因此,生物絮凝系统可通过生物-化学絮凝作用,截留大量污染物,且去除效果强于单纯化学混凝工艺[17-19]。
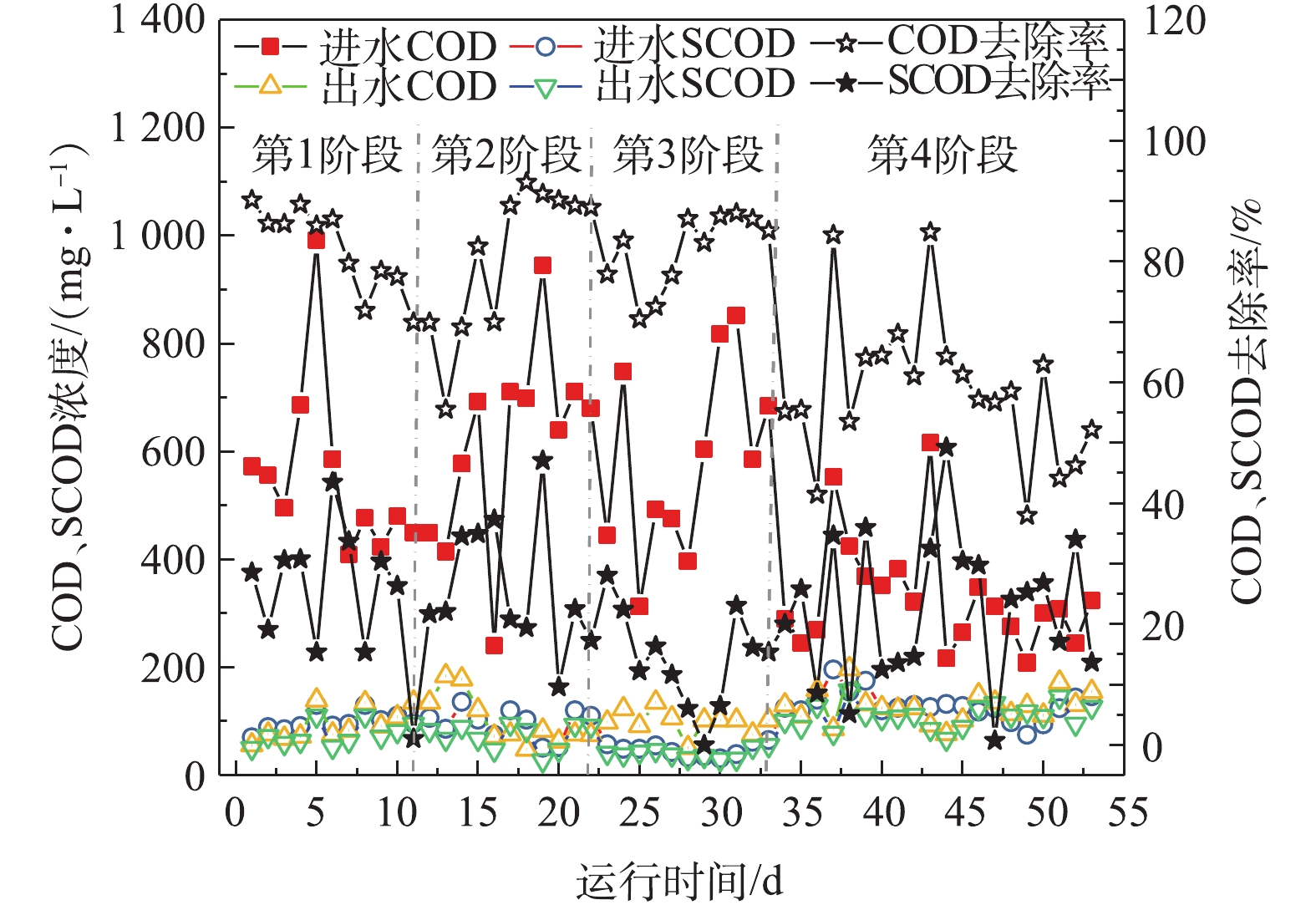
如图2所示,在进水高SS阶段(1~3阶段),HRT由0.80 h降至0.30 h,生物絮凝系统COD去除率变化较小,COD平均去除率分别为82.07%、80.84%和80.03%,出水COD浓度则稳定在100 mg·L−1左右。但SCOD平均去除率分别为24.98%、26.12%、14.35%,出水SCOD浓度分别为75.09、71.73和39.82 mg·L−1。在进水低SS阶段(第4阶段),生物絮凝系统出水COD与SCOD高于1~3阶段,平均值分别为127.60 mg·L−1和109.50 mg·L−1,平均去除率分别为58.73%和22.75%。在1~4阶段,生物絮凝系统COD的去除率远高于SCOD去除率,表明生物絮凝系统可将颗粒态COD絮凝沉淀,进而产生高有机质剩余污泥,为污泥厌氧发酵产酸奠定重要的基础。对比第2和第4阶段可知,进水SS通过影响生物絮凝系统内MLSS从而决定絮凝过程有效碰撞次数[20],进而影响生物絮凝系统COD和SCOD的去除效果。结合图3可知,较高的SS使生物絮凝系统MLSS稳定在较高的水平,提高了生物絮凝系统内有效碰撞次数,进而削弱HRT对COD去除效果的影响。当进水SS降低后(第4阶段),生物絮凝系统的COD截留率也随之明显降低。因此,生物絮凝系统内絮凝效果受进水SS、絮凝剂和HRT等因素影响[20-22]。
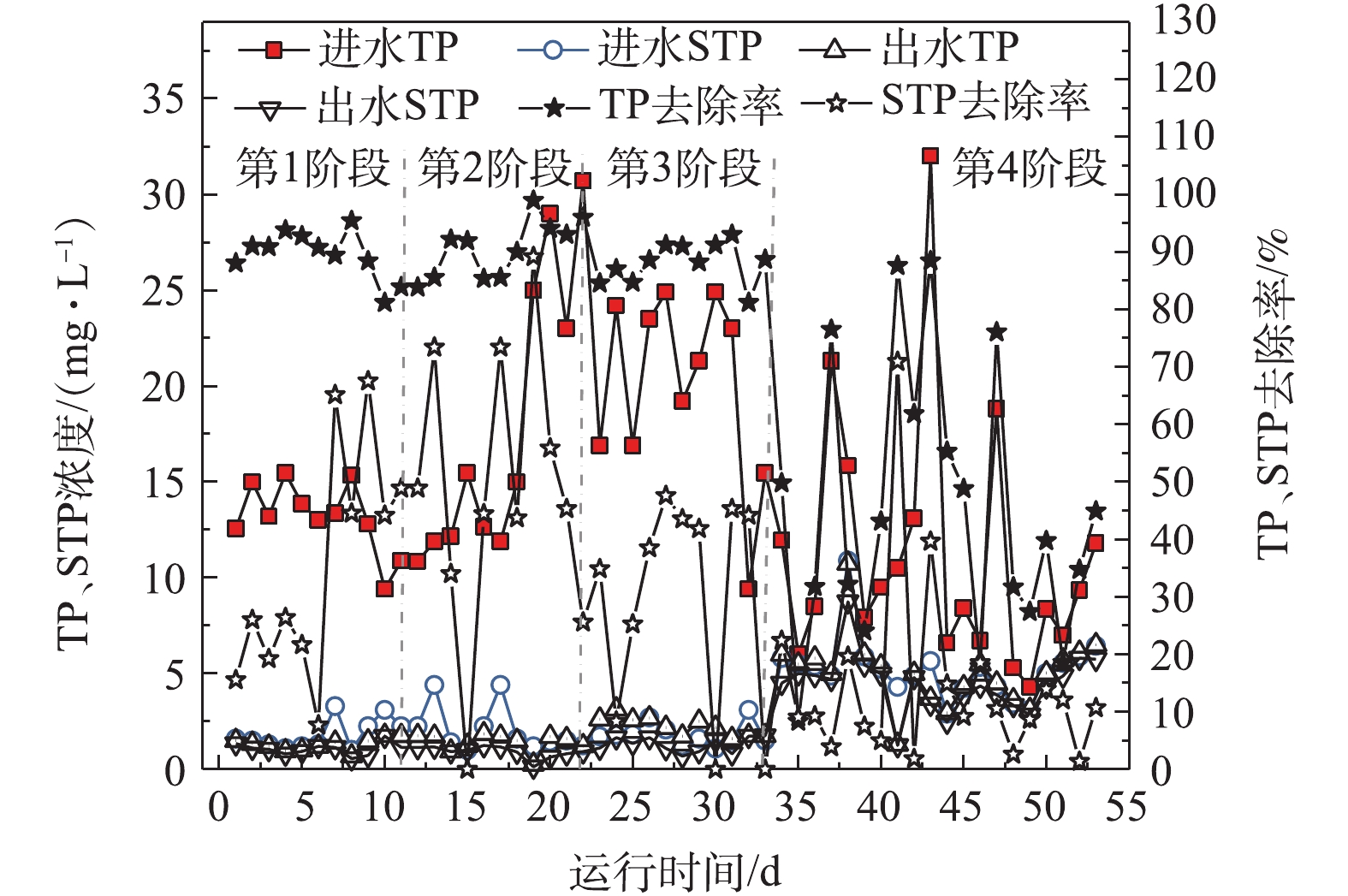
由图4可知,生物絮凝系统对COD和TN去除效果变化趋势类似。生物絮凝系统中因有厌氧环境,故使微生物无法进行反硝化作用,导致该系统对STN去除效果较差。进水高SS阶段(1~3阶段),生物絮凝系统TN和STN去除率受HRT变化影响较小,出水TN和STN稳定在30.57 mg·L−1和28.27 mg·L−1左右。进水低SS阶段(第4阶段),生物絮凝系统出水TN和STN分别为31.54 mg·L−1和28.95 mg·L−1,TN和STN平均去除率为21.24%和4.47%。在1~4阶段,生物絮凝系统出水TN和STN较稳定,表明该系统抗冲击负荷能力较强。如图5所示,生物絮凝系统主要通过生物-化学絮凝作用实现其对进水的颗粒态TP与STP良好去除效果,化学絮凝剂与进水SS变化直接影响到生物-化学絮凝作用的效果。进水高SS阶段(1~3阶段),生物絮凝系统对TP与STP平均去除效果受HRT变化影响较小,出水TP与STP均稳定在1.62 mg·L−1和1.10 mg·L−1。在进水低SS阶段(第4阶段),受进水SS与絮凝剂浓度同时降低的影响,生物絮凝系统出水TP与STP平均值升至5.09 mg·L−1和4.46 mg·L−1,平均去除率为44.96%和14.58%。综上所述,生物絮凝系统对污染物的去除受进水SS、HRT和进水化学絮凝药剂共同作用的影响,进水SS对其影响程度最大。
2.2 生物絮凝系统污染物去除特性
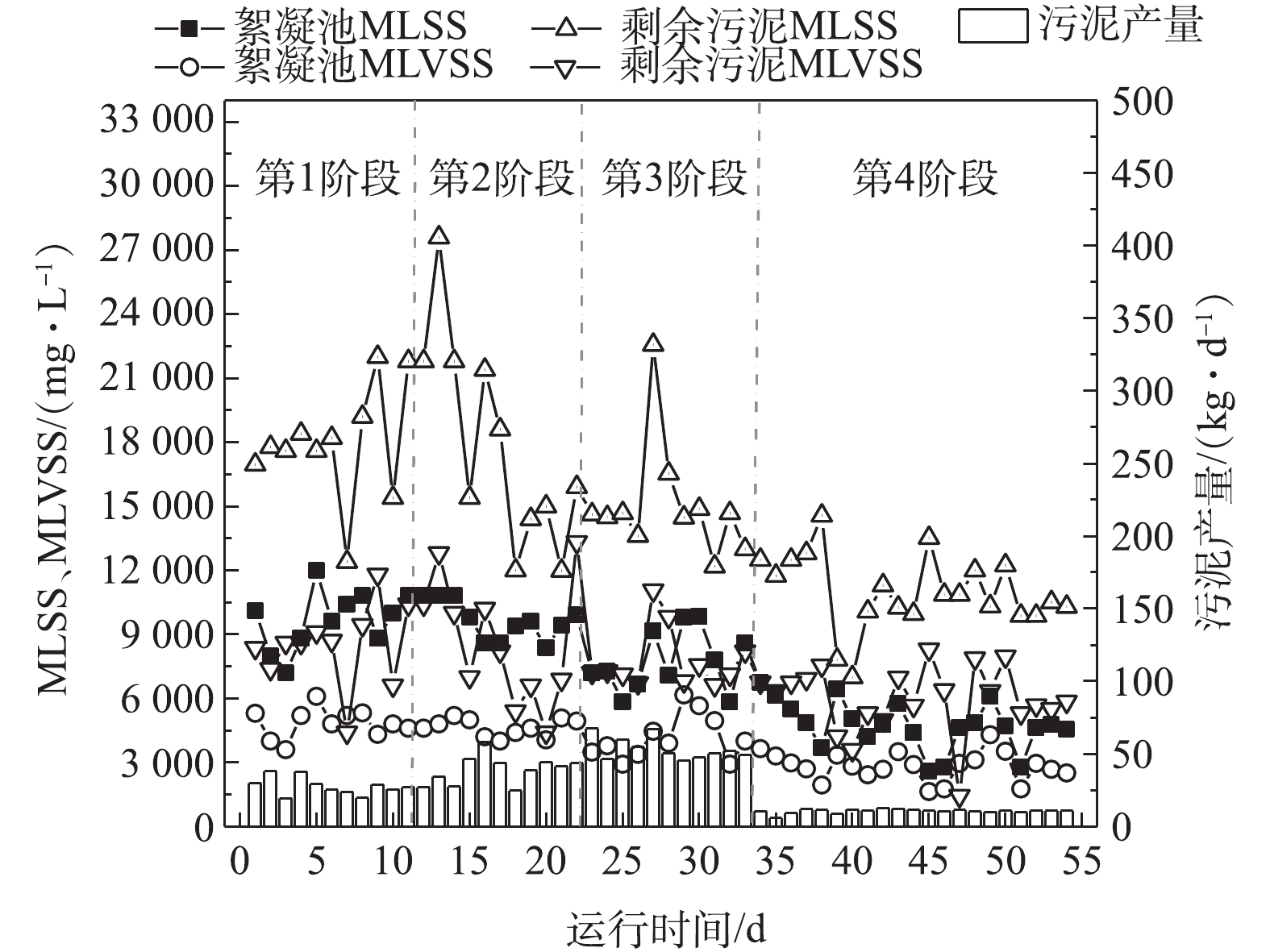
1)生物絮凝系统剩余污泥产量变化。生物絮凝系统通过生物-化学絮凝作用将污染物絮凝沉淀后产生优质剩余污泥,剩余污泥产量与特性随运行条件变化。如图3所示,1~3阶段内进水SS较高,生物絮凝系统日平均污泥产量与HRT呈反比,各阶段平均污泥产量分别为27.66、39.07和53.63 kg·d−1。同时,生物絮凝池内污泥浓度为8 000~10 000 mg·L−1,MLVSS/MLSS平均值分别为0.50、0.48和0.53。剩余污泥浓度为15 000~18 000 mg·L−1,MLVSS/MLSS平均值分别为0.47、0.49和0.52。进水低SS阶段,生物絮凝系统平均污泥产量降低至10.60 kg·d−1,生物絮凝池内MLSS平均值则降至4 760.48 mg·L−1。生物絮凝池内污泥和剩余污泥MLVS/MLSS平均值分别升高至0.60和0.53。剩余污泥产量和有机质含量与HRT呈反比,有机质含量不受进水SS变化影响。生物絮凝系统出水C/N平均值为3.53,剩余污泥厌氧发酵所产有机酸可用于强化后续污水处理工艺脱氮除磷效果。通过核算,发现在进水高SS阶段,生物絮凝系统剩余污泥发酵后,平均有机物产量(以乙酸钠计)分别可达10.28、13.95和21.14 kg·d−1,在进水低SS阶段,有机物产量则为5.67 kg·d−1。
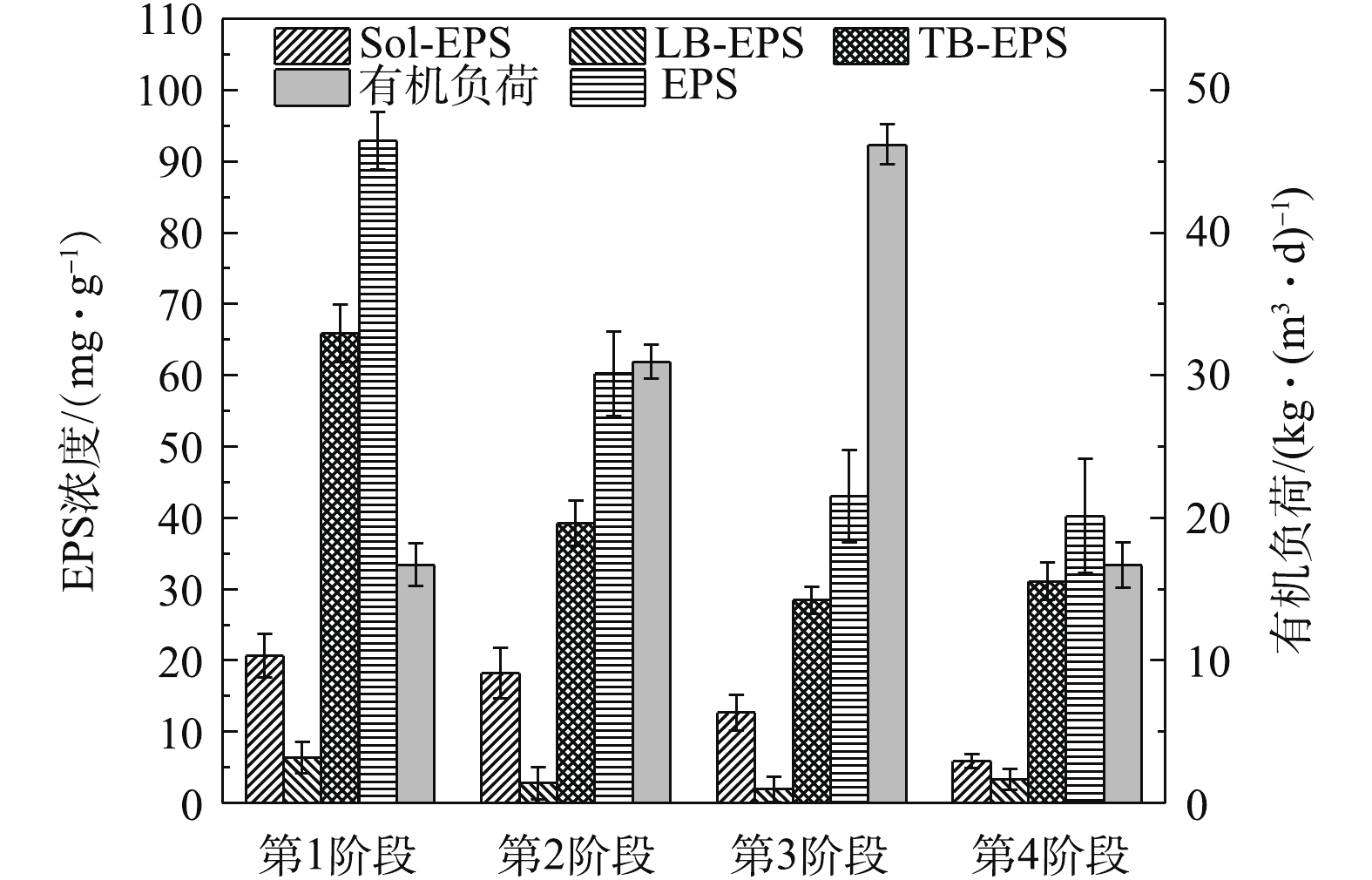
2)生物絮凝污泥EPS合成规律。EPS的合成是影响絮凝效果的关键因素之一,EPS的合成受絮凝剂含量、SS和HRT的共同影响[8, 23-24],而HRT的变化可表现为生物絮凝系统进水有机负荷的变化。EPS可分为Sol-EPS、TB-EPS和LB-EPS 3层,各层EPS功能由其空间结构与化学组成决定。由图6可知,有机负荷升高会抑制生物絮凝系统污泥EPS的合成。第1阶段生物絮凝系统活性污泥的Sol-EPS、LB-EPS和TB-EPS浓度分别为20.68、6.31和65.89 mg·g−1,而接种污泥中3层EPS的浓度分别为6.34、8.19和34.23 mg·g−1,各层EPS浓度差异表明生物絮凝系统内微生物代谢水平已经与传统脱氮除磷工艺内微生物存在差异。生物絮凝系统在1~3阶段内,平均有机负荷由16.70 kg·(m3·d)−1增至46.17 kg·(m3·d) −1,Sol-EPS、LB-EPS、TB-EPS和总EPS浓度均呈下降趋势,表明有机负荷与Sol-EPS、LB-EPS、TB-EPS和总EPS的合成呈反比关系。第4阶段与第2阶段相比,仅进水SS存在差异,但有机负荷降为16.67 kg·(m3·d)−1,EPS也远低于第2阶段,该现象进一步证明了进水SS与HRT会影响微生物EPS的分泌的观点。
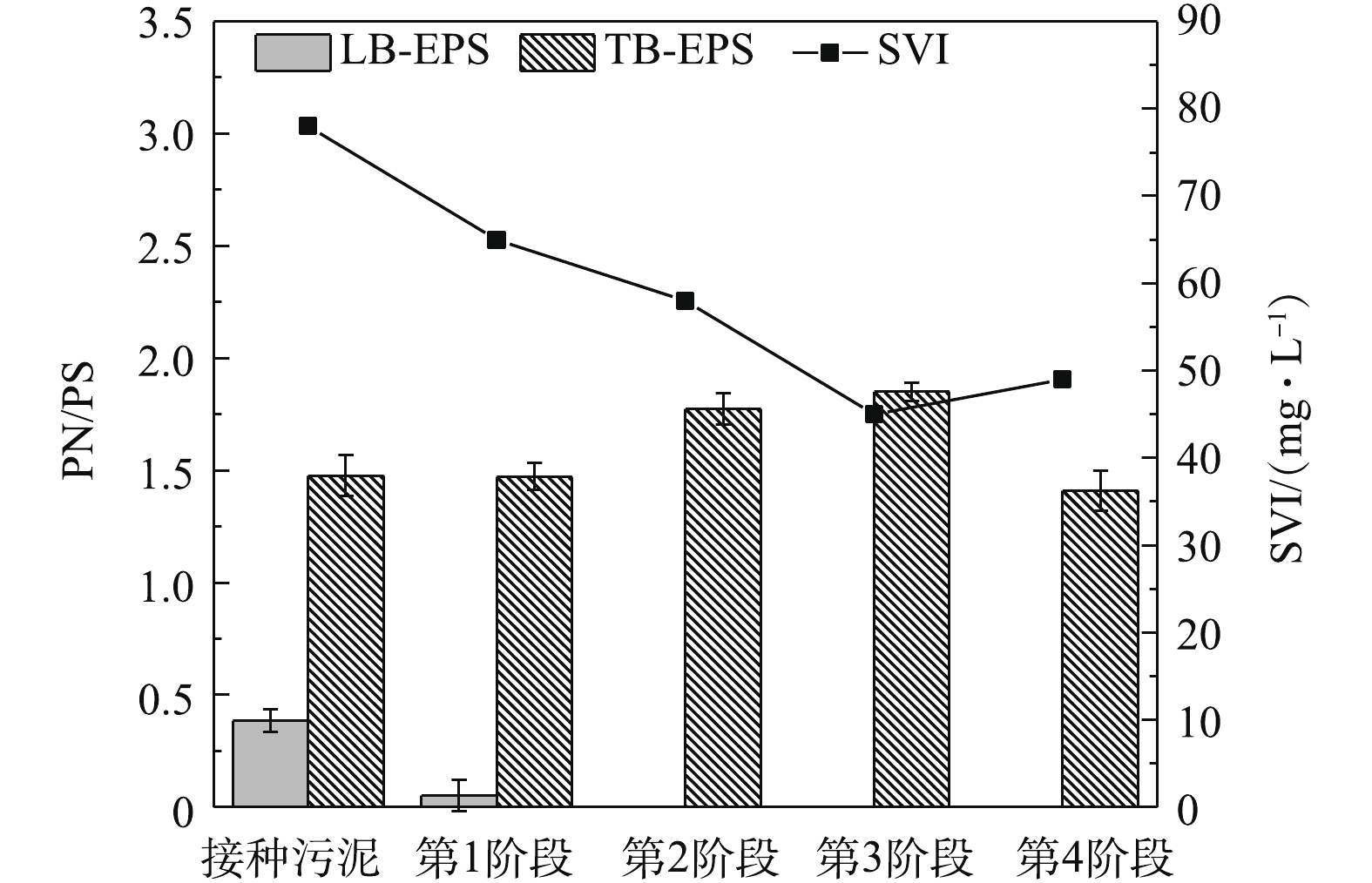
由图7可知,污泥的SVI受EPS中的PN/PS影响,而各层EPS的PN/PS变化受有机负荷和进水絮凝剂共同影响。金属元素(如铁、铝)会降低生物絮凝系统内活性污泥EPS中PN/PS[25],使得接种污泥与1~4阶段污泥LB-EPS的PN/PS相对较低。1~3阶段生物絮凝系统单位时间内化学絮凝剂流入量上升,LB-EPS的PN/PS呈下降趋势。有研究表明,在有机负荷升高后,EPS中PN增量远大于PS增量[26],并且外层EPS对TB-EPS有一定的保护作用,使得TB-EPS组成免受化学絮凝剂的影响,进而使TB-EPS的PN/PS随有机负荷升高呈上升趋势,1~3阶段TB-EPS的PN/PS分别为1.47、1.77和1.85。第4阶段LB-EPS与TB-EPS的PN/PS分别为0和1.41。1~3阶段生物絮凝系统活性污泥的SVI随HRT变化呈下降趋势,SVI分别为78、65和58 mL·g−1,第4阶段SVI升至49 mL·g−1。生物絮凝系统内活性污泥LB-EPS在1~3阶段内呈下降趋势,而第4阶段则小幅上升(图6)。这与王红武等[27]提出LB-EPS与SVI呈正比的结论相符。Al3+、Fe3+等金属阳离子可以促进活性污泥形成絮体,减小活性污泥SVI[28-29],1~3阶段内单位时间生物絮凝系统流入化学絮凝药剂量随HRT的降低呈上升趋势,生物絮凝系统污泥SVI随之逐渐降低。第4阶段,受进水SS降低的影响,进水化学絮凝剂浓度降低,生物絮凝系统污泥SVI小幅上升。
2.3 生物絮凝系统碳减排及电耗
污水处理系统厌氧池内会产生部分CH4,而N2O主要产生自硝化和反硝化过程[30-31]。生物絮凝系统内DO控制在0.30~0.60 mg·L−1,pH控制在7.20左右,SRT控制在0.20~0.50 d,因此,生物絮凝系统内无适宜的厌氧发酵环境。此外,生物絮凝脱氮过程主要通过生物-化学絮凝作用完成,不存在硝化和反硝化过程。因此,生物絮凝系统CH4和N2O的产量可忽略不计。生物絮凝系统所在污水处理厂采用AAO工艺,污水处理过程中厌氧池、缺氧池和好氧池中均会产生部分CH4和N2O。由表3可知,生物絮凝系统所在污水处理厂温室气体排放量(以CO2计)为523.16 g·m−3,而生物絮凝系统温室气体的间接排放量为28.78 g·m−3。进水COD和TN较高不仅会增加污水处理厂电耗,还会提高污水处理工艺温室气体的直接排放量。因此,生物絮凝系统与AAO系统相结合,不仅可降低AAO系统进水33%左右的COD与TN,还可降低温室气体产生量。经核算,若生物絮凝系统与AAO系统组成组合工艺,每处理1 t污水可降低50.20 g的温室气体。此外,生物絮凝系统产生的剩余污泥经厌氧发酵后,有机酸可作为优质碳源提高污水处理厂脱氮除磷效率,减少乙酸钠等碳源使用量,进而降低污水处理成本。
表 3 每吨水温室气体排放量对比(以CO2计算)Table 3. Comparison of greenhouse gas emissions per ton of wastewater (calculated in carbon dioxide)g·m−3 中试系统及处理厂 污水处理过程CH4的排放量 污水处理过程N2O的排放量 用电造成的温室气体排放 温室气体总排放量 生物絮凝中试系统 0 0 28.78 28.78 某污水处理厂 150.38 0.22 372.56 523.16 3. 结论
1)生物絮凝系统抗冲击负荷能力较强,出水COD、TN和TP平均值分别为109.24、30.93和2.95 mg·L−1,平均去除率分别为72.96%、30.84%、72.65%,出水C/N平均值为3.53。此外,生物絮凝作用与化学絮凝作用相结合,可提高污水一级处理对污染物的去除效果,降低二级和三级处理阶段的电能消耗。
2)生物絮凝系统剩余污泥产量与HRT和进水SS呈正比,平均污泥产量最高可达 53.63 kg·d−1。污泥EPS浓度和PN/PS均与有机负荷呈反比。在不同HRT和进水SS条件下,化学絮凝剂通过影响PN/PS和EPS浓度,可间接影响污泥的沉降性能。
3)生物絮凝系统可降低出水C/N,若该工艺与AAO工艺相结合,温室气体排放量预计可降低50.12 g·m−3,剩余污泥资源化利用后可进一步降低污水处理过程中的用电量与温室气体排放量,为污水处理碳中和、节能减排等研究奠定基础。
-
表 1 2,3-DHBA和2,5-DHBA不同时间的含量
Table 1. Contents of 2,3-DHBA and 2,5-DHBA at different times
降解时间/min 2,3-DHBA浓度/(mg·L−1) 2,5-DHBA浓度/(mg·L−1) 4 0.037 3 0.015 5 8 0.022 1 0.014 4 12 0.020 0 0.013 7 表 2 异丙醇降解30 min和60 min的降解产物
Table 2. Products of IPA at 30 min and 60 min degradation
异丙醇降解30 min质谱结果 异丙醇降解60 min质谱结果 保留时间/min 分子式 相对分子质量 相对峰面积/% 保留时间/min 分子式 相对分子质量 相对峰面积/% 2.385 C2H4O2 60.05 46.014 2.278 C2H4O2 60.05 68.57 2.775 C2H8O2Si 92.169 9.246 2.769 C2H8O2Si 92.169 2 11.175 2.865 C3H6O2 74.08 22.436 3.170 C3H8O2 76.09 20.255 3.257 C3H8O2 76.09 22.304 表 3 乙二醇单丁醚降解30 min和60 min的降解产物
Table 3. Products of EB at 30 min and 60 min degradation
乙二醇丁醚降解30 min质谱结果 乙二醇丁醚降解60 min质谱结果 保留时间/min 分子式 相对分子质量 相对峰面积/% 保留时间/min 分子式 相对分子质量 相对峰面积/% 2.184 C4H10O 74.12 7.624 2.329 C2H4O2 60.05 42.980 2.384 C2H4O2 60.05 19.742 2.793 C2H8O2Si 92.169 7.158 2.831 C2H8O2Si 92.169 2 1.453 2.859 (CH2OH)2 62.068 29.959 2.898 (CH2OH)2 62.068 12.649 3.642 C4H8O2 88.105 3.316 3.660 C4H8O2 88.105 1 2.856 4.692 C6H14O2 118.17 12.300 4.605 C6H14O2 118.17 28.126 4.843 C6H14O2 118.17 4.287 4.680 C6H14O2 118.17 25.537 4.854 C4H6O2 86.09 2.013 表 4 因素的初始值和变化值
Table 4. Initial and change values of factors
初始值与变化值 pH CaO质量/g 废液深度/cm 降解时间/min 臭氧用量/(mg·min−1) 初始值 12.0 0 7 60 80 变化值 0.2 1.0 2 20 20 表 5 初始实验条件
Table 5. Initial experimental conditions
实验序号 pH CaO质量/g 废液深度/cm 降解时间/min 臭氧用量/(mg·min−1) 1 12.2 2.0 11 140 200 2 12.4 4.0 13 80 180 3 12.6 6.0 9 160 160 4 12.8 1.0 13 100 140 5 13.0 3.0 9 180 120 6 13.2 5.0 11 120 100 表 6 单纯形优化结果
Table 6. Result of simplex optimization
实验序号 pH CaO质量/g 废液深度/cm 降解时间/min 臭氧用量/(mg·min−1) COD去除率/% 标准差 0.7η+0.1/t+0.2/m 1 12.2 2.0 11 140 200 66.31 0.987 6 0.607 1 2 12.4 4.0 13 80 180 66.97 0.120 2 0.552 1 3 12.6 6.0 9 160 160 83.21 0.720 8 0.653 3 4 12.8 1.0 13 100 140 64.26 2.716 2 0.709 7 5 13.0 3.0 9 180 120 83.4 1.419 3 0.683 8 6 13.2 5.0 11 120 100 62.36 1.007 0 0.526 5 7 12.2 1.4 11 144 200 67.97 1.689 9 0.660 3 8 12.7 1.36 9 180 150 87.24 1.225 3 0.791 1 9 13.2 3.38 9 172 100 91.81 1.565 4 0.736 7 10 12.9 1.0 11 150 120 90.04 0.431 3 0.870 3 11 13.2 2.77 9 175 100 86.8 0.671 7 0.714 3 12 13.2 1.0 11 130 120 75.72 2.517 3 0.776 2 13 13.2 2.804 9 180 100 88.51 2.026 4 0.724 2 -
[1] GHUGE S P, SAROHA A K. Catalytic ozonation for the treatment of synthetic and industrial effluents: Application of mesoporous materials: A review[J]. Journal of Environmental Management, 2018, 211: 83-102. [2] LOU J C, HUANG Y J, HAN J Y. Treatment of printed circuit board industrial wastewater by ferrite process combined with Fenton method[J]. Journal of Hazardous Materials, 2009, 170(2): 620-626. [3] WANG Y, LI X, ZHEN L, et al. Electro-Fenton treatment of concentrates generated in nanofiltration of biologically pretreated landfill leachate[J]. Journal of Hazardous Materials, 2012, 229-230: 115-121. doi: 10.1016/j.jhazmat.2012.05.108 [4] BIANCO B, MICHELIS I D, VEGLIO F. Fenton treatment of complex industrial wastewater: Optimization of process conditions by surface response method[J]. Journal of Hazardous Materials, 2011, 186(2/3): 1733-1738. [5] MINH D P, GALLEZOT P, AZABOU S, et al. Catalytic wet air oxidation of olive oil mill effluents: Treatment and detoxification of real effluents[J]. Applied Catalysis B: Environmental, 2008, 84(3): 749-757. [6] JING G, LUAN M, CHEN T. Progress of catalytic wet air oxidation technology[J]. Arabian Journal of Chemistry, 2016, 9: 1208-1213. doi: 10.1016/j.arabjc.2012.01.001 [7] MEHRJOUEI M, MULLER S, MOLLER D. A review on photocatalytic ozonation used for the treatment of water and wastewater[J]. Chemical Engineering Journal, 2015, 263(1): 209-219. [8] MAMAGHANI A H, HAGHIGHAT F, LEE C S. Photocatalytic oxidation technology for indoor environment air purification: The state-of-the-art[J]. Applied Catalysis B: Environmental, 2017, 203: 247-269. doi: 10.1016/j.apcatb.2016.10.037 [9] WANG Y, XIE Y, SUN H, et al. Efficient catalytic ozonation over reduced graphene oxide for p-hydroxylbenzoic acid (PHBA) destruction: Active site and mechanism[J]. ACS Applied Materials & Interfaces, 2016, 8(15): 9710-9720. [10] LI S, TANG Y, CHEN W, et al. Heterogeneous catalytic ozonation of clofibric acid using Ce/MCM-48: Preparation, reaction mechanism, comparison with Ce/MCM-41[J]. Journal of Colloid & Interface Science, 2017, 504: 238-246. [11] CHEN C, YOZA B A, CHEN H, et al. Manganese sand ore is an economical and effective catalyst for ozonation of organic contaminants in petrochemical wastewater[J]. Water, Air & Soil Pollution, 2015, 226(6): 182. [12] CHAO S, YOU X, MING H, et al. Mesoporous Ce-Ti-Zr ternary oxide millispheres for efficient catalytic ozonation in bubble column[J]. Chemical Engineering Journal, 2018, 338: 261-270. doi: 10.1016/j.cej.2018.01.046 [13] EINAGA H, FUTAMURA S. Oxidation behavior of cyclohexane on alumina-supported manganese oxides with ozone[J]. Applied Catalysis B: Environmental, 2005, 60(1): 49-55. [14] CAO H, XING L, WU G, et al. Promoting effect of nitration modification on activated carbon in the catalytic ozonation of oxalic acid[J]. Applied Catalysis B: Environmental, 2014, 146(1): 169-176. [15] UMAR M, RODDICK F, FAN L, et al. Application of ozone for the removal of bisphenol A from water and wastewater: A review[J]. Chemosphere, 2013, 90(8): 2197-2207. doi: 10.1016/j.chemosphere.2012.09.090 [16] KATSOYIANNIS I A, CANONICA S, GUNTEN U V. Efficiency and energy requirements for the transformation of organic micropollutants by ozone, O/HO and UV/HO[J]. Water Research, 2011, 45(13): 3811-3822. doi: 10.1016/j.watres.2011.04.038 [17] ZHAO L, MA J, SUN Z, et al. Mechanism of heterogeneous catalytic ozonation of nitrobenzene in aqueous solution with modified ceramic honeycomb[J]. Applied Catalysis B: Environmental, 2009, 89(3): 326-334. [18] IKHLAQ A, BROWN D R, KASPRZYK-HORDERN B. Catalytic ozonation for the removal of organic contaminants in water on alumina[J]. Applied Catalysis B: Environmental, 2014, 154-155(14): 110-122. [19] NAWROCKI J. Catalytic ozonation in water: Controversies and questions[J]. Applied Catalysis B: Environmental, 2013, 142-143(5): 465-471. [20] NAWAZ F, XIE Y, CAO H, et al. Catalytic ozonation of 4-nitrophenol over an mesoporous α-MnO2 with resistance to leaching[J]. Catalysis Today, 2015, 258: 595-601. doi: 10.1016/j.cattod.2015.03.044 [21] NAWAZ F, CAO H, XIE Y, et al. Selection of active phase of MnO2 for catalytic ozonation of 4-nitrophenol[J]. Chemosphere, 2016, 168: 1457-1466. [22] HAO Z, MA W, HAN H, et al. Catalytic ozonation of quinoline using Nano-MgO: Efficacy, pathways, mechanisms and its application to real biologically pretreated coal gasification wastewater[J]. Chemical Engineering Journal, 2017, 327: 91-99. doi: 10.1016/j.cej.2017.06.025 [23] MOUSSAVI G, MAHMOUDI M. Degradation and biodegradability improvement of the reactive red 198 azo dye using catalytic ozonation with MgO nanocrystals[J]. Chemical Engineering Journal, 2009, 152(1): 1-7. doi: 10.1016/j.cej.2009.03.014 [24] MASHAYEKH-SALEHI A, MOUSSAVI G, YAGHMAEIAN K. Preparation, characterization and catalytic activity of a novel mesoporous nanocrystalline MgO nanoparticle for ozonation of acetaminophen as an emerging water contaminant[J]. Chemical Engineering Journal, 2017, 310: 157-169. doi: 10.1016/j.cej.2016.10.096 [25] YUAN X, YAN X, XU H, et al. Enhanced ozonation degradation of atrazine in the presence of nano-ZnO: Performance, kinetics and effects[J]. Journal of Environmental Sciences, 2017, 61: 3-13. doi: 10.1016/j.jes.2017.04.037 [26] BASHIRI H, RAFIEE M. Kinetic monte carlo simulation of 2, 4, 6-thrichloro phenol ozonation in the presence of ZnO nanocatalyst[J]. Journal of Saudi Chemical Society, 2016, 20(4): 474-479. doi: 10.1016/j.jscs.2014.11.001 [27] YANG Y, CAO H, PENG P, et al. Degradation and transformation of atrazine under catalyzed ozonation process with TiO2 as catalyst[J]. Journal of Hazardous Materials, 2014, 279: 444-451. doi: 10.1016/j.jhazmat.2014.07.035 [28] GUPTA V K, FAKHRI A, AGARWAL S, et al. Preparation and characterization of TiO2 nanofibers by hydrothermal method for removal of benzodiazepines (Diazepam) from liquids as catalytic ozonation and adsorption processes[J]. Journal of Molecular Liquids, 2017, 249: 1033-1038. [29] VITTENET J, ABOUSSAOUD W, MENDRET J, et al. Catalytic ozonation with γ-Al2O3 to enhance the degradation of refractory organics in water[J]. Applied Catalysis A: General, 2015, 504: 519-532. doi: 10.1016/j.apcata.2014.10.037 [30] IKHLAO A, BROWN D R, KASPRZYK-HORDERN B. Mechanisms of catalytic ozonation on alumina and zeolites in water: Formation of hydroxyl radicals[J]. Applied Catalysis B: Environmental, 2012, 123-124: 94-106. doi: 10.1016/j.apcatb.2012.04.015 [31] DAI Q, WANG J, JIE Y, et al. Catalytic ozonation for the degradation of acetylsalicylic acid in aqueous solution by magnetic CeO2 nanometer catalyst particles[J]. Applied Catalysis B: Environmental, 2014, 144(2): 686-693. [32] ROSAL R, GONZALO M S, RODRIGUEZ A, et al. Catalytic ozonation of atrazine and linuron on MnOx/Al2O3 and MnOx/SBA-15 in a fixed bed reactor[J]. Chemical Engineering Journal, 2010, 165(3): 806-812. doi: 10.1016/j.cej.2010.10.020 [33] GOMES J F, BEDNARCZYK K, GMUREK M, et al. Noble metal-TiO2 supported catalysts for the catalytic ozonation of parabens mixtures[J]. Process Safety and Environmental Protection, 2017, 111: 148-159. doi: 10.1016/j.psep.2017.07.001 [34] LIU Z Q, TU J, WANG Q, et al. Catalytic ozonation of diethyl phthalate in aqueous solution using graphite supported zinc oxide[J]. Separation & Purification Technology, 2018, 200: 51-58. [35] SUI M, XING S, SHENG L, et al. Heterogeneous catalytic ozonation of ciprofloxacin in water with carbon nanotube supported manganese oxides as catalyst[J]. Journal of Hazardous Materials, 2012, 227-228: 227-236. doi: 10.1016/j.jhazmat.2012.05.039 [36] LIAO M, CHEN J, LI L, et al. Effective degradation of nitrotoluenes in wastewater by heterogeneous catalytic ozonation in the presence of calcium oxide[J]. AIP Conference Proceedings, 2017, 1890(1): 020008. [37] BROSEUS R, VINCET S, ABOULFADL K, et al. Ozone oxidation of pharmaceuticals, endocrine disruptors and pesticides during drinking water treatment[J]. Water Research, 2009, 43(18): 4707-4717. doi: 10.1016/j.watres.2009.07.031 [38] HUANG X, LI X, PAN B, et al. Self-enhanced ozonation of benzoic acid at acidic pHs[J]. Water Research, 2015, 73: 9-16. doi: 10.1016/j.watres.2015.01.010 [39] ZHANG S, QUAN X, ZHENG J F, et al. Probing the interphase " HO zone” originated by carbon nanotube during catalytic ozonation[J]. Water Research, 2017, 122: 86-95. doi: 10.1016/j.watres.2017.05.063 [40] WANG Q, DING F, ZHU N, et al. Determination of hydroxyl radical by capillary zone electrophoresis with amperometric detection[J]. Journal of Chromatography A, 2003, 1016(1): 123-128. doi: 10.1016/S0021-9673(03)01294-9 [41] WANG J, BAI Z. Fe-based catalysts for heterogeneous catalytic ozonation of emerging contaminants in water and wastewater[J]. Chemical Engineering Journal, 2016, 312: 79-98. [42] BAI Z, QI Y, WANG J. Catalytic ozonation of sulfamethazine using Ce0.1Fe0.9OOH as catalyst: Mineralization and catalytic mechanisms[J]. Chemical Engineering Journal, 2016, 300: 169-176. doi: 10.1016/j.cej.2016.04.129 [43] HUANG Y, CUI C, ZHANG D, et al. Heterogeneous catalytic ozonation of dibutyl phthalate in aqueous solution in the presence of iron-loaded activated carbon[J]. Chemosphere, 2015, 119: 295-301. doi: 10.1016/j.chemosphere.2014.06.060 -




 DownLoad:
DownLoad: