-
污水中含有大量的细菌等对人体有害的物质。经过城市污水处理厂二级生化处理后虽然可以大大降低水中细菌的浓度,但出水中仍然含有数量可观的细菌,会造成潜在的危险,消毒是保证出水安全性的重要措施。紫外线消毒由于其具有消毒效率高,灭菌广谱,有害消毒副产物量少以及操作简单等优势[1-3],在污水、再生水、饮用水处理过程中已得到广泛的应用。但紫外线不具有持久的消毒能力,消毒出水中微生物存在光复活现象,即微生物在可见光照射下,通过自身损伤修复机制修复紫外线造成的DNA损伤,重新获得活性,从而使水质无法达到使用和回用标准,产生安全健康风险[4-6]。因此,提高出水中紫外光消毒效果,抑制出水中微生物的光复活对于保证出水水质安全具有重要的意义。
过硫酸盐(PS)在降解顽固污染物[7]以及处理生物危害[8]等方面具有优异表现,在工业、消毒和分析等领域有着广泛的应用[9]。过硫酸盐可通过多种活化方式产生硫酸根自由基(
SO⋅−4 ),SO⋅−4 具有极高的氧化还原电位,能够降解多种难去除有机污染物[10]。蒋梦迪等[11]利用热活化过硫酸盐降解三氯生,探讨了热活化的有效性;高金龙等[12]研究表明,二价铁活化过硫酸盐能有效降解土壤中十溴联苯醚;孙昕等[13]采用真空紫外/过二硫酸盐去除饮用水中嗅味物质,解决了饮用水的嗅味问题。UV-PS工艺一直以来大多用于有机物处理,但其作用原理证明其适合用于微生物灭活。本研究以粪便污染指示菌大肠杆菌为研究对象,采用紫外联合过硫酸盐进行水中大肠杆菌灭活,考察各反应条件对大肠杆菌杀灭的影响,并对单独UV消毒和UV-PS 2种不同方法消毒后水中大肠杆菌光复活性能进行研究,分析UV-PS联合消毒对水中大肠杆菌光复活能力的影响。 -
受试菌种:大肠杆菌,由常州大学生物医学工程与健康科学研究院提供。
实验水样:将−80 ℃冰箱中保存的冰冻菌种融化后接种10 µL于5 mL营养肉汤培养基中,于37 ℃、100 r·min−1下振荡培养16 h,再以1 000 r·min−1离心1 min,将沉淀重新悬浮于灭菌生理盐水中,重复2次以去除培养基。将最终的沉淀溶于100 mL灭菌水中得到菌悬液。根据实验要求配制初始浓度约为107 CFU·mL−1的菌悬液作为实验水样。
-
过硫酸钾(K2S2O8)、七水合硫酸亚铁(FeSO4·7H2O),氢氧化钠(NaOH)、硫酸(H2SO4)均为分析纯。
离心机(3K15,西格玛奥德里奇(上海)贸易有限公司);激光共聚焦显微镜(LSM 710,德国卡尔蔡司公司);场发射扫描电子显微镜(Hitachi TM-1000,株式会社日立制作所);超低温冰箱(DW-HL398S,长虹美菱股份有限公司);洁净工作台(北京东联哈尔仪器制造有限公司);笔式pH计(RPB10型,上海今迈仪器仪表有限公司);低压汞灯(15 W,0.104 mW·cm−2,荷兰皇家飞利浦公司);多通道型紫外辐照计UV-M(辽宁赛亚斯科技有限公司)。
-
紫外光源为低压汞灯,紫外灯主波长为254 nm,功率为15 W,额定工作电压为220 V,其装置如图1所示。紫外线强度采用多通道型紫外辐照计UV-M(辽宁赛亚斯科技有限公司)测定。
-
UV及UV-PS消毒实验。将90 mL实验大肠杆菌水样加入到无菌培养皿中(d=12 cm),大肠杆菌的起始浓度约为107 CFU·mL−1,随后向该溶液中加入5 mL所需浓度的PS储备液以及5 mL所需浓度的FeSO4·7H2O储备液后,立即置于紫外灯下开启反应;在分析pH对反应的影响时,预先使用H2SO4(0.1 mol·L−1)或NaOH(0.1 mol·L−1)溶液以调节初始pH;在无PS或FeSO4·7H2O的实验中,使用相应体积的蒸馏水代替。培养皿中细胞悬浮液的深度为1 cm。每组实验重复3次。
单独PS消毒实验。将90 mL实验大肠杆菌水样加入到无菌培养皿中(d=12 cm),大肠杆菌的起始浓度约为107 CFU·mL−1,随后向该溶液中加入10 mL所需浓度的PS储备液以开始反应,培养皿中细胞悬浮液的深度为1 cm。每组实验重复3次。
空白实验。取100 mL实验大肠杆菌水样于无菌培养皿中(d=12 cm),相同时间点取样计算大肠杆菌浓度。每组实验重复3次。
-
经消毒后的水样立即进行光复活实验。以15 W日光灯为光源,调整光源与水面的距离,研究在365 nm[14]处0、8、20、42 µW·cm−2光源强度下水中细菌的光复活情况,光源强度采用多通道型紫外辐照计UV-M(辽宁赛亚斯科技有限公司)测定。采用磁力搅拌子搅拌水样,延长光照时间分别为0、2、4、8、12、24 h,测定不同光复活时间后水样中的大肠杆菌浓度。
-
定时取样1 mL,并用无菌水以10倍浓度梯度连续稀释(保证平板中细菌数在30~300 个之间),然后立即取1 mL和约15 mL融化后温度不高于40 ℃的营养琼脂培养基混合,迅速摇匀,待培养基凝固后将平板倒置于在37 ℃培养箱中培养24 h,计菌落数。每个样品做3个平行样。平板最低检出限为1 CFU·mL−1。
大肠杆菌对数去除率根据式(1)计算。
式中:E为对数去除率;N0为溶液中大肠杆菌初始数,CFU·mL−1;Nt为t时刻溶液中大肠杆菌浓度,CFU·mL−1。
复活百分比根据式(2)计算。
式中:R为复活百分比;N0为溶液中大肠杆菌初始浓度,CFU·mL−1;N为自紫外线照射后水样中的大肠杆菌数,CFU·mL−1;Np为光复活后水样中的大肠杆菌数,CFU·mL−1。
-
死/活荧光染色实验考察了消毒剂是否破坏细菌细胞膜的情况。在15 ℃以下,以14 000 r·min−1离心10 min收获所有细菌样品。将样品重悬于生理盐水中至终体积为0.5 mL。将等体积(0.5 μL)的SYTO9和PI染料溶液分别加入到实验组和对照组的样品中。将样品在黑暗中放置30 min后,在激光共聚焦显微镜下观察。
扫描电子显微镜(SEM)观察了细胞表面形态的变化。在15 ℃以下,以14 000 r·min−1离心10 min收获所有细菌样品,弃上清液。加入2.5%戊二醛4 ℃固定过夜。用0.1 mol·L−1的PBS将样品漂洗3次,每次15 min;接着梯度乙醇溶液(30%、50%、70%、80%、90%、95%)对样品进行脱水处理,各15 min。再用乙醇与醋酸异戊酯的混合液处理样品30 min,最后用纯醋酸异戊酯处理样品1 h。临界点干燥。镀膜,观察。处理好的样品在扫描电镜中观察。
-
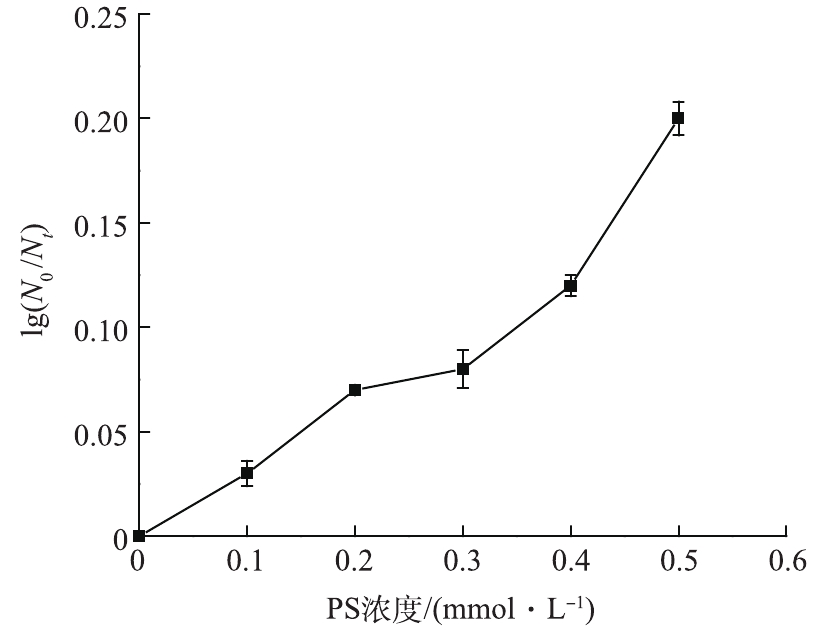
实验首先考察PS对大肠杆菌的杀灭效果。在室温条件下,保持反应体系初始pH为7,大肠杆菌的初始浓度为1.2×107 CFU·mL−1,考察不同PS初始浓度对大肠杆菌对数去除率的影响,反应30 min后结果如图2所示。可以看出,单独PS对大肠杆菌杀灭作用有限,当PS浓度从0.1 mmol·L−1增加到0.5 mmol·L−1时,大肠杆菌对数去除率从0.03个对数级增加到0.2个对数级。这主要是由于
S2O2−8 本身具有一定氧化能力(标准电极电位2.01 V),对大肠杆菌有一定杀灭作用。 -
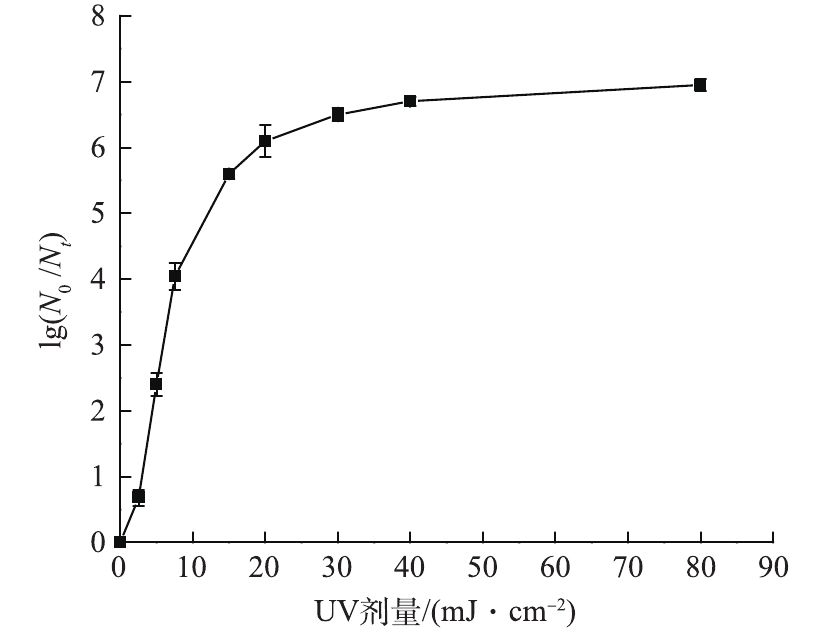
在室温条件下,保持反应体系初始pH为7,大肠杆菌的初始浓度为1.1×107 CFU·mL−1,单独UV消毒对大肠杆菌的灭活如图3所示。随着紫外剂量的增加,大肠杆菌迅速被灭活,当紫外剂量达到15 mJ·cm−2时,大肠杆菌的对数去除率达到5.6个对数级。继续增加紫外剂量,UV对大肠杆菌的灭活进入拖尾阶段。即达到一定紫外剂量后,继续增加紫外剂量大肠杆菌对数去除率保持一定水平不变。拖尾现象主要是由于微生物表面性质发生变化产生的自我聚集现象引起的[15-16]。当紫外剂量达到40 mJ·cm−2和80 mJ·cm−2时,大肠杆菌对数去除率分别达到6.7个对数级和6.95个对数级,几乎完全灭活。
-
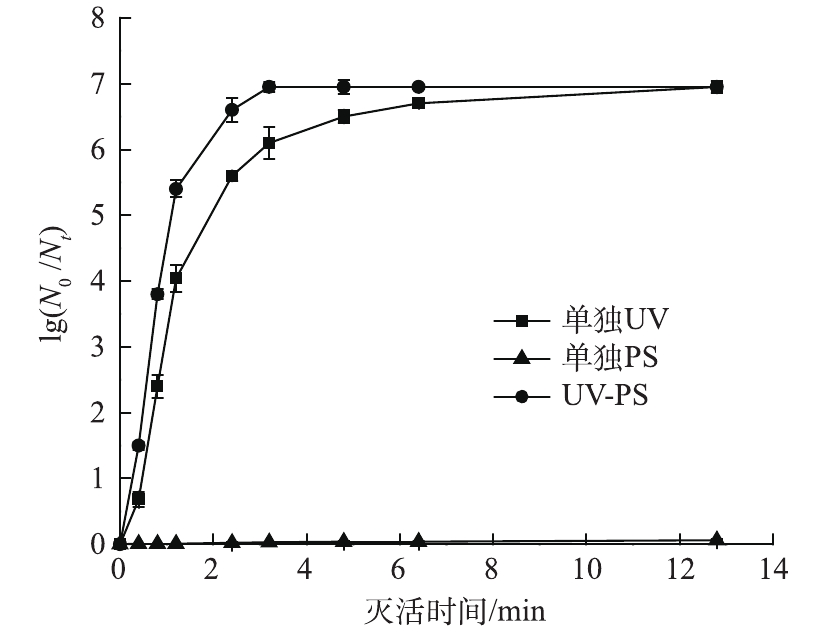
研究了UV、PS以及UV-PS联用杀灭大肠杆菌,实验条件为固定紫外光强为0.104 mW·cm−2、保持反应体系初始pH为7、大肠杆菌的初始浓度为1.1×107 CFU·mL−1、PS初始浓度为0.3 mmol·L−1,结果如图4所示。可以看出,0.3 mmol·L−1 PS对大肠杆菌几乎无杀灭效果;UV-PS联合消毒效率也高于单独UV消毒。这主要是由于UV与PS产生了协同作用。紫外线依靠破坏微生物细胞内DNA或RNA的分子结构,进而影响其复制而不破坏其细胞膜达到灭菌的目的[17-18]。而UV-PS联合消毒在紫外光对水中微生物灭活的同时,过硫酸盐经紫外激活产生
SO⋅−4 ,如式(3)所示,SO⋅−4 具有较高的氧化还原电位(2.6~3.1 V)。氧化剂能够通过攻击、氧化和瓦解细胞膜、细胞壁,同时也能扩散进细胞内部,对其内容物及DNA进行氧化破坏[19-20]。因此,UV-PS联合消毒效率高于单独UV消毒效率。 -
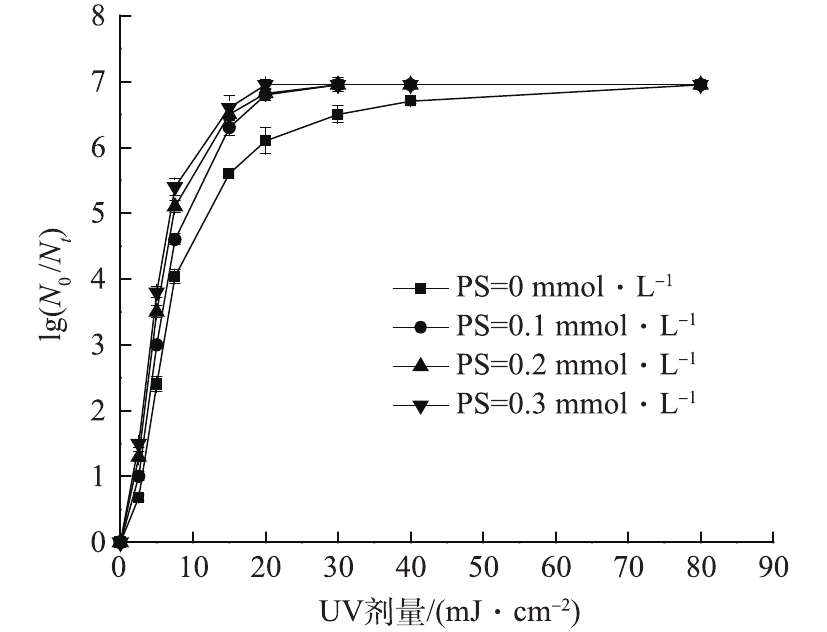
在室温条件下,固定紫外光强为0.104 mW·cm−2,保持反应体系初始pH为7,大肠杆菌的初始浓度为1.3×107 CFU·mL−1,考察PS初始浓度在0.1~0.3 mmol·L−1范围内变化时对大肠杆菌对数去除率的影响,结果如图5所示。由图5可以看出,紫外剂量相同时,大肠杆菌对数去除率随着PS初始浓度的增大而增大。15 mJ·cm−2的紫外剂量下,PS初始浓度为0.1 mmol·L−1时,大肠杆菌对数去除率为6.3个对数级;在0.3 mmol·L−1初始浓度下达到6.6个对数级;而单独UV仅有5.6个对数级的对数去除率。这表明在一定范围内,增加PS的初始浓度能够提高大肠杆菌杀灭效果。这是由于随着PS投加量的增加,反应体系中产生了越来越多的
SO⋅−4 ,因而可以更有效的杀灭大肠杆菌。有研究[21]表明,过量的过硫酸盐会降低目标污染物的降解速率,其原因可能是
SO⋅−4 会与SO⋅−4 或过量的S2O2−8 反应,消耗一定量的SO⋅−4 ,导致降解污染物的SO⋅−4 变少,污染物降解速率下降,如式(4)和式(5)所示。但在本实验中未观察到PS投加量对大肠杆菌杀灭效果的抑制现象,这可能是由于PS的最高投加量(0.3 mmol·L−1)未达到抑制大肠杆菌杀灭效果的临界值。 -
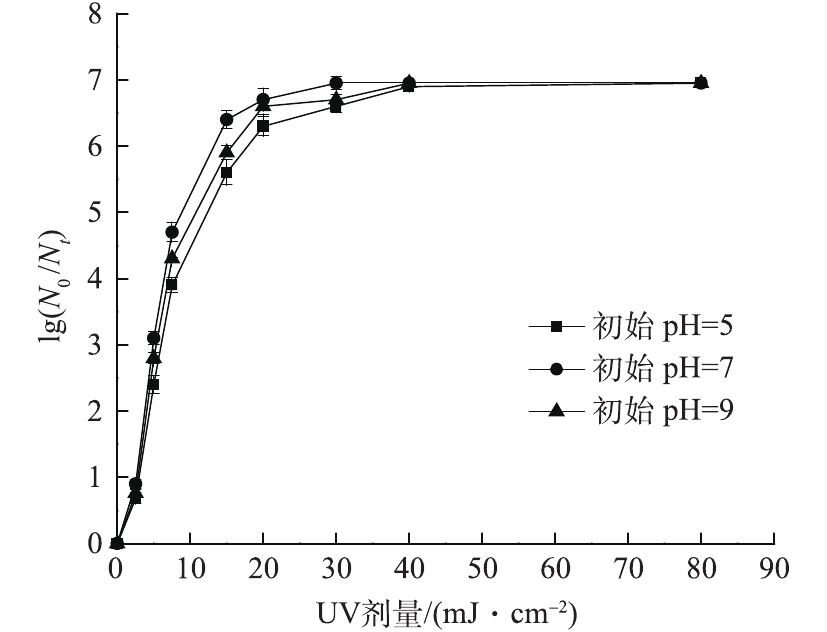
在室温条件下,固定紫外光强为0.104 mW·cm−2,PS初始浓度为0.3 mmol·L−1,大肠杆菌的初始浓度为1.1×107 CFU·mL−1,分别调节溶液初始pH分别为5、7、9进行实验。考察在不同初始pH条件下,体系对大肠杆菌对数去除率的影响,结果如图6所示。可以看出,紫外剂量相同时,pH为7时大肠杆菌对数去除率最高,15 mJ·cm−2的紫外剂量下,达到6.4个对数级。这主要是由于在酸性条件下,过硫酸盐反应生成
SO⋅−4 的过程中会受到水中某些离子干扰,过硫酸盐会和水中硫酸根离子、氢离子等发生反应,故反应速率下降[22]。在碱性条件下,体系中的SO⋅−4 将转化为·OH,体系中以·OH为主,如式(6)所示。由式(7)~式(9)中·OH和SO⋅−4 的氧化还原电位值可知,碱性状态下·OH的电位(1.8 V)明显小于酸性条件下的·OH(2.7 V)和SO⋅−4 (2.6~3.1 V)的电位,导致整体氧化能力的降低。所以在实验范围内,当pH为7时体系对大肠杆菌的杀灭效果最佳。 -
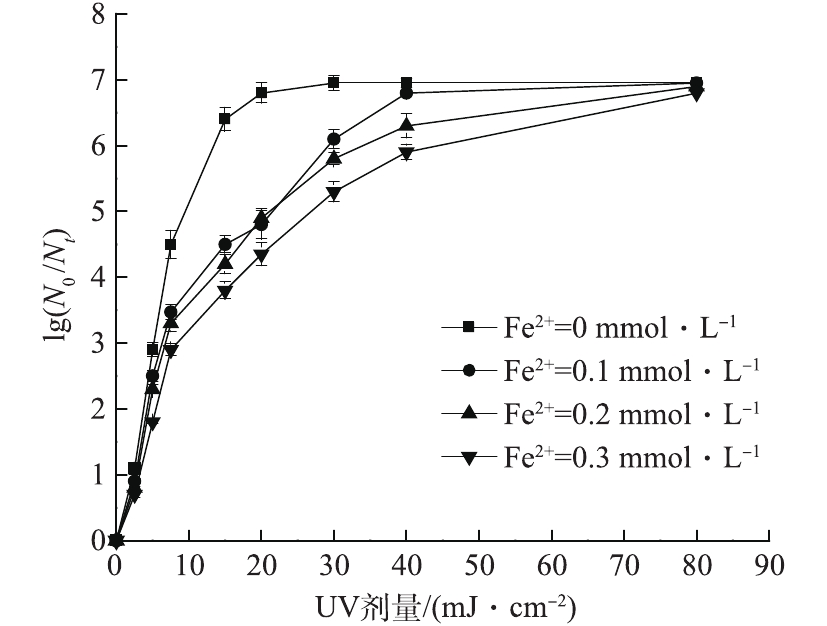
过渡金属离子常被用来活化PS产生
SO⋅−4 处理有机物[12]。由于Fe2+在常温条件下即可快速激活PS产生SO⋅−4 ,且其廉价易得,反应体系简单。因此,本小节选择反应条件温和且活化效率高的Fe2+作为活化剂,考察Fe2+的加入对UV-PS体系的影响。在室温条件下,固定紫外光强为0.104 mW·cm−2,保持反应体系初始pH为7、PS初始浓度为0.3 mmol·L−1、大肠杆菌的初始浓度为0.9×107 CFU·mL−1,考察Fe2+浓度在0.1~0.3 mmol·L−1范围内变化时对大肠杆菌对数去除率的影响,结果如图7所示。可以看出,紫外剂量相同时,大肠杆菌对数去除率随着Fe2+浓度的增加而降低。15 mJ·cm−2的紫外剂量下,当Fe2+浓度从0.1 mmol·L−1增加到0.3 mmol·L−1时,大肠杆菌对数去除率从4.5个对数级降低到3.8个对数级。Fe2+对大肠杆菌对数灭活率的影响一方面是由于铁离子在水中吸收部分紫外光[23],因此在灭活过程中紫外线被水中的铁离子吸收,使得微生物接受的紫外线照射会减少,导致灭活效果减弱;另一方面由于铁易形成絮体,多孔的物质可以吸附包裹微生物避免其受到紫外线照射[24]。所以相比于活化PS产生
SO⋅−4 ,Fe2+的负面作用更为显著,导致随着Fe2+浓度的增加大肠杆菌的对数去除率降低。 -
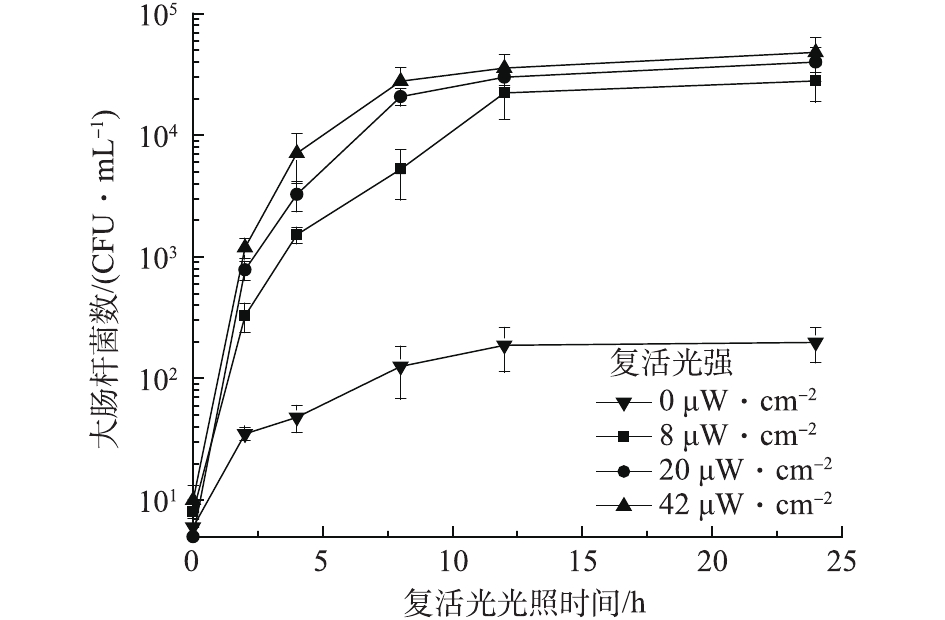
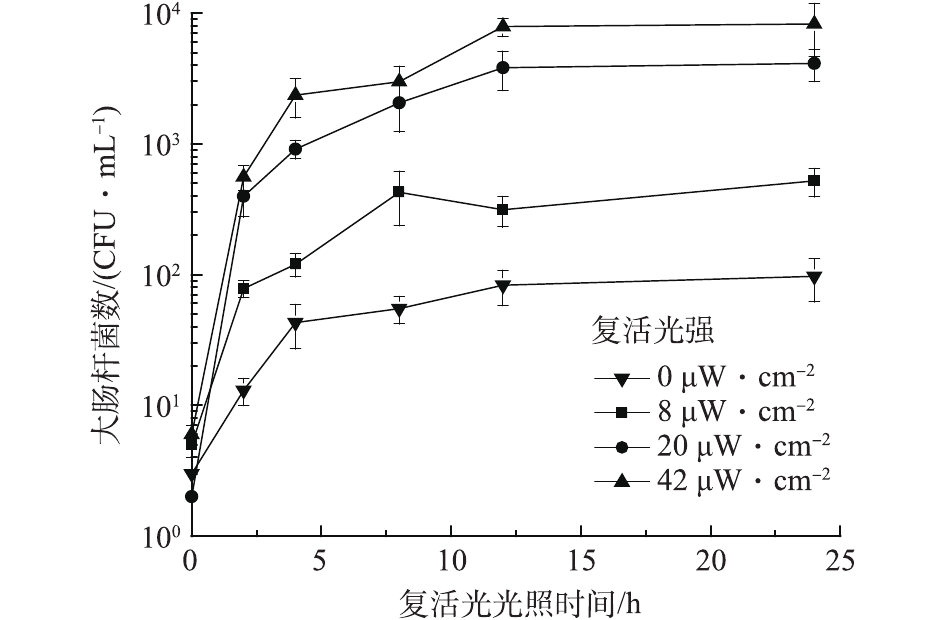
在室温条件下,固定紫外光强为0.104 mW·cm−2,保持反应体系初始pH为7、PS初始浓度为0.3 mmol·L−1、大肠杆菌的初始浓度为1.0×107 CFU·mL−1。实验水样分别经过20 mJ·cm−2单独UV和20 mJ·cm−2 UV-PS处理后,置于不同复活光强度下进行照射,从而得到大肠杆菌的光复活情况,结果如图8和图9所示。可以看出,水样分别经过UV和UV-PS消毒后均有光复活发生,且复活光强越高,复活速度越快。这主要是由于在较强的复活光强度下,细菌恢复受损细胞结构所接受的能量越高,从而光复活速度也越快[25-26]。
但水样在分别经过单独UV处理和UV-PS处理后,大肠杆菌的光复活能力表现不同,经过UV-PS处理后大肠杆菌光复活能力明显下降。在单独UV辐射后,水样在20 µW·cm−2复活光强照射24 h后,大肠杆菌的最大复活百分比达到0.38%,与郭美婷等[27]0.4%的最大复活百分比一致。而在UV-PS辐射后,水样在20 µW·cm−2复活光强照射24 h后,大肠杆菌最大复活百分比仅为0.03%,明显低于单独UV处理后最大复活百分比。
除此之外,在单独UV消毒条件下,水样在8、20、42 µW·cm−2复活光强下均发生明显光复活,且最大复活百分比较为接近,分别为0.3%、0.38%、0.45%;而在UV-PS联合消毒时,不同复活光强对大肠杆菌的最大复活百分比则明显不同。由图9可知,水样经UV-PS联合消毒后,在0、8、20、42 µW·cm−2的复活光强下,大肠杆菌最大复活百分比分别0.001%、0.005%、0.03%、0.08%。在0 µW·cm−2和8 µW·cm−2的低复活光强下水样中大肠杆菌数量变化不大。这可能是由于UV-PS联合消毒对细菌细胞结构损伤较大,在低复活光强照射下受损细胞很难恢复,只有在较强的复活光照射下,受损细胞在高能量补充下才能快速恢复,大肠杆菌才会出现较强的光复活情况。这说明UV-PS联合消毒对大肠杆菌灭活效果高于单独的UV消毒。
-
对UV-PS联合消毒的机理进行了初步分析。图10分别为空白实验、单独UV和UV-PS处理后大肠杆菌死/活荧光染色实验结果。可以看出,相比于空白样品,单独UV处理并未造成更严重的细胞膜损伤,而经过UV-PS联合消毒后的大肠杆菌则失去了细胞膜完整性。因为Syto9是活体核酸透性染料,对死活细胞都染色,而PI染料不能通过活细胞膜,但能穿过破损的细胞膜而对核染色。这主要是由于UV-PS联合消毒过程中产生的SO4·-破坏了细菌细胞膜的完整性,从而使PI染料能对细胞核进行染色。
图11分别为空白实验、单独UV和UV-PS处理后大肠杆菌SEM图像。SEM图像也证实了UV-PS联合消毒后大肠杆菌细胞膜损伤的发生。处理前,大肠杆菌表面光滑,形态完整。单独UV处理后,大肠杆菌形态依然完整,仅表面出现略微褶皱。而经过UV-PS联合消毒后,大肠杆菌细胞形态被破坏,细胞表面发生不同程度凹陷,有部分细胞破裂。
紫外线依靠破坏微生物细胞内DNA或RNA的分子结构,影响其复制而不破坏其细胞膜达到灭菌的目的[17-18],同时也会使细胞表面蛋白质变性,导致细胞通透性屏障受损,其体内外渗透压遭到破坏,从而发生皱缩现象。而UV-PS联合消毒后大肠杆菌细胞形态遭到破坏,这是由于自由基攻击细胞表面,使得细胞结构破损,细胞膜破裂。在穿透细胞膜后,
SO⋅−4 扩散进细胞内部,对其内容物与DNA进行氧化破坏,进而导致细胞死亡。而且在自由基的作用下,细胞内容物暴露,更利于紫外线进行作用,紫外及过硫酸盐具有协同作用[28]。 -
1)UV-PS体系杀菌效率高于单独UV及单独PS杀菌。15 mJ·cm−2紫外剂量下,0.3 mmol·L−1 PS的加入较单独UV杀菌时大肠杆菌对数去除率增加1.0个对数级。
2)在一定浓度范围内,大肠杆菌对数去除率随着PS初始浓度的增加而增加;中性条件更有利于大肠杆菌杀灭;Fe2+的存在抑制了大肠杆菌的杀灭效果。
3)大肠杆菌经UV-PS消毒后光复活能力明显下降,且只有在较强的复活光照下才会产生一定的光复活。
4)UV-PS工艺较单独UV灭活时大肠杆菌细胞形态破坏更为严重,UV-PS产生的硫酸根自由基首先攻击细胞表面,使得细胞结构破损,细胞膜破裂,进而对其内容物进行氧化破坏,导致细胞死亡。
紫外联合过硫酸盐杀灭水中大肠杆菌
Inactivation effect of Escherichia coli by ultraviolet combined with persulfate
-
摘要: 为提高UV杀菌效率并同时解决UV杀菌存在光复活现象的问题,以大肠杆菌为研究对象,采用UV-PS (紫外联合过硫酸盐) 体系杀灭水中大肠杆菌,研究了各因素对UV-PS体系杀菌效果的影响,并考察复活光强度(0~42 µW·cm−2)对不同体系处理后大肠杆菌复活的影响,最后分析其杀菌机理。结果表明:UV-PS体系杀菌效率高于单独UV及单独PS杀菌,15 mJ·cm−2紫外剂量下,0.3 mmol·L−1 PS的加入较单独UV杀菌时大肠杆菌对数去除率增加1.0个对数级;且一定范围内大肠杆菌对数去除率随着PS初始浓度的增加而增加;中性条件更有利于大肠杆菌杀灭;Fe2+对大肠杆菌杀灭产生抑制效果;大肠杆菌经UV-PS体系处理后光复活能力明显下降,且仅在较强的复活光照下才会产生一定的光复活;UV-PS体系较单独UV杀菌时大肠杆菌细胞形态破坏更为严重,UV-PS体系产生的硫酸根自由基首先攻击细胞表面,使得细胞结构破损,细胞膜破裂,进而对其内容物进行氧化损伤,导致细胞死亡。UV-PS体系杀菌效率高且对大肠杆菌的光复活现象抑制明显,具有一定的应用前景。Abstract: In order to improve UV sterilization efficiency and solve the problem of photoreactivation in UV sterilization, ultraviolet (UV) and persulfate (PS) were combined for Escherichia coli (E.coli) inactivation. The effects of different factors on the inactivation were investigated, as well as the effects of different photoreactivating light intensities (0~42 μW·cm−2) on E.coli photoreactivation. The sterilizing mechanism was briefly analyzed. The results showed that E.coli inactivation by UV-PS was more effective than that by UV or PS alone. The addition of 0.3 mmol·L−1 PS elevated the logarithmic removal rate of E.coli by 1.0 lg compared with UV disinfection alone at the dosage of 15 mJ·cm−2. And the logarithmic removal rate of E.coli increased with the initial concentration of PS. The neutral conditions were more conducive to E.coli inactivation, while the presence of Fe2+ had the inhibition effect on E.coli inactivation. The photoreactivation rate of UV-PS disinfected E.coli was much lower than that of UV alone, and only high light intensity could cause the resurrection of some UV-PS disinfected E.coli. The morphological damage of E.coli cells in UV-PS process was more serious than that in UV process. Sulfate free radicals produced by UV-PS first attacked the cell surface, broke the cell structure and ruptured the cell membrane, and then oxidized and destroyed the cellular contents, eventually led to the death of E.coli cell. UV-PS showed high inactivation efficiency and strong inhibition effect on E.coli photoreactivation, and had a promising prospect for practical application.
-
-
[1] 张光辉, 孙迎雪, 顾平, 等. 紫外线灭活水中病原微生物[J]. 水处理技术, 2006, 32(5): 1463-1468. [2] REED D. Selecting alternatives to chlorine disinfection[J]. Pollution Engineering, 1998, 30(9): 48-51. [3] LINDEN K G, SHIN G A, FAUBERT G, et al. UV Disinfection of Giardia lamblia Cysts in water[J]. Environment Science Technology, 2002, 36(11): 2519-2522. doi: 10.1021/es0113403 [4] RAJALA-MUSTONEN R L, TOIVOLA P S, HEINONEN-TANSKI H, et al. Effects of peracetic acid and UV irradiation on the inactivation of coliphages in wastewater[J]. Water Science and Technology, 1997, 35(11): 237-241. [5] LOCAS A, DEMERS J, PAYMENTA P. Evaluation of photoreactivation of Escherichia coli and enterococci after UV disinfection of municipal wastewater[J]. Canadian Journal of Microbiology, 2008, 54(11): 971-975. doi: 10.1139/W08-088 [6] HIJNEN W A M, BEERENDONK E F, MEDEMA G J. Inactivation credit of UV radiation for viruses, bacteria and protozoan(oo) cysts in water: A review[J]. Water Research, 2006, 40: 3-22. doi: 10.1016/j.watres.2005.10.030 [7] 廖云燕, 刘国强, 赵力, 等. 利用热活化过硫酸盐技术去除阿特拉津[J]. 环境科学学报, 2014, 34(4): 931-937. [8] XIA D H, LI Y, HUANG G C, et al. Activation of persulfates by natural magnetic pyrrhotite for water disinfection: Efficiency, mechanisms, and stability[J]. Water Research, 2017, 112: 236-247. doi: 10.1016/j.watres.2017.01.052 [9] STANISŁAW, HOLGER V L, KLAUDIUSZ G, et al. Chemistry of persulfates in water and wastewater treatment: A review[J]. Chemical Engineering Journal, 2017, 30: 44-62. [10] NETA P, HUIE R, POSS A B. Rate constants for reactions of inorganic radicals in aqueous-solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(3): 1027-1284. doi: 10.1063/1.555808 [11] 蒋梦迪, 张清越, 季跃飞, 等. 热活化过硫酸盐降解三氯生[J]. 环境科学, 2018, 39(4): 1661-1667. [12] 高金龙, 马玉琳, 孟庆来, 等. 二价铁活化过硫酸盐降解土壤中十溴联苯醚[J]. 环境工程学报, 2016, 10(12): 7339-7343. doi: 10.12030/j.cjee.201507210 [13] 孙昕, 史路肖, 张燚, 等. 真空紫外/过二硫酸盐去除饮用水中嗅味物质[J]. 环境科学, 2018, 39(5): 2195-2201. [14] KASHIMADA K, KAMIKO N, YAMAMOTO K, et al. Asessment of photoreactivation following ultraviolet light disinfection[J]. Water Science & Technology, 1996, 33(10/11): 261-269. [15] KOLLU K, ORMECI B. UV-induced self-aggregation of E.coli after low and medium pressure ultraviolet irradiation[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 148: 310-321. doi: 10.1016/j.jphotobiol.2015.04.013 [16] AZIMI Y, ALLEN D G, FARNOOD R R. Kinetics of UV inactivation of wastewater bioflocs[J]. Water Research, 2012, 46(12): 3827-3836. doi: 10.1016/j.watres.2012.04.019 [17] SNOWBALL M R, HORNSEY I S. Purification of water supplies using ultraviolet light[J]. Journal of Vacuum Science & Technology A: Vacuum Surfaces & Films, 1998, 2(2): 1037-1038. [18] FARIBORZ T. Ultraviolet and ionizing radiation for microorganism inactivation[J]. Water Research, 2004, 38(6): 3940-3948. [19] FOEGEDING P M. Ozone inactivation of Bacillus and Clostridium spore populations and the importance of the spore coat to resistance[J]. Food Microbiology, 1985, 2(2): 123-134. doi: 10.1016/S0740-0020(85)80005-8 [20] KHADRE M A, YOUSEF A E. Sporicidal action of ozone and hydrogen peroxide: A comparative study[J]. International Journal of Food Microbiology, 2002, 71(2/3): 131-138. [21] HORI H, YAMAMOTO A, HAYAKAWA E, et al. Efficient decomposition of environmentally persistent perfluorocarboxylic acids by use of persulfate as a photochemical oxidant[J]. Environmental Science & Technololgy, 2005, 39(7): 2383-2388. [22] MCCALLUM J E B, MADISON S A, DEPINTO R L, et al. Analytical studies on the oxidative degradation of the reactive dye uniblue A[J]. Environmental Science and Technology, 2000, 34(24): 5157-5164. doi: 10.1021/es0008665 [23] 孙艳芝, 李彩鹦, 万平玉, 等. 紫外分光光度计法测定硝酸盐氮时消除铁离子干扰的新方法[J]. 光谱实验室, 2011, 28(6): 3143-3147. doi: 10.3969/j.issn.1004-8138.2011.06.093 [24] 郭美婷, 胡洪营, 李莉. 污水紫外线消毒工艺的影响因素研究[J]. 中国环境科学, 2007, 27(4): 534-538. doi: 10.3321/j.issn:1000-6923.2007.04.021 [25] EDE S, HAFNER L, DUNLOP P, et al. Photocatalytic disinfection of bacterial pollutants using suspended and immobilized TiO2 powders[J]. Photochemistry and Photobiology, 2012, 88(3): 728-735. doi: 10.1111/php.2012.88.issue-3 [26] NATH R K, ZAIN M F M, KADHUM A A H. Photocatalysis: A novel approach for solving various environmental and disinfection problems: A brief review[J]. Journal of Applied Sciences Research, 2012, 8(8): 4147-4155. [27] 郭美婷, 胡洪营, 刘文君. 避光处理对污水紫外线消毒后大肠杆菌光复活的影响研究[J]. 环境科学, 2008, 29(6): 1644-1648. doi: 10.3321/j.issn:0250-3301.2008.06.033 [28] 朱红. 紫外及紫外联合灭活地下水供水系统中真菌效能及机理研究[D]. 西安: 西安建筑科技大学, 2017. -




 下载:
下载: