全文HTML
1 实验部分
1.1 藻种及培养条件
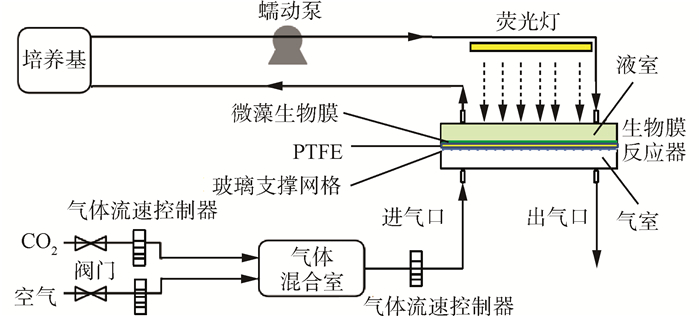
1.2 实验系统的搭建
Fig. 1 Schematic of cultivation system
1.3 检测与分析方法
| cclha=13.95A665−6.88A649 | (1) |
| cclhb=24.96A649−7.32A665 | (2) |
| ccar=1000A470−2.05cchla−114.8cchlb245 | (3) |
2 结果与分析
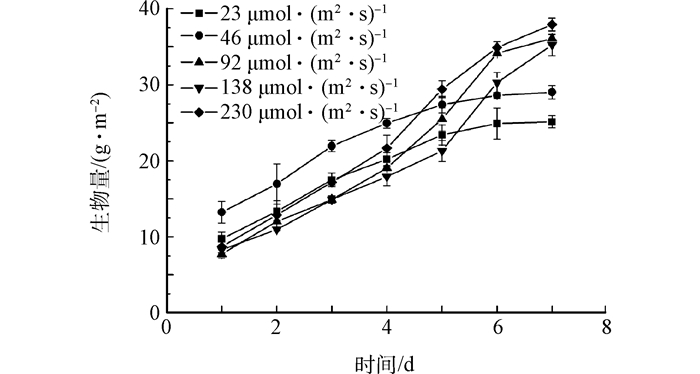
2.1 光照强度对小球藻生物膜生长的影响
Fig. 2 Effects of light intensity on growth of microalgae biofilm
2.2 光照强度对培养基中NO3--N的及pH的影响
Fig. 3 Effect of light intensities on utilization of NO3--N in medium
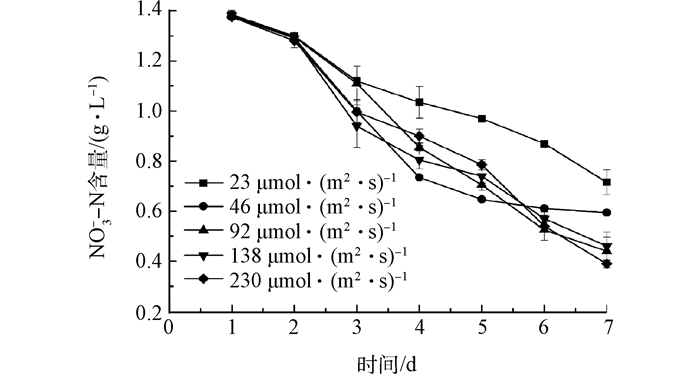
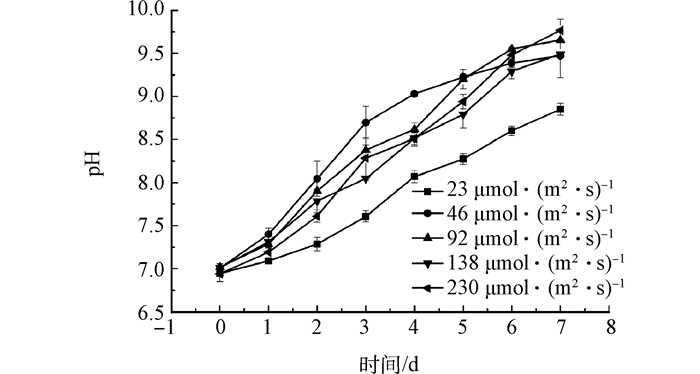
Fig. 4 Effect of light intensities on pH
2.3 光照强度对小球藻细胞组分的影响
Fig. 5 Effects of light intensity on chlorophyll content of microalgae
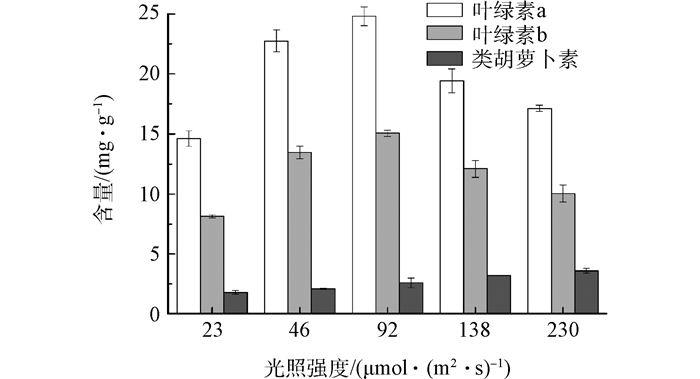
Fig. 6 Effects of light intensity on starch and protein content of microalgae
Fig. 6 Effects of light intensity on starch and protein content of microalgae
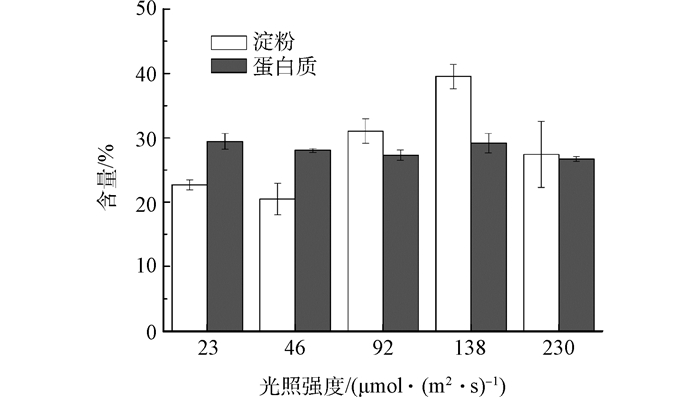
Fig. 7 Effect of light intensity on lipid content of Chlorella
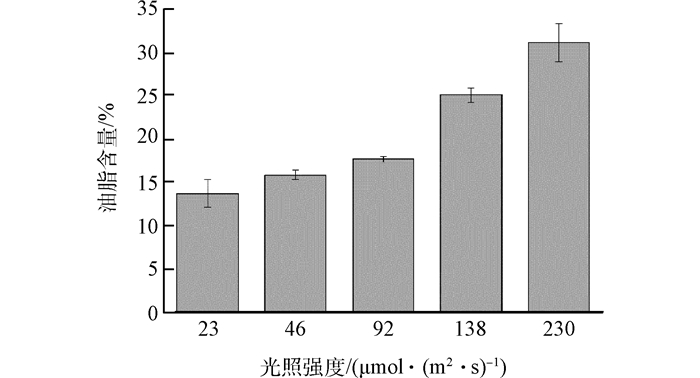
Table 1 1 Fatty acid compositions of C. pyrenoidosa versus different light intensities
Table 1 1 Fatty acid compositions of C. pyrenoidosa versus different light intensities
| 光照强度/ (μmol·(m2·s)-1) |
FACHB-9中各脂肪酸含量/% | |||||||||
| 十六烷酸 (C16:0) |
十六碳一烯酸 (C16:1) |
十八烷酸 (C18:0) |
十八碳一烯酸 (C18:1) |
十八碳二烯酸 (C18:2) |
十八碳三烯酸 (C18:3) |
饱和脂肪酸 | 不饱和脂肪酸 | C16~C18 碳链脂肪酸 |
其他脂肪酸 | |
| 23 | 16.4 | 8.4 | 15.2 | 3 | 27.3 | 23.6 | 31.6 | 62.3 | 93.8 | 6.2 |
| 46 | 18.2 | 11.7 | 14.5 | 3.3 | 29.7 | 19.9 | 32.7 | 64.7 | 97.4 | 2.6 |
| 92 | 15 | 5.1 | 15.5 | 4.1 | 16.6 | 33.6 | 30.5 | 59.3 | 89.8 | 10.2 |
| 138 | 17.2 | 5.7 | 13.7 | 3 | 17.3 | 31.7 | 30.9 | 57.7 | 88.6 | 11.4 |
| 230 | 18.2 | 5.4 | 12.4 | 2.1 | 16.9 | 28.1 | 30.6 | 52.5 | 83.1 | 16.9 |







 下载:
下载:
