特殊植物类群空气凤梨对大气污染物甲醛的净化
Purification of air pollutant—formaldehyde with special plant group—epiphytic Tillandsia
-
摘要: 空气凤梨是一类生长在空气中、不需要土壤、生长所需的水分和营养可以全部来自空气的特殊植物。它们常被用来指示与修复大气重金属污染物和有机污染物,但尚未应用于甲醛净化研究。为了探讨空气凤梨对甲醛的净化效果,我们以2种空气凤梨为实验材料,吊兰为对照材料,通过密封箱内甲醛熏蒸及在封闭的实际环境中进行了实验。结果表明,松萝铁兰、硬叶空凤和吊兰3种植物在甲醛胁迫下,外部形态和生理指标有一定的变化,但未受到明显的伤害。更重要的是,3种植物对甲醛均有相当强的净化作用。6~8 h后,2种空气凤梨对甲醛的净化可达到与吊兰相近的效果。而在2 h内,空气凤梨净化甲醛的速度远远大于吊兰,这可能是与空气凤梨叶片表面覆盖有亲水性的鳞片层有关。上述结果表明,空气凤梨是比吊兰更快速有效地净化甲醛的植物类群,可选择应用于室内甲醛污染去除。Abstract: Epiphytic Tillandsia species uptake nutrients and moistures directly from the atmosphere, so they are often used for monitoring atmospheric heavy metal pollutants and organic pollutants, but have not been applied to the study of purifying formaldehyde yet. Two species of Tillandsia, i.e. T. usneoides and T. stricta, as well as Chlorophytum malayense, were exploited to test their ability of removing formaldehyde under two different conditions, i.e. sealed glass boxes and closed laboratory. Although the morphology and physiology of these plants had some changes, no obvious damages were suffered under formaldehyde stress. After 6~8 hours of purification with three plants, two species of Tillandsia achieved similar results with Chlorophytum. However, the speed that Tillandsia purifying formaldehyde was much higher than Chlorophytum within first 2 hours, which may due to the existence of the foliar hydrophilic trichomes on the leave surface of Tillandsia. The above results suggested that Tillandsia could purify formaldehyde more rapidly and efficiently than Chlorophytum, and it could be applied to remove indoor formaldehyde pollutant.
-
Key words:
- air plants /
- formaldehyde /
- purification /
- foliar trichome
-
饮用水安全是一个很严重的全球性问题,关系到人类的健康。随着水污染的严重和人类的增加,大量的污染物在水源中被检测出[1-2]。传统的水处理工艺(混凝、沉淀和过滤)对微污染物的去除不是很有效,除非添加其他处理工艺[3-5]。预氧化工艺能够有效去除微污染物,在饮用水处理厂中被广泛采用[6-7]。
在水处理过程中,常用的预氧化剂有高锰酸钾(KMnO4)和过氧化氢(H2O2)[8-10]。由于KMnO4和H2O2具有各种缺点,限制了它们在饮用水处理过程中的使用。例如,KMnO4能够引起浊度和颜色的增加[11-12]。由于需要严格的酸性条件、自由基的产率及利用率低以及H2O2不够稳定等原因,所以限制了芬顿氧化的使用[13-14]。相比KMnO4和H2O2,单过硫酸盐(PMS)具有无色、稳定、溶解性高等特性[15-16],因此,PMS也能够被应用在预氧化过程中。
氯离子(Cl−)是天然水体中广泛存在的卤素离子[17]。PMS不仅能够氧化降解有机物,同时也能氧化Cl−为有效氯(HOCl/OCl−)[18]。HOCl/OCl−会和有机物发生化学反应生成消毒副产物(DBPs)[19-20]。DBPs具有致畸、致癌和致突变的特性[21-23]。长期饮用含有DBPs的饮用水,会使癌症的患病概率显著上升。如何减少PMS预氧化体系中DBPs的生成值得研究。
氨基酸(AAs)广泛的存在于天然水体中,在天然水体中的浓度约为50—1000 µg·L−1,占总溶解性有机氮和溶解性有机碳的比例约为35%和2.6%,同时也是DBPs的重要前体物[24-25]。酪氨酸(Tyr)作为一种天然AA,广泛存在于多肽、蛋白质和藻类中[26]。此外,PMS已经成功的应用在部分小水厂和泳池的消毒过程中。因此,Tyr被选定为DBPs的前体物,研究PMS预氧化体系中DBPs的生成特性。
本论文以Tyr和实际水样为研究对象,研究PMS预氧化体系中,预氧化时间、PMS浓度、Cl−浓度、pH对DBPs生成以及毒性的影响,为DBPs的合理控制提供理论依据。
1. 材料和方法(Materials and methods)
1.1 试验材料
三氯甲烷(TCM)、水合三氯乙醛(TCAL)、二氯乙腈(DCAN)、三氯乙腈(TCAN)、二氯乙酰胺(DCAM)和三氯乙酰胺(TCAM)的标准样品购自CanSyn公司(多伦多,加拿大)。氯化钠、PMS(KHSO5·0.5KHSO4·0.5K2SO4,≥ 42% KHSO5)、Tyr等所有试验用到的化学药剂均购自阿拉丁试剂有限公司(上海,中国)。实际水样取自某饮用水水源地,超纯水由Millipore Milli-Q Gradient水净化系统(比勒利卡,美国)制备。
1.2 试验方法
预氧化试验:研究预氧化时间[t = 0.5、1、1.5、2、2.5 h,DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]、PMS浓度[PMS = 100、200、400、600、800 µmol·L−1,DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,t = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]、Cl−浓度[Cl−(Tyr溶液)= 0.5、1、1.5、2、2.5 mmol·L−1,DOC(Tyr溶液)= 5.4 mg·L−1,t = 2 h,PMS = 200 µmol·L−1,pH = 7]和pH [pH = 5、6、7、8、9,DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,t = 2 h,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1]对DBPs生成的影响,反应温度为25 ℃。所有实验样品均做平行样,误差棒代表3组数据的标准偏差,相对标准偏差低于20%。
1.3 分析方法
预氧化试验结束后,添加抗坏血酸(浓度为余氯的2倍)终止反应[24]。取10 mL反应液并用0.22 μm滤膜过滤,然后注入到25 mL的透明玻璃瓶中并加入2 mL甲基叔丁基醚进行液液萃取,将上层液体转移至气相色谱分析专用的进样瓶中进行检测。
DBPs使用气相色谱(GC/ECD,Agilent 7890A)检测,色谱柱为HP-5毛细管柱(30 m×0.32 mm×0.25 µm)。GC/ECD运行参数:载气为氮气,载气控制方式采用压力控制,压力为8.4 psi,总流量为20 mL·min−1,柱流量为2 mL·min−1。进样口温度为200 ℃,进样体积为1 μL。检测器参数:温度300 ℃,尾吹气流量24 mL·min−1。GC的具体升温程序为:初始温度是34 ℃,保持6 min。然后以14 ℃·min−1升至70 ℃,保持0。最后以50 ℃·min−1升至200 ℃,保持2 min。后运行210 ℃,保持3 min。综合毒性指标采用细胞毒性指数(CTI)进行评估[19, 27],具体计算方法如式(1)所示,各种DBP的细胞毒性见表1所示。
表 1 DBPs的细胞毒性Table 1. The cytotoxicity of DBPsDBP种类 Type of DBP TCM TCAL DCAN TCAN DCAM TCAM 细胞毒性LC50x/(mol·L−1) 104 860 175 6250 521 488 CTI=∑CxLC50x (1) 式中,Cx为DBP的浓度(mol·L−1);LC50x为DBP的细胞毒性(mol·L−1).
2. 结果与讨论(Results and discussion)
2.1 预氧化时间对DBPs生成的影响
预氧化时间对DBPs生成的影响见图1。在PMS预氧化过程中,TCM、TCAL、DCAM和TCAM均被检测到,但是DCAN和TCAN未能检测到。PMS的氧化还原电位为1.75 V [28],具有一定的氧化性,因此可氧化Cl−为HOCl/OCl− [29],HOCl/OCl−和有机物发生化学反应生成DBPs [19]。
 图 1 预氧化时间对DBPs(a. TCM,b. TCAL,c. DCAM,d. TCAM)生成的影响Figure 1. Effects of pre-oxidation time on the formation of DBPs (a. TCM, b. TCAL, c. DCAM, d. TCAM)[预氧化时间 = 0.5、1、1.5、2、2.5 h,DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7,DCAN和TCAN未检测到]Condition: The pre-oxidation time = 0.5, 1, 1.5, 2, 2.5 h, DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7. DCAN and TCAN were not detected during the pre-oxidation process.
图 1 预氧化时间对DBPs(a. TCM,b. TCAL,c. DCAM,d. TCAM)生成的影响Figure 1. Effects of pre-oxidation time on the formation of DBPs (a. TCM, b. TCAL, c. DCAM, d. TCAM)[预氧化时间 = 0.5、1、1.5、2、2.5 h,DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7,DCAN和TCAN未检测到]Condition: The pre-oxidation time = 0.5, 1, 1.5, 2, 2.5 h, DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7. DCAN and TCAN were not detected during the pre-oxidation process.随着预氧化时间的增加,Tyr溶液和实际水样中TCM、TCAL、DCAM和TCAM的浓度增加。预氧化时间从0.5 h增加至2.5 h时,Tyr溶液中TCM、TCAL、DCAM和TCAM的浓度分别从5.0、1.0、1.0、0.25 nmol·L−1增加至18.1、5.0、4.3、1.55 nmol·L−1。随着预氧化时间的增加,HOCl/OCl−浓度增加[30],HOCl/OCl−会和有机物发生化学反应生成DBPs。因此,随着预氧化时间的增加,DBPs浓度增加[27]。
2.2 PMS浓度对DBPs生成的影响
PMS浓度对DBPs生成的影响如图2所示。随着预氧化剂PMS的增加,Tyr溶液和实际水样中TCM、TCAL、DCAM、TCAM的浓度增加。PMS从100 µmol·L−1增加至800 µmol·L−1时,Tyr溶液中TCM、TCAL、DCAM、TCAM的浓度分别从3.8、0.9、0、0.5 nmol·L−1增加至83.9、15.8、4.5、0.9 nmol·L−1。研究表明,随着PMS浓度的增加,HOCl/OCl−浓度增加[30]。在HOCl/OCl−存在时,TCM是一个稳定的产物且不会发生水解[31]。DCAN和TCAN不稳定能够转化为DCAM和TCAM [32],且随着HOCl/OCl−浓度的增加,DCAN和TCAN的水解速度加快[33]。因此,随着PMS浓度的增加,TCM、TCAL、DCAM和TCAM的浓度增加。
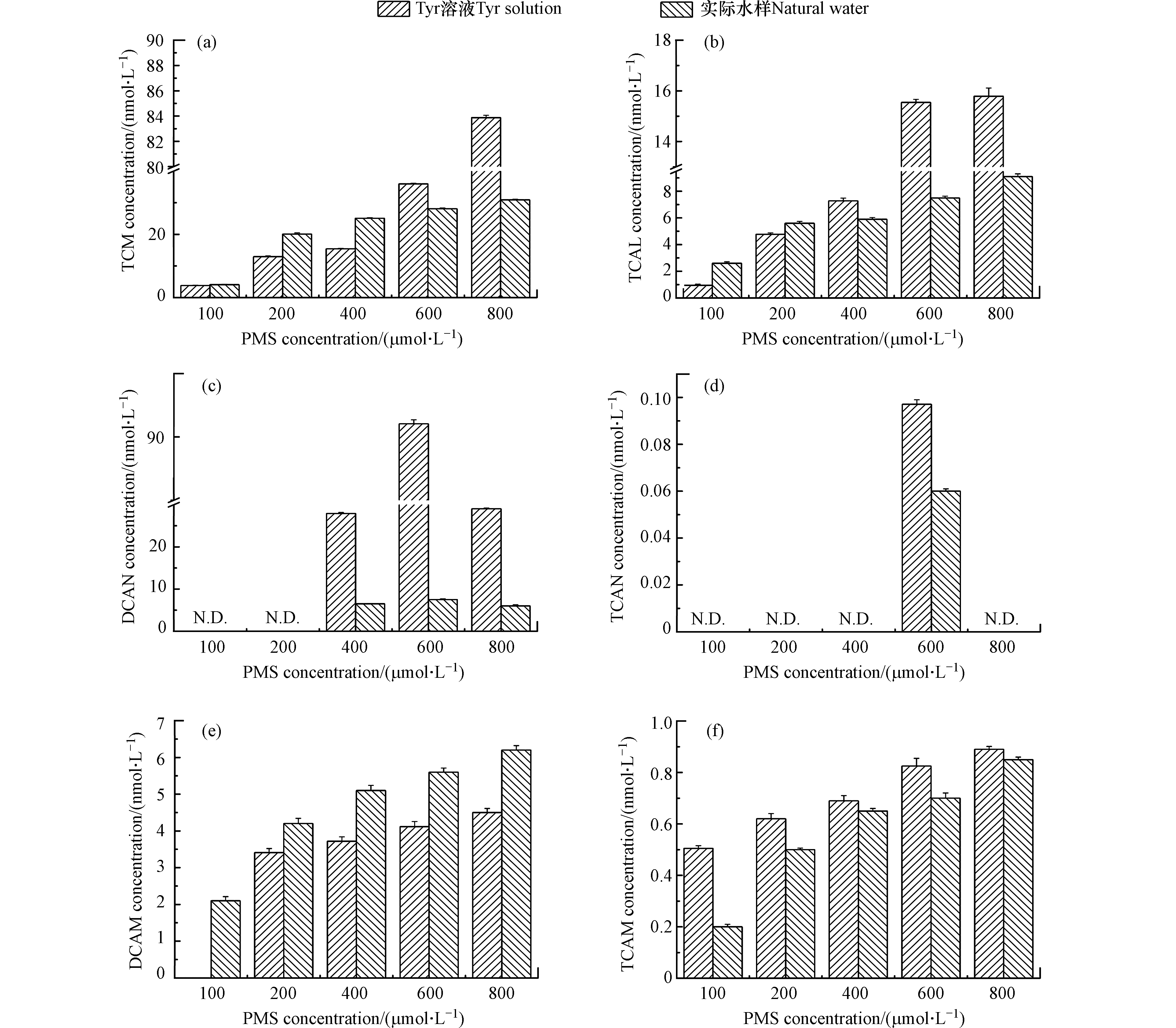 图 2 PMS浓度对DBPs(a. TCM,b. TCAL,c. DCAN,d. TCAN,e. DCAM,f. TCAM)生成的影响Figure 2. Effects of PMS concentration on the formation of DBPs[DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 100、200、400、600、800 µmol·L−1,预氧化时间 = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7](a. TCM, b. TCAL, c. DCAN, d. TCAN, e. DCAM, f. TCAM). Condition: DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 100, 200, 400, 600, 800 µmol·L−1, the pre-oxidation time = 2 h, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7.
图 2 PMS浓度对DBPs(a. TCM,b. TCAL,c. DCAN,d. TCAN,e. DCAM,f. TCAM)生成的影响Figure 2. Effects of PMS concentration on the formation of DBPs[DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 100、200、400、600、800 µmol·L−1,预氧化时间 = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7](a. TCM, b. TCAL, c. DCAN, d. TCAN, e. DCAM, f. TCAM). Condition: DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 100, 200, 400, 600, 800 µmol·L−1, the pre-oxidation time = 2 h, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7.随着PMS浓度的增加,Tyr溶液和实际水样中DCAN和TCAN的浓度先增加后降低。PMS浓度从100 µmol·L−1增加至800 µmol·L−1时,Tyr溶液中DCAN和TCAN的浓度先分别增加至91.1 nmol·L−1和0.097 nmol·L−1,然后降低至29.2 nmol·L−1和0。研究表明,DCAN和TCAN不稳定且能够发生水解[32],随着HOCl/OCl−浓度的增加,DCAN和TCAN的水解速度加快[33]。因此,随着PMS浓度的增加,DCAN和TCAN的浓度先增加后降低。
2.3 Cl−浓度对DBPs生成的影响
Cl−浓度对DBPs生成的影响如图3所示。随着Cl−浓度的增加,Tyr溶液中TCM、TCAL、DCAM和TCAM的浓度增加。但是DCAN和TCAN未检测到。随着Cl−浓度的增加,Tyr溶液中TCM、TCAL、DCAM、TCAM的浓度分别从12.2、0.6、0、0.55 nmol·L−1增加至15.3、8.0、4.1、0.9 nmol·L−1。
 图 3 Cl-浓度对DBPs(a. TCM,b. TCAL,c. DCAM,d. TCAM)生成的影响Figure 3. Effects of Cl- concentration on the formation of DBPs (a. TCM, b. TCAL, c. DCAM, d. TCAM)[DOC(Tyr溶液)= 5.4 mg·L−1,Cl−(Tyr溶液)= 0.5、1、1.5、2、2.5 mmol·L−1,预氧化时间 = 2 h,PMS = 200 µmol·L−1,pH = 7,DCAN和TCAN未检测到]Condition: DOC (Tyr solution) = 5.4 mg·L−1, Cl− (Tyr solution) = 0.5, 1, 1.5, 2, 2.5 mmol·L−1, the pre-oxidation time = 2 h, PMS = 200 µmol·L−1, pH = 7. DCAN and TCAN were not detected during the pre-oxidation process.
图 3 Cl-浓度对DBPs(a. TCM,b. TCAL,c. DCAM,d. TCAM)生成的影响Figure 3. Effects of Cl- concentration on the formation of DBPs (a. TCM, b. TCAL, c. DCAM, d. TCAM)[DOC(Tyr溶液)= 5.4 mg·L−1,Cl−(Tyr溶液)= 0.5、1、1.5、2、2.5 mmol·L−1,预氧化时间 = 2 h,PMS = 200 µmol·L−1,pH = 7,DCAN和TCAN未检测到]Condition: DOC (Tyr solution) = 5.4 mg·L−1, Cl− (Tyr solution) = 0.5, 1, 1.5, 2, 2.5 mmol·L−1, the pre-oxidation time = 2 h, PMS = 200 µmol·L−1, pH = 7. DCAN and TCAN were not detected during the pre-oxidation process.研究表明随着Cl−浓度的增加,HOCl/OCl−浓度增加[30]。HOCl/OCl−会和有机物发生化学反应生成DBPs。因此,随着Cl−浓度的增加,TCM、TCAL、DCAM和TCAM的浓度增加。
2.4 pH对DBPs生成的影响
pH对DBPs生成的影响如图4所示。随着pH的增加,Tyr溶液和实际水样中DBPs的浓度降低。pH从5增加到9时,Tyr溶液中TCM、TCAL、DCAN、TCAN、DCAM、TCAM的浓度分别从413.6、2448.1、980.1、1.2、9.9、1.5 nmol·L−1降低至2.1、1.2、0、0、0.8、0.5 nmol·L−1。
 图 4 pH对DBPs(a. TCM,b. TCAL,c. DCAN,d. TCAN,e. DCAM,f. TCAM)生成的影响Figure 4. Effects of pH on the formation of DBPs (a. TCM, b. TCAL, c. DCAN, d. TCAN, e. DCAM, f: TCAM)[DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,pH = 5、6、7、8、9,预氧化时间 = 2 h,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1]Condition: DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, pH = 5, 6, 7, 8, 9, the pre-oxidation time = 2 h, PMS =200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1.
图 4 pH对DBPs(a. TCM,b. TCAL,c. DCAN,d. TCAN,e. DCAM,f. TCAM)生成的影响Figure 4. Effects of pH on the formation of DBPs (a. TCM, b. TCAL, c. DCAN, d. TCAN, e. DCAM, f: TCAM)[DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,pH = 5、6、7、8、9,预氧化时间 = 2 h,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1]Condition: DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, pH = 5, 6, 7, 8, 9, the pre-oxidation time = 2 h, PMS =200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1.pH对DBPs浓度的影响可以归结于以下几个原因:(1)pH影响PMS的分解及形态,PMS在低pH情况下降解速率很慢,随着pH的增加,PMS的降解速率增加。当pH为9.5时,PMS的含量只有原来的44% [34],因此,随着pH的增加,PMS浓度降低;(2)随着pH的增加,HOCl/OCl−浓度降低[30];(3)随着pH的增加,TCAL的水解速率增加,因此随着pH的增加,TCAL的浓度降低[35];(4)HANs的稳定性受pH的影响,且水解速率随着pH的增加而增加[33, 36]。因此,随着pH的增加,DBPs的浓度降低。
2.5 不同因素对CTI的影响
预氧化时间、PMS浓度、Cl−浓度和pH对CTI的影响如图5所示。随着预氧化时间的增加,Tyr溶液和实际水样中细胞毒性增加。预氧化时间从0.5 h增加至2.5 h时,Tyr溶液中细胞毒性从2.34×103增加至1.03×104。随着PMS浓度的增加,Tyr溶液和实际水样中细胞毒性先增加后降低。PMS从100 µmol·L−1增加至800 µmol·L−1时,Tyr溶液中细胞毒性先增加至1.61×106,然后降低至5.37×105。随着Cl−浓度的增加,Tyr溶液细胞毒性增加。Cl−从0.5 mmol·L−1增加至2.5 mmol·L−1时,Tyr溶液中细胞毒性从2.79×103增加至1.20×104。随着pH的增加,Tyr溶液和实际水样中细胞毒性降低。pH从5增加至9时,Tyr溶液中细胞毒性从1.93×107降低至2.02×103。
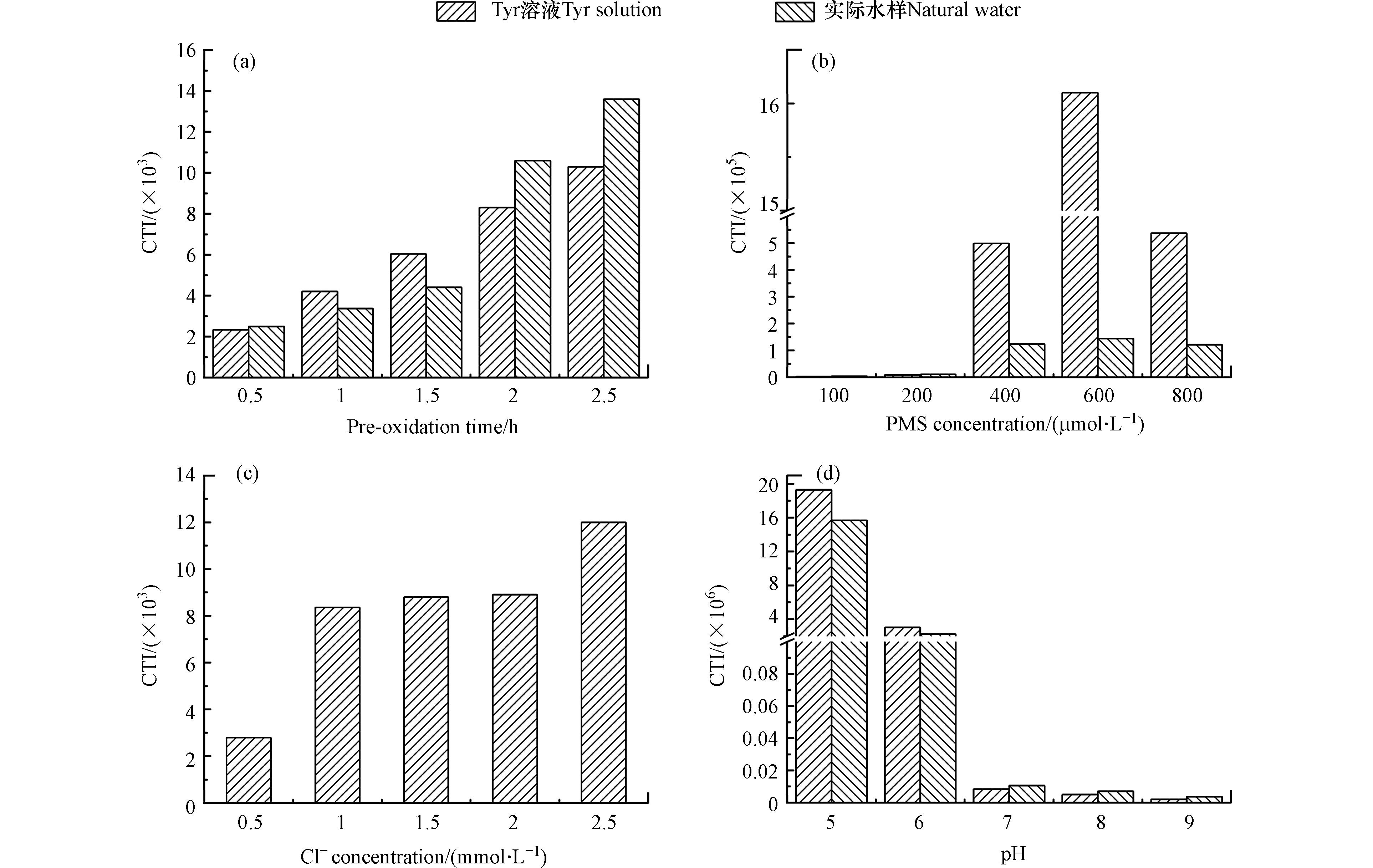 图 5 预氧化时间对CTI的影响Figure 5. Effects of pre-oxidation time on CTI[a. DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,预氧化时间 = 0.5、1、1.5、2、2.5 h,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]、PMS浓度[b. DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 100、200、400、600、800 µmol·L−1,预氧化时间 = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]、Cl−浓度[c. DOC(Tyr溶液)= 5.4 mg·L−1,Cl−(Tyr溶液)= 0.5、1、1.5、2、2.5 mmol·L−1,预氧化时间 = 2 h,PMS = 200 µmol·L−1,pH = 7]和pH [d. DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,pH = 5、6、7、8、9,预氧化时间 = 2 h,PMS = 200 µmol·L−1, Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1][a. DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, the pre-oxidation time = 0.5, 1, 1.5, 2, 2.5 h, PMS = 200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7], PMS concentration [b. DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 100, 200, 400, 600, 800 µmol·L−1, the pre-oxidation time = 2 h, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7], Cl− concentration [c. DOC (Tyr solution) = 5.4 mg·L−1, Cl− = 0.5, 1, 1.5, 2, 2.5 mmol·L−1, the pre-oxidation time = 2 h, PMS = 200 µmol·L−1, pH = 7] and pH [d. DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, pH = 5, 6, 7, 8, 9, the pre-oxidation time = 2 h, PMS = 200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1]
图 5 预氧化时间对CTI的影响Figure 5. Effects of pre-oxidation time on CTI[a. DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,预氧化时间 = 0.5、1、1.5、2、2.5 h,PMS = 200 µmol·L−1,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]、PMS浓度[b. DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 100、200、400、600、800 µmol·L−1,预氧化时间 = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]、Cl−浓度[c. DOC(Tyr溶液)= 5.4 mg·L−1,Cl−(Tyr溶液)= 0.5、1、1.5、2、2.5 mmol·L−1,预氧化时间 = 2 h,PMS = 200 µmol·L−1,pH = 7]和pH [d. DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,pH = 5、6、7、8、9,预氧化时间 = 2 h,PMS = 200 µmol·L−1, Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1][a. DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, the pre-oxidation time = 0.5, 1, 1.5, 2, 2.5 h, PMS = 200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7], PMS concentration [b. DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 100, 200, 400, 600, 800 µmol·L−1, the pre-oxidation time = 2 h, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7], Cl− concentration [c. DOC (Tyr solution) = 5.4 mg·L−1, Cl− = 0.5, 1, 1.5, 2, 2.5 mmol·L−1, the pre-oxidation time = 2 h, PMS = 200 µmol·L−1, pH = 7] and pH [d. DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, pH = 5, 6, 7, 8, 9, the pre-oxidation time = 2 h, PMS = 200 µmol·L−1, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1]随着预氧化时间和Cl−浓度的增加,DBPs的浓度增加,因此细胞毒性增加。随着PMS浓度的增加,尽管TCM、TCAL、DCAM和TCAM的浓度增加,但是DCAN和TCAN的浓度先增加后降低。DCAN和TCAN的细胞毒性明显高于TCM、TCAL、DCAM和TCAM [37]。如图6所示,当DCAN和TCAN存在时,DCAN和TCAN对细胞毒性的贡献总和明显高于TCM、TCAL、DCAM和TCAM对细胞毒性的贡献总和。因此,随着PMS浓度的增加,细胞毒性先增加后降低。随着pH的增加,DBPs的浓度降低,因此随着pH的增加,细胞毒性降低。
 图 6 不同DBPs对细胞毒性的贡献Figure 6. The contributions of different DBPs to cytotoxicity[DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 100、200、400、600、800 µmol·L−1,预氧化时间 = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]Condition: DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 100, 200, 400, 600, 800 µmol·L−1, the pre-oxidation time = 2 h, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7.
图 6 不同DBPs对细胞毒性的贡献Figure 6. The contributions of different DBPs to cytotoxicity[DOC(Tyr溶液)= 5.4 mg·L−1,DOC(实际水样)= 2.5 mg·L−1,PMS = 100、200、400、600、800 µmol·L−1,预氧化时间 = 2 h,Cl−(Tyr溶液)= 1 mmol·L−1,Cl−(实际水样)= 2.9 mmol·L−1,pH = 7]Condition: DOC (Tyr solution) = 5.4 mg·L−1, DOC (natural water) = 2.5 mg·L−1, PMS = 100, 200, 400, 600, 800 µmol·L−1, the pre-oxidation time = 2 h, Cl− (Tyr solution) = 1 mmol·L−1, Cl− (natural water) = 2.9 mmol·L−1, pH = 7.3. 结论(Conclusion)
(1)PMS预氧化过程中能够产生DBPs,随着预氧化时间及Cl−浓度的增加,DBPs的浓度增加。
(2)随着PMS浓度的增加,TCM、TCAL、DCAM和TCAM的浓度增加,但是DCAN和TCAN的浓度先增加后降低。随着pH的增加,DBPs的浓度降低。
(3)随着预氧化时间及Cl−浓度的增加,细胞毒性增加。随着PMS浓度的增加,细胞毒性先增加后降低。随着pH的增加,细胞毒性降低。
(4)当PMS作为预氧化剂时,在保证预氧化效果的同时,应该缩短预氧化时间,降低原水中Cl−浓度,同时提高预氧化时的pH,来降低DBPs浓度和毒性。
-
[1] 曹受金,潘百红,田英翠,等. 6种观赏植物吸收甲醛能力比较研究.生态环境学报,2009,18(5):1798-1801 Cao Shoujin,Pan Baihong,Tian Yingcui,et al. Comparison of ability of absorbing formaldehyde among 6 species of indoor ornamentals. Ecology and Environmental Sciences,2009,18(5):1798-1801(in Chinese) [2] Wolverton B. C.,Donald R. C.,Watkins E. A. Foliage plants for removing indoor air pollution from energy efficient homes. Economic Botany,1984,38(2):224-228 [3] Wolverton B. C. How to Grow Fresh Air: 50 Houseplants that Purify Your Home or Office. New York: Penguin Books,1996 [4] 刘艳菊,葛红.室内观赏植物对苯和甲醛的净化研究及养护技术.北京:科学出版社,2010.42-43 [5] 安雪,李霞,潘会堂,等. 16种室内观赏植物对甲醛净化效果及生理生化变化.生态环境学报,2010,19(2):379-384 An Xue,Li Xia,Pan Huitang,et al. The capacity of 16 ornamental plants on purifying indoor formaldehyde pollution and their physiological response to formaldehyde stress. Ecology and Environmental Sciences,2010,19(2):379-384(in Chinese) [6] Benzing D. H. Bromeliaceae: Profile of An Adaptive Radiation.Cambridge: Cambridge University Press,2000 [7] 郑桂林,王思维,李鹏.空气凤梨对气体污染物的监测和修复.北方园艺,2011,(4):208-210 Zheng Guilin,Wang Siwei,Li Peng. Biomonitoring and control of air pollutants with air plant tillandsia. Northern Horticulture,2011,(4):208-210(in Chinese) [8] Calasans C.F.,Malm O. Elemental mercury contamination survey in a chlor-alkali plant by the use of transplanted Spanish moss,Tillandsia usneoides (L.). Sci. Total Environ.,1997,208(3):77-165 [9] George J. Husk,John F. Weishampel,William H. Schlesinger. Mineral dynamics in Spanish moss,Tillandsia usneoides L.(Bromeliaceae),from Central Florida,USA. Science of the Total Environment,2004,321(1-3):165-172 [10] Pereira M.S.,Heitmann D.,Reifenhauser W. Persistent organic pollutants in atmospheric deposition and biomonitoring with Tillandsia usneoides (L.) in an industrialized area in Rio de Janeiro state,southeast Brazil-Part II: PCB and PAH. Chemosphere, 2007,67(9):1736-1745 [11] 郝再彬,苍晶,徐仲.植物生理实验.哈尔滨:哈尔滨工业大学出版社,2004.46-50 [12] 王学奎.植物生理生化实验原理和技术(2版).北京:高等教育出版社,2006.172-173,280-283 [13] Godish Thad. Indoor Air Pollution Control(1 edition). CRC Press,1989 [14] Wolverton B.C.,Wolverton J.D. Plants and soil microorganisms: Removal of formaldehyde,xylene,and ammonia from the indoor environment. Journal of the Mississippi Academy of Sciences,1993,38(2):11-15 [15] Brett W. Benz,Craig E. Martin. Foliar trichomes,boundary layers,and gas exchange in 12 species of epiphytic Tillandsia (Bromeliaceae). Journal of Plant Physiology,2006,163(6):648-656 [16] David H. Benzing,Karen Henderson,Bruce Kessel,et al. The absorptive capacities of bromeliad trichomes. American Journal of Botany,1976,63(7):1009-1014 [17] David H. Benzing, Burt K. M. Foliar permeability among twenty species of the Bromeliaceae. Bulletin of the Torrey Botanical Club,1970,97(5):269-279 [18] Paterson S.,Machay D.,Mcfarlene C.A. A model of organic chemical uptake by plants from soil and the atmosphere. Environmental Science and Technology,1994,28(13):2259-2266 [19] Simon Pierce,Kate Maxwell,Howard Griffiths,et al. Hydrophobic trichome layers and epicuticular wax powders in bromeliaceae. American Journal of Botany,2001,88(8):1371-1389 [20] Frederick H. Billings. A study of Tillandsia usneoides. Botanical Gazette,1904,38(2):99-121 [21] Ohrui T., Nobira H., Sakata Y.,et al. Foliar trichome-and aquaporin-aided water uptake in a drought-resistant epiphyte Tillandsia ionantha Planchon. Planta,2007,227(1):47-56 [22] 张淑娟,黄耀棠.利用植物净化室内甲醛污染的研究进展.生态环境学报,2010,19(12):3006-3013 Zhang Shujuan,Huang Yaotang. Research progress on the elimination of indoor formaldehyde pollution by plants. Ecology and Environmental Sciences,2010,19(12):3006-3013(in Chinese) [23] 李合生.现代植物生理学(2版).北京:高等教育出版社,2006.145-152,333-336 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 3068
- HTML全文浏览数: 1767
- PDF下载数: 1093
- 施引文献: 0



 DownLoad:
DownLoad:
