-
生态化学计量理论通过将复杂的生态过程简化为物质基本组成元素之间的数量关系和动态平衡,从元素比率角度,将个体、种群、群落、生态系统等不同层次的研究有机地联系起来[1 − 3] . 植物的生长和养分吸收与土壤化学计量比密切相关[4 − 6]. 通过开展植物的生态化学计量学研究,探讨生态系统生态化学计量学特征及其与植物生长的关系,将有助于了解区域化学计量学格局及其驱动因素[7 − 9],有助于评估生态系统的限制性养分与内稳性,进而揭示植物体在特定环境条件的能量分配和适应对策[10 − 12],这对于预测生态系统结构与功能的演变趋势,优化生态系统的管理,维护区域生态安全和实现可持续发展,均具有重要价值.
青檀(Pteroceltis tatarinowii Maxim.)又名翼朴,国家级珍稀濒危物种,为中国特有的单种属植物,隶属于榆科(Ulmaceae)青檀属(Pteroceltis)[13]. 青檀为典型的喜钙植物,是钙质土壤的指示植物,对石灰岩山地、丘陵水土保持具有重要价值[14]. 青檀韧皮纤维(檀皮)发达,是著名的“文房四宝”之一宣纸生产的主要原材料,极具经济价值[15 − 16]. 安徽省泾县青檀栽培历史悠久,现已成为当地宣纸生产和经济发展的重要支柱. 泾县青檀栽培场地成土母岩主要有石灰岩、板岩和砂岩3种,其上青檀植株的生长发育状况存在显著差异. 作为当地的单种林经济林,长年的栽培,出现了青檀植株生长缓慢,林分退化等现象,对当地生态系统稳定和经济发展均产生了一定的影响. 本研究选取上述3种基质土壤及其上生长的青檀为研究对象,分析不同土壤基质条件下青檀的生态化学计量特征,探究不同基质土壤的限制性养分及青檀的环境适应性,为促进青檀栽培区生态系统养分循环与稳定,推动地方的可持续发展提供理论指导.
-
泾县位于安徽省东南部,长江支流青弋江的上游,地处北纬30°21’—30°51’ , 东经117°57’—118°41’,是长江南岸和皖南山区的连接地带. 全境属亚热带季风湿润性气候,年平均温度15 ℃,降水量
1500 mm,日照2113 h,无霜期240 d. 雨量充沛,阳光充足,气候温和,四季分明,土壤类型包括黄红壤、水稻土、粗骨土、潮土、石质土等,植被类型为常绿落叶阔叶混交林,优势种主要包括青冈栎(Cyclobalanopsis glauca)、苦槠(Castanopsis sclerophylla)、石栎(Lithocarpus glaber)、麻栎(Quercus acutissima)、黄连木(Pistacia chinensis)、枫香(Liquidambar formosana)、化香(Platycarya strobilacea)、青檀(Pteroceltis tatarinowii)、刺槐(Robinia pseudoacacia)等. 本研究中,采样地为青檀人工栽培林,栽培时间10年,栽培期间没有施肥等人工辅助措施. -
2021年6月,在泾县栽培10年的基地进行青檀和土壤的采样. 采样时,在不同成土基质的基地分别设定一个采样区. 在各采样区选择立地条件基本一致,坡度相对平缓,林相较为整齐的地段设置样地. 采样区基本概况如表1所示.
植物采样:在上述每个样区内选取 5个样地(10 m×10 m),选取长势良好的个体,采集每棵植株向阳中上部位健康成熟的叶片,带回实验室后,将叶片于105 ℃杀青,85 ℃烘干至恒重,粉碎后过100目筛备用.
土壤采样:在上述每个样区的每个样地内,在采集植物叶片的植株主茎(茎基部)1 m处,围绕茎周围东、西、南、北4个方向取混合土样(0—30 cm深度),共45个混合土样. 土样经剔除石块和其它杂质风干后,过100目筛备用.
-
土壤、青檀叶有机碳(C)含量的测定采用重铬酸钾容量法-外加热法;全氮(N)测定采用凯氏定氮法;全磷(P)含量采用钼锑抗比色法[17].
-
实验数据采用SPSS 27.0软件进行平均值和标准差分析,并对不同基质土壤和青檀各种元素含量及化学计量进行单因素方差分析(one-way ANOVA)和Pearson相关分析.
-
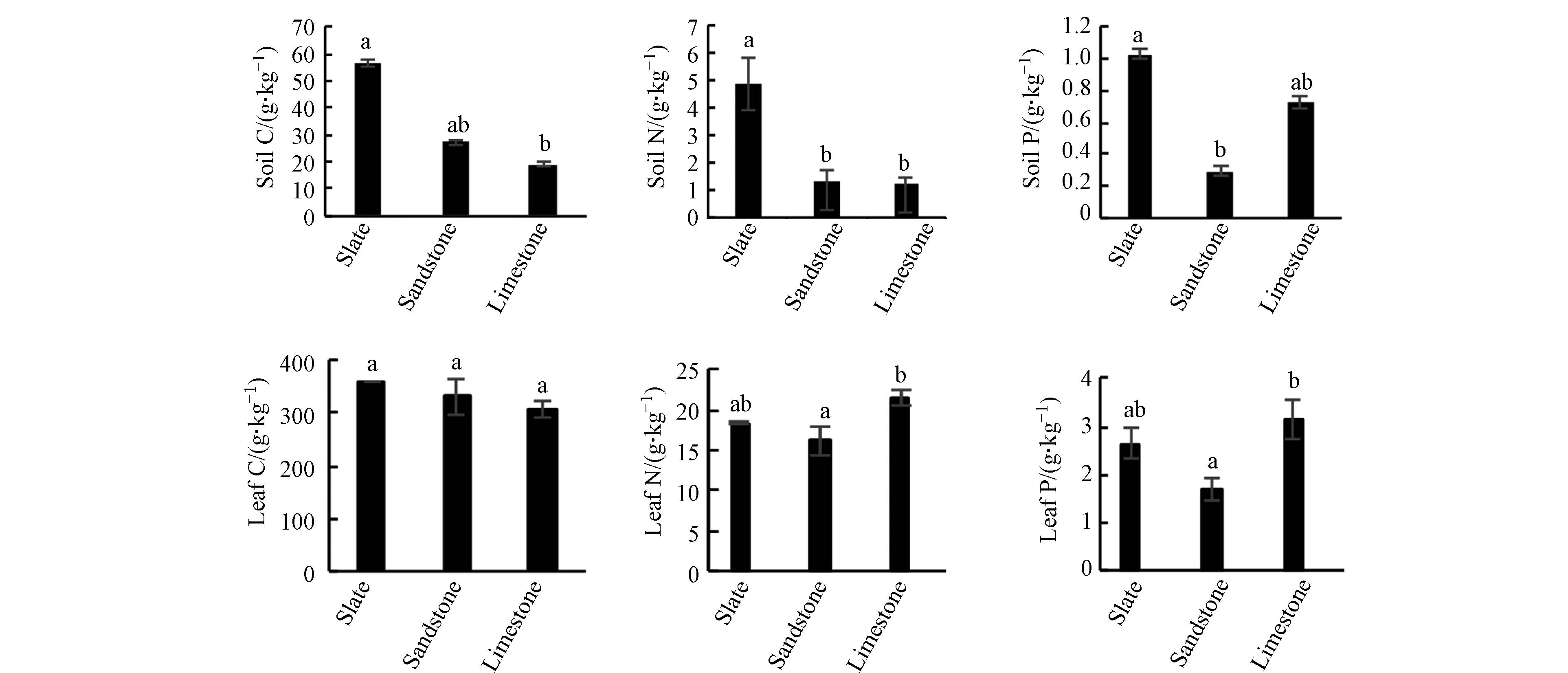
由图1可知,板岩土壤的有机碳(C)、全氮(N)、全磷(P)均为最高,分别为56.50、4.91、1.03 g∙kg−1. 3种基质土壤C含量差异明显,其中板岩土壤C含量显著高于石灰岩(P<0.05). 板岩土壤的N含量显著高于砂岩和石灰岩(P<0.05),砂岩土壤N含量略高于石灰岩土壤(P>0.05). 板岩土壤的P含量显著高于砂岩土壤(P<0.05),略高于石灰岩土壤(P>0.05). 根据全国第二次土壤普查养分分级标准[18],板岩土壤C、N、P含量均值分别为(56.50±5.67)g·kg−1、(4.91±0.41)g·kg−1和(1.03±0.17)g·kg−1,都属于一级水平. 砂岩和石灰岩的C为(27.38±8.93)g·kg−1和(19.02±1.57)g·kg−1,分别隶属于三级和四级,处于缺乏水平;N为(1.31±0.19)g·kg−1和(1.22±0.12)g·kg−1,都属于三级水平;P为(0.30±0.15)g·kg−1和(0.73±0.02)g·kg−1,分别属于五级(很缺乏)和三级水平. 这表明板岩土壤C、N、P元素含量相对丰富. 石灰岩基质上存在较多未风化的岩石和小石块,加上临近沟谷、道路,受外界干扰相对较多,枯枝落叶层较少,分解转化的C含量就很少,导致石灰岩基质土壤C缺乏. 砂岩基质土壤介于上述两者之间,C、N元素含量适中,P含量则较低.
青檀叶片有机碳(C)含量的差异与土壤一致,均为板岩基质土壤>砂岩基质土壤>石灰岩基质土壤,但差异不显著(图1). 3种土壤上的青檀叶片N含量表现为石灰岩上的最高,其次是板岩,砂岩上的最低,其中石灰岩基质土壤的青檀叶片N含量显著大于砂岩上的(P<0.05),板岩基质土壤上的青檀叶片N含量与砂岩的无显著差异(P>0.05). 石灰岩基质土壤上青檀叶片P含量高于板岩上的(P>0.05),显著高于砂岩(P<0.05),板岩上的与砂岩上的差异不显著(P>0.05). 3种不同成土母质土壤上青檀叶片C含量均值范围为308.64—358.77 g·kg−1,与干旱区植物叶C(338.1 g·kg−1)相近 [6,19],但低于我国森林叶片C平均含量(455.10 g·kg−1)[20 − 21];N含量均值范围为16.13—21.56 g·kg−1,除砂岩基质上青檀叶的N含量低于中国东部南北带654种植物叶片N含量平均值(17.55 g·kg−1)[22],其他两种基质上青檀叶片N含量均高于此值. 3种不同基质土壤上青檀叶片P含量均值范围为1.69—3.15 g·kg−1,均高于于中国区域的1.30 g·kg−1[6,23].
-
3种基质土壤C/N范围为11.57—20.85(图2),其中,砂岩基质土壤C/N比值最大,板岩土壤C/N比值最小,但3种成土母质土壤的C/N无明显差异(P>0.05). 土壤C/N是衡量土壤C、N矿化作用与平衡的重要参数,可用于评价土壤N循环速率. 土壤C/N与有机质分解速率、土壤矿化速率呈反比[24 − 26],土壤C/N比值低时,会促进土壤分解释放N元素 [27 − 28]. 3种成土基质土壤中,板岩土壤C/N(11.57)略低于全国土壤C/N(11.9),砂岩和石灰岩基质土壤C/N均高于全国土壤C/N[29 − 30]. 这一方面说明板岩土壤N转化较快,也是使得板岩土壤N含量较其它2种土壤高的原因之一;另一方面,也是因为砂岩和石灰岩基质土壤N含量偏低,拉高了土壤的C/N.
3种基质土壤C/P和N/P范围分别为30.18—357.88和1.95—11.31(图2),砂岩土壤的C/P和N/P比值均为最大,石灰岩土壤的这两种比值均为最小. Duncan显著性检验发现,石灰岩土壤的C/P、N/P比值显著小于砂岩土壤(P<0.05),而板岩土壤的C/P和N/P比值均高于石灰岩土壤,但二者无显著差异. C/P是反映土壤P有效性的重要指标,C/P高时,P的有效性低[27 − 28,31]. 本研究中,砂岩土壤的C/P高于全国土壤C/P的均值61,板岩和石灰岩的C/P低于全国土壤均值,尤其是砂岩土壤C/P远高于全国的平均值[29-30],说明砂岩土壤的P有效性极低. N/P也可间接作为养分限制和供给水平的预测指标[31]. 本研究中,砂岩基质的N/P高于全国水平(5.20)[29 − 30],板岩N/P(5.19)接近全国水平,石灰岩N/P(1.95)远低于全国水平,说明砂岩土壤P含量相对于N,处于偏低的水平. 由此推测,P可能是砂岩基质土壤上植物生长的限制性元素,这与寻亚飞等[32]的研究结果一致.
3种基质土壤上生长的青檀叶C/N范围为14.34—21.48(图2),其中,石灰岩基质土壤上青檀叶片的C/N显著低于砂岩上的(P<0.05);板岩基质土壤上青檀的叶片C/N介于石灰岩和砂岩基质土壤上的青檀之间,但与2者无显著差异(P>0.05). 3种基质土壤上青檀叶C/P范围为109.00—213.27,其中砂岩基质土壤上的青檀叶片C/P比值显著高于石灰岩的(P<0.05),而与板岩上的差异不显著(P>0.05). 3种基质土壤的青檀叶N/P范围为7.41—9.78,虽然砂岩基质土壤上青檀叶片的N/P高于其他2种土壤上的青檀(P>0.05),但3者间没有显著差异. C、N、P是陆地植物生长发育的生源要素. 植物的C/N和C/P受外界环境,特别是土壤N、P可利用量的控制[33 − 35]. 一般稳态条件下,生态系统中N、P含量不足会导致C贮量的相对增加,C/N和C/P比增大[33]. 植物叶片C/N、C/P代表植物吸收N、P元素时同化C元素的能力,反映了植物的生长速率和养分利用的效率[36]. 生长速率假说认为,植物叶片C/N、C/P越低,植物光合效率越高、生长速率越快、资源竞争能力越强;反之,则植物光合效率低、生长速率慢、防御能力强[37 − 39]. 本研究中,石灰岩基质富含钙,其上青檀叶片的C/N、C/P均低,说明其对土壤中N、P元素的吸收能力强,光合效率越高,对环境资源竞争能力强劲,这可能是青檀作为喜钙植物,常成为石灰岩山地优势树种的原因之一. 砂岩基质上青檀叶片C/N、C/P较高,其对N、P元素吸收利用效率较低,生长缓慢(表1),这是植物适应养分贫瘠生境(图1)的一种选择性适应策略. 板岩基质上的青檀介于两者之间,偏向于选择适应策略. 植物叶片N/P可指示生境对植物所需养分的供应状况及植物的生长速率,反映了植物在特定环境下的生长策略. 一般情况下,叶片N/P<14时,植物生长受N限制;N/P>16时,受P限制;14≤N/P≤16时,受N、P共同限制[40 − 41]. 本研究中,青檀叶片的N/P表现为砂岩基质(9.78)>石灰岩基质(7.64)>板岩基质(7.41),均远小于14,说明这3个样区青檀生长均受到N的限制.
-
不同基质土壤与其上生长的青檀叶片的化学计量相关性见表2. 板岩土壤与青檀叶片之间的化学计量相关性均不显著. 砂岩基质上,青檀叶片的N含量与土壤的N/P呈显著正相关(P<0.05). 石灰岩基质上,土壤C含量与土壤N含量显著正相关(P<0.05),土壤P含量与青檀叶片P含量显著负相关(P<0.05),土壤C/P与N/P呈显著负相关(P<0.05).
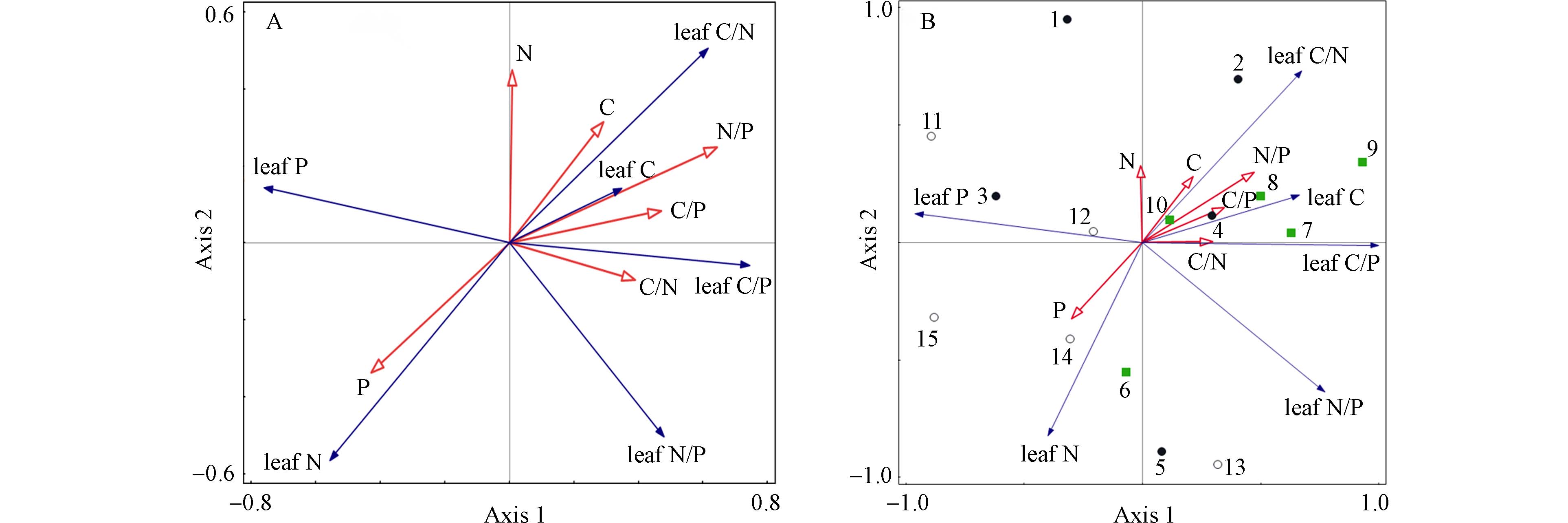
对不同基质土壤与青檀叶片化学计量的关系分析发现,土壤-青檀叶化学计量RDA的第一轴值为0.44,第二轴值为0.12,两轴可解释大约56%的青檀叶片化学计量特征,说明土壤化学计量特征对青檀化学计量特征的影响较小(图3A). 从RDA分析图也可以发现土壤P含量与原点连线较长,说明其与青檀化学计量相关性相对较大,与青檀叶N含量具有正相关性,与青檀叶C/N比呈反比,这与相关性分析结果一致. 土壤-青檀叶片化学计量主成分分析(PCA)的第一轴特征值为0.74,第二轴特征值为0.21,能解释土壤和青檀叶片化学计量95%的信息量(图3B),图中青檀叶片P、C、C/P以及土壤C/N在第一轴的载荷量较大,土壤N、叶片的N在第二轴的载荷量较大;砂岩主要集中在第一象限,沿第一轴与其他两成土母岩土壤的青檀分离,后二者则交错分散在另外3个象限中.
土壤养分的供给水平直接影响着植物的营养状况,而植物通过调节养分摄取比例以维持自身生理代谢内稳性. 砂岩和石灰岩基质上的C、N、P在土壤-青檀叶片中都有着显著相关性(表2). 这可能的原因是生态系统中C与N、P等元素的循环过程中是相互耦合的,在相对稳定的生态系统中,C的贮藏量是由N、P供应量控制的,N、P缺乏意味着C过剩,C/P和C/N上升,反之下降[32]. 叶片和土壤中的P在生态尺度上有较强的耦合关系[28,30,42 − 44]. 石灰岩土壤的P和叶片中的P呈显著负相关(表2)符合该理论,可能与植物吸收土壤中的P来促进P的有效性,进而刺激N吸收有关[45 − 46].
砂岩和板岩基质上青檀叶片C含量与N含量负相关(表2),这和具有广泛“选择适应性策略”的高等陆生植物的C、N等计量关系的普遍规律一致. 石灰岩土壤中,青檀叶片C含量与N含量正相关(表2),这和青檀采取的“竞争性策略”有关. 因为叶片C主要来源于光合作用,而光合作用速率受叶片养分影响,高N含量促进了光合作用,有利于C的积累,进而提升了植物的环境竞争力[39].
-
(1)3种成土母质土壤C、N、P含量具有显著差异,其中板岩基质土壤N转化较快,砂岩和石灰岩基质土壤C含量较低;3种土壤的N、P含量均偏低,其中砂岩土壤受P限制更为严重. 人工适当增施氮肥和磷肥,有望促进研究区,特别是砂岩基质青檀的生长.
(2)泾县青檀栽培基地,3种基质土壤上青檀生态适应策略不同. 石灰岩基质上青檀采取了竞争策略;砂岩基质上青檀为应对生境养分的贫瘠选择了防御为主的适应策略;板岩基质上青檀的介于二者之间,偏向于选择适应策略.
不同土壤基质条件下青檀的生态化学计量特征
Ecological stoichiometric characteristics of Pteroceltis tatarinowii under different soil substrates
-
摘要: 青檀是我国特有的纤维树种,其韧皮纤维是制作宣纸的主要原材料,土壤条件对青檀生长具有较大影响. 为探究不同成土基质土壤的限制性养分及青檀的环境适应性,选取安徽省泾县板岩、砂岩和石灰岩3种成土基质土壤及其上生长的青檀为研究对象,分析不同土壤基质条件下青檀的生态化学计量特征. 结果显示,3种基质土壤间C、N、P含量存在显著差异,其中板岩土壤的C(56.50 g·kg−1)、N(4.91 g·kg−1)、P(1.03 g·kg−1)含量最高,石灰岩土壤N(1.22 g·kg−1)含量最低,砂岩土壤P含量最低(0.30 g·kg−1). 3种土壤中砂岩的C/P、N/P高于全国土壤均值;板岩的C/P低于全国土壤均值,N/P接近全国土壤均值;石灰岩的C/P、N/P均低于全国土壤均值. C/N方面,板岩土壤低于全国土壤C/N平均水平,砂岩和石灰岩基质土壤C/N均高于全国土壤平均水平. 3种成土基质土壤上青檀叶片N、P含量具有显著差异,其中石灰岩土壤上青檀叶片N(21.56 g·kg−1)、P(3.15 g·kg−1)含量最高. 石灰岩基质土壤上青檀叶片的C/N、C/P均低,砂岩基质上青檀叶片C/N、C/P较高,板岩基质上的青檀介于两者之间. 青檀叶片的N/P表现为砂岩基质(9.78)>石灰岩基质(7.64)>板岩基质(7.41),均小于14. 综合分析发现,P和N可能是3种基质土壤上青檀生长的限制性元素,其中砂岩基质受P限制更为严重;在适应对策上,石灰岩基质上青檀采取了竞争策略,砂岩基质上青檀选择了防御为主的适应策略,而板岩基质上的青檀介于二者之间,偏向于适应策略.Abstract: Pteroceltis tatarinowii is the characteristic of the fiber species in China, which phloem fibres are the main raw material for making rice paper. To explore environmental adaptability of P. tatarinowii in different types of parent materials soil and limiting nutrients of the parent materials soil, the ecological stoichiometric characteristics of P. tatarinowii grown on three parent soils, namely slate, sandstone and limestone, in Jingxian County of Anhui Province were analyzed. The results showed: There were significant differences in C, N and P contents among the three soils, among which the content of C (56.50 g·kg−1), N (4.91 g·kg−1) and P (1.03 g·kg−1) in slate soil was the highest, the content of N (1.22 g·kg−1) in limestone soil was the lowest, and the content of P in sandstone soil was the lowest (0.30 g·kg−1). The C/P and N/P of the sandstone soil in the three were higher than the national average. The C/P of the slate soil was lower than the national average, and the N/P closed to national average; The C/P and N/P of the limestone were lower than national average. In terms of C/N, the slate soil was lower than the average level of national soil, while the sandstone and limestone matrix soil were higher than the average level of national soil. There were significant differences in N and P contents of P. tatarinowii leaves on the three soil formation substrates, among which the N (21.56 g·kg−1) and P (3.15 g·kg−1) contents of P. tatarinowii leaves on limestone soil were the highest. The C/N and C/P of P. tatarinowii leaves on limestone matrix soil were low, the C/N and C/P of P. tatarinowii leaves on sandstone matrix were high, and the C/N and C/P of P. tatarinowii leaves on slate matrix were between the two. The N/P of P. tatarinowii leaves showed that sandstone matrix (9.78) > limestone matrix (7.64) > slate matrix (7.41), which were much lower than 14. The comprehensive analysis shows that P and N may be the limiting element for the growth of P. tatarinowii on the three matrix soils, especially the sandstone matrix. In terms of adaptation strategies, P. tatarinowii on limestone substrate adopted the competitive strategy, which on sandstone substrate chose the defense-oriented adaptation strategy, and P. tatarinowii on slate substrate was in between, preferring the adaptive strategy.
-
近年来随着我国城镇化水平的深入推进,城市下垫面不透水层比率迅速提高,加速了径流形成过程,缩短了径流汇集时间;与此同时,人类活动增加了蓄积在城市下垫面污染物的种类和数量。二者共同作用,使得由地表径流引发的城市水体污染问题日益突出[1]。生物滞留池是用于城市雨洪管理的一种低影响开发(low impact development, LID)技术,其可通过地表径流原位滞留调节峰值流量,并通过吸附、生物吸收和降解以去除地表径流中的污染物[2]。有研究表明,生物滞留池对传统目标污染物,如重金属[3]、多环芳烃[4]、总氮、总磷等均具有较好的去除效果[5-6]。
全氟化合物(perfluorinated compounds, PFCs)是一种典型的新污染物,作为表面活性剂和保护剂被广泛应用于日常用品及工业生产中。PFCs具有生物毒性和生物累积性,可在人体内蓄积造成健康危害[7]。城市下垫面累积的全氟和多氟烷基化合物(per/polyfluoroalkyl substances, PFASs)主要来源于大气PFASs及其前体物的传输和沉降[8-9],并在雨水冲刷下进入受纳水体。有研究表明,雨季河水中的PFASs浓度水平明显高于旱季[10]。因此,地表径流中的PFCs含量不可忽视,明确生物滞留池对PFCs的削减效能对城市面源污染防治和可持续发展具有十分重要的现实意义和科学价值。
传统生物滞留系统的填料层(bioretention soil media,BSM)常由土壤与细砂混合而成,具有良好的渗透性能[11]。近年来,以煤质活性炭、沸石等为主要改良剂的生物滞留池得到了广泛运用。活性炭层可明显提高脱氮效率,使氨氮(NH3-N)和总氮(TN)的平均去除率达到80.27%和59.45%[12],沸石层对多环芳烃的去除率达40%以上[13]。然而,改良填料层对PFCs的去除能力及各污染物在系统中的空间分布特征尚不清楚。为此,本研究通过构建不同填料的生物滞留系统,利用为期1 a的模拟实验考察了改良填料下生物滞留池的水量削减效能,分析了其对常规污染物和PFCs的去除效果,探讨了PFCs是否影响常规污染物去除及其长期运行能力,以期为城市雨洪综合管理提供参考。
1. 材料与方法
1.1 生物滞留池装置构建
生物滞留装置采用有机玻璃PMMA材料制成,高度1 500 mm,直径400 mm。距池顶150 mm处设溢流口,沿柱体向下每间隔150 mm设置取样口,共8个取样口,取样口均封有纱网布。设备底部预留滞留体积,接直径为25 mm出水管(图1)。滞留装置基质层填料类别不宜过多,BSM由河沙、土、树皮按质量比65:30:5比例构成[14]。JIANG等[15]设置BSM+10%绿色沸石、BSM+10%粉煤灰等6种改良生物滞留系统,其对溶解性污染物较好均有较好的去除效果。因此,本研究中1#生物滞留池填料层由BSM+10% 2~4 mm沸石(BSM+10% Zeolite)组成;2#池填料层由BSM+10% 2~4 mm煤质颗粒活性炭(BSM+10% GAC)组成。滞留装置由下至上分别是150 mm砾石排水层(粒径24 mm)、600 mm填料层和300 mm的种植层。种植层填料为场地附近红土,种有生性强健、耐阴耐湿的紫芋。种植层表面为50 mm高的覆盖层,材料为树皮。各层间由土工布隔开并预留出200 mm高蓄水层。锡纸包裹柱体种植层以下外壁,模拟无光环境,为厌氧菌提供生存条件。为防止短流,1#生物滞留池内侧用云石胶贴有砾石。
1.2 实验设计
根据ZENG等[16]的研究,采用NH4Cl、KNO3、KH2PO4、尿素、葡萄糖、7种PFCs配置人工雨水。PFCs包括全氟辛酸(perfluorooctanoic acid,PFOA)、全氟丁酸(perfluorobutanoic acid,PFBA)、全氟辛基磺酸(perfluorooctane acid,PFOS)、全氟戊酸(perfluoropentanoic acid,PFPeA)、全氟己酸(perfluorohexanoic acid,PFHxA)、全氟庚酸(perfluoroheptanoic acid,PFHpA)和全氟壬酸(perfluorononanoic acid,PFNA)。污染物分别为1.5 mg·L−1
NH+4 NO−3 表 1 生物滞留装置实验条件设计Table 1. Experimental condition design (for a single bioretention column)实验条件 进水浓度 重现期/a 降雨历时/min 实验水量/L 降雨间隔/d 1 c 0.5 180 58 3 2 c 0.5 180 58 10 3 2c 0.5 180 58 20 1.3 试剂和检测方法
硝酸钾和硫酸(AR,纯度>95%)购自广州化学试剂公司;无水硫代硫酸钠(纯度>99%)购自上海阿拉丁生化科技股份有限公司;葡萄糖购自上海润捷化学试剂有限公司;氯化铵购自CNW公司(德国);磷酸二氢钾购自天津市科密欧化学试剂有限公司;OasisWAXSPE柱(6cc,150mg)购自Waters公司(美国)。
采用HACH DRB200消解器和DR3900分光光度计,根据《水和废水监测分析方法 (第四版) 》中的国家标准或行业标准分析方法测定:COD采用快速消解法、TN采用碱性过硫酸钾消解紫外分光光度法、TP采用钼锑抗分光光度法、
NH+4 NO−3 1.4 数据处理方法
利用Masslynx软件对PFCs数据进行处理。水量削减效果使用水量削减率
RV Rc RV=Vin−Vout−VoverVin×100% (1) Rc=Cin−CoutCin×100% (2) 式中:
RV Rc Vin、Vout、Vover Cin、Cout 2. 结果与讨论
2.1 水量调控效果分析
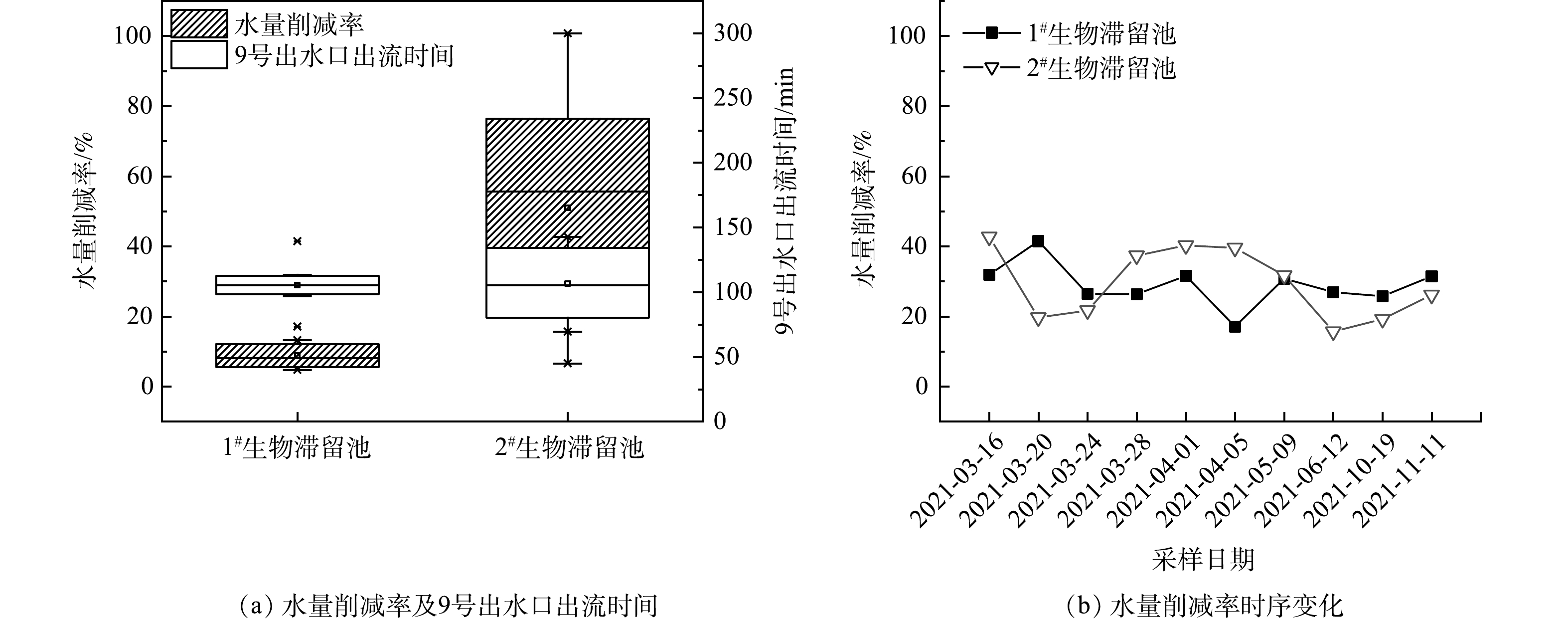
生物滞留装置底部出水口出流时间和水量削减率如图2(a)所示。1#生物滞留池首次出流时间稳定,平均值为(51±9) min。2#生物滞留池平均出流时间高于1#生物滞留池且不稳定,平均值为(165±90) min;其运行初期出流时间高于后期,尤其在投入使用0.5 a后底部出流明显加快。这说明2#生物滞留池填料透水率随运行时间增加而增高,提示长期运行时需考虑煤质活性炭在雨水浸泡后的老化情况和使用年限。1#生物滞留池水量削减率为17.13%~41.48%,2#生物滞留池为15.67%~42.7%,两池的水量削减率相当。匡彬等[17]的研究表明,在P=1、2 a 等小重现期降雨条件下,绿色雨水系统对径流量和峰流量的削减效果较好。当降雨强度为1 a一遇时,径流总量削减率达到21.7%。本研究中重现期设定为0.5 a, 1#和2#生物滞留池水量削减率平均值分别为30.3%和29.4%,削减率与文献报道结果一致[18]。图2(b)为生物滞留池水量削减率随运行时间的变化情况。如图2所示,削减率随运行时间增长呈现波动下降的趋势,其中,2#生物滞留池削减率后期下降趋势更为明显。
2.2 常规污染物去除效果分析
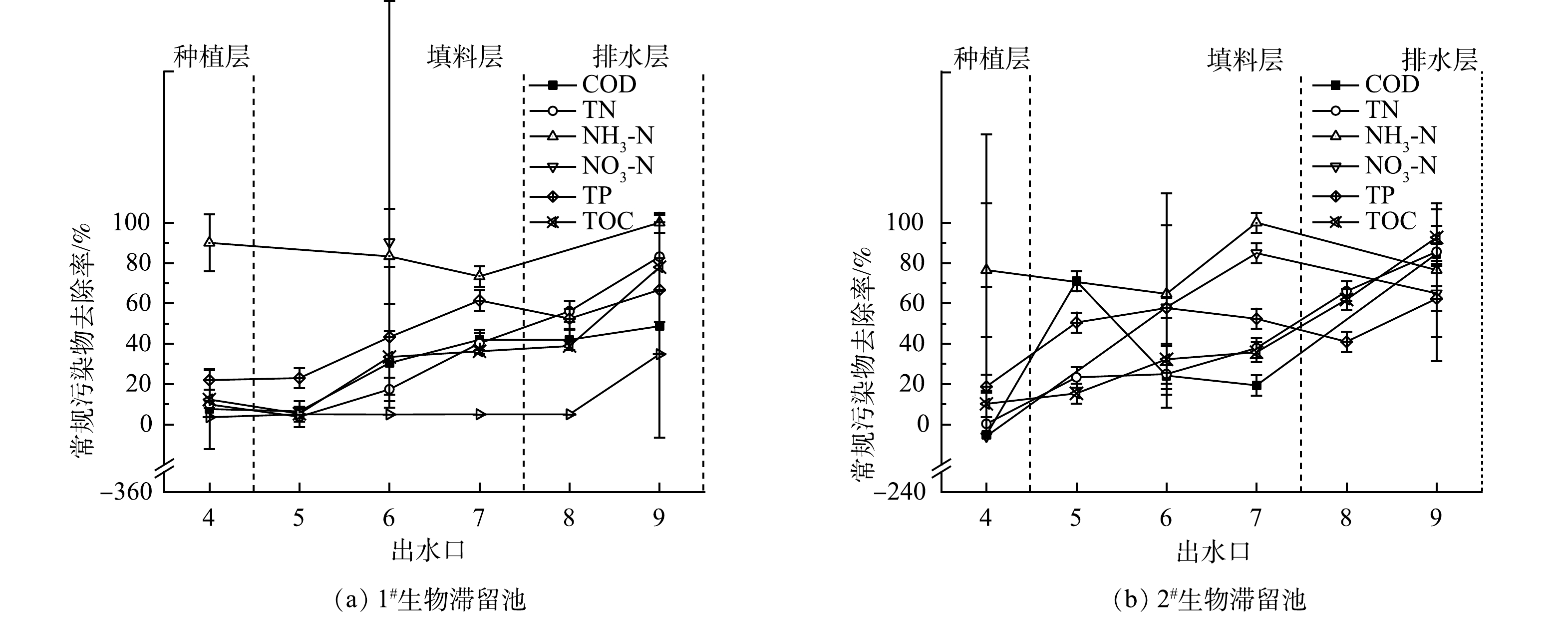
1)常规污染物在生物滞留池中纵向迁移情况。为考查污染物在滞留池中的纵向迁移规律,获取连续3次降雨间隔为10 d的各出水口常规污染物去除率。如图3(a)~(b)所示,目标污染物的去除率随池深增加而提高,说明填料层对常规污染物去除起到关键作用。其中活性炭的比表面积、微孔体积大,有利于为基质提供更多的吸附位点;沸石表面呈粗糙多孔结构,这有利于对离子的物理吸附[19]。
1#生物滞留池由上至下对COD、TP、TOC的去除率均逐渐上升。9号出水口COD、TP、TOC的去除率为48.68%、66.71%、 77.96%。1#生物滞留池对
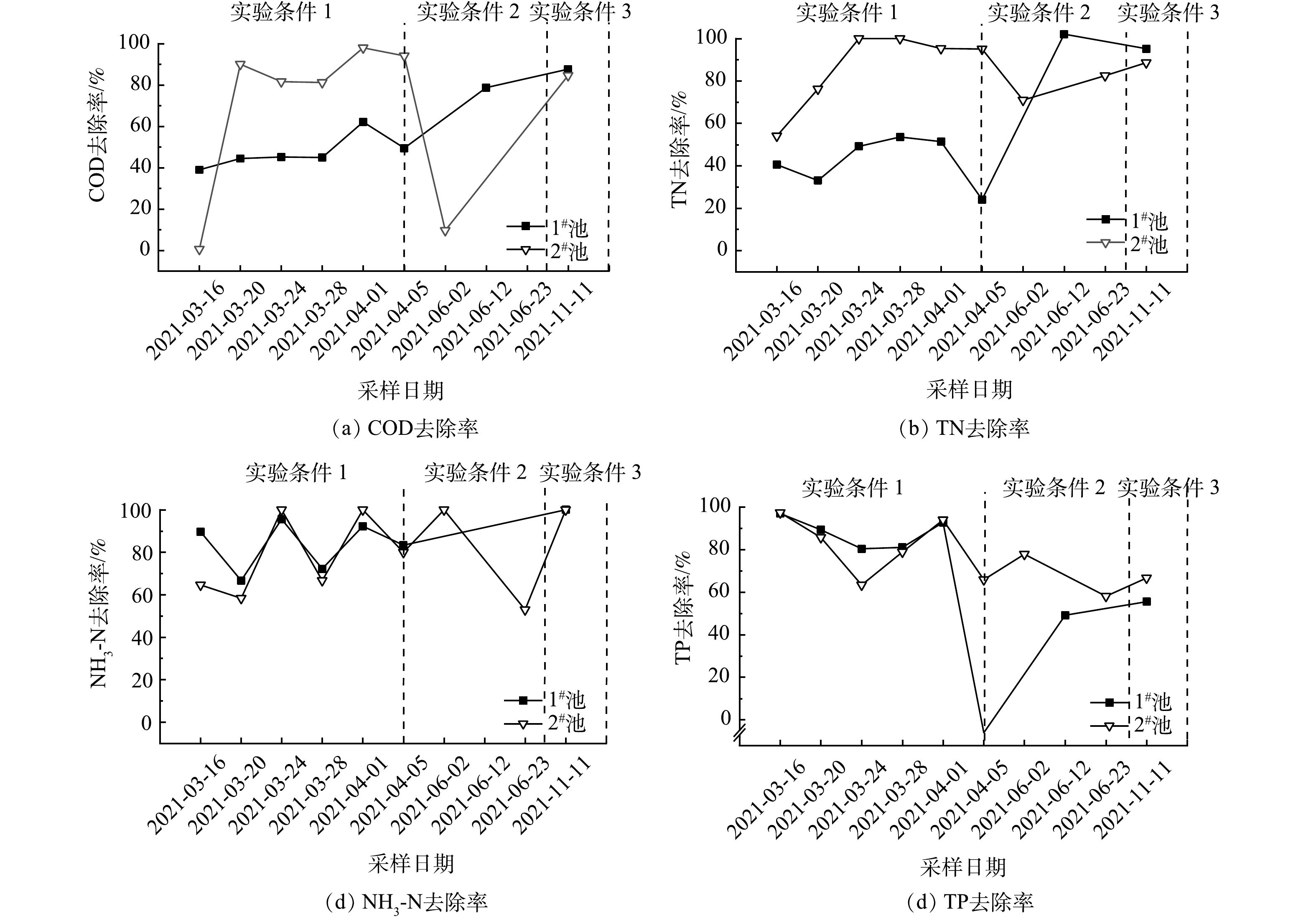
NH+4 NO−3 NH+4 NO−3 NO−3 NH+4 NO−3 2)生物滞留池对常规污染物去除效果的长期稳定性情况。为考察生物滞留池对常规污染物的长期去除性能,系统在8个月内以不同实验条件进行了非连续地降雨实验,其中实验条件1在3—4月,条件2在5—8月,条件3在9—11月下进行。如图4(a)所示,1#生物滞留池COD去除率呈稳定并略有上升的趋势。由38.97%(3月)增长至87.69%(11月);2#生物滞留池COD去除率较1#生物滞留池波动明显,但除去2次异常低值后,COD去除率达80%以上。2#生物滞留池的2次异常低值,分别出现在第1次实验和与前次实验间隔期间较长的第7次实验,考虑为COD浸出与气候的影响。由图4(b)可见,2组生物滞留池对TN的去除效果有着不同的趋势。1#生物滞留池波动较大,去除率偏低,TN去除率由40.52%增至运行后期的95.28%。2#生物滞留池恰好相反,前期TN去除率较高,后期降低。由图4(c)可见,2组生物滞留池对
NH+4 NH+4 NO−3 NO−3 NO−3 NH+4 2.3 全氟化合物迁移滞留情况分析
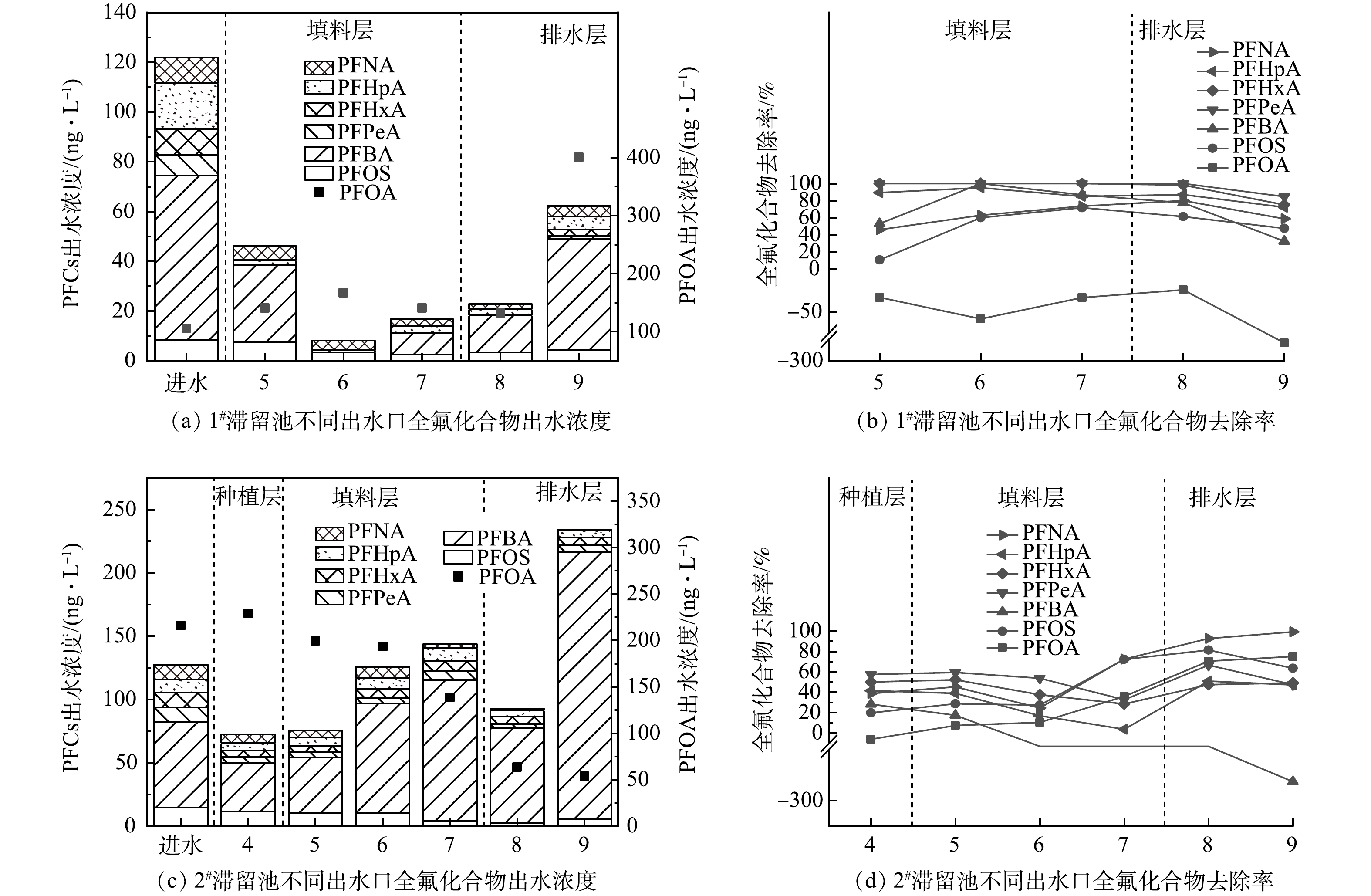
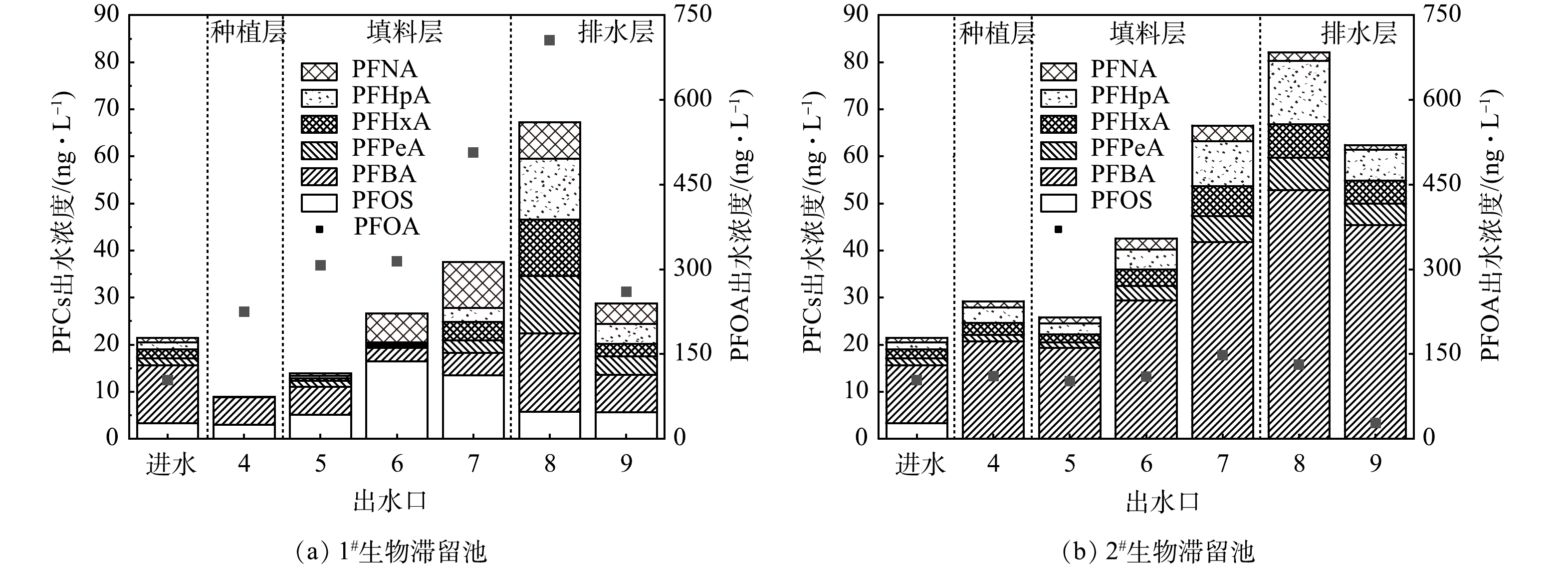
1)全氟化合物在生物滞留池中迁移规律。通过分析各出水口PFCs总量可知,1#生物滞留池在6号出水口获得最高去除率(实验条件2),池底出水口PFCs去除率反而明显下降(图5(a)~(b)),其中对PFOA的去除率尤为低下(-279%)。同样地,2#生物滞留池8号出水口达到最高,底部9号出水口PFPeA、PFHxA、PFHpA、PFOS去除率下降,PFBA下降幅度最为明显(图5(c)~(d))。因此,2组生物滞留池对PFCs的去除沿柱深方向呈现先增加后降低的趋势,说明填料层对PFCs结合不稳定,加之生物滞留池排水快速,短时间内微生物降解难以发挥作用。连续降雨情况下,PFCs可能在生物滞留池发生浸出,导致PFCs出水浓度高于进水浓度。就具体物质而言,PFHxA、PFPeA、PFBA、PFHpA去除率接近100%,而PFBA和PFOS的去除率较低(60%),但该差异原因尚不清楚。
2)全氟化合物在生物滞留池中的浸出情况。生物滞留池在运行近3个月后,为进一步分析PFCs在生物滞留池中的浸出情况,采用加入硫代硫酸钠除氯后的自来水作为进水,测定滞留池各出水口PFCs浓度。由图6(a)可见,1#生物滞留池4号出水口PFOS有明显降低,说明种植层土壤仍对PFCs有截留作用;5~8号出水口PFCs出水浓度呈升高趋势,甚至出现了进水含量较低的PFNA、PFHpA;7号出水口PFHpA的浸出尤为明显;PFOA在8号出水口的出水质量浓度达到705.25 ng·L−1。上述结果证实了PFCs截留在5~8号出水口的填料层,但并未被转化降解。由图6(b)可见,2#生物滞留池中同样存在PFCs浸出情况,但PFOA的浸出量较1#生物滞留池(147.70 ng·L−1)大幅减少,说明煤质活性炭中PFCs不易脱出,运行稳定性更有保障。
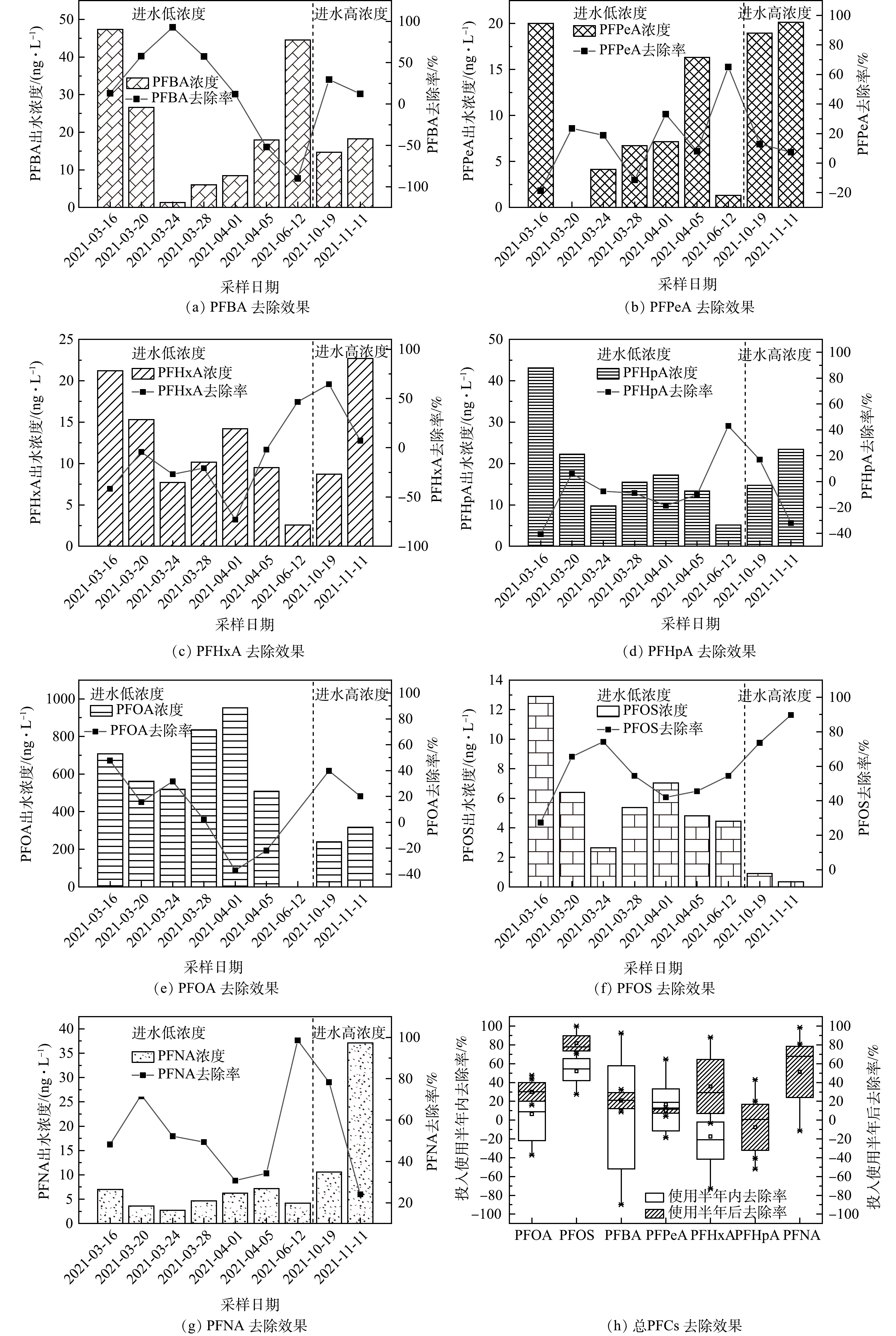
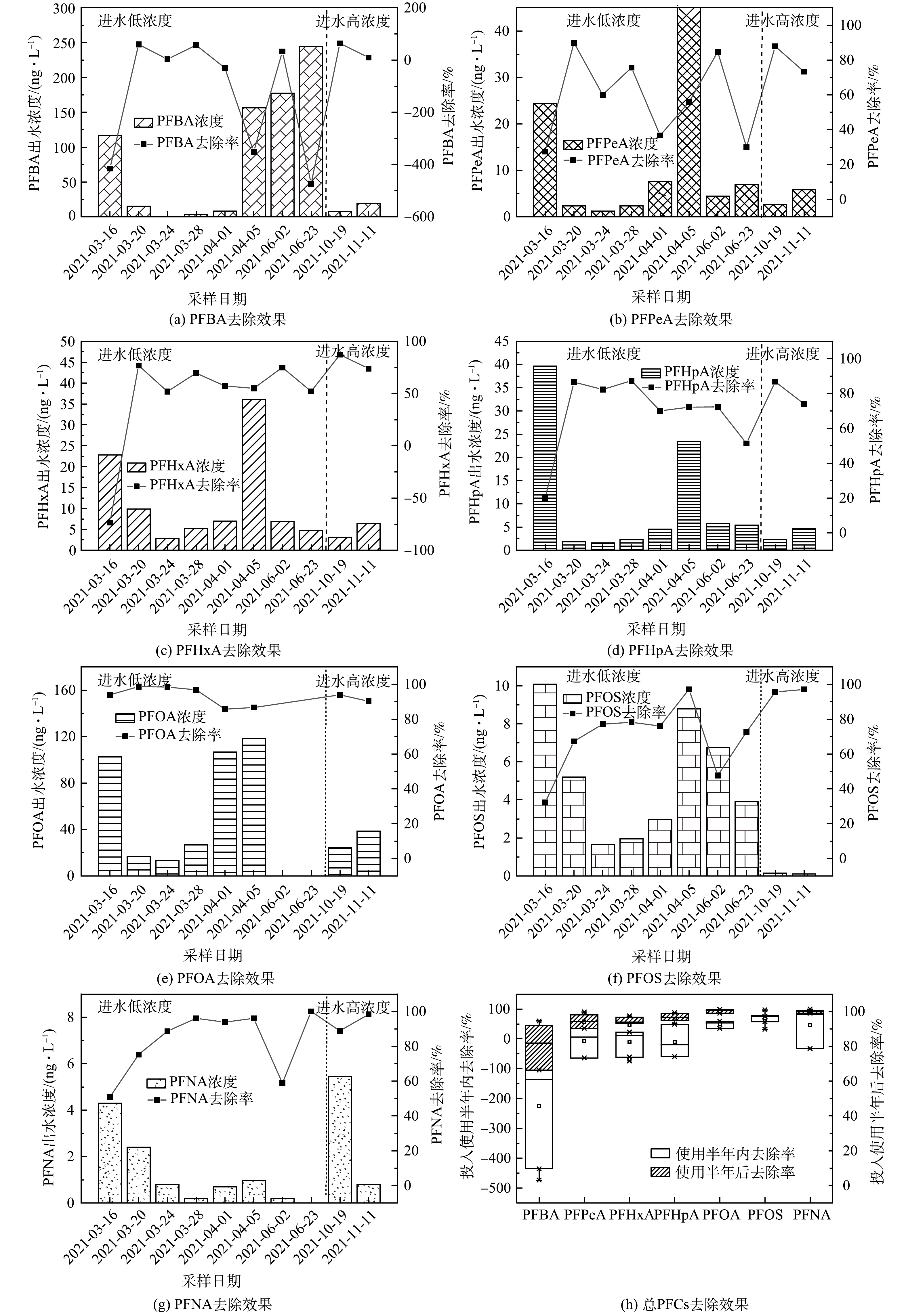
3)生物滞留池对全氟化合物去除效果的长期稳定性情况。通过分析2021年3—11月生物滞留池底部出水口PFCs去除率,判断其长期使用潜能。如图7所示,由1#生物滞留池对PFCs去除效能随降雨次数的增加而降低。具体来说,3—4月间PFBA、PFHxA、PFOA和PFOS去除率逐次降低,甚至出现负值即存在浸出现象。但值得注意的是,上述物质去除效能在间隔2个月后得到恢复,推断长时间干旱条件下,PFCs在池内出现了降解转化,释放了填料层的吸附容量,后续需结合微生物实验验证。
如图8所示,2#生物滞留池对PFCs去除效果远优于1#生物滞留池,说明其具有长期使用的潜能。PFHxA、PFHpA、PFNA、PFOS的去除较稳定(>60%),其中PFOA去除率高于 85%,这个结果印证了煤质活性炭具有高效地吸附去除PFOA的能力[22],PFPeA去除率有一定波动,均值为62.12%。
3. 结论
1) 1#生物滞留池对径流水量的平均削减率为(30.3±6.2)%,2#生物滞留池对径流水量的平均削减率为(29.3±10.1)%。随着投入使用时间的延长,2组生物滞留池的水量削减率均呈现波动下降的趋势,其中2#生物滞留池的下降趋势明显。
2) 2组生物滞留池对常规污染物均有较好的去除效果。其中,2#生物滞留池对COD、TP、TOC、TN 的去除率分别为84.6%、62.4%、92.7%、85.6%。生物滞留池对常规污染物的去除主要依靠填料层的吸附作用,但种植层中植物根系与土壤也具备一定的净化能力。在经过将近1 a后,2#生物滞留池对常规污染物仍保持较好的去除效果。
3) PFCs在生物滞留池中浓度分布规律明显。PFBA主要集中于种植层,而PFPeA、PFHxA、PFHpA、PFOA、PFOS、PFNA则更集中于填料层,1#生物滞留池对PFCs的去除效果在0.5 a后由明显下降,而2#生物滞留池对多数PFCs的去除效率还保持在较高的水平,说明其具有长期使用的潜能。
-
表 1 青檀采样地概况
Table 1. General situation of P. tatarinowii sampling site
采样区Sampling area 北纬Northern latitude 东经East longitude 成土母质Soil parent material 青檀冠幅/mCrown breadth of P. tatarinowii P1(泾县廊桥镇球桂村) 30°30′ 118°24′ 板岩 5×4 P2(泾县白华林场后山) 30°32′ 118°26′ 砂岩 2×2 P3(泾县丁家桥镇小岭村) 30°40′ 118°18′ 石灰岩 4×4 表 2 不同土壤与其上生长的青檀叶片的化学计量相关性
Table 2. Stoichiometric correlation between soil and the leaves of P. tatarinowii growing on it
基质Matrix 类别Category 指标Index 土壤Soil 叶片Leave C N P C/N C/P N/P C N P C/N C/P N/P 板岩 土壤 C 1 N 0.659 1 P 0.788 0.51 1 C/N 0.613 −0.19 0.5 1 C/P −0.236 −0.002 −0.771 −0.316 1 N/P 0.575 −0.04 0.829 0.8 −0.817 1 叶片 C 0.506 0.189 −0.103 0.453 0.632 −0.095 1 N 0.269 −0.085 0.493 0.44 −0.624 0.63 −0.32 1 P 0.053 0.545 0.432 −0.492 −0.459 0.035 −0.563 −0.2 1 C/N 0.036 0.143 −0.482 −0.109 0.849 −0.57 0.769 −0.838 −0.236 1 C/P 0.313 −0.173 −0.237 0.58 0.567 −0.014 — −0.002 — 0.52 1 N/P 0.095 −0.425 0.035 0.564 −0.141 0.381 0.087 0.8 −0.745 −0.441 0.512 1 砂岩 土壤 C 1 N 0.329 1 P −0.598 −0.153 1 C/N — 0.016 −0.614 1 C/P — 0.067 −0.531 .991** 1 N/P −0.631 −0.328 — −0.589 −0.52 1 叶片 C 0.81 0.763 −0.642 0.612 0.629 −0.754 1 N −0.46 −0.583 0.859 −0.323 −0.264 .925* −0.774 1 P −0.419 −0.731 0.709 −0.225 −0.206 0.816 −0.838 0.920* 1 C/N −0.036 0.326 −0.671 −0.111 −0.205 −0.694 0.324 −0.842 −0.679 1 C/P −0.424 −0.59 0.583 −0.27 −0.282 0.679 −0.773 0.692 0.898* −0.361 1 N/P 0.091 −0.431 −0.258 0.249 0.159 −0.148 −0.237 −0.06 0.335 0.265 0.625 1 石灰岩 土壤 C 1 N 0.936* 1 P 0.436 0.265 1 C/N −0.188 −0.519 0.404 1 C/P −0.1 0.047 −0.472 1 N/P −0.099 −0.316 0.826 0.723 −0.942* 1 叶片 C 0.153 0.073 0.084 0.156 0.054 −0.028 1 N 0.72 0.467 0.564 0.44 −0.29 0.282 0.581 1 P −0.551 −0.387 −0.920* −0.325 0.773 −0.652 −0.447 −0.75 1 C/N −0.457 −0.195 −0.047 −0.499 −0.143 0.001 0.038 −0.603 0.043 1 C/P −0.231 −0.132 −0.077 −0.172 −0.092 0.062 −0.647 0.446 0.071 1 N/P −0.249 −0.389 −0.558 0.392 0.531 −0.261 −0.234 −0.061 0.621 −0.691 0.168 1 注:*为0.05水平显著相关,**为0.01水平极显著相关;--为存在显著自相关关系. Note: *indicated significant correlated at 0.05 level, **indicated extremely correlated at 0.01level; -- indicated autocorrelation. -
[1] STERNER R W, ELSER J J, VITOUSEK P M. Ecological Stoichiometry: The biology of elements from molecules to the biosphere[M]. Princeton, Oxford: Princeton University Press, 2017. [2] 卢建男, 刘凯军, 王瑞雄, 等. 中国荒漠植物-土壤系统生态化学计量学研究进展[J]. 中国沙漠, 2022, 42(2): 173-182. LU J N, LIU K J, WANG R X, et al. Research advances in stoichiometry of desert plant-soil system in China[J]. Journal of Desert Research, 2022, 42(2): 173-182 (in Chinese).
[3] 曾德慧, 陈广生. 生态化学计量学: 复杂生命系统奥秘的探索[J]. 植物生态学报, 2005, 29(6): 1007-1019. ZENG D H, CHEN G S. Ecological stoichiometry: A science to explore the complexity of living systems[J]. Acta Phytoecologica Sinica, 2005, 29(6): 1007-1019 (in Chinese).
[4] 贺金生, 韩兴国. 生态化学计量学: 探索从个体到生态系统的统一化理论[J]. 植物生态学报, 2010, 34(1): 2-6. HE J S, HAN X G. Ecological stoichiometry: Searching for unifying principles from individuals to ecosystems[J]. Chinese Journal of Plant Ecology, 2010, 34(1): 2-6 (in Chinese).
[5] 孙德斌, 栗云召, 于君宝, 等. 黄河三角洲湿地不同植被类型下土壤营养元素空间分布及其生态化学计量学特征[J]. 环境科学, 2022, 43(6): 3241-3252. SUN D B, LI Y Z, YU J B, et al. Spatial distribution and eco-stoichiometric characteristics of soil nutrient elements under different vegetation types in the Yellow River Delta wetland[J]. Environmental Science, 2022, 43(6): 3241-3252 (in Chinese).
[6] 程昊天, 孔涛, 吕刚, 等. 不同林龄樟子松人工林土壤-针叶-微生物生态化学计量及稳态性特征[J]. 生态学杂志, 2022, 41(5): 887-894. CHENG H T, KONG T, LÜ G, et al. The soil-needle-microbe ecological stoichiometry and homeostasis in Pinus sylvestris var. mongolica plantations with different stand ages[J]. Chinese Journal of Ecology, 2022, 41(5): 887-894 (in Chinese).
[7] 萨仁其力莫格, 荆佳强, 秦洁, 等. 不同利用方式下贝加尔针茅草原植物和土壤的生态化学计量特征[J]. 中国草地学报, 2022, 44(1): 20-29. SARENQILIMOGE, JING J Q, QIN J, et al. Ecological stoichiometric characteristics of plants and soil in Stipa baicalensis grassland under different utilization modes[J]. Chinese Journal of Grassland, 2022, 44(1): 20-29 (in Chinese).
[8] YANG Y, LIU B R, AN S S. Ecological stoichiometry in leaves, roots, litters and soil among different plant communities in a desertified region of Northern China[J]. Catena, 2018, 166: 328-338. doi: 10.1016/j.catena.2018.04.018 [9] 田地, 严正兵, 方精云. 植物生态化学计量特征及其主要假说[J]. 植物生态学报, 2021, 45(7): 682-713. doi: 10.17521/cjpe.2020.0331 TIAN D, YAN Z B, FANG J Y. Review on characteristics and main hypotheses of plant ecological stoichiometry[J]. Chinese Journal of Plant Ecology, 2021, 45(7): 682-713 (in Chinese). doi: 10.17521/cjpe.2020.0331
[10] HE M Z, DIJKSTRA F A, ZHANG K, et al. Influence of life form, taxonomy, climate, and soil properties on shoot and root concentrations of 11 elements in herbaceous plants in a temperate desert[J]. Plant and Soil, 2016, 398(1): 339-350. [11] 何茂松, 罗艳, 彭庆文, 等. 新疆67种荒漠植物叶碳氮磷计量特征及其与气候的关系[J]. 应用生态学报, 2019, 30(7): 2171-2180. HE M S, LUO Y, PENG Q W, et al. Leaf C: N: P stoichiometry of 67 plant species and its relations with climate factors across the deserts in Xinjiang, China[J]. Chinese Journal of Applied Ecology, 2019, 30(7): 2171-2180 (in Chinese).
[12] 何茂松, 罗艳, 彭庆文, 等. 新疆45种荒漠植物粗根碳、氮、磷计量特征及其与环境的关系[J]. 生态学杂志, 2019, 38(9): 2603-2614. HE M S, LUO Y, PENG Q W, et al. Carbon, nitrogen and phosphorus stoichiometry in the coarse roots of 45 desert plant species in relation to environmental factors across the deserts in Xinjiang[J]. Chinese Journal of Ecology, 2019, 38(9): 2603-2614 (in Chinese).
[13] 傅立国. 中国高等植物 [M]. 青岛: 青岛出版社, 2003. FU L G. Higher plants of China[M]. Qingdao, China: Qingdao Publishing House, 2003(in Chinese).
[14] 张兴旺, 张小平, 郭传友, 等. 皖北石灰岩山地青檀种群不同发育阶段的点格局分析[J]. 生态学杂志, 2013, 32(3): 542-550. ZHANG X W, ZHANG X P, GUO C Y, et al. Point pattern analysis of Pteroceltis tatarinowii population at its different development stages in limestone mountain area of North Anhui, East China[J]. Chinese Journal of Ecology, 2013, 32(3): 542-550 (in Chinese).
[15] 方升佐, 崔同林, 虞木奎. 成土母岩和条龄对青檀檀皮质量的影响[J]. 北京林业大学学报, 2007, 29(2): 122-127. FANG S Z, CUI T L, YU M K. Effects of soil-forming rocks and sprout ages on the bark quality of Pteroceltis tatarinowii[J]. Journal of Beijing Forestry University, 2007, 29(2): 122-127 (in Chinese).
[16] 方升佐, 李光友, 洑香香. 立地条件对青檀檀皮中矿质元素含量的影响[J]. 林业科学, 2002, 38(1): 8-14. FANG S Z, LI G Y, FU X X. Effects of site conditions on mineral element contents in the bark of wingceltis (Pteroceltis tatarinowii)[J]. Scientia Silvae Sinicae, 2002, 38(1): 8-14 (in Chinese).
[17] 王友保. 土壤污染生态修复实验技术[M]. 北京: 科学出版社, 2018. WANG Y B. Experimental technology of ecological restoration of soil pollution[M]. Beijing: Science Press, 2018(in Chinese).
[18] 全国土壤普查办公室. 中国土壤普查技术[M]. 北京: 农业出版社, 1992. State Soil Survey Office of Agricultural Ministry. Techniques for soil survey of China[M]. Beijing: Agriculture Press, 1992(in Chinese).
[19] 李从娟, 雷加强, 徐新文, 等. 塔克拉玛干沙漠腹地人工植被及土壤CNP的化学计量特征[J]. 生态学报, 2013, 33(18): 5760-5767. doi: 10.5846/stxb201304300872 LI C J, LEI J Q, XU X W, et al. The stoichiometric characteristics of C, N, P for artificial plants and soil in the hinterland of Taklimakan Desert[J]. Acta Ecologica Sinica, 2013, 33(18): 5760-5767 (in Chinese). doi: 10.5846/stxb201304300872
[20] 童冉, 陈庆标, 周本智. 基于生态因子与神经网络的杉木叶片碳氮磷含量预测[J]. 林业科学研究, 2021, 34(6): 56-64. TONG R, CHEN Q B, ZHOU B Z. Prediction of carbon, nitrogen, and phosphorus contents of Chinese fir based on ecological factors and artificial neural networks[J]. Forest Research, 2021, 34(6): 56-64 (in Chinese).
[21] ZHAO H, XU L, WANG Q F, et al. Spatial patterns and environmental factors influencing leaf carbon content in the forests and shrublands of China[J]. Journal of Geographical Sciences, 2018, 28(6): 791-801. [22] 任书杰, 于贵瑞, 陶波, 等. 中国东部南北样带654种植物叶片氮和磷的化学计量学特征研究[J]. 环境科学, 2007, 28(12): 2665-2673. REN S J, YU G R, TAO B, et al. Leaf nitrogen and phosphorus stoichiometry across 654 terrestrial plant species in NSTEC[J]. Environmental Science, 2007, 28(12): 2665-2673 (in Chinese).
[23] 王晶苑, 王绍强, 李纫兰, 等. 中国四种森林类型主要优势植物的C: N: P化学计量学特征[J]. 植物生态学报, 2011, 35(6): 587-595. WANG J Y, WANG S Q, LI R L, et al. C: N: P stoichiometric characteristics of four forest types’ dominant tree species in China[J]. Chinese Journal of Plant Ecology, 2011, 35(6): 587-595 (in Chinese).
[24] 喻阳华, 李一彤, 王俊贤, 等. 贵州白云岩地区植物群落叶片-凋落物-土壤化学计量与碳氮同位素特征[J]. 生态学报, 2022, 42(8): 3356-3365. YU Y H, LI Y T, WANG J X, et al. Leaf-litter-soil stoichiometry and carbon and nitrogen isotopes of plant communities in dolomite district in Guizhou Province[J]. Acta Ecologica Sinica, 2022, 42(8): 3356-3365 (in Chinese).
[25] 金宝石, 闫鸿远, 王维奇, 等. 互花米草入侵下湿地土壤碳氮磷变化及化学计量学特征[J]. 应用生态学报, 2017, 28(5): 1541-1549. JIN B S, YAN H Y, WANG W Q, et al. Changes of soil carbon, nitrogen and phosphorus and stoichiometry characteristics in marsh invaded by Spartina alterniflora[J]. Chinese Journal of Applied Ecology, 2017, 28(5): 1541-1549 (in Chinese).
[26] 朱秋莲, 邢肖毅, 张宏, 等. 黄土丘陵沟壑区不同植被区土壤生态化学计量特征[J]. 生态学报, 2013, 33(15): 4674-4682. doi: 10.5846/stxb201212101772 ZHU Q L, XING X Y, ZHANG H, et al. Soil ecological stoichiometry under different vegetation area on loess hillygully region[J]. Acta Ecologica Sinica, 2013, 33(15): 4674-4682 (in Chinese). doi: 10.5846/stxb201212101772
[27] 王涛, 蒙仲举, 党晓宏, 等. 库布齐沙漠典型防护林土壤养分特征[J]. 水土保持学报, 2022, 36(1): 325-331. WANG T, MENG Z J, DANG X H, et al. Soil nutrient characteristic of typical shelterbelt in Hobq desert[J]. Journal of Soil and Water Conservation, 2022, 36(1): 325-331 (in Chinese).
[28] 王亚东, 魏江生, 周梅, 等. 大兴安岭南段杨桦次生林土壤化学计量特征[J]. 土壤通报, 2020, 51(5): 1056-1064. WANG Y D, WEI J S, ZHOU M, et al. Soil stoichiometric characteristics in the poplar and birch secondary forests in the southern greater Xing’an Mountains[J]. Chinese Journal of Soil Science, 2020, 51(5): 1056-1064 (in Chinese).
[29] 程滨, 赵永军, 张文广, 等. 生态化学计量学研究进展[J]. 生态学报, 2010, 30(6): 1628-1637. CHENG B, ZHAO Y J, ZHANG W G, et al. The research advances and prospect of ecological stoichiometry[J]. Acta Ecologica Sinica, 2010, 30(6): 1628-1637 (in Chinese).
[30] TIAN H Q, CHEN G S, ZHANG C, et al. Pattern and variation of C: N: P ratios in China’s soils: A synthesis of observational data[J]. Biogeochemistry, 2010, 98(1): 139-151. [31] 冯德枫, 包维楷. 土壤碳氮磷化学计量比时空格局及影响因素研究进展[J]. 应用与环境生物学报, 2017, 23(2): 400-408. FENG D F, BAO W K. Review of the temporal and spatial patterns of soil C: N: P stoichiometry and its driving factors[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(2): 400-408 (in Chinese).
[32] 寻亚非, 李映雪, 王佳俊, 等. 拉鲁湿地植物和底泥氮磷生态化学计量学特征[J]. 环境化学, 2021, 40(7): 2105-2114. doi: 10.7524/j.issn.0254-6108.2020082901 XUN Y F, LI Y X, WANG J J, et al. Ecological stoichiometry characteristics of nitrogen and phosphorus in plants and sediments in Lhalu wetland[J]. Environmental Chemistry, 2021, 40(7): 2105-2114 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020082901
[33] 王宁, 张有利, 王百田, 等. 山西省油松林生态系统碳氮磷化学计量特征[J]. 水土保持研究, 2015, 22(1): 72-79. WANG N, ZHANG Y L, WANG B T, et al. Stoichiometry of carbon, nitrogen and phosphorus in Pinus tabulaeformis Carr. Forest ecosystems in Shanxi Province, China[J]. Research of Soil and Water Conservation, 2015, 22(1): 72-79 (in Chinese).
[34] TESSIER J T, RAYNAL D. Use of nitrogen to phosphorus ratios in plant tissue as an indicator of nutrient limitation and nitrogen saturation[J]. Journal of Applied Ecology, 2003, 40: 523-534. doi: 10.1046/j.1365-2664.2003.00820.x [35] HOGAN E J, MINNULLINA G, SMITH R I, et al. Effects of nitrogen enrichment on phosphatase activity and nitrogen: Phosphorus relationships in Cladonia portentosa[J]. The New Phytologist, 2010, 186(4): 911-925. doi: 10.1111/j.1469-8137.2010.03222.x [36] 魏晨, 张小平, 罗子渝, 等. 兰州市南山和北山3种乔木叶片生态化学计量特征的对比研究[J]. 生态学报, 2021, 41(6): 2460-2470. WEI C, ZHANG X P, LUO Z Y, et al. A comparative study on foliar stoichiometry traits of three trees in north and south mountains of Lanzhou City[J]. Acta Ecologica Sinica, 2021, 41(6): 2460-2470 (in Chinese).
[37] POORTER L, BONGERS F. Leaf traits are good predictors of plant performance across 53 rain forest species[J]. Ecology, 2006, 87(7): 1733-1743. doi: 10.1890/0012-9658(2006)87[1733:LTAGPO]2.0.CO;2 [38] SHIPLEY B, LECHOWICZ M J, WRIGHT I, et al. Fundamental trade-offs generating the worldwide leaf economics spectrum[J]. Ecology, 2006, 87(3): 535-541. doi: 10.1890/05-1051 [39] 张蕾蕾, 钟全林, 程栋梁, 等. 刨花楠不同相对生长速率下林木叶片碳氮磷的适应特征[J]. 生态学报, 2016, 36(9): 2607-2613. ZHANG L L, ZHONG Q L, CHENG D L, et al. Biomass relative growth rate of Machilus pauhoi in relation to leaf carbon, nitrogen, and phosphorus stoichiometry properties[J]. Acta Ecologica Sinica, 2016, 36(9): 2607-2613 (in Chinese).
[40] KOERSELMAN W, MEULEMAN A F M. The vegetation N: P ratio: A new tool to detect the nature of nutrient limitation[J]. The Journal of Applied Ecology, 1996, 33(6): 1441. doi: 10.2307/2404783 [41] 刘若璇, 崔东, 赵阳, 等. 伊犁河谷不同生境下大麻根茎叶生态化学计量特征[J]. 环境化学, 2022, 41(5): 1639-1648. doi: 10.7524/j.issn.0254-6108.2020122803 LIU R X, CUI D, ZHAO Y, et al. Ecological stoichiometric characteristics of root, stem and leaf of Cannabis sativa in different habitats of Yili River Valley[J]. Environmental Chemistry, 2022, 41(5): 1639-1648 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020122803
[42] 马丽丽, 朱婷, 兰龙焱, 等. 不同品种油茶果实成熟期叶片养分及磷组分的差异[J]. 中南林业科技大学学报, 2021, 41(11): 82-89. MA L L, ZHU T, LAN L Y, et al. Differences of nutrients and foliar phosphorus fraction in different Camellia oleifera varieties at fruit maturation period[J]. Journal of Central South University of Forestry & Technology, 2021, 41(11): 82-89 (in Chinese).
[43] 李家湘, 徐文婷, 熊高明, 等. 中国南方灌丛优势木本植物叶的氮、磷含量及其影响因素[J]. 植物生态学报, 2017, 41(1): 31-42. LI J X, XU W T, XIONG G M, et al. Leaf nitrogen and phosphorus concentration and the empirical regulations in dominant woody plants of shrublands across Southern China[J]. Chinese Journal of Plant Ecology, 2017, 41(1): 31-42 (in Chinese).
[44] HEDIN L O. Global organization of terrestrial plant-nutrient interactions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 10849-10850. [45] 宋语涵, 张鹏, 金光泽. 阔叶红松林不同演替阶段灌木叶片碳氮磷化学计量特征及其影响因素[J]. 植物生态学报, 2021, 45(9): 952-960. doi: 10.17521/cjpe.2021.0101 SONG Y H, ZHANG P, JIN G Z. Characteristics of shrub leaf carbon, nitrogen and phosphorus stoichiometry and influencing factors in mixed broadleaved-Korean pine forests at different successional stages[J]. Chinese Journal of Plant Ecology, 2021, 45(9): 952-960 (in Chinese). doi: 10.17521/cjpe.2021.0101
[46] SISTLA S A, APPLING A P, LEWANDOWSKA A M, et al. Stoichiometric flexibility in response to fertilization along gradients of environmental and organismal nutrient richness[J]. Oikos, 2015, 124(7): 949-959. doi: 10.1111/oik.02385 -







 下载:
下载: