-
当前,在我国的重金属污染治理行业中,铅蓄电池行业是重点关注行业之一,也是重金属铅离子(Pb2+)的主要污染来源[1],因其隐蔽性、危害性等特点,在土壤中不断富集,最终对人体产生高毒性和致癌性[2],因此,对于铅污染处理极为紧迫. 吸附、反渗透、化学沉淀、离子交换等是处理重金属污染的典型方法[3],与其他方法相比,吸附法因其技术成熟、成本低、沉淀物生成少等优点在重金属污染治理中被广泛应用[4].
在土壤固相物质中,微生物可将土壤有机质(soil organic matter,SOM)同化为自身组分并在其死亡后以微生物残体的形式逐渐积累在土壤中[5],并与土壤矿物相互作用形成各种矿物-有机复合体、配合物或聚集体[6 − 7],成为稳定土壤有机碳库的重要组成部分,其对土壤重金属的治理起到了关键性的作用. 其中,蒙脱石和赤铁矿常作为典型的土壤矿物对重金属吸附进行研究[8],蒙脱石因其较大的比表面积和较高的阳离子交换能力常被作为吸附剂[9],赤铁矿因其含有铁氧化物且边缘表面带正电[10],使得带负电荷的有机质与其相结合,二者皆可与SOM结合形成有机无机复合体[11]. 目前,土壤对Pb2+的吸附主要受到土壤有机质、黏土、铁和锰氧化物等土壤组分的影响[12],且研究了不同物理化学性质的土壤对Pb2+的吸附,如不同质地、不同有机质浓度和不同阳离子交换容量等[13]. 其中,前人就土壤微生物源有机质对Pb2+的吸附主要研究其整体的有机无机复合体[14],而真菌残体较细菌残体更稳定,且在微生物残体碳中占比更高[15],故本文将微生物分为两类菌群(细菌菌群、真菌菌群),取两种典型的矿物(黏土矿物-蒙脱石、铁氧化物-赤铁矿),研究经培养后的微生物残体及有机无机复合体对Pb2+的吸附作用.
本研究旨在探讨微生物残体(细菌、真菌)及其与黏土矿物(蒙脱石、赤铁矿)形成的有机无机复合体的结合机制,进一步解释矿物与微生物相结合后的有机无机复合体对Pb2+的吸附能力,进而表明微生物残体及其与矿物结合形成有机无机复合体对土壤重金属的吸附不可忽视.
-
本实验土壤采样于云南省昆明市呈贡区平均海拔为2006 m的竹林红壤土. 以该土壤微生物作为源微生物,按照细菌、真菌生长所需配置细菌培养基和真菌培养基[16],进行细菌菌群和真菌菌群的选取、接种及收集.
选取菌群:取200 g土壤样品置于200 mL 水中均匀振荡10 min,之后静置30 min,取上清液约50 mL到离心管中,再次均匀振荡并静置. 取10 mL上清液分别加到已灭菌的细菌培养基和真菌培养基中,放入摇床,设定条件150 r·min−1,温度25 ℃. 通过分光光度法确定细菌和真菌的对数期,并取对数期的细菌菌群和真菌菌群为纯化菌群.
接种菌群:将细菌、真菌培养基分装至250 mL锥形瓶中,分别设两个实验组,一组不添加矿物,另一组向对应锥形瓶分别加入1.0 g蒙脱石和1.0 g赤铁矿. 所有培养基经高压蒸汽灭菌后(121 ℃,30 min),放入紫外操作台中进行接种操作. 取10 mL的纯化菌体对应接种到细菌、真菌培养基及含有矿物的培养基中,放入摇床,设定条件150 r·min−1,温度25 ℃. 在摇床中培养24 h后取出,此时培养基中出现浑浊,随后放入高压蒸汽灭菌锅中进行灭菌,设定温度为120 ℃,时间为30 min.
微生物残体及复合体的收集:将高温灭菌后的微生物残体及复合体置于离心管中,用超纯水多次润洗并离心(
3000 r·min−1,10 min),以去除微生物残体中的溶解性有机碳. 将残体碳及复合体经冷干机干燥,研磨至过200目筛,在-80 ℃下保存备用. 将微生物残体及其复合体分别命名为细菌残体(BN)、细菌-蒙脱石(B-M)、细菌-赤铁矿(B-Fe)、真菌残体(FN)、真菌-蒙脱石(F-M)、真菌-赤铁矿(F-Fe). -
配制0.1 mol·L−1的NaNO3作为背景液,调至pH5备用. 称取Pb(NO3)2用背景液在500 mL烧杯中稀释,稀释后作为母液. Pb2+浓度梯度设置在1—10 mg·L−1,移取母液并用背景液进行稀释. 加入NaN3用以抑制微生物的活动,其浓度为200 mg·L−1. 通过预实验确定BN、FN、B-M、F-M、F-Fe、M的固液比为1:7500,B-Fe、Fe的固液比为1:1000,确保每个吸附剂对Pb2+的吸附率基本在20%—80%之间, 每个浓度设置3个平行. 样品置于25 ℃、120 r·min−1的摇床中避光振荡3 d. 吸附平衡后,样品在
3000 r·min−1下离心10 min,上清液经0.45 μm水相滤膜去除胶体和杂质,收集滤液待测. 根据质量损失加入等体积的背景液进行解吸实验,解吸实验进行3次,解吸平衡后,在3000 r·min−1下离心10 min后经0.45 μm水相滤膜过滤,上清液中Pb2+浓度用火焰原子吸收分光光度计测定. -
样品冷冻干燥后,研磨过200目筛,称取(2±0.1)mg的样品于锡舟中,每个样品设置3次重复,使用元素分析仪(Vario EL II Elemental)进行测定.
-
样品和溴化钾按照1:100比例混合均匀,在玛瑙研钵中充分磨细压片,然后在光谱仪上进行扫描(Varian 640-IR FTIR),扫描次数20,分辨率为8 cm−1,操作范围为400—
4000 cm−1,使用Origin 2018作图. -
有机无机复合体的比表面积、孔径大小是表征吸附剂对污染物吸附物的重要参数指标. 本研究在N2的模式下,采用了BET分析仪(Micromeritics ASAP2020)测定.
-
本研究使用Origin2018软件进行拟合,比较Freundlich模型和Langmuir模型两种吸附等温线的拟合相关系数R2来衡量拟合结果.
Freundlich模型:
式中,Qe为吸附剂的平衡吸附量(mg·g−1);Ce为液相平衡浓度(mg·L−1);KF为Freundlich模型的吸附平衡系数;n为Freundlich模型的非线性系数.
Langmuir模型:
式中,Qe为吸附剂的平衡吸附量(mg·g−1);Qm为最大吸附量(mg·g−1);Ce为液相平衡浓度(mg·L−1);KL为Langmuir模型的吸附平衡系数.
Pb2+在解吸过程中存在解吸滞后现象,该现象通过解吸率的大小(RR)来衡量:
式中,Q0为解吸结束后吸附剂上Pb2+质量(mg·g−1).
-
如表1所示,不同微生物残体及其复合体中的元素组成有所差异,相较于微生物-矿物复合体而言,BN和FN具有较高的含碳量(C%均超过40%),氮(N)、硫(S)含量相差不大,且二者的极性((N+O)/C)和芳香性(H/C)相近. 蒙脱石-微生物复合体的C%均低于对应的赤铁矿-微生物复合体,蒙脱石相比于赤铁矿具有较大的比表面积(蒙脱石的比表面积是赤铁矿的20倍,见表2),但并没有增加微生物残体碳的积累. 有研究指出微生物细胞壁的主要活性基团(羧基和磷酸基)可在细胞表面形成共价键,促进微生物分泌物附着到铁氧化物[17]. 因此,该培养下赤铁矿更有利于微生物残体碳的积累.
此外,各个复合体间的H/C比值各不相同,其表现为B-Fe<FN<F-Fe<BN<F-M<B-M. 一般地,H/C比值越低,芳香性越强,故赤铁矿-微生物复合体的芳香性高于蒙脱石-微生物复合体. 一方面,有研究表明赤铁矿表面富含铁原子配位—OH位点,且高芳香性的有机分子会优先与—OH基团形成配合物[18];另一方面,赤铁矿可通过共沉淀作用与芳香性化合物形成复合体[19]. 这可能是赤铁矿-微生物复合体相比蒙脱石-微生物复合体具有更高的芳香性的重要因素. 综上所述,通过吸附微生物分泌物可能改变矿物的表面性质变化,进一步影响复合体对Pb2+的吸附能力.
如表2所示,BN和FN的孔隙结构相差不大. M的比表面积是Fe的18倍,这是由于M具有较大的内比表面积[20]. 赤铁矿-微生物复合体的比表面积较赤铁矿变化不明显,而蒙脱石-微生物复合体的比表面积较蒙脱石显著降低,但其比表面积是赤铁矿-微生物复合体的四倍以上,蒙脱石-微生物复合体基于自身比表面积对Pb2+可能具有更高的吸附量. 此外,微生物-矿物复合体的平均孔径相较纯矿物均增加,这可能是由于微生物分泌物黏附在矿物表面上,促进了矿物的腐蚀[21],从而增加了其平均孔径.
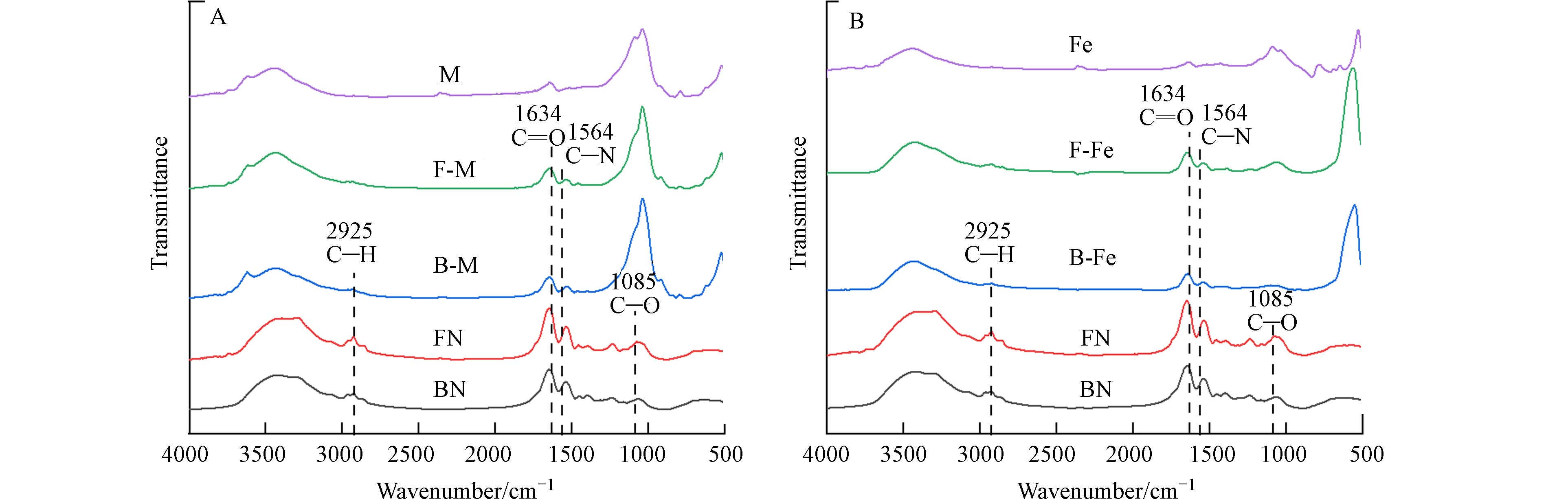
由图1可知,细菌残体和真菌残体在红外光谱图中的特征峰位置类似,说明二者所含官能团种类及相对峰面积基本相同,其中,在
2925 cm−1是脂肪族中—CH2和—CH3的特征峰[22],仅在纯残体组中出现,表明微生物残体相较复合体含有较多的脂肪族化合物. 在1085 cm−1处的吸收峰为C—O—C的伸缩振动,FN在该处的相对峰面积高于BN,表明FN具有更多的多糖类物质. 在1634 cm−1、1564 cm−1处分别表示C=O、C—N的特征峰,各个微生物-矿物复合体在这两处的相对峰面积均高于纯矿物,表明微生物-矿物复合体上结合了含氧、含氮化合物,这可促进复合体与重金属相络合[23],这也可能是复合体对Pb2+表现出较好的络合能力的主要原因. -
采用Langmuir模型和Freundlich模型对批量吸附实验进行了拟合,如表3所示. 通过比较拟合相关系数R2,Langmuir模型拟合下的R2远低于Freundlich模型拟合,因此,Freundlich模型更适合描述所有吸附剂对Pb2+的吸附作用(R2的范围为0.828—0.957,Fe除外). 在Freundlich模型中,所有吸附剂的n值在0.204—0.626,远低于1,表明微生物残体表面吸附位点分布不均,呈现出较强的吸附异质性.
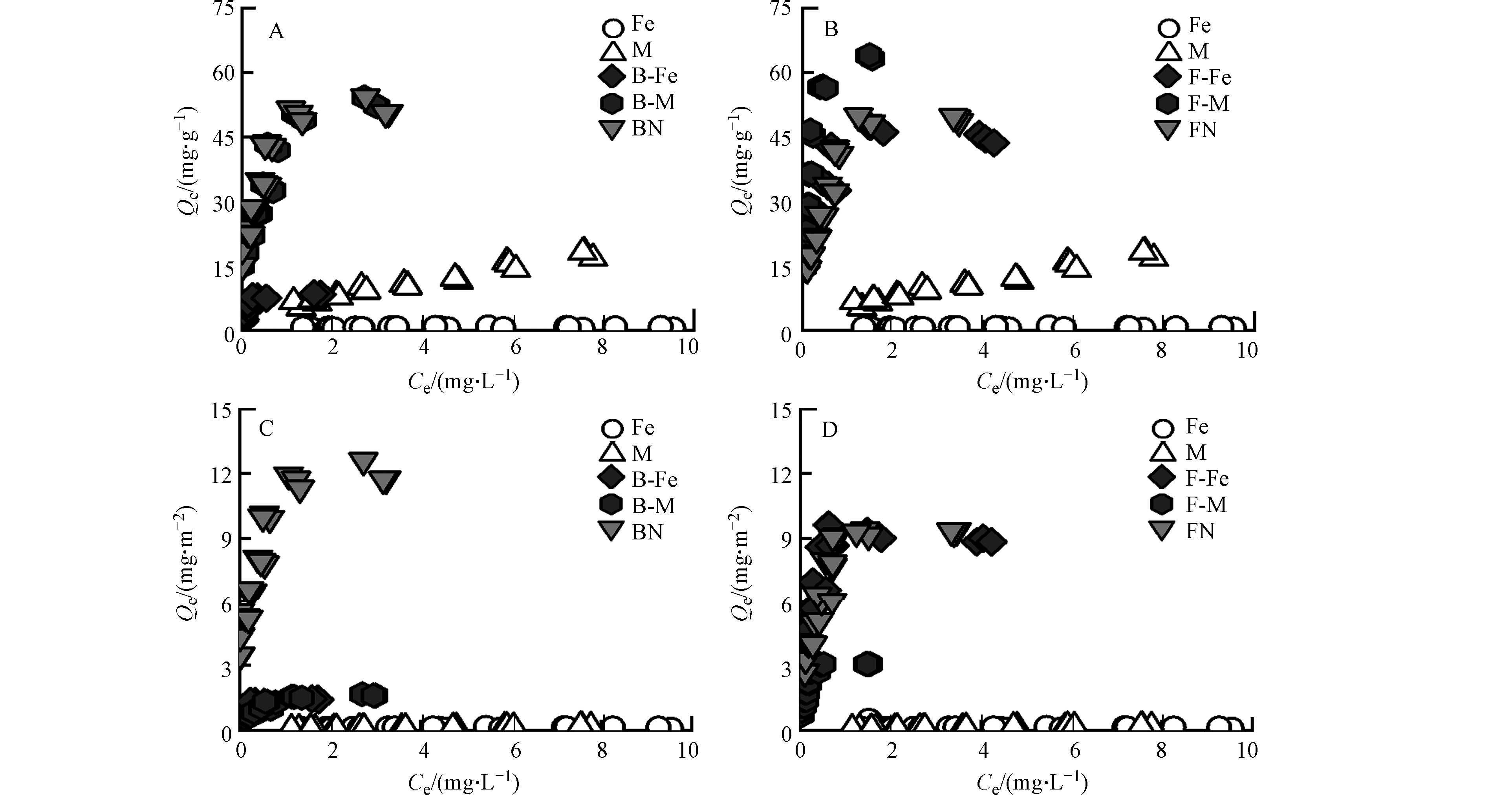
纯矿物、微生物残体及其复合体对Pb2+的吸附等温线如图2所示,各个复合体对Pb2+的吸附容量随着Pb2+的初始浓度增加而增加,随后达到饱和吸附量. 其中,纯矿物对Pb2+的吸附量远低于微生物残体. 由图1可知,微生物残体含有较多的含氧官能团(C—O、C=O),这些官能团可为其表面提供负电荷场所,进一步通过络合作用[24]、静电吸附[25]对Pb2+进行吸附;且细菌残体对Pb2+的吸附量与真菌残体相差不大,因为二者具有相近的元素组成、表面官能团及孔隙结构,因此,细菌残体和真菌残体对Pb2+的吸附量基本一致.
由图2A、图2B可知,矿物-微生物复合体相比于纯矿物而言,对Pb2+均表现出较好的吸附性能. 其中,蒙脱石-微生物复合体对Pb2+的吸附量比赤铁矿-微生物复合体更大. 由图1可知,蒙脱石/赤铁矿-微生物复合体的表面均表现出含氧官能团和含氮官能团,这说明矿物经微生物附着生长后其表面负载了这些活性基团,进而为吸附Pb2+提供更多的吸附位点[26];由表2可知,蒙脱石-微生物复合体的比表面积是赤铁矿-微生物复合体的4倍以上,且蒙脱石-微生物复合体中的矿物基质(蒙脱石)本身具有较好的吸附性能[27]. 因此,蒙脱石-微生物复合体对Pb2+的吸附过程中,除了活性基团提供吸附位点外,还有矿物基质(蒙脱石)提供吸附位点,故蒙脱石-微生物复合体对Pb2+的吸附效果更好.
此外,真菌-矿物复合体对Pb2+的吸附量比细菌-矿物复合体更大,由表1可知,F-M比B-M具有更高的芳香性,可为复合体表面提供更多的酚羟基官能团. 研究表明Pb2+可与酚羟基和羧基官能团相络合[28];又有研究表明复合体中的芳香结构可通过阳离子-π作用与Pb2+相结合[29],故F-M对Pb2+吸附效果更佳. 虽然F-Fe比B-Fe的芳香性低,但研究表明真菌菌丝中会产生大量的活性氧自由基(O2-),这些自由基在赤铁矿存在下能够发生芬顿反应[30],进而产生氢氧根离子(OH-)[31],使F-Fe表面暴露出更多的吸附位点,并通过络合作用与Pb2+相结合[32],增强了其对Pb2+的吸附能力.
由图2C、图2D可知,经比表面积标准化后,蒙脱石-微生物复合体(B-M、F-M)对Pb2+的吸附量Qe值大大降低,这说明二者在单位面积内对Pb2+吸附量较小,蒙脱石复合体吸附Pb2+主要是依赖自身较大的比表面积而非其表面的有机官能团. 而赤铁矿复合体在比表面积标准化前后其Qe值基本不变,赤铁矿复合体对Pb2+的吸附不受比表面积的影响. 在赤铁矿-微生物复合体在形成过程中,其中的铁元素受到微生物分泌物的影响可发生氧化还原反应[33],可促进赤铁矿与微生物分泌物形成配合物[34],该过程主要分为两部分,一是有机质通过特定的化学相互作用(如化学吸附)吸附到赤铁矿表面形成内球配合物[35],并使其表面负载阴离子基团[36];二是可通过非特异性相互作用(如物理吸附、氢键作用和静电吸附)形成外球配合物[37]. 因此,在双层络合机制作用下,在赤铁矿上形成的有机无机复合体中有机官能团较蒙脱石对Pb2+的吸附更强.
-
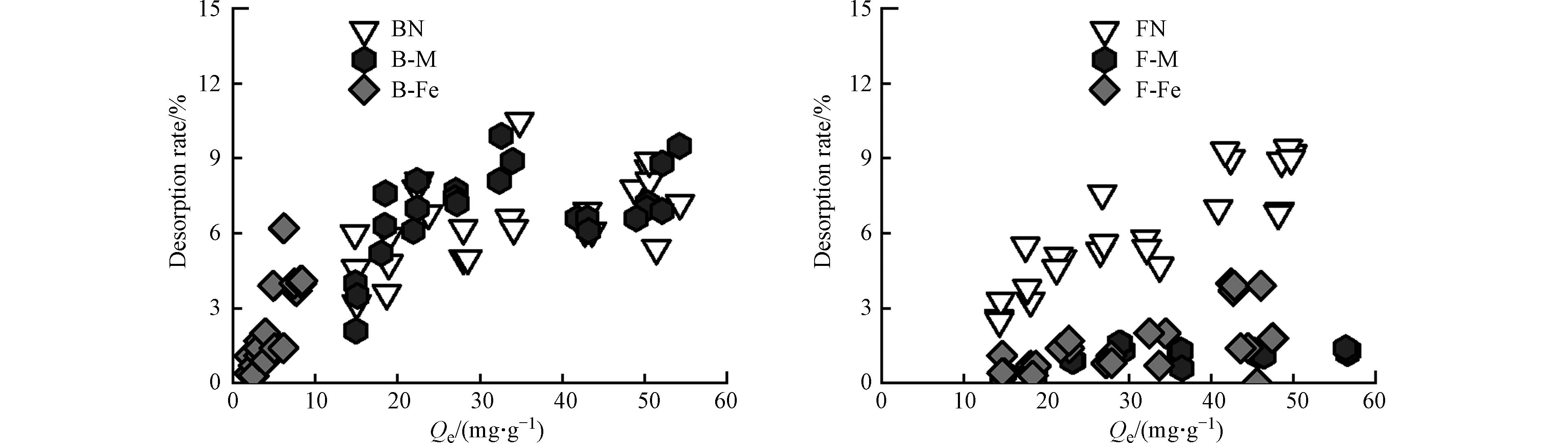
如图3所示,在微生物残体、微生物-矿物复合体对Pb2+的解吸过程中,所有吸附剂在第一次解吸时,Pb2+会有少部分被解吸,而在第二次、第三次解吸时,所有吸附剂基本不解吸,微生物残体及其复合体与Pb2+之间的吸附可能通过物理作用(如静电吸附)和化学作用(如络合作用和阳离子-π作用),且结合后的化学键较难破坏[38],所以吸附在各个吸附剂上的Pb2+难解吸.
如图4所示,微生物残体及其复合体对Pb2+的解吸率(RR)基本在10%以下,表现为BN为8.9%,FN为9.0%,B-M为8.8%,F-M为1.7%,B-Fe为4.1%,F-Fe为1.4%. 各个复合体的解吸率均低于微生物残体,微生物残体(BN、FN)的解吸率RR接近9%,由图2可知,微生物残体对Pb2+的吸附量较大,研究表明微生物残体表面带负电荷[39],故其对Pb2+的吸附机理更多地是静电吸附和络合作用. 其中,静电吸附作用相较其他化学作用并不稳定,因此,微生物残体对Pb2+的吸附量较多,但解吸量也较多. 蒙脱石-微生物复合体较赤铁矿-微生物复合体对Pb2+的吸附量更大,但其解吸率也更大,故基于复合体中的矿物基质(蒙脱石)对Pb2+的吸附量虽多,但并不牢固. 而赤铁矿-微生物复合体的解吸率较蒙脱石-微生物复合体的小,这是由于其表面存在“双层络合”吸附机制[40]. 当Pb2+浓度较高时,可直接与赤铁矿-微生物复合体表面结合,通过配体作用形成较弱的键合[41];在低Pb2+的浓度下,在其表面以羟基为主的内球层发生络合作用[42],故赤铁矿-微生物复合体对Pb2+的吸附更牢固. 综上所述,矿物的存在可以增加有机质对Pb2+的固定作用,蒙脱石-微生物复合体在矿物基质(蒙脱石)的作用下,对Pb2+的吸附量更多;而赤铁矿-微生物复合体在有机官能团的作用下,对Pb2+吸附更牢固.
-
(1)细菌残体和真菌残体的元素含量和性质较为相近,但各个复合体间的组成和性质差异较大. 其中,真菌-矿物复合体相比细菌-矿物复合体具有更高的碳含量且具有更低的极性,赤铁矿-微生物复合体比蒙脱石-微生物复合体具有较高的芳香性.
(2)蒙脱石-微生物复合体对Pb2+的吸附主要受比表面积控制,而赤铁矿-微生物复合体的吸附主要受其表面有机官能团的影响. 经比表面积标准化可知,相较于蒙脱石组,赤铁矿-微生物复合体在单位面积具有更强的吸附能力.
(3)各个复合体相较微生物残体的解吸率(RR)更低,微生物残体通过静电作用对Pb2+的吸附并不牢固. 赤铁矿-微生物复合体较蒙脱石-微生物复合体的解吸率更低,这说明赤铁矿-微生物复合体因较强的络合作用对Pb2+的吸附较为牢固. 同时,真菌-矿物复合体通过更强的阳离子-π作用或络合作用较细菌组对Pb2+的吸附更高且更稳定.
微生物残体及其与矿物形成的复合体对Pb2+的吸附解吸
Adsorption and desorption of Pb2+ by microbial necromass and microbial- mineral complexes
-
摘要: 土壤有机质是控制土壤重金属吸附行为的重要组分之一,最近微生物源有机质被认为是土壤稳态碳的重要组分,然而,微生物源有机质及其与土壤矿物形成的复合体对重金属的吸附解吸行为关注较少. 以微生物(细菌、真菌)为有机质,黏土矿物(蒙脱石、赤铁矿)为矿物基质,制备细菌残体(BN)、真菌残体(FN)、细菌-蒙脱石复合体(B-M)、真菌-蒙脱石复合体(F-M)、细菌-赤铁矿复合体(B-Fe)、真菌-赤铁矿复合体(F-Fe),研究微生物残体及复合体对铅离子(Pb2+)的吸附解吸过程. 结果表明,真菌残体和细菌残体具有相近的元素组成和有机官能团,其对Pb2+的吸附解吸相一致;但相比于微生物-矿物复合体而言,纯残体对Pb2+的吸附量较大,解吸率也较大,吸附并不稳定. 各个复合体中,尽管赤铁矿-微生物复合体对Pb2+的吸附量较蒙脱石-微生物复合体更小,但经比表面积标准化后,蒙脱石-微生物复合体的吸附明显降低,而赤铁矿-微生物复合体的吸附量前后变化不明显且高于蒙脱石组,表明赤铁矿-微生物复合体在单位面积的吸附能力高于蒙脱石-微生物复合体. 真菌-矿物复合体较细菌-矿物复合体具有更高的吸附,经比表面积标准化后,真菌-矿物复合体仍具有更高的吸附. 同时,各个复合体对Pb2+的解吸率表现为B-M>B-Fe>F-M>F-Fe,表明赤铁矿-微生物复合体通过络合作用对Pb2+的吸附更稳定,真菌-矿物复合体通过更强的阳离子-π作用和络合作用对Pb2+的吸附更稳定. 因此,微生物与矿物形成的复合体对Pb2+的吸附能力在土壤重金属修复治理中需要被关注,这为控制土壤重金属的迁移和生物有效性提供了新的思路.Abstract: Soil organic matter (SOM) is one of the important components controlling the adsorption behavior of heavy metals in soil. However, as an important component of stabilized SOM, little attention has been paid to the adsorption/desorption behavior of heavy metals by microbial-derived organic matter and its complexes formed with soil minerals. In this study, the adsorption/desorption of Pb ions (Pb2+) by microbial (bacteria and fungi) and the complexes with clay mineral (montmorillonite and hematite) were studied, specifically, bacterial necromass (BN), fungal necromass (FN), bacteria-montmorillonite complex (B-M), fungus-montmorillonite complex (F-M), bacteria-hematite complex (B-Fe), and fungus-hematite complex (F-Fe). The results showed that the fungal nacromass and bacterial necromass had similar elemental composition and organic functional groups, and their adsorption and desorption for Pb2+ were consistent. However, compared with the microbial-mineral complex, the microbial necromass has a larger adsorption capacity for Pb2+, the desorption rate is also larger, and the adsorption is not stable. In each complex, although the adsorption amount of Pb2+ by hematite-microbial complex was smaller than that of montmorillonite-microbial complex, after the standardization of specific surface area, the adsorption of montmorillonite-microbial complex obviously decreased, while the adsorption of hematite-microbial complex did not change and was higher than that of montmorillonite group. The results showed that the adsorption capacity of hematite-microbial complex was higher than that of montmorillonite-microbial complex. The adsorption of fungus-mineral complex was higher than that of bacteria-mineral complex, and the adsorption of fungus-mineral complex was still higher after the standardization of specific surface area. Meanwhile, the desorption rate of Pb2+ for each complex was in order of B-M>B-Fe>F-M>F-Fe, indicating that the hematite-microbial complex was more stable for Pb2+ adsorption through complexation, and the fungus-mineral complex was more stable for Pb2+ adsorption through cation-π interaction and complexation compared to bacteria-mineral complex. Overall, our study demonstrated the adsorption capacity of different microbial-mineral complex to Pb2+, which will provide a new idea for controlling the migration and bioavailability of heavy metals in soil.
-
Key words:
- microbial necromss /
- clay minerals /
- adsorption and desorption /
- Pb2+.
-
自1929年发现青霉素来,抗生素作为一种能够有效对抗细菌感染的药物已被广泛应用于人类和牲畜疾病的预防与治疗. Klein等[1]的研究表明,在2000年至2015年间,全球抗生素的消费量增加了65%,并且预测在没有政策干预的情况下,2030年全球抗生素消费量可能比2015年高出200%. 由抗生素大量使用诱导产生的抗生素耐药问题是人类面临的重要公共卫生挑战之一. 据估计,每年死于抗生素耐药性问题的人数高达70万,如果不采取适当的预防措施,到2050年,每年的死亡人数将接近1000万,超过癌症的死亡人数[2]. 存在于抗生素耐药菌(antibiotic resistant bacteria, ARB)中的抗生素抗性基因(antibiotic resistance genes, ARGs),作为一种新污染物,与传统污染物不同,可以通过细菌的繁殖,进行垂直基因转移(vertical gene transfer, VGT),在环境中大量扩增,也可以通过水平基因转移(horizontal gene transfer, HGT)在不同细菌间扩散,进一步诱导抗生素耐药性的产生,因而引起了广泛的关注[3-4].
覆盖地球71%表面积的海洋对人类的生存和发展具有重要意义,反过来也受到了人类活动的广泛影响,它不仅是各类陆源污染物的汇,同样也是ARGs的重要天然储库. 海洋环境中的ARGs可以存在于细菌等微生物体内,也可以在微生物死亡后释放到海水和沉积物中并长期存在[5-6]. 这些ARGs可以在海洋生物之间传播,也可以在海洋生物与人类之间传播,显然海洋介质在ARGs的传播中发挥着重要作用,但这种作用在很大程度上无法量化[6-7]. 全球约40%的人口居住在海岸线100 km2以内的沿海地区,海洋环境中ARGs的存在会对这一区域的人类健康带来前所未有的挑战[8]. 但目前人们对于海洋环境中ARGs的来源、组成和影响因素,仍缺乏系统的认识. 本研究在总结国内外最新研究的基础上,重点讨论了海洋环境中ARGs的主要来源,对比分析了不同海域ARGs的优势类型、浓度水平,以及多个影响因子对海水和沉积物中ARGs的潜在影响,探讨了海洋环境中ARGs的传播扩散路径以及潜在影响等,为深入研究和治理海洋环境ARGs污染,降低ARGs的生态和健康风险提供参考.
1. 海洋环境中抗生素抗性基因的来源(Sources of antibiotic resistance genes in marine environment)
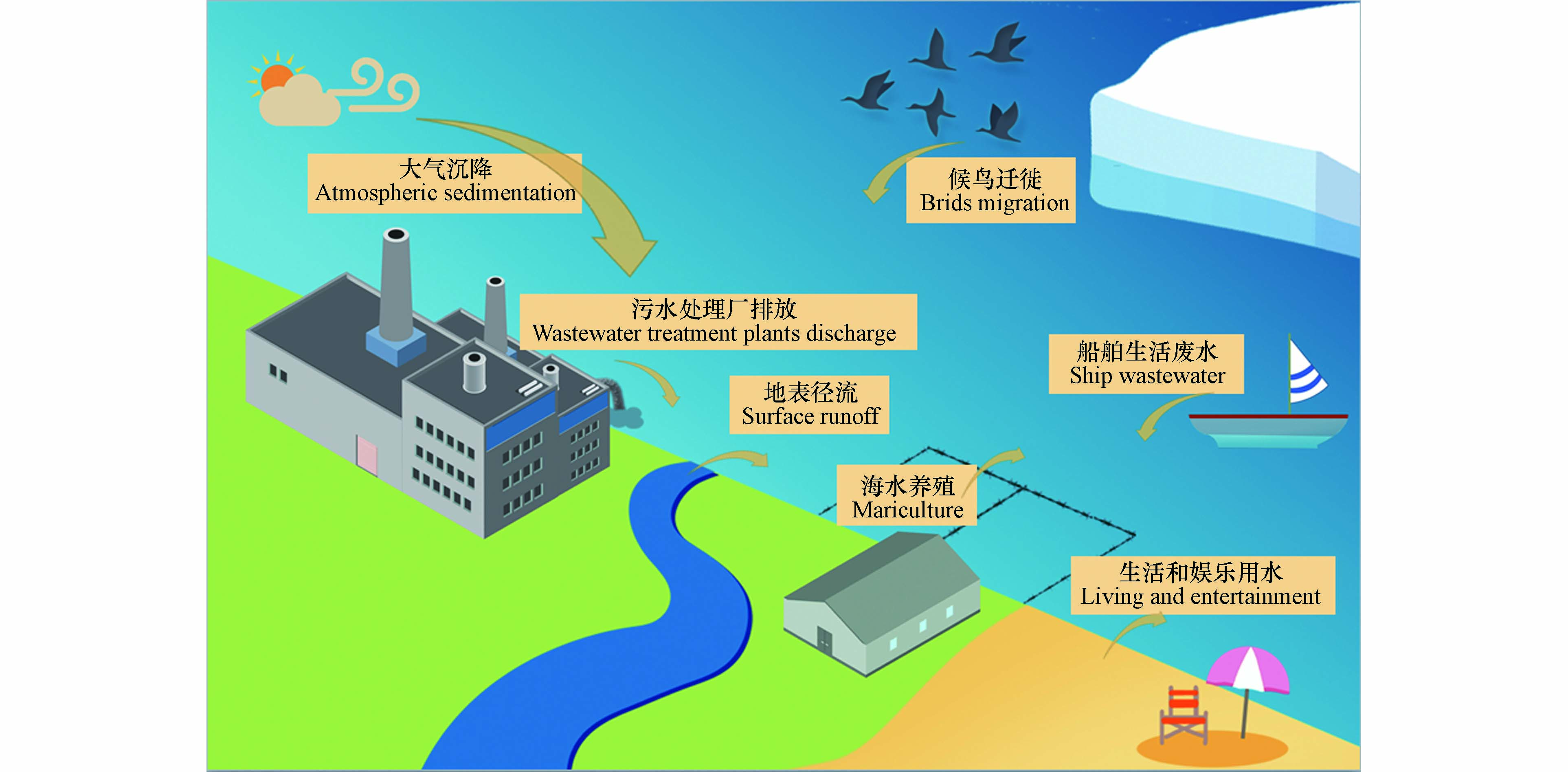
海洋环境中的污染物往往存在着复杂的来源,如污水处理厂排放、地表径流、船舶污染、人类近岸活动、大气远距离传输和候鸟迁徙等过程,这些过程给海洋环境带来了大量的污染物[9-12],其中就包括ARGs.
大多数污水处理厂的现有水处理方法不能有效地去除抗生素和ARGs,残留的抗生素和ARGs会通过污水处理厂的出水口排放到环境中,是河口和近海环境中ARGs的一大来源[13-15]. 在国内外许多海域,近海污水处理厂的废水排放是ARGs的重要来源之一. Huang等[16]的研究发现,市政污水处理厂的废水可能是福建九龙江口和闽江口的主要ARGs污染源. Makkaew等[17]的研究表明,污水直排输入会提高泰国邦盛和芭提雅海滩附近海水中ARGs的丰度. Fonti等[18]研究发现,在中亚得里亚海排放入海的废水中存在大量的ermB、qnrS、sul2和tetA等ARGs.
除此之外,地表径流也是海洋环境中ARGs的一个重要来源,人类和动物疾病治疗残留的大量抗生素和诱导产生的ARGs随着人为排放、雨水冲刷等途径直接入海或者进入河流,最终将排放到河口和近海环境中[13,19]. Dewi等[20]研究发现,澳大利亚悉尼海滩附近海水中的碳青霉素烯耐药菌很可能是通过雨水和其他淡水径流从陆源输入的. 河流排放是渤海[21]ARGs的重要来源之一,而胶州湾的ARGs则可能来自于河水和/或陆地废水排放[22].
包括近海海水养殖、居民生活、娱乐用水等的人类活动也会给海洋环境带来ARGs污染. 为了治疗和预防动物疾病,海水养殖过程中往往会投加大量的抗生素,这些抗生素将会导致海洋环境的ARGs污染[23-24]. 与自然海域相比,海水养殖场中ARGs丰度更高[25]. 在土耳其爱琴海居鲁克湾[26]进行的观测表明,水产养殖区具有更高的抗生素耐药风险. 韩国巨济附近海水中ARGs来源可能是沿海地区的港口和造船厂活动,而莞岛附近海水中ARGs的来源可能是水产养殖或农业活动[27].
候鸟尤其是海鸟在迁徙的过程中,也会携带ARGs并将其传播到更远的区域. 在美国东北部沿海水域,海鸟中分离出来的细菌的耐药性比在海洋哺乳动物中更普遍[28]. 斯瓦尔巴群岛朗伊尔城繁殖区的北极燕鸥泄殖腔内存在大量β-内酰胺类和喹诺酮类耐药菌[29]. 这些存在于海鸟体内的ARGs,将会随着海鸟的长距离迁移,传播到更远的区域.
除此之外,大气远距离传输和船舶生活污水排放等途径也将给海洋环境尤其是远洋环境带来ARGs污染,但目前仍缺乏相应的研究,人们对这些来源的贡献以及影响这些传播途径的因素知之甚少(图1).
2. 海洋环境中抗生素抗性基因的检测方法(Detection of antibiotic resistance genes in marine environment)
对于海洋环境中微生物抗生素耐药性的检测,主要包括传统的微生物培养-药敏试验的方法和采用分子生物学技术的聚合酶链式反应(polymerase chain reaction, PCR)、定量PCR(quantitative real-time PCR, qPCR)、高通量qPCR(high-throughput qPCR, HT-qPCR)以及宏基因组检测等方法. 前者仅能检测海洋环境中可培养的ARB,而后者分析的对象则包括了可培养和不可培养的微生物,并可以进一步检测海洋环境中的ARGs,使得到的结果更为全面.
在一些早期的研究中,大多采用细菌培养-药敏试验的方法对海洋环境中细菌的耐药性进行检测[30-32]. 这种方法较为简单,且成本较低,可以检测细菌的耐药率,鉴别多重耐药菌. 其中,药敏试验部分主要包括纸片扩散法(K-B琼脂法)和稀释法,前者主要通过测量含抗生素在琼脂平板培养基上形成的抑菌环的直径,测定细菌的耐药强度;后者则是通过配置药物浓度梯度稀释的培养基,测定抗生素的最小抑菌浓度(minimum inhibitory concentration, MIC),进而得到细菌耐药强度[33].
一些研究会对得到的细菌进行进一步的DNA提取,并进行PCR检测,以进一步鉴定其中的ARGs种类[34-36]. 也有一些研究直接对海水或沉积物进行DNA提取,进一步PCR检测[37-38]. PCR检测主要是对特定DNA片段进行指数扩增,再采用琼脂糖凝胶电泳对扩增产物进行检测,以鉴别原始样品中是否存在目标DNA片段,这种检测方法耗时短、准确性强,能够定性分析海水和沉积物中的ARGs,但不能对其定量. 因此,近年来的许多研究采用了qPCR方法,对ARGs进行定量检测[39-41]. qPCR检测是在PCR检测的基础上,通过分析荧光信号在特定DNA片段指数扩增过程中的累积,对目标DNA片段进行定量的检测方法,这种方法可以更直观的表征海洋环境中ARGs组成和丰度的变化. 随着检测技术的发展,也有一些新的研究采用微滴式数字PCR(droplet digital PCR, ddPCR)[42]和HT-qPCR[43-44]对海洋环境中ARGs的组成进行分析,这些方法的灵敏度和检测效率更高.
随着测序技术的逐步发展,越来越多的研究采用了宏基因组检测的方法对海洋环境中ARGs的组成进行分析[45-47]. 宏基因组又名微生物环境基因组或环境基因组,主要是从环境中直接提取全部的DNA,并构建宏基因组文库,进行测序,更全面地识别出环境中ARGs的组成;也可通过基因克隆,构建文库进行筛选分析,发现新的ARGs[48].
3. 海洋环境中抗生素抗性基因污染现状(Current status of antibiotic resistance gene pollution in marine environment)
3.1 海水中抗生素抗性基因污染现状
海洋环境中的污染物既会受到附近人为污染源的强烈影响,也会随着海洋环流不断扩散,对遥远的大洋和极地产生影响,并长期存在于海水和沉积物中(图2). 因此,不同区域海水中ARGs的组成和丰度往往存在较大的差异,但总的来说,多药耐药基因,β-内酰胺类抗性基因和磺胺类抗性基因是常被检出的类型(表1).
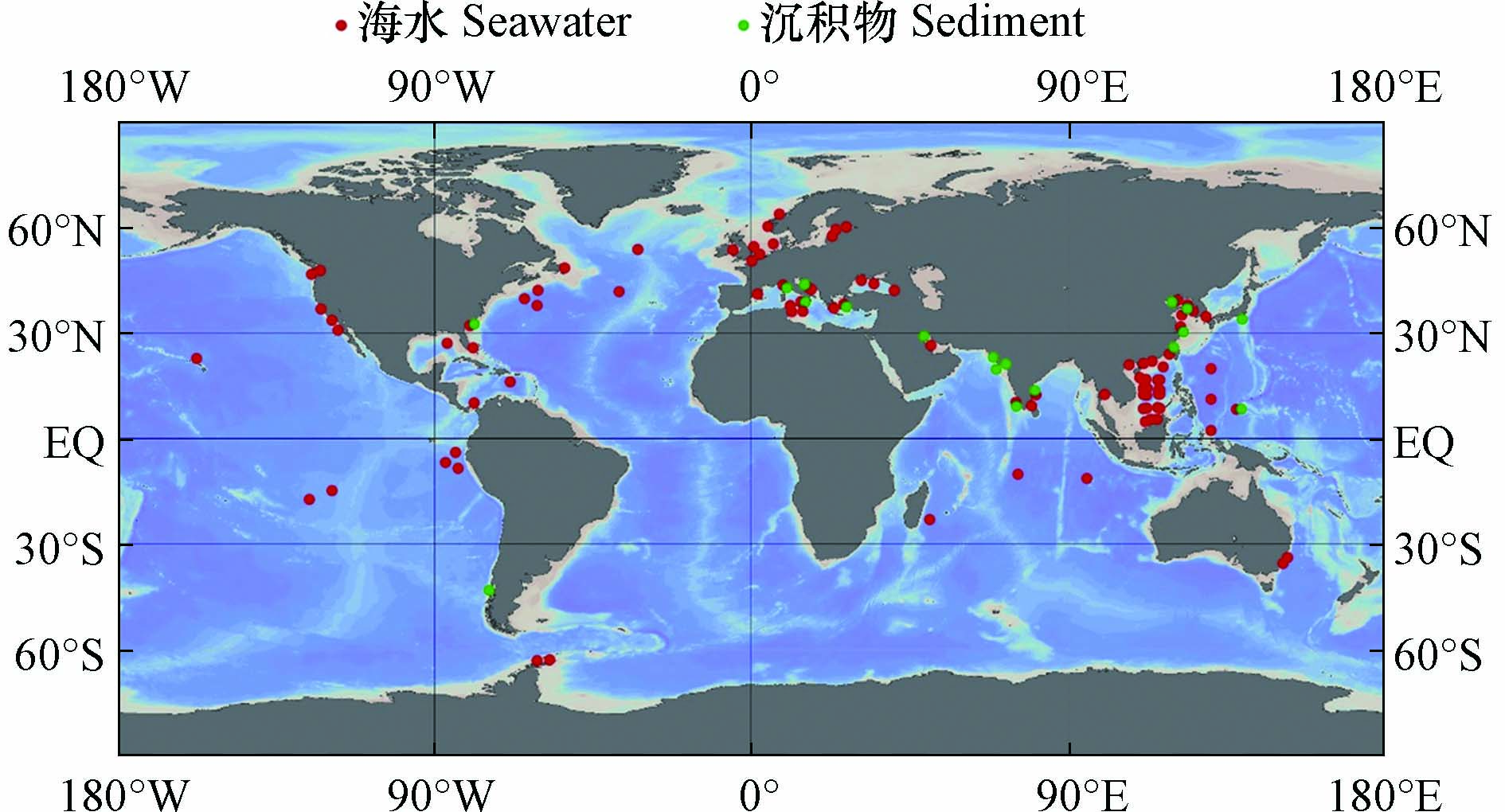 图 2 海水和沉积物中ARGs的相关研究(采用Ocean Data View[69]绘制)Figure 2. Researches of ARGs in seawater and sediments (Draw with Ocean Data View)
图 2 海水和沉积物中ARGs的相关研究(采用Ocean Data View[69]绘制)Figure 2. Researches of ARGs in seawater and sediments (Draw with Ocean Data View)河口和近海生态系统是陆源抗生素和ARGs入海的起点[39,49-50]. 对于印度洋附近海域,科钦河口肠外致病性大肠杆菌对β-内酰胺类抗生素氨苄西林耐药性最强(23.07%),其次是四环素(19.23%)[51]. 对于大西洋附近海域,西西里岛西北部近海地区的海水中β-内酰胺类抗性基因bla-TEM的检出率最高[38],亚得里亚海东部卡什泰拉湾的海水中β-内酰胺类抗生素耐药最强,其中检出率最高的抗性基因是bla-TEM[52],黑海近海地区海水中万古霉素类抗性基因vanB(2×10−1±1×10−1)和β-内酰胺类抗性基因bla-SHV(4×10−2±1×10−2)是相对丰度最高的ARGs[53],英吉利海峡和北海海域磺胺类抗性基因sul1占主导[54]. 在太平洋沿岸海域,泰国邦盛和芭堤雅海滩的海水中,bla-TEM在所有样品中均能检测到,磺胺类抗性基因sul1检出率为97.6%,四环素类抗性基因tetQ检出率为85.4%[17];我国通向南海的河口中,β-内酰胺类抗性基因和磺胺类抗性基因占主导[55-56];在渤海湾检出率最高的ARGs为磺胺类抗性基因sul1、sul2,β-内酰胺类抗性基因bla-TEM和四环素类抗性基因tetB,四者检出率均为100%[6]
而与近海环境相比,更开阔且受人类活动影响较小的大洋区域,ARGs的丰度相对较低. 在相对封闭的地中海,检测到的ARGs的平均相对丰度明显高于开阔的南大西洋[57]. 对于不同大洋区域,ARGs丰度也存在差异,西太平洋海水中ARGs的丰度((3.0×106±1.6×106) copies·mL−1)高于南大洋((1.7×106±1.0×106) copies·mL−1),ARGs丰度从最远的采样点到靠近陆地的采样点呈增加趋势,与人类活动或人为污染源有关[58]. 而对于同一区域,西太平洋中层和深层海水中观察到的ARGs丰度与在浅海中的差异并不显著,表明深海也是ARGs的汇[58]. 此外,在大西洋和北海的海水中,sul2基因在40年间无显著变化,但造成这一奇怪现象的原因仍不清楚[42].
极地通常被认为是脆弱且受人类影响最小的区域,但极地海洋环境中仍有ARGs的存在,不过南极海水中ARGs的丰度比地中海中低3—5个数量级,bla-TEM和tetW是地中海中最丰富的ARGs,而bla-TEM和bla-CTX-M-1是南极海域最丰富的ARGs,这种差异主要与人为污染有关. 地中海海水中ARGs的丰度更高,主要是由于受到沿岸人类活动带来的高抗生素选择压力和人类粪便污染的影响[63]. 在南极洲菲尔德斯地区,多肽、多药耐药和β-内酰胺抗性基因在海水中的含量也较为丰富.
表 1 不同海域海水中的ARGs的丰度Table 1. Abundance of ARGs in seawater of different areas海域Sea area 研究时间Time 研究方法Method ARGs 相对丰度(16S rRNA−1)Relative abundance 绝对丰度Absolute abundance 参考文献Reference 中国渤海湾 2015.07.12 qPCR tetM 5.15×10−5 [59] sul 10−5—10−3 泰国邦盛和芭堤雅海滩 2018.12, 2019.02—2019.08 qPCR bla-TEM 2.08—4.12 lg copies·100 mL−1 [17] 中国黄海和渤海 2018.08.18—2018.09.07 qPCR sul1, sul2, tetB, tetG, tetX, ermF, ermT, qnrA, qnrB, qnrS 21.1—8.00×103 copies·mL−1 [60] 西太平洋和南大洋 2019.10.31—2019.12.04 qPCR tetA, tetB, tetBP, tetD, tetZ, sul1, ermB, blaTEM, qnrD, oqxA (3.0×106±1.6×106) copies·mL−1 [58] 爱尔兰海 2018.09—2019.10 qPCR bla-TEM 2.6×103—6.3×103 GC·100 mL−1 [41] sul1 3.7×102—4.8×103 GC·100 mL−1 黑海 2019.07—08 qPCR vanB 2×10−1±1×10−1 [53] bla-SHV 4×10−2±1×10−2 bla-CMY 1×10−2±3×10−3 mcr-1 3×10−2±2×10−2 ermB 1×10−3±5×10−4 vanA 1×10−5±5×10−4 悉尼港河口玫瑰湾 2019.08—09 qPCR sul1 (7.96×101±2.16×102) copies·100 mL−1 [61] qnrS (1.38×103±3.23×103) copies·100 mL−1 tetA (9.98×103±3.03×103) copies·100 mL−1(2.87×105±2.50×105) copies·100 mL−1 波罗的海 2008.08,2009.09 qPCR tetB 1.8×102—7.3×102 copies·L−1 [62] bla-SHV 2.5×102—1.0×103 copies·L−1 ermB 5.0×101—3.0×102 copies·L−1 tetM 4.2×101—7.8×103 copies·L−1 sul1 2.5×101—1.7×104 copies·L−1 英吉利海峡和北海海域 2020.01 qPCR tetA 2.24 lg copies·mL−1 [54] sul1 1.52—3.55 lg copies·mL−1 3.2 沉积物中抗生素抗性基因污染现状
与流动的海水环境相比,沉积物更具有区域稳定性,因此ARGs更倾向于在沉积物中积累,沉积物中的ARGs丰富且持久[21,60](表2),所以沉积物的再悬浮也是海水中ARGs的一种重要来源[17,49,64]. 总的来说,多药耐药基因和磺胺类抗性基因是海洋沉积物中常被检出的类型(表2和图2).
表 2 不同海域沉积物中的ARGs丰度Table 2. Abundance of ARGs in sediment of different areas海域Sea area 研究时间Time 研究方法Method ARGs 相对丰度(16S rRNA−1)Relative abundance 绝对丰度(copies·g−1)Absolute abundance 参考文献Reference 中国渤海湾 2015.07.12 qPCR tetM 1.7×10−4 [59] sul 10−4—10−2 中国九龙江口和闽江口 2016.04 宏基因组 289种ARGs 1.05×10−1—2.93×10−1 [16] 中国黄海和渤海 2018.08.18—2018.09.07 qPCR sul1, sul2, tetB, tetG, tetX, ermF, ermT, qnrA, qnrB, qnrS 4.67×103—1.08×107 [60] 白令海北部 2007.05—06,2016.07,2015.11 qPCR sul1, sul2, sul3, tetA, tetB, tetM, tetC, tetD, aacC2, aacC3, aacC4, qepA, qnrB, qnrA, qnrS, qnrD, ermC, blaOXA-1, blaTEM-1, blaOXA-2, blaDHA-1, blaVIM-1, ampC, blaCMY-2, blaOXA-10, blaSHV-1, blaGES-1, blaNDM-1, blaKPC 10−9—10−5 [68] 中国渤海附近海河河口 2018.05 HT-qPCR 85种ARGs 9.06×106—2.93×108 [43] 对于印度洋周边海域,在科威特附近海域沉积物中β-内酰胺类、头孢菌素类和青霉素类抗性基因被频繁检出[65],而在库奇湾、康巴特湾和阿拉伯海的沉积物中,多药耐药抗性基因的占比几乎>40%[66]. 对于太平洋周边海域,多药耐药基因是东中国海九龙江口和闽江口主要的ARGs类型[16],氨基糖苷类、多药耐药和磺胺类耐药是渤海湾西部海河河口3种最主要的耐药类型,其主要的耐药机制为抗生素失活和外排泵(共占81.4%)[43].
在大洋区域的沉积物中,情况与近海不同,ARGs的检出率和种类数目明显低于海水中. Su等[67]在西太平洋雅浦海沟的一个沉积物样品中检出了杆菌肽抗性基因,在另外两个沉积物样品中则未检出任何ARGs,而在海水样品中则检出了包括万古霉素、大环内酯和多药耐药等多种ARGs,这可能与海沟的极端深度和远离人为污染有关.
在极地海洋沉积物中也检出了ARGs. 在北极和亚北极的白令海北部区域,sul1、sul2和sul3是最普遍存在的ARGs,但其丰度与渤海湾的海河河口和其他受人类严重影响的海域相比低约2—5个数量级[68].
4. 海洋环境中抗生素抗性基因的影响因素(Influencing factors of antibiotic resistance genes in marine environment)
除污水处理厂的排放、地表径流、船舶污染、人类近岸活动等常见ARGs污染源的影响外,海洋环境中ARGs的组成还受到多种生物和环境因素的影响.
微生物作为ARGs的直接宿主,其群落组成会对ARGs的组成产生重要影响,但在不同区域,ARGs往往有着不同的潜在宿主. 蛭弧菌门(Bdellovibrionota)、蓝细菌(Cyanobacteria)和Margulisbacteria是西太平洋和南大洋海水中ARGs的主要潜在宿主[58]. γ‐变形菌(Gammaproteobacteria)和α-变形菌(Alphaproteobacteria)是西太平洋和深海ARGs的主要潜在宿主[70]. 而拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)与黄海沉积物中大部分ARGs正相关,可能是其潜在宿主[71]. Yang等[57]通过对Tara Oceans项目收集的全球132个海水样品中ARGs组成分析发现,海杆菌(Marinobacter)、交替单胞菌(Alteromonas)、黄杆菌(Flavobacterium)和假交替单胞菌(Pseudoalteromonas)是这些样品中ARGs的主要潜在宿主. 这种差异可能是不同区域理化因子和优势菌群的差异导致的. 与大多数化学污染物不同,ARGs不仅能够长期存在于海洋环境中,而且还能够通过VGT随着宿主的增殖进一步扩增. Li等[72]对龟山岛附近浅海热液口海水的调查显示,细菌群落和物理化学因素对ARGs的组成存在较强的共同影响,细菌群落介导的VGT过程可能对浅海生态系统中ARGs的组成存在重要影响. 此外,它们还能通过HGT作用在不同细菌之间传递,在环境中逐渐增加[73-74]. 包括质粒、转座子、整合子等在内的可移动遗传元件(Mobile Genetic Elements, MGEs)通过接合、转化、转导等方式实现HGT[75]. 许多研究都发现intI1能够促进海水和沉积物中一些基因的传递[43,58-59,76]. 例如,Na等[77]研究显示,1类整合子intI1与sul1和sul2显著相关,表明1类整合子可以促进黄海海水和沉积物中这两种抗性基因的传播. 而亚得里亚海沉积物中,具有β-内酰胺抗性的大肠杆菌菌株则与IncF质粒之间表现出显著相关[78].
此外,抗生素作为诱导产生ARGs的直接驱动力,是许多区域ARGs组成和丰度的重要影响因素. 例如,在一些海水养殖区,抗生素的浓度与一些相应ARGs丰度呈显著正相关关系[64,79]. 在厦门西溪河口和台州椒江口也发现了相同的情况[44]. 在珠江口的沉积物、北黄海的海水和渤海湾水和沉积物中,sul1和sul2都与磺胺类抗生素均呈显著正相关[56,59,77],此外,在渤海湾的海水和沉积物中,tetW与土霉素也呈显著正相关[59]. 但这种情况并非是绝对的,同样是在黄、渤海沉积物中,Lu等[60]的研究则发现,ARGs与相应抗生素间无明显相关关系. 在辽河河口海水、泰国沿海海水、香港沿岸沉积物中,抗生素浓度也与ARGs无明显相关关系[39,80-81]. 这可能与抗生素浓度和水文动力学过程对污染物的影响有关,在抗生素浓度高的养殖等区域,对ARGs存在更强的选择压力,并且海水的运动也会稀释近海水体中的抗生素和ARGs,减弱二者的相关性[39].
非抗生素污染因素也可以通过共同选择过程等影响ARGs的组成和丰度[39,82]. 越来越多的证据表明,重金属[39]、微塑料[46]、有机污染物(包括苯扎氯铵消毒剂[83]、多环芳烃(polycyclic aromatic hydrocarbons, PAHs)[84]、多氯联苯(polychlorinated biphenyls, PCBs)[85]、杀虫剂[86]、等离子液体[87]、纳米粒子[88]等在内的多种因素都会影响环境中ARGs的组成和丰度. Yang等[46]研究发现,与海水相比,微塑料和大塑料中ARGs和MRGs的相对丰度均较高,塑料是ARGs的重要载体. Wang等[84]研究发现,PAHs促进了海水中intI1介导的ARGs的共轭转移. Li等[50]研究发现,有机污染物PAHs、PCBs和六溴环十二烷的浓度也与ARGs丰度呈正相关,这一结果可以通过上述污染物对intI1的上调来解释. 此外,也有许多研究表明,海水和沉积物中的重金属与ARGs间存在显著正相关,这与共选择机制作用有关[39,44,50].
与淡水环境相比,海洋具有独特的物理化学性质,包括pH、盐度、营养盐和微量元素水平等,这些因素也会影响ARGs的组成. Zhang等[6]研究表明,海水中溶解氧(dissolved oxygen, DO)和sul2、bla-TEM有强负相关,DO是表示海水自净能力的重要因素,ARGs与DO呈负相关,表明海水的自净能力越低,ARGs的丰度越高,即在低氧海水环境中,ARGs具有更高的浓度. 盐度是衡量海水性质的重要指标,不同研究区域地理位置和盐度变化范围存在差异,对ARGs的影响也就不同. 在大洋海域,盐度高且变化小,而河口和近海区域盐度低且变化幅度大[58]. 在西太平洋和南大洋海水中,盐度和ARGs丰度呈正相关关系[58]. 而在太平洋海域的南海珊瑚礁海域的海水中、渤海湾海河河口沉积物中、厦门西溪河口沉积物中,以及大西洋海域英吉利海峡和北海海水中,盐度和ARGs丰度则呈现负相关关系[43-44,90]. 这可能与污水排放和地表径流对海水的冲淡有关,携带有大量ARGs的污水和河水盐度较低,但会带来大量的ARGs输入,因而导致了这种负相关关系. 与盐度类似,不同海域海水和沉积物中ARGs与不同理化因子的关系也不同. 渤海和黄海海水中ARGs的组成主要受铵盐、硝酸盐和海水盐度的影响[60]. Lu等[44]研究表明,沉积物中ARGs的相对丰度与沉积物粒径和总有机碳(total organic carbon, TOC)含量呈正相关,与沉积物pH和氧化还原电位呈负相关,其中,沉积物粒径是影响ARGs丰度的主要因子. 英吉利海峡和北海海水中sul1与DO、pH和浊度显著正相关[54]. 福建闽江口沉积物中ARGs与TOC、总氮(Total Nitrogen, TN)和总磷(total phosphorus, TP)显著正相关,而九龙江口沉积物中ARGs则与TOC显著正相关,与TN和TP显著负相关[16]. 西太平洋和渤海海水中的糖肽、三氯生、磷霉素和大环内酯-林可酰胺-链阳菌素抗性基因与亚硝酸盐、硝酸盐、叶绿素a、DO呈正相关,而糖肽、三氯生、大环内酯-林可酰胺-链阳菌素和β-内酰胺抗性基因与盐度和DO呈负相关[70]. 总的来说,TOC与海水和沉积物中ARGs呈明显正相关,而不同区域营养盐和pH则对ARGs的组成呈现不同的影响. 有机碳作为微生物尤其是异养细菌的重要营养来源,可以影响微生物群落[90-91],因而与ARGs呈明显正相关;而不同区域营养盐浓度和微生物群落组成差异较大,因此对ARGs的影响也不同.
综上所述,ARGs与环境因子和生物因素的相关性存在区域差异,可能与不同环境中这些理化因子差异较大、以及微生物的适应过程不同有关. 在复杂的海洋生态系统中,存在多种影响ARGs组成和丰度的因素,但对此仍没有一致性认识,因此需要进一步的识别和量化,并揭示相关机制.
5. 海洋环境中抗生素抗性基因污染的生态与健康风险(Ecological and health risks of antibiotic resistance gene pollution in marine environment)
海洋微生物群落是地球上最丰富、最复杂的群落之一[92],因此海洋也成了ARGs巨大的汇. 虽然海洋环境中ARGs的污染目前可能是局部性的,但其后果具有全球相关性,这些首先存在于局域环境中的ARGs可以通过海洋环流运输、海鲜运输和消费、旅游等过程扩大污染范围,对公共卫生、生态系统功能和动物疾病防治等造成严重危害[93].
首先,沿海地区会受到ARGs污染,并给附近生活的人类造成健康威胁. 例如,公共海滩是潜在ARGs污染源,这些区域的休闲海水、沉积物和沙子中存在的ARGs会给海滩使用者带来潜在的健康风险[17,30,36,94-95]. 在大连的傅家庄海水浴场,海水中检出了多种抗生素耐药大肠杆菌,其中38%(26/69)的菌株对至少一种抗生素具有耐药性[96]. 在巴西的海滩,休闲水域的海水和沙子中,也检测出了多种ARGs[97].
其次,海洋环境中的ARGs可以通过洋流输送到遥远的地区,构成全球风险,最终对人类健康构成威胁. 例如,极地区域和深海中也检出了多种ARGs[47,63,70]. Tan等[68]研究发现,北极/亚北极区域存在多种ARGs,这些ARGs与人类特异性分子标记物显著相关,这意味着极地区域已受到人为源ARGs的污染,而这些人为源ARGs很可能是通过海洋环流等过程传输而来的. 除此之外,陆源ARGs可以通过大气传输影响海洋,而海洋环境中的ARGs也可以通过海-气交换进入大气环境,并通过大气长距离运输,进一步传播到更远的地区. 候鸟迁徙也是ARGs从海洋环境向外扩散的一个重要途径,多项研究表明,海鸟胃肠道和粪便中存在多种ARB和ARGs,它们即是环境中的被感染对象也是潜在的传播源[98-100].
此外,海水养殖设施对海水和沉积物中ARGs的积累和传播也具有重要作用. 随着海水养殖业的快速发展,使得大量投加抗生素治疗养殖生物的细菌感染等疾病成为了常态,这带来了大量的抗生素残留,而鱼、虾等海产品则会从海水养殖环境中摄取这些ARGs,并进一步通过食物链威胁人类健康[101-103]. 在不同国家的多种海产品中均检出了ARGs[104-106]. 例如,在印度孟买零售市场销售的海鲜中分离出了大肠杆菌,71.58%的菌株能够产生超广谱β-内酰胺酶[107]. 在中国12个沿海地区采集的虾的内脏中也检测到了114种ARGs,其中主要为多药耐药抗性基因(21.05%),其次是四环素类抗性基因(17.54%)[108]. 可见,这些存在于海水养殖环境及水产品中ARGs将会通过食用等途径,给人类健康带来风险.
6. 总结与展望(Summarization and prospect)
抗生素耐药性问题是一个全球性的公共卫生问题,也是整个世界,尤其是发展中国家面临的一个亟待解决的重要问题. 而海洋环境作为人类活动产生的污染物的重要归宿,也是ARGs的一个天然储库. 海洋环境中存在着多种ARGs,但目前关于海洋环境中ARGs种类组成和传播途径的相关研究较少,对ARGs的归趋及其影响因素还缺乏系统的认识,对海水和沉积物中ARGs的扩散机制仍有待进一步探索.
因此,建议在以下4个方面强化研究,以深入认识海洋环境中的ARGs污染过程及防控措施:(1)开展各个海域、各种模式下海洋环境中ARGs的来源、组成和丰度的相关研究,深入解析不同人为源和自然源对海洋环境ARGs的贡献. (2)丰富海洋环境中ARGs的相关数据,建立海洋ARGs污染数据库,调查抗生素污染以及由此引发的ARGs对海洋微生物的长期和短期影响,并建立和完善海洋环境中ARGs的生态风险和人类健康风险评价指标体系,研发近海海洋环境ARGs污染基准,为制定相应环境标准、规范海水养殖和近海污水处理排放提供理论依据. (3)深入探究海洋环境中各类理化因子和污染物对ARGs的选择压力及机制,研究海洋环境中ARGs的降解机制,明确ARGs与海洋微生物群落之间的关系,细化海洋生态系统中ARGs的环境行为,从而制定相应策略,以期遏制ARGs在海洋环境中的扩散. (4)明确海洋环境中ARGs扩散和传播的分子机制,基于基因组学、大数据分析和数值模型,预测海洋环境介质中ARGs的变化趋势.
-
表 1 微生物残体及复合体的元素分析
Table 1. Elemental analysis of microbial necromass and complexes
样品Sample 元素质量组成/%Elemental mass component 摩尔原子比Molar atomic ratio C H O N S H/C O/C (N+O)/C BN 42.1 6.72 31.5 11.1 0.480 1.91 0.561 0.787 B-M 6.72 2.31 11.6 3.24 0.155 4.13 1.29 1.71 B-Fe 9.57 1.03 22.7 2.09 0.239 1.29 1.78 1.97 FN 45.3 6.16 33.6 10.6 0.460 1.63 0.556 0.757 F-M 10.7 1.74 14.6 2.19 0.162 1.96 1.03 1.20 F-Fe 15.6 2.33 24.3 3.92 0.299 1.79 1.17 1.38 注:BN,细菌残体bacterial necromass;FN真菌残体fungal necromass;B-M,细菌残体-蒙脱石bacteria-montmorillonite complex;F-M,真菌残体-蒙脱石fungus -montmorillonite complex;B-Fe,细菌残体-赤铁矿bacteria-hematite complex;F-Fe,真菌残体-赤铁矿fungus -hematite complex. 表 2 微生物残体及复合体的比表面积和孔隙结构
Table 2. Specific surface area and pore structure of microbial necromass and complexes
吸附剂Adsorbent 比表面积/(m2·g−1)Specific surface area 孔容积/(cm3·g−1)Pore volume 平均孔径/nmMean pore size M 100 0.20 7.76 Fe 5.56 0.03 18.0 BN 4.31 0.01 8.76 B-M 32.6 0.09 10.5 B-Fe 5.83 0.04 25.3 FN 5.32 0.02 11.7 F-M 20.9 0.12 22.6 F-Fe 4.94 0.05 39.4 表 3 微生物残体及复合体的吸附等温线拟合
Table 3. Adsorption isotherm fitting of microbial necromass and complexes
吸附质Adsorbate 吸附剂Adsorbent Langmuir拟合Langmuir model Freundlich拟合Freundlich model KL Qm R2 KF n R2 Pb2+ BN 6.21 53.2 0.524 42.7 0.204 0.888 B-M 3.65 56.7 0.765 41.3 0.277 0.887 B-Fe 6.12 0.550 0.725 7.98 0.213 0.828 FN 2.02 63.9 0.902 42.2 0.317 0.935 F-M 7.35 72.2 0.912 83.2 0.306 0.923 Pb2+ F-Fe 7.78 46.5 0.874 42.6 0.216 0.938 M 1.19 10.6 0.445 4.85 0.626 0.957 Fe 1.09 0.823 0.413 0.487 0.210 0.436 -
[1] 鲍雪蓉. 铅蓄电池企业绿化带土壤铅污染特征研究[J]. 资源节约与环保, 2022(7): 116-119. BAO X R. Study on lead pollution characteristics of soil in green belt of lead storage battery enterprises[J]. Resources Economization & Environmental Protection, 2022(7): 116-119 (in Chinese).
[2] ZOU Y D, WANG X X, KHAN A, et al. Environmental remediation and application of nanoscale zero-valent iron and its composites for the removal of heavy metal ions: A review[J]. Environmental Science & Technology, 2016, 50(14): 7290-7304. [3] WAN D, ZHANG N C, CHEN W L, et al. Organic matter facilitates the binding of Pb to iron oxides in a subtropical contaminated soil[J]. Environmental Science and Pollution Research, 2018, 25(32): 32130-32139. [4] ZHAO J, HUANG B W, GAO W, et al. Periodic DFT study on heavy metals Cu(II) and Pb(II) atoms adsorption on Na-montmorillonite (010) edge surface[J]. Solid State Communications, 2023, 366/367: 115171. [5] ZHU X F, JACKSON R D, DeLUCIA E H, et al. The soil microbial carbon pump: From conceptual insights to empirical assessments[J]. Global Change Biology, 2020, 26(11): 6032-6039. doi: 10.1111/gcb.15319 [6] QU C C, CHEN W L, HU X P, et al. Heavy metal behaviour at mineral-organo interfaces: Mechanisms, modelling and influence factors[J]. Environment International, 2019, 131: 104995. [7] BAO Y P, BOLAN N S, LAI J H, et al. Interactions between organic matter and Fe (hydr)oxides and their influences on immobilization and remobilization of metal(loid)s: A review[J]. Critical Reviews in Environmental Science and Technology, 2022, 52(22): 4016-4037. doi: 10.1080/10643389.2021.1974766 [8] 刘洵, 赖潘民旺, 张敏, 等. 微生物-矿物相互作用: 机制与重金属固定效应[J]. 环境化学, 2024, 43(2): 377-392. doi: 10.7524/j.issn.0254-6108.2022080205 LIU X, LAIPAN M W, ZHANG M, et al. Microbe-mineral interactions: Mechanisms and immobilization effect toward heavy metals[J]. Environmental Chemistry, 2024, 43(2): 377-392(in Chinese). doi: 10.7524/j.issn.0254-6108.2022080205
[9] UDDIN M K. A review on the adsorption of heavy metals by clay minerals, with special focus on the past decade[J]. Chemical Engineering Journal, 2017, 308: 438-462. [10] DIMIRKOU A, IOANNOU A, DOULA M. Preparation, characterization and sorption properties for phosphates of hematite, bentonite and bentonite-hematite systems[J]. Advances in Colloid and Interface Science, 2002, 97(1/2/3): 37-61. [11] MANJAIAH K M, KUMAR S, SACHDEV M S, et al. Study of clay-organic complexes[J]. Current Science, 2010, 98(7): 915-921. [12] VEGA F A, COVELO E F, ANDRADE M L. A versatile parameter for comparing the capacities of soils for sorption and retention of heavy metals dumped individually or together: Results for cadmium, copper and lead in twenty soil horizons[J]. Journal of Colloid and Interface Science, 2008, 327(2): 275-286. doi: 10.1016/j.jcis.2008.08.027 [13] CERQUEIRA B, COVELO E F, ANDRADE L, et al. The influence of soil properties on the individual and competitive sorption and desorption of Cu and Cd[J]. Geoderma, 2011, 162(1/2): 20-26. [14] 刘金香, 葛玉杰, 谢水波, 等. 改性微生物吸附剂在重金属废水处理中的应用进展[J]. 微生物学通报, 2020, 47(3): 941-951. LIU J X, GE Y J, XIE S B, et al. Application progress of modified microbial adsorbents for the treatment of heavymetal wastewater[J]. Microbiology China, 2020, 47(3): 941-951 (in Chinese).
[15] WEI J E, ZHANG F F, MA D L, et al. Microbial necromass carbon in estuarine tidal wetlands of China: Influencing factors and environmental implication[J]. Science of the Total Environment, 2023, 876: 162566. [16] BITTAR F, GOURIET F, KHELAIFIA S, et al. FastFung: A novel medium for the culture and isolation of fastidious fungal species from clinical samples[J]. Journal of Microbiological Methods, 2021, 180: 106108. doi: 10.1016/j.mimet.2020.106108 [17] ELZINGA E J, HUANG J H, CHOROVER J, et al. ATR-FTIR spectroscopy study of the influence of pH and contact time on the adhesion of Shewanella putrefaciens bacterial cells to the surface of hematite[J]. Environmental Science & Technology, 2012, 46(23): 12848-12855. [18] LV J T, MIAO Y X, HUANG Z Q, et al. Facet-mediated adsorption and molecular fractionation of humic substances on hematite surfaces[J]. Environmental Science & Technology, 2018, 52(20): 11660-11669. [19] ADHIKARI D, ZHAO Q, DAS K, et al. Dynamics of ferrihydrite-bound organic carbon during microbial Fe reduction[J]. Geochimica et Cosmochimica Acta, 2017, 212: 221-233. doi: 10.1016/j.gca.2017.06.017 [20] CECILIA J A, GARCÍA-SANCHO C, FRANCO F. Montmorillonite based porous clay heterostructures: Influence of Zr in the structure and acidic properties[J]. Microporous and Mesoporous Materials, 2013, 176: 95-102. doi: 10.1016/j.micromeso.2013.03.037 [21] SCHMALENBERGER A, DURAN A L, BRAY A W, et al. Oxalate secretion by ectomycorrhizal Paxillus involutus is mineral-specific and controls calcium weathering from minerals[J]. Scientific Reports, 2015, 5: 12187. doi: 10.1038/srep12187 [22] 常汉达, 王晶, 张凤华. 基于傅里叶红外光谱弃耕地开垦前后土壤有机质结构变化分析[J]. 土壤通报, 2019, 50(2): 333-340. CHANG H D, WANG J, ZHANG F H. Change in soil organic matter structure before and after reclamation for the abandoned farmland based on Fourier transform infrared spectrometer[J]. Chinese Journal of Soil Science, 2019, 50(2): 333-340 (in Chinese).
[23] YE Q Q, LI Q H, LI X. Removal of heavy metals from wastewater using biochars: Adsorption and mechanisms[J]. Environmental Pollutants and Bioavailability, 2022, 34(1): 385-394. doi: 10.1080/26395940.2022.2120542 [24] 郭微, 戴九兰, 王仁卿. 溶解性有机质影响土壤吸附重金属的研究进展[J]. 土壤通报, 2012, 43(3): 761-768. GUO W, DAI J L, WANG R Q. Progress in the effect of dissolved organic matter on adsorption of heavy metals by soil[J]. Chinese Journal of Soil Science, 2012, 43(3): 761-768 (in Chinese).
[25] 姜晶, 邓精灵, 盛光遥. 生物炭老化及其对重金属吸附影响研究进展[J]. 生态环境学报, 2022, 31(10): 2089-2100. JIANG J, DENG J L, SHENG G Y. A review of biochar aging and its impact on the adsorption of heavy metals[J]. Ecology and Environmental Sciences, 2022, 31(10): 2089-2100 (in Chinese).
[26] LU Z F, WANG H M, LI J Y, et al. Adsorption characteristics of bio-adsorbent on chromium(III) in industrial wastewater[J]. Water Science and Technology, 2015, 72(7): 1051-1061. [27] ZHU T T, ZHOU C H, KABWE F B, et al. Exfoliation of montmorillonite and related properties of clay/polymer nanocomposites[J]. Applied Clay Science, 2019, 169: 48-66. doi: 10.1016/j.clay.2018.12.006 [28] ZHAO Q J, QIU Y, LAN T, et al. Comparison of lead adsorption characteristics onto soil-derived particulate organic matter versus humic acid[J]. Journal of Soils and Sediments, 2021, 21(7): 2589-2603. doi: 10.1007/s11368-021-02911-4 [29] LU Y, LIANG Y Z, LIU F, et al. Nano scale visualization of enhanced adsorption and distribution of humic acid on hematite: Effect of Pb(II) ions[J]. Chemical Geology, 2020, 541: 119573. doi: 10.1016/j.chemgeo.2020.119573 [30] KRUMINA L, OP de BEECK M, MEKLESH V, et al. Ectomycorrhizal fungal transformation of dissolved organic matter: Consequences for reductive iron oxide dissolution and fenton-based oxidation of mineral-associated organic matter[J]. Frontiers in Earth Science, 2022, 10: 763695. doi: 10.3389/feart.2022.763695 [31] SHAH F, NICOLÁS C, BENTZER J, et al. Ectomycorrhizal fungi decompose soil organic matter using oxidative mechanisms adapted from saprotrophic ancestors[J]. The New Phytologist, 2016, 209(4): 1705-1719. [32] LANG M F, YU X Q, LIU J H, et al. Fenton aging significantly affects the heavy metal adsorption capacity of polystyrene microplastics[J]. Science of the Total Environment, 2020, 722: 137762. doi: 10.1016/j.scitotenv.2020.137762 [33] PORSCH K, DIPPON U, RIJAL M L, et al. In-situ magnetic susceptibility measurements As a tool to follow geomicrobiological transformation of Fe minerals[J]. Environmental Science & Technology, 2010, 44(10): 3846-3852. [34] HOHMANN C, WINKLER E, MORIN G, et al. Anaerobic Fe(II)-oxidizing bacteria show As resistance and immobilize As during Fe(III) mineral precipitation[J]. Environmental Science & Technology, 2010, 44(1): 94-101. [35] JOHNSON S B, YOON T H, BROWN G E. Adsorption of organic matter at mineral/water interfaces: 5. effects of adsorbed natural organic matter analogues on mineral dissolution[J]. Langmuir, 2005, 21(7): 2811-2821. doi: 10.1021/la0481041 [36] OMOIKE A, CHOROVER J, KWON K D, et al. Adhesion of bacterial exopolymers to α-FeOOH: inner-sphere complexation of phosphodiester groups[J]. Langmuir, 2004, 20(25): 11108-11114. doi: 10.1021/la048597+ [37] JOHNSON S B, BROWN G E, HEALY T W, et al. Adsorption of organic matter at mineral/water interfaces. 6. effect of inner-sphere versus outer-sphere adsorption on colloidal stability[J]. Langmuir, 2005, 21(14): 6356-6365. doi: 10.1021/la047030q [38] HINSINGER P, PLASSARD C, TANG C X, et al. Origins of root-mediated pH changes in the rhizosphere and their responses to environmental constraints: A review[J]. Plant and Soil, 2003, 248(1): 43-59. [39] YING-CHIEN C, SU Y P, CHIING-CHANG C, et al. Relationship between antibacterial activity of chitosan and surface characteristics of cell wall[J]. Acta Pharmacologica Sinica, 2004, 25(7): 932-936. [40] RAM R, MORRISROE L, ETSCHMANN B, et al. Lead (Pb) sorption and co-precipitation on natural sulfide, sulfate and oxide minerals under environmental conditions[J]. Minerals Engineering, 2021, 163: 106801. doi: 10.1016/j.mineng.2021.106801 [41] BRADL H B. Adsorption of heavy metal ions on soils and soils constituents[J]. Journal of Colloid and Interface Science, 2004, 277(1): 1-18. doi: 10.1016/j.jcis.2004.04.005 [42] MASON S E, ICEMAN C R, TANWAR K S, et al. Pb(II) adsorption on isostructural hydrated alumina and hematite (0001) surfaces: A DFT study[J]. The Journal of Physical Chemistry C, 2009, 113(6): 2159-2170. -






 下载:
下载: