-
有机磷酸酯(Organophosphate esters OPEs)是一类用来改变材料性能、防止风化或延缓燃烧的化学物质,常被添加到电子设备、电器零件、家具等产品的塑料、树脂或聚氨酯泡沫中[1 − 5],容易通过挥发、磨损等方式进入环境[6 − 7]. 随着这些产品生产和使用量的增加,OPEs已普遍存在于我们的生活中,目前不仅在空气、水体、灰尘等环境介质中广泛检出[8 − 12],而且在尿液、血液、指甲和头发等人体样品中也有不同浓度的报道[13 − 17]. OPEs已经被证明具有神经毒性、行为和内分泌干扰等多种毒性效应[18 − 20]. 因此OPEs暴露已经成为危害人体健康不可忽视的影响因素[21 − 25].
头发作为生物监测材料已经被广泛应用于法医学、毒理学、环境科学等研究领域中[26 − 29],相比于血液或尿液而言,它具有无创性、采集简单、性质稳定等优点,既可以反映短期暴露又可以反映长期暴露[30 − 32]. 然而目前环境有机污染物进入毛发的机制还缺乏深入的研究. 亚洲人以黑发为主,随着年龄的衰老,常常会出现白发,因此在头发样品采集的过程中,存在黑、白或棕色混杂的现象,而颜色是否会对污染物在毛发中的富集产生影响还未有定论. 唐斌等采集了电子垃圾拆解工人的黑、白头发并分别检测了头发中9种OPEs的含量,发现大部分OPEs在黑发中的浓度高于白发[33]. 但人群头发可能同时包含内部摄入和外部自由扩散两种途径的污染物[34 − 35],而动物暴露实验可以有效的控制体内暴露的剂量和外部环境的污染,能够成为研究毛发中污染物富集机制的有力手段. 多项研究表明喹硫平等药物在不同颜色毛发中的富集水平存在显著差异[36 − 38],但也有文献报道毛发颜色对某些合成大麻素等药物几乎不存在影响[39]. 目前关于毛发颜色对其中有机污染物(包括OPEs)富集的影响,还缺乏动物暴露实验的相关研究.
豚鼠(学名:Cavia porcellus)是一种常见的模式动物,其毛发与人类头发生物结构高度相似,同样具有表皮衍生物如髓质、皮质、角质分层结构;毛囊具有丰富的毛细血管,体内污染物可以通过血管进入毛发中. 豚鼠汗腺不发达,可以减少体内暴露污染物通过汗腺对毛发的污染. 一些品种具有多种毛色,可以开展毛发颜色对污染物富集影响的研究[40].
本研究以三色豚鼠为实验对象,通过控制三种典型OPEs的剂量进行暴露实验,研究不同颜色毛发的OPEs暴露特征. 应用基于超声提取-分散固相萃取的前处理技术和液相色谱质谱联用定量分析技术,检测同一只豚鼠不同颜色毛发中的OPEs含量,探究毛发颜色对豚鼠毛发中不同OPEs富集的影响,为人群调查中头发样品的采集提供参考,推动头发作为人体新污染物暴露监测的非侵入材料的广泛应用.
-
主要化学品:目标化合物标准品磷酸三(1,3-二氯-2-丙基)酯(Tris(1,3-dichloro-2-propyl) phosphate,TDCIPP)、磷酸三苯酯(Triphenyl phosphate,TPHP)、磷酸三丁酯(Tri-n-butyl phosphate,TNBP)(AccuStandard,美国),氘代同位素标准品 d15-TDCIPP、d15-TPHP(Cambridge Isotope Laboratories,美国). 三种OPEs的基本信息见表1.
主要材料与试剂:无水硫酸钠(Na2SO4),碳18(C18),2 mL、15 mL离心管,2.5 mm、5 mm氧化锆研磨珠(上海安谱实验科技股份有限公司,中国);色谱纯甲醇(MeOH) (默克,德国),色谱纯正己烷(HEX)、丙酮(ACE)、乙酸乙酯(EtAC)、乙腈(ACN)、乙酸铵(上海安谱实验科技股份有限公司,中国).
主要仪器:Agilent
1260 液相色谱仪(Agilent,美国),AB SCIEX API4000 三重四极杆质谱仪(AB SCIEX,美国),Poroshell 120 EC-C18 色谱柱( 4.6 mm×50 mm,2.7 μm) (Agilent,美国),混合型研磨仪MM400(Restch,德国),离心机(Thermo Fisher Scientific,美国),氮吹仪(Organomation,美国),涡旋振荡器(Troemner,美国). -
健康雄性三色豚鼠饲养于广东省医学实验动物中心普通级动物房,品种为短毛顺毛,毛发颜色同时包含黑色、棕色或白色,质量为200—300 g,使用普通级饲料喂养,饮用水为无菌水,自由摄食和饮水,保持12 h/12 h的日/夜光照循环,室内温度为20—24 ℃,湿度为40%—60%. 本研究已经通过广东省医学实验动物中心伦理委员会批准(批准号:B202302-7). 为避免含排泄物的垫料对毛发可能产生的污染,本次暴露实验采用不锈钢笼饲养. 大/小鼠经口暴露TDCIPP、TPHP、TNBP这3种化合物的无可见有害作用水平/最小可见损害作用水平(no observed adverse effect level/ lowest observed adverse effect level,NOAEL/ LOAEL)分别为13.2 mg·kg−1·d−1、25 mg·kg−1·d−1、100 mg·kg−1·d−1,本次暴露剂量设置为10 mg·kg−1,尽量避免化合物毒性对豚鼠健康的影响. 所有豚鼠在实验室适应性饲养7 d后开始暴露实验,按照随机分配的原则分为对照组(n = 5)和暴露组(n = 7). 开始暴露前,将豚鼠背部的毛剃除干净. 每天上午10:00,对照组豚鼠使用纯玉米油灌胃,暴露组豚鼠使用混有3种化合物的玉米油灌胃,连续暴露20d,期间每3d记录一次体重.
-
暴露结束后,使用电动剃毛刀按照不同颜色将背部毛发剃下,称重后用洁净的锡箔纸包裹并于−20 ℃保存. 样品分析前,使用丙酮清洗过的尖头镊子将黑色、棕色和白色的毛发完全区分开. 毛发的清洗参考之前的研究[44],具体步骤为:准确称量50 mg毛发置于2 mL 离心管中,加入1.5 mL丙酮,以
1500 r·min−1速度涡旋1 min、100 Hz超声1 min后小心吸出溶液,重复两次,清洗结束后将毛发自然晾干. 干燥后的毛发置于干净的2 mL离心管中,加入氧化锆研磨珠,使用研磨仪充分研磨成粉末. 毛发中目标化合物的提取参考罗镇南等的方法[45],准确称量10 mg毛发粉末于15 mL离心管,加入100 μL的 EtAC及20 μL同位素内标(d15-TPHP、d15-TDCIPP质量分数均为100 ng·mL−1),通风橱静置过夜使溶剂挥发. 加入HEX、ACE、ACN 及EtAC(1:1:1:1,V/V/V/V)的混合溶液4 mL,2000 r·min−1 涡旋4 min,20 ℃ 超声20 min,4000 r·min−1离心15 min后取提取上清液. 此提取过程重复3次后,将合并的上清液在温和氮气下浓缩至1 mL,加入20 mg无水 Na2SO4 和 100 mg C18 进行除水和净化,1200 r·min−1 涡旋 7 min、3500 r·min−1 离心 15 min后,再转移上清液至干净的离心管中. 氮吹近干后,使用200 μL MeOH复溶,放置−20 ℃冰箱中静置 4—6 h 冷冻沉淀除杂,取上清液待质谱分析. -
使用液相色谱-三重四极杆串联质谱仪(LC-MS/MS)分析样品中OPEs的含量. 色谱柱为Poroshell 120 EC-C18 (4.6 mm× 50 mm,2.7 μm);流动相为甲醇(A)和0.01 mol·L−1的乙酸铵溶液(B),梯度洗脱时间共计18 min: 0—2 min,50% A;2—4 min,50—95% A;4—6 min,95% A;6—6.1 min,95—50% A;6.1—9 min,50% A. 流速250 μL·min−1,进样量5 μL,色谱柱温45 ℃. 质谱条件:正离子扫描;毛细管电压
4000 V;气体(N2)温度550 ℃. 三种OPEs的质谱信息见表2. -
样品研磨过程使用的研磨珠及样品前处理过程使用的离心管均为一次性使用,避免交叉污染. 实验样品制备过程同步设置3个空白样品. 每6个实验样品同步做一个平行样品. 方法定量限(limit of quantification,LOQ)和方法检出限(limit of detection,LOD)分别为空白样品中目标化合物浓度的均值加10倍和3倍标准差;空白未检出时,LOQ或LOD定义为10倍或者3倍信噪比,本研究TDCIPP、TPHP、TNBP的LOD分别为0.35 ng·g−1 (dw,干重)、0.93 ng·g−1 (dw)、0.49 ng·g−1 (dw). 用混合毛发制备3个基质加标样品,按照“1.3”节的方法进行前处理,仪器分析后计算加标回收率. 实验得到TDCIPP、TPHP、TNBP的回收率分别为(59.4% ± 12.5%)、(79.8% ± 7.6%)、(74.2% ± 3.8%).
-
采用SPSS 25.0软件进行统计学分析. 描述分析中,样品检出浓度结果用均值±标准差(`x ± s)表示;检出浓度低于检出限时,浓度值计为零. 两组间比较采用独立样本T检验,3组及以上采用单因素方差分析,两两比较使用最小显著差异(least significant difference, LSD)t检验,P < 0.05和P < 0.01分别表示有显著性和非常显著性差异.
-
本实验饲养的三色豚鼠3种颜色毛发在体表分布不均,个别豚鼠的背部毛发可能缺少其中一种颜色,例如对照组有1只缺失棕色,暴露组中3只豚鼠分别缺失黑色、棕色和白色. 因此最终获得对照组毛发14份,暴露组毛发18份.
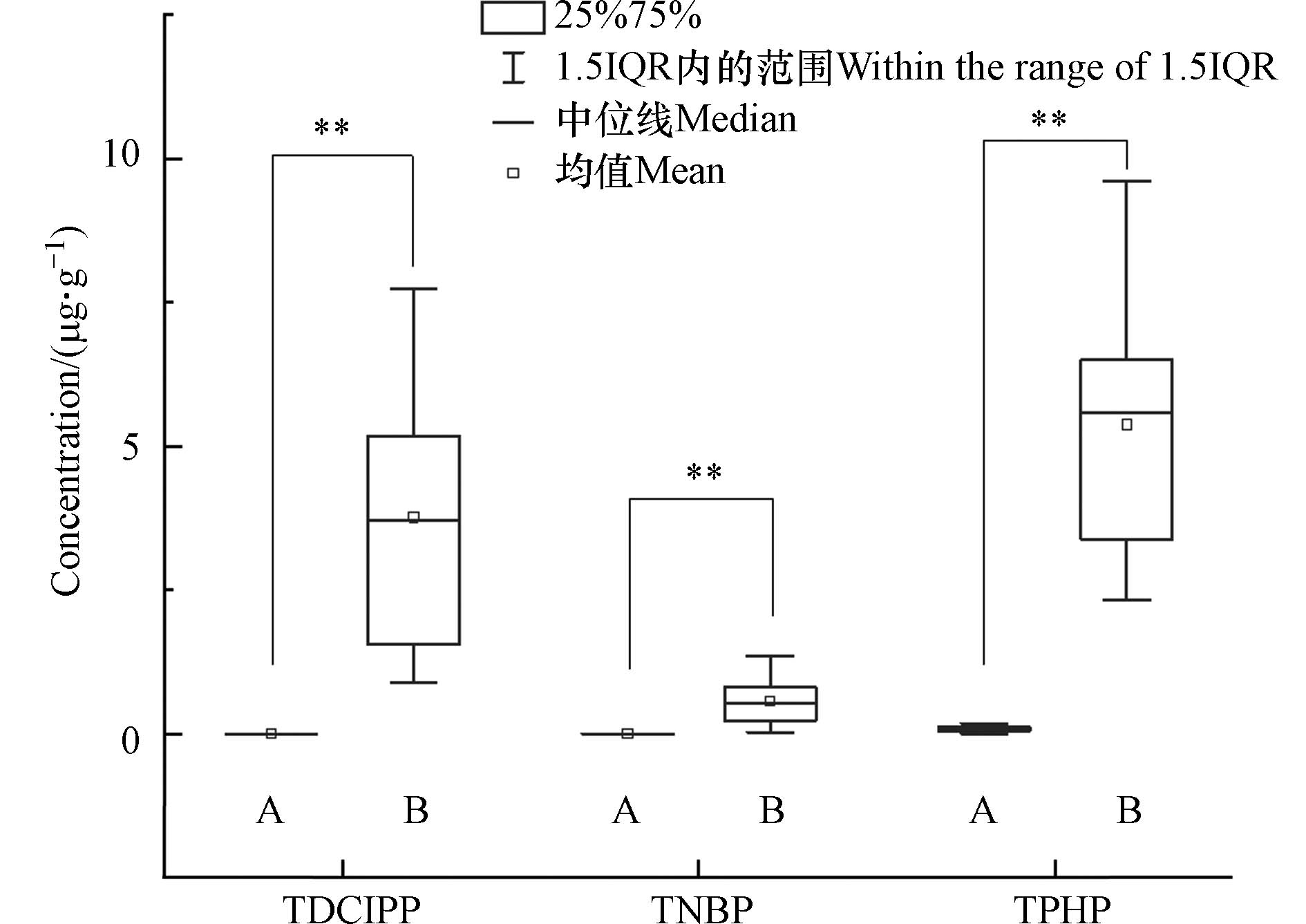
TDCIPP在对照组所有豚鼠毛发样品中均未检出,而在暴露组毛发中的浓度范围为0.96—13.9 μg·g−1,平均浓度为(4.11 ± 3.12) μg·g−1(图1). 该结果表明通过灌胃进入豚鼠体内的TDCIPP能够蓄积到毛发中. TDCIPP的暴露剂量为10 mg·kg−1(即10 μg·g−1),则TDCIPP从灌胃到进入毛发平均富集0.41倍,最高富集了1.39倍. 目前关于OPEs在动物毛发中富集的报道相对较少,一项关于C57BL/6雄性小鼠的暴露实验发现[46],300 mg·kg−1 TDCIPP连续暴露35d后,毛发中TDCIPP含量为(76.0 ± 10.2) μg·g−1,从灌胃到进入毛发平均富集0.25倍,略低于本实验中豚鼠毛发的平均富集倍数,这可能与不同物种的代谢差异有关.
与TDCIPP不同,对照组除了1个毛发样品未检出外,其它均检出TPHP,最高浓度为0.18 μg·g−1,平均浓度为(0.078 ± 0.043) μg·g−1,这可能是饲养环境中较高的本底值导致. 暴露组毛发样品均检出了较高浓度的TPHP,浓度范围为2.3—9.6 μg·g−1,平均浓度为(5.5 ± 2.3) μg·g−1(图1). 暴露组中TPHP检出浓度显著高于对照组(P < 0.01),表明毛发中的TPHP可以反映豚鼠的内负荷水平. 扣除本实验对照组的本底值后,TPHP在毛发中的平均富集倍数为0.47,与TDCIPP(0.41)较为接近. 目前还未发现关于TPHP在动物毛发中富集水平的相关报道.
TNBP在对照组毛发中均未检出,暴露组毛发中的浓度范围为0.028—1.08 μg·g−1,平均浓度为(0.46 ± 0.28) μg·g−1(图1). 尽管3种污染物的暴露剂量相同,然而毛发中TNBP的含量显著低于TPHP和TDCIPP(P < 0.05). 毛发中TNBP的平均富集倍数仅为0.046,较TPHP和TDCIPP低一个数量级,这可能与污染物在豚鼠体内的生物利用度和其理化性质有关. 目前关于TNBP在实验动物毛发中的报道也较为缺乏.
OPEs进入机体后会在代谢酶的作用下快速水解,分解为代谢物随尿液排出体外[47];尚未代谢的OPEs会随血液传输到各个组织,其中在毛囊周围毛细血管中的OPEs会扩散进入生长中的毛囊基质细胞,进而蓄积在毛发中[48]. 因此,毛发中污染物的含量与其在机体内的代谢速率和毛发血液分配系数密切相关. 已有文献报道了3种OPEs在大鼠体内的代谢速率呈现TNBP > TPHP > TDCIPP[49]的趋势;另有研究发现,小鼠在暴露3种OPEs后,TDCIPP在小鼠组织中的总含量明显高于TNBP和TPHP[50],这与本研究豚鼠毛发中TDCIPP浓度显著高于TNBP的结果一致,而TPHP在毛发中的富集程度与TDCIPP相接近,可能是由于豚鼠与小鼠间物种差异的原因.
另一方面,污染物在毛发中可能会与角蛋白、黑色素等成分相结合,因此理化性质也是影响在毛发中富集的重要因素. 如 Nakahara [51]发现在药物进入头发的过程中,含氯和苯环基团起到了积极的促进作用. 另有研究显示,极化率高的分子与毛发中角蛋白的亲和力更大,如苯、酚类与头发的结合量明显高于环己烷等烷烃类化合物[52]. 这与本研究豚鼠毛发中TDCIPP(氯代)和TPHP(芳基)含量显著高于TNBP(烷烃类)的结果相一致. Wang等[53]发现,咪达唑仑低剂量(5 mg·kg−1)给药28 d后豚鼠毛根中的检出浓度为0.01—0.04 ng·mg−1,而几乎检测不到其亲水的代谢物(羟基-咪达唑仑),认为化合物在头发中的结合与其亲脂性呈正相关关系. 此外,体外实验和理论模型也表明亲脂性能够促进化合物与毛发的结合[54]. 然而本研究并未发现该趋势,这可能与3种OPEs的辛醇-水分配系数比较接近有关(lgKow:3.65—4.59).
-
暴露组豚鼠黑色毛发中TDCIPP、TPHP和TNBP的浓度分别为(5.4 ± 4.6) μg·g−1、(5.4 ± 1.8) μg·g−1和(0.59 ± 0.40) μg·g−1;棕色毛发中TDCIPP、TPHP和TNBP的浓度分别为(3.3 ± 2.1) μg·g−1、(4.9 ± 2.4) μg·g−1和(0.51 ± 0.24) μg·g−1;白色毛发中TDCIPP、TPHP和TNBP的浓度分别为(3.6 ± 2.0) μg·g−1、(6.3 ± 2.7) μg·g−1和(0.61 ± 0.51) μg·g−1. 黑色、棕色和白色毛发中三种OPEs检出浓度均明显高于对照组(P < 0.01),表明不同颜色的毛发均可以表征污染物的内负荷. 刘俊芳等[37]对不同毛色的豚鼠开展了氯胺酮药物暴露实验,结果也表明不同颜色的毛发药物检出量均满足给药剂量相关性.
刘俊芳等[37]关于毛发颜色对氯胺酮在豚鼠毛发中分布影响的研究采用了不同毛色的豚鼠,可能存在个体差异的影响. 本研究选用三色豚鼠可以对同一只豚鼠的毛发进行成对比较,避免这一因素的影响. 如图2所示,TDCIPP在毛发中呈现黑色>白色>棕色的趋势,TPHP呈现白色>黑色>棕色的趋势,而TNBP在黑色和白色的含量相当,均略高于棕色毛发. 然而通过对豚鼠毛发每两种颜色的TDCIPP、TPHP和TNBP检出浓度分别做最小显著差异法LSD-t检验,发现黑色-白色、黑色-棕色、棕色-白色三组对比均没有显著性差异(P ˃ 0.05). 这项结果表明,同等暴露条件下,对同一只豚鼠个体,毛发颜色对于TDCIPP、TPHP和TNBP这3种OPEs在毛发中的富集没有明显的影响. 已有研究表明黑色素对于多种药物、毒品等具有较强的吸附能力,但缺乏对有机污染物的研究[38,55]. 本研究结果与之前药物的研究结果不同,可能是由于OPEs本身的理化性质与药物的差异较大,如喹硫平、氯胺酮等药物含有亚胺基等碱性基团,这些药物的lgKow也更低[36,37]. 这些性质可能更有利于与黑色素的带电基团发生结合[55],从而导致不同颜色的毛发中化合物浓度差异更加明显. 因此,本研究提示有机污染物在毛发中的富集机制可能与药物不同,不能直接套用药物研究的结论,而需要开展具体的实验研究.
-
本研究通过三种典型OPEs的三色豚鼠灌胃暴露实验发现,TNBP(烷烃OPEs)在毛发中的蓄积显著低于TPHP(芳基OPEs)与TDCIPP(氯代OPEs),其中TNBP和TPHP在实验动物毛发中的检出是首次报道. 对照实验表明,毛发可以表征OPEs的体内负荷;三色豚鼠可以作为模式动物,评价毛发颜色对污染物富集的影响. 本实验结果的统计分析显示,不同颜色毛发中的OPEs浓度无显著差异,表明毛发颜色对富集结果没有明显影响. 本实验未分析毛发中OPEs的代谢物以及血液样品中相关化合物的浓度,因此对于三种OPEs在毛发中的富集规律有待进一步验证. 此外,本实验还存在样本量较少和暴露浓度单一的局限性,还需进一步开展相关实验研究,以便更好地阐明毛发对有机物污染的富集机制.
有机磷酸酯在豚鼠不同颜色毛发中的富集特征
Accumulation of organophosphate esters in guinea pig hair with different colors
-
摘要: 研究三色豚鼠灌胃暴露磷酸三丁酯(TNBP)、磷酸三苯酯(TPHP)和磷酸三(1,3-二氯-2-丙基)酯(TDCIPP)等3种有机磷酸酯(OPEs)后,不同颜色毛发中不同OPEs的富集特征,探讨毛发颜色对OPEs在毛发中富集的影响. 将同时具有黑色、棕色和白色毛发的雄性健康豚鼠随机分为对照组和暴露组,暴露组每日采用玉米油进行灌胃,暴露剂量为10 mg·kg−1,连续20 d. 暴露结束后采集不同颜色的毛发进行分析. 暴露组豚鼠毛发中3种OPEs的检出浓度均明显高于对照组(P <0.01);暴露组毛发中TDCIPP与TPHP的水平相当,分别为(4.11 ± 3.12) μg·g−1 和(5.5 ± 2.3) μg·g−1,明显大于TNBP((0.46 ± 0.28)μg·g−1)(P <0.05);暴露组3种OPEs在不同颜色毛发之间的浓度差异均无统计学意义. 毛发作为一种可靠的生物材料能够反映OPEs的内负荷水平;理化性质会显著影响OPEs在毛发中的富集程度;毛发颜色对3种OPEs富集无显著影响.Abstract: To investigate the accumulation characteristics of different organophosphate esters (OPEs) in hair with different colors after exposure to tri-n-butyl phosphate (TNBP), triphenyl phosphate (TPHP), and tris(1,3-dichloro-2-propyl) phosphate (TDCIPP) via gavage, in guinea pigs, and to explore the effect of hair color on the accumulation of OPEs in hair. Healthy male guinea pigs with black, brown, and white hair were randomly divided into a control group (n = 5) and an exposed group (n = 7). The exposure dosage via gavage was 10 mg·kg−1·d−1 for 20 consecutive days. Then, hair samples with the same color were collected for quantitative analysis. The concentrations of TDCIPP, TPHP, and TNBP in the exposed group were significantly higher than those in the control group (P < 0.01). The levels of TDCIPP and TPHP in the exposed group were (4.11 ± 3.12) μg·g−1 and (5.5 ± 2.3) μg·g−1, respectively, which were significantly higher than that of TNBP ((0.46 ± 0.28) μg·g−1) (P < 0.05). There was no statistically significant difference in the concentration of the three OPEs among different hair colors in the exposed group. The results suggest that hair can reflect the body burden of OPEs. And physicochemical properties can significantly affect the concentrations of OPEs in hair. Within the same individual, hair color had no obvious effect on the accumulation of these three OPEs in guinea pig hair.
-
Key words:
- organophosphate esters /
- hair /
- guinea pig /
- experimental animal.
-
有机磷酸酯(Organophosphate esters OPEs)是一类用来改变材料性能、防止风化或延缓燃烧的化学物质,常被添加到电子设备、电器零件、家具等产品的塑料、树脂或聚氨酯泡沫中[1 − 5],容易通过挥发、磨损等方式进入环境[6 − 7]. 随着这些产品生产和使用量的增加,OPEs已普遍存在于我们的生活中,目前不仅在空气、水体、灰尘等环境介质中广泛检出[8 − 12],而且在尿液、血液、指甲和头发等人体样品中也有不同浓度的报道[13 − 17]. OPEs已经被证明具有神经毒性、行为和内分泌干扰等多种毒性效应[18 − 20]. 因此OPEs暴露已经成为危害人体健康不可忽视的影响因素[21 − 25].
头发作为生物监测材料已经被广泛应用于法医学、毒理学、环境科学等研究领域中[26 − 29],相比于血液或尿液而言,它具有无创性、采集简单、性质稳定等优点,既可以反映短期暴露又可以反映长期暴露[30 − 32]. 然而目前环境有机污染物进入毛发的机制还缺乏深入的研究. 亚洲人以黑发为主,随着年龄的衰老,常常会出现白发,因此在头发样品采集的过程中,存在黑、白或棕色混杂的现象,而颜色是否会对污染物在毛发中的富集产生影响还未有定论. 唐斌等采集了电子垃圾拆解工人的黑、白头发并分别检测了头发中9种OPEs的含量,发现大部分OPEs在黑发中的浓度高于白发[33]. 但人群头发可能同时包含内部摄入和外部自由扩散两种途径的污染物[34 − 35],而动物暴露实验可以有效的控制体内暴露的剂量和外部环境的污染,能够成为研究毛发中污染物富集机制的有力手段. 多项研究表明喹硫平等药物在不同颜色毛发中的富集水平存在显著差异[36 − 38],但也有文献报道毛发颜色对某些合成大麻素等药物几乎不存在影响[39]. 目前关于毛发颜色对其中有机污染物(包括OPEs)富集的影响,还缺乏动物暴露实验的相关研究.
豚鼠(学名:Cavia porcellus)是一种常见的模式动物,其毛发与人类头发生物结构高度相似,同样具有表皮衍生物如髓质、皮质、角质分层结构;毛囊具有丰富的毛细血管,体内污染物可以通过血管进入毛发中. 豚鼠汗腺不发达,可以减少体内暴露污染物通过汗腺对毛发的污染. 一些品种具有多种毛色,可以开展毛发颜色对污染物富集影响的研究[40].
本研究以三色豚鼠为实验对象,通过控制三种典型OPEs的剂量进行暴露实验,研究不同颜色毛发的OPEs暴露特征. 应用基于超声提取-分散固相萃取的前处理技术和液相色谱质谱联用定量分析技术,检测同一只豚鼠不同颜色毛发中的OPEs含量,探究毛发颜色对豚鼠毛发中不同OPEs富集的影响,为人群调查中头发样品的采集提供参考,推动头发作为人体新污染物暴露监测的非侵入材料的广泛应用.
1. 材料与方法(Materials and methods)
1.1 化学品、试剂与仪器
主要化学品:目标化合物标准品磷酸三(1,3-二氯-2-丙基)酯(Tris(1,3-dichloro-2-propyl) phosphate,TDCIPP)、磷酸三苯酯(Triphenyl phosphate,TPHP)、磷酸三丁酯(Tri-n-butyl phosphate,TNBP)(AccuStandard,美国),氘代同位素标准品 d15-TDCIPP、d15-TPHP(Cambridge Isotope Laboratories,美国). 三种OPEs的基本信息见表1.
表 1 三种OPEs的基本理化性质和毒理参数Table 1. Basic physicochemical properties and toxic parameters of three OPEs化合物Compounds CAS 结构式Structural formula 分子量Molecular weight 辛醇-水分配系数alg Kow 酸电离常数bpKa 半数致死剂量c /(mg·kg−1)LD50 无可见有害作用水平/最小可见损害作用水平/(mg·kg−1·d−1)NOAEL/ LOAEL TDCIPP 13674 -87-8
430.91 3.65 6.19 大鼠口服:1850;小鼠口服: 2250 13.2d TPHP 115-86-6 
326.29 4.59 4.66 大鼠口服: 3800 25e TNBP 126-73-8 
266.30 4.00 6.08 大鼠口服: 3000 100f alg Kow bpKa cLD50、来源于ChemIDplus数据库;alg Kow bpKa cLD50 were obtained from the ChemIDplus database; d NOAEL,基于小鼠肝重增加[41];d NOAEL,based on the increased liver weight in mice[41]; e LOAEL,基于对大鼠行为表达的影响[42];e LOAEL,based on the effects on the behavioral expression in rats[42]; f NOAEL,基于大鼠体重降低[43]. f NOAEL,based on the reduced body weight in rats[43]. 主要材料与试剂:无水硫酸钠(Na2SO4),碳18(C18),2 mL、15 mL离心管,2.5 mm、5 mm氧化锆研磨珠(上海安谱实验科技股份有限公司,中国);色谱纯甲醇(MeOH) (默克,德国),色谱纯正己烷(HEX)、丙酮(ACE)、乙酸乙酯(EtAC)、乙腈(ACN)、乙酸铵(上海安谱实验科技股份有限公司,中国).
主要仪器:Agilent
1260 液相色谱仪(Agilent,美国),AB SCIEX API4000 三重四极杆质谱仪(AB SCIEX,美国),Poroshell 120 EC-C18 色谱柱( 4.6 mm×50 mm,2.7 μm) (Agilent,美国),混合型研磨仪MM400(Restch,德国),离心机(Thermo Fisher Scientific,美国),氮吹仪(Organomation,美国),涡旋振荡器(Troemner,美国).1.2 动物暴露实验
健康雄性三色豚鼠饲养于广东省医学实验动物中心普通级动物房,品种为短毛顺毛,毛发颜色同时包含黑色、棕色或白色,质量为200—300 g,使用普通级饲料喂养,饮用水为无菌水,自由摄食和饮水,保持12 h/12 h的日/夜光照循环,室内温度为20—24 ℃,湿度为40%—60%. 本研究已经通过广东省医学实验动物中心伦理委员会批准(批准号:B202302-7). 为避免含排泄物的垫料对毛发可能产生的污染,本次暴露实验采用不锈钢笼饲养. 大/小鼠经口暴露TDCIPP、TPHP、TNBP这3种化合物的无可见有害作用水平/最小可见损害作用水平(no observed adverse effect level/ lowest observed adverse effect level,NOAEL/ LOAEL)分别为13.2 mg·kg−1·d−1、25 mg·kg−1·d−1、100 mg·kg−1·d−1,本次暴露剂量设置为10 mg·kg−1,尽量避免化合物毒性对豚鼠健康的影响. 所有豚鼠在实验室适应性饲养7 d后开始暴露实验,按照随机分配的原则分为对照组(n = 5)和暴露组(n = 7). 开始暴露前,将豚鼠背部的毛剃除干净. 每天上午10:00,对照组豚鼠使用纯玉米油灌胃,暴露组豚鼠使用混有3种化合物的玉米油灌胃,连续暴露20d,期间每3d记录一次体重.
1.3 样品采集与准备
暴露结束后,使用电动剃毛刀按照不同颜色将背部毛发剃下,称重后用洁净的锡箔纸包裹并于−20 ℃保存. 样品分析前,使用丙酮清洗过的尖头镊子将黑色、棕色和白色的毛发完全区分开. 毛发的清洗参考之前的研究[44],具体步骤为:准确称量50 mg毛发置于2 mL 离心管中,加入1.5 mL丙酮,以
1500 r·min−1速度涡旋1 min、100 Hz超声1 min后小心吸出溶液,重复两次,清洗结束后将毛发自然晾干. 干燥后的毛发置于干净的2 mL离心管中,加入氧化锆研磨珠,使用研磨仪充分研磨成粉末. 毛发中目标化合物的提取参考罗镇南等的方法[45],准确称量10 mg毛发粉末于15 mL离心管,加入100 μL的 EtAC及20 μL同位素内标(d15-TPHP、d15-TDCIPP质量分数均为100 ng·mL−1),通风橱静置过夜使溶剂挥发. 加入HEX、ACE、ACN 及EtAC(1:1:1:1,V/V/V/V)的混合溶液4 mL,2000 r·min−1 涡旋4 min,20 ℃ 超声20 min,4000 r·min−1离心15 min后取提取上清液. 此提取过程重复3次后,将合并的上清液在温和氮气下浓缩至1 mL,加入20 mg无水 Na2SO4 和 100 mg C18 进行除水和净化,1200 r·min−1 涡旋 7 min、3500 r·min−1 离心 15 min后,再转移上清液至干净的离心管中. 氮吹近干后,使用200 μL MeOH复溶,放置−20 ℃冰箱中静置 4—6 h 冷冻沉淀除杂,取上清液待质谱分析.1.4 仪器分析
使用液相色谱-三重四极杆串联质谱仪(LC-MS/MS)分析样品中OPEs的含量. 色谱柱为Poroshell 120 EC-C18 (4.6 mm× 50 mm,2.7 μm);流动相为甲醇(A)和0.01 mol·L−1的乙酸铵溶液(B),梯度洗脱时间共计18 min: 0—2 min,50% A;2—4 min,50—95% A;4—6 min,95% A;6—6.1 min,95—50% A;6.1—9 min,50% A. 流速250 μL·min−1,进样量5 μL,色谱柱温45 ℃. 质谱条件:正离子扫描;毛细管电压
4000 V;气体(N2)温度550 ℃. 三种OPEs的质谱信息见表2.表 2 三种OPEs的质谱信息Table 2. Mass spectrometry parameters of three OPEs化合物Compounds 初级离子(m/z)Primary ion 次级离子(m/z)Secondary ion 保留时间/min Retention time 去簇电压/VDeclustering potential 碰撞能/eVCollision energy 对应内标Corresponding internal standard TDCIPP 431 99 11.3 82 42 d15-TDCIPP TPHP 327 152 11.4 102 49 d15-TPHP TNBP 267 155 11.9 65 15 d15-TPHP 1.5 质量保证与质量控制(QA/QC)
样品研磨过程使用的研磨珠及样品前处理过程使用的离心管均为一次性使用,避免交叉污染. 实验样品制备过程同步设置3个空白样品. 每6个实验样品同步做一个平行样品. 方法定量限(limit of quantification,LOQ)和方法检出限(limit of detection,LOD)分别为空白样品中目标化合物浓度的均值加10倍和3倍标准差;空白未检出时,LOQ或LOD定义为10倍或者3倍信噪比,本研究TDCIPP、TPHP、TNBP的LOD分别为0.35 ng·g−1 (dw,干重)、0.93 ng·g−1 (dw)、0.49 ng·g−1 (dw). 用混合毛发制备3个基质加标样品,按照“1.3”节的方法进行前处理,仪器分析后计算加标回收率. 实验得到TDCIPP、TPHP、TNBP的回收率分别为(59.4% ± 12.5%)、(79.8% ± 7.6%)、(74.2% ± 3.8%).
1.6 统计学方法
采用SPSS 25.0软件进行统计学分析. 描述分析中,样品检出浓度结果用均值±标准差(`x ± s)表示;检出浓度低于检出限时,浓度值计为零. 两组间比较采用独立样本T检验,3组及以上采用单因素方差分析,两两比较使用最小显著差异(least significant difference, LSD)t检验,P < 0.05和P < 0.01分别表示有显著性和非常显著性差异.
2. 结果与讨论(Results and discussion)
2.1 豚鼠毛发中三种OPEs的检出特征
本实验饲养的三色豚鼠3种颜色毛发在体表分布不均,个别豚鼠的背部毛发可能缺少其中一种颜色,例如对照组有1只缺失棕色,暴露组中3只豚鼠分别缺失黑色、棕色和白色. 因此最终获得对照组毛发14份,暴露组毛发18份.
TDCIPP在对照组所有豚鼠毛发样品中均未检出,而在暴露组毛发中的浓度范围为0.96—13.9 μg·g−1,平均浓度为(4.11 ± 3.12) μg·g−1(图1). 该结果表明通过灌胃进入豚鼠体内的TDCIPP能够蓄积到毛发中. TDCIPP的暴露剂量为10 mg·kg−1(即10 μg·g−1),则TDCIPP从灌胃到进入毛发平均富集0.41倍,最高富集了1.39倍. 目前关于OPEs在动物毛发中富集的报道相对较少,一项关于C57BL/6雄性小鼠的暴露实验发现[46],300 mg·kg−1 TDCIPP连续暴露35d后,毛发中TDCIPP含量为(76.0 ± 10.2) μg·g−1,从灌胃到进入毛发平均富集0.25倍,略低于本实验中豚鼠毛发的平均富集倍数,这可能与不同物种的代谢差异有关.
与TDCIPP不同,对照组除了1个毛发样品未检出外,其它均检出TPHP,最高浓度为0.18 μg·g−1,平均浓度为(0.078 ± 0.043) μg·g−1,这可能是饲养环境中较高的本底值导致. 暴露组毛发样品均检出了较高浓度的TPHP,浓度范围为2.3—9.6 μg·g−1,平均浓度为(5.5 ± 2.3) μg·g−1(图1). 暴露组中TPHP检出浓度显著高于对照组(P < 0.01),表明毛发中的TPHP可以反映豚鼠的内负荷水平. 扣除本实验对照组的本底值后,TPHP在毛发中的平均富集倍数为0.47,与TDCIPP(0.41)较为接近. 目前还未发现关于TPHP在动物毛发中富集水平的相关报道.
TNBP在对照组毛发中均未检出,暴露组毛发中的浓度范围为0.028—1.08 μg·g−1,平均浓度为(0.46 ± 0.28) μg·g−1(图1). 尽管3种污染物的暴露剂量相同,然而毛发中TNBP的含量显著低于TPHP和TDCIPP(P < 0.05). 毛发中TNBP的平均富集倍数仅为0.046,较TPHP和TDCIPP低一个数量级,这可能与污染物在豚鼠体内的生物利用度和其理化性质有关. 目前关于TNBP在实验动物毛发中的报道也较为缺乏.
OPEs进入机体后会在代谢酶的作用下快速水解,分解为代谢物随尿液排出体外[47];尚未代谢的OPEs会随血液传输到各个组织,其中在毛囊周围毛细血管中的OPEs会扩散进入生长中的毛囊基质细胞,进而蓄积在毛发中[48]. 因此,毛发中污染物的含量与其在机体内的代谢速率和毛发血液分配系数密切相关. 已有文献报道了3种OPEs在大鼠体内的代谢速率呈现TNBP > TPHP > TDCIPP[49]的趋势;另有研究发现,小鼠在暴露3种OPEs后,TDCIPP在小鼠组织中的总含量明显高于TNBP和TPHP[50],这与本研究豚鼠毛发中TDCIPP浓度显著高于TNBP的结果一致,而TPHP在毛发中的富集程度与TDCIPP相接近,可能是由于豚鼠与小鼠间物种差异的原因.
另一方面,污染物在毛发中可能会与角蛋白、黑色素等成分相结合,因此理化性质也是影响在毛发中富集的重要因素. 如 Nakahara [51]发现在药物进入头发的过程中,含氯和苯环基团起到了积极的促进作用. 另有研究显示,极化率高的分子与毛发中角蛋白的亲和力更大,如苯、酚类与头发的结合量明显高于环己烷等烷烃类化合物[52]. 这与本研究豚鼠毛发中TDCIPP(氯代)和TPHP(芳基)含量显著高于TNBP(烷烃类)的结果相一致. Wang等[53]发现,咪达唑仑低剂量(5 mg·kg−1)给药28 d后豚鼠毛根中的检出浓度为0.01—0.04 ng·mg−1,而几乎检测不到其亲水的代谢物(羟基-咪达唑仑),认为化合物在头发中的结合与其亲脂性呈正相关关系. 此外,体外实验和理论模型也表明亲脂性能够促进化合物与毛发的结合[54]. 然而本研究并未发现该趋势,这可能与3种OPEs的辛醇-水分配系数比较接近有关(lgKow:3.65—4.59).
2.2 不同颜色毛发中OPEs的检出特征
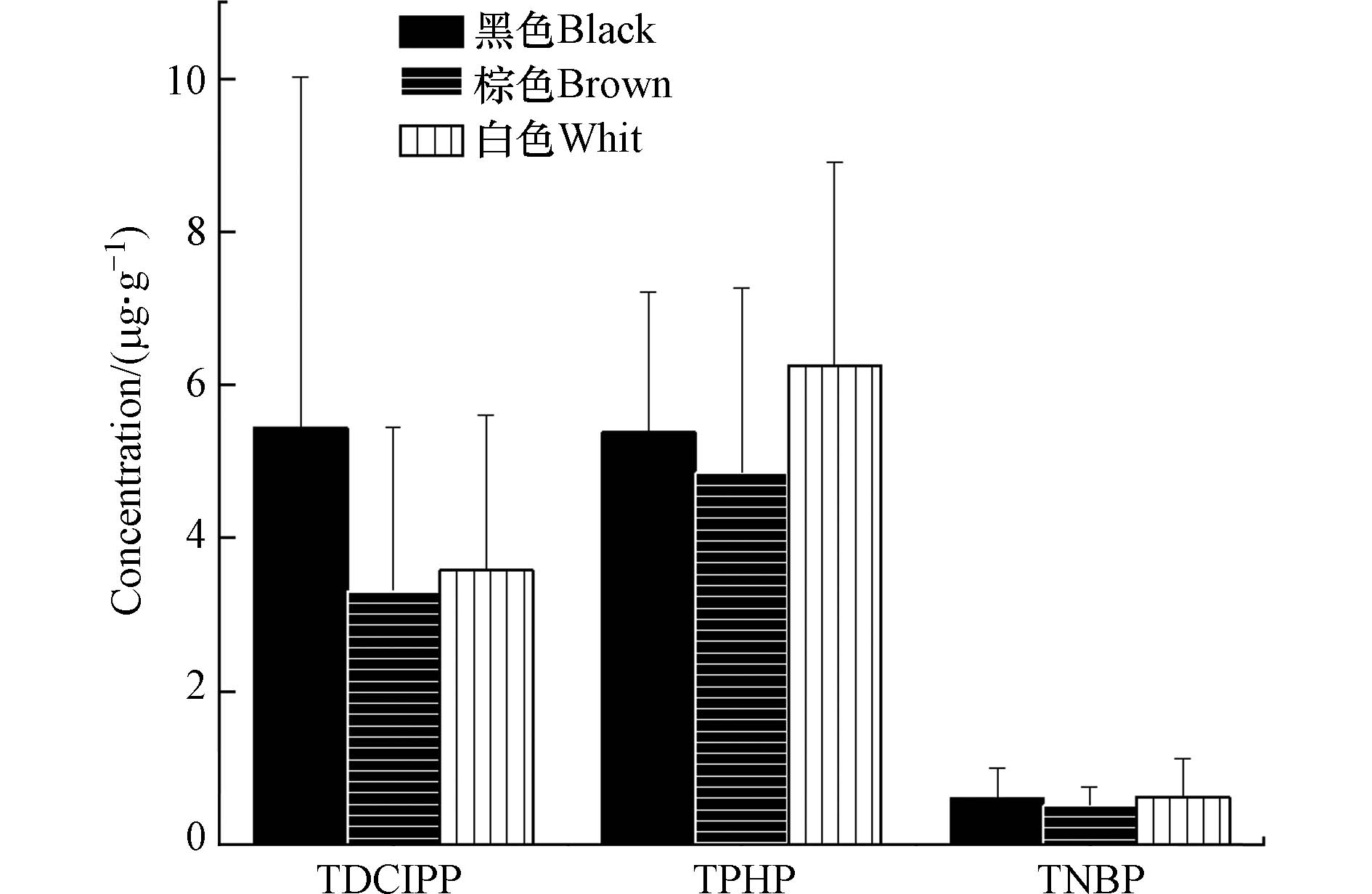
暴露组豚鼠黑色毛发中TDCIPP、TPHP和TNBP的浓度分别为(5.4 ± 4.6) μg·g−1、(5.4 ± 1.8) μg·g−1和(0.59 ± 0.40) μg·g−1;棕色毛发中TDCIPP、TPHP和TNBP的浓度分别为(3.3 ± 2.1) μg·g−1、(4.9 ± 2.4) μg·g−1和(0.51 ± 0.24) μg·g−1;白色毛发中TDCIPP、TPHP和TNBP的浓度分别为(3.6 ± 2.0) μg·g−1、(6.3 ± 2.7) μg·g−1和(0.61 ± 0.51) μg·g−1. 黑色、棕色和白色毛发中三种OPEs检出浓度均明显高于对照组(P < 0.01),表明不同颜色的毛发均可以表征污染物的内负荷. 刘俊芳等[37]对不同毛色的豚鼠开展了氯胺酮药物暴露实验,结果也表明不同颜色的毛发药物检出量均满足给药剂量相关性.
刘俊芳等[37]关于毛发颜色对氯胺酮在豚鼠毛发中分布影响的研究采用了不同毛色的豚鼠,可能存在个体差异的影响. 本研究选用三色豚鼠可以对同一只豚鼠的毛发进行成对比较,避免这一因素的影响. 如图2所示,TDCIPP在毛发中呈现黑色>白色>棕色的趋势,TPHP呈现白色>黑色>棕色的趋势,而TNBP在黑色和白色的含量相当,均略高于棕色毛发. 然而通过对豚鼠毛发每两种颜色的TDCIPP、TPHP和TNBP检出浓度分别做最小显著差异法LSD-t检验,发现黑色-白色、黑色-棕色、棕色-白色三组对比均没有显著性差异(P ˃ 0.05). 这项结果表明,同等暴露条件下,对同一只豚鼠个体,毛发颜色对于TDCIPP、TPHP和TNBP这3种OPEs在毛发中的富集没有明显的影响. 已有研究表明黑色素对于多种药物、毒品等具有较强的吸附能力,但缺乏对有机污染物的研究[38,55]. 本研究结果与之前药物的研究结果不同,可能是由于OPEs本身的理化性质与药物的差异较大,如喹硫平、氯胺酮等药物含有亚胺基等碱性基团,这些药物的lgKow也更低[36,37]. 这些性质可能更有利于与黑色素的带电基团发生结合[55],从而导致不同颜色的毛发中化合物浓度差异更加明显. 因此,本研究提示有机污染物在毛发中的富集机制可能与药物不同,不能直接套用药物研究的结论,而需要开展具体的实验研究.
3. 结论(Conclusion)
本研究通过三种典型OPEs的三色豚鼠灌胃暴露实验发现,TNBP(烷烃OPEs)在毛发中的蓄积显著低于TPHP(芳基OPEs)与TDCIPP(氯代OPEs),其中TNBP和TPHP在实验动物毛发中的检出是首次报道. 对照实验表明,毛发可以表征OPEs的体内负荷;三色豚鼠可以作为模式动物,评价毛发颜色对污染物富集的影响. 本实验结果的统计分析显示,不同颜色毛发中的OPEs浓度无显著差异,表明毛发颜色对富集结果没有明显影响. 本实验未分析毛发中OPEs的代谢物以及血液样品中相关化合物的浓度,因此对于三种OPEs在毛发中的富集规律有待进一步验证. 此外,本实验还存在样本量较少和暴露浓度单一的局限性,还需进一步开展相关实验研究,以便更好地阐明毛发对有机物污染的富集机制.
-
表 1 三种OPEs的基本理化性质和毒理参数
Table 1. Basic physicochemical properties and toxic parameters of three OPEs
化合物Compounds CAS 结构式Structural formula 分子量Molecular weight 辛醇-水分配系数alg Kow 酸电离常数bpKa 半数致死剂量c /(mg·kg−1)LD50 无可见有害作用水平/最小可见损害作用水平/(mg·kg−1·d−1)NOAEL/ LOAEL TDCIPP 13674 -87-8430.91 3.65 6.19 大鼠口服:1850;小鼠口服: 2250 13.2d TPHP 115-86-6 326.29 4.59 4.66 大鼠口服: 3800 25e TNBP 126-73-8 266.30 4.00 6.08 大鼠口服: 3000 100f alg Kow bpKa cLD50、来源于ChemIDplus数据库;alg Kow bpKa cLD50 were obtained from the ChemIDplus database; d NOAEL,基于小鼠肝重增加[41];d NOAEL,based on the increased liver weight in mice[41]; e LOAEL,基于对大鼠行为表达的影响[42];e LOAEL,based on the effects on the behavioral expression in rats[42]; f NOAEL,基于大鼠体重降低[43]. f NOAEL,based on the reduced body weight in rats[43]. 表 2 三种OPEs的质谱信息
Table 2. Mass spectrometry parameters of three OPEs
化合物Compounds 初级离子(m/z)Primary ion 次级离子(m/z)Secondary ion 保留时间/min Retention time 去簇电压/VDeclustering potential 碰撞能/eVCollision energy 对应内标Corresponding internal standard TDCIPP 431 99 11.3 82 42 d15-TDCIPP TPHP 327 152 11.4 102 49 d15-TPHP TNBP 267 155 11.9 65 15 d15-TPHP -
[1] DU J, LI H X, XU S D, et al. A review of organophosphorus flame retardants (OPFRs): Occurrence, bioaccumulation, toxicity, and organism exposure[J]. Environmental Science and Pollution Research, 2019, 26(22): 22126-22136. doi: 10.1007/s11356-019-05669-y [2] van der VEEN I, de BOER J. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis[J]. Chemosphere, 2012, 88(10): 1119-1153. doi: 10.1016/j.chemosphere.2012.03.067 [3] LIN L, HUANG Y X, WANG P, et al. Environmental occurrence and ecotoxicity of aquaculture-derived plastic leachates[J]. Journal of Hazardous Materials, 2023, 458: 132015. doi: 10.1016/j.jhazmat.2023.132015 [4] STABILETON H M, KLOSTERHAUS S, EAGLE S, et al. Detection of organophosphate flame retardants in furniture foam and U. S. house dust[J]. Environmental Science & Technology, 2009, 43(19): 7490-7495. [5] 陈勇. 我国阻燃剂行业发展现状及未来趋势分析[J]. 现代化工, 2023, 43(5): 11-13,19. CHEN Y. Development status and trend of flame retardant industry in China[J]. Modern Chemical Industry, 2023, 43(5): 11-13,19(in Chinese).
[6] GONZÁLEZ-GÓMEZ X, CAMBEIRO-PÉREZ N, MARTÍNEZ-CARBALLO E, et al. Screening of organic pollutants in pet hair samples and the significance of environmental factors[J]. Science of the Total Environment, 2018, 625: 311-319. doi: 10.1016/j.scitotenv.2017.12.270 [7] BLUM A, BEHL M, BIRNBAUM L, et al. Organophosphate ester flame retardants: Are they a regrettable substitution for polybrominated diphenyl ethers[J]. Environmental Science & Technology Letters, 2019, 6(11): 638-649. [8] HOU R, XU Y P, WANG Z J. Review of OPFRs in animals and humans: Absorption, bioaccumulation, metabolism, and internal exposure research[J]. Chemosphere, 2016, 153: 78-90. doi: 10.1016/j.chemosphere.2016.03.003 [9] BJÖRNSDOTTER M. K, ROMERA-GARCÍA E, BORRULL J, et al. Presence of diphenyl phosphate and aryl-phosphate flame retardants in indoor dust from different microenvironments in Spain and the Netherlands and estimation of human exposure[J]. Environment International, 2018, 112: 59-67. doi: 10.1016/j.envint.2017.11.028 [10] GIULIVO M, CAPRI E, ELJARRAT E, et al. Analysis of organophosphorus flame retardants in environmental and biotic matrices using on-line turbulent flow chromatography-liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2016, 1474: 71-78. doi: 10.1016/j.chroma.2016.10.042 [11] AZNAR-ALEMANY Ò, AMINOT Y, VILÀ-CANO J, et al. Halogenated and organophosphorus flame retardants in European aquaculture samples[J]. Science of the Total Environment, 2018, 612: 492-500. doi: 10.1016/j.scitotenv.2017.08.199 [12] LIU Q, TANG X X, WANG Y, et al. ROS changes are responsible for tributyl phosphate (TBP)-induced toxicity in the alga Phaeodactylum tricornutum[J]. Aquatic Toxicology, 2019, 208: 168-178. doi: 10.1016/j.aquatox.2019.01.012 [13] FENG L P, OUYANG F X, LIU L P, et al. Levels of urinary metabolites of organophosphate flame retardants, TDCIPP, and TPHP, in pregnant women in Shanghai[J]. Journal of Environmental and Public Health, 2016, 2016: 9416054. [14] TANG J, MA S T, HU X, et al. Handwipes as indicators to assess organophosphate flame retardants exposure and thyroid hormone effects in e-waste dismantlers[J]. Journal of Hazardous Materials, 2023, 443(Pt B): 130248. [15] MENDELSOHN E, HAGOPIAN A, HOFFMAN K, et al. Nail Polish as a source of exposure to triphenyl phosphate[J]. Environment International, 2016, 86: 45-51. doi: 10.1016/j.envint.2015.10.005 [16] XU F C, EULAERS I, ALVES A, et al. Human exposure pathways to organophosphate flame retardants: Associations between human biomonitoring and external exposure[J]. Environment International, 2019, 127: 462-472. doi: 10.1016/j.envint.2019.03.053 [17] HAINES D A, SARAVANABHAVAN G, WERRY K, et al. An overview of human biomonitoring of environmental chemicals in the Canadian Health Measures Survey: 2007-2019[J]. International Journal of Hygiene and Environmental Health, 2017, 220(2): 13-28. doi: 10.1016/j.ijheh.2016.08.002 [18] YAN S H, WANG Q, YANG L H, et al. Comparison of the toxicity effects of tris(1, 3-dichloro-2-propyl)phosphate (TDCIPP) with tributyl phosphate (TNBP) reveals the mechanism of the apoptosis pathway in Asian freshwater clams (Corbicula fluminea)[J]. Environmental Science & Technology, 2020, 54(11): 6850-6858. [19] SUN L W, XU W B, PENG T, et al. Developmental exposure of zebrafish larvae to organophosphate flame retardants causes neurotoxicity[J]. Neurotoxicology and Teratology, 2016, 55: 16-22. doi: 10.1016/j.ntt.2016.03.003 [20] JI X Y, LI N, MA M, et al. In vitro estrogen-disrupting effects of organophosphate flame retardants[J]. Science of the Total Environment, 2020, 727: 138484. doi: 10.1016/j.scitotenv.2020.138484 [21] HOFFMAN K, GEARHART-SERNA L, LORBER M, et al. Estimated tris(1, 3-dichloro-2-propyl) phosphate exposure levels for US infants suggest potential health risks[J]. Environmental Science & Technology Letters, 2017, 4(8): 334-338. [22] 张晓华, 赵繁荣, 胡建英. 我国人群有机磷阻燃剂暴露评估及其健康风险[J]. 生态毒理学报, 2021, 16(3): 155-165. doi: 10.7524/AJE.1673-5897.20210412002 ZHANG X H, ZHAO F R, HU J Y. Exposure assessment and health Risk of organophosphate flame retardants in general population in China[J]. Asian Journal of Ecotoxicology, 2021, 16(3): 155-165(in Chinese). doi: 10.7524/AJE.1673-5897.20210412002
[23] JIN H B, GAO Y, CHEN R R, et al. A preliminary report on the association between maternal serum organophosphate ester concentrations and gestational diabetes mellitus[J]. Heliyon, 2023, 9(3): e14302. doi: 10.1016/j.heliyon.2023.e14302 [24] BAI X Y, LU S Y, XIE L, et al. A pilot study of metabolites of organophosphorus flame retardants in paired maternal urine and amniotic fluid samples: Potential exposure risks of tributyl phosphate to pregnant women[J]. Environmental Science. Processes & Impacts, 2019, 21(1): 124-132. [25] 邓富昌, 方建龙, 李湉湉, 等. , 有机磷阻燃剂暴露与中国老年人胰岛素抵抗和糖代谢紊乱的关系: 来自中国老年人空气污染物暴露的生物标志物研究(BAPE)的证据[C]//中国毒理学会第十次全国毒理学大会论文集. 珠海, 2023: 509-510. [26] KUCHARSKA A, CEQUIER E, THOMSEN C, et al. Assessment of human hair as an indicator of exposure to organophosphate flame retardants. Case study on a Norwegian mother-child cohort[J]. Environment International, 2015, 83: 50-57. doi: 10.1016/j.envint.2015.05.015 [27] SROGI K. Hair analysis as method for determination of level of drugs and pharmaceutical in human body: Review of chromatographic procedures[J]. Analytical Letters, 2006, 39(2): 231-258. doi: 10.1080/00032710500476821 [28] GÜNTHER K N, JOHANSEN S S, NIELSEN M K K, et al. Post-mortem quetiapine concentrations in hair segments of psychiatric patients—Correlation between hair concentration, dose and concentration in blood[J]. Forensic Science International, 2018, 285: 58-64. doi: 10.1016/j.forsciint.2018.01.020 [29] CAMPO P, BLACHÈRE V, PAYAN J P, et al. Toluene toxicokinetics and metabolism parameters in the rat and guinea pig[J]. Environmental Toxicology and Pharmacology, 2006, 21(3): 276-282. doi: 10.1016/j.etap.2005.09.004 [30] PENG F J, EMOND C, HARDY E M, et al. Population-based biomonitoring of exposure to persistent and non-persistent organic pollutants in the Grand Duchy of Luxembourg: Results from hair analysis[J]. Environment International, 2021, 153: 106526. doi: 10.1016/j.envint.2021.106526 [31] ZHANG H, CHAI Z F, SUN H B. Human hair as a potential biomonitor for assessing persistent organic pollutants[J]. Environment International, 2007, 33(5): 685-693. doi: 10.1016/j.envint.2007.02.003 [32] POON S, WADE M G, ALEKSA K et al. Hair as a biomarker of systemic exposure to polybrominated diphenyl ethers[J]. Environmental Science & Technology, 2014, 48(24): 14650-14658. [33] TANG B, ZHENG J, XIONG S M, et al. The accumulation of organic contaminants in hair with different biological characteristics[J]. Chemosphere, 2023, 312(Pt 1): 137064. [34] WIELGOMAS B, CZARNOWSKI W, JANSEN E H J M. Persistent organochlorine contaminants in hair samples of Northern Poland population, 1968-2009[J]. Chemosphere, 2012, 89(8): 975-981. doi: 10.1016/j.chemosphere.2012.06.056 [35] 国家技术监督局, 中华人民共和国卫生部. 生物监测质量保证规范: GB/T 16126—1995[S]. 北京: 中国标准出版社, 1996. State Bureau of Quality and Technical Supervision of the People's Republic of China, Ministry of Health of the People's Republic of China. Quidelines for quality assurance of biological monitoring: GB/T 16126—1995[S]. Beijing: Standards Press of China, 1996(in Chinese).
[36] YAN H, JI J J, XIANG P, et al. Characteristics of quetiapine and 7-hydroxyquetiapine in hair roots and blood after a single dose of quetiapine[J]. Forensic Science International, 2020, 309: 110189. doi: 10.1016/j.forsciint.2020.110189 [37] 刘俊芳, 李鹏旺, 王玉瑾. 毛发颜色和给药剂量对氯胺酮在豚鼠毛发中分布与代谢的影响[J] . 中国药物依赖性杂志 2011, 20(2): 97-100. LIU J F, LI P W, WANG Y J. Influence on distribution and metabolism of ketamine in guinea pigs hair by hair color and drug dosage[J]. Chinese Journal of Drug Dependence, 2011, 20(2): 97-100(in Chinese).
[38] HEGSTAD S, REISTAD R, HAUG L S, et al. Eumelanin is a major determinant for 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) incorporation into hair of mice[J]. Pharmacology & Toxicology, 2002, 90(6): 333-337. [39] KIM J, PARK Y, PARK M, et al. Simultaneous determination of five naphthoylindole-based synthetic cannabinoids and metabolites and their deposition in human and rat hair[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 102: 162-175. doi: 10.1016/j.jpba.2014.09.013 [40] PARAKKAL P F. The fine structure of the dermal papilla of the guinea pig hair follicle[J]. Journal of Ultrastructure Research, 1966, 14(1/2): 133-142. [41] KAMATA E, NAITO K, NAKAJI Y, et al. Acute and subacute toxicity studies of tris(1, 3-dichloro-2-propyl) phosphate on mice[J]. Eisei Shikenjo Hokoku. Bulletin of National Institute of Hygienic Sciences, 1989(107): 36-43. [42] NAKAYAMA A, HATTORI T, ISOBE A, et al. The effects of 28-day early-life exposure to triphenyl phosphate (TPhP) on odor preference and sexual behavior in female rats[J]. Journal of Applied Toxicology:JAT, 2020, 40(12): 1614-1621. doi: 10.1002/jat.4021 [43] BERDASCO N A M, McCREADY D. Risk assessment and class-based evaluation of three phosphate esters[J]. Human and Ecological Risk Assessment:an International Journal, 2011, 17(2): 367-380. doi: 10.1080/10807039.2011.552394 [44] LIN M Q, TANG J, MA S T, et al. Simultaneous determination of polybrominated diphenyl ethers, polycyclic aromatic hydrocarbons and their hydroxylated metabolites in human hair: A potential methodology to distinguish external from internal exposure[J]. The Analyst, 2019, 144(24): 7227-7235. doi: 10.1039/C9AN01359H [45] 罗镇南, 秦瑞欣, 张释义, 等. 头发中多种新型有机污染物检测方法的建立[J]. 环境化学, 2023, 42(5): 1509-1523. doi: 10.7524/j.issn.0254-6108.2022091405 LUO Z N, QIN R X, ZHANG S Y, et al. The establishment of a new method for the detection of emerging organic contaminants in hair[J]. Environmental Chemistry, 2023, 42(5): 1509-1523(in Chinese). doi: 10.7524/j.issn.0254-6108.2022091405
[46] 朱亭. 磷酸三(1, 3: 二氯: 2: 丙基)酯(TDCIPP)在小鼠体内的蓄积、转化和毒性机制研究[D]. 北京: 中国科学院大学, 2020. ZHU T. Study on accumulation, transformation and toxicity mechanism of tri (1, 3-dichloro-2-propyl) phosphate (TDCIPP) in mice[D], Beijing: University of Chinese Academy of Sciences, 2020 (in Chinese).
[47] WANG X, ZHU Q Q, LIAO C Y, et al. Human internal exposure to organophosphate esters: A short review of urinary monitoring on the basis of biological metabolism research[J]. Journal of Hazardous Materials, 2021, 418: 126279. doi: 10.1016/j.jhazmat.2021.126279 [48] ZHANG S Y, YAN X, TANG B, et al. Human hair as a noninvasive matrix to assess exposure to micro-organic contaminants: State of the art review[J]. Science of the Total Environment, 2023, 892: 164341. doi: 10.1016/j.scitotenv.2023.164341 [49] SASAKI K, SUZUKI T, TAKEDA M, et al. Metabolism of phosphoric acid triesters by rat liver homogenate[J]. Bulletin of Environmental Contamination and Toxicology, 1984, 33(1): 281-288. doi: 10.1007/BF01625544 [50] CHEN M, LIAO X L, YAN S C, et al. Uptake, accumulation, and biomarkers of PM2.5-associated organophosphate flame retardants in C57BL/6 mice after chronic exposure at real environmental concentrations[J]. Environmental Science & Technology, 2020, 54(15): 9519-9528. [51] NAKAHARA Y, KIKURA R. Hair analysis for drugs of abuse. XIII. Effect of structural factors on incorporation of drugs into hair: The incorporation rates of amphetamine analogs[J]. Archives of Toxicology, 1996, 70(12): 841-849. doi: 10.1007/s002040050348 [52] BREUER M M. The binding of small molecules and polymers to keratin and their effects on the physicochemical and surface properties of hair fibers[C]//Orfanos CE, Montagna W, Stüttgen G. Hair Research. Berlin, Heidelberg: Springer, 1981: 96-115. [53] WANG X, XIANG P, DRUMMER O H, et al. Pharmacokinetic study of midazolam and α-hydroxymidazolam in guinea pig blood and hair roots after a single dose of midazolam[J]. Journal of Pharmaceutical and Biomedical Analysis, 2021, 195: 113890. doi: 10.1016/j.jpba.2021.113890 [54] WANG L M, CHEN L J, HAN L J, et al. Kinetics and equilibrium of solute diffusion into human hair[J]. Annals of Biomedical Engineering, 2012, 40(12): 2719-2726. doi: 10.1007/s10439-012-0610-8 [55] RIMPELÄ A K, REINISALO M, HELLINEN L, et al. Implications of melanin binding in ocular drug delivery[J]. Advanced Drug Delivery Reviews, 2018, 126: 23-43. doi: 10.1016/j.addr.2017.12.008 -




 DownLoad:
DownLoad: