-
海洋浮游植物的生物量仅占生物圈初级生产者生物量的0.2%,但贡献的初级生产量约占全球初级净产量的50%[1 − 3]. 浮游植物广泛分布于海洋上层和河口环境中[4],在调节海洋生物泵和全球生物化学地球循环方面发挥着重要作用[5],是浮游动物和海洋渔业的重要食物来源[6 − 7]. 通过利用光作为主要能源,海洋浮游植物的生长通过食物链满足了较高营养级生物的能源需求,并支持了海洋生态系统的正常运行[8]. 同时,海洋浮游植物具有繁殖周期短和对环境变化敏感的特点[9 − 10]. 通常来说,环境条件的变化会直接影响到浮游植物的群落结构和多样性[11 − 12]. 例如,海洋暖化可增加浮游植物的多样性[13],营养物质的有效性、温度和辐照度可能影响浮游植物群落的粒径大小[14];此外,气候变化的间接影响,例如营养负荷的增加,可能比温度对浮游植物产生的直接影响更深远[15]. 同时,浮游植物群落的动态变化是反映海洋生态系统和环境变化的最佳指标,这在很大程度上是由于浮游植物群落动态与环境变化之间的紧密联系[16 − 17]. 因此,研究浮游植物群落结构及其影响因素对于理解海洋环境的变化以及海洋生态系统的结构和功能具有重要意义[18 − 19].
靖海湾是面积为140 km2的半封闭海湾,位于山东半岛东部,于2007年设立了松江鲈鱼水产种质资源保护区[20],是青龙河和蔡官庄河的入海口所在地,接收了大量来自威海市的工业、农业和城市废水排放[21]. 靖海湾作为典型的河口和海湾区域,能够为人类生活、经济贸易和交通运输等提供资源,是沿海生态系统中能为人类可持续发展做出贡献的代表性区域[22]. 海湾和河口区域因受到人类活动的影响和与外界水交换的局限,生态系统的健康和完整性可能会受到损害[23]. 先前的研究对沿海区域水质进行分析,发现城市污水、农业和工业废水排放等人为污染输入,是造成沿海区域海水富营养化、有机污染和病原体、除草剂等有害物质积累严重的重要原因[24]. 随着时间的推移,沿海区域富营养化等环境问题将随着城市化、工业化进程的发展日趋严重,可能造成有害藻华的发生、低氧区的扩大和酸化的加剧等问题[25 − 26],而这将不可避免地影响甚至改变沿海生态系统浮游植物群落的结构功能和多样性[12],进而导致沿海生态系统受到生物资源枯竭和生物多样性减少的威胁. 此前对于此区域的研究多局限于重金属污染、海洋地质等方面[27 − 28],如徐林波等揭示了靖海湾悬浮颗粒物和沉积物中铅污染主要来源于人类生产生活活动[27];张先锋等发现靖海湾表层沉积物搬运方式受水动力条件影响而变化[28],而目前对靖海湾浮游植物群落的研究较少,且富营养化及其对浮游植物群落结构的影响研究尚未见报道. 因此,了解富营养化等环境问题对浮游植物群落的影响,有助于加强后续对靖海湾环境生态的管理和研究,对改善靖海湾沿海生态系统的稳定性、健康性和可持续性提供理论支持.
-
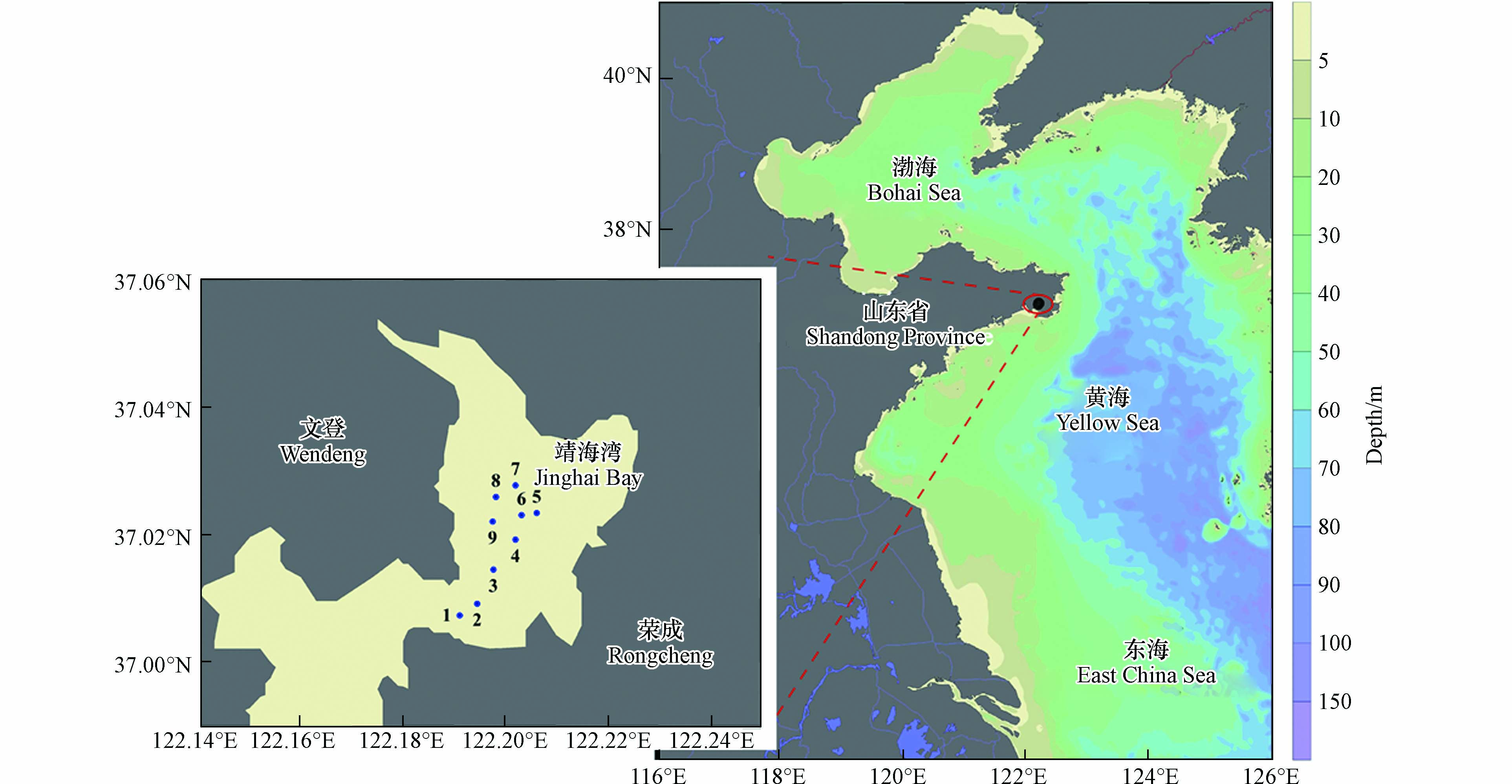
本研究分别于2021年和2022年的5月和8月(分别代表了春季和夏季)在靖海湾海域(37.01°—37.03°N,122.19°—122.21°E)展开了4个航次的调查(图1),共涵盖9个采样站位,且每个季节采样站位的位置都一致. 4个航次共采集了34个浮游植物样品,其中2021年度的8号站位缺少了浮游植物样品.
-
使用规格为10 L的Niskin瓶在表层(约2 m)收集海水样本. 使用YSI便携式多参数水质测量仪(ProDSS,美国)对水温、盐度、溶解氧(DO)和pH进行现场测定. 上述理化参数根据Wei等的标准方法进行校准[29]. 收集250 mL海水样品用于化学需氧量(COD)的测定,并在−20 ℃条件下迅速冷冻,在实验室中使用K2Cr2O7方法进行测定. 营养盐样品通过0.45 µm醋酸纤维素膜过滤器过滤以去除大颗粒,然后立即在−20 ℃条件下冷冻并尽快分析. 营养盐包括硝酸盐(NO3-N)、亚硝酸盐(NO2-N)、铵盐(NH4-N)和磷酸盐(PO4-P),根据Crouch和Malmstadt和Verdouw等描述的方法,使用Technicon AA3自动分析仪(Bran+Luebbe,Norderstedt,德国)测定营养盐的浓度[30 − 31]. 溶解无机氮(DIN)的浓度为硝酸盐、亚硝酸盐、铵盐的浓度之和[32],溶解无机磷(DIP)的浓度则以磷酸盐的浓度为代表. 此外,为避免检测限问题,将最低营养盐浓度设定为0.001 mg·L−1.
-
使用浅水Ⅲ型浮游生物网(网目尺寸约20 µm)通过垂直拖网收集表层(约2 m)浮游植物分析样品,然后用2%的稀释福尔马林溶液进行固定,并在黑暗条件下储存[18,32]. 此后,在实验室中使用100 mL的Utermöhl沉降柱将保存的样品浓缩24—48 h,然后使用倒置显微镜(Motic AE2000)在400倍和/或200倍的放大倍率下以Utermöhl描述的方法鉴定和计数浮游植物类群(>5 μm)[33]. 在低真空压力(<0.04 MPa)下,使用Whatman GF/F滤膜(25 mm)过滤用于叶绿素a(Chla)提取和定量的样品(约500 mL),然后在−20 ℃下快速冷冻[18]. 使用5 mL 90%的丙酮(4 ℃,黑暗中24 h)进行叶绿素a的提取. 去除滤膜后,根据Welschmeyer的荧光法,在Turner设计的荧光计上对Chla浓度进行定量测定[34]. 以上所有的生物和环境参数都使用相同的Niskin瓶中收集的水样测定.
-
根据Shannon-Wiener多样性指数(H’)、Pielou均匀度指数(J)和优势度指数(Y)分别计算了黄海沿岸浮游植物群落的多样性、均匀度和优势度[35]. 在本研究中,将优势度Y>0.02的物种作为优势种.
其中,S表示采集样品中浮游植物物种的总数,Pi表示某物种的相对细胞丰度,ni表示物种i的细胞数(单物种总和),N表示样品中细胞的总数,fi表示每个样品中物种i的出现频率.
应用富营养化指数(Ei)评价了研究海域的富营养化状况. Ei按以下公式(4)计算,其中,海水水质富营养化等级定义为轻度富营养化(1 ≤Ei≤ 3)、中度富营养化(3 <Ei≤ 9)和重度富营养化(Ei> 9)[22].
其中,Ei为富营养化指数,CCOD、CDIN和CDIP分别为COD、DIN和DIP的实测浓度(mg·L−1).
采用污染指数法评价海水有机污染程度[36],综合考虑了COD、DIN、DIP和DO对海水水质的影响. 有机污染指数(Ci)可通过以下评价公式(5)计算. 当1 ≤Ci≤ 3时,海水处于轻度有机污染状态;当Ci> 3时,海水则处于严重污染水平.
其中,Ci为有机污染指数,CCOD、CDIN、CDIP和CDO分别为COD、DIN、DIP和DO的实测浓度(mg·L−1);CCOD1、CDIN1、CDIP1和CDO1是标准浓度(分别为2、0.2、0.015和6 mg·L−1),符合《海水水质标准》的规定.
所有平均值以平均值±标准差(SD)表示. 采样站位图由Ocean Data View(v 5.6.2)绘制,利用Origin(v 2021)软件绘制了箱线图、柱状图、点线图、散点图. 相关性热图使用TB tools软件绘制. 使用SPSS 26进行了Pearson相关性分析. 冗余分析(RDA)用于评估丰度、多样性指数、均匀度指数与环境参数之间的关系(Canoco v.5).
-
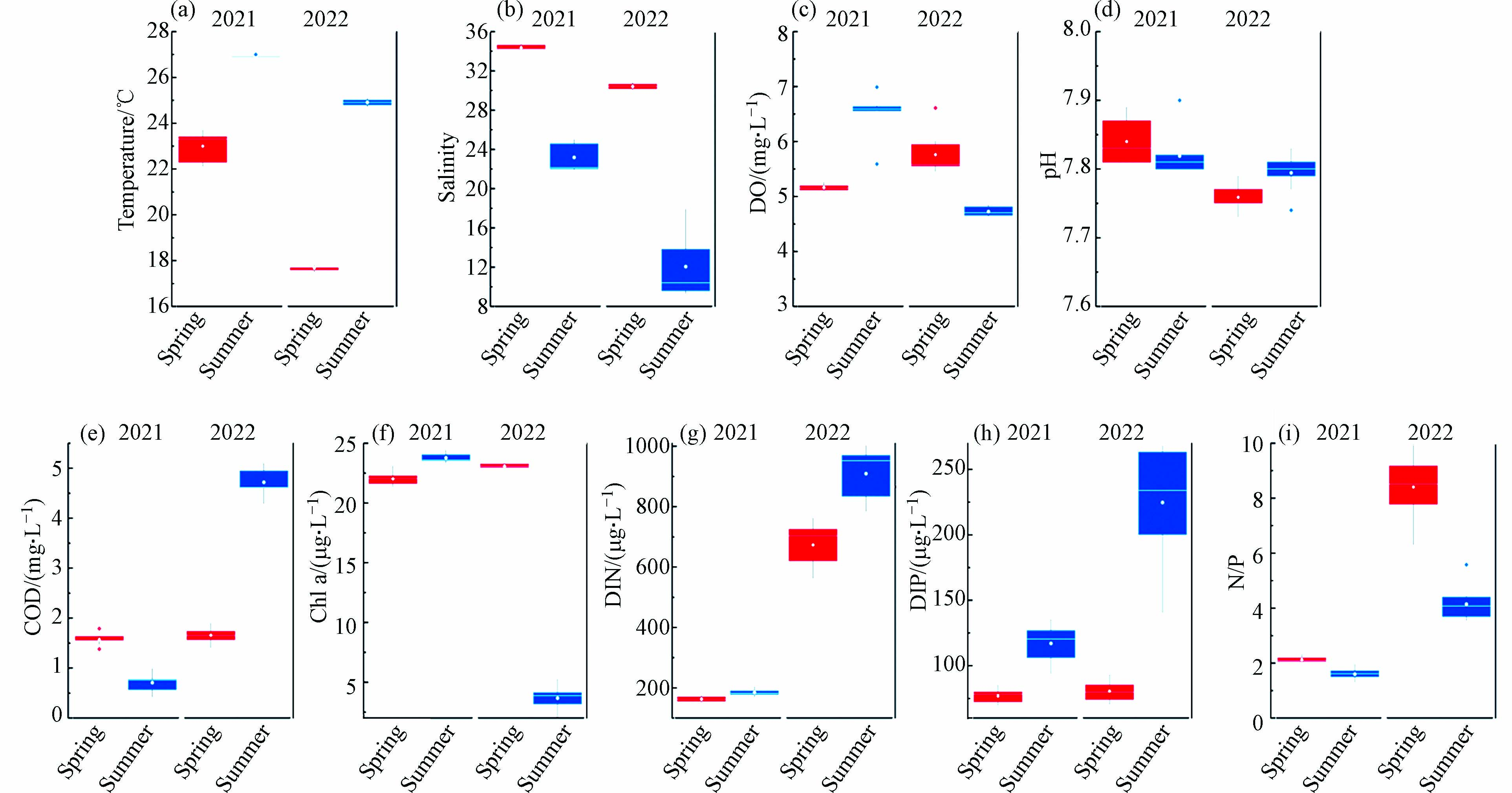
靖海湾研究区域表层海水各环境参数的年际和季节变化如图2所示,各环境参数范围及平均值见表1. 研究区域水温范围在17.50—27.00 ℃之间,呈现出明显的季节变化特征,夏季水温明显高于春季(图2a). 同时,水温存在较明显的年际变化,2021年春夏两季水温高于2022年春夏水温(图2a,表1). 2021年和2022年研究区域的盐度(变化范围为9.30—34.68)都呈现出夏季低于春季的季节变化趋势,这通常是夏季降水量增大和地表径流量增加导致的. 此外,研究区域盐度的年际变化也较为显著,呈现出2021年高于2022年的变化特征(图2b,表1). 溶解氧(DO)的含量介于4.64—6.99 mg·L−1之间,年际变化和季节变化趋势不明显(图2c). 2021年和2022年春夏两季研究海区pH的变化范围为7.73—7.90,在年际变化上呈现出略微下降的趋势,但在季节变化上不明显(图2d). 化学需氧量(COD)的平均含量(0.72—4.72 mg·L−1)在2021年和2022年出现了较为明显的年际变化趋势,2022年COD的平均含量明显高于2021年,且在2022年夏季出现了极大值(图2e). 研究区域的叶绿素a含量变化范围为1.83—24.42 µg·L−1,且在2022年存在极为显著的季节变化,2022年夏季出现了明显的极小值,而其他3个季节没有明显差异(图2f,表1). 研究区域的溶解无机氮(DIN)含量变化范围为152.75—1007.12 µg·L−1,溶解无机磷(DIP)含量变化范围为69.59—271.80 µg·L−1,营养盐含量呈现出相似的季节和年际分布趋势,即春季含量低于夏季,2022年营养盐含量高于2021年营养盐含量. 靖海湾研究区域N/P比值分布范围为1.30—10.01,其中2022年春季平均N/P比值最高(8.41±1.11),2021年夏季平均N/P比值最低(1.60±0.20)(表1). N/P比值呈现出相似的季节变化趋势,即春季高于夏季,且2022年N/P比值明显高于2021年.
-
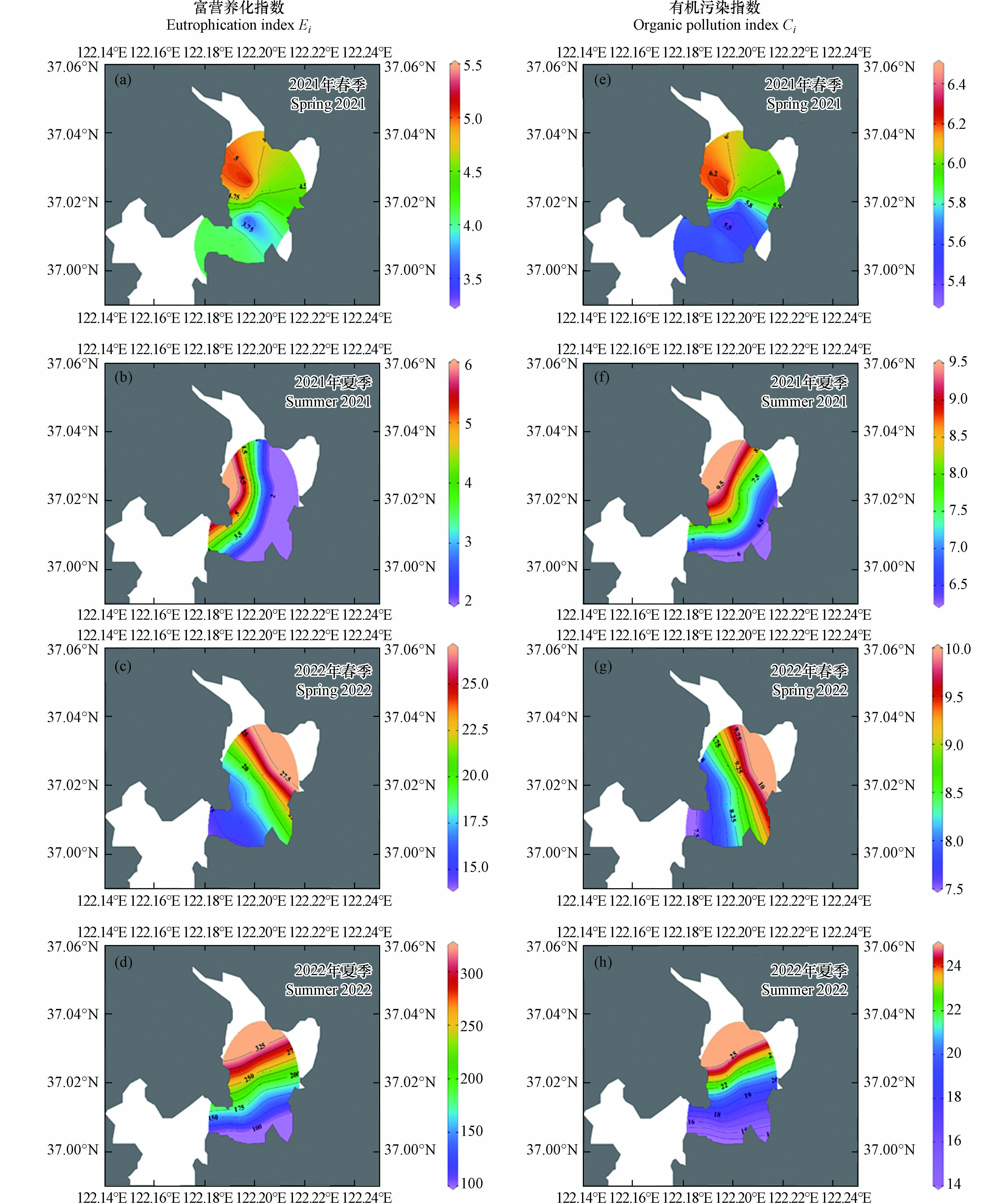
富营养化指数(Ei)和有机污染指数(Ci)在2021年和2022年春夏两季都表现出了逐渐上升的趋势(图3),且在2022年夏季两项指数均达到了极大值. 从平均值来看,2021年富营养化指数(3.42—4.40)介于3—9之间,属于中度富营养化;而在2022年富营养化指数(20.10—219.80)远远超过9,属于重度富营养化. 此外,2021年(5.86—8.00)和2022年(8.61—21.10)的平均有机污染指数(Ci)均超过重度有机污染标准3,因此表明该研究区域在2021年及2022年春夏两季都面临重度有机污染问题,应当引起重视. 富营养化指数(Ei)和有机污染指数(Ci)的平面分布在相同年份的相同季节呈现出相似的分布情况(图4),且两项指数都在靠近研究区域北部的站位观察到较高的数值,这可能是受到地表径流(如青龙河)的输入影响较大.
-
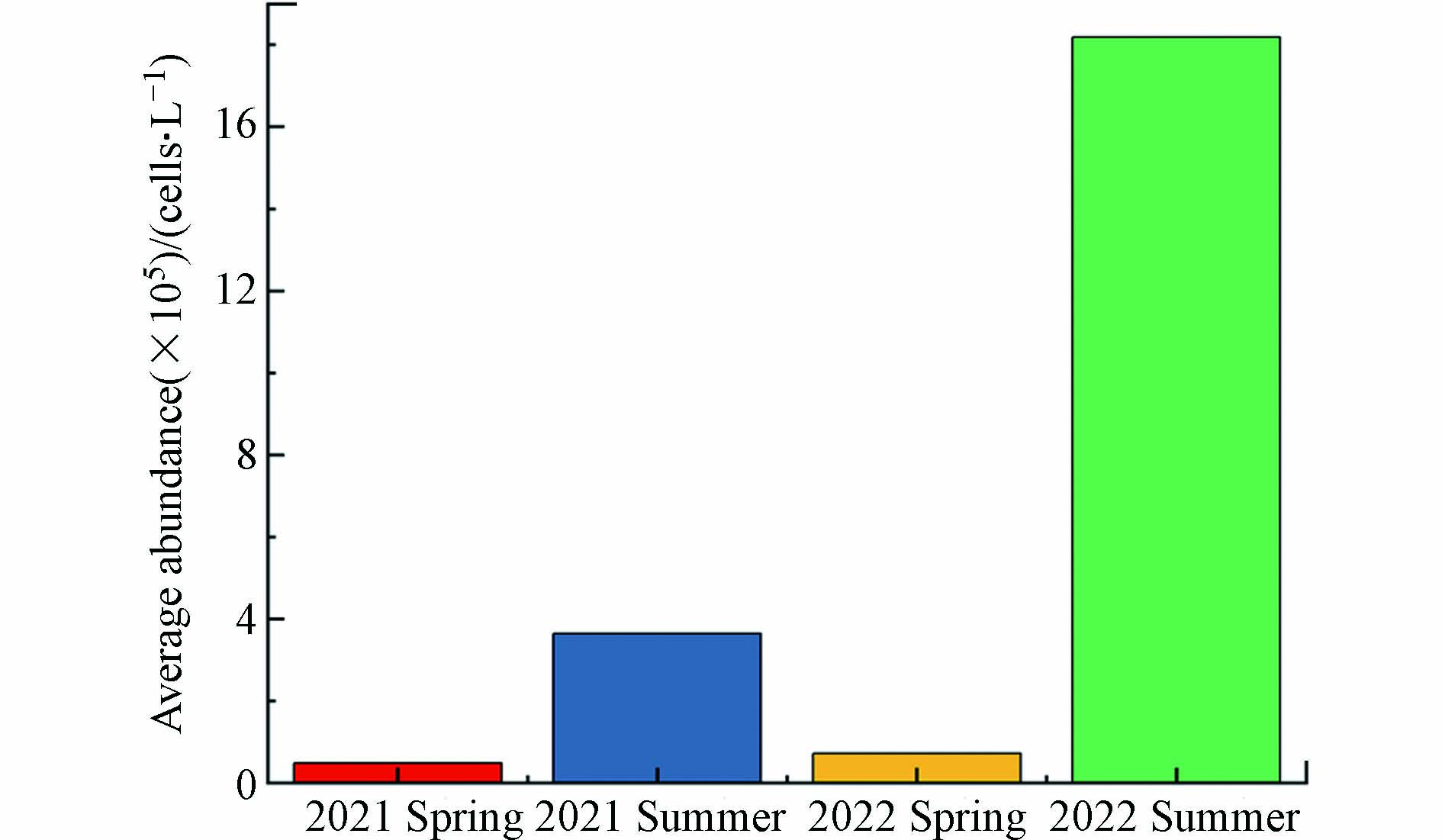
研究区域2021年浮游植物丰度在0.135×105—7.320×105 cells·L−1之间,平均值为2.063×105 cells·L−1;2022年浮游植物丰度介于0.270×105—51.390×105 cells·L−1,平均值为9.456×105 cells·L−1. 在同一年度中,浮游植物丰度呈现夏季高于春季的特点,2021年夏季浮游植物平均丰度为3.644×105 cells·L−1,高于同年春季浮游植物平均丰度(0.483×105 cells·L−1). 2022年春季浮游植物平均丰度为0.727×105 cells·L−1,与2021年春季相近,而2022年夏季浮游植物平均丰度(18.185×105 cells·L−1)远高于其他3个季节(图5).
-
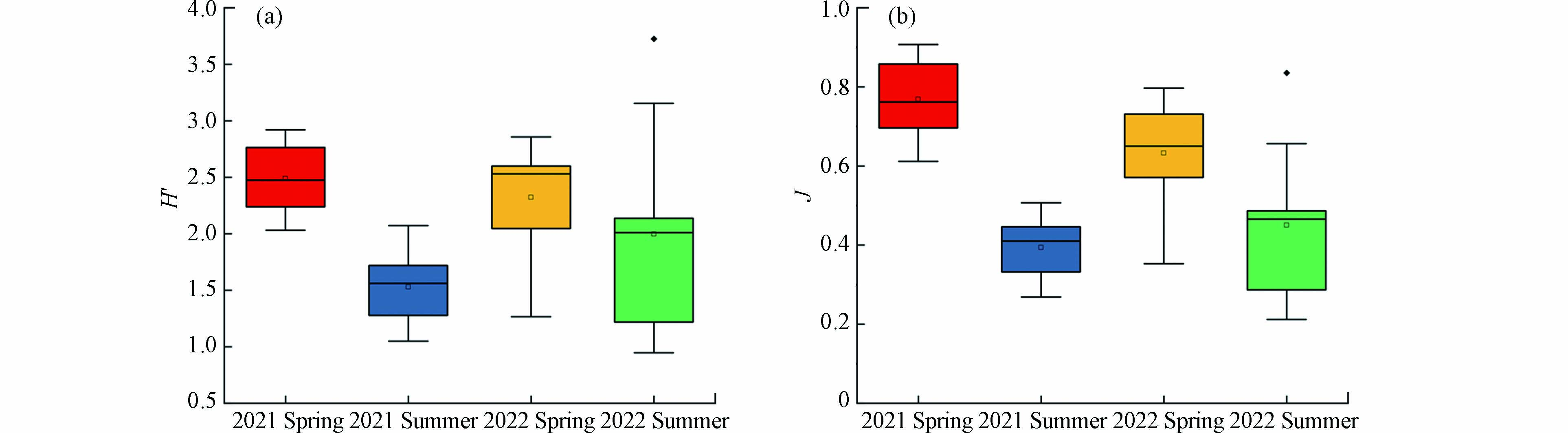
多样性指数(H′)和均匀度指数(J)分别用于评估群落结构的复杂性和评价群落是否稳定(公式1和2). 在研究区域,多样性指数(H′)分布范围在0.95—3.72之间,均匀度指数(J)分布范围在0.21—0.91之间. H′和J指数在靖海湾的2年4个季节的季节变化上展示出了相似的分布模式(图6),即在同一年中多样性指数和均匀度指数均为春季高于夏季,表明两年中春季的生物多样性优于夏季. 靖海湾研究区域多样性指数(H′)和均匀度指数(J)的具体年际和季节数值见表2.
-
2021年和2022年春夏两季在靖海湾研究区域共鉴定出150个浮游植物物种(>5 μm),属于6个门(即硅藻门、甲藻门、金藻门、蓝藻门、绿藻门和裸藻门)(表3). 结果表明,靖海湾春夏两季浮游植物群落主要由硅藻和甲藻组成,分别鉴定出123种硅藻(占浮游植物总分类群的82.00%)和13种甲藻(占总物种的8.67%). 其他类群中的物种数量较少(<5%),包括在2021年和2022年春季都观察到的1种金藻(占0.67%),以及只在2022年夏季观察到的5种蓝藻(3.33%)、6种绿藻(4.00%)和1种裸藻(占0.67%). 因此,这些结果表明2021年和2022年春夏两季靖海湾浮游植物群落主要由硅藻和甲藻组成. 靖海湾各季节浮游植物具体分类情况如表3所示.
-
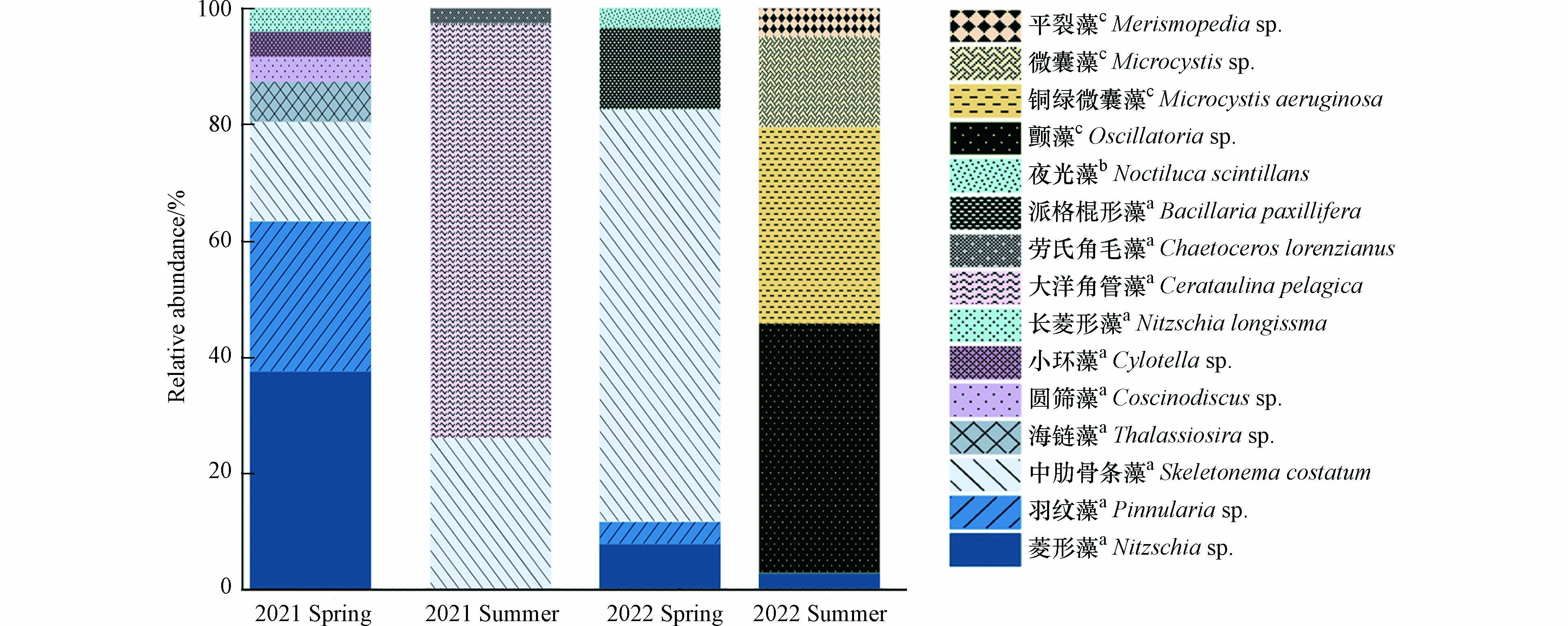
本研究选取了优势度指数(Y)大于0.02的物种作为优势种,各季节优势种的丰度、出现频率和优势度指数如表4所示. 在优势种中,除了出现在2022年春季的夜光藻(Noctiluca scintillans)(属于甲藻门)以及出现在2022年夏季的颤藻(Oscillatoria sp.)、铜绿微囊藻(Microcystis aeruginosa)、微囊藻(Microcystis sp.)和平裂藻(Merismopedia sp.)(属于蓝藻门)之外,其余物种都属于硅藻门,这些结果进一步证实了靖海湾研究区域的浮游植物群落以硅藻为主. 如图7所示,浮游植物优势种的丰度在2022年夏季最高,其次是2021年夏季,这与图5体现的结果一致. 优势种中,中肋骨条藻(Skeletonemacostatum)和菱形藻(Nitzschia sp.)均在2年中的3个季节出现(图7和表4). 靖海湾浮游植物优势种的年际变化较大,尤其是2022年夏季优势种所属类群出现了明显的变化,属于蓝藻门的物种占比上升(图8).
-
本研究中,浮游植物群落主要是由硅藻和甲藻组成的(表3),且2021年和2022年春夏两季的优势种除夜光藻、颤藻、铜绿微囊藻、微囊藻和平裂藻之外,都属于硅藻门,占浮游植物总分类群的82.00%(表4). 本研究得到的上述结果与先前对中国海域浮游植物群落的研究结果相一致,Guo等研究了东海浮游植物的季节变化,并得出了东海中的浮游植物群落主要由硅藻和甲藻组成的结论[18];Zhong等对南海北部珠江口海域的浮游植物群落进行了研究,发现链状硅藻主导了研究区域浮游植物群落[37]. 此外,游剑涛对福建三沙湾及邻近开放海域开展了浮游植物与环境要素的同步采样分析,发现研究区域浮游植物类群以硅藻为主[38];Wei等考察了浮游植物群落对渤海当前变化的环境的反应,并表明了硅藻是过去3年中数量最多、种类最多的类群,平均分别占总丰度和分类群的约78%和约82%[39]. 各种基于实验室和实地考察研究的理论都表明,浮游植物群落组成总是与所处环境中各种物理化学变量的波动相关[12]. 之前的研究中,浮游植物群落组成和丰度主要受各种环境参数的共同影响,如营养水平、水温、盐度、水团运动、极端天气、光照的可用性等[18,39 − 40]. 湍流等水动力因素也有可能会对海洋浮游植物的群落组成造成影响[18],硅藻由于自身细胞壁的保护,在具有较为剧烈湍流等水体运动的海域可以正常生长生活,而甲藻的细胞结构及代谢过程都容易受到水体运动的影响而被破坏,进而在丰度上低于硅藻. 此外,极端天气例如台风等,也可能改变海洋中的物理或化学环境因素,进而给研究区域浮游植物的群落组成带来影响. 2022年8月台风“桑达”影响到山东半岛区域,带来了较强的降水和风浪. 由台风引起的强烈垂直混合,以及上升流和海洋涡旋,可以把营养物质从海洋底部携带到表层[41 − 42]. 而在近岸地区,台风带来的强降水使得河流等地表径流水量增加,在短期内增加了河口的淡水输入,进而更多地把来自陆地的营养盐输送到海水中,造成海水中营养盐水平的上升[43 − 44]. 由于浮游植物的生长受温度、盐度和营养盐浓度等因素的影响较大,因此台风可以导致浮游植物群落和生物量发生变化,甚至引发赤潮等藻华现象[42,45]. 这解释了2022年夏季DIN和DIP等营养盐浓度明显高于其他3个季节(图2),且2022年夏季靖海湾的浮游植物丰度远高于2021年春夏季和2022年春季(图5)的原因. 在本研究中,2022年夏季的优势种中颤藻、铜绿微囊藻、微囊藻和平裂藻都属于淡水藻类(表4),这可能是由于淡水输入量在短期内的迅速增加,一些淡水藻类会随径流汇入靖海湾中,并且在高营养盐的情况下生长. 综上所述,可能是台风造成的淡水径流和沿岸河流营养盐输入的增加促进了靖海湾内浮游植物的生长、增殖和扩张.
-
通过冗余分析(RDA)可以确定哪些环境因素影响浮游植物丰度的变化,并对控制黄海沿岸浮游植物丰度季节动态的决定因素进行了一些深入了解(图9). 根据RDA分析结果,2021年春季浮游植物的丰度与富营养化指数(Ei)、有机污染指数(Ci)和pH呈负相关关系(图9a),与之类似的是,2021年夏季浮游植物丰度与富营养化指数(Ei)、温度呈负相关关系(图9b). 2022年春季浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)呈正相关关系(图9c),2022年夏季浮游植物丰度与温度、盐度和N/P呈负相关关系(图9d). 此外,由于研究区域富营养化和有机污染水平比较严重(图3),本研究使用Pearson相关性分析对富营养化指数(Ei)和有机污染指数(Ci)与丰度和多样性指数、均匀度指数的潜在影响进行了评估(图10),发现2021年春夏两季浮游植物丰度与富营养化指数(Ei)呈现显著负相关关系,而在2022年春夏两季浮游植物丰度与富营养化指数(Ei)呈现出正相关关系,这可能与2022年研究区域优势种的变化有关. 以上结果表明,富营养化指数(Ei)与其他环境参数相比较而言对浮游植物群落的丰度影响更大,因此认为富营养化可能是影响靖海湾浮游植物群落动态变化的关键因素.
-
全球沿海地区的经济快速发展和城市化进程加速对沿海生态系统的稳定性和可持续性产生了深远的影响[42,46]. 由于营养水平负荷增大而造成的沿海水域富营养化被认为是最受关注的环境问题之一[34]. 可以预见到的是,如果不采取适当的措施以平衡或抵消人类活动对环境造成的负面影响,沿海生态系统的环境状况极有可能在未来数十年进一步恶化[47 − 48].
在本研究中,2021和2022年的春夏两季的浮游植物丰度都与富营养化指数(Ei)具有相关性(图9). 2021年春夏两季,浮游植物丰度与富营养化指数(Ei)呈现出负相关关系,其中2021年春季是显著负相关关系(P<0.05),而在2022年春夏季浮游植物丰度与富营养化指数(Ei)呈正相关(图10). 本实验已经观察到靖海湾在2021年和2022年春夏季富营养化指数(Ei)分别处于中度富营养化和重度富营养化水平,且在2022年夏季富营养化指数(Ei)出现了极大值(图3). 此外,2021年和2022年靖海湾生物多样性水平表现为春季优于夏季(表2),并且在2022年夏季优势种尤其是属于蓝藻门的颤藻、铜绿微囊藻、微囊藻和平裂藻丰度急剧上升,即在靖海湾出现了蓝藻增长的现象(图7,图8). 先前的研究表明,河流等地表径流的汇入是污染物进入沿海环境的主要途径,约占污染物输入量的50%[24,49],通过河流汇入沿海生态系统的营养元素(如氮和磷等)可以显著刺激浮游植物的初级生产力[12]. 孔等发现,由于营养负荷过大,富营养化水平增加,黄海沿岸海域在春季和夏季同时观察到了绿潮、金潮和赤潮的爆发[50]. Li等研究发现,受到海洋酸化、变暖和富营养化的综合影响,黄海北部海域海洋钙化生物和底栖生态系统正受到越来越大的威胁[51]. 被威海市包围的靖海湾将不可避免地受到环境条件变化的影响,进而使得浮游植物群落结构和多样性发生变化. 大量研究表明,与营养盐含量密切相关的富营养化会提高浮游植物的生长和代谢率,大大促进浮游植物的生长繁殖,经常会导致藻类(包括有毒或有害藻类)的大量繁殖[15,25,52]. 因此,有害藻华发生的频率、强度和持续时间将因富营养化水平的上升而增加[12,22,53]. 在本研究中,2022年夏季的台风“桑达”带来的强降水使得属于淡水藻类的颤藻、铜绿微囊藻、微囊藻和平裂藻等蓝藻进入靖海湾,并且丰度远高于其他3个季节的优势种(图7),通过Pearson相关性分析发现它们的丰度与富营养化指数(Ei)呈正相关关系(图10),这可能与蓝藻自身的生理特征有关. 例如,Fujimoto等认为铜绿微囊藻对营养盐(氮、磷)的结合能力高于其他藻类,这为铜绿微囊藻在富营养化水体中的迅速增殖提供了基础[54]. 先前的研究得到,蓝藻可以通过化感作用机制降低其他浮游植物的丰度[55 − 56],从而成为浮游植物群落中的优势种. Willén等指出,蓝藻门中的颤藻、平裂藻等被认为是富营养的种类[57],且蓝藻数量随季节发生短时间内急速增长的现象,可以作为水体富营养化的严重程度的标志[58]. 此外,观察到2022年夏季营养盐含量及浮游植物丰度高于其余3个季节(图2g和h,图5),叶绿素a含量却低于其余3个季节(图2f),此前研究的结果通常是浮游植物丰度与叶绿素a含量呈正相关分布,叶绿素a含量的水平可以间接用作浮游植物丰度的指标[39,59],这与本文的结果相反,推测出现此相反结果的原因可能是与浮游动物的选择性摄食有关[60]. 同时,靖海湾面积较小且被威海市包围,调查期间该海域环境受人类活动、气象因素等影响大,这可能在一定程度上影响叶绿素a含量[61].
-
靖海湾作为典型半封闭海湾和河口区域,容易受到附近城市人类活动影响而造成环境污染,出现富营养化等环境问题,威胁到沿海生态系统的健康和可持续性发展. 本文研究显示,靖海湾浮游植物群落组成以硅藻和甲藻为主,而在2022年夏季出现了蓝藻的大量增长,富营养化可能是影响靖海湾浮游植物群落的关键因素.
富营养化对靖海湾浮游植物群落的影响
Effects of eutrophication on phytoplankton community in Jinghai Bay
-
摘要: 海洋浮游植物在维持海洋生物泵的运转中起着至关重要的作用,对全球生物地球化学循环产生巨大影响. 海湾和河口区域因受到人类活动的影响较大且与外界水交换的局限,容易出现富营养化等威胁生态系统稳定性的问题,因此研究沿海生态系统中富营养化与浮游植物群落之间的关系有助于维持生态系统的健康和可持续性发展. 本研究于2021年和2022年的5月和8月对靖海湾进行了4个航次的调查,研究了春夏两季浮游植物群落和环境因素之间的关系. 结果表明,2021年和2022年春夏两季在靖海湾共观察到150个浮游植物物种,浮游植物群落主要由硅藻和甲藻组成,且在2022年夏季出现了蓝藻的大量增长;两年的生物多样性均为春季高于夏季,富营养化指数(Ei)出现了明显的上升,由2021年的中度富营养化变为2022年的重度富营养化. 通过冗余分析和Pearson相关性分析发现,富营养化可能是影响靖海湾浮游植物群落的关键因素. 本研究的结果有助于后续为改善靖海湾沿海生态系统的稳定性、健康性和可持续性提供理论支持.Abstract: Marine phytoplankton play a vital role in maintaining the operation of the marine biological pump and have a huge impact on the global biogeochemical cycle. Due to the great influence of human activities and the limited water exchange with the outside sea, the bay and estuary regions are prone to problems such as eutrophication that threaten ecosystem stability. Therefore, studying the relationship between eutrophication and phytoplankton communities incoastal ecosystems is helpful to maintain the health and sustainable development of the ecosystems. In this study, four cruises were carried out in May and August of 2021 and 2022 in Jing Bay to investigate the relationship between phytoplankton communities and environmental factors in spring and summer. The results showed that a total of 150 phytoplankton species were observed in the spring and summer of 2021 and 2022 in Jinghai Bay, and the phytoplankton community was mainly composed of diatoms and dinoflagellate, and a large number of cyanobacteria increased in the summer of 2022. Biodiversity in spring was higher than that in summer in both years, and the eutrophication index (Ei) showed a significant increase, from moderate eutrophication in 2021 to severe eutrophication in 2022. The redundancy analysis and Pearson correlation analysis results indicated that eutrophication may be the key factor affecting the phytoplankton community in Jinghai Bay. The results of this study are helpful to provide theoretical support for improving the stability, health and sustainability of the coastal ecosystem in Jinghai Bay.
-
Key words:
- phytoplankton /
- Bacillariophyta and Dinophyta /
- community composition /
- eutrophication /
- Jinghai Bay
-
海洋浮游植物的生物量仅占生物圈初级生产者生物量的0.2%,但贡献的初级生产量约占全球初级净产量的50%[1 − 3]. 浮游植物广泛分布于海洋上层和河口环境中[4],在调节海洋生物泵和全球生物化学地球循环方面发挥着重要作用[5],是浮游动物和海洋渔业的重要食物来源[6 − 7]. 通过利用光作为主要能源,海洋浮游植物的生长通过食物链满足了较高营养级生物的能源需求,并支持了海洋生态系统的正常运行[8]. 同时,海洋浮游植物具有繁殖周期短和对环境变化敏感的特点[9 − 10]. 通常来说,环境条件的变化会直接影响到浮游植物的群落结构和多样性[11 − 12]. 例如,海洋暖化可增加浮游植物的多样性[13],营养物质的有效性、温度和辐照度可能影响浮游植物群落的粒径大小[14];此外,气候变化的间接影响,例如营养负荷的增加,可能比温度对浮游植物产生的直接影响更深远[15]. 同时,浮游植物群落的动态变化是反映海洋生态系统和环境变化的最佳指标,这在很大程度上是由于浮游植物群落动态与环境变化之间的紧密联系[16 − 17]. 因此,研究浮游植物群落结构及其影响因素对于理解海洋环境的变化以及海洋生态系统的结构和功能具有重要意义[18 − 19].
靖海湾是面积为140 km2的半封闭海湾,位于山东半岛东部,于2007年设立了松江鲈鱼水产种质资源保护区[20],是青龙河和蔡官庄河的入海口所在地,接收了大量来自威海市的工业、农业和城市废水排放[21]. 靖海湾作为典型的河口和海湾区域,能够为人类生活、经济贸易和交通运输等提供资源,是沿海生态系统中能为人类可持续发展做出贡献的代表性区域[22]. 海湾和河口区域因受到人类活动的影响和与外界水交换的局限,生态系统的健康和完整性可能会受到损害[23]. 先前的研究对沿海区域水质进行分析,发现城市污水、农业和工业废水排放等人为污染输入,是造成沿海区域海水富营养化、有机污染和病原体、除草剂等有害物质积累严重的重要原因[24]. 随着时间的推移,沿海区域富营养化等环境问题将随着城市化、工业化进程的发展日趋严重,可能造成有害藻华的发生、低氧区的扩大和酸化的加剧等问题[25 − 26],而这将不可避免地影响甚至改变沿海生态系统浮游植物群落的结构功能和多样性[12],进而导致沿海生态系统受到生物资源枯竭和生物多样性减少的威胁. 此前对于此区域的研究多局限于重金属污染、海洋地质等方面[27 − 28],如徐林波等揭示了靖海湾悬浮颗粒物和沉积物中铅污染主要来源于人类生产生活活动[27];张先锋等发现靖海湾表层沉积物搬运方式受水动力条件影响而变化[28],而目前对靖海湾浮游植物群落的研究较少,且富营养化及其对浮游植物群落结构的影响研究尚未见报道. 因此,了解富营养化等环境问题对浮游植物群落的影响,有助于加强后续对靖海湾环境生态的管理和研究,对改善靖海湾沿海生态系统的稳定性、健康性和可持续性提供理论支持.
1. 材料和方法(Materials and methods)
1.1 研究区域和采样站位
本研究分别于2021年和2022年的5月和8月(分别代表了春季和夏季)在靖海湾海域(37.01°—37.03°N,122.19°—122.21°E)展开了4个航次的调查(图1),共涵盖9个采样站位,且每个季节采样站位的位置都一致. 4个航次共采集了34个浮游植物样品,其中2021年度的8号站位缺少了浮游植物样品.
1.2 样品采集与分析
1.2.1 环境参数
使用规格为10 L的Niskin瓶在表层(约2 m)收集海水样本. 使用YSI便携式多参数水质测量仪(ProDSS,美国)对水温、盐度、溶解氧(DO)和pH进行现场测定. 上述理化参数根据Wei等的标准方法进行校准[29]. 收集250 mL海水样品用于化学需氧量(COD)的测定,并在−20 ℃条件下迅速冷冻,在实验室中使用K2Cr2O7方法进行测定. 营养盐样品通过0.45 µm醋酸纤维素膜过滤器过滤以去除大颗粒,然后立即在−20 ℃条件下冷冻并尽快分析. 营养盐包括硝酸盐(NO3-N)、亚硝酸盐(NO2-N)、铵盐(NH4-N)和磷酸盐(PO4-P),根据Crouch和Malmstadt和Verdouw等描述的方法,使用Technicon AA3自动分析仪(Bran+Luebbe,Norderstedt,德国)测定营养盐的浓度[30 − 31]. 溶解无机氮(DIN)的浓度为硝酸盐、亚硝酸盐、铵盐的浓度之和[32],溶解无机磷(DIP)的浓度则以磷酸盐的浓度为代表. 此外,为避免检测限问题,将最低营养盐浓度设定为0.001 mg·L−1.
1.2.2 生物参数
使用浅水Ⅲ型浮游生物网(网目尺寸约20 µm)通过垂直拖网收集表层(约2 m)浮游植物分析样品,然后用2%的稀释福尔马林溶液进行固定,并在黑暗条件下储存[18,32]. 此后,在实验室中使用100 mL的Utermöhl沉降柱将保存的样品浓缩24—48 h,然后使用倒置显微镜(Motic AE2000)在400倍和/或200倍的放大倍率下以Utermöhl描述的方法鉴定和计数浮游植物类群(>5 μm)[33]. 在低真空压力(<0.04 MPa)下,使用Whatman GF/F滤膜(25 mm)过滤用于叶绿素a(Chla)提取和定量的样品(约500 mL),然后在−20 ℃下快速冷冻[18]. 使用5 mL 90%的丙酮(4 ℃,黑暗中24 h)进行叶绿素a的提取. 去除滤膜后,根据Welschmeyer的荧光法,在Turner设计的荧光计上对Chla浓度进行定量测定[34]. 以上所有的生物和环境参数都使用相同的Niskin瓶中收集的水样测定.
1.3 数据分析
根据Shannon-Wiener多样性指数(H’)、Pielou均匀度指数(J)和优势度指数(Y)分别计算了黄海沿岸浮游植物群落的多样性、均匀度和优势度[35]. 在本研究中,将优势度Y>0.02的物种作为优势种.
H′=−∑Si=1Pilog2Pi (1) J=H′log2S (2) Y=niNfi (3) 其中,S表示采集样品中浮游植物物种的总数,Pi表示某物种的相对细胞丰度,ni表示物种i的细胞数(单物种总和),N表示样品中细胞的总数,fi表示每个样品中物种i的出现频率.
应用富营养化指数(Ei)评价了研究海域的富营养化状况. Ei按以下公式(4)计算,其中,海水水质富营养化等级定义为轻度富营养化(1 ≤Ei≤ 3)、中度富营养化(3 <Ei≤ 9)和重度富营养化(Ei> 9)[22].
Ei=CCOD×CDIN×CDIP4500×106 (4) 其中,Ei为富营养化指数,CCOD、CDIN和CDIP分别为COD、DIN和DIP的实测浓度(mg·L−1).
采用污染指数法评价海水有机污染程度[36],综合考虑了COD、DIN、DIP和DO对海水水质的影响. 有机污染指数(Ci)可通过以下评价公式(5)计算. 当1 ≤Ci≤ 3时,海水处于轻度有机污染状态;当Ci> 3时,海水则处于严重污染水平.
Ci=CCODCCOD1+CDINCDIN1+CDIPCDIP1−CDOCDO1 (5) 其中,Ci为有机污染指数,CCOD、CDIN、CDIP和CDO分别为COD、DIN、DIP和DO的实测浓度(mg·L−1);CCOD1、CDIN1、CDIP1和CDO1是标准浓度(分别为2、0.2、0.015和6 mg·L−1),符合《海水水质标准》的规定.
所有平均值以平均值±标准差(SD)表示. 采样站位图由Ocean Data View(v 5.6.2)绘制,利用Origin(v 2021)软件绘制了箱线图、柱状图、点线图、散点图. 相关性热图使用TB tools软件绘制. 使用SPSS 26进行了Pearson相关性分析. 冗余分析(RDA)用于评估丰度、多样性指数、均匀度指数与环境参数之间的关系(Canoco v.5).
2. 结果与讨论(Results and discussion)
2.1 研究区域环境参数概况
靖海湾研究区域表层海水各环境参数的年际和季节变化如图2所示,各环境参数范围及平均值见表1. 研究区域水温范围在17.50—27.00 ℃之间,呈现出明显的季节变化特征,夏季水温明显高于春季(图2a). 同时,水温存在较明显的年际变化,2021年春夏两季水温高于2022年春夏水温(图2a,表1). 2021年和2022年研究区域的盐度(变化范围为9.30—34.68)都呈现出夏季低于春季的季节变化趋势,这通常是夏季降水量增大和地表径流量增加导致的. 此外,研究区域盐度的年际变化也较为显著,呈现出2021年高于2022年的变化特征(图2b,表1). 溶解氧(DO)的含量介于4.64—6.99 mg·L−1之间,年际变化和季节变化趋势不明显(图2c). 2021年和2022年春夏两季研究海区pH的变化范围为7.73—7.90,在年际变化上呈现出略微下降的趋势,但在季节变化上不明显(图2d). 化学需氧量(COD)的平均含量(0.72—4.72 mg·L−1)在2021年和2022年出现了较为明显的年际变化趋势,2022年COD的平均含量明显高于2021年,且在2022年夏季出现了极大值(图2e). 研究区域的叶绿素a含量变化范围为1.83—24.42 µg·L−1,且在2022年存在极为显著的季节变化,2022年夏季出现了明显的极小值,而其他3个季节没有明显差异(图2f,表1). 研究区域的溶解无机氮(DIN)含量变化范围为152.75—1007.12 µg·L−1,溶解无机磷(DIP)含量变化范围为69.59—271.80 µg·L−1,营养盐含量呈现出相似的季节和年际分布趋势,即春季含量低于夏季,2022年营养盐含量高于2021年营养盐含量. 靖海湾研究区域N/P比值分布范围为1.30—10.01,其中2022年春季平均N/P比值最高(8.41±1.11),2021年夏季平均N/P比值最低(1.60±0.20)(表1). N/P比值呈现出相似的季节变化趋势,即春季高于夏季,且2022年N/P比值明显高于2021年.
表 1 2021和2022年春季和夏季靖海湾环境参数的范围和平均值Table 1. Range and mean values of environmental parameters in the spring and summer of Jinghai Bay in 2021 and 2022环境参数Environmental parameters 2021年春季2021 Spring 2021年夏季2021 Summer 2022年春季2022 Spring 2022年夏季2022 Summer 温度/℃ 范围 22.1—23.70 26.90—27.00 17.50—17.80 24.70—25.10 平均值 23.00 ±0.61 26.92±0.04 17.68±0.10 24.91±0.13 盐度 范围 34.18—34.68 21.94—25.02 30.07—30.81 9.30—17.90 平均值 34.37±0.21 23.18±1.40 30.41±0.27 12.06±3.18 DO/(mg L−1) 范围 5.11—5.26 5.59—6.99 5.45—6.61 4.64—6.85 平均值 5.16±0.05 6.52±0.38 5.76±0.37 4.73±0.08 pH 范围 7.81—7.89 7.80—7.90 7.73—7.79 7.74—7.83 平均值 7.84±0.03 7.82±0.03 7.76±0.02 7.79±0.03 COD/(mg L−1) 范围 1.38—1.79 0.42—0.99 1.40—1.90 4.28—5.10 平均值 1.58±0.12 0.72±0.20 1.66±0.16 4.72±0.28 Chla/(µg L−1) 范围 21.36—23.09 23.33—24.42 22.82—23.30 1.83—5.26 平均值 22.01±0.54 23.77±0.40 23.08±0.18 3.66±0.97 DIN/(µg L−1) 范围 152.75—173.87 168.57—204.15 562.18—762.46 783.13—1007.12 平均值 162.93±7.28 185.08±11.79 673.10±72.40 909.25±84.94 DIP/(µg L−1) 范围 69.59—85.49 93.51—135.63 70.23—93.26 140.31—271.80 平均值 76.82±5.16 117.05±13.61 80.62±7.66 224.72±43.15 N/P 范围 2.03—2.33 1.30—1.96 6.30—10.01 3.54—5.58 平均值 2.13±0.10 1.60±0.20 8.41±1.11 4.14±0.63 2.2 富营养化指数和有机污染指数
富营养化指数(Ei)和有机污染指数(Ci)在2021年和2022年春夏两季都表现出了逐渐上升的趋势(图3),且在2022年夏季两项指数均达到了极大值. 从平均值来看,2021年富营养化指数(3.42—4.40)介于3—9之间,属于中度富营养化;而在2022年富营养化指数(20.10—219.80)远远超过9,属于重度富营养化. 此外,2021年(5.86—8.00)和2022年(8.61—21.10)的平均有机污染指数(Ci)均超过重度有机污染标准3,因此表明该研究区域在2021年及2022年春夏两季都面临重度有机污染问题,应当引起重视. 富营养化指数(Ei)和有机污染指数(Ci)的平面分布在相同年份的相同季节呈现出相似的分布情况(图4),且两项指数都在靠近研究区域北部的站位观察到较高的数值,这可能是受到地表径流(如青龙河)的输入影响较大.
2.3 研究区域浮游植物概况
2.3.1 浮游植物丰度和细胞密度
研究区域2021年浮游植物丰度在0.135×105—7.320×105 cells·L−1之间,平均值为2.063×105 cells·L−1;2022年浮游植物丰度介于0.270×105—51.390×105 cells·L−1,平均值为9.456×105 cells·L−1. 在同一年度中,浮游植物丰度呈现夏季高于春季的特点,2021年夏季浮游植物平均丰度为3.644×105 cells·L−1,高于同年春季浮游植物平均丰度(0.483×105 cells·L−1). 2022年春季浮游植物平均丰度为0.727×105 cells·L−1,与2021年春季相近,而2022年夏季浮游植物平均丰度(18.185×105 cells·L−1)远高于其他3个季节(图5).
2.3.2 浮游植物多样性特征
多样性指数(H′)和均匀度指数(J)分别用于评估群落结构的复杂性和评价群落是否稳定(公式1和2). 在研究区域,多样性指数(H′)分布范围在0.95—3.72之间,均匀度指数(J)分布范围在0.21—0.91之间. H′和J指数在靖海湾的2年4个季节的季节变化上展示出了相似的分布模式(图6),即在同一年中多样性指数和均匀度指数均为春季高于夏季,表明两年中春季的生物多样性优于夏季. 靖海湾研究区域多样性指数(H′)和均匀度指数(J)的具体年际和季节数值见表2.
表 2 靖海湾浮游植物群落的多样性指数(H′)和均匀度指数(J)的年际和季节变化Table 2. Inter-annualand seasonal variations of the H' and J indices inJinghai Bay时间Time 多样性指数Shannon-Wiener diversity index H' 均匀度指数Pielou’s evenness index J 最大值Maximum 最小值Minimum 平均值Average 最大值Maximum 最小值Minimum 平均值Average 2021 Spring 2.92 2.03 2.49 0.91 0.61 0.77 2021 Summer 2.07 1.05 1.53 0.51 0.27 0.39 2022 Spring 2.86 1.27 2.32 0.80 0.35 0.63 2022 Summer 3.72 0.95 2.00 0.84 0.21 0.45 2.3.3 浮游植物群落组成
2021年和2022年春夏两季在靖海湾研究区域共鉴定出150个浮游植物物种(>5 μm),属于6个门(即硅藻门、甲藻门、金藻门、蓝藻门、绿藻门和裸藻门)(表3). 结果表明,靖海湾春夏两季浮游植物群落主要由硅藻和甲藻组成,分别鉴定出123种硅藻(占浮游植物总分类群的82.00%)和13种甲藻(占总物种的8.67%). 其他类群中的物种数量较少(<5%),包括在2021年和2022年春季都观察到的1种金藻(占0.67%),以及只在2022年夏季观察到的5种蓝藻(3.33%)、6种绿藻(4.00%)和1种裸藻(占0.67%). 因此,这些结果表明2021年和2022年春夏两季靖海湾浮游植物群落主要由硅藻和甲藻组成. 靖海湾各季节浮游植物具体分类情况如表3所示.
表 3 靖海湾浮游植物分类情况Table 3. Classification of phytoplankton taxa inJinghai Bay2021春季2021 Spring 2021夏季2021 Summer 2022春季2022 Spring 2022夏季2022 Summer 物种数目Species number 占比/%Proportion 物种数目Species number 占比/%Proportion 物种数目Species number 占比/%Proportion 物种数目Species number 占比/%Proportion 硅藻Bacillariophyta 21 87.50 32 86.49 32 91.43 38 70.37 甲藻Pyrrophyta 2 8.33 5 13.51 2 5.71 4 7.41 金藻Chrysophyta 1 4.17 — — 1 2.86 — — 蓝藻Cyanophyta — — — — — — 5 9.26 绿藻Chlorophyta — — — — — — 6 11.11 裸藻Euglenophyta — — — — — — 1 1.85 2.3.4 研究区域浮游植物优势种
本研究选取了优势度指数(Y)大于0.02的物种作为优势种,各季节优势种的丰度、出现频率和优势度指数如表4所示. 在优势种中,除了出现在2022年春季的夜光藻(Noctiluca scintillans)(属于甲藻门)以及出现在2022年夏季的颤藻(Oscillatoria sp.)、铜绿微囊藻(Microcystis aeruginosa)、微囊藻(Microcystis sp.)和平裂藻(Merismopedia sp.)(属于蓝藻门)之外,其余物种都属于硅藻门,这些结果进一步证实了靖海湾研究区域的浮游植物群落以硅藻为主. 如图7所示,浮游植物优势种的丰度在2022年夏季最高,其次是2021年夏季,这与图5体现的结果一致. 优势种中,中肋骨条藻(Skeletonemacostatum)和菱形藻(Nitzschia sp.)均在2年中的3个季节出现(图7和表4). 靖海湾浮游植物优势种的年际变化较大,尤其是2022年夏季优势种所属类群出现了明显的变化,属于蓝藻门的物种占比上升(图8).
表 4 浮游植物群落中优势种的丰度、出现频率和优势度指数Table 4. The abundance, frequency of occurrence, and dominance index of dominant species among the phytoplankton community时间Time 优势种Dominant species 丰度(×105)/( cells· L−1)Abundance 出现频率/%Frequency 优势度指数Dominance index 2021春2021 Spring 菱形藻a Nitzschia sp. 0.156 100 0.3238 羽纹藻a Pinnularia sp. 0.108 87.50 0.1949 中肋骨条藻a Skeletonema costatum 0.071 62.50 0.0923 海链藻a Thalassiosira sp. 0.029 87.50 0.0521 圆筛藻a Coscinodiscus sp. 0.018 100 0.0363 小环藻a Cylotella sp. 0.018 87.50 0.0329 长菱形藻a Nitzschia longissma 0.016 75.00 0.0253 2021夏2021 Summer 大洋角管藻a Cerataulina pelagica 2.393 100 0.6610 中肋骨条藻a Skeletonema costatum 0.879 100 0.2290 劳氏角毛藻a Chaetoceros lorenzianus 0.085 87.50 0.0239 2022春2022 Spring 中肋骨条藻a Skeletonema costatum 0.403 100 0.5543 派格棍形藻a Bacillaria paxillifera 0.080 88.89 0.0979 菱形藻a Nitzschia sp. 0.045 88.89 0.0550 羽纹藻a Pinnularia sp. 0.022 77.78 0.0232 夜光藻b Noctiluca scintillans 0.018 88.89 0.0224 2022夏2022 Summer 颤藻c Oscillatoria sp. 6.785 77.78 0.2884 铜绿微囊藻c Microcystis aeruginosa 5.333 22.22 0.0580 微囊藻c Microcystis sp. 2.463 22.22 0.0402 菱形藻a Nitzschia sp. 0.461 100 0.0249 平裂藻c Merismopedia sp. 0.751 55.56 0.0207 注:物种名称右上角标注a代表硅藻,b代表甲藻,c代表蓝藻. Note: The top right corner of the species name is marked with a for Bacillariophyta, b for Dinophyta, and c for Cyanophyta. 2.3.5 影响浮游植物群落结构的潜在因素
本研究中,浮游植物群落主要是由硅藻和甲藻组成的(表3),且2021年和2022年春夏两季的优势种除夜光藻、颤藻、铜绿微囊藻、微囊藻和平裂藻之外,都属于硅藻门,占浮游植物总分类群的82.00%(表4). 本研究得到的上述结果与先前对中国海域浮游植物群落的研究结果相一致,Guo等研究了东海浮游植物的季节变化,并得出了东海中的浮游植物群落主要由硅藻和甲藻组成的结论[18];Zhong等对南海北部珠江口海域的浮游植物群落进行了研究,发现链状硅藻主导了研究区域浮游植物群落[37]. 此外,游剑涛对福建三沙湾及邻近开放海域开展了浮游植物与环境要素的同步采样分析,发现研究区域浮游植物类群以硅藻为主[38];Wei等考察了浮游植物群落对渤海当前变化的环境的反应,并表明了硅藻是过去3年中数量最多、种类最多的类群,平均分别占总丰度和分类群的约78%和约82%[39]. 各种基于实验室和实地考察研究的理论都表明,浮游植物群落组成总是与所处环境中各种物理化学变量的波动相关[12]. 之前的研究中,浮游植物群落组成和丰度主要受各种环境参数的共同影响,如营养水平、水温、盐度、水团运动、极端天气、光照的可用性等[18,39 − 40]. 湍流等水动力因素也有可能会对海洋浮游植物的群落组成造成影响[18],硅藻由于自身细胞壁的保护,在具有较为剧烈湍流等水体运动的海域可以正常生长生活,而甲藻的细胞结构及代谢过程都容易受到水体运动的影响而被破坏,进而在丰度上低于硅藻. 此外,极端天气例如台风等,也可能改变海洋中的物理或化学环境因素,进而给研究区域浮游植物的群落组成带来影响. 2022年8月台风“桑达”影响到山东半岛区域,带来了较强的降水和风浪. 由台风引起的强烈垂直混合,以及上升流和海洋涡旋,可以把营养物质从海洋底部携带到表层[41 − 42]. 而在近岸地区,台风带来的强降水使得河流等地表径流水量增加,在短期内增加了河口的淡水输入,进而更多地把来自陆地的营养盐输送到海水中,造成海水中营养盐水平的上升[43 − 44]. 由于浮游植物的生长受温度、盐度和营养盐浓度等因素的影响较大,因此台风可以导致浮游植物群落和生物量发生变化,甚至引发赤潮等藻华现象[42,45]. 这解释了2022年夏季DIN和DIP等营养盐浓度明显高于其他3个季节(图2),且2022年夏季靖海湾的浮游植物丰度远高于2021年春夏季和2022年春季(图5)的原因. 在本研究中,2022年夏季的优势种中颤藻、铜绿微囊藻、微囊藻和平裂藻都属于淡水藻类(表4),这可能是由于淡水输入量在短期内的迅速增加,一些淡水藻类会随径流汇入靖海湾中,并且在高营养盐的情况下生长. 综上所述,可能是台风造成的淡水径流和沿岸河流营养盐输入的增加促进了靖海湾内浮游植物的生长、增殖和扩张.
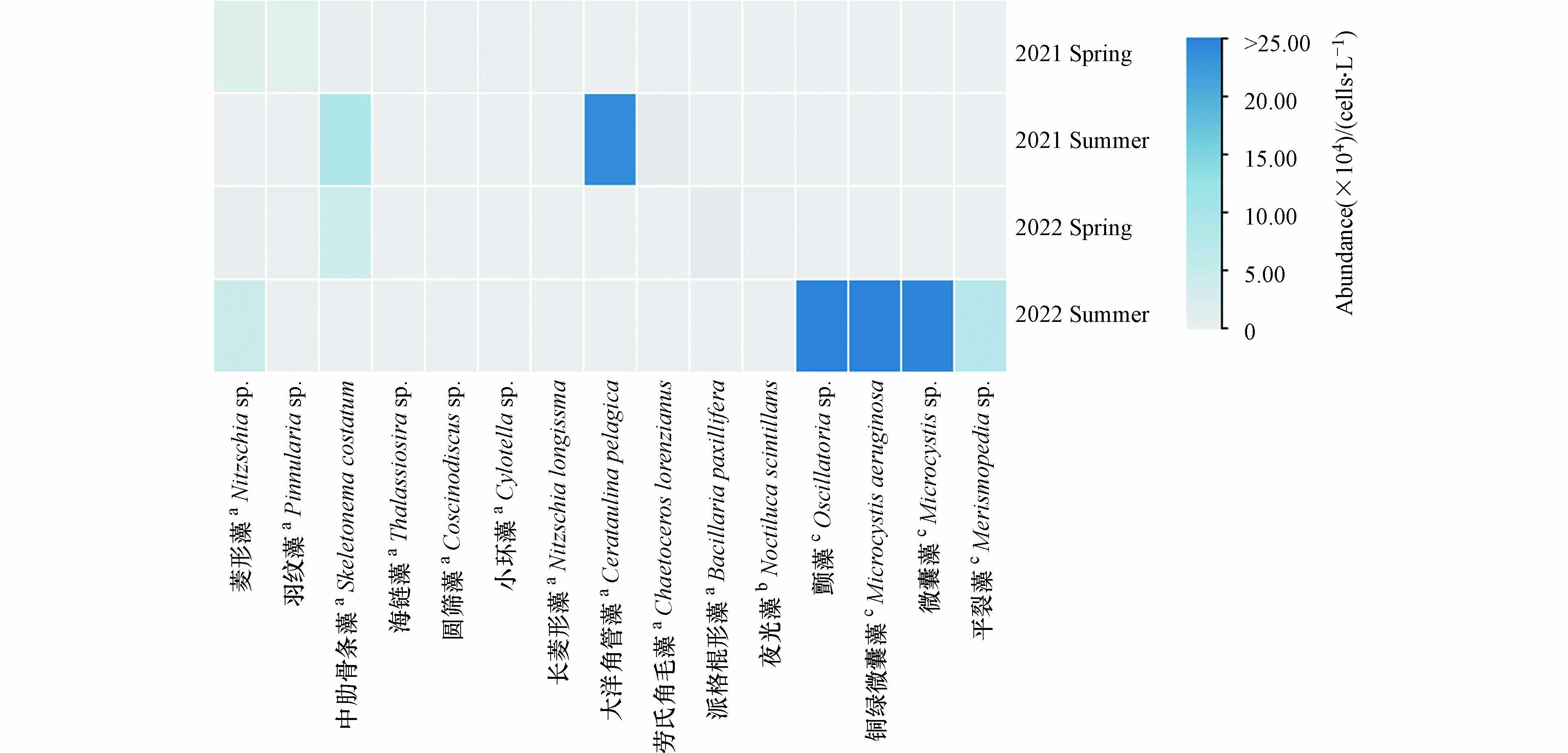 图 7 优势种在2021年和2022年春夏两季的丰度对比Figure 7. Comparison of abundance of dominant species in spring and summer in 2021 and 2022浮游植物物种丰度的大小由浅灰色到深蓝色的颜色表示. 物种名称右上角标注a代表硅藻,b代表甲藻,c代表蓝藻The magnitude of abundance for phytoplankton species is indicated by color intensity changing from light grey to dark blue. The top right corner of the species name is marked with a for Bacillariophyta, b for Dinophyta, and c for Cyanophyta
图 7 优势种在2021年和2022年春夏两季的丰度对比Figure 7. Comparison of abundance of dominant species in spring and summer in 2021 and 2022浮游植物物种丰度的大小由浅灰色到深蓝色的颜色表示. 物种名称右上角标注a代表硅藻,b代表甲藻,c代表蓝藻The magnitude of abundance for phytoplankton species is indicated by color intensity changing from light grey to dark blue. The top right corner of the species name is marked with a for Bacillariophyta, b for Dinophyta, and c for Cyanophyta2.4 影响浮游植物群落的环境因素
2.4.1 浮游植物群落特征与环境参数之间的关系
通过冗余分析(RDA)可以确定哪些环境因素影响浮游植物丰度的变化,并对控制黄海沿岸浮游植物丰度季节动态的决定因素进行了一些深入了解(图9). 根据RDA分析结果,2021年春季浮游植物的丰度与富营养化指数(Ei)、有机污染指数(Ci)和pH呈负相关关系(图9a),与之类似的是,2021年夏季浮游植物丰度与富营养化指数(Ei)、温度呈负相关关系(图9b). 2022年春季浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)呈正相关关系(图9c),2022年夏季浮游植物丰度与温度、盐度和N/P呈负相关关系(图9d). 此外,由于研究区域富营养化和有机污染水平比较严重(图3),本研究使用Pearson相关性分析对富营养化指数(Ei)和有机污染指数(Ci)与丰度和多样性指数、均匀度指数的潜在影响进行了评估(图10),发现2021年春夏两季浮游植物丰度与富营养化指数(Ei)呈现显著负相关关系,而在2022年春夏两季浮游植物丰度与富营养化指数(Ei)呈现出正相关关系,这可能与2022年研究区域优势种的变化有关. 以上结果表明,富营养化指数(Ei)与其他环境参数相比较而言对浮游植物群落的丰度影响更大,因此认为富营养化可能是影响靖海湾浮游植物群落动态变化的关键因素.
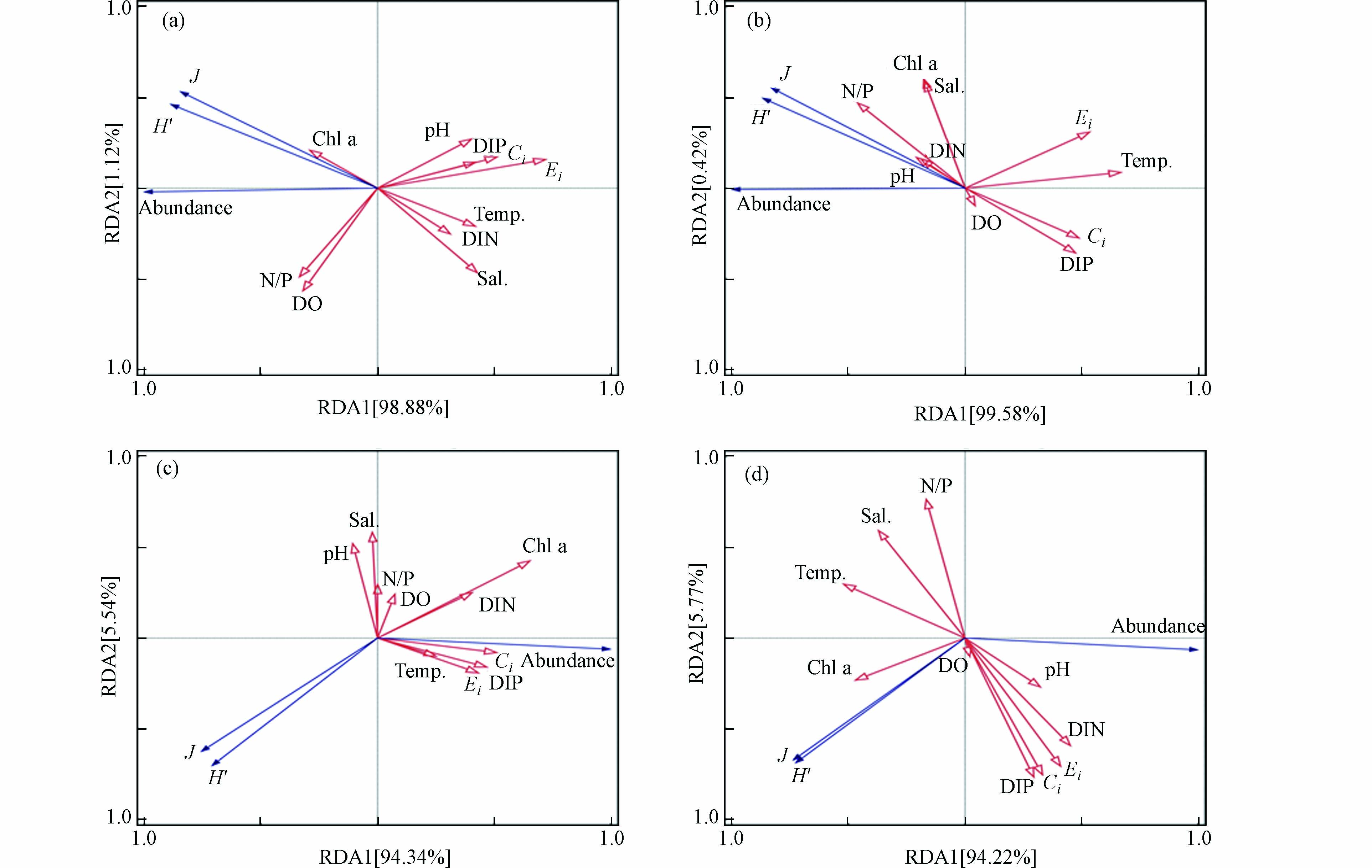 图 9 2021和2022年春夏季靖海湾浮游植物丰度与环境变量关系的RDA分析Figure 9. The RDA analysis for the relationships between phytoplankton abundance and environmental variables during the spring and summer of 2021 and 2022 along the Jinghai Bay(a)和(b)分别表示了2021春季和夏季浮游植物丰度与环境参数的关系;(c)和(d)分别表示了2022年春季和夏季浮游植物丰度与环境参数之间的关系. Temp.表示温度,Sal.表示盐度,Abundance表示浮游植物丰度.(a) and (b) represent the relationships between phytoplankton abundance and environmental parameters in spring, summer of 2021, respectively; (c) and (d) show the relationships between phytoplankton abundance and environmental parameters in spring, summer of 2022, respectively
图 9 2021和2022年春夏季靖海湾浮游植物丰度与环境变量关系的RDA分析Figure 9. The RDA analysis for the relationships between phytoplankton abundance and environmental variables during the spring and summer of 2021 and 2022 along the Jinghai Bay(a)和(b)分别表示了2021春季和夏季浮游植物丰度与环境参数的关系;(c)和(d)分别表示了2022年春季和夏季浮游植物丰度与环境参数之间的关系. Temp.表示温度,Sal.表示盐度,Abundance表示浮游植物丰度.(a) and (b) represent the relationships between phytoplankton abundance and environmental parameters in spring, summer of 2021, respectively; (c) and (d) show the relationships between phytoplankton abundance and environmental parameters in spring, summer of 2022, respectively2.4.2 富营养化对浮游植物群落的显著影响
全球沿海地区的经济快速发展和城市化进程加速对沿海生态系统的稳定性和可持续性产生了深远的影响[42,46]. 由于营养水平负荷增大而造成的沿海水域富营养化被认为是最受关注的环境问题之一[34]. 可以预见到的是,如果不采取适当的措施以平衡或抵消人类活动对环境造成的负面影响,沿海生态系统的环境状况极有可能在未来数十年进一步恶化[47 − 48].
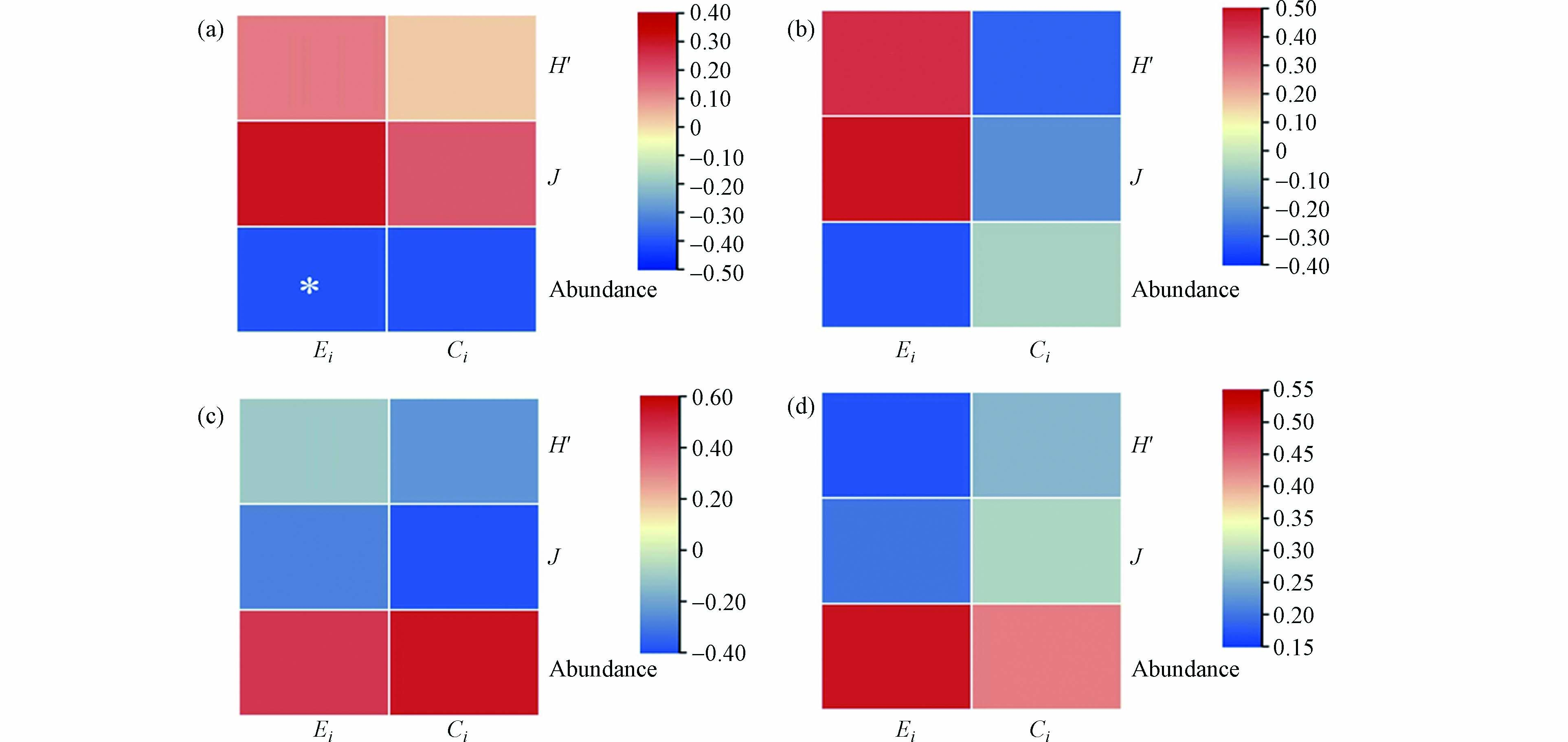 图 10 2021和2022年春夏季靖海湾浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)关系的Pearson相关性分析Figure 10. Pearson correlation analysis of the relationship between phytoplankton abundance and eutrophication index (Ei) and organic pollution index (Ci) in Jinghai Bay in spring and summer of 2021 and 2022(a)和(b)分别表示了2021春季和夏季浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)的Pearson相关性分析;(c)和(d)分别表示了2022年春季和夏季浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)之间的Pearson相关性分析. Pearson相关系数的范围从负到正,并且分别由从蓝色到红色变化的颜色强度表示. *为P < 0.05(双尾)(a) and (b) represent Pearson correlation analysis of phytoplankton abundance with eutrophication index (Ei) and organic pollution index (Ci) in spring and summer of 2021, respectively; (c) and (d) represent Pearson correlation analysis between phytoplankton abundance and eutrophication index (Ei) and organic pollution index (Ci) in spring and summer of 2022, respectively. Pearson correlation coefficients ranged from negative to positive and are indicated by color intensity changing from blue to red, respectively. * is P< 0.05 (2-tailed)
图 10 2021和2022年春夏季靖海湾浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)关系的Pearson相关性分析Figure 10. Pearson correlation analysis of the relationship between phytoplankton abundance and eutrophication index (Ei) and organic pollution index (Ci) in Jinghai Bay in spring and summer of 2021 and 2022(a)和(b)分别表示了2021春季和夏季浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)的Pearson相关性分析;(c)和(d)分别表示了2022年春季和夏季浮游植物丰度与富营养化指数(Ei)、有机污染指数(Ci)之间的Pearson相关性分析. Pearson相关系数的范围从负到正,并且分别由从蓝色到红色变化的颜色强度表示. *为P < 0.05(双尾)(a) and (b) represent Pearson correlation analysis of phytoplankton abundance with eutrophication index (Ei) and organic pollution index (Ci) in spring and summer of 2021, respectively; (c) and (d) represent Pearson correlation analysis between phytoplankton abundance and eutrophication index (Ei) and organic pollution index (Ci) in spring and summer of 2022, respectively. Pearson correlation coefficients ranged from negative to positive and are indicated by color intensity changing from blue to red, respectively. * is P< 0.05 (2-tailed)在本研究中,2021和2022年的春夏两季的浮游植物丰度都与富营养化指数(Ei)具有相关性(图9). 2021年春夏两季,浮游植物丰度与富营养化指数(Ei)呈现出负相关关系,其中2021年春季是显著负相关关系(P<0.05),而在2022年春夏季浮游植物丰度与富营养化指数(Ei)呈正相关(图10). 本实验已经观察到靖海湾在2021年和2022年春夏季富营养化指数(Ei)分别处于中度富营养化和重度富营养化水平,且在2022年夏季富营养化指数(Ei)出现了极大值(图3). 此外,2021年和2022年靖海湾生物多样性水平表现为春季优于夏季(表2),并且在2022年夏季优势种尤其是属于蓝藻门的颤藻、铜绿微囊藻、微囊藻和平裂藻丰度急剧上升,即在靖海湾出现了蓝藻增长的现象(图7,图8). 先前的研究表明,河流等地表径流的汇入是污染物进入沿海环境的主要途径,约占污染物输入量的50%[24,49],通过河流汇入沿海生态系统的营养元素(如氮和磷等)可以显著刺激浮游植物的初级生产力[12]. 孔等发现,由于营养负荷过大,富营养化水平增加,黄海沿岸海域在春季和夏季同时观察到了绿潮、金潮和赤潮的爆发[50]. Li等研究发现,受到海洋酸化、变暖和富营养化的综合影响,黄海北部海域海洋钙化生物和底栖生态系统正受到越来越大的威胁[51]. 被威海市包围的靖海湾将不可避免地受到环境条件变化的影响,进而使得浮游植物群落结构和多样性发生变化. 大量研究表明,与营养盐含量密切相关的富营养化会提高浮游植物的生长和代谢率,大大促进浮游植物的生长繁殖,经常会导致藻类(包括有毒或有害藻类)的大量繁殖[15,25,52]. 因此,有害藻华发生的频率、强度和持续时间将因富营养化水平的上升而增加[12,22,53]. 在本研究中,2022年夏季的台风“桑达”带来的强降水使得属于淡水藻类的颤藻、铜绿微囊藻、微囊藻和平裂藻等蓝藻进入靖海湾,并且丰度远高于其他3个季节的优势种(图7),通过Pearson相关性分析发现它们的丰度与富营养化指数(Ei)呈正相关关系(图10),这可能与蓝藻自身的生理特征有关. 例如,Fujimoto等认为铜绿微囊藻对营养盐(氮、磷)的结合能力高于其他藻类,这为铜绿微囊藻在富营养化水体中的迅速增殖提供了基础[54]. 先前的研究得到,蓝藻可以通过化感作用机制降低其他浮游植物的丰度[55 − 56],从而成为浮游植物群落中的优势种. Willén等指出,蓝藻门中的颤藻、平裂藻等被认为是富营养的种类[57],且蓝藻数量随季节发生短时间内急速增长的现象,可以作为水体富营养化的严重程度的标志[58]. 此外,观察到2022年夏季营养盐含量及浮游植物丰度高于其余3个季节(图2g和h,图5),叶绿素a含量却低于其余3个季节(图2f),此前研究的结果通常是浮游植物丰度与叶绿素a含量呈正相关分布,叶绿素a含量的水平可以间接用作浮游植物丰度的指标[39,59],这与本文的结果相反,推测出现此相反结果的原因可能是与浮游动物的选择性摄食有关[60]. 同时,靖海湾面积较小且被威海市包围,调查期间该海域环境受人类活动、气象因素等影响大,这可能在一定程度上影响叶绿素a含量[61].
3. 结论(Conclusion)
靖海湾作为典型半封闭海湾和河口区域,容易受到附近城市人类活动影响而造成环境污染,出现富营养化等环境问题,威胁到沿海生态系统的健康和可持续性发展. 本文研究显示,靖海湾浮游植物群落组成以硅藻和甲藻为主,而在2022年夏季出现了蓝藻的大量增长,富营养化可能是影响靖海湾浮游植物群落的关键因素.
-
表 1 2021和2022年春季和夏季靖海湾环境参数的范围和平均值
Table 1. Range and mean values of environmental parameters in the spring and summer of Jinghai Bay in 2021 and 2022
环境参数Environmental parameters 2021年春季2021 Spring 2021年夏季2021 Summer 2022年春季2022 Spring 2022年夏季2022 Summer 温度/℃ 范围 22.1—23.70 26.90—27.00 17.50—17.80 24.70—25.10 平均值 23.00 ±0.61 26.92±0.04 17.68±0.10 24.91±0.13 盐度 范围 34.18—34.68 21.94—25.02 30.07—30.81 9.30—17.90 平均值 34.37±0.21 23.18±1.40 30.41±0.27 12.06±3.18 DO/(mg L−1) 范围 5.11—5.26 5.59—6.99 5.45—6.61 4.64—6.85 平均值 5.16±0.05 6.52±0.38 5.76±0.37 4.73±0.08 pH 范围 7.81—7.89 7.80—7.90 7.73—7.79 7.74—7.83 平均值 7.84±0.03 7.82±0.03 7.76±0.02 7.79±0.03 COD/(mg L−1) 范围 1.38—1.79 0.42—0.99 1.40—1.90 4.28—5.10 平均值 1.58±0.12 0.72±0.20 1.66±0.16 4.72±0.28 Chla/(µg L−1) 范围 21.36—23.09 23.33—24.42 22.82—23.30 1.83—5.26 平均值 22.01±0.54 23.77±0.40 23.08±0.18 3.66±0.97 DIN/(µg L−1) 范围 152.75—173.87 168.57—204.15 562.18—762.46 783.13—1007.12 平均值 162.93±7.28 185.08±11.79 673.10±72.40 909.25±84.94 DIP/(µg L−1) 范围 69.59—85.49 93.51—135.63 70.23—93.26 140.31—271.80 平均值 76.82±5.16 117.05±13.61 80.62±7.66 224.72±43.15 N/P 范围 2.03—2.33 1.30—1.96 6.30—10.01 3.54—5.58 平均值 2.13±0.10 1.60±0.20 8.41±1.11 4.14±0.63 表 2 靖海湾浮游植物群落的多样性指数(H′)和均匀度指数(J)的年际和季节变化
Table 2. Inter-annualand seasonal variations of the H' and J indices inJinghai Bay
时间Time 多样性指数Shannon-Wiener diversity index H' 均匀度指数Pielou’s evenness index J 最大值Maximum 最小值Minimum 平均值Average 最大值Maximum 最小值Minimum 平均值Average 2021 Spring 2.92 2.03 2.49 0.91 0.61 0.77 2021 Summer 2.07 1.05 1.53 0.51 0.27 0.39 2022 Spring 2.86 1.27 2.32 0.80 0.35 0.63 2022 Summer 3.72 0.95 2.00 0.84 0.21 0.45 表 3 靖海湾浮游植物分类情况
Table 3. Classification of phytoplankton taxa inJinghai Bay
2021春季2021 Spring 2021夏季2021 Summer 2022春季2022 Spring 2022夏季2022 Summer 物种数目Species number 占比/%Proportion 物种数目Species number 占比/%Proportion 物种数目Species number 占比/%Proportion 物种数目Species number 占比/%Proportion 硅藻Bacillariophyta 21 87.50 32 86.49 32 91.43 38 70.37 甲藻Pyrrophyta 2 8.33 5 13.51 2 5.71 4 7.41 金藻Chrysophyta 1 4.17 — — 1 2.86 — — 蓝藻Cyanophyta — — — — — — 5 9.26 绿藻Chlorophyta — — — — — — 6 11.11 裸藻Euglenophyta — — — — — — 1 1.85 表 4 浮游植物群落中优势种的丰度、出现频率和优势度指数
Table 4. The abundance, frequency of occurrence, and dominance index of dominant species among the phytoplankton community
时间Time 优势种Dominant species 丰度(×105)/( cells· L−1)Abundance 出现频率/%Frequency 优势度指数Dominance index 2021春2021 Spring 菱形藻a Nitzschia sp. 0.156 100 0.3238 羽纹藻a Pinnularia sp. 0.108 87.50 0.1949 中肋骨条藻a Skeletonema costatum 0.071 62.50 0.0923 海链藻a Thalassiosira sp. 0.029 87.50 0.0521 圆筛藻a Coscinodiscus sp. 0.018 100 0.0363 小环藻a Cylotella sp. 0.018 87.50 0.0329 长菱形藻a Nitzschia longissma 0.016 75.00 0.0253 2021夏2021 Summer 大洋角管藻a Cerataulina pelagica 2.393 100 0.6610 中肋骨条藻a Skeletonema costatum 0.879 100 0.2290 劳氏角毛藻a Chaetoceros lorenzianus 0.085 87.50 0.0239 2022春2022 Spring 中肋骨条藻a Skeletonema costatum 0.403 100 0.5543 派格棍形藻a Bacillaria paxillifera 0.080 88.89 0.0979 菱形藻a Nitzschia sp. 0.045 88.89 0.0550 羽纹藻a Pinnularia sp. 0.022 77.78 0.0232 夜光藻b Noctiluca scintillans 0.018 88.89 0.0224 2022夏2022 Summer 颤藻c Oscillatoria sp. 6.785 77.78 0.2884 铜绿微囊藻c Microcystis aeruginosa 5.333 22.22 0.0580 微囊藻c Microcystis sp. 2.463 22.22 0.0402 菱形藻a Nitzschia sp. 0.461 100 0.0249 平裂藻c Merismopedia sp. 0.751 55.56 0.0207 注:物种名称右上角标注a代表硅藻,b代表甲藻,c代表蓝藻. Note: The top right corner of the species name is marked with a for Bacillariophyta, b for Dinophyta, and c for Cyanophyta. -
[1] LONGHURST A, SATHYENDRANATH S, PLATT T, et al. An estimate of global primary production in the ocean from satellite radiometer data[J]. Journal of Plankton Research, 1995, 17(6): 1245-1271. doi: 10.1093/plankt/17.6.1245 [2] FIELD C B, BEHRENFELD M J, RANDERSON J T, et al. Primary production of the biosphere: Integrating terrestrial and oceanic components[J]. Science, 1998, 281(5374): 237-240. doi: 10.1126/science.281.5374.237 [3] AGAWIN N S R, DUARTE C M, AGUSTÍ S. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production[J]. Limnology and Oceanography, 2000, 45(8): 1891. [4] SAIFULLAH A S M, KAMAL A H M, IDRIS M H, et al. Community composition and diversity of phytoplankton in relation to environmental variables and seasonality in a tropical mangrove estuary[J]. Regional Studies in Marine Science, 2019, 32: 100826. doi: 10.1016/j.rsma.2019.100826 [5] 张占飞, 刘定莹, 张英豪. 东平湖秋季浮游生物群落特征及其与环境因子的关系[J]. 环境化学, 2024, 43(1): 264-274. ZHANG Z, LIU D Y, ZHANG Y H. Plankton community characteristics and its relationship with environmental factors in the autumn of Dongping Lake, China[J]. Environmental Chemistry, 2024, 43(1): 264-274(in Chinese).
[6] SCHLOSS I R, ABELE D, MOREAU S, et al. Response of phytoplankton dynamics to 19-year (1991-2009) climate trends in Potter Cove ( Antarctica)[J]. Journal of Marine Systems, 2012, 92(1): 53-66. doi: 10.1016/j.jmarsys.2011.10.006 [7] BARTON A D, FINKEL Z V, WARD B A, et al. On the roles of cell size and trophic strategy in North Atlantic diatom and dinoflagellate communities[J]. Limnology and Oceanography, 2013, 58(1): 254-266. doi: 10.4319/lo.2013.58.1.0254 [8] TIWARI A, CHAUHAN S V S. Seasonal phytoplanktonic diversity of Kitham lake, Agra[J]. Journal of Environmental Biology, 2006, 27(1): 35-38. [9] NIEHOFF B, MADSEN S, HANSEN B, et al. Reproductive cycles of three dominant Calanus species in Disko Bay, West Greenland[J]. Marine Biology, 2002, 140(3): 567-576. doi: 10.1007/s00227-001-0731-3 [10] RIEBESELL U. Effects of CO2 enrichment on marine phytoplankton[J]. Journal of Oceanography, 2004, 60(4): 719-729. doi: 10.1007/s10872-004-5764-z [11] THOMAS M K, ARANGUREN-GASSIS M, KREMER C T, et al. Temperature-nutrient interactions exacerbate sensitivity to warming in phytoplankton[J]. Global Change Biology, 2017, 23(8): 3269-3280. doi: 10.1111/gcb.13641 [12] XIAO W P, LIU X, IRWIN A J, et al. Warming and eutrophication combine to restructure diatoms and dinoflagellates[J]. Water Research, 2018, 128: 206-216. doi: 10.1016/j.watres.2017.10.051 [13] IBARBALZ F M, HENRY N, BRANDÃO M C, et al. Global trends in marine plankton diversity across Kingdoms of life[J]. Cell, 2019, 179(5): 1084-1097. e21. [14] FU T T, CHEN B H, JI W D, et al. Size structure of phytoplankton community and its response to environmental factors in Xiamen Bay, China[J]. Environmental Earth Sciences, 2016, 75(9): 734. doi: 10.1007/s12665-016-5552-2 [15] de SENERPONT DOMIS L N, ELSER J J, GSELL A S, et al. Plankton dynamics under different climatic conditions in space and time[J]. Freshwater Biology, 2013, 58(3): 463-482. doi: 10.1111/fwb.12053 [16] HAYS G C, RICHARDSON A J, ROBINSON C. Climate change and marine plankton[J]. Trends in Ecology & Evolution, 2005, 20(6): 337-344. [17] PTACNIK R, SOLIMINI A G, ANDERSEN T, et al. Diversity predicts stability and resource use efficiency in natural phytoplankton communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(13): 5134-5138. [18] GUO S J, FENG Y Y, WANG L, et al. Seasonal variation in the phytoplankton community of a continental-shelf sea: The East China Sea[J]. Marine Ecology Progress Series, 2014, 516: 103-126. doi: 10.3354/meps10952 [19] WEI Y Q, SUN J, ZHANG G C, et al. Environmental factors controlling the dynamics of phytoplankton communities during spring and fall seasons in the southern Sunda Shelf[J]. Environmental Science and Pollution Research International, 2020, 27(18): 23222-23233. doi: 10.1007/s11356-020-08927-6 [20] 崔毅, 马菲菲, 夏斌, 等. 靖海湾松江鲈鱼种质资源保护区海水环境质量年际变化趋势及综合评价[J]. 渔业科学进展, 2013, 34(6): 1-8. doi: 10.3969/j.issn.1000-7075.2013.06.001 CUI Y, MA F F, XIA B, et al. Annual variation and comprehensive evaluation of seawater quality in Trachidermus fasciatus Heckel germ plasm resource protection area in Jinghai Bay[J]. Progress in Fishery Sciences, 2013, 34(6): 1-8 (in Chinese). doi: 10.3969/j.issn.1000-7075.2013.06.001
[21] SUN X M, WANG T, CHEN B J, et al. Factors influencing the occurrence and distribution of microplastics in coastal sediments: From source to sink[J]. Journal of Hazardous Materials, 2021, 410: 124982. doi: 10.1016/j.jhazmat.2020.124982 [22] ZHU G H, ABU NOMAN M, NARALE D D, et al. Evaluation of ecosystem health and potential human health hazards in the Hangzhou Bay and Qiantang Estuary region through multiple assessment approaches[J]. Environmental Pollution, 2020, 264: 114791. doi: 10.1016/j.envpol.2020.114791 [23] WEI Y Q, DING D S, GU T, et al. Ocean acidification and warming significantly affect coastal eutrophication and organic pollution: A case study in the Bohai Sea[J]. Marine Pollution Bulletin, 2023, 186: 114380. doi: 10.1016/j.marpolbul.2022.114380 [24] KENNISH M J. Environmental threats and environmental future of estuaries[J]. Environmental Conservation, 2002, 29(1): 78-107. doi: 10.1017/S0376892902000061 [25] ANDERSON D M, GLIBERT P M, BURKHOLDER J M. Harmful algal blooms and eutrophication: Nutrient sources, composition, and consequences[J]. Estuaries, 2002, 25(4): 704-726. doi: 10.1007/BF02804901 [26] WALLACE R B, BAUMANN H, GREAR J S, et al. Coastal ocean acidification: The other eutrophication problem[J]. Estuarine, Coastal and Shelf Science, 2014, 148: 1-13. doi: 10.1016/j.ecss.2014.05.027 [27] 徐林波, 高勤峰, 董双林, 等. 靖海湾重金属污染及铅稳定同位素溯源研究[J]. 环境科学, 2013, 34(2): 476-483. XU L B, GAO Q F, DONG S L, et al. Study on heavy metal contaminations and the sources of Pb pollution in Jinghai Bay using the stable isotope technique[J]. Environmental Science, 2013, 34(2): 476-483 (in Chinese).
[28] 张先锋, 吴建政, 胡日军, 等. 靖海湾表层沉积物粒度特征及沉积动力环境分区[J]. 海洋地质前沿, 2013, 29(10): 47-51. ZHANG X F, WU J Z, HU R J, et al. Grain size distribution pattern of surface sediment in Jinghai Bay and dynamic envieronment division[J]. Marine Geology Frontiers, 2013, 29(10): 47-51 (in Chinese).
[29] WEI Y Q, CUI H W, HU Q J, et al. Eutrophication status assessment in the Laizhou Bay, Bohai Sea: Further evidence for the ecosystem degradation[J]. Marine Pollution Bulletin, 2022, 181: 113867. doi: 10.1016/j.marpolbul.2022.113867 [30] CROUCH S R, MALMSTADT H V. Mechanistic investigation of molybdenum blue method for determination of phosphate[J]. Analytical Chemistry, 1967, 39(10): 1084-1089. doi: 10.1021/ac60254a027 [31] VERDOUW H, van ECHTELD C J A, DEKKERS E M J. Ammonia determination based on indophenol formation with sodium salicylate[J]. Water Research, 1978, 12(6): 399-402. doi: 10.1016/0043-1354(78)90107-0 [32] WEI Y Q, LIU H J, ZHANG X D, et al. Physicochemical conditions in affecting the distribution of spring phytoplankton community[J]. Chinese Journal of Oceanology and Limnology, 2017, 35(6): 1342-1361. doi: 10.1007/s00343-017-6190-6 [33] UTERMÖHL H. Neue wege in der quantitativen erfassung des plankton. (mit besonderer berücksichtigung des ultraplanktons. )[J]. SIL Proceedings, 1922, -2010,1931,5(2): 567-596. [34] WELSCHMEYER N A. Fluorometric analysis of chlorophyll a in the presence of chlorophyll b and pheopigments[J]. Limnology and Oceanography, 1994, 39(8): 1985-1992. doi: 10.4319/lo.1994.39.8.1985 [35] 姜登岭, 赵昊, 邬喜红, 等. 嘉兴城市河网区高、低水位期浮游植物群落及其与环境因子的典范对应分析[J]. 环境化学, 2020, 39(9): 2540-2550. doi: 10.7524/j.issn.0254-6108.2020040804 JIANG D L, ZHAO H, WU X H, et al. Model correspondence analysis of phytoplankton community and its environmental factors at high and low water levels in urban river network area of Jiaxing City[J]. Environmental Chemistry, 2020, 39(9): 2540-2550 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020040804
[36] LIU S G, LOU S, KUANG C P, et al. Water quality assessment by pollution-index method in the coastal waters of Hebei Province in western Bohai Sea, China[J]. Marine Pollution Bulletin, 2011, 62(10): 2220-2229. doi: 10.1016/j.marpolbul.2011.06.021 [37] ZHONG Q, XUE B, ABU NOMAN M, et al. Effect of river plume on phytoplankton community structure in Zhujiang River Estuary[J]. Journal of Oceanology and Limnology, 2021, 39(2): 550-565. doi: 10.1007/s00343-020-9213-7 [38] 游剑涛. 三沙湾及邻近开放海域夏季浮游植物群落结构比较[J]. 渔业研究, 2022, 44(6): 581-587. YOU J T. Comparative study on the ecological characteristics of phytoplankton community in summer in Sansha Bay and adjacent open waters, Fujian Province[J]. Journal of Fisheries Research, 2022, 44(6): 581-587 (in Chinese).
[39] WEI Y Q, DING D S, GU T, et al. Different responses of phytoplankton and zooplankton communities to current changing coastal environments[J]. Environmental Research, 2022, 215: 114426. doi: 10.1016/j.envres.2022.114426 [40] CHEN C S, ZHU J R, BEARDSLEY R C, et al. Physical-biological sources for dense algal blooms near the Changjiang River[J]. Geophysical Research Letters, 2003, 30(10) :1515. [41] SHIBANO R, YAMANAKA Y, OKADA N, et al. Responses of marine ecosystem to typhoon passages in the western subtropical North Pacific[J]. Geophysical Research Letters, 2011, 38(18) :18608. [42] GUAN S D, ZHAO W, SUN L, et al. Tropical cyclone-induced sea surface cooling over the Yellow Sea and Bohai Sea in the 2019 Pacific typhoon season[J]. Journal of Marine Systems, 2021, 217: 103509. doi: 10.1016/j.jmarsys.2021.103509 [43] ZHAO H, TANG D L, WANG D X. Phytoplankton blooms near the Pearl River Estuary induced by Typhoon Nuri[J]. Journal of Geophysical Research, 2009, 114(C12): C12027. [44] PAERL H W, HALL N S, HOUNSHELL A G, et al. Recent increases of rainfall and flooding from tropical cyclones (TCs) in North Carolina (USA): Implications for organic matter and nutrient cycling in coastal watersheds[J]. Biogeochemistry, 2020, 150(2): 197-216. doi: 10.1007/s10533-020-00693-4 [45] CHUNG C C, GONG G C, HUNG C C. Effect of Typhoon Morakot on microphytoplankton population dynamics in the subtropical NorthwestPacific[J]. Marine Ecology Progress Series, 2012, 448: 39-49. doi: 10.3354/meps09490 [46] SARMIENTO J L, SLATER R, BARBER R, et al. Response of ocean ecosystems to climate warming[J]. Global Biogeochemical Cycles, 2004, 18(3) :002143. [47] HALPERN B S, WALBRIDGE S, SELKOE K A, et al. A global map of human impact on marine ecosystems[J]. Science, 2008, 319(5865): 948-952. doi: 10.1126/science.1149345 [48] ZHOU Y, WANG L L, ZHOU Y Y, et al. Eutrophication control strategies for highly anthropogenic influenced coastal waters[J]. Science of the Total Environment, 2020, 705: 135760. doi: 10.1016/j.scitotenv.2019.135760 [49] RADACH G, PÄTSCH J. Variability of continental riverine freshwater and nutrient inputs into the North Sea for the years 1977-2000 and its consequences for the assessment of eutrophication[J]. Estuaries and Coasts, 2007, 30(1): 66-81. doi: 10.1007/BF02782968 [50] 孔凡洲, 姜鹏, 魏传杰, 等. 2017年春、夏季黄海35°N共发的绿潮、金潮和赤潮[J]. 海洋与湖沼, 2018, 49(5): 1021-1030. KONG F Z, JIANG P, WEI C J, et al. Co-occurence of green tide, golden tide and red tides along the 35?n transect in the Yellow Sea during spring and summer in 2017[J]. Oceanologia et Limnologia Sinica, 2018, 49(5): 1021-1030 (in Chinese).
[51] LI C L, YANG D Z, ZHAI W D. Effects of warming, eutrophication and climate variability on acidification of the seasonally stratified North Yellow Sea over the past 40 years[J]. The Science of the Total Environment, 2022, 815: 152935. doi: 10.1016/j.scitotenv.2022.152935 [52] LEE K H, JEONG H J, LEE K, et al. Effects of warming and eutrophication on coastal phytoplankton production[J]. Harmful Algae, 2019, 81: 106-118. doi: 10.1016/j.hal.2018.11.017 [53] 李丽, 吕颂辉. 近30年广东沿海赤潮灾害的特征及成因分析[J]. 安全与环境学报, 2009, 9(3): 83-86. doi: 10.3969/j.issn.1009-6094.2009.03.021 LI L, LU S H. A 30-year retrospective analysis over the detrimental algal blooms in Guangdong coastal areas[J]. Journal of Safety and Environment, 2009, 9(3): 83-86 (in Chinese). doi: 10.3969/j.issn.1009-6094.2009.03.021
[54] FUJIMOTO N, SUDO R, SUGIURA N, et al. Nutrient-limited growth of Microcystis aeruginosa and Phormidium tenue and competition under various N: P supply ratios and temperatures[J]. Limnology and Oceanography, 1997, 42(2): 250-256. doi: 10.4319/lo.1997.42.2.0250 [55] SARMA S S S, NANDINI S, GULATI R D. Life history strategies of cladocerans: Comparisons of tropical and temperate taxa[J]. Hydrobiologia, 2005, 542(1): 315-333. doi: 10.1007/s10750-004-3247-2 [56] HAN M Q, DONG C C, MA S Q, et al. Food web responses to a cyanobacterial bloom in a freshwater Eutrophic Lake[J]. Water, 2021, 13(9): 1296. doi: 10.3390/w13091296 [57] WILLÉN E. Planktonic green algae in an acidification gradient of nutrient-poor lakes[J]. Archiv Für Protistenkunde, 1992, 141(1/2): 47-64. [58] 顾礼明, 曹慧敏, 范铭芳, 等. 大型湖库浮游植物生物多样性研究进展综述[J]. 污染防治技术, 2019, 32(4): 37-39. GU L M, CAO H M, FAN M F, et al. Research progress of phytoplankton biodiversity in large lakes and reservoirs: A review[J]. Pollution Control Technology, 2019, 32(4): 37-39 (in Chinese).
[59] SARI L A, AL DIANA N, ARSAD S, et al. Monitoring of phytoplankton abundance and chlorophyll-a content in the estuary of Banjar Kemuning River, Sidoarjo Regency, East Java[J]. Journal of Ecological Engineering, 2021, 22(1): 29-35. doi: 10.12911/22998993/128877 [60] 曾祥波, 黄邦钦, 陈纪新, 等. 台湾海峡小型浮游动物的摄食对夏季藻华演替的影响[J]. 海洋学报, 2006, 28(5): 107-116. ZENG X B, HUANG B Q, CHEN J X, et al. Grazing impact of microzooplankton on algal bloom in the Taiwan Strait in summer[J]. Acta Oceanologica Sinica, 2006, 28(5): 107-116 (in Chinese).
[61] 潘胜军, 沈志良. 胶州湾叶绿素a浓度及浮游植物的粒级组成[J]. 应用生态学报, 2009, 20(10): 2468-2474. PAN S J, SHEN Z L. Chlorophyll-a concentration and phytoplankton size-fractionated composition in Jiaozhou Bay[J]. Chinese Journal of Applied Ecology, 2009, 20(10): 2468-2474 (in Chinese).
期刊类型引用(5)
1. 吐孙尼亚则·麦麦提,禹宝伟,钟钦梅,袁月,杨胜韬. ZIF-8掺杂石墨烯/壳聚糖小球吸附重金属Cu~(2+)的研究. 西南民族大学学报(自然科学版). 2024(06): 636-643 .  百度学术
百度学术
2. 刘兵. 含铜工业废水处理技术. 清洗世界. 2023(12): 112-114 .  百度学术
百度学术
3. 熊江磊,赵浩钧,刘云霄,罗嘉豪,严群. 聚吡咯修饰阳极在电絮凝技术处理铜铬废水过程中的研究. 安全与环境工程. 2022(06): 200-207 .  百度学术
百度学术
4. 方楠,吴健,何强,程辉彩,张丽萍,王宏伟. 响应面法优化铁尾矿砂对铜(II)的吸附条件. 矿产综合利用. 2020(01): 140-145 .  百度学术
百度学术
5. 饶俊元,黄弦,侯明才,王万证,杨远秀,姚创. 基于电催化絮凝的洗护用品生产废水处理改造工程. 工业用水与废水. 2020(02): 65-68 .  百度学术
百度学术
其他类型引用(8)
-






 下载:
下载: