-
非甾体类抗炎药(Non-steroidal antiinflammatory drugs,NSAIDs)是一类具有解热、镇痛、消炎作用的非类固激素类药物[1]. 据统计在各类药物中,镇痛药和非甾体抗炎药在2020年的市场规模最大,分别为469.9亿美元和482亿美元,而抗抑郁药(286亿美元)、抗高血压药(241.7亿美元)、抗真菌药(130.6亿美元)和麻醉药(20亿美元)等其他药物的市场份额明显较小[2 − 3]. 因此,非甾体抗炎药被视为人类和兽医医学中最常用的药物之一. 由于大量的生产和使用,科研工作者已经在地表水、地下水、污水处理厂等水体中检测到多种非甾体抗炎药[4 − 8],NSAIDs的浓度在ng·L−1至μg·L−1之间.
NSAIDs作为一种新污染物,其在水环境中的广泛存在对水生生物产生毒性效应,进而通过食物链对人体的健康造成威胁. 2022年国家首次将新污染物调查试点监测纳入生态环境监测体系. 生态环境部《生态环境监测规划纲要(2020—2035 年)》 将新污染物监测有序开展设为 2030 年的监测业务发展目标;国务院《新污染物治理行动方案》提出新污染物治理要监测先行. 因此建立高灵敏度、准确可靠、同时测定多种NSAIDs的监测方法为生态环境管理部门加强新污染物治理提供技术基础.
目前国内外采用的分析方法有高效液相色谱法、液相色谱-串联质谱法、气相色谱-串联质谱法、毛细管电泳法、薄层色谱法和分光光度法等[9 − 16]. 其中液相色谱-串联质谱法因其高灵敏度和高选择性成为NSAIDs最常见的检测方法. 刘彦等[17]建立了水中尼美舒利和塞来昔布2种NSAIDs的检测方法并应用于环境水体. Yan等[7]采用固相萃取-高效液相串联质谱法测定水中乙酰氨基酚、双氯芬酸、布洛芬和萘普生4种NSAIDs. 凌慧娟等[18]采用固相萃取-超高效液相色谱-质谱测定水中5种NSAIDs. 已报道的文献对水体中NSAIDs的数量和种类研究较少,对于NSAIDs的多残留分析,方法扩展不足.
本研究扩增了分析物种类与数量,以化学结构为分类依据,选取代表NSAIDs 的全部11类的23种药物(见表1). 对固相萃取的前处理过程进行深入探讨,选用混合阳离子交换反相吸附固相萃取柱(MCX小柱)进行,结合超高效液相色谱-串联质谱仪,建立了水中23种NSAIDs的分析方法. 本方法灵敏度好、准确度高满足水体中NSAIDs痕量检测的要求.
-
超高效液相色谱-三重四极杆质谱联用仪(SCIEX Triple Quad 6500,美国Sciex公司);Oasis MCX固相萃取柱(500 mg/6 mL,美国Waters公司);ASPE 900全自动固相萃取仪(日本GL Science公司);0.22 μm有机相滤膜(美国Waters公司);实验用水为Milli-Q 水(美国Bedford公司).
甲醇、乙腈(色谱纯,美国Merck公司)、甲酸、氨水(色谱纯,德国Sigma-Aldirich公司).
23种非甾体抗炎药包括(1)水杨酸类:水杨酸;(2)苯胺类:对乙酰氨基酚;(3)吲哚基和茚基乙酸类:吲哚美辛、舒林酸、依托度酸;(4)芳基乙酸类:双氯芬酸、托美丁、(5)芳基丙酸类:布洛芬、萘普生、洛索洛芬、氟比洛芬、酮洛芬;(6)灭酸类:甲芬那酸、托芬那酸、甲氯芬那酸;(7)烯醇酸:萘普酮;(8)昔康类:替诺昔康、吡罗昔康、美诺昔康;(9)磺酰苯胺类:尼美舒利;(10)昔布类:罗非昔布、帕瑞昔布;(11)吡唑酮类:安替比林,具体信息见表1. 3种内标包括:对乙酰氨基酚-D3、甲氯芬那酸-13C6、吡罗昔康-D3.
所有标准品均购自百灵威科技有限公司,纯度均大于98.0%. 内标均购自德国Dr.Ehrenstorfer公司,纯度均大于98.0%.
-
以甲醇为溶剂,将23种非甾体抗炎药配制成100 μg·mL−1的标准储备液,于-20 ℃条件下储存. 用甲醇将标准储备液稀释成1 μg·mL−1的中间储备液,于-20 ℃保存备用. 使用前以50%(V/V)甲醇水溶液为溶剂,将1 μg·mL−1的23种非甾体抗炎药的使用液逐级稀释成200、100、50、20、10、5、2、1、0.5、0.1 ng·mL−1的系列标准混合溶液.
3种内标分别用甲醇配制成100 μg·mL−1的内标储备液;用甲醇进一步稀释配制成质量浓度为2 μg·mL−1的内标使用液.
-
用量筒准确量取200 mL水样,用4 mol·mL−1硫酸溶液调节pH值至4.0左右,然后以2.0 mL·mL−1的流速通过Oasis MCX小柱进行固相萃取. 上样前,依次用10 mL甲醇、10 mL水活化小柱. 水样过柱后,先用10.0 mL水淋洗小柱,之后用氮气吹20 min,再依次用4.0 mL甲醇、4 mL5%(V/V)氨水甲醇溶液以小于1.0 mL·min−1的流速洗脱,收集洗脱液,氮吹浓缩至近干,用体积比1∶1甲醇-水溶液定容到1.0 mL,最后加入内标使用液10 μL,混匀后经0.22 μm滤膜过滤,置于样品瓶中,待测. -
色谱条件: ACQUITY UPLCTM BEH C18柱(2.1 mm×100 mm, 1.7 μm, 美国Waters公司);流动相A:2 mmol·L−1乙酸铵+0.05%(V/V)甲酸水溶液,流动相B:乙腈;流速:0.4 mL·min−1;梯度洗脱程序:0—1.5 min,5%B;1.5—10.0 min,5%B—70%B;10.0—13.0 min,70%B—90%B;13.0—14.0 min,90%B;14.0—14.2 min,90%B—5%B;14.2—15.0 min,5%B. 进样量:2 μL.
质谱条件: 采用电喷雾电离(ESI)源,离子源加热温度为250 ℃,检测方式为多反应选择离子监测(MRM)的采集模式. 正负离子切换同时检测. 喷雾电压为5500 V/-4500 V;雾化气压力为345 kPa (50 psi);辅助气压力为345 kPa (50 psi);气帘气压力为207 kPa (30 psi). 各化合物的质谱参数见表2.
-
在ESI源和正、负离子扫描模式下,配制23种非甾体抗炎药及其内标混合溶液(100 μg·mL−1),采用流动注射进入质谱进行扫描,确定最佳去簇电压、碰撞能量及各化合物的母离子和子离子等质谱参数,优化后的质谱条件见表1. SCIEX Triple Quad 6500 超高效液相串联三重四极杆质谱仪可在5 ms内完成两种电离方式的切换,完全能满足正负离子切换模式下待测物的测定.
在流动相的水相中添加甲酸可以提高ESI+模式下的电离效率,促使[M+H]+生成;添加乙酸铵可改变流动相的pH值,促使酸性化合物在ESI−模式下形成[M-H]−,并有效减少[M+Na]+的生成. 因此本实验选择以2 mmol·L−1乙酸铵+0.05%(V/V)甲酸水溶液作为流动相的水相. 23种非甾体抗炎药(20 ng·L−1)的提取离子流图(图1).
-
从分子结构上看(表1),大多数NSAIDs带有羧酸基、酚羟基、磺酰氨基以及含N杂环等极性基团,因此本研究对Oasis HLB、Oasis MCX、Oasis MAX的使用效果进行比较. 结果发现(图2):Oasis HLB的保留原理为反相保留,呈分子态的化合物更容易在HLB上进行保留,离子型化合物在HLB上保留较弱;Oasis MCX、Oasis MAX这2款属于混合固相萃取柱兼具反相保留和离子交换功能. Oasis MCX、Oasis MAX属于强离子交换柱,适用于弱碱、弱酸化合物的萃取. 双氯芬酸、甲芬那酸、托芬那酸和甲氯芬那酸结构中含有二苯氨基(pKa0.85),替诺昔康、吡罗昔康和美洛昔康结构中含有酸性烯醇羟基,在MAX上保留很强,难以洗脱,结果与文献报道[19]一致. 大部分NSAIDs都含有N、S、Cl等电负性原子,在酸性条件下易于得到质子(H+),形成带正电荷的化合物,再加上MCX具有反相吸附和阳离子交换的功能,从而能更好地在MCX上保留,该结论与前期科研工作者报道的一致[19],因此用MCX柱对23种NSAIDs的萃取效果最好.
-
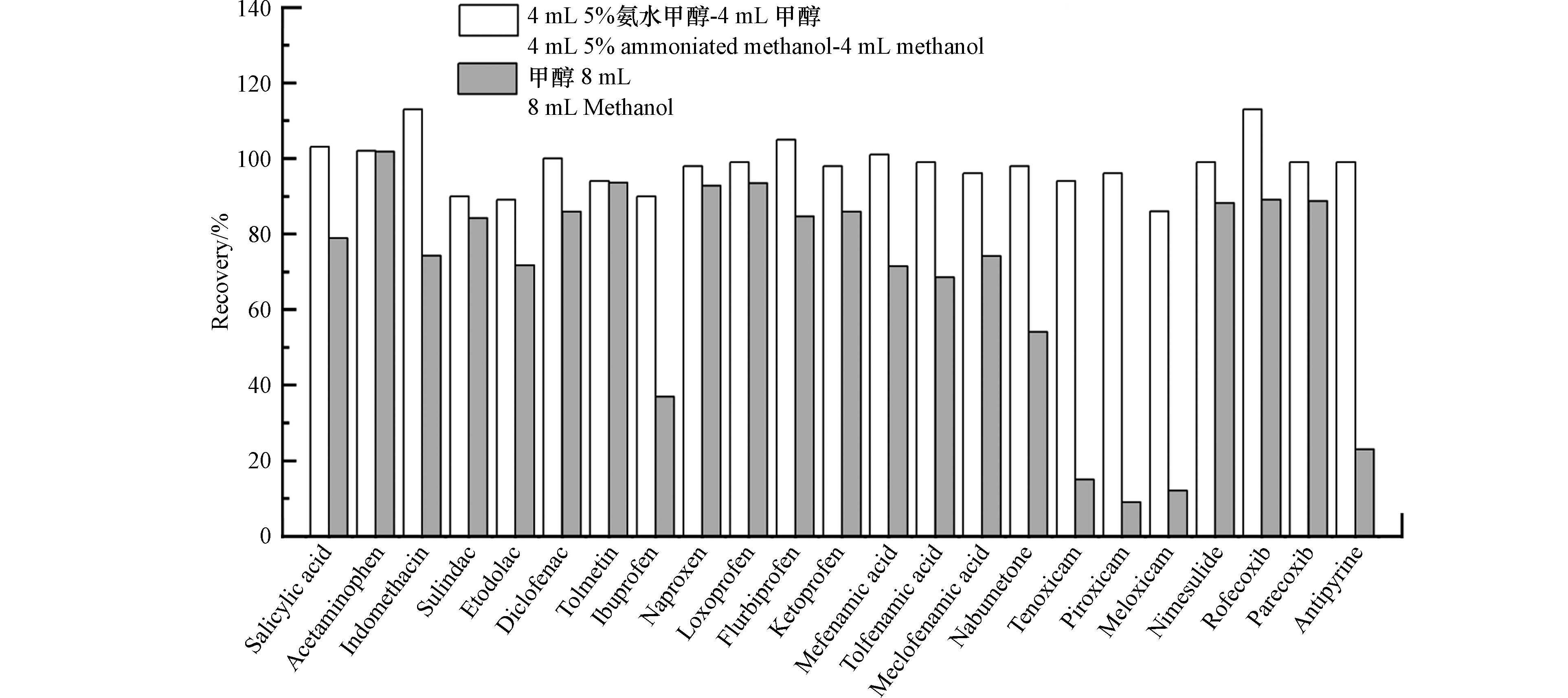
比较了5%(V/V)氨水甲醇-甲醇和甲醇的洗脱效果,实验结果发现(图3),替诺昔康、砒罗昔康、美洛昔康和安替比林都易于得到H+带上正电荷,通过与MCX柱上的负电荷吸附剂结合从而在MCX柱上得到保留. 因此当仅用甲醇进行洗脱时并不能这4个目标化合物洗脱下来,使得回收率很低. 而5%(V/V)氨水甲醇可使与MCX柱吸附剂结合的目标化合物失去质子形成不带电荷的化合物,从而被洗脱下来;甲醇可用于洗脱与MCX柱上通过反相保留的中性化合物;因此5%(V/V)氨水甲醇与甲醇能够最大程度地洗脱NSAIDs,通过优化体积,确定依次用4 mL甲醇和4 mL 5%(V/V)氨水甲醇进行洗脱.
-
用4 mol·L−1硫酸溶液调节样品pH至4和7,实验结果发现(图4)样品在pH=4时的回收率普遍高于pH=7. 药物在萃取柱上的吸附强度与其存在形式(分子或离子状态)紧密相关,实验发现pH=4的条件下,样品在更容易形成正电荷从而更好的在MCX上得到保留,从而提高萃取效率.
-
配制23种化合物的系列混合标准溶液,按确定的分析条件进行测定,以各物质的质量浓度(μg·L−1)为横坐标X,以其对应的峰面积与内标峰面积比值为纵坐标(Y),绘制标准曲线. 实验结果显示,在0.1—200 μg·L−1范围(布洛芬在2—200 μg·L−1)内,23种非甾体抗药的线性良好(r=0.9951—0.9992)(表3).
按照环境监测分析方法标准制修订技术导则进行方法检出限(MDL)试验,即分别在7个200 mL空白水样中加入10 μL质量浓度为100 μg·L−1的混合标液(布洛芬1.0 mg·L−1),按照1.3节进行前处理和分析测定,计算7次测定结果的标准偏差,MDL为3.143倍的标准偏差. 23种非甾体抗炎药的方法检出限为0.20—4.84 ng·L−1(见表3). 方法灵敏度高,完全能够满足环境水体中NSAIDs的检测需求.
-
为考察方法的准确度和精密度,分别于200 mL的地表水和空白纯水中加入低、中、高的3个水平的混合标准溶液,每个水平做6个平行样,结果如表4所示,方法的回收率为80.2%—120%,相对标准偏差为0.4%—12.5%(表4).
-
对本研究建立的测定方法与其他研究的测定方法进行了比较,详细数据见表5. 与现有的文献相比,当前的方法分析水体中NSAIDs的数量和种类更多,一定程度上满足了非甾体抗炎药种类的全面性,同时回收率和检出限可以满足定量分析要求,因此本方法具有扩展性好、灵敏度高和可靠的优点. -
分别采用不含待测组分的地表水样的前处理液和50%甲醇配制低、中、高不同质量浓度的基质标准溶液和溶剂标准溶液,上机测定. 用空白基质中目标分析物的峰面积A和50%甲醇中目标分析物的峰面积B的比值考察基质效应的大小,基质效应被定义为A/B×100%,基质效应大于100%表示基质增强,基质效应小于100%表示基质减弱[23]. 表4可以看出,23种化合物的基质效应在85.3%—115%之间,地表水对23种NSAIDs基质效应不明显.
-
采用优化的前处理方法和仪器条件对江苏省某市10个地表水样品进行分析. 结果表明,共有10种NSAIDs被检出(表6),质量浓度在ND—83.5 ng·L−1之间,水杨酸、双氯芬酸、对乙酰氨基酚和吡罗昔康的检出率为100%,其中水杨酸检出的质量浓度最高.
-
建立了水中11类23种NSAIDs的混合阳离子交换反相吸附固相萃取-超高效液相-串联质谱法. 该方法灵敏度好,准确度高,适用于水中痕量浓度水平NSAIDs的测定,为摸清新污染物环境赋存底 数和新污染物治理与管控提供有力支撑.
混合型离子交换反相吸附固相萃取-超高效液相色谱-三重四极杆质谱法测定水中23种非甾体抗炎药的残留
Determination of 23 non-steriodal antiinflammatory drugs residues in water using mixed ion exchange reversed phase adsorption solid phase extraction by ultra-high performance liquid chromatography-triple quadrupole mass spectrometry
-
摘要: 非甾体抗炎药(NSAIDs)作为一种新型有机污染物,在环境水体中普遍检出,对生态系统及人体健康造成潜在的威胁,开发准确、可靠的测定水中痕量非甾体抗炎药的检测方法至为重要. 本文采用Oasis MCX固相萃取柱对水样进行富集,建立测定水中23种非甾体抗炎药的超高效液相色谱-三重四极杆质谱分析方法. 采用酸性条件(pH=4)萃取水样,上样的流速为2 mL·min−1,用4 mL甲醇-4 mL5%氨水甲醇进行洗脱,浓缩定容后用ACQUITY UPLCTM BEH C18柱(2.1 mm×100 mm,1.7 μm),以2 mmol·L−1乙酸铵+0.05%(V/V)甲酸水溶液-乙腈作为流动相进行梯度洗脱,多反应选择离子监测(MRM)模式进行检测,内标法定量. 23种NSAIDs在相关线性范围内线性良好(r=0.9951—0.9992),回收率为80.2%—120%,相对标准偏差为0.4%—12.5%,方法检出限为0.20—4.84 ng·L−1. 将该方法应用于10份地表水的检测,结果显示有10种NSAIDs检出,质量浓度在ND—83.5 ng·L−1之间. 该方法简单、灵敏、高效,可应用于环境水体中NSAIDs的检测.
-
关键词:
- 混合型离子交换反相吸附固相萃取 /
- 超高效液相色谱-三重四极杆质谱 /
- 非甾体抗炎药 /
- 环境水体.
Abstract: Non-steroidal anti-inflammatory drugs (NSAIDs) are emerging contaminants that have recently attracted attention. They have been frequently detected in environmental water. They have been considered as a potential threat to the aquatic ecosystem and human health. It is important to develop accurate and reliable methods for the determination of trace amounts of NSAIDs in water. An analytical method was developed for the determination of 23 NSAIDs in water by ultra-high performance liquid chromatography-triple quadrupole mass spectrometry. Filtered water samples were adjusted to pH of 4 and extracted by SPE with Oasis MCX cartridges (500 mg and 6 mL)at a flow rate of 2 mL·min−1. Then NSAIDs retained on the cartridges were eluted with 4 mL of 5%(V/V)ammoniated methanol and 4 mL of methanol. The eluates were finally evaporated to near dryness and redissolved in 1 mL of methanol. The target analytes were separated on ACQUITY UPLCTM BEH C18 column (2.1 mm×100 mm, 1.7 μm) using acetonitrile and aqueous solution mixture containing 0.05%(V/V)formic acid and 2 mmol·L−1 ammonium acetate as mobile phase. The analysis was performed under multiple reaction monitoring(MRM)mode, quantified with internal standard method. Good linearity was observed for all the tested NSAIDs, with a correlation coefficient(r) greater than 0.995. The method detection limits (MDLs) ranged from 0.20—4.84 ng·L−1. The average recoveries ranged from 80.2% to 120%, while the relative standard deviations (RSDs) were ranged from 0.4% to 12.5%. The method was successfully applied to the determination of 10 surface water samples. Ten NSAIDs, viz. salicylic acid, sulindac, etodolac, diclofenac, mefenamic acid, piroxicam, parecoxib, antipyrine, nabumetone and acetaminophen, were detected in the 10 water samples. The total NSAIDs content in each sample ranged from not detected to 83.5 ng·L−1. The developed method is simple, rapid, and efficient, and it shows promise for the simultaneous determination of trace levels of the 23 NSAIDs in environmental water. -
非甾体类抗炎药(Non-steroidal antiinflammatory drugs,NSAIDs)是一类具有解热、镇痛、消炎作用的非类固激素类药物[1]. 据统计在各类药物中,镇痛药和非甾体抗炎药在2020年的市场规模最大,分别为469.9亿美元和482亿美元,而抗抑郁药(286亿美元)、抗高血压药(241.7亿美元)、抗真菌药(130.6亿美元)和麻醉药(20亿美元)等其他药物的市场份额明显较小[2 − 3]. 因此,非甾体抗炎药被视为人类和兽医医学中最常用的药物之一. 由于大量的生产和使用,科研工作者已经在地表水、地下水、污水处理厂等水体中检测到多种非甾体抗炎药[4 − 8],NSAIDs的浓度在ng·L−1至μg·L−1之间.
NSAIDs作为一种新污染物,其在水环境中的广泛存在对水生生物产生毒性效应,进而通过食物链对人体的健康造成威胁. 2022年国家首次将新污染物调查试点监测纳入生态环境监测体系. 生态环境部《生态环境监测规划纲要(2020—2035 年)》 将新污染物监测有序开展设为 2030 年的监测业务发展目标;国务院《新污染物治理行动方案》提出新污染物治理要监测先行. 因此建立高灵敏度、准确可靠、同时测定多种NSAIDs的监测方法为生态环境管理部门加强新污染物治理提供技术基础.
目前国内外采用的分析方法有高效液相色谱法、液相色谱-串联质谱法、气相色谱-串联质谱法、毛细管电泳法、薄层色谱法和分光光度法等[9 − 16]. 其中液相色谱-串联质谱法因其高灵敏度和高选择性成为NSAIDs最常见的检测方法. 刘彦等[17]建立了水中尼美舒利和塞来昔布2种NSAIDs的检测方法并应用于环境水体. Yan等[7]采用固相萃取-高效液相串联质谱法测定水中乙酰氨基酚、双氯芬酸、布洛芬和萘普生4种NSAIDs. 凌慧娟等[18]采用固相萃取-超高效液相色谱-质谱测定水中5种NSAIDs. 已报道的文献对水体中NSAIDs的数量和种类研究较少,对于NSAIDs的多残留分析,方法扩展不足.
本研究扩增了分析物种类与数量,以化学结构为分类依据,选取代表NSAIDs 的全部11类的23种药物(见表1). 对固相萃取的前处理过程进行深入探讨,选用混合阳离子交换反相吸附固相萃取柱(MCX小柱)进行,结合超高效液相色谱-串联质谱仪,建立了水中23种NSAIDs的分析方法. 本方法灵敏度好、准确度高满足水体中NSAIDs痕量检测的要求.
表 1 23种非甾体抗炎药的化合物信息Table 1. Compound information for the 23 NSAIDs序号No. 类别Category 化合物Compoud 中文名Chinese name CAS 号CAS No. 化学分子式Chemical formula 1 水杨酸类 Salicylic acid 水杨酸 69-72-7 C7H6O3 2 苯胺类 Acetaminophen 对乙酰氨基酚 103-90-2 C8H9NO2 3 吲哚基和茚基乙酸类 Indomethacin 吲哚美辛 53-86-1 C19H16ClNO4 4 Sulindac 舒林酸 38194-50-2 C20H17FO3S 5 Etodolac 依托度酸 41340-25-4 C17H21NO3 6 芳基乙酸类 Diclofenac 双氯芬酸 15307-86-5 C14H11Cl2NO2 7 Tolmetin 托美汀 26171-23-3 C15H15NO3 8 芳基丙酸类 Ibuprofen 布洛芬 15687-27-1 C13H18O2 9 Naproxen 萘普生 22204-53-1 C14H14O3 10 Loxoprofen 洛索洛芬 68767-14-6 C15H18O3 11 Flurbiprofen 氟比洛芬 51543-40-9 C15H13FO2 12 Ketoprofen 酮洛芬 22071-15-4 C16H14O3 13 灭酸类 Mefenamic acid 甲芬那酸 61-68-7 C15H15NO2 14 Tolfenamic acid 托芬那酸 13710-19-5 C14H12ClNO2 15 Meclofenamic acid 甲氯芬那酸 644-62-2 C14H11Cl2NO2 16 烯醇酸 Nabumetone 萘普酮 42924-53-8 C15H16O2 17 昔康类 Tenoxicam 替诺昔康 59804-37-4 C13H11N3O4S2 18 Piroxicam 吡罗昔康 36322-90-4 C15H13N3O4S 19 Meloxicam 美诺西康 71125-38-7 C14H13N3O4S2 20 磺酰苯胺类 Nimesulide 尼美舒利 51803-78-2 C13H12N2O5S 21 昔布类 Rofecoxib 罗非昔布 162011-90-7 C17H14O4S 22 Parecoxib 帕瑞昔布 198470-84-7 C19H18N2O4S 23 吡唑酮类 Antipyrine 安替比林 60-80-0 C11H12N2O 1. 材料与方法(Materials and methods)
1.1 仪器、试剂与材料
超高效液相色谱-三重四极杆质谱联用仪(SCIEX Triple Quad 6500,美国Sciex公司);Oasis MCX固相萃取柱(500 mg/6 mL,美国Waters公司);ASPE 900全自动固相萃取仪(日本GL Science公司);0.22 μm有机相滤膜(美国Waters公司);实验用水为Milli-Q 水(美国Bedford公司).
甲醇、乙腈(色谱纯,美国Merck公司)、甲酸、氨水(色谱纯,德国Sigma-Aldirich公司).
23种非甾体抗炎药包括(1)水杨酸类:水杨酸;(2)苯胺类:对乙酰氨基酚;(3)吲哚基和茚基乙酸类:吲哚美辛、舒林酸、依托度酸;(4)芳基乙酸类:双氯芬酸、托美丁、(5)芳基丙酸类:布洛芬、萘普生、洛索洛芬、氟比洛芬、酮洛芬;(6)灭酸类:甲芬那酸、托芬那酸、甲氯芬那酸;(7)烯醇酸:萘普酮;(8)昔康类:替诺昔康、吡罗昔康、美诺昔康;(9)磺酰苯胺类:尼美舒利;(10)昔布类:罗非昔布、帕瑞昔布;(11)吡唑酮类:安替比林,具体信息见表1. 3种内标包括:对乙酰氨基酚-D3、甲氯芬那酸-13C6、吡罗昔康-D3.
所有标准品均购自百灵威科技有限公司,纯度均大于98.0%. 内标均购自德国Dr.Ehrenstorfer公司,纯度均大于98.0%.
1.2 标准溶液配制
以甲醇为溶剂,将23种非甾体抗炎药配制成100 μg·mL−1的标准储备液,于-20 ℃条件下储存. 用甲醇将标准储备液稀释成1 μg·mL−1的中间储备液,于-20 ℃保存备用. 使用前以50%(V/V)甲醇水溶液为溶剂,将1 μg·mL−1的23种非甾体抗炎药的使用液逐级稀释成200、100、50、20、10、5、2、1、0.5、0.1 ng·mL−1的系列标准混合溶液.
3种内标分别用甲醇配制成100 μg·mL−1的内标储备液;用甲醇进一步稀释配制成质量浓度为2 μg·mL−1的内标使用液.
1.3 样品前处理
用量筒准确量取200 mL水样,用4 mol·mL−1硫酸溶液调节pH值至4.0左右,然后以2.0 mL·mL−1的流速通过Oasis MCX小柱进行固相萃取. 上样前,依次用10 mL甲醇、10 mL水活化小柱. 水样过柱后,先用10.0 mL水淋洗小柱,之后用氮气吹20 min,再依次用4.0 mL甲醇、4 mL5%(V/V)氨水甲醇溶液以小于1.0 mL·min−1的流速洗脱,收集洗脱液,氮吹浓缩至近干,用体积比1∶1甲醇-水溶液定容到1.0 mL,最后加入内标使用液10 μL,混匀后经0.22 μm滤膜过滤,置于样品瓶中,待测. 1.4 分析条件
色谱条件: ACQUITY UPLCTM BEH C18柱(2.1 mm×100 mm, 1.7 μm, 美国Waters公司);流动相A:2 mmol·L−1乙酸铵+0.05%(V/V)甲酸水溶液,流动相B:乙腈;流速:0.4 mL·min−1;梯度洗脱程序:0—1.5 min,5%B;1.5—10.0 min,5%B—70%B;10.0—13.0 min,70%B—90%B;13.0—14.0 min,90%B;14.0—14.2 min,90%B—5%B;14.2—15.0 min,5%B. 进样量:2 μL.
质谱条件: 采用电喷雾电离(ESI)源,离子源加热温度为250 ℃,检测方式为多反应选择离子监测(MRM)的采集模式. 正负离子切换同时检测. 喷雾电压为5500 V/-4500 V;雾化气压力为345 kPa (50 psi);辅助气压力为345 kPa (50 psi);气帘气压力为207 kPa (30 psi). 各化合物的质谱参数见表2.
表 2 23种非甾体抗炎药的质谱参数Table 2. MS parameters for the 23 NSAIDs化合物Compound 保留时间/min tR 母离子Precursor (m/z) 子离子Product (m/z) 锥孔电压/VDeclustering potential 碰撞电压/eVCollison energy Salicylic acid 5.8 136.9 93.0* −20 −24 65.0 −20 −40 Acetaminophen 2.8 152.0 110.0* 20 23 93.0 20 31 Indomethacin 9.6 356.1 312.2* −20 −14 297.1 −20 −26 Sulindac 8.0 357.1 233.3* 120 65 248.1 120 46 Etodolac 9.3 285.7 242.1* −36 −26 212.1 −36 −34 Diclofenac 9.8 294.0 250.0* −12 −17 214.0 −12 −27 Tolmetin 8.1 258.0 119.0* 45 22 91.0 45 50 Ibuprofen 9.4 205.1 160.9* −20 −11 159.0 −20 −10 Naproxen 8.5 229.0 170.0* −10 −21 185.2 −10 −10 Loxoprofen 7.8 264.3 117.2* 30 45 201.3 30 18 Flurbiprofen 9.4 243.1 199.0* −20 −14 197.0 −20 −25 Ketoprofen 8.4 255.1 209.2* 88 21 105.1 88 32 Mefenamic acid 10.6 242.2 223.9* 35 20 209.2 35 38 Tolfenamic acid 11.0 259.8 216.2* −116 −22 200.0 −35 −19 Meclofenamic acid 10.8 293.8 258.1* −40 −19 214.1 −40 −27 Nabumetone 9.4 229.1 171.1* 55 26 128.2 55 52 Tenoxicam 6.1 338.3 121.0* 122 27 95.0 122 26 Piroxicam 7.4 332.2 95.1* 115 23 121.2 115 26 Meloxicam 8.5 352.3 115.1* 153 23 141.1 153 27 Nimesulide 9.0 306.9 229.0* −35 −23 198.0 −35 −38 Rofecoxib 7.7 315.1 269.0* 110 29 192.2 110 33 Parecoxib 9.0 369.1 119.0* −100 −38 234.2 −100 −32 Antipyrine 4.8 189.1 77.0* 95 54 106.1 95 36 Acetaminophen-D3 2.8 155.0 111.3 20 23 Meclofenamic acid-13C6 10.6 299.8 264.1 −35 −19 Piroxicam-D3 7.4 335.2 95.0 115 23 *定量离子Quantitative ion. 2. 结果与讨论 (Results and discussion)
2.1 仪器条件的优化
在ESI源和正、负离子扫描模式下,配制23种非甾体抗炎药及其内标混合溶液(100 μg·mL−1),采用流动注射进入质谱进行扫描,确定最佳去簇电压、碰撞能量及各化合物的母离子和子离子等质谱参数,优化后的质谱条件见表1. SCIEX Triple Quad 6500 超高效液相串联三重四极杆质谱仪可在5 ms内完成两种电离方式的切换,完全能满足正负离子切换模式下待测物的测定.
在流动相的水相中添加甲酸可以提高ESI+模式下的电离效率,促使[M+H]+生成;添加乙酸铵可改变流动相的pH值,促使酸性化合物在ESI−模式下形成[M-H]−,并有效减少[M+Na]+的生成. 因此本实验选择以2 mmol·L−1乙酸铵+0.05%(V/V)甲酸水溶液作为流动相的水相. 23种非甾体抗炎药(20 ng·L−1)的提取离子流图(图1).
2.2 前处理条件的优化
2.2.1 SPE柱的选择
从分子结构上看(表1),大多数NSAIDs带有羧酸基、酚羟基、磺酰氨基以及含N杂环等极性基团,因此本研究对Oasis HLB、Oasis MCX、Oasis MAX的使用效果进行比较. 结果发现(图2):Oasis HLB的保留原理为反相保留,呈分子态的化合物更容易在HLB上进行保留,离子型化合物在HLB上保留较弱;Oasis MCX、Oasis MAX这2款属于混合固相萃取柱兼具反相保留和离子交换功能. Oasis MCX、Oasis MAX属于强离子交换柱,适用于弱碱、弱酸化合物的萃取. 双氯芬酸、甲芬那酸、托芬那酸和甲氯芬那酸结构中含有二苯氨基(pKa0.85),替诺昔康、吡罗昔康和美洛昔康结构中含有酸性烯醇羟基,在MAX上保留很强,难以洗脱,结果与文献报道[19]一致. 大部分NSAIDs都含有N、S、Cl等电负性原子,在酸性条件下易于得到质子(H+),形成带正电荷的化合物,再加上MCX具有反相吸附和阳离子交换的功能,从而能更好地在MCX上保留,该结论与前期科研工作者报道的一致[19],因此用MCX柱对23种NSAIDs的萃取效果最好.
2.2.2 洗脱溶剂的选择
比较了5%(V/V)氨水甲醇-甲醇和甲醇的洗脱效果,实验结果发现(图3),替诺昔康、砒罗昔康、美洛昔康和安替比林都易于得到H+带上正电荷,通过与MCX柱上的负电荷吸附剂结合从而在MCX柱上得到保留. 因此当仅用甲醇进行洗脱时并不能这4个目标化合物洗脱下来,使得回收率很低. 而5%(V/V)氨水甲醇可使与MCX柱吸附剂结合的目标化合物失去质子形成不带电荷的化合物,从而被洗脱下来;甲醇可用于洗脱与MCX柱上通过反相保留的中性化合物;因此5%(V/V)氨水甲醇与甲醇能够最大程度地洗脱NSAIDs,通过优化体积,确定依次用4 mL甲醇和4 mL 5%(V/V)氨水甲醇进行洗脱.
2.2.3 pH值的选择
用4 mol·L−1硫酸溶液调节样品pH至4和7,实验结果发现(图4)样品在pH=4时的回收率普遍高于pH=7. 药物在萃取柱上的吸附强度与其存在形式(分子或离子状态)紧密相关,实验发现pH=4的条件下,样品在更容易形成正电荷从而更好的在MCX上得到保留,从而提高萃取效率.
2.3 方法学验证
2.3.1 线性范围与方法检出限
配制23种化合物的系列混合标准溶液,按确定的分析条件进行测定,以各物质的质量浓度(μg·L−1)为横坐标X,以其对应的峰面积与内标峰面积比值为纵坐标(Y),绘制标准曲线. 实验结果显示,在0.1—200 μg·L−1范围(布洛芬在2—200 μg·L−1)内,23种非甾体抗药的线性良好(r=0.9951—0.9992)(表3).
表 3 23种非甾体抗炎药的线性方程、相关系数、线性范围和方法检出限Table 3. Linear equations, correlation coefficients(r), linear ranges and method detection limits (MDLs) of the 23 non-steroidal anti-inflammatory drugs化合物Compound 线性方程Linear equation 相关系数r 线性范围/(μg·L−1)Linear range 方法线性范围/(ng·L−1)Method linear range 方法检出限/(ng·L−1)MDL 方法定量限/(ng·L−1)MQL Salicylic acid y = 1.69×10−2x +2.29×10−3 0.9988 0.1—200 0.5—1000 0.61 2.44 Acetaminophen y = 7.66×10−2x +3.30×10−3 0.9978 0.1—200 0.5—1000 0.2 0.8 Indomethacin y = 2.14×10−3x +1.96×10−4 0.9974 0.1—200 0.5—1000 0.25 1.00 Sulindac y = 1.09×10−2x +1.70×10−3 0.9958 0.1—200 0.5—1000 0.26 1.04 Etodolac y = 6.70×10−3x +1.42×10−4 0.9971 0.1—200 0.5—1000 0.46 1.84 Diclofenac y = 6.83×10−3x -1.92×10−6 0.9982 0.2—200 1.0—1000 0.46 1.84 Tolmetin y = 1.55×10−2x +9.31×10−4 0.9978 0.1—200 0.5—1000 0.32 1.28 Ibuprofen y = 4.61×10−4x +8.80×10−4 0.9990 2—200 10—1000 4.84 19.4 Naproxen y = 5.68×10−4x +9.60×10−5 0.9950 0.1—200 0.5—1000 0.2 0.8 Loxoprofen y = 1.60×10−2x +3.91×10−4 0.9986 0.1—200 0.5—1000 0.29 1.16 Flurbiprofen y = 1.30×10−3x +8.65×10−4 0.9978 0.2—200 1.0—1000 0.37 1.48 Ketoprofen y = 7.41×10−2x +1.63×10−3 0.9992 0.1—200 0.5—1000 0.48 1.92 Mefenamic acid y = 1.26×10−1x +1.36×10−3 0.9976 0.1—200 0.5—1000 0.46 1.84 Tolfenamic acid y = 7.79×10−4x +4.44×10−5 0.9989 0.2—200 1.0—1000 0.46 1.84 Meclofenamic acid y = 8.88×10−4x -3.62×10−5 0.9970 0.2—200 1.0—1000 0.48 1.92 Nabumetone y = 6.05×10−2x +8.82×10−4 0.9977 0.1—200 0.5—1000 0.36 1.44 Tenoxicam y = 1.58×10−2x +3.51×10−4 0.9987 0.1—200 0.5—1000 0.25 1.00 Piroxicam y = 2.24×10−2x +4.22×10−3 0.9974 0.1—200 0.5—1000 0.26 1.04 Meloxicam y = 1.32×10−3x +6.12×10−4 0.9951 0.1—200 0.5—1000 0.56 2.24 Nimesulide y = 2.88×10−2x -1.42×10−5 0.9984 0.1—200 0.5—1000 0.55 2.20 Rofecoxib y = 4.60×10−2x +1.52×10−3 0.9952 0.1—200 0.5—1000 0.39 1.56 Parecoxib y = 6.92×10−3x -3.78×10−5 0.9986 0.2—200 1.0—1000 0.47 1.88 Antipyrine y = 5.49×10−2x +1.12×10−3 0.9986 0.2—200 1.0—1000 0.45 1.80 按照环境监测分析方法标准制修订技术导则进行方法检出限(MDL)试验,即分别在7个200 mL空白水样中加入10 μL质量浓度为100 μg·L−1的混合标液(布洛芬1.0 mg·L−1),按照1.3节进行前处理和分析测定,计算7次测定结果的标准偏差,MDL为3.143倍的标准偏差. 23种非甾体抗炎药的方法检出限为0.20—4.84 ng·L−1(见表3). 方法灵敏度高,完全能够满足环境水体中NSAIDs的检测需求.
2.3.2 准确度与精密度
为考察方法的准确度和精密度,分别于200 mL的地表水和空白纯水中加入低、中、高的3个水平的混合标准溶液,每个水平做6个平行样,结果如表4所示,方法的回收率为80.2%—120%,相对标准偏差为0.4%—12.5%(表4).
表 4 23种非甾体抗炎药的加标回收率、相对标准偏差及基质效应(n=3)Table 4. Spiked recoveries, RSDs and matrix effect of the 23 non-steroidal anti-inflammatory drugs (n=3)化合物Compound 加标浓度/(ng·L−1)Spiked 空白水样Water 地表水Surface water 基质效应/%Matrix effect/% Recovery/% RSD/% Recovery/% RSD/% Salicylic acid 2 89.2 6.1 91.2 4.8 86.2 100 98.1 6.7 112 6.9 115 500 120 4.8 118 9.8 98.8 Acetaminophen 2 82.5 0.4 86.3 1.2 96.1 100 98.6 7.2 95.3 6.5 97.2 500 90.6 7.1 92.1 6.9 102 Indomethacin 2 84.2 3.1 86.3 4.5 105 100 108 4.7 94.3 4.6 87.8 500 95.6 4.9 96.3 5.1 101 Sulindac 2 82.1 2.6 90.2 3.2 98.2 100 101 8 94.6 6.5 94.2 500 97.5 3.2 99.3 3.8 102 Etodolac 2 83 4.3 85.3 2.3 101 100 89.2 7.6 90.3 3.7 102 500 91.2 8.8 92.5 3 102 Diclofenac 2 89.2 2.3 86.2 3.1 95.2 100 106 8.4 90.8 4.6 86.2 500 97.6 5.8 91.3 4.8 94 Tolmetin 2 90.1 3.3 87.6 2.8 95.3 100 95.6 6.4 85.3 2.9 89.7 500 100 5.1 91.3 3.8 91.8 Ibuprofen 20 80.2 5.2 81.1 3.2 110 100 90.1 7.2 85.3 6.8 95.2 500 88.1 6.6 86.3 8.2 98.5 Naproxen 2 85.2 1.2 84.2 2.9 95.6 100 104 8.1 88.9 7.5 86 500 98.2 4.2 96 5.6 98.3 Loxoprofen 2 100 6.4 102 3.2 89.7 100 107 6.9 90.8 3.5 85.4 500 92.4 2.8 97.2 4 106 Flurbiprofen 2 102 2.6 95.1 3.1 91.3 100 105 9.5 89 6.2 85.3 500 98.9 4.4 90.3 4.3 91.8 Ketoprofen 2 105 3 102 3.2 96.1 100 96 9.6 89.9 6.5 94.1 500 106 5.3 96.6 4.1 91.6 Mefenamic acid 2 101 2.9 95.6 3.6 97.5 100 101 8.5 92.1 3.6 91.7 500 100 6.3 95.3 2.9 95.8 Tolfenamic acid 2 87.2 4.2 85.3 3.2 90.2 100 99.6 6.6 88.9 6.4 89.8 500 96.8 5.9 92.3 4.6 95.9 Meclofenamic acid 2 86.9 4.1 85.3 3.2 90.3 100 111 9.5 94.3 5 85.5 500 88.5 4.6 88.2 4.6 100 Nabumetone 2 109 2.2 112 3.6 113 100 96.9 7.6 90.3 5.6 93.7 500 100 9.8 91.3 6.1 91.8 Tenoxicam 2 80.3 7.9 84.1 5.8 105 100 83.9 9.2 87.1 2.9 104 500 86.5 6.8 89.1 3.2 104 Piroxicam 2 81.2 1.2 82.1 2.1 95.6 100 86.1 7.3 93.5 4.3 109 500 91.4 11.5 101.2 5.3 111 Meloxicam 2 81 2.9 85.3 4.5 112 100 82.9 9.7 84.6 6.5 103 500 86.9 12.5 86.3 9.6 100 Nimesulide 2 114 1.4 95.2 3.2 91.2 100 92.8 5.8 91.3 4.6 98.9 500 108 8.4 95.6 9.5 89 Rofecoxib 2 103 1 90.2 2.1 90.2 100 112 8 100 9.1 89.8 500 90.5 5.3 94.3 4.3 105 Parecoxib 2 113 0.8 105 2.1 101 100 114 6.2 108 4.6 95.2 500 103 6.7 101 5.3 98.6 Antipyrine 2 104 3.9 91 5.6 96.2 100 105 7.1 89.9 7.1 86.1 500 101 5.6 96.3 6.5 95.8 2.4 方法性能对比
对本研究建立的测定方法与其他研究的测定方法进行了比较,详细数据见表5. 与现有的文献相比,当前的方法分析水体中NSAIDs的数量和种类更多,一定程度上满足了非甾体抗炎药种类的全面性,同时回收率和检出限可以满足定量分析要求,因此本方法具有扩展性好、灵敏度高和可靠的优点. 表 5 与其他方法的比较Table 5. Comparison with other methods化合物Compound 回收率/%Recovery 相对标准偏差/%RSD 仪器检出限/(μg·L−1)LOD 方法检出限/(ng·L−1)MDL 参考文献References 11类23种 80.2—120 0.4—12.5 无 0.20—4.84(取样量为200 mL) 本方法 Acetaminophen、Diclofenac等(3类4种) 75—113 6.4—8.3 0.05—0.1 无 [7] Ketoprofen、Ibuprofen等(4类5种) 71.4—124.1 <13.2 0.005—0.008 无 [18] Diclofenac(1类1种) 85.3—94.2 无 无 0.08(取样量为1L) [20] Diclofenac、Indomethacin(2类2种) 85—109 1.0—5.0 无 0.15—0.16(取样量为1L) [21] Acetaminophen、Diclofenac等(5类7种) 73.6—105 3.6—5.8 0.06—0.6 0.3—2.5(取样量为1L) [22] 2.5 基质效应评价
分别采用不含待测组分的地表水样的前处理液和50%甲醇配制低、中、高不同质量浓度的基质标准溶液和溶剂标准溶液,上机测定. 用空白基质中目标分析物的峰面积A和50%甲醇中目标分析物的峰面积B的比值考察基质效应的大小,基质效应被定义为A/B×100%,基质效应大于100%表示基质增强,基质效应小于100%表示基质减弱[23]. 表4可以看出,23种化合物的基质效应在85.3%—115%之间,地表水对23种NSAIDs基质效应不明显.
2.6 实际样品的分析
采用优化的前处理方法和仪器条件对江苏省某市10个地表水样品进行分析. 结果表明,共有10种NSAIDs被检出(表6),质量浓度在ND—83.5 ng·L−1之间,水杨酸、双氯芬酸、对乙酰氨基酚和吡罗昔康的检出率为100%,其中水杨酸检出的质量浓度最高.
表 6 实际水样中NSAIDs的阳性检测结果Table 6. Positive detection results of NSAIDs in actual samples化合物Compound 地表水/(ng·L−1) Surface water W1 W2 W3 W4 W5 W6 W7 W8 W9 W10 Salicylic acid 83.5 74.1 76.4 79.1 76.1 78.9 76.0 78.1 71.1 68.0 Sulindac 0.45 0.50 ND 0.45 ND 0.74 0.34 0.65 ND ND Etodolac 6.90 4.50 ND 5.67 5.7 ND ND ND ND ND Diclofenac 4.30 6.90 ND 5.2 2.6 3.8 3.24 2.70 1.45 1.29 Mefenamic acid 0.71 ND ND 0.70 ND ND ND ND ND ND Piroxicam 3.82 2.85 3.45 3.40 3.40 3.41 3.67 3.65 3.45 2.70 Parecoxib 2.12 ND ND ND ND ND ND ND ND ND Antipyrine 35.1 ND 18.5 14.5 ND 12.5 ND ND ND ND Nabumetone 2.19 ND ND ND ND ND ND ND ND ND Acetaminophen 19.5 6.69 1.63 5.10 0.65 0.60 0.67 3.71 0.56 0.45 ND: less and MDL 3. 结论(Conclusion)
建立了水中11类23种NSAIDs的混合阳离子交换反相吸附固相萃取-超高效液相-串联质谱法. 该方法灵敏度好,准确度高,适用于水中痕量浓度水平NSAIDs的测定,为摸清新污染物环境赋存底 数和新污染物治理与管控提供有力支撑.
-
表 1 23种非甾体抗炎药的化合物信息
Table 1. Compound information for the 23 NSAIDs
序号No. 类别Category 化合物Compoud 中文名Chinese name CAS 号CAS No. 化学分子式Chemical formula 1 水杨酸类 Salicylic acid 水杨酸 69-72-7 C7H6O3 2 苯胺类 Acetaminophen 对乙酰氨基酚 103-90-2 C8H9NO2 3 吲哚基和茚基乙酸类 Indomethacin 吲哚美辛 53-86-1 C19H16ClNO4 4 Sulindac 舒林酸 38194-50-2 C20H17FO3S 5 Etodolac 依托度酸 41340-25-4 C17H21NO3 6 芳基乙酸类 Diclofenac 双氯芬酸 15307-86-5 C14H11Cl2NO2 7 Tolmetin 托美汀 26171-23-3 C15H15NO3 8 芳基丙酸类 Ibuprofen 布洛芬 15687-27-1 C13H18O2 9 Naproxen 萘普生 22204-53-1 C14H14O3 10 Loxoprofen 洛索洛芬 68767-14-6 C15H18O3 11 Flurbiprofen 氟比洛芬 51543-40-9 C15H13FO2 12 Ketoprofen 酮洛芬 22071-15-4 C16H14O3 13 灭酸类 Mefenamic acid 甲芬那酸 61-68-7 C15H15NO2 14 Tolfenamic acid 托芬那酸 13710-19-5 C14H12ClNO2 15 Meclofenamic acid 甲氯芬那酸 644-62-2 C14H11Cl2NO2 16 烯醇酸 Nabumetone 萘普酮 42924-53-8 C15H16O2 17 昔康类 Tenoxicam 替诺昔康 59804-37-4 C13H11N3O4S2 18 Piroxicam 吡罗昔康 36322-90-4 C15H13N3O4S 19 Meloxicam 美诺西康 71125-38-7 C14H13N3O4S2 20 磺酰苯胺类 Nimesulide 尼美舒利 51803-78-2 C13H12N2O5S 21 昔布类 Rofecoxib 罗非昔布 162011-90-7 C17H14O4S 22 Parecoxib 帕瑞昔布 198470-84-7 C19H18N2O4S 23 吡唑酮类 Antipyrine 安替比林 60-80-0 C11H12N2O 表 2 23种非甾体抗炎药的质谱参数
Table 2. MS parameters for the 23 NSAIDs
化合物Compound 保留时间/min tR 母离子Precursor (m/z) 子离子Product (m/z) 锥孔电压/VDeclustering potential 碰撞电压/eVCollison energy Salicylic acid 5.8 136.9 93.0* −20 −24 65.0 −20 −40 Acetaminophen 2.8 152.0 110.0* 20 23 93.0 20 31 Indomethacin 9.6 356.1 312.2* −20 −14 297.1 −20 −26 Sulindac 8.0 357.1 233.3* 120 65 248.1 120 46 Etodolac 9.3 285.7 242.1* −36 −26 212.1 −36 −34 Diclofenac 9.8 294.0 250.0* −12 −17 214.0 −12 −27 Tolmetin 8.1 258.0 119.0* 45 22 91.0 45 50 Ibuprofen 9.4 205.1 160.9* −20 −11 159.0 −20 −10 Naproxen 8.5 229.0 170.0* −10 −21 185.2 −10 −10 Loxoprofen 7.8 264.3 117.2* 30 45 201.3 30 18 Flurbiprofen 9.4 243.1 199.0* −20 −14 197.0 −20 −25 Ketoprofen 8.4 255.1 209.2* 88 21 105.1 88 32 Mefenamic acid 10.6 242.2 223.9* 35 20 209.2 35 38 Tolfenamic acid 11.0 259.8 216.2* −116 −22 200.0 −35 −19 Meclofenamic acid 10.8 293.8 258.1* −40 −19 214.1 −40 −27 Nabumetone 9.4 229.1 171.1* 55 26 128.2 55 52 Tenoxicam 6.1 338.3 121.0* 122 27 95.0 122 26 Piroxicam 7.4 332.2 95.1* 115 23 121.2 115 26 Meloxicam 8.5 352.3 115.1* 153 23 141.1 153 27 Nimesulide 9.0 306.9 229.0* −35 −23 198.0 −35 −38 Rofecoxib 7.7 315.1 269.0* 110 29 192.2 110 33 Parecoxib 9.0 369.1 119.0* −100 −38 234.2 −100 −32 Antipyrine 4.8 189.1 77.0* 95 54 106.1 95 36 Acetaminophen-D3 2.8 155.0 111.3 20 23 Meclofenamic acid-13C6 10.6 299.8 264.1 −35 −19 Piroxicam-D3 7.4 335.2 95.0 115 23 *定量离子Quantitative ion. 表 3 23种非甾体抗炎药的线性方程、相关系数、线性范围和方法检出限
Table 3. Linear equations, correlation coefficients(r), linear ranges and method detection limits (MDLs) of the 23 non-steroidal anti-inflammatory drugs
化合物Compound 线性方程Linear equation 相关系数r 线性范围/(μg·L−1)Linear range 方法线性范围/(ng·L−1)Method linear range 方法检出限/(ng·L−1)MDL 方法定量限/(ng·L−1)MQL Salicylic acid y = 1.69×10−2x +2.29×10−3 0.9988 0.1—200 0.5—1000 0.61 2.44 Acetaminophen y = 7.66×10−2x +3.30×10−3 0.9978 0.1—200 0.5—1000 0.2 0.8 Indomethacin y = 2.14×10−3x +1.96×10−4 0.9974 0.1—200 0.5—1000 0.25 1.00 Sulindac y = 1.09×10−2x +1.70×10−3 0.9958 0.1—200 0.5—1000 0.26 1.04 Etodolac y = 6.70×10−3x +1.42×10−4 0.9971 0.1—200 0.5—1000 0.46 1.84 Diclofenac y = 6.83×10−3x -1.92×10−6 0.9982 0.2—200 1.0—1000 0.46 1.84 Tolmetin y = 1.55×10−2x +9.31×10−4 0.9978 0.1—200 0.5—1000 0.32 1.28 Ibuprofen y = 4.61×10−4x +8.80×10−4 0.9990 2—200 10—1000 4.84 19.4 Naproxen y = 5.68×10−4x +9.60×10−5 0.9950 0.1—200 0.5—1000 0.2 0.8 Loxoprofen y = 1.60×10−2x +3.91×10−4 0.9986 0.1—200 0.5—1000 0.29 1.16 Flurbiprofen y = 1.30×10−3x +8.65×10−4 0.9978 0.2—200 1.0—1000 0.37 1.48 Ketoprofen y = 7.41×10−2x +1.63×10−3 0.9992 0.1—200 0.5—1000 0.48 1.92 Mefenamic acid y = 1.26×10−1x +1.36×10−3 0.9976 0.1—200 0.5—1000 0.46 1.84 Tolfenamic acid y = 7.79×10−4x +4.44×10−5 0.9989 0.2—200 1.0—1000 0.46 1.84 Meclofenamic acid y = 8.88×10−4x -3.62×10−5 0.9970 0.2—200 1.0—1000 0.48 1.92 Nabumetone y = 6.05×10−2x +8.82×10−4 0.9977 0.1—200 0.5—1000 0.36 1.44 Tenoxicam y = 1.58×10−2x +3.51×10−4 0.9987 0.1—200 0.5—1000 0.25 1.00 Piroxicam y = 2.24×10−2x +4.22×10−3 0.9974 0.1—200 0.5—1000 0.26 1.04 Meloxicam y = 1.32×10−3x +6.12×10−4 0.9951 0.1—200 0.5—1000 0.56 2.24 Nimesulide y = 2.88×10−2x -1.42×10−5 0.9984 0.1—200 0.5—1000 0.55 2.20 Rofecoxib y = 4.60×10−2x +1.52×10−3 0.9952 0.1—200 0.5—1000 0.39 1.56 Parecoxib y = 6.92×10−3x -3.78×10−5 0.9986 0.2—200 1.0—1000 0.47 1.88 Antipyrine y = 5.49×10−2x +1.12×10−3 0.9986 0.2—200 1.0—1000 0.45 1.80 表 4 23种非甾体抗炎药的加标回收率、相对标准偏差及基质效应(n=3)
Table 4. Spiked recoveries, RSDs and matrix effect of the 23 non-steroidal anti-inflammatory drugs (n=3)
化合物Compound 加标浓度/(ng·L−1)Spiked 空白水样Water 地表水Surface water 基质效应/%Matrix effect/% Recovery/% RSD/% Recovery/% RSD/% Salicylic acid 2 89.2 6.1 91.2 4.8 86.2 100 98.1 6.7 112 6.9 115 500 120 4.8 118 9.8 98.8 Acetaminophen 2 82.5 0.4 86.3 1.2 96.1 100 98.6 7.2 95.3 6.5 97.2 500 90.6 7.1 92.1 6.9 102 Indomethacin 2 84.2 3.1 86.3 4.5 105 100 108 4.7 94.3 4.6 87.8 500 95.6 4.9 96.3 5.1 101 Sulindac 2 82.1 2.6 90.2 3.2 98.2 100 101 8 94.6 6.5 94.2 500 97.5 3.2 99.3 3.8 102 Etodolac 2 83 4.3 85.3 2.3 101 100 89.2 7.6 90.3 3.7 102 500 91.2 8.8 92.5 3 102 Diclofenac 2 89.2 2.3 86.2 3.1 95.2 100 106 8.4 90.8 4.6 86.2 500 97.6 5.8 91.3 4.8 94 Tolmetin 2 90.1 3.3 87.6 2.8 95.3 100 95.6 6.4 85.3 2.9 89.7 500 100 5.1 91.3 3.8 91.8 Ibuprofen 20 80.2 5.2 81.1 3.2 110 100 90.1 7.2 85.3 6.8 95.2 500 88.1 6.6 86.3 8.2 98.5 Naproxen 2 85.2 1.2 84.2 2.9 95.6 100 104 8.1 88.9 7.5 86 500 98.2 4.2 96 5.6 98.3 Loxoprofen 2 100 6.4 102 3.2 89.7 100 107 6.9 90.8 3.5 85.4 500 92.4 2.8 97.2 4 106 Flurbiprofen 2 102 2.6 95.1 3.1 91.3 100 105 9.5 89 6.2 85.3 500 98.9 4.4 90.3 4.3 91.8 Ketoprofen 2 105 3 102 3.2 96.1 100 96 9.6 89.9 6.5 94.1 500 106 5.3 96.6 4.1 91.6 Mefenamic acid 2 101 2.9 95.6 3.6 97.5 100 101 8.5 92.1 3.6 91.7 500 100 6.3 95.3 2.9 95.8 Tolfenamic acid 2 87.2 4.2 85.3 3.2 90.2 100 99.6 6.6 88.9 6.4 89.8 500 96.8 5.9 92.3 4.6 95.9 Meclofenamic acid 2 86.9 4.1 85.3 3.2 90.3 100 111 9.5 94.3 5 85.5 500 88.5 4.6 88.2 4.6 100 Nabumetone 2 109 2.2 112 3.6 113 100 96.9 7.6 90.3 5.6 93.7 500 100 9.8 91.3 6.1 91.8 Tenoxicam 2 80.3 7.9 84.1 5.8 105 100 83.9 9.2 87.1 2.9 104 500 86.5 6.8 89.1 3.2 104 Piroxicam 2 81.2 1.2 82.1 2.1 95.6 100 86.1 7.3 93.5 4.3 109 500 91.4 11.5 101.2 5.3 111 Meloxicam 2 81 2.9 85.3 4.5 112 100 82.9 9.7 84.6 6.5 103 500 86.9 12.5 86.3 9.6 100 Nimesulide 2 114 1.4 95.2 3.2 91.2 100 92.8 5.8 91.3 4.6 98.9 500 108 8.4 95.6 9.5 89 Rofecoxib 2 103 1 90.2 2.1 90.2 100 112 8 100 9.1 89.8 500 90.5 5.3 94.3 4.3 105 Parecoxib 2 113 0.8 105 2.1 101 100 114 6.2 108 4.6 95.2 500 103 6.7 101 5.3 98.6 Antipyrine 2 104 3.9 91 5.6 96.2 100 105 7.1 89.9 7.1 86.1 500 101 5.6 96.3 6.5 95.8 表 5 与其他方法的比较
Table 5. Comparison with other methods
化合物Compound 回收率/%Recovery 相对标准偏差/%RSD 仪器检出限/(μg·L−1)LOD 方法检出限/(ng·L−1)MDL 参考文献References 11类23种 80.2—120 0.4—12.5 无 0.20—4.84(取样量为200 mL) 本方法 Acetaminophen、Diclofenac等(3类4种) 75—113 6.4—8.3 0.05—0.1 无 [7] Ketoprofen、Ibuprofen等(4类5种) 71.4—124.1 <13.2 0.005—0.008 无 [18] Diclofenac(1类1种) 85.3—94.2 无 无 0.08(取样量为1L) [20] Diclofenac、Indomethacin(2类2种) 85—109 1.0—5.0 无 0.15—0.16(取样量为1L) [21] Acetaminophen、Diclofenac等(5类7种) 73.6—105 3.6—5.8 0.06—0.6 0.3—2.5(取样量为1L) [22] 表 6 实际水样中NSAIDs的阳性检测结果
Table 6. Positive detection results of NSAIDs in actual samples
化合物Compound 地表水/(ng·L−1) Surface water W1 W2 W3 W4 W5 W6 W7 W8 W9 W10 Salicylic acid 83.5 74.1 76.4 79.1 76.1 78.9 76.0 78.1 71.1 68.0 Sulindac 0.45 0.50 ND 0.45 ND 0.74 0.34 0.65 ND ND Etodolac 6.90 4.50 ND 5.67 5.7 ND ND ND ND ND Diclofenac 4.30 6.90 ND 5.2 2.6 3.8 3.24 2.70 1.45 1.29 Mefenamic acid 0.71 ND ND 0.70 ND ND ND ND ND ND Piroxicam 3.82 2.85 3.45 3.40 3.40 3.41 3.67 3.65 3.45 2.70 Parecoxib 2.12 ND ND ND ND ND ND ND ND ND Antipyrine 35.1 ND 18.5 14.5 ND 12.5 ND ND ND ND Nabumetone 2.19 ND ND ND ND ND ND ND ND ND Acetaminophen 19.5 6.69 1.63 5.10 0.65 0.60 0.67 3.71 0.56 0.45 ND: less and MDL -
[1] KHAN H Y, PARVEEN S, YOUSUF I, et al. Metal complexes of NSAIDs as potent anti-tumor chemotherapeutics: Mechanistic insights into cytotoxic activity via multiple pathways primarily by inhibition of COX–1 and COX–2 enzymes[J]. Coordination Chemistry Reviews, 2022, 453: 214316. doi: 10.1016/j.ccr.2021.214316 [2] IMARC- Analgesics Market: Global Industry Trends, Share, Size, Growth, Opportunity and Forecast 2021-2026[R]. [2023-2-15]. [3] Newswire, Globe, 2020. Global Antidepressants Market (2020 to 2030) - COVID-19 Implications and Growth[R]. [2023-2-15]. Dublin, April 21, 2020. [4] RASTOGI A, TIWARI M K, GHANGREKAR M M. A review on environmental occurrence, toxicity and microbial degradation of Non-Steroidal Anti-Inflammatory Drugs (NSAIDs)[J]. Journal of Environmental Management, 2021, 300: 113694. doi: 10.1016/j.jenvman.2021.113694 [5] MOHD HANAFIAH Z, WAN MOHTAR W H M, ABD MANAN T S B, et al. The occurrence of non-steroidal anti-inflammatory drugs (NSAIDs) in Malaysian urban domestic wastewater[J]. Chemosphere, 2022, 287: 132134. doi: 10.1016/j.chemosphere.2021.132134 [6] MARMON P, OWEN S F, MARGIOTTA-CASALUCI L. Pharmacology-informed prediction of the risk posed to fish by mixtures of non-steroidal anti-inflammatory drugs (NSAIDs) in the environment[J]. Environment International, 2021, 146: 106222. doi: 10.1016/j.envint.2020.106222 [7] YAN J N, LIN W T, GAO Z H, et al. Use of selected NSAIDs in Guangzhou and other cities in the world as identified by wastewater analysis[J]. Chemosphere, 2021, 279: 130529. doi: 10.1016/j.chemosphere.2021.130529 [8] ZHOU Y Y, XU J B, LU N, et al. Development and application of metal-organic framework@GA based on solid-phase extraction coupling with UPLC-MS/MS for the determination of five NSAIDs in water[J]. Talanta, 2021, 225: 121846. doi: 10.1016/j.talanta.2020.121846 [9] HASSAN M K, KARLOCK L G. The effect of post-operative NSAID administration on bone healing after elective foot and ankle surgery[J]. Foot and Ankle Surgery, 2020, 26(4): 457-463. doi: 10.1016/j.fas.2019.05.016 [10] KAMARUZAMAN S, SANAGI M M, ENDUD S, et al. MCM-41 solid phase membrane tip extraction combined with liquid chromatography for the determination of non-steroidal anti-inflammatory drugs in human urine[J]. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 2013, 940: 59-65. doi: 10.1016/j.jchromb.2013.09.017 [11] HAN X F, CHEN J, LI Z, et al. Combustion fabrication of magnetic porous carbon as a novel magnetic solid-phase extraction adsorbent for the determination of non-steroidal anti-inflammatory drugs[J]. Analytica Chimica Acta, 2019, 1078: 78-89. doi: 10.1016/j.aca.2019.06.022 [12] ABD WAHIB S M, WAN IBRAHIM W A, SANAGI M M, et al. Magnetic sporopollenin-cyanopropyltriethoxysilane-dispersive micro-solid phase extraction coupled with high performance liquid chromatography for the determination of selected non-steroidal anti-inflammatory drugs in water samples[J]. Journal of Chromatography. A, 2018, 1532: 50-57. doi: 10.1016/j.chroma.2017.11.059 [13] LI W Q, WANG R, CHEN Z L. Zr-based metal-organic framework-modified cotton for solid phase micro-extraction of non-steroidal anti-inflammatory drugs[J]. Journal of Chromatography A, 2018, 1576: 19-25. doi: 10.1016/j.chroma.2018.09.032 [14] GOUDA A A, KOTB EL-SAYED M I, AMIN A S, et al. Spectrophotometric and spectrofluorometric methods for the determination of non-steroidal anti-inflammatory drugs: A review[J]. Arabian Journal of Chemistry, 2013, 6(2): 145-163. doi: 10.1016/j.arabjc.2010.12.006 [15] AMENDOLA L, GARRIBBA F, BOTRÈ F. Determination of endogenous and synthetic glucocorticoids in human urine by gas chromatography–mass spectrometry following microwave-assisted derivatization[J]. Analytica Chimica Acta, 2003, 489(2): 233-243. doi: 10.1016/S0003-2670(03)00703-7 [16] AHMAD S M, ALMEIDA C, NENG N R, et al. Bar adsorptive microextraction (BAμE) coated with mixed sorbent phases—Enhanced selectivity for the determination of non-steroidal anti-inflammatory drugs in real matrices in combination with capillary electrophoresis[J]. Journal of Chromatography B, 2016, 1008: 115-124. doi: 10.1016/j.jchromb.2015.11.018 [17] 刘彦, 律涛, 高飞萌, 等. 氧化石墨烯/中空纤维-固相微萃取分析环境水中非甾体抗炎药的残留[J]. 分析试验室, 2020, 39(2): 236-239. doi: 10.13595/j.cnki.issn1000-0720.2019.050301 LIU Y, LV T, GAO F M, et al. Solid phase microextraction with grapheme oxide bound hollow fiber for the analysis of non-steroidal anti-inflammatory drugs in aquatic environment[J]. Chinese Journal of Analysis Laboratory, 2020, 39(2): 236-239 (in Chinese). doi: 10.13595/j.cnki.issn1000-0720.2019.050301
[18] 凌慧娟, 吴阁格, 李爽, 等. 基于金属有机骨架复合气凝胶的分散固相萃取-超高效液相色谱-串联质谱法测定水中5种非甾体类抗炎药[J]. 色谱, 2022, 40(4): 323-332. LING H J, WU G G, LI S, et al. Determination of five nonsteroidal anti-inflammatory drugs in water by dispersive solid phase extraction-ultra performance liquid chromatography-tandem mass spectrometry based on metal-organic framework composite aerogel[J]. Chinese Journal of Chromatography, 2022, 40(4): 323-332 (in Chinese).
[19] 胡婷, 彭涛, 李晓娟, 等. 离子交换固相萃取-超高效液相色谱-串联质谱法同时测定动物组织中的8类非甾体抗炎药残留[J]. 分析化学, 2012, 40(2): 236-242. HU T, PENG T, LI X J, et al. Ion exchange solid phase extraction coupled with liquid chromatography tandem mass spectrometry for determination of 8 classes of non-steroidal anti-inflammatory drugs residues in animal tissues[J]. Chinese Journal of Analytical Chemistry, 2012, 40(2): 236-242 (in Chinese).
[20] 曹荥玉, 汤庆会, 牛璐瑶, 等. 超高效液相色谱-串联质谱法快速测定水中双氯酚酸和卡马西平[J]. 净水技术, 2019, 38(3): 5-8. doi: 10.15890/j.cnki.jsjs.2019.03.002 CAO X Y, TANG Q H, NIU L Y, et al. Rapid determination of diclofenac and carbamazepine in water by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Water Purification Technology, 2019, 38(3): 5-8 (in Chinese). doi: 10.15890/j.cnki.jsjs.2019.03.002
[21] FAN X Q, GAO J, LI W C, et al. Determination of 27 pharmaceuticals and personal care products (PPCPs) in water: The benefit of isotope dilution[J]. Frontiers of Environmental Science & Engineering, 2020, 14(1): 8. [22] TRAN N H, HU J Y, ONG S L. Simultaneous determination of PPCPs, EDCs, and artificial sweeteners in environmental water samples using a single-step SPE coupled with HPLC-MS/MS and isotope dilution[J]. Talanta, 2013, 113: 82-92. doi: 10.1016/j.talanta.2013.03.072 [23] ZHOU L J, YING G G, LIU S, et al. Simultaneous determination of human and veterinary antibiotics in various environmental matrices by rapid resolution liquid chromatography–electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1244: 123-138. doi: 10.1016/j.chroma.2012.04.076 -






 DownLoad:
DownLoad: